Method Article
Imagem óptica baseada em fotodiodo para dinâmica de rede de gravação com resolução de neurônio único em invertebrados não transgênicos
Neste Artigo
Resumo
Este protocolo apresenta um método para a atividade populacional neuronal de imagem com resolução unicelular em espécies invertebrados não transgênicas usando corantes sensíveis à tensão de absorvância e uma matriz de fotodiodo. Essa abordagem permite um fluxo de trabalho rápido, onde imagens e análises podem ser perseguidas ao longo de um único dia.
Resumo
O desenvolvimento de preparações transgênicas de invertebrados em que a atividade de conjuntos específicos de neurônios pode ser registrada e manipulada com luz representa um avanço revolucionário para estudos da base neural do comportamento. No entanto, uma desvantagem desse desenvolvimento é sua tendência a concentrar os pesquisadores em um número muito pequeno de organismos "designers" (por exemplo, C. elegans e Drosophila), potencialmente impactando negativamente a busca de estudos comparativos em muitas espécies, o que é necessário para identificar princípios gerais da função da rede. O presente artigo ilustra como a gravação óptica com corantes sensíveis à tensão nos cérebros de espécies gastropodes não transgênicas pode ser usada rapidamente (ou seja, dentro do curso de tempo de experimentos únicos) revelar características da organização funcional de suas redes neurais com resolução unicelular. Delineamos detalhadamente os métodos de dissecção, coloração e gravação utilizados pelo nosso laboratório para obter traços potenciais de ação de dezenas a ~150 neurônios durante programas motores comportamentalmente relevantes no CNS de múltiplas espécies gastropodes, incluindo um novo para a neurociência – o nudibranch Berghia stephanieae. A imagem é realizada com corantes sensíveis à tensão de absorvância e uma matriz de fotodiodos de 464 elementos que é amostrada a 1.600 quadros/segundo, rápido o suficiente para capturar todos os potenciais de ação gerados pelos neurônios registrados. Várias gravações de vários minutos podem ser obtidas por preparação com pouco ou nenhum branqueamento de sinal ou fototoxicidade. Os dados ópticos brutos coletados através dos métodos descritos podem posteriormente ser analisados através de uma variedade de métodos ilustrados. Nossa abordagem de gravação óptica pode ser facilmente usada para sondar a atividade de rede em uma variedade de espécies não transgênicas, tornando-a adequada para estudos comparativos de como os cérebros geram comportamento.
Introdução
O desenvolvimento de linhas transgênicas de invertebrados como Drosophila e C. elegans forneceu sistemas poderosos nos quais as bases neurais do comportamento podem ser adequadamente interrogadas e manipuladas. No entanto, essas preparações especiais podem ter a desvantagem de reduzir o entusiasmo por estudos de circuito neural de espécies não transgênicas, particularmente no que diz respeito à introdução de novas espécies na pesquisa de neurociência. Focar exclusivamente em um ou dois sistemas de modelos é prejudicial à busca de princípios gerais da função da rede, pois os estudos comparativos representam um caminho essencial pelo qual tais princípios são descobertos1,2,3,4. Nosso objetivo aqui é demonstrar uma abordagem de imagem em larga escala para obter uma visão rápida da estrutura funcional das redes neurais gastropodes, em um esforço para facilitar estudos comparativos da função da rede neural.
Moluscos gastropodes como Aplysia, Lymnaea, Tritonia, Pleurobranchaea e outros têm sido usados há muito tempo para investigar princípios da função da rede neural, em grande parte porque seus comportamentos são mediados por neurônios grandes, muitas vezes individualmente identificáveis localizados na superfície do gânglio, tornando-os facilmente acessíveis às técnicas de gravação5. Na década de 1970, foram desenvolvidos corantes sensíveis à tensão (VSDs) que podem se integrar à membrana plasmática que logo permitiram as primeiras gravações livres de eletrodos dos potenciais de ação gerados por múltiplos neurônios6. Aqui, demonstramos nosso uso de VSDs para examinar a atividade de rede em várias espécies de gastropodes, incluindo uma nova para a neurociência, Berghia stephanieae. O dispositivo de imagem é um conjunto de fotodiodos de 464 elementos disponíveis comercialmente (PDA) que é amostrado a 1.600 quadros/segundo(Figura 1),que, quando usado com VSDs de absorção rápida, revela os potenciais de ação de todos os neurônios registrados7. Os sinais registrados por todos os diodos são exibidos imediatamente após a aquisição e sobrepostos a uma imagem do gânglio no software de aquisição do PDA, possibilitando a investigação de neurônios de interesse com eletrodos afiados na mesma preparação8,9.
Nos dados brutos do PDA, muitos diodos registram redundantemente os neurônios maiores, e muitos também contêm sinais mistos de múltiplos neurônios. Um ponto de virada foi o desenvolvimento de um método automatizado de classificação de picos usando análise de componentes independentes para processar rapidamente cada dados PDA brutos de 464 canais definidos em um novo conjunto de traços, no qual cada neurônio registrado aparece em um traço separado contendo apenas seus potenciais de ação10,11.
Neste artigo, descrevemos as etapas essenciais envolvidas na obtenção de gravações potenciais de ação em larga escala a partir de sistemas nervosos gastropodes com uma matriz de fotodiodos e VSDs de absorção rápida. Ilustramos, além disso, métodos analíticos que podem ser empregados para agrupamento e mapeamento dos neurônios registrados opticamente em relação aos seus conjuntos funcionais, e para caracterizar características de nível populacional que muitas vezes não são aparentes através da simples inspeção dos traços de disparo12,13.
Protocolo
NOTA: O fluxo de trabalho descrito abaixo está resumido na Figura 2.
1. Minimizar a vibração
- Se possível, certifique-se de que a plataforma está no térreo e use uma mesa de isolamento baseada em mola, que amortece uma gama maior de frequências de vibração do que as tabelas de ar.
- Se usar uma mesa baseada em mola, certifique-se de que ela está flutuando (ela precisa ser ajustada toda vez que alguém adicionar ou tirar algo da mesa).
- Reduza o ruído à base de vibração na sala de imagem o máximo possível, mesmo na medida em que desligar o fluxo de ar durante a imagem, se necessário. Minimize qualquer vibração decorrente da turbulência do fluido nos sistemas de perfusão.
NOTA: A preparação neural não deve se mover durante a aquisição. Movimentos de qualquer tipo produzem mudanças de bordas de contraste através dos diodos, levando a sinais artefatos. Se o procedimento envolve um estímulo durante a aquisição, não deve induzir o movimento de preparação.
2. Execute um teste de pinhole para permitir o alinhamento adequado das fotos de gânglio com os dados do PDA
- Coloque um pedaço de papel alumínio com 3 pequenos furos enfiados nele em um slide de microscópio. Tire uma imagem dos três buracos com a câmera digital montada em seu photoport parfocal.
- Usando o software de imagem que vem com o PDA, adquira um arquivo curto (por exemplo, 5 s). Em parte através da aquisição, toque na mesa para induzir artefatos de vibração que serão muito visíveis ao redor das bordas dos pinholes, permitindo que a imagem dos orifícios esteja precisamente alinhada com os dados ópticos.
- Use a função Sobreposta no software de imagem, encontrado no item do menu "Display | Página Sobrepoda | Sobrepor traços c/| de imagem externa Sobreponha a imagem"para sobrepor os dados do diodo na foto dos orifícios e, em seguida, ajuste iterativamente as configurações x, y e ampliação para a foto até que os pinholes se sentem diretamente sobre os artefatos do pinhole nos dados do diodo.
- Salve esses números para alinhar imagens de preparação tiradas com a câmera com os dados do diodo em experimentos futuros.
NOTA: O alinhamento do pinhole do PDA só precisa ser realizado uma vez após o PDA ser montado no microscópio, até que seja girado ou removido, momento em que deve ser feito novamente.
- Salve esses números para alinhar imagens de preparação tiradas com a câmera com os dados do diodo em experimentos futuros.
3. Dissecções para três espécies de gastropodes marinhos
- Para espécies que crescem em grande porte, como Tritonia e Aplysia,comece com indivíduos menores, que têm gânglios mais finos e menos opacos, facilitando a obtenção de luz suficiente para o sinal-para-ruído ideal.
- Tenha pronto a água do mar artificial filtrada para ser usada como soro fisiológico para as dissecções e experimentos de imagem.
NOTA: Em todas as etapas subsequentes do protocolo, "soro fisiológico" denota água do mar artificial. - Dissecção de Tritonia diomedea
- Coloque um animal na geladeira por cerca de 20 minutos para anestesiar.
- Para animais maiores, exponha o cérebro segurando o animal em uma mão, deixando a ponta da cabeça cobrir o dedo indicador para expor o "pescoço". Para animais menores, fixe-os lado dorsal em um prato de dissecção forrado de cera antes de expor o cérebro.
- Utilizando uma tesoura de dissecção, faça uma incisão de 3-4 cm no lado dorsal do animal, acima da massa bucal (que pode ser sentida através da parede do corpo).
NOTA: A parte necessária do CNS, constituída por gânglios fundidos, bilaterais e pânlicos, é laranja e distinta na aparência do tecido circundante; ele está imediatamente posterior aos rinoforos e no topo da massa bucal. - Extirpa o CNS cortando os nervos que inervam o corpo do animal usando fórceps e tesouras de microdisseção, mantendo intactos todos os nervos que ligam o gânglio central. Deixe um longo comprimento de nervo pedal 3 (PdN3), ou qualquer nervo será estimulado.
- Use pinos de minutien para fixar o CNS no fundo de um prato alinhado com elastômero para dissecção posterior. Mantenha a temperatura de preparação a 11 °C, perfundiando o prato com soro fisiológico entregue com um sistema de resfriamento Peltier controlado por feedback usando uma bomba peristáltica.
- Usando fórceps e tesouras de microdisseção, remova cuidadosamente a camada de adesão solta do tecido conjuntivo ao redor do CNS. Deixe a baia fina de perto aderindo ao gânglio.
- Brevemente (~10 s) mergulham o gânglio em uma solução de 0,5% glutaraldeído em soro fisiológico. Coloque o gânglio de volta no prato salino-perfumado de elastômero, permitindo que o soro fisiológico lave o glutaraldeído antes de iniciar a coloração VSD.
NOTA: Esta correção leve do tecido conjuntivo e seus músculos intrínsecos ajudarão a prevenir o movimento durante a imagem.
- Dissecção de Aplysia californica
- Anestesiar um animal de aproximadamente 40 g injetando ~20 mL de 350 mM MgCl2 no corpo através da superfície ventral (pé).
- Use pinos para posicionar o lado ventral animal em um prato de dissecção forrado de cera.
- Usando uma tesoura de dissecção, faça uma incisão midline de 2-3 cm ao longo da extensão mais anterior do pé. Fixar os retalhos do pé em ambos os lados da incisão para revelar parte do CNS e massa bucal.
NOTA: A parte necessária do CNS, constituída por gânglios cerebrais fundidos, e de perto, pleural bilateral e gânglios de pedal, é amarelo-laranja e distinto na aparência do tecido circundante; ele se senta dorsal e posterolateral para a massa bucal muscular bulbosa. - Use fórceps e tesouras de dissecção para dissecar cuidadosamente a massa bucal, revelando o gânglio cerebral.
- Extirpa o CNS cortando os nervos que inervam o corpo do animal usando fórceps e tesouras de microdisseção, mantendo intactos todos os nervos que ligam o gânglio central. Deixe um longo comprimento de nervo pedal 9 (PdN9), ou qualquer nervo será estimulado.
- Use pinos minutien para posicionar o CNS em um prato revestido de elastômero recheado de soro fisiológico. Mantenha a temperatura de preparação a 15-16 °C perfusando o prato com soro fisiológico passando por um dispositivo de resfriamento Peltier.
- Usando fórceps e tesouras de microdisseção, remova o tecido conjuntivo excessivo do CNS e disseque uma porção superficial da bainha no gânglio ou gânglio a ser imageado. Tenha cuidado durante este processo para não fazer um buraco na baia, o que resultaria em neurônios derramando de dentro.
- Brevemente (~20 s) mergulham o gânglio em uma solução de 0,5% glutaraldeído em soro fisiológico. Coloque o gânglio de volta no prato salino-perfumado de elastômero, permitindo que o soro fisiológico lave o glutaraldeído antes de iniciar a coloração VSD.
- Dissecção de Berghia stephanieae
- Coloque um animal na geladeira por cerca de 20 minutos para anestesiar.
- Usando um prato alinhado com elastômero cheio de soro fisiológico de temperatura ambiente, coloque pinos minutien na cabeça e na cauda.
- Utilizando uma tesoura de microdisseção, faça uma incisão dorsal de 5-7 mm superficial ao CNS.
NOTA: Os olhos, manchas escuras que residem dentro do animal ao lado do CNS, marcam convenientemente a posição da porção necessária CNS, que consiste em cerebropleural e gânglios de pedal e fica no topo da massa bucal. - Extirpa o CNS cortando os nervos que inervam o corpo do animal usando fórceps e tesouras de microdisseção. Deixe qualquer nervo sendo estimulado o suficiente para um eletrodo de sucção.
4. Colorigue a preparação com um corante sensível à tensão
- Prepare soluções de estoque de RH155 (também conhecido como NK3041) ou RH482 (também conhecido como NK3630 ou JPW1132).
- RH155: Dissolva 5,4 mg de corante sólido em 1 mL de 100% EtOH, pipetando 29 μL em cada um dos 34 tubos de microcentrifuusagem. Com o conteúdo de cada tubo exposto ao ar, deixe-os secar durante a noite no escuro. Cap e coloque as alíquotas sólidas resultantes de RH155, cada uma contendo 0,15 mgs, em um congelador de -20 °C.
- RH482: Dissolva 2 mg de corante sólido em 100 μL de DMSO, divida a solução em 20 alíquotas de 5 μL, cada uma contendo 0,1 mg de RH482, e armazene em um congelador de -20 °C.
NOTA: Para Tritonia e Aplysia,a perfusão do banho ou a aplicação da pressão podem ser usadas para carregar o VSD RH155 nas membranas dos neurônios na preparação. A aplicação de pressão tem a vantagem de expor apenas o gânglio sendo imagedo para o VSD.
- Para perfusão de banho, adicione 5 mL de soro fisiológico a cada uma das duas alíquotas acima de RH155 sólidos e vórtice em solução, produzindo uma solução combinada de 10 mL contendo 0,03 mg/mL RH155.
- Perfuse no escuro (para evitar fotobleaching) por 1 a 1,5 h a 11 °C para Tritonia e a 16 °C para Aplysia. Mantenha a temperatura passando a solução de perfusão através de um sistema de resfriamento Peltier.
- Para aplicação de pressão, adicione 500 μL salino a uma alíquota de RH155 e vórtice para produzir uma concentração de corante de 0,3 mg/mL.
- Desenhe cerca de 200 μL da solução em tubos de polietileno usando um microdispensor portátil, garantindo que haja uma boa correspondência entre o diâmetro do tubo e o diâmetro do gânglio a ser manchado.
- Use um micromanipulador para colocar cuidadosamente a extremidade do tubo sobre o gânglio alvo, baixando-o até formar um selo confortável no gânglio. Use o tipo de sistema de resfriamento descrito acima para manter o gânglio na temperatura desejada.
- Diminua as luzes da sala para evitar fotobleaching e gire o botão aplicador de microdispenser a cada 5 minutos para forçar mais corante no gânglio.
- Verifique em 30 min para confirmar que uma boa coloração está ocorrendo e, em seguida, continue por um tempo total de coloração de cerca de 1h.
- Para coloração em Berghia,adicione 1 mL de soro fisiológico a uma alíquota congelada de RH482, e vórtice para dissolver.
- Transfira 200 μL desta solução para um tubo de microcentrífuga contendo 800 μL de soro fisiológico e vórtice para solução, produzindo uma solução de coloração final de 0,02 mg/ml RH482 em soro fisiológico com 0,1% DMSO.
- Coloque todo o CNS no tubo de microcentrifuuge, enrolando o tubo em papel alumínio para evitar fotobleaching, e aperte à mão a cada 5-6 min por cerca de 1 h. Armazene os 800 μL restantes da primeira solução na geladeira e use por até 3 dias para manchar os preparos subsequentes.
5. Achate a preparação e configure-se para estimulação nervosa
NOTA: As etapas desta seção devem ser executadas sob iluminação mínima ou com luz verde para minimizar o fotobleaching.
- Após a coloração, mergulhe o CNS em soro fisiológico dentro da câmara de imagem e coloque sob um microscópio de dissecação.
- Coloque pedaços de silicone (para Tritonia ou Aplysia) ou bolhas de geleia de petróleo (para Berghia) à esquerda e à direita do gânglio/gânglio a ser imageado.
- Pressione um pedaço de um vidro ou tampas plásticas apropriadamente dimensionados para baixo na preparação para achatá-lo. Pressione firmemente, mas não tão forte a ser que danifique os neurônios.
NOTA: Achatar a superfície convexa da preparação desta forma tornará um maior número de neurônios parfocal, aumentando assim o número de neurônios registrados, e ainda ajudará a imobilizar a preparação durante a imagem. - Se estimular um nervo a provocar um programa motor fictício, prepare um eletrodo de sucção cuja ponta frontal é aproximadamente tão larga quanto o diâmetro do nervo. Faça isso derretendo cuidadosamente um segmento de tubos de polietileno PE-100 sobre uma chama enquanto puxa suavemente as duas extremidades do segmento de tubulação e, em seguida, cortando o afunilador resultante no ponto desejado.
- Desenhe um pequeno volume de soro fisiológico através da extremidade afilada de um eletrodo de sucção de polietileno, seguido pela extremidade do nervo a ser estimulado, anexando um comprimento de tubo de polímero flexível e de parede grossa na extremidade traseira do eletrodo e usando sucção bucal para aplicar pressão negativa.
- Confirme que o soro fisiológico do eletrodo não tem bolhas que possam interromper a condução elétrica.
6. Preparação e otimização para imagem
- Mova a câmara para a plataforma de imagens. Inicie a perfusão salina através da câmara de gravação e coloque a sonda de temperatura perto da preparação. Defina o controlador de temperatura para a temperatura desejada para a espécie que está sendo imageda (para Tritonia, 11 °C, para Aplysia, 15-16 °C, ou para Berghia, 26-27 °C).
- Coloque um fio de prata com clorided no eletrodo de sucção, certificando-se de que ele entre em contato com o soro fisiológico no eletrodo, e coloque o outro fio Ag-AgCl (o caminho de retorno) no soro fisiológico do banho, perto do eletrodo de sucção.
- Abaixe a lente de imersão de água no soro fisiológico. Feche o diafragma base e, em seguida, levante ou baixe o condensador de subestágio e ajuste o foco até que as bordas do diafragma estejam em foco acentuado, criando iluminação Köhler.
- Concentre-se na região da preparação a ser imagen. Viés focando em neurônios menores em relação aos maiores, já que sinais ópticos originários de neurônios maiores são mais propensos do que os menores a serem registrados, mesmo que estejam ligeiramente fora de foco.
- Tire uma foto do gânglio para ser imagens com a câmera digital parfocal.
- Com o interruptor de ganho do painel de controle definido para 1x, inspecione a intensidade da luz de repouso (RLI) no software de imagem clicando no botão "RLI"e verificando o RLI médio dos diodos. Ajuste o nível de tensão enviado de um estimulador para a fonte de alimentação da lâmpada LED e continue verificando o nível médio de RLI até que esteja na faixa desejada (geralmente em torno de 3-4 V).
NOTA: RLIs altos, correspondentes a aproximadamente 3-4 V no PDA, são desejáveis. Quanto maior a luz, melhor a relação sinal-ruído dos sinais ópticos, no entanto, isso deve ser equilibrado contra uma taxa mais rápida de fotobleaching em RLIs mais altas. Este risco é minimizado pelo uso de lentes objetivas de alta NA. As lentes objetivas de imersão de água utilizadas são 10x/0.6 NA, 20x/0.95 NA, 40x/0.8 NA e 40x/1.15 NA.
- Defina o interruptor de ganho do painel de controle para 100x para a gravação.
- Se estimular um nervo, defina a tensão, a frequência e a duração desejadas em um estimulador separado daquele usado para definir o nível de luz. Confirme se o acionamento TTL entre o painel de controle e o estimulador está devidamente configurado.
NOTA: Os parâmetros de estímulo nervoso amostral em cada espécie são os seguintes: Tritonia PdN3, 2 s, 10 Hz de trem de pulso de 5 ms, 10 V; Aplysia PdN9, trem de pulso de 2,5 s, 20 Hz de 5 ms, pulsos de 8 V; um nervo do pedal berghia, 2 s, trem de pulso de 10 Hz de 5 ms, pulsos de 5 V. - Verifique se a mola ou a mesa de ar estão flutuando.
7. Gravação óptica
- Desligue ou diminua as luzes do quarto, incluindo qualquer iluminação fluorescente aérea.
- Defina a duração do arquivo desejada, o nome do caminho e do arquivo e, em seguida, clique no botão "Take Data" no software de imagem para adquirir arquivos até a capacidade da RAM disponível do computador. Fique parado durante a gravação óptica, pois pequenas vibrações podem introduzir grandes artefatos nos dados de gravação óptica.
NOTA: Para aquisições que excedam a MEMÓRIA RAM disponível do computador, um programa de aquisição C++ personalizado está disponível através do Dr. Jian-young Wu da Universidade de Georgetown. - Para visualizar os dados imediatamente após a aquisição, use a função Superimpose no software de imagem para sobrepor os dados coletados por todos os 464 diodos sobre a imagem do gânglio tirada anteriormente da preparação7. Clique em qualquer um dos diodos representados no software para expandir o que eles gravaram em uma tela de rastreamento separada.
- Obtenha o alinhamento exato dos diodos em relação à preparação, inserindo os fatores x, y e ampliação, conforme determinado anteriormente pelo teste do orifício.
- Para maximizar a visibilidade potencial de ação e melhorar o rendimento do neurônio para a classificação subsequentede picos 14,imponha um filtro Butterworth bandpass com cortes de 5 Hz e 100 Hz (disponível em software de imagem) para remover ruídos de baixa e alta frequência.
- Para salvar dados ópticos filtrados como um arquivo de texto para análise posterior em uma plataforma de computação científica, selecione primeiro a caixa "filtro TP" logo abaixo da tela "Page" no software de imagem. Em seguida, selecione "Salvar página como ASCII" da guia "Saída" e digite o nome de arquivo desejado na caixa de diálogo que aparece.
Resultados
Tritonia
O contato com a pele com seu predador seastar desencadeia a fuga de Tritonia diomedea, consistindo de uma série rítmica de flexões do corpo inteiro que o impulsionam para longe em segurança(Figura 3A). Em preparações cerebrais isoladas, um breve estímulo ao nervo pedal 3 (PdN3) provoca o programa rítmico de motor de natação (SMP) para este comportamento, que é facilmente reconhecível em gravações ópticas do gânglio do pedal. A Figura 3B retrata o layout de um experimento de imagem VSD projetado para registrar a atividade de disparo de neurônios na superfície dorsal do gânglio do pedal tritonia esquerda, sobre o qual o PDA foi posicionado, como um estímulo ao contralateral (direita) PdN3 provoca o SMP. Dados brutos e filtrados (filtro bandpass Butterworth, cortes de 5 e 100 Hz) de 20 diodos atividade de gravação antes, durante e após a estimulação de PdN3 são mostrados nas Figuras 3C,D, respectivamente. O estímulo nervoso foi entregue 20 s no arquivo de 2 min. Imediatamente após a aquisição, os sinais medidos por todos os 464 diodos da matriz de gravação podem ser exibidos topograficamente sobre uma imagem da preparação no software de imagem(Figura 3E). Neste ponto, muitos traços contêm picos registrados redundantemente dos mesmos neurônios, e alguns traços contêm picos de mais de um neurônio. A triagem dos traços de diodo filtrado com ICA produziu 53 traços neuronais únicos, dos quais 30 são mostrados na Figura 3F. A cinética dos picos individuais pode ser apreciada na Figura 3G,que expande um trecho de quatro traços da Figura 3F (caixa vermelha); a precisão do algoritmo de classificação de picos ica foi previamente verificada usando gravações simultâneas de eletrodos afiados, que mostraram que todos os picos nos traços classificados correspondem a picos registrados intracelularmente de neurônios individuais11,14.
Aplysia
Um forte estímulo de cauda aversivo à Aplysia californica provoca uma resposta de fuga rítmica de duas partes estereotipada15. A primeira fase da resposta é um galope de vários ciclos de pulmões na cabeça e puxões de cauda que movem o animal rapidamente para a frente. Isso é normalmente seguido por um período de rastreamento, envolvendo repetidas ondas de contrações musculares cabeça-a-cauda que conduzem o animal para a frente a uma velocidade mais lenta por vários minutos(Figura 4A). Para capturar esses programas motores de fuga em gravações ópticas, o PDA estava focado na superfície dorsal do gânglio do pedal direito em uma preparação cerebral isolada, e um eletrodo de sucção foi colocado no nervo do pedal contralateral (esquerdo) 9 (PdN9; Figura 4B). Um minuto em uma gravação óptica contínua de 20 minutos(Figura 4C),PdN9 foi estimulado a provocar a sequência do programa motor gallop-crawl. As distribuições espaciais gaussianas probabilísticas dos sinais de todos os 81 neurônios registrados foram mapeadas no gânglio(Figura 4D). A redução da dimensionalidade aplicada à gravação completa revelou que as fases galope (ciano) e crawl (azul escuro) do programa de fuga ocupavam áreas distintas e formavam trajetórias diferentes, espiral e loop, respectivamente, no espaço componente principal(Figura 4E).
Três vídeos baseados na gravação da Aplysia retratada na Figura 4 demonstram outros tipos de análises que podem ser realizadas em tais conjuntos de dados. O vídeo 1 anima o disparo de todos os neurônios gravados durante toda a duração da gravação. O período pós-estimulatório inicial do programa de motor de fuga foi caracterizado por um galope, no qual a atividade no gânglio foi marcada pelo estouro alternado de diferentes aglomerados funcionais(Vídeo 2). O galope posteriormente transitou para um rastreamento, no qual a atividade através de aglomerados neuronais permaneceu amplamente phasic, mas assumiu uma trajetória rotacional no sentido anti-horário no gânglio(Vídeo 3). Estes dois últimos vídeos também incorporam agrupamento de consenso, o que revela o disparo e os locais dos diferentes conjuntos funcionais para as fases de galope e rastreamento da resposta de fuga separadamente. Note que muitos neurônios atribuídos ao mesmo aglomerado nas fases galope e crawl apresentaram proximidade física entre si no gânglio, consistente com os achados anteriores12.
Berghia
O nudibranch aeolid Berghia stephanieae (Figura 5A) representa um novo sistema modelo para a neurociência. A configuração de imagem para um experimento típico de Berghia é mostrada na Figura 5B. Para provocar atividade neuronal em larga escala, um eletrodo de sucção foi colocado no nervo mais proeminente do pedal esquerdo, e um estímulo nervoso foi entregue 30 s em uma gravação de 2 minutos. Os traços processados pelo ICA revelaram atividade espontânea e evocada por estímulos em 55 neurônios(Figura 5C). A detecção da comunidade por meio de clustering de consenso identificou dez conjuntos funcionais distintos, que são retratados na Figura 5D em um gráfico de rede e na Figura 5E,que reorganiza os traços mostrados na Figura 5C com base em suas atribuições de agrupamento. As distribuições gaussianas dos sinais de todos os neurônios registrados são sobrepostas a uma imagem da preparação na Figura 5F para indicar as posições de todos os 55 neurônios registrados.

Figura 1: Visualizações da plataforma de imagem óptica e do conjunto de fotodiodos (PDA). (A) A plataforma de imagem óptica, com o PDA, câmera digital, microscópio e palco. (B) O desenho interno do PDA, no qual a fibra óptica conecta a abertura de imagem a 464 fotodiodos. Uma linha de amplificadores está localizada acima dos fotodiodos. (C) A face hexagonal da abertura de imagem, na qual a área que está sendo imagemizada está focada. Clique aqui para ver uma versão maior desta figura.

Figura 2: Um fluxograma ilustrando o fluxo de trabalho essencial na obtenção de gravações ópticas. As etapas essenciais do protocolo de imagem VSD, desde dissecção e coloração até os detalhes da imagem, são retratadas neste fluxograma. Clique aqui para ver uma versão maior desta figura.
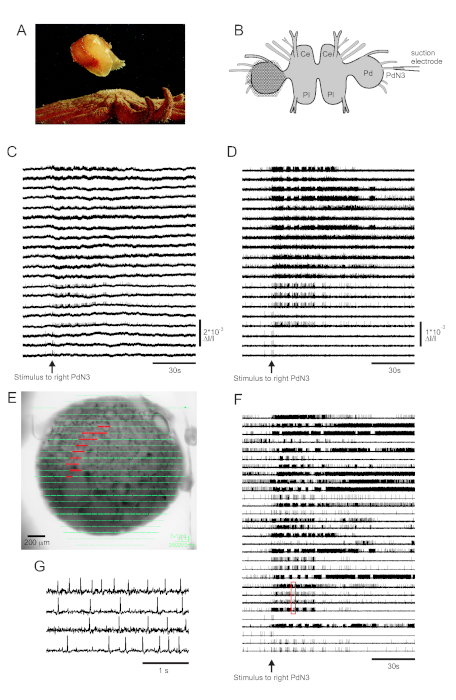
Figura 3: Resultados da Tritonia diomedea,ilustrandodadosbrutos, filtrados e classificados por picos. (A) Tritonia escapando da estrela do mar predatório Pycnopodia helianthoides através de sua natação, que consiste em alternar flexões dorsais e ventrais do corpo. (B) Esquema da configuração de imagem. Lóbulo cerebral ce=do gânglio cerebropleural; Pl = lobo pleural do gânglio cerebropleural; Pd = gânglio de pedal. (C) Dados brutos de 20 fotodiodos, exibindo atividade no gânglio do pedal esquerdo para estimulação do PdN3 contralateral (estímulo indicado pela seta). (D) Dados filtrados dos mesmos diodos como em C (filtro Butterworth bandpass de 5 e 100 Hz). (E) Saída de software de imagem em que traços comprimidos coletados por todos os 464 diodos são sobrepostos topograficamente sobre uma imagem da preparação. As posições dos 20 diodos cujos traços são mostrados em C e D são destacadas em vermelho. (F) Trinta traços selecionados de um único neurônio gerados pela classificação de picos via ICA. (G) Uma visão expandida de quatro traços de um único neurônio, correspondente à caixa vermelha em F,exibe seus potenciais de ação em maior resolução temporal. Clique aqui para ver uma versão maior desta figura.
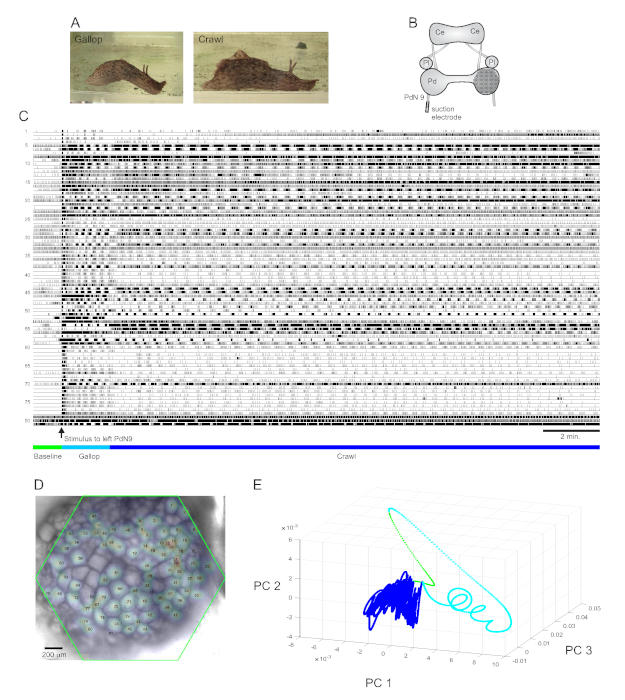
Figura 4: Resultados da Aplysia californica, ilustrando gravação de longa duração, mapeamento de sinais e redução de dimensionalidade. (A) As duas fases do programa de motor de fuga sequencial da Aplysia, o galope e o rastreamento. (B) Esquema da configuração de imagem. Ce = gânglio cerebral; Pl = gânglio pleural; Pd = gânglio de pedal. (C) Uma gravação de 20 min de 81 neurônios no gânglio do pedal direito respondendo a um estímulo ao PdN9 contralateral (indicado pela seta). Barras verdes, cianos e azuis escuras abaixo dos traços indicam o período pré-estímulo, o galope e as fases de rastreamento do programa motor de fuga, respectivamente. (D) Uma imagem da preparação com distribuições gaussianas probabilísticas mapeadas dos locais de todas as 81 fontes de sinal neuronal identificadas pelo ICA. O contorno verde representa a posição da face hexagonal do PDA em relação ao gânglio. Os números de cada gaussiano correspondem aos números de traço em C. (E) Redução de dimensionalidade usando a análise de componentes principais plotando os três primeiros componentes principais uns contra os outros ao longo do arquivo de 20 min. As épocas pré-estimulatórias de base, galope e rastreamento são mostradas em verde, ciano e azul escuro, respectivamente. Consulte vídeos 1-3 para animações de disparo neuronal correspondentes a esta gravação. Clique aqui para ver uma versão maior desta figura.
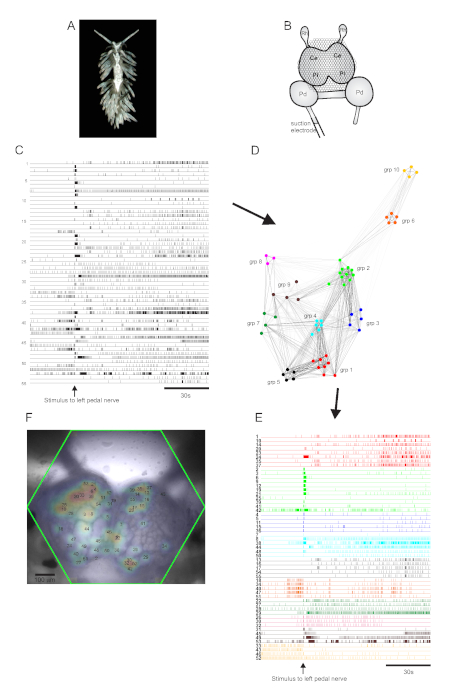
Figura 5: Resultados de Berghia stephanieae, uma nova espécie para neurociência, ilustrando gráficos de rede, agrupamento funcionale mapeamento bilateral de sinais. Umespécime de Berghia. (B) Esquema da configuração de imagem. Ce = lobo cerebral do gânglio cerebropleural; Pl = lobo pleural do gânglio cerebropleural; Pd = gânglio de pedal; Rh = gânglio rinoceronte. (C) Traços que apresentam a atividade espontânea e estimulada de 55 neurônios bilaterais na gânglios cerebropleural (a entrega do estímulo é indicada pela seta). (D) Um gráfico de rede exibindo os dez conjuntos funcionais, cada um atribuído a uma cor única, identificado através de clustering de consenso. Os nós nesta trama representam neurônios, onde a distância no espaço de rede representa o grau de correlação de disparo dentro e entre conjuntos. (E) Os traços em C são reorganizados e codificados por cores (seguindo o esquema de cores de D) em conjuntos funcionais. (F) Uma imagem da preparação mostrando os locais mapeados dos sinais de cada neurônio registrado, e os números de traços em C e E aos quais correspondem. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Animação do programa locomotor de fuga da Aplysia de 20 minutoscompleto . A opacidade das formas brancas sobrepostas a 81 neurônios individuais no gânglio do pedal direito (painel esquerdo) foi impulsionada pelos traços neuronais correspondentes (painel direito) e variou linearmente em função da taxa média de pico (binned por cada 0,61 s de tempo real na gravação). Para cada neurônio, a opacidade total foi normalizada à sua taxa máxima de disparo durante a duração da gravação. Um segundo do tempo decorrido no vídeo representa 12,2 s de tempo real. A barra de escala corresponde ao tempo real, com as linhas verde, ciano e azul escuro abaixo dos traços que indicam as fases de base pré-estímulo, galope e rastreamento do programa locomotor de fuga, respectivamente. As caixas amarelas ao redor da fase galope e uma parte da fase crawl indicam os trechos de gravação usados para gerar as animações nos Vídeos 2 e 3. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Vídeo 2: Animação da fase galope do programa de locomotor de fuga da Aplysia. O agrupamento de consenso foi realizado em todos os 81 neurônios registrados apenas na fase galope do programa motor para derivar os conjuntos funcionais, utilizando a abordagem e software descritos e disponibilizados no ref.12. Conjuntos neuronais exibindo padrões de disparo em grande parte tônicos ou irregulares durante esta fase do programa de fuga foram omitidos deste vídeo. Os potenciais de ação dos neurônios pertencentes aos conjuntos preto e verde-oliva podem ser ouvidos na faixa de áudio do vídeo, com os neurônios e traços correspondentes destacados. As taxas médias de pico foram normalizadas como no Vídeo 1 e com binning de tempo equivalente; 1 s de tempo decorrido no vídeo corresponde a 6.1 s de tempo real. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Vídeo 3: Animação da fase de rastreamento do programa de locomotor de fuga da Aplysia. O agrupamento de consenso foi realizado em todos os 81 neurônios registrados apenas na fase de rastreamento do programa motor para derivar os conjuntos funcionais. Conjuntos que exibem padrões de disparo em grande parte tônicos ou irregulares durante esta fase do programa motor foram omitidos deste vídeo. As taxas médias de pico foram normalizadas como nos vídeos 1 e 2 e com binning de tempo equivalente; 1 s de tempo decorrido no vídeo corresponde a aproximadamente 12,2 s de tempo real. Clique aqui para ver este vídeo. (Clique com o botão direito do download.)
Discussão
Um dos detalhes mais importantes na implementação de nossa abordagem de imagem VSD em larga escala é minimizar a vibração, que produz movimentos de bordas de contraste através dos diodos, resultando em grandes sinais artefatográficos. Como os VSDs de absorvimento produzem mudanças percentuais muito pequenas na intensidade da luz com potenciais de ação, artefatos de vibração, se não impedidos, podem obscurecer os sinais neuronais de interesse. Empregamos vários métodos para minimizar artefatos de vibração. Primeiro, nossa sala de imagem está situada no térreo, o que isola a preparação de vibrações relacionadas à construção de equipamentos de manuseio de ar e muitas outras fontes. Em segundo lugar, foi utilizada uma tabela de isolamento baseada em mola, que outros usuários de PDA confirmaram fornecer melhor amortecimento de vibração do que a tabela de ar mais comum16. Em terceiro lugar, foram utilizados objetivos de imersão em água, que eliminam flutuações de imagem decorrentes de ondulações superficiais. Em quarto lugar, a preparação que está sendo imageada foi levemente pressionada entre o fundo da tampa da câmara e um fragmento de deslizamento pressionado para baixo de cima que é mantido no lugar por plugues de silicone ou geleia de petróleo, estabilizando ainda mais a preparação. Isso também achata a superfície convexa do gânglio ou gânglio sendo imaged, resultando em mais neurônios no plano de foco do objetivo, o que aumenta o número de neurônios registrados.
Para maximizar a relação sinal-ruído para as pequenas mudanças no grau de absorção de luz VSD resultante de um potencial de ação, é essencial alcançar luz quase saturada através da preparação para o PDA, ao mesmo tempo em que minimiza a fotobleaching do corante. Para isso, normalmente trabalhamos a 3-4 V de intensidade de luz de repouso, medida com o interruptor de ganho do painel de controle PDA na posição 1x (os amplificadores 464 do PDA saturam a 10 V de luz). Durante a aquisição de dados, esse fator de ganho é alterado para 100x. Obter luz suficiente para atingir 3-4 V medido pelo PDA pode ser realizado de várias maneiras. Primeiro, use uma fonte de luz LED ultrabright que ofereça um comprimento de onda apropriado às propriedades de absorção do corante de absorção em uso. Assim, foi utilizada uma lâmpada collimated LED de 735 nm, que se sobrepõe aos comprimentos de onda de absorção ideais de RH155 e RH482. Em segundo lugar, se necessário, use um condensador de subestácrio flip-top que concentra a luz da fonte de luz LED para uma área menor. Em terceiro lugar, ajuste a altura do condensador para alcançar a iluminação Köhler, o que garante alto, até mesmo brilho e qualidade máxima da imagem. Em quarto lugar, certifique-se de que não há filtros de calor na via óptica, o que pode atenuar o comprimento de onda de 735 nm da lâmpada LED. Em quinto lugar, remova os difusores, se for necessário mais luz, da via óptica. Em sexto lugar, utilize objetivos de alta NA, que fornecem alta resolução espacial, e permitem níveis suficientes de luz para alcançar o PDA em intensidades de lâmpadas mais baixas. Isso nos permitiu minimizar o fotobleaching na medida em que podemos obter vários arquivos de aquisição de 10-20 minutos de duração por preparação usando a mesma intensidade de luz em todos os arquivos e sem uma perda significativa de amplitude de sinal ou a necessidade de re-coloração. Crucialmente, se o experimentador deseja rastrear neurônios através desses arquivos mais longos, certifique-se de que o plano focal não mude, e que a preparação não se mova. Finalmente, uma maneira adicional de direcionar luz suficiente para o PDA é usar animais mais jovens, que têm gânglios mais finos e, portanto, menos opacos.
De tempos em tempos, descobrimos que a relação sinal-ruído dos sinais ópticos se deteriora e/ou os ritmos do programa motor são subótimos (por exemplo, lentos ou anormais). Quando isso começa a ocorrer de forma consistente, misturamos novas soluções de VSD. As alíquotas de VSD normalmente permanecem viáveis por cerca de 6 meses em um congelador de -20 °C. Em relação, vale ressaltar que, para Berghia,os melhores resultados foram obtidos até agora com a absorção VSD RH482. Como o RH482 é mais lipofílico que o RH155, pode manchar melhor os neurônios relativamente menores de Berghiaou permanecer nas membranas neuronais de forma mais eficaz na maior temperatura salina de registro usada para esta espécie tropical.
Uma limitação da imagem baseada em PDA da atividade neural relaciona-se com o acoplamento CA dos sinais de tensão no hardware antes da etapa de preamplificação de 100x: embora isso represente uma característica necessária para remover o grande deslocamento dc produzido pelo alto nível de luz de repouso exigido por esta técnica, o acoplamento CA intrínseco ao PDA impede a medição de mudanças lentas no potencial da membrana, como aqueles associados a entradas sinápticas. Se a gravação de alterações potenciais lentas ou de estado constante for desejada, um sistema de imagem de câmera CMOS acoplado a DC pode ser utilizado para capturar atividades de sublocar. Byrne e colegas recentemente usaram tal configuração com RH155 para imaginar a atividade de neurônios no gânglio bucal da Aplysia17,18. Usamos ambos os sistemas e descobrimos que a câmera CMOS, devido à sua densidade muito maior de detectores (128 x 128), gera 50x arquivos de dados maiores para o mesmo tempo de imagem7. Os arquivos menores do PDA facilitam o processamento e análise mais rápidos. Isso também permite gravações estendidas de ensaio único(Figura 4) e estudos de aprendizagem, nos quais os dados de múltiplos ensaios são congratados em um grande arquivo antes da classificação de picos, permitindo que a organização da rede seja rastreada à medida que o aprendizado se desenvolve19.
Em outras investigações baseadas em câmeras, VSDs fluorescentes têm sido usados por Kristan e colegas para examinar a função de rede no gânglio segmental da sanguessuga. Em um estudo influente, isso levou à identificação de um neurônio envolvido na decisão do animal de nadar ou rastejar20. Em outro estudo, Kristan et al. examinaram até que ponto os comportamentos de natação e rastreamento da sanguessuga são impulsionados por circuitos multifuncionais versus dedicados21. Mais recentemente, Wagenaar e colegas usaram um microscópio de duas laterais para imagens de tensão que lhes permite gravar de quase todos os neurônios em um gânglio segmental de sanguessuga22. Em contraste com muitos métodos de imagem baseados em câmera, uma vantagem do nosso método de imagem baseado em PDA é a rápida e imparcial classificação de picos pela ICA, uma forma de separação de fontes cegas que não envolve decisões sobre limites neuronais para processamento de resultados.
Com relação à escolha dos VSDs, uma vantagem dos corantes de absorção RH155 e RH482 é a fototoxicidade pouco a não associada a eles23,24, permitindo tempos de gravação mais longos do que é típico para VSDs fluorescentes. Além disso, os VSDs de absorção rápida que usamos são adequados para registrar os potenciais de ação somática de superação nas preparações gastropodes, que normalmente são de 80 mV em amplitude. Como mostrado na Figura 3G,nosso método óptico pode registrar subvasidades potenciais de ação (nenhuma de nossas gravações são rastreadas em média): isso sugere que os VSDs que usamos devem ser capazes de discernir potenciais de ação em outros sistemas de modelo que atenuam até certo ponto e, portanto, não estão exagerando no momento em que chegam à soma. No entanto, nossa abordagem óptica pode não ser ideal para espécies que são conhecidas por apresentar potenciais de ação altamente atenuados quando registradas na soma.
Muitas pesquisas atuais em redes neurais estão sendo focadas em um pequeno número de espécies transgênicas de designers. No entanto, a neurociência se beneficia do estudo de uma grande variedade de espécies filogeneticamente distintas. Estudar muitas espécies diferentes fornece insights sobre como os circuitos evoluem25,26, e ilumina princípios da função de rede que podem ser comuns entre o filo1,2,3,4,27. Até agora aplicamos nosso método de imagem em várias espécies gastropodes, incluindo Aplysia californica8,11,12,13,14,28, Tritonia diomedea8,9,11,14,19,28, Tritonia festiva28, Pleurobranchaea californica (dados inéditos) e, mais recentemente, Berghia stephanieae (Figura 5). Um apelo dessa abordagem é que ela pode ser prontamente aplicada a muitas espécies, sem necessidade de animais transgênicos. Queremos reconhecer que nosso uso de imagens VSD com corantes de absorção rápida e um PDA segue os passos do trabalho pioneiro que realizou isso em preparações semi-intactas, comportando Navanax29 e Aplysia30 preparações. Nossa ênfase na rapidez de nossa abordagem é, em parte, uma resposta às preocupações de que muitos pesquisadores possam estar cada vez mais relutantes em iniciar estudos em rede em novas espécies devido aos temores de que anos de estudo serão necessários para caracterizar a organização básica da rede antes de poder explorar questões científicas de amplo interesse para a neurociência31. Assim, nosso objetivo aqui é demonstrar uma técnica que acelere muito o processo – a ponto de que insights significativos no mesmo dia sobre a organização da rede possam ser obtidos a partir de preparações únicas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela NSF 1257923 e NIH 1U01NS10837. Os autores desejam reconhecer a ajuda de Jean Wang no laboratório.
Materiais
| Name | Company | Catalog Number | Comments |
| Achromat 0.9 NA swing condenser | Nikon | N/A | |
| Bipolar temperature controller | Warner Instruments | CL-100 with SC-20 | Controls perfusion saline temperature |
| Chamber thermometer | Physitemp | BAT-12 with IT-18 microprobe | |
| Digital camera | Optronics | S97808 | |
| Dissecting forceps | Dumont | #5 | |
| Dissecting scissors | American Diagnostic Corp. | ADC-3410Q | |
| Imaging microscope | Olympus | BX51WIF | |
| Imaging perfusion chamber | Siskiyou | PC-H | |
| Instant Ocean | Instant Ocean | SS6-25 | Makes 25 gallons at a time |
| Master-8 pulse stimulator | A.M.P.I. | Master-8 | |
| Microdispenser | Drummond Scientific | 3-000-752 | Dye applicator for pressure staining |
| Microdissection scissors | Moria | 15371-92 | |
| Minutien pins (0.1 mm) | Fine Science Tools | NC9677548 | For positioning and stabilizing CNS |
| Motorized microscope platform | Thorlabs | GHB-BX | Gibraltar platform |
| NeuroPlex imaging software | RedShirtImaging | NeuroPlex | Compatible with the WuTech photodiode array |
| Objective lenses | Olympus | XLPLN10XSVMP, XLUMPLFLN20XW, LUMPLFLN40XW, UAPON40XW340 | |
| PE-100 polyethylene tubing | VWR | 63018-726 | Tubing to make suction electrodes |
| Perfusion pump | Instech | P720 with DBS062SDBSU tube set | |
| Petroleum jelly | Equate | NDC 49035-038-54 | |
| Photodiode array with control panel | WuTech Instruments | 469-IV photodiode array | Contact jianwu2nd@gmail.com for ordering information |
| RH155 | Santa Cruz Biotechnology | sc-499432 | Voltage-sensitive dye |
| RH482 | Univ of Conn. Health Center | JPW-1132 | Voltage-sensitive dye; special order from Leslie Leow |
| Silicone earplugs | Mack's | Model 7 | To be use for preparation compression |
| Staining PE tubing | VWR | 63018-xxx | Different sizes depending on fit |
| Sylgard 184 silicone elastomer kit | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Thorlabs LED and driver | Thorlabs | M735L2-C1, DC2100 | LED lamp and driver |
| Tygon tubing | Fisher Scientific | 14-171-xxx | |
| Vibration isolation table | Kinetic Systems | MK26 | Spring-based |
Referências
- Miller, C. T., Hale, M. E., Okano, H., Okabe, S., Mitra, P. Comparative Principles for Next-Generation Neuroscience. Frontiers in Behavioral Neuroscience. 13 (12), (2019).
- Brenowitz, E. A., Zakon, H. H. Emerging from the bottleneck: benefits of the comparative approach to modern neuroscience. Trends in Neuroscience. 38 (5), 273-278 (2015).
- Bolker, J. Model organisms: There's more to life than rats and flies. Nature. 491 (7422), 31-33 (2012).
- Carlson, B. A. Diversity matters: the importance of comparative studies and the potential for synergy between neuroscience and evolutionary biology. JAMA Neurology. 69 (8), 987-993 (2012).
- Chase, R. . Behavior and its neural control in gastropod molluscs. , (2002).
- Salzberg, B. M., Grinvald, A., Cohen, L. B., Davila, H. V., Ross, W. N. Optical recording of neuronal activity in an invertebrate central nervous system: simultaneous monitoring of several neurons. Journal of Neurophysiology. 40 (6), 1281-1291 (1977).
- Frost, W. N., et al. Monitoring Spiking Activity of Many Individual Neurons in Invertebrate Ganglia. Advances in Experimental Medicine and Biology. 859, 127-145 (2015).
- Frost, W. N., Wang, J., Brandon, C. J. A stereo-compound hybrid microscope for combined intracellular and optical recording of invertebrate neural network activity. Journal of Neuroscience Methods. 162 (1-2), 148-154 (2007).
- Frost, W. N., Wu, J. -. Y., Covey, E., Carter, M. Voltage-sensitive dye imaging. Basic Electrophysiological Methods. , 169-195 (2015).
- Brown, G. D., Yamada, S., Sejnowski, T. J. Independent component analysis at the neural cocktail party. Trends in Neuroscience. 24 (1), 54-63 (2001).
- Hill, E. S., Moore-Kochlacs, C., Vasireddi, S. K., Sejnowski, T. J., Frost, W. N. Validation of independent component analysis for rapid spike sorting of optical recording data. Journal of Neurophysiology. 104 (6), 3721-3731 (2010).
- Bruno, A. M., Frost, W. N., Humphries, M. D. Modular deconstruction reveals the dynamical and physical building blocks of a locomotion motor program. Neuron. 86 (1), 304-318 (2015).
- Bruno, A. M., Frost, W. N., Humphries, M. D. A spiral attractor network drives rhythmic locomotion. ELife. 6, 27342 (2017).
- Hill, E. S., Bruno, A. M., Vasireddi, S. K., Frost, W. N., Naik, G. R. ICA applied to VSD imaging of invertebrate neuronal networks. Independent Component Analysis for Audio and Biosignal Applications. , 235-246 (2012).
- Jahan-Parwar, B., Fredman, S. M. Neural control of locomotion in Aplysia: role of the central ganglia. Behavioral and Neural Biology. 27 (1), 39-58 (1979).
- Jin, W., Zhang, R. J., Wu, J. Y. Voltage-sensitive dye imaging of population neuronal activity in cortical tissue. Journal of Neuroscience Methods. 115 (1), 13-27 (2002).
- Neveu, C. L., et al. Unique Configurations of Compression and Truncation of Neuronal Activity Underlie l-DOPA-Induced Selection of Motor Patterns in Aplysia. eNeuro. 4 (5), 17 (2017).
- Cai, Z., Neveu, C. L., Baxter, D. A., Byrne, J. H., Aazhang, B. Inferring neuronal network functional connectivity with directed information. Journal of Neurophysiology. 118 (2), 1055-1069 (2017).
- Hill, E. S., Vasireddi, S. K., Wang, J., Bruno, A. M., Frost, W. N. Memory Formation in Tritonia via Recruitment of Variably Committed Neurons. Current Biology. 25 (22), 2879-2888 (2015).
- Briggman, K. L., Abarbanel, H. D., Kristan, W. B. Optical imaging of neuronal populations during decision-making. Science. 307 (5711), 896-901 (2005).
- Briggman, K. L., Kristan, W. B. Imaging dedicated and multifunctional neural circuits generating distinct behaviors. Journal of Neuroscience. 26 (42), 10925-10933 (2006).
- Tomina, Y., Wagenaar, D. A. A double-sided microscope to realize whole-ganglion imaging of membrane potential in the medicinal leech. ELife. 6, 29839 (2017).
- Chang, P. Y., Jackson, M. B. Interpretation and optimization of absorbance and fluorescence signals from voltage-sensitive dyes. Journal of Membrane Biology. 196 (2), 105-116 (2003).
- Parsons, T. D., Salzberg, B. M., Obaid, A. L., Raccuia-Behling, F., Kleinfeld, D. Long-term optical recording of patterns of electrical activity in ensembles of cultured Aplysia neurons. Journal of Neurophysiology. 66, 316-333 (1991).
- Katz, P. S. Evolution of central pattern generators and rhythmic behaviours. Transactions of the Royal Society of London, Series B. 371 (1685), 20150057 (2016).
- Moroz, L. L. Biodiversity Meets Neuroscience: From the Sequencing Ship (Ship-Seq) to Deciphering Parallel Evolution of Neural Systems in Omic's Era. Integrative and Comparative Biology. 55 (6), 1005-1017 (2015).
- Frost, W. N., Tian, L. -. M., Hoppe, T. A., Mongeluzi, D. L., Wang, J. A cellular mechanism for prepulse inhibition. Neuron. 40, 991-1001 (2003).
- Hill, E. S., Vasireddi, S. K., Bruno, A. M., Wang, J., Frost, W. N. Variable neuronal participation in stereotypic motor programs. PLoS One. 7 (7), 40579 (2012).
- London, J. A., Zecevic, D., Cohen, L. B. Simultaneous optical recording of activity from many neurons during feeding in Navanax. Journal of Neuroscience. 7 (3), 649-661 (1987).
- Wu, J., Cohen, L. B., Falk, C. X. Neuronal activity during different behaviors in Aplysia: A distributed organization. Science. 263 (5148), 820-823 (1994).
- Marder, E., North, G., Greenspan, R. J. Searching for insight. In Invertebrate Neurobiology. , 1-18 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados