Method Article
زرع رقعة مطبوعة بيولوجية ثلاثية الأبعاد في نموذج مورين من احتشاء عضلة القلب
In This Article
Summary
يهدف هذا البروتوكول إلى زرع رقعة مطبوعة بيولوجية ثلاثية الأبعاد على epicardium من الفئران المهجوعة التي تقوم بالنمذجة لفشل القلب. وهو يتضمن تفاصيل تتعلق التخدير, فتح الصدر الجراحية, الربط الدائم من اليسار المنحدرة (LAD) الشريان التاجي وتطبيق التصحيح مطبوعة بيولوجيا على المنطقة الزراعية من القلب.
Abstract
اختبار خصائص التجديد من 3D بقع القلب المطبوعة بيولوجيا في الجسم الحي باستخدام نماذج مورين من قصور القلب عن طريق دائمة اليسار تنازلي (LAD) الربط هو إجراء صعب ولديه معدل وفيات عالية نظرا لطبيعتها. لقد طورنا طريقة لزرع بقع مطبوعة بيولوجيًا باستمرار من الخلايا والهيدروجيل على epicardium لقلب فأر مُفرّس لاختبار خصائصها التجديدية بطريقة قوية وممكنة. أولاً، يتم تخدير الماوس بعمق بعناية وتهوية. بعد استئصال الصدر الجانبي الأيسر (الفتحة الجراحية للصدر) ، يتم ربط LAD المكشوف بشكل دائم ويتم زرع التصحيح المطبوع بيولوجيًا على epicardium. الماوس يتعافى بسرعة من الإجراء بعد إغلاق الصدر. وتشمل مزايا هذا النهج القوي والسريع معدل وفيات متوقع لمدة 28 يوما يصل إلى 30٪ (أقل من 44٪ التي ذكرتها دراسات أخرى باستخدام نموذج مماثل من الربط LAD دائم في الفئران). وعلاوة على ذلك، فإن النهج الموصوف في هذا البروتوكول متعدد الاستخدامات ويمكن تكييفه لاختبار البقع المطبوعة بيولوجيا باستخدام أنواع مختلفة من الخلايا أو الهيدروجيلات حيث هناك حاجة إلى أعداد كبيرة من الحيوانات لدراسات الطاقة على النحو الأمثل. عموما، ونحن نقدم هذا باعتبارها نهجا مفيدا التي قد تغير الاختبار قبل الفحص في الدراسات المستقبلية لمجال تجديد القلب وهندسة الأنسجة.
Introduction
زرع القلب هو العلاج القياسي الذهبي للمرضى الذين يعانون من فشل القلب في نهاية المرحلة ولكن هناك نقص في الأعضاء المانحة. فإنه يتطلب قمع الجهاز المناعي لمنع رفض الكسب غير المشروع ومعدل الوفيات لمدة عام واحد هو 15٪ في جميع أنحاء العالم1. لذلك، هناك حافز طويل الأمد لتجديد عضلة القلب في نماذج الحيوانات قبل السريرية بهدف ترجمة إلى التجارب على الإنسان2،,3،,4،,5،,6،,7،,8،,9. وقد اكتسبت التطورات الأخيرة في الطباعة الحيوية 3D من الخلايا الجذعية أو الخلايا الجذعية المشتقة من الخلايا الجذعية الاهتمام باعتبارها نهجا واعدا لتجديد عضلة القلب2,3,9,10,11,12.
وقد تم الإبلاغ عن أول تجارب السلامة البشرية تطبيق بقع لتجديد القلب, مع خلايا أحادية نخاع العظم التلقائية علقت في الكولاجين أو الخلايا الجذعية الجنينية المشتقة الخلايا الخلايا الجذعية الخلايا السلف في الفيبرين, زرعها إلى epicardium7,8,13. ومع ذلك ، للحصول على طريقة أكثر دقة وقابلة للتطوير وقابلة للأتمتة وقابلة للاستنساخ ، الطباعة الحيوية ثلاثية الأبعاد لبقع هيدروجيل الأمثل ليتم تطبيقها على سطح القلب epicardial هو نهج واعد لتجديد عضلة القلب للمرضى الذين قد يحتاجون إلى زراعة قلب2،10،11،12.
قبل أن تحدث الترجمة إلى التجارب البشرية، هناك حاجة إلى دراسات حيوانية قبل السريرية. Preclinical في نماذج الجسم الحي متابعة تجديد عضلة القلب وقد أفيد في الخنازير5, الأغنام14,الفئران 6 والفئران4. نموذج مشترك من احتشاء عضلة القلب (MI) في الفئران يستخدم الربط الدائم من اليسار المنحدرة (LAD) الشريان التاجيالتاجي 15,16. بين سلالات مختلفة من الفئران المستخدمة، ربط LAD دائم في الفئران C57BL6 لديه معدل البقاء على قيد الحياة مقبولة وعادة ما يقدم إعادة عرض متسقة وتغييرات القلب بعد MI16. في نماذج القوارض، وقد وصفت العديد من الأساليب حيث تم تطبيق أنسجة القلب على القلب سعيا لتجديد فعال من عضلة القلب التالفة4،6،17. في حين أن الحيوانات الكبيرة لا تزال تمثل نموذجا أكثر أهمية سريريا لاختبار خصائص تجديد القلب5,14, براعة وجدوى نموذج الماوس يفسح المجال لهذه المنطقة سريعة الحركة من الدراسة. هذا قد تجنب بعض المزالق نموذجية من الدراسات الحيوانية الكبيرة, بما في ذلك (ولكن لا تقتصر على): 1) ارتفاع معدل وفيات الحيوانات (ما لم يتم ربط الشرايين التاجية قطري مما يؤدي إلى حظائر تجزئة لا يمكن التنبؤ بها14, أو يتم منع نهاية هرج من LAD متبوعا reperfusion بدلا من الربط الدائم5); 2) القضايا الأخلاقية مع زيادة الضرر نسبيا الناجمة عن بروتوكولات الحيوانات الكبيرة مقارنة الفئران18؛ 3) زيادة التكلفة و / أو قضايا الجدوى، على سبيل المثال عدم توافر نسبيا من المعدات الحيوانية الكبيرة مثل الماسحات الضوئية الرنين المغناطيسي14. ومن المهم أيضاً النظر في أنه بالنظر إلى المدة الواسعة والالتزام النموذجي للدراسات الحيوانية الكبيرة، فإن لديها القدرة على أن تصبح بالية قبل الانتهاء منها، لا سيما مع التطورات السريعة النموذجية لهذا المجال. على سبيل المثال، إلا في الآونة الأخيرة أن الدور الحاسم الذي لعبته الخلايا الالتهابية والوسطاء في تنظيم تجديد القلب قد ظهرت19,20. وعلاوة على ذلك، تم تسليط الضوء على الدور الحاسم للدراسات قبل السريرية، مثل نماذج الحيوانات الصغيرة، من قبل لجنة لانسيت كخطوة أساسية لاكتساب معرفة قوية قبل الانتقال إلى التجارب البشرية21.
لتسهيل التقدم في فهم الآليات وتحسين الظروف لنهج تجديد القلب على أساس التصحيح في الجسم الحي ، نقدم نهجًا جديدًا يصف طريقة "scoop وthing" لتطبيق تصحيح Alginate/gelatine hydrogel ثلاثي الأبعاد المطبوعة على سطح القلوب المهائمة في الفئران C57BL6. والهدف من هذا النهج هو توفير تنوعا في نموذج vivo لاختبار بقع 3D مطبوعة بيولوجيا التي من المرجح أن تكون مجدية في سياقات بحثية واسعة النطاق لحقل سريع التطور لتجديد القلب2. ويمكن تكييف هذه الطريقة لاختبار بقع ولدتها أساليب غير البيولوجية، والهيدروجل المختلفة والخلايا الجذعية الذاتية أو اللوجينية المشتقة من الخلايا الجذعية داخل بقع في الجسم الحي. ومع ذلك، فإن النظر التفصيلي في الطباعة البيولوجية أو الهيدروجيلات أو أنواع الخلايا خارج نطاق هذه الدراسة التي تركز على طريقة الزرع الجراحي.
وتشمل مزايا البروتوكول أن احتشاء عضلة القلب وتطبيق التصحيح مطبوعة بيولوجيا يتم تنفيذها في عملية جراحية واحدة التي يمكن تنفيذها بسرعة، مع الأدوات المختبرية المتاحة بسهولة، فعالة من حيث التكلفة ومع معدل وفيات منخفض نسبيا. كما أنه يسمح عادة لعدد أكبر من الحيوانات من النماذج الحيوانية الكبيرة في مساحة أصغر، مما يسمح مقارنة قوية من مجموعات تجريبية متعددة، مفيدة بشكل خاص للمقارنة بين المجموعات المتعددة في الجسم الحي. من ناحية أخرى ، هذا البروتوكول له عيوب: 1) نموذج الماوس هو أكثر بعدا عن حجم القلب البشري ، والتشريح وعلم وظائف الأعضاء مما كانت عليه في نماذج الحيوانات الكبيرة ، وأنه لا يترجم مباشرة إلى البشر ؛ 1) نموذج الماوس هو أكثر بعدا عن حجم القلب البشري ، وعلم وظائف الأعضاء في الجسم . 2) فروع المورين لاد proximally، مع تباين كبير بين الفئران الفردية، مما يؤدي إلى تقلب حجم المزارع (مشكلة مشتركة مع نماذج الحيوانات الكبيرة)؛ 3) يجب تطبيق التصحيح على سطح القلب الأمامي كله، وهو أقل دقة من تطبيق على منطقة محددة من الفاركت؛ و 4) يتم تطبيق التصحيح على الفور في ذلك الوقت من MI (للاستخدام البشري فمن المرجح أن يكون أكثر فائدة سريريا لتطوير التصحيح للتطبيق على فشل مزمن في أشهر القلب بعد MI14الأولية).
ومع ذلك، إذا تم اختياره بشكل مناسب وفقاً للفرضية التي يجري اختبارها، يمكن لهذا البروتوكول أن يوفر بيانات حيوية في البيانات الحية بسرعة، مع أرقام n عالية، بطريقة تتسق مع المواد والميزانية والخبرة المتاحة في معظم المختبرات. بالمقارنة مع نماذج الحيوانات الكبيرة ، وهو نموذج في الجسم الحي الذي هو تنوعا بما يكفي للتكيف مع تكنولوجيات 3D الناشئة للطباعة الحيوية (على سبيل المثال من خلال السهولة النسبية لإجراء الدراسات التجريبية لاختبار الجدوى والسلامة قبل الانتقال إلى نماذج حيوانية أكبر). سيكون مناسبًا تمامًا للباحثين الذين يرغبون في توليد بيانات vivo بكفاءة وبتكلفة غير مكلفة ، وربما تشغيل مقارنات متعددة من بقع مطبوعة بيولوجيًا ثلاثية الأبعاد مع معلمات الطباعة الحيوية المختلفة أو الخلايا أو الهيدروجيل في البقع. وسيكون من المفيد بشكل خاص لاختبار تفاعلات مختلف خليط من الخلايا الجذعية والخلايا الجذعية المشتقة من الخلايا الجذعية مع الهيدروجيل في الجسم الحي دون الهدر الزائد من أنساب الخلايا باهظة الثمن أو غيرها من المواد التي قد تحدث إذا باستخدام بقع واسعة النطاق. ومن شأن استخدام نموذج الماوس أن يسهل أيضا اختبار البقع التي تحتوي على الخلايا المشتقة من الماوس المتوافقة مع الأنواع وسلالات الخلايا الجذعية أو الخلايا المشتقة من الإنسان حيث من المرغوب فيه وجود فئران موحدة تعاني من نقص مناعي محدد. بالإضافة إلى ذلك، يمكن أن يسمح الاختبار في سلالات الفئران المعدلة وراثيا للباحثين بعزل آثار جينات محددة على مسارات الإشارة وفي أنواع محددة من الخلايا ذات الصلة بأمراض القلب والأوعية الدموية، وهو ما لن يكون ممكناً في الوقت الحالي في نموذج حيواني كبير.
Protocol
وقد وافقت لجنة أخلاقيات الحيوان في منطقة الصحة المحلية في شمال سيدني، نيو ساوث ويلز، أستراليا على جميع الإجراءات الموصوفة في هذه التجربة (رقم المشروع RESP17/55).
1. التخدير والنوب
ملاحظة: قم بتشغيل و إعداد منظار الميكروكروسكوب، وسادة الحرارة (مغطاة بواصة امتصاص) ونظام التنفس الصناعي.
- قفازات نظيفة، والمنطقة الجراحية، والأدوات مع 70٪ الإيثانول.
- وزن الماوس لحساب جرعة التخدير حقن طريق intraperitoneal (الكيتامين 40 ملغ / كغ، xylazine 5 ملغ / كغ، الأتروبين 0.15 ملغ / كغ) وإعطاء الحقن.
- بمجرد أن يصل الماوس إلى مستوى عميق من التخدير ، يحلق الجانب الأيسر من الصدر مع أداة تشذيب.
- ضع الفأر في غرفة تحتوي على 2٪ isoflurane (ضمان التهوية استخراج كافية في الغرفة).
ملاحظة: الجرعة المنخفضة نسبيا من الكيتامين / حقن xylazine جنبا إلى جنب مع 2٪ استنشاق ايزوفلوران يقلل من خطر وفاة الماوس مع السماح النوبه الأمثل دون الاستيقاظ الماوس. - ضع الماوس وكبح جماحه من أسنانه القاطعة العليا مع خياطة 3.0 مسجلة على مقاعد البدلاء ، كما هو موضح في الفيديو. تأكيد التخصب عن طريق إجراء قرصة إصبع. ضع إضاءة عالية الكثافة فوق رقبة الماوس بحيث يمكن تصور البلعوم.
ملاحظة: بدلاً من ذلك، يمكن وضع الماوس على الحامل من مجموعة الاحتضان (مثل مجموعة الاحتضان ماوس كينت) مع شريط مرنة المضمون تحت القاطعات الأعلى لعقد الفم مفتوحة لتحديد القصبة الهوائية. - استخدام ملعقة منحنية لفتح الفك وزوج آخر من ملاعق / ملقط حادة لرفع اللسان بلطف للخروج من الطريق. تأكد من intubate أثناء وضعه في أو أقل قليلاً من مستوى العين مع جسم الماوس.
- تصور فتح وإغلاق الحبال الصوتية. عند فتح، أدخل قسطرة بلاستيكية 20 G مزودة مع مجموعة النوبات.
- نقل بعناية الماوس intubated إلى سطح التشغيل مجهزة وسادة التدفئة. قم بتوصيل الماوس بجهاز التنفس الصناعي (على سبيل المثال، MouseVent) الذي يقوم تلقائيًا بتعيين الحجم المستهدف استنادًا إلى وزن الماوس.
- تسليم 1.5-2٪ isoflurane مع الأكسجين (الذي ينظمه تلقائيا جهاز التنفس الصناعي: ضمان وجود اتصال من اسطوانة الأكسجين إلى جهاز التنفس الصناعي التلقائي في 1-2 L/ دقيقة معدل التدفق إلى جهاز التنفس الصناعي). تحقق من النوب عن طريق التحقق من ارتفاع الصدر الثنائية. تحقق من التخدير عن طريق إجراء قرصة إصبع قدم.
- تطبيق مرهم opthalmic (على سبيل المثال، Puralube الطبيب البيطري مرهم Opthalmic) إلى كلتا العينين لمنعهم من الجفاف.
2. إعداد المجال الجراحي
- تأمين أنبوب النوبات مع الشريط في موقع الربط بين جهاز التنفس وأنبوب التنفس / القسطرة.
- قطع قطعة أطول من الشريط وتأمين القدم الأمامية اليسرى لسطح التشغيل في وضع مرتفع قليلا. أيضا الشريط أسفل الأطراف الأخرى.
- تنظيف الصدر مع 70٪ معقمة isopropanol و povidone محلول اليود، وتنظيف في حركة دائرية الانتقال من مركز إلى أطراف.
- تحقق من التخدير مرة أخرى مع قرصة إصبع.
- إدارة 0.08 ملغم / كغم تيمفيت (البوبرينورفين) في 0.1 مل من 0.9٪ ملحي عن طريق الحقن تحت الجلد.
3. اليسار ثُرَكَةِ الرَمَيّة
- استخدام ملقط غرامة تلميح لرفع بلطف الجلد عند نقطة ما يقرب من 5 ملم إلى يسار الغضروف xiphoid بارزة. استخدام مقص الجراحية لخلق شق فوق مومي في الجلد من هذه النقطة صعودا ونحو خط الوسط، إلى مستوى مانوبيوم.
- استخدم ملقط منحنية لفصل بلطف طبقات الجلد والعضلات. افتح طبقة العضلات، بعد شق الجلد.
- تحديد وإجراء شق في الفضاء البيني الثالث، بعد الزاوية الطبيعية للضرع الصدري.
- استخدم الدارق للانتشار بلطف بعيداً عن الأضلاع الثالثة والرابعة.
- قم بإزالة الـ"بيريكارديوم" الرقيق بلطف باستخدام ملقط.
- إذا لم يتم تصور LAD، دفع بلطف auricle اليسار (انظر الشكل التكميلي 1) صعودا وتحديد موقع الشرايين التاجية تحت.
4. اليسار الهبوط الأمامي (LAD) ربط الشريان التاجي الدائم
- قطع ~ 3 مم طويلة خياطة الحرير 3-0 ووضع هذا تعزيز 3-0 قطعة خياطة الحرير على رأس LAD في نفس الاتجاه كما LAD (كما هو مبين في الفيديو في الوقت نقطة 02:12 – 02:20).
- تحديد LAD وتمرير خياطة الحرير 7-0 تحت LAD. إذا لم يكن متصوراً بوضوح، أدخل الإبرة 1 ملم دونية ووسيبل إلى النقطة السفلية التي تم الوصول إليها من قبل طرف الوركل الأيسر أثناء الحركة الديناميكية للقلب.
ملاحظة: هذا الهيكل هو لون أخف لون أحمر إلى غرف البطين من القلب ولكن أغمق من الرئة المجاورة وأفضل تصور في الفيديو في الوقت نقطة 01:54 - 01:55 حيث يكون مرئيا فقط أدنى من الذراع متفوقة من الدارف، متفوقة على الرئة اليسرى (انظر الشكل التكميلي 1 للحصول على صورة الفيديو المشروحة لا يزال). - إكمال رميتين مع خياطة الحرير 7-0 وإغلاقه بإحكام يمر على رأس خياطة الحرير داعمة 3-0 لتأمين LAD. إذا نجح الربط، فإن منطقة البطين الأمامي البعيدة عن الرباط سوف تبيض.
- إكمال عقدة مع رمية ثالثة في الاتجاه المعاكس لتأمينه، وضمان عدم نقل قوة الجر التصاعدي إلى خياطة. لا يلزم رميات إضافية للحد من خطر تلف عضلة القلب أو LAD عن طريق قطع خياطة من خلال.
5. زرع التصحيح مطبوعة بيولوجيا على epicardium
- نقل بعناية التصحيح مطبوعة بيولوجيا من ستة لوحة بئر إلى منطقة المزارع باستخدام سطح داخل العقيمة من حزمة مشرط الجراحية المفتوحة.
- ضع بعناية الرقعة المطبوعة بيولوجيًا على السطح الملحمي الأمامي ، حيث يجب أن تغطي السطح بأكمله وثنية على الحواف السفلية والجانبية ، وتغطي البطين الأيسر ومنطقة الفار (منطقة مبيضة).
- أغلقي الداّر برفق وأزلي الداّر دون توجيه حواف حادة نحو القلب.
- استخدام 6-0 خياطة البرلين في نمط توقف بسيط لإغلاق القفص الصدري وطبقات العضلات.
- مع وظيفة التنفس تنهد في حين إغلاق الصدر مع خياطة البرلين 6-0، تضخيم الرئتين لإزالة الهواء الزائد في تجويف الجنبي، والتي من شأنها أن تصبح خلاف ذلك محاصرين في تجويف الصدر ويؤدي إلى وجود رئة.
- تأكد من أن الصدر مغلق بإحكام.
- إنقاص isoflurane إلى 1.0%. أغلق الجلد مع 6-0 خياطة البرلين في نمط متقطع بسيط. قم بإيقاف تشغيل مرذاذ الـisoflurane.
6. الماوس الانتعاش
- موضعيا تطبيق 2 ملغ / مل bupivacaine في 0.9٪ المالحة إلى شق. يُعطى أيضاً: ط) مضادات الزّاد (أتيباميزولي) 1 ملغم/كغ؛ '2' لاسيكس (فوروسميد) 8 ملغم/كغ؛ iii) 600 ميكرولتر من محلول ملحي 0.9٪ عن طريق حقن تحت الجلد.
ملاحظة: Antisedan هو عكس التخدير بسرعة أكبر; فوروسيميد هو تفريغ السوائل الزائدة بسبب حل وسط الناتج القلبي والسوائل إضافية تدار مع حقن المخدرات. - مراقبة الماوس والانتظار حتى يتم ملاحظة التنفس مستقلة لإزالة الماوس من أنبوب النوبات.
- عندما يوضح الماوس معدل التنفس الثنائي الكافي والعمق ويستجيب لقرصة إصبع، ضع الماوس في قفص انتعاش نظيف يوضع على وسادة حرارية.
- تزويد الماوس مع الطعام الرطب (مبللة للمضغ)، وزجاجة المياه والمغذيات / ترطيب هلام. مراقبة لجهود التنفس مبالغ فيها، نزيف مفرط، أو مضاعفات أخرى يحتمل أن تهدد الحياة.
- للأيام الثلاثة المقبلة, إدارة 0.08 ملغم / كغ تيمفيت (البوبرينورفين) في 0.1 مل من 0.9% ملحي عن طريق حقن تحت الجلد أو داخل الصفتون, مرتين يوميا, ثم مرة واحدة يوميا حتى اليوم الخامس بعد الإجراء.
- فئران المنزل في أزواج مفصولة بفواصل قفص لمنع العزلة مع منع السلوكيات القتالية. مراقبة الفئران يوميا على الأقل حتى نهاية التجارب (28 يوما) مع إيلاء اهتمام وثيق لرفاههم وزيادة وتيرة الرصد إذا كان هناك أي مخاوف.
النتائج
في زرع, اللزوجة من التصحيح في درجة حرارة الغرفة (دون إضافية crosslinker يجري تطبيقها) سمح لها 'ستائر' على ملامح القلب (الشكل 1) والتحرك بشكل حيوي مع دورة القلب. بعد الجراحة، تركنا بقع لمدة 28 يوما في الجسم الحي كما وجدت الدراسات أن هذا فترة زمنية مناسبة تسمح للآثار التصحيح على وظيفة القلب المضيف3،4 (على الرغم من أنه قد أفيد أن الآثار الوظيفية الكاملة قد لا ينظر إليها حتى ثلاثة أشهر بعد زرع)22. تم التقاط صورة للصقع يظهر في الموقع على قلب الماوس في الشكل 1 مباشرة بعد التطبيق ، مما يظهر قدرة التصحيح على الثني على القلب عند الزرع. هذه النتيجة التمثيلية تبين أن الهيدروجيل يسمح للصقع لقالب إلى ملامح القلب، وحيث حدث التوتر المفرط هيدروجيل كان قادرا على تقسيم كما هو مبين من قبل عارية (هيدروجيل خالية) منطقة الثلاثي في الشكل 1 (المشار إليها من قبل نجم أسود في الصورة). وتظهر بيانات البقاء على قيد الحياة (كابلان ماير منحنيات البقاء على قيد الحياة) في الشكل 2 بالمقارنة مع الفئران التي تمر بإجراء صوري (مرور إبرة وخياطة تحت LAD دون ربط تليها إغلاق الصدر الماوس).
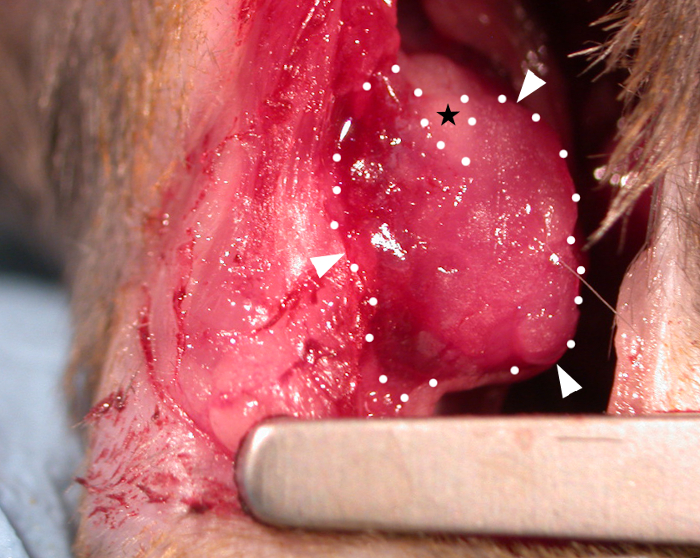
الشكل 1: تصحيح القلب مطبوع بيولوجيا تطبيقها على epicardium من قلب الماوس C57BL6. يظهر 10 مم × 10 مم × 0.4 مم رقعة مطبوعة بيولوجية (مباشرة بعد الزرع) تحتوي على هيدروجيل (alginate 4٪ (ث / v) / جيلاتين 8٪ (ث / الخامس) في وسائل الإعلام) تتدلى على المنطقة المهاذبة والتمسك السطح epicardial (رؤوس الأسهم البيضاء والخطوط المنقطة = الحدود من التصحيح). اللزوجة التصحيح يسمح لها العفن إلى ملامح القلب، وحيث حدث التوتر المفرط في الجانب متفوقة وقد انقسم التصحيح لجعل منطقة عارية الثلاثي لا تغطيها هيدروجيل (نجمة سوداء). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
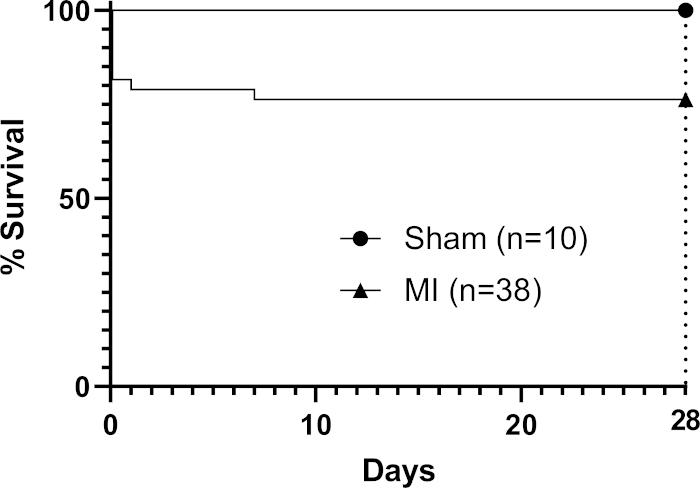
الشكل 2: تحليل كابلان ماير للبقاء على قيد الحياة خلال 28 يوما بعد MI. تسعة الفئران في المجموعة الإجرائية توفي (ن = 38) لإعطاء معدل وفيات إجمالي من 24٪. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: صورة الفيديو الثابتة (فيديو نقطة الوقت 01:54 – 01:55) تظهر في اليمين (الملحق الأذين الأيسر). يشير السهم إلى الطرف الاستدلالي للورقة اليسرى التي تظهر كهيكل مثلث على الحافة اليسرى العليا للقلب. في حالة عدم تصور LAD بوضوح ، يمكن استخدام طرف الـ auricle الأيسر كمعلم لدخول الإبرة لتمرير خياطة تحت LAD. نقطة الدخول 1 ملم أدنى ووسيل إلى النقطة السفلية يصل طرف auricle اليسار أثناء الحركات الديناميكية للقلب (يظهر السهم الأسود تلميحا الاستدلالية من auricle اليسار). الرجاء النقر هنا لتحميل هذا الرقم.
Discussion
تسهل الطريقة المشغل لزرع تصحيح مطبوع بيولوجيًا بكفاءة عن طريق تطبيقه على السطح الملحمي لقلب فأر مُفرّق بعد ربط LAD الدائم. في هذه الطريقة التي تركز على الجدوى، ونحن قادرون على تنفيذ هذا الإجراء على ثمانية فئران في يوم العمل (بما في ذلك إعداد الغرفة قبل وبعد). وتستغرق عملية الطباعة البيولوجية التي تنتج ثماني بقع 1 سم2 في آبار من ألواح من ستة آبار 2-3 ساعات (بما في ذلك وقت التحضير قبل وبعد). استخدمنا داخل العقيمة من حزمة مشرط الجراحية كما مغرفة لدينا التصحيح، والتي يمكن الوصول إليها بسهولة وعموما يضيف الحد الأدنى من التكلفة، وذلك باستخدام خصائص لاصقة الطبيعية من التصحيح هيدروجيل alginate / الجيلاتين لثنية التصحيح عبر السطح الأمامي من القلب. في تجربتنا، بروتوكول لاتم ربط LAD في الفئران يعتمد على المشغل ويمكن تحقيق معدل وفيات أقل في 28 يوما مع المشغلين ذوي الخبرة المتخصصة في نموذج واحد. وذكرت فان دنبورن وآخرون 16 أن الفئران C57BL6 تمثل 44٪ وفيات بعد ربط LAD دائم في 28 يوما دون تطبيق التصحيح، وهو أعلى من الحد الأعلى من 30٪ التي لاحظناها مع الأسلوب.
خطوة النوبات أمر بالغ الأهمية وفي حد ذاته يمكن أن يكون مصدرا للوفيات للفئران ما لم يتم تنفيذها من قبل مشغل المهرة. وهو أمر صعب بسبب حجم صغير من القصبة الهوائية، وهذا هو السبب يتم ارتداء النظارات المكبرة من قبل المشغل لهذه الخطوة. نستخدم الكيتامين عن طريق الحقن/إكسيلازين وكذلك ايزوفلوران المستنشق لاستقراء التخدير بحيث يتم تخدير الفأر بعمق بجرعات منخفضة نسبيا من كل دواء. ولذلك، ليس هناك خطر للماوس على الاستيقاظ خلال هذه الخطوة النوبه ولكن يتم تجنب ارتفاع معدل الوفيات المرتبطة جرعات عالية من المخدرات واحد. كما أعطيت الأتروبين لمواجهة الآثار الجانبية مثل بطء القلب وفرط الحساسية. استخدام الضوء المطبق على الحلق تضيء خارجيا القصبة الهوائية داخليا حتى يكون أكثر وضوحا والحبال الصوتية يجب أن يكون تصور فتح وإغلاق مع معدل التنفس في الماوس (عادة ~ 120 نفسا في الدقيقة الواحدة). من المهم وضع الماوس تماما (وهذا هو السبب يفضل سطح صلب بدلا من حصيرة الاحترار تحت الماوس لهذه الخطوة) مع اثنين من الأسنان القاطعة التي عقدت من قبل خيط حلقي واللسان تراجع بلطف للغاية مع ملقط حادة / زوج من ملعقة لفتح الفم وتصور القصبة الهوائية. بمجرد اكتمال النوب، يجب على المشغل أن يكون حريصاً على عدم إزاحة الأنبوب في النقل من منطقة الاحتضان إلى سرير التشغيل (الذي لديه حصيرة حرارة تحته لمنع انخفاض حرارة الجسم). عند توصيل أنبوب التنفس بجهاز التنفس ، من المهم تثبيت الأنبوب بيد واحدة وتوصيل دائرة التنفس الصناعي مع الأخرى ، بحيث يكون هناك الحد الأدنى من حركة أنبوب التنفس مثل دفعه أكثر عمقًا في القصبة الهوائية عند توصيل جزء جهاز التنفس الصناعي من الأنبوب.
في هذه الدراسة، استخدمنا alginate 4٪ (ث / الخامس) / الجيلاتين 8٪ (ث / الخامس) في دولبيككو معدلة النسر المتوسط (DMEM). ومن المعروف Alginate / الجيلاتين الهيدروجيلات لمكوناتها الحيوية، وانخفاض التكلفة وخصائص الميكانيكا الحيوية مما يجعلها مفيدة لاستراتيجيات هندسة الأنسجة 3D23. ويمكن ربط هذه الهيدروجيل بواسطة هلام خفيف عن طريق إضافة أيونات الكالسيوم، والتي تسمح بتغيير اللزوجة. بعد الطباعة الحيوية، قمنا بتطبيق كلوريد الكالسيوم (CaCl2)2٪ (ث / الخامس) في محلول ملحي الفوسفات المخزن (PBS) على بقع ثم استزراعها في DMEM في ستة لوحات بئر لمدة 7-14 أيام قبل زرعها. وكان هذا هو الإطار الأمثل بعد بقع تحتوي على خلايا القلب بدأت في التغلب على الثقافة ولكن قبل بقع بدأت تتفكك. في حين يمكن إضافة CaCl2 بانتظام في جميع أنحاء مرحلة ما بعد الطباعة الحيوية للحد من تفكك التصحيح ، وجدنا أن اللزوجة الجوهرية للهيدروجيل كانت كافية للبقع للحفاظ على هيكلها حتى زرع مع جرعة واحدة فقط الأولية من CaCl2.
الطريقة المسموح بها لزرع ناجحة دون الغرز (التي قد تضر القلب) أو الغراء (والتي قد تمنع الواجهة بين التصحيح والقلب). قد تؤكد الدراسات المستقبلية فرضية أن زرع الغرز و الغراء لا يؤثر سلبا على الغرة في الفئران لأنه من الأهمية بمكان أن التصحيح لا تنزلق من القلب أو تتداخل مع الرئتين. وقد قامت دراسات أخرى تقييم engraftment من بقع في نماذج ربط LAD الدائمة مع إصلاح التصحيح القائمعلى 3 قياس منطقة engrafted (مم2)المتبقية مع الوقت24، سمك التصحيح المطعمة (μm) remining مع الوقت25، quantification الخلايا المزروعة بواسطة تفاعل البوليميراز المتسلسل (PCR)26 أو تدفق انبعاثات فوتونات الضوئية الحيوية للخلايا المتبرعة الحية الموسومة (مقياس للفوتونات المنبعثة في الثانية الواحدة والتي يمكن أن تحدد كميا الخلايا المطعمة الموسومة الباقية على قيد الحياة في الحيوانات الحية مع مرور الوقت)27. قد تستخدم الدراسات المستقبلية هذه الأساليب لمواصلة تقييم ما إذا كان زرع الغرز والخالية من الغراء يؤثر على النقش التصحيح (وكذلك الآثار الهيكلية والوظيفية على عضلة القلب المضيف). ومع ذلك ، بشكل العيان بعد 28 يوما في الجسم الحي في الفئران لدينا المناعية ، وقدم الوسيط الأمامي متغير fibrinous المواد والالتصاقات. قد تكون آلية تجديد القلب القائم على التصحيح من تحفيز الاستجابات الالتهابية الضامةالمضيفة 19 أو العوامل المناعية السرية20 بدلاً من تجديد الخلايا العددية. إذا كان الالتهاب يلعب دورا إيجابيا، قد يكون وجود المواد هيدروجيل الأجنبية مفيدة. بدلا من ذلك، للحد من وجود المواد الأجنبية قد يكون من المفيد إذا كان مكون هيدروجيل يتفكك مع مرور الوقت. في الواقع، بعض النهج استخدام المواد الحيوية التي تدعم الخلايا في البداية ومن ثم تتفكك، وترك الأنسجة فقط28،29. دراسات مستقبلية لتحليل كامل تصحيح engraftment وفهم أفضل للآليات وراء تجديد القلب التصحيح القائم على قد يؤدي إلى الأمثل التصاميم التجريبية قبل الترجمة إلى التجارب البشرية2.
وعموما، من المرجح أن يكون هذا البروتوكول ممكنا على نطاق واسع، كما أنه مناسب لاختبار مجموعات متعددة من بقع مطبوعة بيولوجيا ثلاثية الأبعاد، على سبيل المثال مع محتويات خلوية مختلفة. وتشمل الاتجاهات المستقبلية لهذه الطريقة الطباعة البيولوجية للبقع التي تحتوي على الهيدروجيلات المتقدمة التي لم تختبر من قبل في الجسم الحي أو اختبار آثار الخلايا الجذعية المشتقة من الخلايا الجذعية ذاتية أو التحللية المختلفة، وذلك لتحسينها قبل الشروع في النماذج الحيوانية الكبيرة.
Disclosures
اي.
بيان التمويل:
تم دعم كريستوفر د. روش بمنحة السير جون لوينثال 2019 (جامعة سيدني)، وصندوق لو غروس للتراث في نيوزيلندا (PhD012019) ومنحة دكتوراه في أبحاث القلب في أستراليا (2019-2002). تم دعم كارمين جنتيل من قبل منحة جامعة سيدني كيك ستارت، ومنحة برنامج حوافز الدكتوراه من جامعة سيدني، وتمويل البذور UTS، والارشمندرية الكاثوليكية من منحة سيدني لبحوث الخلايا الجذعية للبالغين، ومنحة أبحاث جراحة القلب والصدر في كلية طب سيدني Foudation Cardiothcic.
Acknowledgements
مع الشكر لناتالي جونستون لتسجيل لقطات غير الجراحية وجميع تحرير الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| 3-0 non-absorbable black braided treated silk | Ethicon | 232G | |
| 6-0, 24” (60 cm) Prolene (polypropylene) suture, blue monofilament | Ethicon | 8805H | |
| 7-0, 18” (45 cm) silk black braided | Ethicon | 768G | |
| Adjustable stereo microscope with 6.4x magnification | Olympus | SZ 3060 STU1 | |
| Anitisedan (atipamezole) | Zoetis | N/A | |
| Atropine sulphate 0.6 mg, 1 mL vials, 10 pack | Symbion Pharmacy Services | ATRO S I2 | |
| Bupivacaine, 20 mL, 5 vials | Baxter Heathcare | BUPI I C01 | |
| Temvet (buprenorphine), 300 µg/mL, 10 mL bottle | Troy Laboratories | TEMV I 10 | |
| Curved-tip forceps | Kent Scientific | INS650915-4 | Iris dressing forceps, 10 cm-long curved dressing forceps; 0.8 mm serrated tips; stainless steel. |
| Dissecting scissors for cutting muscle/skin | Kent Scientific | INS600393-G | Dissecting scissors, straight, 10 cm long |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | Including intubation catheter/tube (20 G), fibre-optic light source and dental spatula |
| Fine scissors | Kent Scientific | INS600124 | McPherson-Vannas micro scissors, 8 cm long, straight, 0.1 mm tips, 5 mm blades; stainless steel. |
| Lasix (furosemide) 20 mg, 2 mL, 5 pack | Sigma Company | LASI A 1 | |
| Heat pad for animal recovery post-op | Passwell | PAD | Passwell Cosy Heat Pad for Animals - 26cm x 36cm; 10 Watts; Soft PVC Cover |
| Ketamine 100 mg, 50 mL | CEVA Animal Heath | KETA I 1 | |
| Needle holder | Kent Scientific | INS600137 | Castroviejo needle holder, serrated, 14 cm long, 1.2 mm jaws with lock |
| PhysioSuite with MouseVent G500 automatic ventilator | Kent Scientific | PS-MVG | |
| Puralube Vet Opthalmic Ointment (sterile occular lubricant) | Dechra | 17033-211-38 | |
| Self-retaining toothed mouse retractor | Kent Scientific | INS600240 | ALM serrated self-retaining retractor, 7 cm long |
| Straight forceps | Kent Scientific | INS650908-4 | Super fine dressing forceps, 12.5 cm Long, serrated tips, 0.35 x 0.10 mm; stainless steel. |
| Surgical magnifying glasses | Kent Scientific | SL-001 | |
| VetFlo vaporizer | Kent Scientific | VetFlo-1205S-M | |
| Xylazine 100 mg, 50 mL | Randlab | XYLA I R01 |
References
- Lund, L. H., et al. The registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult heart transplantation report-2017; focus theme: allograft ischemic time. Journal of Heart and Lung Transplantation. 36 (10), 1037-1046 (2017).
- Roche, C. D., Brereton, R. J. L., Ashton, A. W., Jackson, C., Gentile, C. Current challenges in three-dimensional bioprinting heart tissues for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 58 (3), 500-510 (2020).
- Wang, H., Roche, C. D., Gentile, C. Omentum support for cardiac regeneration in ischaemic cardiomyopathy models: a systematic scoping review. European Journal of Cardio-Thoracic Surgery. , ezaa205 (2020).
- Mattapally, S., et al. Spheroids of cardiomyocytes derived from human-induced pluripotent stem cells improve recovery from myocardial injury in mice. American Journal of Physiology-Heart and Circulatory Physiology. 315 (2), 327-339 (2018).
- Gao, L., et al. Large cardiac muscle patches engineered from human induced-pluripotent stem cell-derived cardiac cells improve recovery from myocardial infarction in swine. Circulation. 137 (16), 1712-1730 (2018).
- Yang, B., et al. A net mold-based method of biomaterial-free three-dimensional cardiac tissue creation. Tissue Engineering Methods (Part C). 25 (4), 243-252 (2019).
- Menasché, P., et al. Human embryonic stem cell-derived cardiac progenitors for severe heart failure treatment: first clinical case report. European Heart Journal. 36 (30), 2011-2017 (2015).
- Menasché, P., et al. Transplantation of human embryonic stem cell-derived cardiovascular progenitors for severe ischemic left ventricular dysfunction. Journal of the American College of Cardiology. 71 (4), 429-438 (2018).
- Beyersdorf, F. Three-dimensional bioprinting: new horizon for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 46 (3), 339-341 (2014).
- Noor, N., et al. 3D printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344 (2019).
- Maiullari, F., et al. A multi-cellular 3D bioprinting approach for vascularized heart tissue engineering based on HUVECs and iPSC-derived cardiomyocytes. Scientific Reports. 8 (1), 13532 (2018).
- Zhang, Y. S., et al. Bioprinting 3D microfibrous scaffolds for engineering endothelialized myocardium and heart-on-a-chip. Biomaterials. 110, 45-59 (2016).
- Chachques, J. C., et al. Myocardial assistance by grafting a new bioartificial upgraded myocardium (MAGNUM clinical trial): one year follow-up. Cell Transplant. 16 (9), 927-934 (2007).
- Chachques, J. C., et al. Elastomeric cardiopatch scaffold for myocardial repair and ventricular support. European Journal of Cardio-Thoracic Surgery. 57 (3), 545-555 (2020).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: an improved and simplified model for myocardial infarction. Journal of Visualized Experiments. (122), e55353 (2017).
- van den Borne, S. W. M., et al. Mouse strain determines the outcome of wound healing after myocardial infarction. Cardiovascular Research. 84 (2), 273-282 (2009).
- Noguchi, R., et al. Development of a three-dimensional pre-vascularized scaffold-free contractile cardiac patch for treating heart disease. Journal of Heart and Lung Transplantation. 35 (1), 137-145 (2016).
- Walker, R. L., Eggel, M. From mice to monkeys? Beyond orthodox approaches to the ethics of animal model choice. Animals. 10 (1), 77 (2020).
- Vagnozzi, R. J., et al. An acute immune response underlies the benefit of cardiac stem-cell therapy. Nature. 577, 405-409 (2019).
- Waters, R., et al. Stem cell-inspired secretome-rich injectable hydrogel to repair injured cardiac tissue. Acta Biomaterialia. 69, 95-106 (2018).
- Cossu, G., et al. Lancet Commission: stem cells and regenerative medicine. Lancet. 391 (10123), 883-910 (2018).
- Kawamura, M., et al. Enhanced therapeutic effects of human iPS cell derived-cardiomyocyte by combined cell-sheets with omental flap technique in porcine ischemic cardiomyopathy model. Scientific Reports. 7 (1), 8824 (2017).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kainuma, S., et al. Cell-sheet therapy with omentopexy promotes arteriogenesis and improves coronary circulation physiology in failing heart. Molecular Therapy. 23 (2), 374-386 (2015).
- Suzuki, R., et al. Omentopexy enhances graft function in myocardial cell sheet transplantation. Biochemical and Biophysical Research Communications. 387 (2), 353-359 (2009).
- Zhou, Q., Zhou, J. Y., Zheng, Z., Zhang, H., Hu, S. S. A novel vascularized patch enhances cell survival and modifies ventricular remodeling in a rat myocardial infarction model. Journal of Thoracic and Cardiovascular Surgery. 140 (6), 1388-1396 (2010).
- Lilyanna, S., et al. Cord lining-mesenchymal stem cells graft supplemented with an omental flap induces myocardial revascularization and ameliorates cardiac dysfunction in a rat model of chronic ischemic heart failure. Tissue Engineering (Part A). 19 (11-12), 1303-1315 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Zhang, B., et al. Biodegradable scaffold with built-in vasculature for organ-on-a-chip engineering and direct surgical anastomosis. Nature Materials. 15 (6), 669-678 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved