Method Article
Transplante de um Patch Bioimpresso 3D em um modelo murino de infarto do miocárdio
Neste Artigo
Resumo
Este protocolo visa transplantar um patch bioimpresso 3D no epicárdio de camundongos infartados modelando insuficiência cardíaca. Inclui detalhes sobre anestesia, abertura do tórax cirúrgico, ligadura permanente da artéria coronária descendente anterior esquerda (LAD) e aplicação de um patch bioimpresso na área infarto do coração.
Resumo
Testar propriedades regenerativas de manchas cardíacas bioimpressoras 3D in vivo usando modelos murinos de insuficiência cardíaca via ligadura permanente esquerda anterior (LAD) é um procedimento desafiador e tem uma alta taxa de mortalidade devido à sua natureza. Desenvolvemos um método para transplantar consistentemente manchas bioimpressoras de células e hidrogéis no epicárdio de um coração de rato infartado para testar suas propriedades regenerativas de forma robusta e viável. Primeiro, um rato profundamente anestesiado é cuidadosamente entubado e ventilado. Após a toracotomia lateral esquerda (abertura cirúrgica do peito), o LAD exposto é permanentemente ligado e o patch bioimpresso transplantado no epicárdio. O rato se recupera rapidamente do procedimento após o fechamento do peito. As vantagens dessa abordagem robusta e rápida incluem uma taxa de mortalidade prevista de 28 dias de até 30% (menor do que os 44% relatados por outros estudos usando um modelo semelhante de ligadura lad permanente em camundongos). Além disso, a abordagem descrita neste protocolo é versátil e poderia ser adaptada para testar patches bioimpressos usando diferentes tipos de células ou hidrogéis onde um grande número de animais são necessários para estudar de forma ideal. No geral, apresentamos isso como uma abordagem vantajosa que pode alterar testes pré-clínicos em estudos futuros para o campo da regeneração cardíaca e engenharia tecidual.
Introdução
Um transplante de coração é o tratamento padrão ouro para pacientes com insuficiência cardíaca em estágio terminal, mas há escassez de órgãos doadores. Requer supressão do sistema imunológico para evitar a rejeição do enxerto e a taxa de mortalidade de um ano é de 15% em todo o mundo1. Portanto, há um incentivo de longa data para regenerar o miocárdio em modelos animais pré-clínicos com o objetivo de traduzir para ensaios em humanos2,,3,4,5,,6,7,8,9. Os recentes avanços na bioimpressão 3D de células-tronco ou células-tronco derivadas de células-tronco ganharam atenção como uma abordagem promissora para regenerar o miocárdio2,,3,,9,,10,11,12.
Os primeiros testes de segurança humana que aplicam patches para regenerar o coração foram relatados, com células mononucleares de medula óssea autólogas suspensas em colágeno ou células progenitoras cardíacas derivadas de células-tronco em fibrina, transplantadas para o epicárdio7,,8,,13. No entanto, para um método mais preciso, escalável, automatizado e reprodutível, a bioimpressão 3D de manchas de hidrogel otimizadas a serem aplicadas à superfície epicárida do coração é uma abordagem promissora para regenerar o miocárdio para pacientes que de outra forma precisariam de um transplante de coração2,,10,,11,12.
Antes que a tradução para testes em humanos possa ocorrer, estudos pré-clínicos em animais são necessários. Modelos in vivo pré-clínicos que buscam a regeneração do miocárdio foram relatados em suínos5, ovelhas14, ratos6 e camundongos4. Um modelo comum de infarto do miocárdio (MI) em camundongos utiliza a ligadura permanente da artéria coronária descendente anterior esquerda (LAD)15,16. Entre as diferentes cepas de camundongos utilizados, a ligadura lad permanente em camundongos C57BL6 tem uma taxa de sobrevivência aceitável e normalmente apresenta remodelagem consistente e alterações cardíacas após o MI16. Em modelos de roedores, várias abordagens foram descritas onde o tecido cardíaco foi aplicado ao coração em busca de uma regeneração efetiva do miocárdio danificado4,,6,17. Enquanto animais de grande porte ainda representam um modelo mais clinicamente relevante para testar propriedades regenerativas cardíacas5,14, a versatilidade e viabilidade do modelo do camundongo se presta a essa área de estudo em movimento rápido. Isso pode evitar algumas das armadilhas típicas de grandes estudos em animais, incluindo (mas não se limitando a): 1) alta mortalidade animal (a menos que as artérias coronárias diagonais estejam ligadas levando a infartos segmentais imprevisíveis14, ou a extremidade distal do LAD é ocluída seguida de reperfusão em vez de ligadura permanente5); 2) questões éticas com o dano relativamente aumentado causado por protocolos animais de grande porte em comparação com camundongos18; 3) aumento do custo e/ou questões de viabilidade, por exemplo, a relativa indisponibilidade de equipamentos animais de grande porte, como os scanners de ressonância magnética14. Também é importante considerar que, dada a extensa duração e comprometimento típicos de grandes estudos em animais, eles têm o potencial de se desatualizados antes de serem concluídos, especialmente com os rápidos desenvolvimentos típicos deste campo. Por exemplo, é apenas recentemente que o papel crítico desempenhado por células inflamatórias e mediadores na regulação da regeneração cardíaca emergiu19,20. Além disso, o papel crítico dos estudos pré-clínicos, como pequenos modelos animais, tem sido destacado pela Comissão Lancet como um passo essencial para obter conhecimento robusto antes de passar para testes em humanos21.
Para facilitar o progresso na compreensão de mecanismos e condições de otimização para abordagens de regeneração cardíaca baseadas em patches in vivo, apresentamos uma nova abordagem descrevendo um método de "colher e cortina" para aplicar um patch de hidrogágênio/gelatina bioimpressora 3D à superfície de corações infartados em camundongos C57BL6. O objetivo desta abordagem é fornecer um modelo in vivo versátil para testar patches bioimpressos 3D que provavelmente serão viáveis em amplos contextos de pesquisa para o campo de regeneração cardíaca em rápidaevolução 2. Este método poderia ser adaptado para testar patches gerados por métodos não bioimpressoras, diferentes hidrogéis e células derivadas de células-tronco autólogas ou alergênicas dentro de patches in vivo. No entanto, a consideração detalhada da bioimpressão, hidrogéis ou tipos de células está além do escopo deste estudo, que se concentra no método de transplante cirúrgico.
As vantagens do protocolo incluem que o infarto do miocárdio e a aplicação de um patch bioimpresso são realizados em um procedimento cirúrgico que pode ser realizado rapidamente, com ferramentas de laboratório prontamente disponíveis e econômicas e com uma taxa de mortalidade relativamente baixa. Também normalmente permite um número maior de animais do que modelos animais grandes em um espaço menor, o que permite uma comparação robusta de múltiplos grupos experimentais, particularmente útil para comparação de múltiplos grupos in vivo. Por outro lado, este protocolo tem as desvantagens que: 1) o modelo do camundongo está mais distante do tamanho do coração humano, anatomia e fisiologia do que em grandes modelos animais e não se traduz diretamente em humanos; 2) os ramos murine LAD proximalmente, com variabilidade significativa entre camundongos individuais, o que leva à variabilidade do tamanho do infarto (problema compartilhado com grandes modelos animais); 3) o patch deve ser aplicado sobre toda a superfície cardíaca anterior, o que é menos preciso do que aplicar sobre uma área específica de infarto; e 4) o patch é aplicado imediatamente no momento do MI (para uso humano é provável que seja mais clinicamente útil para desenvolver um patch para aplicação para o coração cronicamente infartado falhando meses após o MI14inicial ).
No entanto, se escolhido adequadamente de acordo com a hipótese que está sendo testada, este protocolo pode fornecer dados in vivo críticos rapidamente, com números n elevados, de forma coerente com os materiais, orçamento e expertise disponíveis na maioria dos laboratórios. Comparado aos grandes modelos animais, é um modelo in vivo que é versátil o suficiente para se adaptar às tecnologias emergentes de bioimpressão 3D (por exemplo, pela relativa facilidade de realizar estudos piloto para testar a viabilidade e a segurança antes de se mudar para modelos animais maiores). Seria adequado para pesquisadores que querem gerar dados in vivo de forma eficiente e barata, talvez executando múltiplas comparações de patches bioimprimidos 3D com diferentes parâmetros de bioimpressão, células ou hidrogéis nas patches. Seria especialmente útil para testar as interações de diferentes misturas de células-tronco e células-tronco derivadas de células-tronco com hidrogéis in vivo sem desperdício excessivo de linhagens celulares caras ou outros materiais que poderiam ocorrer se usar patches de grande escala. O uso de um modelo de camundongo também facilitaria o teste de patches contendo linhagens de células derivadas de camundongos e células-tronco compatíveis com espécies ou células-tronco, onde ratos uniformes com deficiência imunológica específica são desejáveis. Além disso, testes em cepas de camundongos geneticamente modificados poderiam permitir que os pesquisadores isolassem os efeitos de genes específicos em vias de sinalização e em tipos de células específicas relevantes para doenças cardiovasculares, o que atualmente não seria possível em um grande modelo animal.
Protocolo
Todos os procedimentos descritos neste experimento foram aprovados pelo Comitê de Ética Animal no Distrito De Saúde Local de Sydney, NSW, Austrália (número do projeto RESP17/55).
1. Anestesia e intubação
NOTA: Ligue e configure o estereótipo, a almofada de calor (coberta com uma folha absorvente) e o sistema de ventilação.
- Luvas limpas, a área cirúrgica e as ferramentas com 70% de etanol.
- Pesar o mouse para calcular a dosagem de anestesia injetada pela rota intraperitoneal (cetamina 40 mg/kg, xilazina 5 mg/kg, atropina 0,15 mg/kg) e dar a injeção.
- Uma vez que o rato atinge um plano profundo de anestesia, raspe o lado esquerdo ventral do tórax com um aparador.
- Coloque o rato em uma câmara contendo 2% de isoflurane (garantindo ventilação adequada de extração na sala).
NOTA: A dose relativamente baixa de injeção de cetamina/xilazina juntamente com 2% de inalação de isoflurane reduz o risco de morte do rato, permitindo a intubação ideal sem acordar o rato. - Coloque o supino do rato e contenha-o de seus dentes incisivos superiores com uma sutura 3.0 colada no banco, como mostrado no vídeo. Confirme a sedação realizando uma pitada de dedo do dedo do sol. Posicione um iluminador de alta intensidade acima do pescoço do mouse para que a orofaringe possa ser visualizada.
NOTA: Alternativamente, o mouse pode ser colocado no suporte a partir do kit de intubação (por exemplo, Kent Mouse Intubation Kit) com uma faixa elástica presa sob os incisivos superiores para manter a boca aberta para identificar a traqueia. - Use uma espátula curva para abrir a mandíbula e outro par de espátulas/fórceps contundentes para levantar a língua suavemente para fora do caminho. Certifique-se de entubar enquanto estiver posicionado a nível ou ligeiramente abaixo do nível dos olhos com o corpo do mouse.
- Visualize a abertura e o fechamento das cordas vocais. Quando abrir, insira o cateter plástico de 20 G fornecido com o kit de intubação.
- Transfira cuidadosamente o mouse entubado para uma superfície de operação equipada com uma almofada de aquecimento. Conecte o mouse ao ventilador (por exemplo, MouseVent) que define automaticamente o volume alvo com base no peso do mouse.
- Entregar 1,5-2% de isoflurano com oxigênio (que é automaticamente regulado pelo ventilador: certifique-se de que há uma conexão de um cilindro de oxigênio ao ventilador automático a 1-2 L/min de fluxo para o ventilador). Verifique a intubação verificando se há aumento bilateral do tórax. Verifique a anestesia realizando uma pitada do dedo do dedo do sol.
- Aplique pomada opthalmic (por exemplo, Puralube Vet Opthalmic Pomment) em ambos os olhos para evitar que eles sequem.
2. Preparação do campo cirúrgico
- Fixar o tubo de intubação com fita adesiva no local de conexão entre o ventilador e o tubo/cateter respiratório.
- Corte um pedaço mais longo de fita e fixe o pé esquerdo da frente na superfície de operação em uma posição ligeiramente elevada. Também atralam as outras extremidades.
- Limpe o peito com solução de isopropanol e poviona de 70% e povidone, limpando em um movimento circular movendo-se do centro para a periferia.
- Verifique a anestesia mais uma vez com uma pitada de dedo do dedo do sol.
- Administre 0,08 mg/kg Temvet (buprenorfina) em 0,1 mL de soro fisiológico de 0,9% por injeção subcutânea.
3. Toracotomia lateral esquerda
- Use fórceps finos para levantar suavemente a pele em um ponto aproximadamente 5 mm à esquerda da cartilagem xifoide proeminente. Use uma tesoura cirúrgica para criar uma incisão superromedial na pele a partir deste ponto para cima e para a linha média, para o nível do manúbrio.
- Use fórceps curvos para separar suavemente as camadas de pele e músculo. Abra a camada muscular, seguindo a incisão da pele.
- Identifique e faça uma incisão no terceiro espaço intercostal, seguindo o ângulo natural da caixa torácica.
- Use um retrátil para espalhar suavemente as 3ª e 4ª costelas.
- Remova suavemente o pericárdio fino com fórceps.
- Se o LAD não for visualizado, empurre suavemente a aurícula esquerda (ver Figura Suplementar 1) para cima e localize as artérias coronárias por baixo.
4. Esquerda anterior descendente (LAD) ligadura permanente da artéria coronária
- Corte uma sutura de seda de ~3 mm de comprimento 3-0 e coloque esta peça de sutura de seda reforçada 3-0 em cima do LAD na mesma direção que o LAD (como mostrado no vídeo no ponto de tempo 02:12 – 02:20).
- Identifique o LAD e passe uma sutura de seda 7-0 sob o LAD. Se o LAD não for claramente visualizado, insira a agulha 1 mm inferior e medial até o ponto inferior alcançado pela ponta da aurícula esquerda durante o movimento dinâmico do coração.
NOTA: Esta estrutura é uma cor mais clara vermelha para as câmaras ventriculares do coração, mas mais escura que o pulmão adjacente e é melhor visualizada no vídeo no ponto de tempo 01:54 – 01:55 onde é visível apenas inferior ao braço superior do retrátil, superior ao pulmão esquerdo (ver Figura Suplementar 1 para imagem ainda anotada de vídeo). - Complete dois lances com a sutura de seda 7-0 e feche-a firmemente passando em cima da sutura de seda de apoio 3-0 para garantir o LAD. Se a ligadura for bem sucedida, a área ventricular anterior distal da ligadura ficará branquear.
- Complete o nó com um terceiro arremesso na direção oposta para fixá-lo, garantindo que nenhuma força de tração ascendente seja transmitida à sutura. Lances adicionais não são necessários para reduzir o risco de danos ao miocárdio ou LAD por corte de sutura.
5. Transplante do patch bioimpresso no epicárdio
- Mova cuidadosamente o patch bioimpresso de uma placa de seis poços para a área de infarto usando a superfície interna estéril de um pacote de bisturi cirúrgico aberto.
- Posicione cuidadosamente o patch bioimpresso na superfície epicardial anterior, onde deve cobrir toda a superfície e cobrir as bordas inferiores e laterais, cobrindo o ventrículo esquerdo e a zona de infarto (área branca).
- Feche suavemente e remova o retrátil sem direcionar bordas afiadas para o coração.
- Use suturas de prolene 6-0 em um padrão simples interrompido para fechar a caixa torácica e as camadas musculares.
- Com a função de respiração suspiro enquanto fecha o peito com as suturas de prolene 6-0, infle os pulmões para remover o excesso de ar na cavidade pleural, que de outra forma ficaria preso na cavidade torácica e resultaria em um pneumotórax.
- Certifique-se de que o peito está bem selado.
- Diminuir o isoflurane para 1,0%. Feche a pele com suturas de prolene 6-0 em um padrão simples interrompido. Desligue o vaporizador isoflurane.
6. Recuperação do rato
- Aplique topicamente 2 mg/mL bupivacaína em 0,9% salina à incisão. Administrar também: i) Antisedan (atipamezole) 1 mg/kg; ii) Lasix (furosemida) 8 mg/kg; iii) 600 μL de solução salina de 0,9% através de uma injeção subcutânea.
NOTA: Antisedan é reverter o anestésico mais rapidamente; furosemida é descarregar o excesso de fluido devido ao comprometimento da produção cardíaca e fluido adicional administrado com injeções de drogas. - Monitore o mouse e espere até que a respiração independente seja observada para remover o rato do tubo de intubação.
- Quando o camundongo demonstrar uma taxa de respiração bilateral adequada e profundidade e responder a uma pitada de dedo do pé, coloque o mouse em uma gaiola de recuperação limpa colocada em uma almofada de calor.
- Forneça ao rato alimentos úmidos (umedecidos para mastigabilidade), uma garrafa de água e gel de nutrientes/hidratantes. Monitore para um esforço respiratório exagerado, sangramento excessivo ou outras complicações potencialmente fatais.
- Nos próximos três dias, administre 0,08 mg/kg Temvet (buprenorfina) em 0,1 mL de soro fisiológico de 0,9% por injeção subcutânea ou intraperitoneal, duas vezes por dia, depois uma vez diária até o quinto dia após o procedimento.
- Casa ratos em pares separados por divisores de gaiola para evitar o isolamento, evitando comportamentos de combate. Monitore os camundongos pelo menos diariamente até o final dos experimentos (28 dias) com muita atenção ao seu bem-estar e maior frequência de monitoramento se houver alguma preocupação.
Resultados
No transplante, a viscosidade do patch à temperatura ambiente (sem a aplicação de crosslinker adicional) permitiu que ele 'drape' sobre os contornos do coração(Figura 1) e se movesse dinamicamente com o ciclo cardíaco. Após a cirurgia, deixamos as manchas por 28 dias in vivo, pois estudos descobriram que este é um período de tempo adequado permitindo efeitos de patch na função cardíaca hospedeira3,4 (embora tenha sido relatado que os efeitos funcionais completos podem não ser vistos até três meses após o transplante)22. A fotografia de um patch mostrado in situ em um coração de rato na Figura 1 foi tirada imediatamente após a aplicação, mostrando a capacidade do patch de cobrir o coração no transplante. Este resultado representativo mostra que o hidrogel permite que o patch molde para os contornos do coração e onde ocorreu tensão excessiva o hidrogel foi capaz de dividir como mostrado pela área triangular nua (livre de hidrogel) na Figura 1 (indicada por uma estrela negra na imagem). Os dados de sobrevivência (curvas de sobrevivência de Kaplan-Meier) são mostrados na Figura 2 em comparação com os camundongos submetidos a um procedimento falso (passagem de uma agulha e sutura sob o LAD sem ligadura seguida de fechamento do peito do rato).
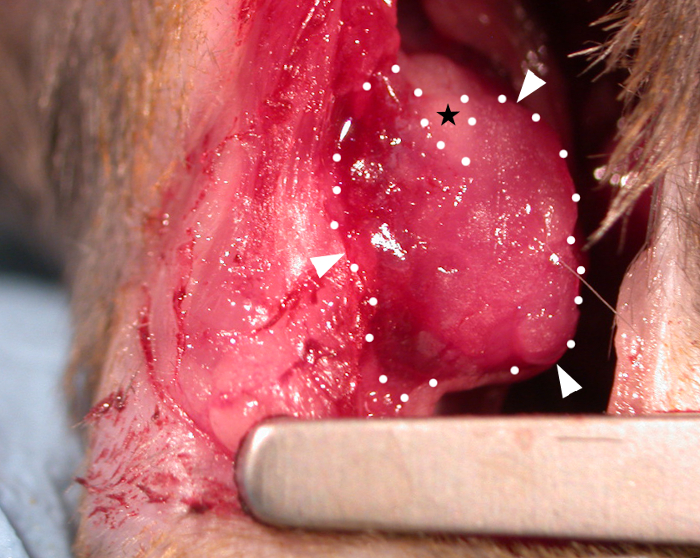
Figura 1: Um patch cardíaco bioimpresso aplicado no epicárdio de um coração de rato C57BL6. Um patch bioimpresso de 10 mm x 10 mm x 0,4 mm (imediatamente após o transplante) contendo hidrogel (alginato 4% (w/v)/gelatina 8% (w/v) na mídia) é mostrado sobre a área infartada e aderindo à superfície epicárida (pontas de flecha branca e linhas pontilhadas = borda do patch). A viscosidade do patch permite que ele molde para os contornos do coração e onde a tensão excessiva ocorreu no aspecto superior o patch se dividiu para fazer uma área nua triangular não coberta por hidrogel (estrela negra). Clique aqui para ver uma versão maior desta figura.
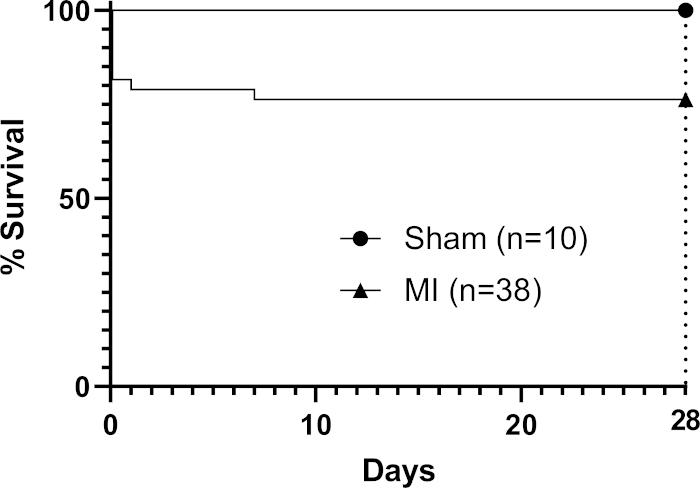
Figura 2: Análise de sobrevivência de Kaplan-Meier durante 28 dias após a MI. Nove camundongos do grupo processual morreram (n=38) para dar uma taxa global de mortalidade de 24%. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Imagem parada do vídeo (ponto de vídeo 01:54 – 01:55) mostrando o aurículo esquerdo (apêndice atrial esquerdo). A seta aponta para a ponta inferomedial da aurícula esquerda que é visível como uma estrutura triangular na borda superior esquerda do coração. Caso o LAD não seja claramente visualizado, a ponta do aurículo esquerdo pode ser usada como um marco para a entrada de agulha para passar uma sutura sob o LAD. O ponto de entrada é 1 mm inferior e medial ao ponto inferior que a ponta da aurícula esquerda atinge durante movimentos dinâmicos do coração (a seta preta mostra ponta inferomedial do auricle esquerdo). Clique aqui para baixar este número.
Discussão
O método facilita o operador a transplantar eficientemente um patch bioimpresso, aplicando-o à superfície epicárida de um coração de rato infartado após a ligadura lad permanente. Neste método focado em viabilidade, podemos realizar este procedimento em oito ratos por dia de trabalho (incluindo a preparação da sala antes e depois). Uma corrida de bioimpressão produzindo oito patches de 1 cm2 em poços de placas de seis poços leva de 2-3 horas (incluindo o tempo de preparação antes e depois). Usamos o interior estéril de um pacote de bisturi cirúrgico como colher para o nosso patch, que é facilmente acessível e geralmente adiciona um custo mínimo, utilizando as propriedades adesivas naturais do patch de hidrogel de alginato/gelatina para cobrir o patch através da superfície infartada anterior do coração. Em nossa experiência, o protocolo de ligadura LAD em camundongos é dependente de operadores e uma menor taxa de mortalidade em 28 dias pode ser alcançada com operadores experientes especializados em um modelo. Van den Borne et al.16 relataram que os camundongos C57BL6 apresentam uma mortalidade de 44% após a ligadura de LAD permanente em 28 dias sem a aplicação de um patch, que é superior ao limite superior de 30% que observamos com o método.
O passo da intubação é crítico e em si pode ser uma fonte de mortalidade para camundongos, a menos que seja realizado por um operador qualificado. Isso é dificultado devido ao tamanho minúsculo da traqueia, razão pela qual as lupas são usadas pelo operador para esta etapa. Usamos cetamina/xilazina injetada, bem como isofluorano inalado para indução de anestésico para que o rato seja profundamente anestesiado em doses relativamente baixas de cada droga. Portanto, não há risco para o camundongo acordar durante esta etapa de intubação, mas a alta mortalidade associada a altas doses de um único medicamento é evitada. A atropina também foi dada para neutralizar efeitos colaterais como bradicardia e hipersalivação. O uso de um holofote aplicado na garganta externamente ilumina a traqueia internamente para que ela seja mais visível e as cordas vocais devem ser visualizadas abrindo e fechando com a taxa respiratória do mouse (geralmente ~120 respirações por minuto). É fundamental posicionar o mouse perfeitamente (e é por isso que uma superfície dura é preferida em vez de um tapete de aquecimento sob o mouse para esta etapa) com os dois dentes incisivos segurados por um fio em loop e a língua retraída extremamente suavemente com punhestumbas/par de espátulas para abrir a boca e visualizar a traqueia. Uma vez concluída a intubação, o operador deve ter cuidado para não desalojar o tubo na transferência da área de intubação para o leito de operação (que tem um tapete de calor por baixo para evitar hipotermia). Ao conectar o tubo de respiração ao aparelho do ventilador, é fundamental estabilizar o tubo com uma mão e conectar o circuito do ventilador com a outra, de modo que haja um movimento mínimo do tubo de respiração, como empurrá-lo mais profundamente para dentro da traqueia ao conectar o segmento do ventilador da tubulação.
Neste estudo, utilizou-se alginato 4% (w/v)/gelatina 8% (w/v) no Médio Águia Modificada (DMEM) de Dulbecco. Os hidrogéis de alginato/gelatina são conhecidos por sua biocompatibilidade, baixo custo e propriedades biomecânicas, tornando-os úteis para estratégias de engenharia de tecidos 3D23. Estes hidrogéis podem ser cruzados por gelação leve adicionando íons de cálcio, o que permite que a viscosidade seja alterada. Após a bioimpressão, aplicamos cloreto de cálcio (CaCl2) 2% (w/v) em soro fisiológico tamponado de fosfato (PBS) em patches e depois os cultuamos em DMEM em seis placas de poço por 7-14 dias antes de transplantá-los. Esta foi a janela ideal depois que manchas contendo células cardíacas começaram a bater na cultura, mas antes das manchas começarem a se desintegrar. Embora o CaCl2 pudesse ser adicionado regularmente durante toda a fase pós-bioimpressão para reduzir a desintegração do patch, descobrimos que a viscosidade intrínseca do hidrogel era suficiente para que as manchas mantivessem sua estrutura até o transplante com apenas uma dose inicial de CaCl2.
O método permitiu o transplante bem-sucedido sem suturas (que podem danificar o coração) ou cola (que pode bloquear a interface entre o patch e o coração). Estudos futuros podem confirmar a hipótese de que o transplante sem sutura e sem cola não afeta negativamente o enxerto em camundongos, pois é fundamental que o patch não escorregue do coração ou interfira nos pulmões. Outros estudos que avaliam o enxerto de manchas em modelos permanentes de ligadura LAD com reparo à base de remendo3 mediram área engrafada (mm2) permanecendo com o tempo24, a espessura do patch enxertado (μm) reminando com o tempo25, quantificação de transplantado células por reação em cadeia de polimerase (PCR)26 ou fluxo de emissão de fótons de bioluminescência de células doadoras vivas rotuladas (uma medida de fótons emitidos por segundo que podem quantificar células enxertadas rotuladas sobrevivendo em animais vivos ao longo do tempo)27. Estudos futuros podem usar esses métodos para avaliar se o transplante sem sutura e sem cola afeta o enxerto de patch (bem como efeitos estruturais e funcionais no miocárdio hospedeiro). No entanto, macroscopicamente após 28 dias in vivo em nossos camundongos imunocompetuntes, o mediastino anterior apresentou material fibrinous variável e aderências. O mecanismo de regeneração cardíaca baseada em patches pode ser da estimulação de respostas inflamatórias do macrófago hospedeiro19 ou fatores imunológicos secretos20 em vez de reposição celular numérica. Se a inflamação desempenha um papel positivo, a presença de material hidrogel estrangeiro pode ser benéfica. Alternativamente, para reduzir a presença de material estranho pode ser benéfico se o componente hidrogel se desintegrar ao longo do tempo. Na verdade, algumas abordagens usam biomateriais que suportam células inicialmente e depois se desintegram, restando apenas tecido28,29. Estudos futuros para analisar completamente o enxerto de patches e entender melhor os mecanismos por trás da regeneração cardíaca baseada em patches podem levar a projetos experimentais otimizados antes da tradução para testes em humanos2.
No geral, este protocolo provavelmente será amplamente viável e também adequado para testar vários grupos de patches bioimpressas 3D, por exemplo, com diferentes conteúdos celulares. As direções futuras para este método incluem a bioimpressão de patches contendo hidrogéis avançados não testados anteriormente in vivo ou testando os efeitos de diferentes células-tronco autólogas ou alusias, para otimização antes de prosseguir para grandes modelos animais.
Divulgações
Nenhum.
DECLARAÇÃO DE FINANCIAMENTO:
Christopher D. Roche foi apoiado por uma Bolsa de Estudos Sir John Loewenthal 2019 (Universidade de Sydney), o Le Gros Legacy Fund New Zealand (PhD012019) e uma Bolsa de Doutorado da Heart Research Australia (2019-02). Carmine Gentile foi apoiado por uma Bolsa de Incentivo à Universidade de Sydney Kick-Start, Bolsa do Programa de Incentivo ao Doutorado da Universidade de Sydney, FINANCIAMENTO DE SEMENTES DA UTS, Arquidiocese Católica de Sydney Grant para Pesquisa de Células-Tronco Adultas e uma Bolsa de Pesquisa de Cirurgia Cardiotorácica da Escola de Medicina de Sydney.
Agradecimentos
Com agradecimentos a Natalie Johnston pela gravação das imagens não cirúrgicas e todas as ediçãos de vídeo.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-0 non-absorbable black braided treated silk | Ethicon | 232G | |
| 6-0, 24” (60 cm) Prolene (polypropylene) suture, blue monofilament | Ethicon | 8805H | |
| 7-0, 18” (45 cm) silk black braided | Ethicon | 768G | |
| Adjustable stereo microscope with 6.4x magnification | Olympus | SZ 3060 STU1 | |
| Anitisedan (atipamezole) | Zoetis | N/A | |
| Atropine sulphate 0.6 mg, 1 mL vials, 10 pack | Symbion Pharmacy Services | ATRO S I2 | |
| Bupivacaine, 20 mL, 5 vials | Baxter Heathcare | BUPI I C01 | |
| Temvet (buprenorphine), 300 µg/mL, 10 mL bottle | Troy Laboratories | TEMV I 10 | |
| Curved-tip forceps | Kent Scientific | INS650915-4 | Iris dressing forceps, 10 cm-long curved dressing forceps; 0.8 mm serrated tips; stainless steel. |
| Dissecting scissors for cutting muscle/skin | Kent Scientific | INS600393-G | Dissecting scissors, straight, 10 cm long |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | Including intubation catheter/tube (20 G), fibre-optic light source and dental spatula |
| Fine scissors | Kent Scientific | INS600124 | McPherson-Vannas micro scissors, 8 cm long, straight, 0.1 mm tips, 5 mm blades; stainless steel. |
| Lasix (furosemide) 20 mg, 2 mL, 5 pack | Sigma Company | LASI A 1 | |
| Heat pad for animal recovery post-op | Passwell | PAD | Passwell Cosy Heat Pad for Animals - 26cm x 36cm; 10 Watts; Soft PVC Cover |
| Ketamine 100 mg, 50 mL | CEVA Animal Heath | KETA I 1 | |
| Needle holder | Kent Scientific | INS600137 | Castroviejo needle holder, serrated, 14 cm long, 1.2 mm jaws with lock |
| PhysioSuite with MouseVent G500 automatic ventilator | Kent Scientific | PS-MVG | |
| Puralube Vet Opthalmic Ointment (sterile occular lubricant) | Dechra | 17033-211-38 | |
| Self-retaining toothed mouse retractor | Kent Scientific | INS600240 | ALM serrated self-retaining retractor, 7 cm long |
| Straight forceps | Kent Scientific | INS650908-4 | Super fine dressing forceps, 12.5 cm Long, serrated tips, 0.35 x 0.10 mm; stainless steel. |
| Surgical magnifying glasses | Kent Scientific | SL-001 | |
| VetFlo vaporizer | Kent Scientific | VetFlo-1205S-M | |
| Xylazine 100 mg, 50 mL | Randlab | XYLA I R01 |
Referências
- Lund, L. H., et al. The registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult heart transplantation report-2017; focus theme: allograft ischemic time. Journal of Heart and Lung Transplantation. 36 (10), 1037-1046 (2017).
- Roche, C. D., Brereton, R. J. L., Ashton, A. W., Jackson, C., Gentile, C. Current challenges in three-dimensional bioprinting heart tissues for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 58 (3), 500-510 (2020).
- Wang, H., Roche, C. D., Gentile, C. Omentum support for cardiac regeneration in ischaemic cardiomyopathy models: a systematic scoping review. European Journal of Cardio-Thoracic Surgery. , ezaa205 (2020).
- Mattapally, S., et al. Spheroids of cardiomyocytes derived from human-induced pluripotent stem cells improve recovery from myocardial injury in mice. American Journal of Physiology-Heart and Circulatory Physiology. 315 (2), 327-339 (2018).
- Gao, L., et al. Large cardiac muscle patches engineered from human induced-pluripotent stem cell-derived cardiac cells improve recovery from myocardial infarction in swine. Circulation. 137 (16), 1712-1730 (2018).
- Yang, B., et al. A net mold-based method of biomaterial-free three-dimensional cardiac tissue creation. Tissue Engineering Methods (Part C). 25 (4), 243-252 (2019).
- Menasché, P., et al. Human embryonic stem cell-derived cardiac progenitors for severe heart failure treatment: first clinical case report. European Heart Journal. 36 (30), 2011-2017 (2015).
- Menasché, P., et al. Transplantation of human embryonic stem cell-derived cardiovascular progenitors for severe ischemic left ventricular dysfunction. Journal of the American College of Cardiology. 71 (4), 429-438 (2018).
- Beyersdorf, F. Three-dimensional bioprinting: new horizon for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 46 (3), 339-341 (2014).
- Noor, N., et al. 3D printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344 (2019).
- Maiullari, F., et al. A multi-cellular 3D bioprinting approach for vascularized heart tissue engineering based on HUVECs and iPSC-derived cardiomyocytes. Scientific Reports. 8 (1), 13532 (2018).
- Zhang, Y. S., et al. Bioprinting 3D microfibrous scaffolds for engineering endothelialized myocardium and heart-on-a-chip. Biomaterials. 110, 45-59 (2016).
- Chachques, J. C., et al. Myocardial assistance by grafting a new bioartificial upgraded myocardium (MAGNUM clinical trial): one year follow-up. Cell Transplant. 16 (9), 927-934 (2007).
- Chachques, J. C., et al. Elastomeric cardiopatch scaffold for myocardial repair and ventricular support. European Journal of Cardio-Thoracic Surgery. 57 (3), 545-555 (2020).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: an improved and simplified model for myocardial infarction. Journal of Visualized Experiments. (122), e55353 (2017).
- van den Borne, S. W. M., et al. Mouse strain determines the outcome of wound healing after myocardial infarction. Cardiovascular Research. 84 (2), 273-282 (2009).
- Noguchi, R., et al. Development of a three-dimensional pre-vascularized scaffold-free contractile cardiac patch for treating heart disease. Journal of Heart and Lung Transplantation. 35 (1), 137-145 (2016).
- Walker, R. L., Eggel, M. From mice to monkeys? Beyond orthodox approaches to the ethics of animal model choice. Animals. 10 (1), 77 (2020).
- Vagnozzi, R. J., et al. An acute immune response underlies the benefit of cardiac stem-cell therapy. Nature. 577, 405-409 (2019).
- Waters, R., et al. Stem cell-inspired secretome-rich injectable hydrogel to repair injured cardiac tissue. Acta Biomaterialia. 69, 95-106 (2018).
- Cossu, G., et al. Lancet Commission: stem cells and regenerative medicine. Lancet. 391 (10123), 883-910 (2018).
- Kawamura, M., et al. Enhanced therapeutic effects of human iPS cell derived-cardiomyocyte by combined cell-sheets with omental flap technique in porcine ischemic cardiomyopathy model. Scientific Reports. 7 (1), 8824 (2017).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kainuma, S., et al. Cell-sheet therapy with omentopexy promotes arteriogenesis and improves coronary circulation physiology in failing heart. Molecular Therapy. 23 (2), 374-386 (2015).
- Suzuki, R., et al. Omentopexy enhances graft function in myocardial cell sheet transplantation. Biochemical and Biophysical Research Communications. 387 (2), 353-359 (2009).
- Zhou, Q., Zhou, J. Y., Zheng, Z., Zhang, H., Hu, S. S. A novel vascularized patch enhances cell survival and modifies ventricular remodeling in a rat myocardial infarction model. Journal of Thoracic and Cardiovascular Surgery. 140 (6), 1388-1396 (2010).
- Lilyanna, S., et al. Cord lining-mesenchymal stem cells graft supplemented with an omental flap induces myocardial revascularization and ameliorates cardiac dysfunction in a rat model of chronic ischemic heart failure. Tissue Engineering (Part A). 19 (11-12), 1303-1315 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Zhang, B., et al. Biodegradable scaffold with built-in vasculature for organ-on-a-chip engineering and direct surgical anastomosis. Nature Materials. 15 (6), 669-678 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados