Method Article
心筋梗塞のマウスモデルにおける3次元バイオプリントパッチの移植
要約
このプロトコルは、心不全をモデル化する梗塞マウスの心外膜に3Dバイオプリントパッチを移植することを目的としている。麻酔、手術胸部開口部、左前下降(LAD)冠動脈の永久結紮、心臓の梗塞領域へのバイオプリントパッチの適用に関する詳細が含まれています。
要約
永久的な左前下降(LAD)結紮を介した心不全のマウスモデルを使用して生体内で3Dバイオプリント心臓パッチの再生特性をテストすることは困難な手順であり、その性質上高い死亡率を有する。我々は、細胞およびヒドロゲルのバイオプリントパッチを梗塞マウス心臓の心外膜に一貫して移植し、その再生特性を堅牢かつ実現可能な方法で試験する方法を開発した。まず、深く麻酔されたマウスは慎重に挿管され、換気される。左横胸部切開術(胸部の外科的開口)に続いて、露出したLADは永久に結紮され、バイオプリントパッチは心外膜に移植される。マウスは胸部閉鎖後の処置からすぐに回復する。この堅牢かつ迅速なアプローチの利点は、最大30%の予測28日間の死亡率(マウスにおける恒久的なLADライゲーションの同様のモデルを使用して他の研究によって報告された44%よりも低い)を含む。さらに、このプロトコルに記載されているアプローチは汎用性が高く、最適なパワー研究のために多くの動物が必要な異なる細胞タイプまたはヒドロゲルを使用してバイオプリントパッチをテストするために適応することができます。全体として、心臓再生および組織工学の分野における将来の研究において前臨床試験を変える可能性のある有利なアプローチとしてこれを提示する。
概要
心臓移植は、末期心不全患者に対するゴールドスタンダード治療であるが、ドナー臓器が不足している。移植片拒絶反応を予防するために免疫系の抑制が必要であり、1年間の死亡率は15%1の世界1.したがって、ヒト試験,,7,,,2、3、4、5、7、8、93,への翻訳を視野に入れて、前臨床動物モデルの2心筋を再生する長年のインセンティブがある。45689近年の幹細胞や幹細胞由来心臓細胞の3Dバイオプリンティングの進歩は、心筋,,22、3、9、10、11、123,9,を再生する有望なアプローチとして注目を集めている。101112
心臓を再生するためにパッチを適用する最初のヒト安全試験が報告されているが、自家骨髄単核細胞をコラーゲンまたは胚性幹細胞由来心臓前駆細胞に懸濁して、心外膜77、8、138,13に移植した。しかし、より正確でスケーラブルで、自律的で再現可能な方法では、心臓の外心表面に適用される最適化されたヒドロゲルパッチの3Dバイオプリンティングは、心臓,移植2、10、11、1210を必要とする患者に対して心筋を再生するための有望2なアプローチである。,1112
ヒト試験への翻訳が起こる前に、前臨床試験が必要です。心筋の再生を追求する前臨床インビボモデルは、ブタ5、ヒツジ14、ラット6およびマウス4で報告されている。マウスにおける心筋梗塞(MI)の一般的なモデルは、左前方降下(LAD)冠動脈15,16,の永久結紮を使用する。使用されるマウスの異なる株の中で、C57BL6マウスにおける恒久的なLADライゲーションは、許容可能な生存率を有し、典型的にはMI16後に一貫したリモデリングおよび心臓変化を提示する。げっ歯類モデルでは、心臓組織が心臓に適用されたいくつかのアプローチが、損傷した心筋44、6、176,17の効果的な再生を追求して行われている。大型動物は、心臓回生特性55、1414をテストするためのより臨床的に関連するモデルを依然として表していますが、マウスモデルの汎用性と実現可能性は、この動きの速い研究領域に適しています。これは、大規模な動物研究の典型的な落とし穴のいくつかを避ける可能性があります: 1) 高い動物死亡率 (斜め冠動脈が結紮されない限り、予測不可能な節性梗塞につながる 14),またはLADの遠位端は永久的な結紮の代わりに再灌流が続く;2)マウス18と比較して、大きな動物のプロトコルによって引き起こされる比較的増加した害との倫理的問題;3)コストの増加および/または実現可能性の問題、例えばMRIスキャナ14などの大型動物機器の相対的な利用不能。また、大規模な動物研究の典型的な広範な期間とコミットメントを考えると、特にこの分野の典型的な急速な発展で、それらが終わる前に時代遅れになる可能性があることを考慮することも重要です。例えば、心臓再生を調節する上で炎症性細胞およびメディエーターが果たす重要な役割が19,20,20に出現したのはごく最近のものである。さらに、小動物モデルのような前臨床試験の重要な役割は、人間の試験21に移行する前に堅牢な知識を得るための不可欠なステップとしてランセット委員会によって強調されている。
生体内でのパッチベースの心臓再生アプローチのメカニズムの理解と条件の最適化を促進するために、C57BL6マウスの梗塞した心臓の表面に3Dバイオプリントアルギン酸/ゼラチンハイドロゲルパッチを適用する「スクープとドレープ」法を説明する新しいアプローチを提示する。このアプローチの目的は、心臓再生2の急速に進化する分野の広範な研究コンテキストで実現可能である可能性が高い3Dバイオプリントパッチをテストするための汎用性の高いin vivoモデルを提供することである。この方法は、生体内のパッチ内の非バイオプリンティング法、異なるヒドロゲルおよび自己または同種幹細胞由来細胞によって生成されたパッチを試験するために適合させることができる。しかし、バイオプリンティング、ヒドロゲルまたは細胞タイプの詳細な検討は、外科的移植方法に焦点を当てたこの研究の範囲を超えている。
このプロトコルの利点は、心筋梗塞とバイオプリントパッチの適用が、容易に入手可能で費用対効果の高い実験室用具と比較的低い死亡率で、迅速に行うことができる1つの外科的処置で行われることである。また、通常、より小さな空間で大型動物モデルよりも多くの動物を使用することができ、複数の実験群の堅牢な比較が可能であり、特に生体内での複数のグループ比較に有用である。一方、このプロトコルには、マウスモデルが大型動物モデルよりも人間の心臓サイズ、解剖学、生理学から遠く離れていて、人間に直接翻訳されないという欠点があります。2)マウスLADは、個々のマウス間に有意な変動性を有する近位的に分岐し、梗塞サイズ変動(大きな動物モデルと共有する問題)につながる。3)パッチは、特定の梗塞領域上に適用するよりも正確ではない、心前の表面全体に適用する必要があります。4)パッチはMIの時点で直ちに適用される(ヒトの使用のために、最初のMI14の後の慢性梗塞の失敗した心臓に適用するためのパッチを開発するためにより臨床的に有用である可能性が高い)。
それにもかかわらず、試験されている仮説に従って適切に選択された場合、このプロトコルは、ほとんどの研究室で利用可能な材料、予算、専門知識と一致する方法で、高いn数で、迅速に重要なin vivoデータを提供することができます。大型動物モデルと比較すると、新しい3Dバイオプリンティング技術に適応するのに十分な汎用性を備えたin vivoモデルです(例えば、より大きな動物モデルに移行する前に実現可能性と安全性をテストするためのパイロット研究を行う比較的容易です)。インビボデータを効率的かつ安価に生成したい研究者に適しており、おそらくパッチ内の異なるバイオプリンティングパラメータ、細胞またはヒドロゲルを持つ3Dバイオプリントパッチの複数の比較を実行します。これは、大規模なパッチを使用する場合に発生する可能性のある高価な細胞系統や他の材料の余分な浪費なしに、生体内のヒドロゲルと幹細胞および幹細胞由来細胞の異なる混合物の相互作用をテストするのに特に有用であろう。マウスモデルを使用すると、種相性マウス由来細胞および幹細胞系統またはヒト由来細胞を含むパッチの検査を容易にし、特異的な免疫不全を有する均一マウスが望ましい。さらに、遺伝子組み換えマウス株の検査は、研究者がシグナル伝達経路および心血管疾患に関連する特定の細胞型に対する特定の遺伝子の影響を単離することを可能にする可能性があり、これは現在、大規模な動物モデルでは不可能である。
プロトコル
この実験に記載されているすべての手順は、オーストラリアのニューサウスウェールズ州ノーザンシドニー地方保健地区の動物倫理委員会によって承認されました(プロジェクト番号RESP17/55)。
1. 麻酔と挿管
メモ:ステレオ顕微鏡、ヒートパッド(吸収シートで覆われている)、および人工呼吸器システムをオンにして設定します。
- 清潔な手袋、外科領域、および70%エタノールの用具。
- マウスの重量を量って腹腔内経路(ケタミン40mg/kg、キシラジン5mg/kg、アトロピン0.15mg/kg)によって注入された麻酔の投与量を計算し、注射を与える。
- マウスが麻酔の深い平面に達したら、胸郭の腹側をトリマーで剃ります。
- 2%のイオブルラン(部屋の適切な抽出換気を確保する)を含むチャンバーにマウスを置きます。
注:ケタミン/キシラジン注射の比較的低用量は、2%イゾフルラン吸入と一緒にマウスを目覚めさせることなく最適な挿管を可能にしながら、マウスの死のリスクを低減します。 - ビデオに示すように、マウスの上の縫合を置き、ベンチに3.0縫合糸をテーピングして上切歯の歯から拘束します。つま先ピンチを実行してセドレーションを確認します。マウスの首の上に高輝度のイルミエータを配置して、中咽頭を視覚化できるようにします。
注:またはマウスは、口を開けて気管を識別するために口を開いたままにする上部の切開器の下に固定された伸管式キット(例えば、ケントマウス挿管キット)からスタンドに置くことができます。 - 湾曲したへらを使用して顎を開き、別のスパチュラ/鈍い鉗子を使用して舌をそっと持ち上げます。マウスの本体で目の高さ以下に配置されている間は、必ず挿管してください。
- 声帯の開閉を可視化します。開いた時、挿管キットに付属の20Gプラスチックカテーテルを挿入します。
- 挿管されたマウスを、ヒーティングパッドを備えた操作面に慎重に移します。マウスのウェイトに基づいてターゲットボリュームを自動的に設定する人工呼吸器(例えば、MouseVent)にマウスを接続します。
- 酸素で1.5-2%のイオブルランを送達します(人工呼吸器によって自動的に調節されます:酸素ボンベから1-2 L/分の流量で人工呼吸器と人工呼吸器への接続があることを確認してください)。両側の胸の上昇をチェックして挿管を確認します。つま先ピンチを行って麻酔を確認します。
- 眼軟膏(例えば、Puralube Vet Opthalmic軟膏)を両眼に塗布し、乾燥を防ぎます。
2. 手術場の準備
- 換気装置と呼吸管/カテーテルの間の接続場所でテープで挿管チューブを固定します。
- テープを長く切り、左前足をわずかに高い位置に押し込みます。また、他の四肢をテープダウンします。
- 滅菌70%イソプロパノールとポビドネヨウ素溶液で胸部をきれいにし、中心から周辺に移動する円形の動きで洗浄します。
- つま先ピンチでもう一度麻酔を確認してください。
- 0.1 mL の 0.9% 生理食道下注射で 0.08 mg/kg テンベット (ブプレノルフィン) を投与します。
3. 左横回しの回膜術
- 細かい先端の鉗子を使用して、顕著なxiphoid軟骨の左側に約5mmの点で皮膚を穏やかに持ち上げます。手術用はさみを使用して、この点から上向きに、そして正中線に向かって、マニュバリウムのレベルまで皮膚に超眼心切開を作成します。
- 湾曲した鉗子を使用して、皮膚と筋肉の層を穏やかに分離します。皮膚切開に続いて、筋肉層を開きます。
- 胸部の自然な角度に従って、第3肋間空間で切開を識別し、行う。
- レトラクターを使用して、3番目と4番目の肋骨をそっと広げます。
- 薄い心膜を鉗子でそっと取り除きます。
- LADが可視化されていない場合は、左耳の大小を軽く押し上げ( 補足図1を参照)、下の冠状動脈を見つけます。
4. 左前前降下(LAD)永久的冠動脈結紮
- 長さ〜3 mm の 3-0 シルク縫合糸をカットし、この補強 3-0 シルク縫合糸片を LAD と同じ方向に LAD の上に置きます (時間ポイント 02:12 ~ 02:20 のビデオに示すように)。
- LAD を識別し、LAD の下で 7-0 シルク縫合糸を渡します。LADが明確に視覚化されていない場合は、針1mmの劣り、内側を心臓の動的な動きの間に左大介の先端が到達した最も下の点に挿入します。
注:この構造は、心臓の心室に明るい色の赤ですが、隣接する肺よりも暗く、時間のポイント01:54 - 01:55でビデオで最もよく視覚化され、左肺よりも優れたレトラクターの上腕より劣って見えます(注釈付きビデオ静止画については 、補足図1 を参照)。 - 7-0シルク縫合糸で2回のスローを完了し、LADを確保するために支持的な3-0シルク縫合糸の上をしっかりと通過します。結紮が成功すると、合字から遠位する前心室領域がブランチする。
- ノットを逆方向に3回目の投球で完了して固定し、上向きの牽引力が縫合糸に伝達されないようにします。縫合線切断による心筋またはLADへの損傷のリスクを減らすために、追加の投球は必要ありません。
5. バイオプリントパッチを心外膜に移植する
- 開いた外科用メスのパケットの無菌の内部表面を使用して、6つのウェルプレートから梗塞領域に慎重にバイオプリントパッチを移動します。
- バイオプリントパッチを前部心外膜表面に慎重に配置し、表面全体を覆い、下心室と下側端(ブランチ領域)を覆う下地と側面の縁にドレープする必要があります。
- 心臓に向かって鋭いエッジを向けずに、リトラクタをそっと閉じて取り外します。
- 胸部と筋肉の層を閉じるために単純な中断パターンで6-0プロレン縫合を使用してください。
- 6-0のプロレン縫合糸で胸を閉じながらため息をする機能を使用すると、胸膜腔内の余分な空気を除去するために肺を膨らませ、そうでなければ胸腔に閉じ込められ、気胸を引き起こす。
- 胸部がしっかりと密閉されていることを確認します。
- イオブルランを1.0%に減らします。単純な中断パターンで6-0プロレン縫合糸で皮膚を閉じます。イオブルーラン気化器をオフにします。
6. マウスの回復
- 局所的に切開に0.9%生理食前に2mg/mLブピバカインを適用します。また、投与: i) アンチセダン (アティパメゾール) 1 mg/kg;ii) ラシックス (フロセミド) 8 mg/kg;iii) 皮下注射による0.9%生理食水の600 μL。
注:アンチセダンは、より迅速に麻酔薬を逆転させることです。フロセミドは、心臓出力の妥協と薬物注射で投与された追加の流体のために余分な流体をオフロードすることです。 - マウスを監視し、独立した呼吸が観察されるまで待って、挿管チューブからマウスを取り除きます。
- マウスが適切な両側呼吸速度と深さを示し、つま先のピンチに反応する場合は、マウスをヒートパッドに置かれたきれいな回復ケージに入れます。
- マウスに湿った食べ物(噛み付き可能なため湿らせた)、水筒、栄養素/水分補給ゲルを提供します。大げさな呼吸努力、過度の出血、または他の生命を脅かす可能性のある合併症を監視します。
- 次の3日間、0.08mg/kgテンベット(ブプレノルフィン)を皮下注射または腹腔内注射を介して0.1mLの0.1mLで、1日2回、手順の後5日目まで1日1回投与する。
- ケージディバイダーで区切られたペアでマウスを収容し、戦闘行動を防ぎながら孤立を防ぎます。実験の終わりまで少なくとも毎日(28日間)マウスを監視し、その幸福に細心の注意を払い、懸念がある場合は監視の頻度を増やします。
結果
移植時に、常温でのパッチの粘度(追加の架橋剤を適用せずに)は、心臓の輪郭(図1)上に「ドレープ」し、心周期と共に動的に移動することを可能にした。手術後、我々は、研究が、これが宿主の心機能33、44に対するパッチ効果を可能にする適切な期間であることを発見したので、28日間のパッチをvivoに残した(移植後3ヶ月まで完全な機能的効果が見られないことが報告されているが)22。図1のマウス心臓の現場で示されたパッチの写真は、適用直後に撮影され、移植時にパッチが心臓の上にドレープする能力を示した。この代表的な結果は、ハイドロゲルが心臓の輪郭にパッチを成形することを可能にし、ハイドロゲルが過剰な張力が発生した場所では、図1の裸(ヒドロゲルフリー)三角領域(画像内の黒星で示される)で示されるように分割できたことを示しています。生存データ(Kaplan-Meier生存曲線)は、偽の処置を受けているマウスと比較して図2に示されている(結紮せずにLADの下で針と縫合糸の通過、続いてマウス胸部の閉鎖)。
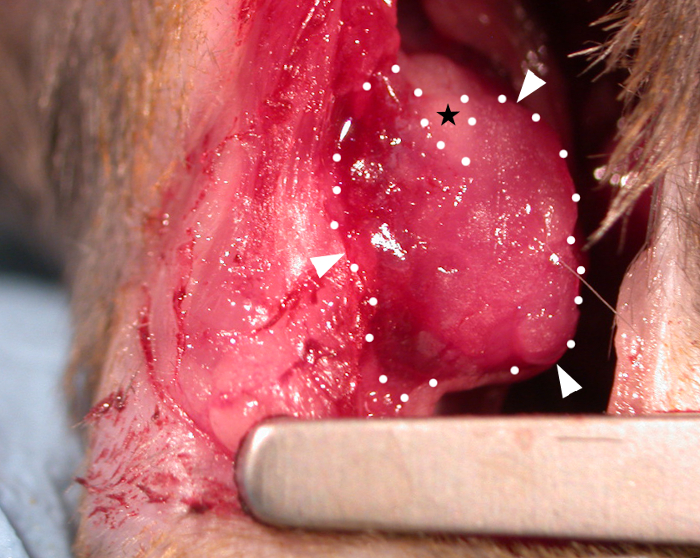
図1:C57BL6マウス心臓の心気体に適用されるバイオプリント心パッチ。ヒドロゲル(アルギン酸4%(w/v)/ゼラチン8%(メディア)を含む10mm x 10 mm x 0.4mmバイオプリントパッチ(メディアではアルギン酸4%/ゼラチン8%)が、心筋領域にドレープされ、上心面(白い矢印と点線=パッチの境界)に付着していることが示されています。パッチ粘度は、心臓の輪郭に成形することを可能にし、パッチがヒドロゲル(ブラックスター)で覆われていない三角形の裸領域を作るためにパッチが分割した優れた側面で過度の緊張が発生した場所。 この図の大きなバージョンを表示するには、ここをクリックしてください。
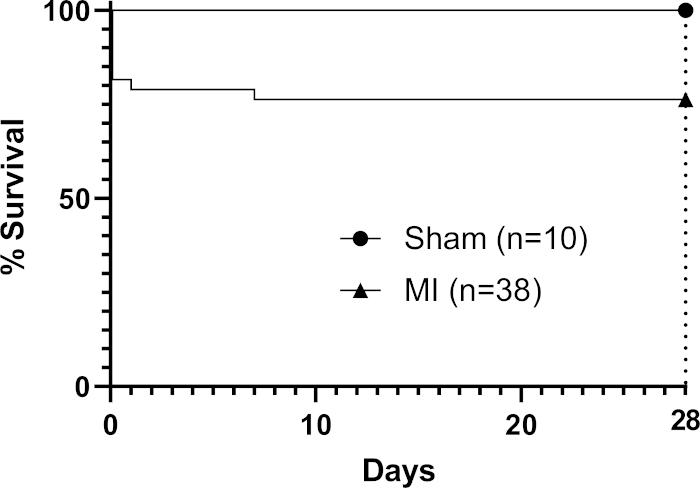
図2:MI後28日間のカプランマイヤー生存率分析手続き型群の9匹のマウスが死亡し(n=38)、全体の死亡率は24%であった。 この図の大きなバージョンを表示するには、ここをクリックしてください。
補助図1:ビデオ静止画(ビデオタイムポイント01:54~01:55)は左耳利き(左心房付属器)を示しています。 矢印は、心臓の上端の三角構造として見える左大口のインフェロメトリアル先端を指しています。LADが明確に視覚化されていない場合、左耳通りの先端は、LADの下に縫合線を通過するための針のエントリのためのランドマークとして使用することができます。エントリポイントは1mm劣り、心臓の動的な動きの間に左大介の先端が到達する最も下の点に内側である(黒い矢印は左耳介のインフェロメジアル先端を示す)。 こちらをダウンロードしてください。
ディスカッション
この方法は、永久LAD結紮後の梗塞マウス心臓の外心表面に適用することにより、バイオプリントパッチを効率的に移植するオペレータを容易にする。この実現可能性に焦点を当てた方法では、1日当たり8匹のマウス(部屋の準備前後を含む)に対してこの手順を実行することができます。6ウェルプレートの井戸に8つの1cm2 パッチを生成するバイオプリンティングランは2〜3時間かかります(前と後の準備時間を含む)。私たちは、手術メスパケットの中の無菌を私たちのパッチのスクープとして使用し、アルギネート/ゼラチンハイドロゲルパッチの自然な接着特性を利用して心臓の前梗塞表面にパッチをドレープし、一般的に最小限のコストを追加します。我々の経験では、マウスにおけるLADの結紮のためのプロトコルはオペレータに依存し、28日で低い死亡率は1つのモデルに特化した経験豊富なオペレータと達成することができる。Van den Borne et et al.16 は、C57BL6マウスがパッチの適用なしに28日で恒久的なLADライゲーションに続いて44%の死亡率を提示し、これは我々がこの方法で観察した30%の上限を超えていると報告した。
挿管段階は重要であり、熟練したオペレータによって行われない限り、それ自体がマウスの死亡率の源となり得る。気管の小さなサイズのために困難にされ、このステップのためにオペレータが虫眼鏡を着用する理由です。注射ケタミン/キシラジンを使用し、麻酔薬の誘導のために吸入イソフルオランを使用して、マウスが各薬物の比較的低用量で深く麻酔を受けるようにします。したがって、この挿管段階でマウスが目を覚ます危険性はありませんが、高い単一薬物投与に関連する高い死亡率は回避されます。アトロピンは、徐脈や過周リカリなどの副作用を打ち消すために与えられました.喉に適用されるスポットライトの使用は、内部で気管を点灯するので、より目に見えるようにし、声帯はマウスの呼吸速度(通常は毎分〜120呼吸)で開閉を視覚化する必要があります。ループ状の糸で保持された2本の切歯歯と舌を鈍い鉗子/痙攣で非常に穏やかに引き込んで口を開き、気管を視覚化することで、マウスを完全に配置することが重要です(このステップでは、マウスの下に固いマットよりも硬い表面が好まれます)。挿管が完了したら、オペレータは挿管領域から手術台への移動中のチューブを外さないように注意する必要があります(低体温症を防ぐためにその下にヒートマットがあります)。呼吸管を換気装置に接続する際には、チューブを片手で安定させ、他方の手で人工呼吸器回路を接続することが重要であり、チューブの換気口を接続する際に気管に深く押し込むなど、呼吸管の動きを最小限に抑える必要があります。
本研究では、ダルベックコの修飾イーグル培地(DMEM)でアルギン酸塩4%(w/v)/ゼラチン8%(w/v)を使用しました。アルギン酸/ゼラチンヒドロゲルは、生体適合性、低コスト、生体力学的特性で知られており、3D組織工学戦略23に有用です。これらのヒドロゲルは、カルシウムイオンを添加することによって穏やかなゲル化によって架橋することができ、粘性を変えることができます。バイオプリンティング後、リン酸緩衝生理食塩2水中(CaCl2)2%(w/v)をパッチに塗布し、6枚のウェルプレートで7~14日間培養した後、移植を行いました。これは、心臓細胞を含むパッチが培養中に打ち始めた後、パッチが崩壊し始める前に最適なウィンドウでした。CaCl2は、パッチ崩壊を減らすためにポストバイオプリンティング段階を通して定期的に添加することができたが、我々は、ヒドロゲルの本質的な粘度は、CaCl2の最初の用量だけで移植までの構造を維持するためにパッチのために十2分であることがわかった。
この方法は、縫合糸(心臓に損傷を与える可能性がある)または接着剤(パッチと心臓の間のインターフェースを妨げう可能性がある)なしで移植に成功することを可能にした。今後の研究では、縫合および接着剤のない移植は、パッチが心臓から滑り落ちたり肺を妨げたりしないことが重要であるため、マウスの生着に悪影響を及ぼさないという仮説を裏付ける可能性がある。パッチベースの修復3を有する恒久的なLADライゲーションモデルにおけるパッチの生着を評価する他の研究は、時間24に残る生移植領域(mm2)を測定し、移植されたパッチ厚(μm)を時間25で再採掘し、移植の定量化を行った。 細胞は、ポリメラーゼ連鎖反応(PCR)26または生体発光光子放出フラックスの標識された生きたドナー細胞(1秒間に放出される光子の測定値で、生きている動物で生き残った標識されたグラフト細胞を時間経過に伴って定量することができる)27。26今後の研究では、縫合および糊のない移植がパッチ生着(ならびに宿主心筋膜に対する構造的および機能的効果)に影響を及ぼすかどうかをさらに評価するために、これらの方法を用いるかもしれない。それにもかかわらず、私たちの免疫担当マウスで生体内で28日後にマクロコピカルに、前メディスターの内隔は可変性の線維性物質および癒着を提示した。パッチベースの心臓再生のメカニズムは、数値細胞補充ではなく宿主マクロファージ炎症応答19または分泌免疫因子20の刺激からであってもよい。炎症が肯定的な役割を果たす場合、外国のヒドロゲル材料の存在が有益である可能性があります。あるいは、異物の存在を減らすために、ヒドロゲル成分が経時的に崩壊する場合に有益であり得る。実際、いくつかのアプローチは、細胞を最初にサポートし、その後崩壊する生体材料を使用し、組織28、29,29のみを残す。パッチの生着を完全に分析し、パッチベースの心臓再生の背後にあるメカニズムをよりよく理解するための将来の研究は、ヒト試験への翻訳前に最適化された実験計画につながる可能性があります2.
全体として、このプロトコルは広く実現可能であり、例えば細胞の内容が異なる3Dバイオプリントパッチの複数のグループをテストするのに適している可能性が高い。この方法の今後の方向性としては、これまで生体内でテストされていない高度なヒドロゲルを含むパッチのバイオプリンティングや、大型動物モデルに進む前に最適化するための異なる自家または異種幹細胞由来細胞の効果をテストすることが含まれる。
開示事項
なし。
資金調達ステートメント:
クリストファー・D・ロシュは、サー・ジョン・ローエンタール奨学金2019(シドニー大学)、ル・グロス・レガシー・ファンド・ニュージーランド(PhD012019)、ハート・リサーチ・オーストラリア博士奨学金(2019-02)によって支援されました。カーミン異邦人は、シドニー大学キックスタートグラント、シドニー大学首相の博士インセンティブプログラム助成金、UTSシード資金、成人幹細胞研究のためのシドニー補助金のカトリック大司教区、シドニー医学部フォーダネーション心臓胸部外科研究助成金によってサポートされました。
謝辞
非外科的な映像とすべてのビデオ編集の記録のためのナタリー・ジョンストンのおかげで。
資料
| Name | Company | Catalog Number | Comments |
| 3-0 non-absorbable black braided treated silk | Ethicon | 232G | |
| 6-0, 24” (60 cm) Prolene (polypropylene) suture, blue monofilament | Ethicon | 8805H | |
| 7-0, 18” (45 cm) silk black braided | Ethicon | 768G | |
| Adjustable stereo microscope with 6.4x magnification | Olympus | SZ 3060 STU1 | |
| Anitisedan (atipamezole) | Zoetis | N/A | |
| Atropine sulphate 0.6 mg, 1 mL vials, 10 pack | Symbion Pharmacy Services | ATRO S I2 | |
| Bupivacaine, 20 mL, 5 vials | Baxter Heathcare | BUPI I C01 | |
| Temvet (buprenorphine), 300 µg/mL, 10 mL bottle | Troy Laboratories | TEMV I 10 | |
| Curved-tip forceps | Kent Scientific | INS650915-4 | Iris dressing forceps, 10 cm-long curved dressing forceps; 0.8 mm serrated tips; stainless steel. |
| Dissecting scissors for cutting muscle/skin | Kent Scientific | INS600393-G | Dissecting scissors, straight, 10 cm long |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | Including intubation catheter/tube (20 G), fibre-optic light source and dental spatula |
| Fine scissors | Kent Scientific | INS600124 | McPherson-Vannas micro scissors, 8 cm long, straight, 0.1 mm tips, 5 mm blades; stainless steel. |
| Lasix (furosemide) 20 mg, 2 mL, 5 pack | Sigma Company | LASI A 1 | |
| Heat pad for animal recovery post-op | Passwell | PAD | Passwell Cosy Heat Pad for Animals - 26cm x 36cm; 10 Watts; Soft PVC Cover |
| Ketamine 100 mg, 50 mL | CEVA Animal Heath | KETA I 1 | |
| Needle holder | Kent Scientific | INS600137 | Castroviejo needle holder, serrated, 14 cm long, 1.2 mm jaws with lock |
| PhysioSuite with MouseVent G500 automatic ventilator | Kent Scientific | PS-MVG | |
| Puralube Vet Opthalmic Ointment (sterile occular lubricant) | Dechra | 17033-211-38 | |
| Self-retaining toothed mouse retractor | Kent Scientific | INS600240 | ALM serrated self-retaining retractor, 7 cm long |
| Straight forceps | Kent Scientific | INS650908-4 | Super fine dressing forceps, 12.5 cm Long, serrated tips, 0.35 x 0.10 mm; stainless steel. |
| Surgical magnifying glasses | Kent Scientific | SL-001 | |
| VetFlo vaporizer | Kent Scientific | VetFlo-1205S-M | |
| Xylazine 100 mg, 50 mL | Randlab | XYLA I R01 |
参考文献
- Lund, L. H., et al. The registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult heart transplantation report-2017; focus theme: allograft ischemic time. Journal of Heart and Lung Transplantation. 36 (10), 1037-1046 (2017).
- Roche, C. D., Brereton, R. J. L., Ashton, A. W., Jackson, C., Gentile, C. Current challenges in three-dimensional bioprinting heart tissues for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 58 (3), 500-510 (2020).
- Wang, H., Roche, C. D., Gentile, C. Omentum support for cardiac regeneration in ischaemic cardiomyopathy models: a systematic scoping review. European Journal of Cardio-Thoracic Surgery. , ezaa205 (2020).
- Mattapally, S., et al. Spheroids of cardiomyocytes derived from human-induced pluripotent stem cells improve recovery from myocardial injury in mice. American Journal of Physiology-Heart and Circulatory Physiology. 315 (2), 327-339 (2018).
- Gao, L., et al. Large cardiac muscle patches engineered from human induced-pluripotent stem cell-derived cardiac cells improve recovery from myocardial infarction in swine. Circulation. 137 (16), 1712-1730 (2018).
- Yang, B., et al. A net mold-based method of biomaterial-free three-dimensional cardiac tissue creation. Tissue Engineering Methods (Part C). 25 (4), 243-252 (2019).
- Menasché, P., et al. Human embryonic stem cell-derived cardiac progenitors for severe heart failure treatment: first clinical case report. European Heart Journal. 36 (30), 2011-2017 (2015).
- Menasché, P., et al. Transplantation of human embryonic stem cell-derived cardiovascular progenitors for severe ischemic left ventricular dysfunction. Journal of the American College of Cardiology. 71 (4), 429-438 (2018).
- Beyersdorf, F. Three-dimensional bioprinting: new horizon for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 46 (3), 339-341 (2014).
- Noor, N., et al. 3D printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344 (2019).
- Maiullari, F., et al. A multi-cellular 3D bioprinting approach for vascularized heart tissue engineering based on HUVECs and iPSC-derived cardiomyocytes. Scientific Reports. 8 (1), 13532 (2018).
- Zhang, Y. S., et al. Bioprinting 3D microfibrous scaffolds for engineering endothelialized myocardium and heart-on-a-chip. Biomaterials. 110, 45-59 (2016).
- Chachques, J. C., et al. Myocardial assistance by grafting a new bioartificial upgraded myocardium (MAGNUM clinical trial): one year follow-up. Cell Transplant. 16 (9), 927-934 (2007).
- Chachques, J. C., et al. Elastomeric cardiopatch scaffold for myocardial repair and ventricular support. European Journal of Cardio-Thoracic Surgery. 57 (3), 545-555 (2020).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: an improved and simplified model for myocardial infarction. Journal of Visualized Experiments. (122), e55353 (2017).
- van den Borne, S. W. M., et al. Mouse strain determines the outcome of wound healing after myocardial infarction. Cardiovascular Research. 84 (2), 273-282 (2009).
- Noguchi, R., et al. Development of a three-dimensional pre-vascularized scaffold-free contractile cardiac patch for treating heart disease. Journal of Heart and Lung Transplantation. 35 (1), 137-145 (2016).
- Walker, R. L., Eggel, M. From mice to monkeys? Beyond orthodox approaches to the ethics of animal model choice. Animals. 10 (1), 77 (2020).
- Vagnozzi, R. J., et al. An acute immune response underlies the benefit of cardiac stem-cell therapy. Nature. 577, 405-409 (2019).
- Waters, R., et al. Stem cell-inspired secretome-rich injectable hydrogel to repair injured cardiac tissue. Acta Biomaterialia. 69, 95-106 (2018).
- Cossu, G., et al. Lancet Commission: stem cells and regenerative medicine. Lancet. 391 (10123), 883-910 (2018).
- Kawamura, M., et al. Enhanced therapeutic effects of human iPS cell derived-cardiomyocyte by combined cell-sheets with omental flap technique in porcine ischemic cardiomyopathy model. Scientific Reports. 7 (1), 8824 (2017).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kainuma, S., et al. Cell-sheet therapy with omentopexy promotes arteriogenesis and improves coronary circulation physiology in failing heart. Molecular Therapy. 23 (2), 374-386 (2015).
- Suzuki, R., et al. Omentopexy enhances graft function in myocardial cell sheet transplantation. Biochemical and Biophysical Research Communications. 387 (2), 353-359 (2009).
- Zhou, Q., Zhou, J. Y., Zheng, Z., Zhang, H., Hu, S. S. A novel vascularized patch enhances cell survival and modifies ventricular remodeling in a rat myocardial infarction model. Journal of Thoracic and Cardiovascular Surgery. 140 (6), 1388-1396 (2010).
- Lilyanna, S., et al. Cord lining-mesenchymal stem cells graft supplemented with an omental flap induces myocardial revascularization and ameliorates cardiac dysfunction in a rat model of chronic ischemic heart failure. Tissue Engineering (Part A). 19 (11-12), 1303-1315 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Zhang, B., et al. Biodegradable scaffold with built-in vasculature for organ-on-a-chip engineering and direct surgical anastomosis. Nature Materials. 15 (6), 669-678 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved