Method Article
Transplantation eines biobedruckten 3D-Patches in einem Murine-Modell des Myokardinfarkts
In diesem Artikel
Zusammenfassung
Dieses Protokoll zielt darauf ab, ein biogedrucktes 3D-Pflaster auf das Epikardium von infarktierten Mäusen zu transplantieren, die Herzinsuffizienz modellieren. Es enthält Details über Anästhesie, die chirurgische Brustöffnung, permanente Ligation der linken vorderen absteigenden (LAD) Koronararterie und die Anwendung eines biobedruckten Pflasters auf den Infarktbereich des Herzens.
Zusammenfassung
Die Prüfung der regenerativen Eigenschaften von 3D-bioprinted Herzpflaster nin vivo unter Verwendung muriner Modelle der Herzinsuffizienz über permanente linke vordere Absteigende (LAD) Ligation ist ein anspruchsvolles Verfahren und hat aufgrund seiner Natur eine hohe Sterblichkeitsrate. Wir haben eine Methode entwickelt, um biogedruckte Flecken von Zellen und Hydrogelen konsequent auf das Epikardium eines infarktierten Mausherzes zu transplantieren, um ihre regenerativen Eigenschaften auf robuste und machbare Weise zu testen. Zunächst wird eine tief anästhesierte Maus sorgfältig intubiert und belüftet. Nach der linken seitlichen Thorakotomie (chirurgische Öffnung der Brust) wird der exponierte LAD dauerhaft ligiert und das biobedruckte Pflaster auf das Epikardium transplantiert. Die Maus erholt sich schnell von der Prozedur nach dem Brustverschluss. Zu den Vorteilen dieses robusten und schnellen Ansatzes gehört eine prognostizierte 28-Tage-Sterblichkeitsrate von bis zu 30 % (niedriger als die 44 %, die von anderen Studien mit einem ähnlichen Modell der permanenten LAD-Ligation bei Mäusen gemeldet wurden). Darüber hinaus ist der in diesem Protokoll beschriebene Ansatz vielseitig und könnte angepasst werden, um biogedruckte Pflaster mit verschiedenen Zelltypen oder Hydrogelen zu testen, bei denen eine hohe Anzahl von Tieren benötigt wird, um Die Energiestudien optimal durchzuführen. Insgesamt stellen wir dies als vorteilhaften Ansatz dar, der präklinische Tests in zukünftigen Studien für den Bereich der Herzregeneration und Gewebetechnik verändern kann.
Einleitung
Eine Herztransplantation ist die Goldstandardbehandlung für Patienten mit Herzinsuffizienz im Endstadium, aber es gibt einen Mangel an Spenderorganen. Es erfordert eine Unterdrückung des Immunsystems, um eine Transplantatabstoßung zu verhindern, und die einjährige Sterblichkeitsrate beträgt 15% weltweit1. Daher gibt es einen langjährigen Anreiz, das Myokard in präklinischen Tiermodellen zu regenerieren, um in Studien am Menschen zu übersetzen2,3,4,5,6,7,8,9. Jüngste Fortschritte im 3D-Bioprinting von Stammzellen oder Stammzellen-abgeleiteten Herzzellen haben Aufmerksamkeit als vielversprechender Ansatz zur Regenerierung des Myokards2,3,9,10,11,12gewonnen.
Die ersten menschlichen Sicherheitsstudien, in der Pflaster zur Regenerierung des Herzens angewendet wurden, wurden berichtet, wobei autologe Knochenmark-Mononuklezellen in Kollagen- oder embryonalen Stammzell-abgeleiteten Herzvorläuferzellen in Fibrin suspendiert und in das Epikardium7,,8,13transplantiert wurden. Für eine präzisere, skalierbarere, automatisierbare und reproduzierbare Methode ist der 3D-Bioprinting optimierter Hydrogel-Pflaster, die auf die Epikardinatidialoberfläche des Herzens aufgebracht werden sollen, jedoch ein vielversprechender Ansatz, um das Myokard für Patienten zu regenerieren, die sonst eine Herztransplantation benötigen2,10,11,12.
Bevor die Übersetzung in Studien am Menschen erfolgen kann, sind präklinische Tierstudien erforderlich. Präklinische In-vivo-Modelle zur Regeneration des Myokards wurden bei Schweinen5,Schafen 14,Ratten6 und Mäusen4berichtet. Ein gemeinsames Modell des Myokardinfarkts (MI) bei Mäusen verwendet permanente Ligation der linken vorderen absteigenden (LAD) koronaren Arterie15,16. Unter den verschiedenen Stämmen von Mäusen verwendet, permanente LAD Ligation in C57BL6 Mäuse hat eine akzeptable Überlebensrate und in der Regel präsentiert konsistente Umgestaltung und Herzveränderungen nach MI16. In Nagetiermodellen wurden mehrere Ansätze beschrieben, bei denen Herzgewebe auf das Herz aufgetragen wurde, um eine effektive Regeneration des geschädigten Myokards4,6,17zu verfolgen. Während große Tiere noch ein klinisch relevanteres Modell zur Prüfung der kardialen regenerativen Eigenschaften5,14darstellen, eignet sich die Vielseitigkeit und Machbarkeit des Mausmodells für dieses schnelllebige Studiengebiet. Dies kann einige der für große Tierstudien typischen Fallstricke vermeiden, einschließlich (aber nicht beschränkt auf): 1) hohe Tiersterblichkeit (es sei denn, diagonale Koronararterien sind ligiert, was zu unvorhersehbaren Segmentinfarkten14führt, oder das distale Ende des LAD wird ausgeschlossen, gefolgt von Einertrifusion anstelle einer permanenten Ligation5); 2) ethische Fragen mit dem relativ erhöhten Schaden, der durch große Tierprotokolle im Vergleich zu Mäusen verursacht wird18; 3) erhöhte Kosten und/oder Durchführbarkeitsprobleme, z. B. die relative14Nichtverfügbarkeit von großen Tiergeräten wie MRT-Scanner14 . Es ist auch wichtig zu bedenken, dass sie angesichts der für große Tierstudien typischen umfangreichen Dauer und Desentwicklung das Potenzial haben, veraltet zu sein, bevor sie abgeschlossen sind, insbesondere mit den für diesen Bereich typischen schnellen Entwicklungen. So ist beispielsweise erst vor kurzem die entscheidende Rolle von Entzündungszellen und Mediatoren bei der Regulierung der Herzregeneration entstanden19,20. Darüber hinaus wurde die entscheidende Rolle präklinischer Studien, wie z. B. Kleintiermodelle, von einer Lancet-Kommission als wesentlicher Schritt hervorgehoben, um vor dem Übergang zu Studien am Menschen solide Kenntnisse zu erlangen21.
Um Fortschritte beim Verständnis von Mechanismen und der Optimierung der Bedingungen für patchbasierte Herzregenerationsansätze in vivo zu erleichtern, präsentieren wir einen neuartigen Ansatz, der eine "Scoop and drape"-Methode beschreibt, um ein 3D-bioprinted Alginat/Gelatine-Hydrogel-Patch auf die Oberfläche von Infarktherzen bei C57BL6-Mäusen anzuwenden. Ziel dieses Ansatzes ist es, ein vielseitiges In-vivo-Modell zum Testen von 3D-Biodruck-Patches bereitzustellen, die in weiten Forschungskontexten für das sich schnell entwickelnde Feld der Herzregeneration möglich sein dürften2. Diese Methode könnte angepasst werden, um Patches zu testen, die durch Nicht-Bioprinting-Methoden, verschiedene Hydrogele und autologe oder allogene Stammzellen-abgeleitete Zellen innerhalb von Patches in vivo erzeugt werden. Eine detaillierte Betrachtung von Bioprinting, Hydrogelen oder Zelltypen geht jedoch über den Rahmen dieser Studie hinaus, die sich auf die chirurgische Transplantationsmethode konzentriert.
Die Vorteile des Protokolls umfassen, dass der Myokardinfarkt und die Anwendung eines biogedruckten Pflasters in einem chirurgischen Verfahren durchgeführt werden, das schnell, mit leicht verfügbaren, kostengünstigen Laborwerkzeugen und mit einer relativ niedrigen Sterblichkeitsrate durchgeführt werden kann. Es ermöglicht auch in der Regel eine höhere Anzahl von Tieren als große Tiermodelle in einem kleineren Raum, was einen robusten Vergleich mehrerer experimenteller Gruppen ermöglicht, besonders nützlich für mehrere Gruppenvergleiche in vivo. Andererseits hat dieses Protokoll die Nachteile, dass: 1) das Mausmodell ist mehr entfernt von menschlicher Herzgröße, Anatomie und Physiologie als bei großen Tiermodellen und es nicht direkt in den Menschen übersetzt; 2) die murinen LAD-Zweige proximal, mit signifikanter Variabilität zwischen einzelnen Mäusen, was zu Einerfarktgrößenvariabilität führt (ein Problem, das mit großen Tiermodellen geteilt wird); 3) Das Pflaster muss über die gesamte vordere Herzoberfläche aufgetragen werden, die weniger präzise ist als die Anwendung über einen bestimmten Infarktbereich; und 4) das Pflaster wird sofort zum Zeitpunkt des MI angewendet (für den menschlichen Gebrauch ist es wahrscheinlich klinisch nützlicher, ein Pflaster für die Anwendung auf die chronisch infarktierten versagenden Herz Monate nach dem ursprünglichen MI14zu entwickeln).
Dennoch kann dieses Protokoll, wenn es entsprechend der getesteten Hypothese ausgewählt wird, schnell kritische In-vivo-Daten mit hohen n Zahlen liefern, und zwar in einer Weise, die mit den Materialien, dem Budget und dem Fachwissen in den meisten Laboratorien übereinstimmt. Im Vergleich zu großen Tiermodellen ist es ein In-vivo-Modell, das vielseitig genug ist, um sich an neue 3D-Bioprinting-Technologien anzupassen (z. B. durch die relative Leichtigkeit der Durchführung von Pilotstudien, um Machbarkeit und Sicherheit zu testen, bevor sie zu größeren Tiermodellen wechseln). Es wäre gut geeignet für Forscher, die In-vivo-Daten effizient und kostengünstig generieren wollen, vielleicht mehrere Vergleiche von 3D-Biodruck-Patches mit verschiedenen Bioprinting-Parametern, Zellen oder Hydrogelen in den Patches durchführen. Es wäre besonders nützlich, um die Wechselwirkungen verschiedener Gemische von Stammzellen und Stammzellen abgeleiteten Zellen mit Hydrogelen in vivo zu testen, ohne übermäßige Verschwendung von teuren Zelllinien oder anderen Materialien, die auftreten könnten, wenn großflächige Pflaster verwendet werden. Die Verwendung eines Mausmodells würde auch das Testen von Patches erleichtern, die artkompatible, maus-abgeleitete Zell- und Stammzelllinien oder vom Menschen abgeleitete Zellen enthalten, bei denen einheitliche Mäuse mit einem spezifischen Immunmangel wünschenswert sind. Darüber hinaus könnten Tests an genetisch veränderten Mausstämmen es Forschern ermöglichen, die Auswirkungen bestimmter Gene auf Signalwege und bestimmte Zelltypen, die für Herz-Kreislauf-Erkrankungen relevant sind, zu isolieren, was derzeit in einem großen Tiermodell nicht möglich wäre.
Protokoll
Alle in diesem Experiment beschriebenen Verfahren wurden von der Animal Ethics Committee at the Northern Sydney Local Health District, NSW, Australia (Projektnummer RESP17/55) genehmigt.
1. Anästhesie und Intubation
HINWEIS: Schalten Sie das Stereomikroskop, das Wärmepad (mit einem absorbierenden Blech bedeckt) und das Beatmungssystem ein und richten Sie es ein.
- Reinigen Sie Handschuhe, den operationsischen Bereich und die Werkzeuge mit 70% Ethanol.
- Wiegen Sie die Maus, um die Dosierung der Anästhesie zu berechnen, die durch den intraperitonealen Weg injiziert wird (Ketamin 40 mg/kg, Xylazin 5 mg/kg, Atropin 0,15 mg/kg) und geben Sie die Injektion.
- Sobald die Maus eine tiefe Ebene der Anästhesie erreicht, rasieren Sie die ventrale linke Seite des Thorax mit einem Trimmer.
- Legen Sie die Maus in eine Kammer mit 2% Isofluran (sorgt für eine ausreichende Extraktionslüftung im Raum).
HINWEIS: Die relativ niedrige Dosis der Ketamin/Xylazin-Injektion zusammen mit 2% Isofluran-Inhalation reduziert das Risiko des Maussterbens und ermöglicht eine optimale Intubation, ohne die Maus aufzuwecken. - Legen Sie die Maus-Supine und halten Sie sie von seinen oberen Schneidezähnen mit einer 3.0 Naht auf die Bank geklebt, wie im Video gezeigt. Bestätigen Sie die Sedierung, indem Sie eine Zehenklemmung durchführen. Positionieren Sie einen hochintensiven Beleuchtungskörper über dem Maushals, damit der Oropharynx visualisiert werden kann.
HINWEIS: Alternativ kann die Maus vom Intubationskit (z. B. Kent Mouse Intubation Kit) mit einem elastischen Band unter den oberen Schneidezähnen auf dem Ständer platziert werden, um den Mund offen zu halten, um die Luftröhre zu identifizieren. - Verwenden Sie einen gekrümmten Spachtel, um den Kiefer zu öffnen und ein weiteres Paar Spachtel/stumpfe Zange, um die Zunge sanft aus dem Weg zu heben. Achten Sie darauf, intubieren, während auf oder leicht unter Augenhöhe mit dem Körper der Maus positioniert.
- Visualisieren Sie das Öffnen und Schließen der Stimmbänder. Wenn sie geöffnet sind, legen Sie den mitgelieferten 20 G Kunststoffkatheter mit dem Intubationskit ein.
- Übertragen Sie die intubierte Maus vorsichtig auf eine Mitbedienfläche, die mit einem Heizkissen ausgestattet ist. Schließen Sie die Maus an das Beatmungsgerät (z. B. MouseVent) an, das automatisch das Zielvolumen basierend auf dem Mausgewicht festlegt.
- Liefern Sie 1,5-2% Isofluran mit Sauerstoff (die automatisch durch das Beatmungsgerät geregelt wird: Stellen Sie sicher, dass es eine Verbindung von einem Sauerstoffzylinder zum automatischen Ventilator bei 1-2 L/min Durchfluss rate zum Beatmungsgerät gibt). Überprüfen Sie die Intubation, indem Sie den bilateralen Brustanstieg überprüfen. Überprüfen Sie die Anästhesie, indem Sie eine Zehenklemme durchführen.
- Tragen Sie opthalmische Salbe (z.B. Puralube Vet Opthalmic Salbe) auf beide Augen auf, um zu verhindern, dass sie austrocknen.
2. Vorbereitung des Operationsfeldes
- Sichern Sie das Intubationsrohr mit Klebeband an der Verbindungsstelle zwischen dem Beatmungsgerät und dem Atemschlauch/Katheter.
- Schneiden Sie ein längeres Stück Klebeband und sichern Sie seinen linken Vorderfuß in leicht erhöhter Position an der Betriebsfläche. Auch die anderen Extremitäten abkleben.
- Reinigen Sie die Brust mit steriler 70% Isopropanol und Povidon Jodlösung, Reinigung in einer kreisförmigen Bewegung bewegt sich von der Mitte zur Peripherie.
- Anästhesie noch einmal mit einer Zehenprise überprüfen.
- 0,08 mg/kg Temvet (Buprenorphin) in 0,1 ml 0,9% Saline mittels subkutaner Injektion verabreichen.
3. Linke laterale Thorakotomie
- Verwenden Sie Feinspitzenzange, um die Haut an einer Stelle ca. 5 mm links vom markanten xiphoiden Knorpel sanft zu heben. Verwenden Sie eine chirurgische Schere, um einen superomedialen Schnitt in der Haut von diesem Punkt nach oben und in Richtung der Mittellinie, auf die Ebene des Manubriums zu schaffen.
- Verwenden Sie gekrümmte Zangen, um die Haut- und Muskelschichten sanft zu trennen. Öffnen Sie die Muskelschicht nach dem Hautschnitt.
- Identifizieren und machen Sie einen Schnitt im dritten interkostalen Raum, nach dem natürlichen Winkel des Brustkorbs.
- Verwenden Sie einen Retraktor, um die 3. und 4. Rippe sanft auseinander zu streuen.
- Entfernen Sie das dünne Perikard vorsichtig mit Zangen.
- Wenn der LAD nicht visualisiert ist, drücken Sie vorsichtig die linke Ohrmuschel (siehe Zusatzabbildung 1) nach oben und lokalisieren Sie die Herzkranzgefäße darunter.
4. Links anterior absteigend (LAD) permanente koronare Arterieligation
- Schneiden Sie eine 3 mm lange 3-0 Seidennaht und legen Sie dieses verstärkende 3-0 Seidennahtstück auf den LAD in die gleiche Richtung wie der LAD (wie im Video zum Zeitpunkt 02:12 – 02:20 gezeigt).
- Identifizieren Sie den LAD und übergeben Sie eine 7-0 Seidennaht unter dem LAD. Wenn der LAD nicht klar visualisiert ist, legen Sie die Nadel 1 mm unter und medial bis zum untersten Punkt ein, der durch die Spitze der linken Ohrmuschel während der dynamischen Bewegung des Herzens erreicht wird.
HINWEIS: Diese Struktur ist eine hellere Farbe rot zu den ventrikulären Kammern des Herzens, aber dunkler als die benachbarte Lunge und ist am besten im Video zum Zeitpunkt 01:54 – 01:55 visualisiert, wo es nur unter dem überlegenen Arm des Retraktors sichtbar ist, besser als die linke Lunge (siehe Ergänzende Abbildung 1 für anmerkungen Video-Standbild). - Schließe zwei Würfe mit der 7-0 Seidennaht ab und schließe sie fest an der Oberseite der unterstützenden 3-0 Seidennaht, um den LAD zu sichern. Wenn die Ligation erfolgreich ist, blanchiert der vordere ventrikuläre Bereich distal von der Ligatur.
- Vervollständigen Sie den Knoten mit einem dritten Wurf in die entgegengesetzte Richtung, um ihn zu sichern, so dass keine nach oben gerichtete Zugkraft auf die Naht übertragen wird. Zusätzliche Würfe sind nicht erforderlich, um das Risiko einer Beschädigung des Myokards oder LAD durch Durchschneiden von Nähten zu verringern.
5. Transplantation des biobedruckten Pflasters auf das Epikard
- Bewegen Sie das biogedruckte Pflaster vorsichtig von einer sechs Brunnenplatte in den Infarktbereich, indem Sie die sterile Innenfläche eines geöffneten chirurgischen Skalpellpakets verwenden.
- Positionieren Sie das biogedruckte Pflaster vorsichtig auf die vordere Epikardinaoberfläche, wo es die gesamte Oberfläche abdecken und über die unteren und seitlichen Kanten drapieren sollte, wobei der linke Ventrikel und die Infarktzone (blanched area) bedeckt sind.
- Schließen Sie den Retraktor vorsichtig und entfernen Sie ihn, ohne scharfe Kanten in Richtung Herz zu lenken.
- Verwenden Sie 6-0 Prolen-Nähte in einem einfachen unterbrochenen Muster, um den Brustkorb und die Muskelschichten zu schließen.
- Mit der Seufzeratmung-Funktion beim Schließen der Brust mit den 6-0 Prolen-Nähten, aufblasen Sie die Lunge, um überschüssige Luft in der Pleurahöhle zu entfernen, die sonst in der Brusthöhle gefangen würde und zu einem Pneumothorax führen würde.
- Stellen Sie sicher, dass die Brust dicht verschlossen ist.
- Verringern Sie das Isofluran auf 1,0%. Schließen Sie die Haut mit 6-0 Prolen-Nähten in einem einfachen unterbrochenen Muster. Schalten Sie den Isofluran-Verdampfer aus.
6. Maus-Wiederherstellung
- Topisch 2 mg/ml Bupivacain in 0,9% Kochsaline auf den Schnitt auftragen. Auch verabreichen: i) Antisedan (Atipamezole) 1 mg/kg; ii) Lasix (Furosemid) 8 mg/kg; iii) 600 l 0,9% Salinelösung über eine subkutane Injektion.
HINWEIS: Antisedan ist, das Anästhetikum schneller umzukehren; Furosemid ist es, überschüssige Flüssigkeit aufgrund von Herzleistung Kompromiss und zusätzliche Flüssigkeit mit Medikamenteninjektionen verabreicht zu entladen. - Überwachen Sie die Maus und warten Sie, bis eine unabhängige Atmung beobachtet wird, um die Maus aus dem Intubationsrohr zu entfernen.
- Wenn die Maus eine ausreichende bilaterale Atemfrequenz und -tiefe demonstriert und auf eine Zehenklemme reagiert, legen Sie die Maus in einen sauberen Bergungskäfig, der auf einem Heatpad platziert ist.
- Geben Sie der Maus feuchte Nahrung (befeuchtet für Diekbarkeit), eine Wasserflasche und ein Nährstoff-/Feuchtigkeitsgel. Monitor für eine übertriebene Atemanstrengung, übermäßige Blutungen oder andere potenziell lebensbedrohliche Komplikationen.
- Für die nächsten drei Tage 0,08 mg/kg Temvet (Buprenorphin) in 0,1 ml mit 0,9 % Saline mittels subkutaner oder intraperitonealer Injektion zweimal täglich, dann einmal täglich bis zum fünften Tag nach dem Eingriff verabreichen.
- Hausmäuse in Paaren, die durch Käfigteiler getrennt sind, um Isolation zu verhindern und gleichzeitig Kampfverhalten zu verhindern. Überwachen Sie Mäuse mindestens täglich bis zum Ende der Experimente (28 Tage) mit viel Aufmerksamkeit auf ihr Wohlbefinden und erhöhte Häufigkeit der Überwachung, wenn es irgendwelche Bedenken gibt.
Ergebnisse
Bei der Transplantation erlaubte die Viskosität des Pflasters bei Raumtemperatur (ohne dass zusätzlicher Verklinker aufgebracht wurde) es, über die Konturen des Herzens zu "drapieren" (Abbildung 1) und sich dynamisch mit dem Herzzyklus zu bewegen. Nach der Operation, verließen wir die Pflaster für 28 Tage in vivo als Studien haben festgestellt, dass dies ein geeigneter Zeitraum für Patch-Effekte auf Host-Herzfunktion3,4 (obwohl es berichtet wurde, dass volle funktionelle Effekte nicht gesehen werden können, bis drei Monate nach der Transplantation)22. Das Foto eines Patches, das in situ auf einem Mausherz in Abbildung 1 gezeigt wurde, wurde unmittelbar nach der Anwendung aufgenommen und zeigt die Fähigkeit des Pflasters, bei der Transplantation über das Herz zu drapieren. Dieses repräsentative Ergebnis zeigt, dass das Hydrogel es dem Pflaster ermöglicht, sich zu den Konturen des Herzens zu formen, und wo eine übermäßige Spannung auftrat, konnte sich das Hydrogel spalten, wie der nackte (hydrogelfreie) dreieckige Bereich in Abbildung 1 zeigt (angezeigt durch einen schwarzen Stern im Bild). Überlebensdaten (Kaplan-Meier-Überlebenskurven) sind in Abbildung 2 im Vergleich zu Mäusen dargestellt, die sich einem Scheinverfahren unterziehen (Durchgang einer Nadel und Naht unter dem LAD ohne Ligation gefolgt von Verschluss der Mausbrust).
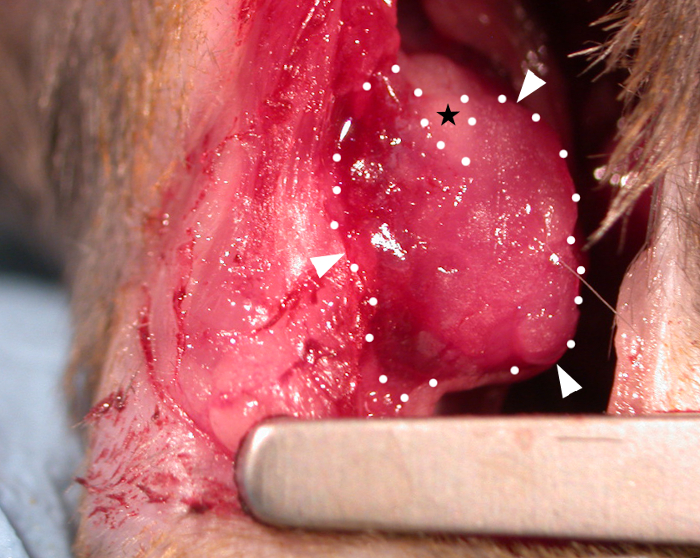
Abbildung 1: Ein biogedrucktes Herzpflaster, das auf das Epikard eines C57BL6-Mausherzens aufgetragen wird. Ein 10 mm x 10 mm x 0,4 mm biobedrucktes Pflaster (unmittelbar nach der Transplantation), das Hydrogel enthält (Alginat 4% (w/v)/Gelatine 8% (w/v) in Denmedien) wird über dem Infarktbereich drapiert und an der Epikardenoberfläche haftend (weiße Pfeilspitzen und gepunktete Linien = Rand des Pflasters). Die Patchviskosität ermöglicht es, zu den Konturen des Herzens zu formen und wo übermäßige Spannung an der oberen Aspekt des Patches gespalten ist, um eine dreieckige nackte Fläche nicht mit Hydrogel (schwarzer Stern) bedeckt zu machen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
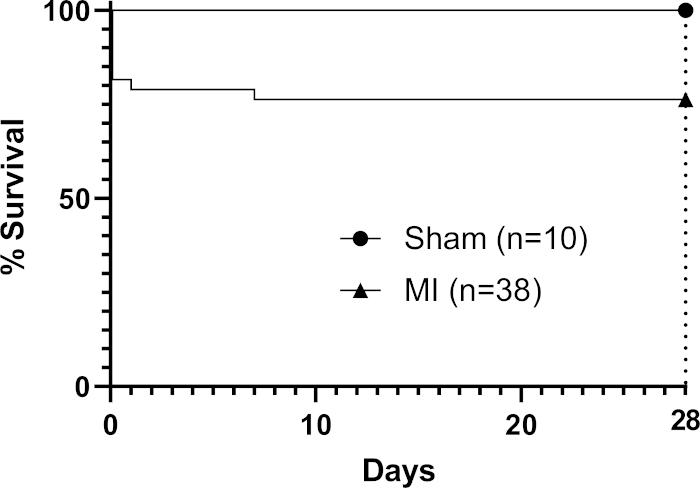
Abbildung 2: Kaplan-Meier-Überlebensanalyse über 28 Tage nach MI. Neun Mäuse in der Verfahrensgruppe starben (n=38), um eine Gesamtsterblichkeitsrate von 24 % zu erreichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Video-Standbild (Videozeitpunkt 01:54 – 01:55) zeigt die linke Aurikel (linkes Vorhof-Anhängszeichen). Der Pfeil zeigt auf die inferomediale Spitze der linken Ohrmuschel, die als dreieckige Struktur am oberen linken Rand des Herzens sichtbar ist. Falls der LAD nicht klar visualisiert ist, kann die Spitze der linken Ohrmuschel als Wegweiser für den Nadeleintrag verwendet werden, um eine Naht unter dem LAD zu passieren. Der Einstiegspunkt ist 1 mm unter und medial bis zum untersten Punkt, den die Spitze der linken Ohrmuschel bei dynamischen Bewegungen des Herzens erreicht (schwarzer Pfeil zeigt inferomediale Spitze der linken Ohrmuschel). Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Diskussion
Die Methode erleichtert es dem Bediener, ein biogedrucktes Pflaster effizient zu transplantieren, indem es nach permanenter LAD-Ligation auf die Epikardinatsoberfläche eines infarktierten Mausherzes aufgebracht wird. Bei dieser machbarkeitsorientierten Methode sind wir in der Lage, dieses Verfahren an acht Mäusen pro Arbeitstag durchzuführen (einschließlich der Vorbereitung des Raumes vor und nachher). Ein Bioprinting-Lauf, der acht 1 cm2 Pflaster in Brunnen mit Sechs-Brunnen-Platten produziert, dauert 2-3 Stunden (einschließlich Vorbereitungszeit vor und nach her). Wir verwendeten das sterile Innere eines chirurgischen Skalpellpakets als Schaufel für unser Pflaster, das leicht zugänglich ist und in der Regel minimale Kosten verursacht, wobei die natürlichen Klebstoffeigenschaften des Alginat-/Gelatine-Hydrogel-Patches verwendet werden, um das Pflaster über die vordere Infarktoberfläche des Herzens zu drapieren. Nach unserer Erfahrung ist das Protokoll für die LAD-Ligation bei Mäusen bedienerabhängig und eine niedrigere Sterblichkeitsrate nach 28 Tagen kann mit erfahrenen Betreibern erreicht werden, die auf ein Modell spezialisiert sind. Van den Borne et al.16 berichteten, dass C57BL6-Mäuse eine Sterblichkeit von 44 % nach permanenter LAD-Ligation nach 28 Tagen ohne Anwendung eines Pflasters aufweisen, das über der Obergrenze von 30 % liegt, die wir mit der Methode beobachtet haben.
Der Intubationsschritt ist kritisch und kann für Mäuse eine Todesursache sein, es sei denn, er wird von einem erfahrenen Bediener durchgeführt. Schwierig wird dies durch die winzige Größe der Luftröhre, weshalb die Lupe nissen wird, für diesen Schritt vom Bediener getragen wird. Wir verwenden injiziertes Ketamin/Xylazin sowie inhaliertes Isofluoran zur Induktion von Anästhetika, so dass die Maus bei relativ niedrigen Dosen jedes Arzneimittels tief betäuben wird. Daher besteht kein Risiko für die Maus, während dieses Intubationsschritts aufzuwachen, aber die hohe Sterblichkeit, die mit hohen Einzelmedikamentendosen verbunden ist, wird vermieden. Atropin wurde auch gegeben, um Nebenwirkungen wie Bradykardie und Hypersalivation entgegenzuwirken. Die Verwendung eines Scheinwerfers, der auf den Hals aufgebracht wird, leuchtet die Luftröhre nach innen, so dass sie sichtbarer ist und die Stimmbänder beim Öffnen und Schließen mit der Atemfrequenz der Maus visualisiert werden müssen (in der Regel 120 Atemzüge pro Minute). Es ist wichtig, die Maus perfekt zu positionieren (deshalb wird für diesen Schritt eine harte Oberfläche bevorzugt als eine wärmende Matte unter der Maus) mit den beiden Schneidzähnen, die von einem Schleifenfaden gehalten werden, und die Zunge zog sich extrem sanft mit stumpfen Zangen/Spachtpaar ein, um den Mund zu öffnen und die Luftröhre zu visualisieren. Sobald die Intubation abgeschlossen ist, muss der Bediener darauf achten, dass die Röhre im Transfer vom Intubationsbereich zum Operationsbett nicht entfernt wird (die eine Wärmematte darunter hat, um Unterkühlung zu verhindern). Beim Anschluss des Atemschlauchs an das Beatmungsgerät ist es wichtig, das Rohr mit einer Hand zu stabilisieren und den Beatmungskreislauf mit der anderen zu verbinden, so dass es eine minimale Bewegung des Atemschlauchs gibt, wie z. B. es beim Anschluss des Lüftersegments des Schlauches tiefer in die Luftröhre zu schieben.
In dieser Studie verwendeten wir Alginat 4% (w/v)/Gelatine 8% (w/v) in Dulbecco es Modified Eagle Medium (DMEM). Alginat/Gelatine-Hydrogele sind bekannt für ihre Biokompatibilität, niedrige Kosten und biomechanische Eigenschaften, die sie für 3D-Gewebe-Engineering-Strategien nützlich machen23. Diese Hydrogele können durch milde Gelation durch Zugabe von Calciumionen vernetzt werden, wodurch eine Viskosität verändert werden kann. Nach dem Bioprinting haben wir Calciumchlorid (CaCl2) 2% (w/v) in phosphatgepufferter Kochsaline (PBS) auf Pflaster aufgetragen und dann in DMEM in sechs Brunnenplatten für 7-14 Tage kultiviert, bevor sie transplantiert werden. Dies war das optimale Fenster, nachdem Patches mit Herzzellen in der Kultur zu schlagen begannen, aber bevor Patches begannen zu zerfallen. Während CaCl2 während der post-bioprinting Phase regelmäßig hinzugefügt werden konnte, um den Zerfall von Pflastern zu reduzieren, stellten wir fest, dass die intrinsische Viskosität des Hydrogels ausreichte, um ihre Struktur bis zur Transplantation mit nur einer Anfangsdosis von CaCl2aufrecht zu erhalten.
Die Methode ermöglichte eine erfolgreiche Transplantation ohne Nähte (die das Herz schädigen kann) oder Kleber (die die Schnittstelle zwischen dem Patch und dem Herzen blockieren kann). Zukünftige Studien können die Hypothese bestätigen, dass eine naht- und klebelose Transplantation die Transplantation von Mäusen nicht negativ beeinflusst, da es entscheidend ist, dass das Pflaster nicht vom Herzen abrutscht oder die Lunge stört. Andere Studien zur Bewertung der Verdrängung von Pflastern in permanenten LAD-Ligationsmodellen mit Patch-basierter Reparatur3 haben die veredelte Fläche (mm2) gemessen, die mit der Zeit24verbleibt, die veredelte Patchdicke (m) remining mit der Zeit25, Quantifizierung transplantierter Zellen durch Polymerase-Kettenreaktion (PCR)26 oder Biolumineszenz-Photonen-Emissionsfluss von markierten lebenden Spenderzellen (ein Maß für photonen emittierte Photonen, die markierte transplantierte Zellen quantifizieren können, die bei lebenden Tieren im Laufe der Zeit überleben)27. Zukünftige Studien können diese Methoden verwenden, um weiter zu beurteilen, ob naht- und klebelose Transplantation Die Patch-Engraftment (sowie strukturelle und funktionelle Effekte auf das Wirtsmyokard) beeinflusst. Dennoch präsentierte das vordere Mediastinum makroskopisch nach 28 Tagen in vivo in unseren immunkompetenten Mäusen variables fibrinöses Material und Adhäsionen. Der Mechanismus der patchbasierten Karstregeneration kann von der Stimulation der Host-Makrophagen-Entzündungsreaktionen19 oder abgesonderte immunologische Faktoren20 sein, anstatt numerische Zellauffüllung. Wenn Entzündungen eine positive Rolle spielen, kann das Vorhandensein von fremdem Hydrogelmaterial von Vorteil sein. Alternativ kann es vorteilhaft sein, das Vorhandensein von Fremdmaterial zu reduzieren, wenn die Hydrogelkomponente im Laufe der Zeit zerfällt. Tatsächlich verwenden einige Ansätze Biomaterialien, die Zellen zunächst unterstützen und dann zerfallen, so dass nur Gewebe28,29übrig bleibt. Zukünftige Studien zur vollständigen Analyse der Patch-Engraftment und besser zu verstehen, die Mechanismen hinter Patch-basierte Herzregeneration kann zu optimierten experimentellen Designs vor der Übersetzung in menschliche Studien führen2.
Insgesamt ist dieses Protokoll wahrscheinlich weit übermöglich und eignet sich auch zum Testen mehrerer Gruppen von 3D-Biodruck-Patches, z. B. mit unterschiedlichen Zellinhalten. Zukünftige Richtungen für diese Methode umfassen den Bioprinting von Patches, die fortgeschrittene Hydrogele enthalten, die zuvor nicht in vivo getestet wurden, oder die Prüfung der Auswirkungen verschiedener autologen oder allogener Stammzellen-abgeleiteter Zellen zur Optimierung, bevor sie zu großen Tiermodellen übergehen.
Offenlegungen
nichts.
FINANZIERUNGSERKLÄRUNG:
Christopher D. Roche wurde durch ein Sir John Loewenthal Stipendium 2019 (University of Sydney), den Le Gros Legacy Fund New Zealand (PhD012019) und ein Heart Research Australia PhD Scholarship (2019-02) unterstützt. Carmine Gentile wurde von einem Kick-Start Grant der University of Sydney, dem Doctoral Incentive Programme Grant der University of Sydney, der UTS Seed Funding, dem Catholic Archdiocese of Sydney Grant for Adult Stem Cell Research und einem Sydney Medical School Foudation Cardiothoracic Surgery Research Grant unterstützt.
Danksagungen
Mit Dank an Natalie Johnston für die Aufnahme des nicht-chirurgischen Filmmaterials und alle Videobearbeitung.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-0 non-absorbable black braided treated silk | Ethicon | 232G | |
| 6-0, 24” (60 cm) Prolene (polypropylene) suture, blue monofilament | Ethicon | 8805H | |
| 7-0, 18” (45 cm) silk black braided | Ethicon | 768G | |
| Adjustable stereo microscope with 6.4x magnification | Olympus | SZ 3060 STU1 | |
| Anitisedan (atipamezole) | Zoetis | N/A | |
| Atropine sulphate 0.6 mg, 1 mL vials, 10 pack | Symbion Pharmacy Services | ATRO S I2 | |
| Bupivacaine, 20 mL, 5 vials | Baxter Heathcare | BUPI I C01 | |
| Temvet (buprenorphine), 300 µg/mL, 10 mL bottle | Troy Laboratories | TEMV I 10 | |
| Curved-tip forceps | Kent Scientific | INS650915-4 | Iris dressing forceps, 10 cm-long curved dressing forceps; 0.8 mm serrated tips; stainless steel. |
| Dissecting scissors for cutting muscle/skin | Kent Scientific | INS600393-G | Dissecting scissors, straight, 10 cm long |
| Endotracheal intubation kit | Kent Scientific | ETI-MSE | Including intubation catheter/tube (20 G), fibre-optic light source and dental spatula |
| Fine scissors | Kent Scientific | INS600124 | McPherson-Vannas micro scissors, 8 cm long, straight, 0.1 mm tips, 5 mm blades; stainless steel. |
| Lasix (furosemide) 20 mg, 2 mL, 5 pack | Sigma Company | LASI A 1 | |
| Heat pad for animal recovery post-op | Passwell | PAD | Passwell Cosy Heat Pad for Animals - 26cm x 36cm; 10 Watts; Soft PVC Cover |
| Ketamine 100 mg, 50 mL | CEVA Animal Heath | KETA I 1 | |
| Needle holder | Kent Scientific | INS600137 | Castroviejo needle holder, serrated, 14 cm long, 1.2 mm jaws with lock |
| PhysioSuite with MouseVent G500 automatic ventilator | Kent Scientific | PS-MVG | |
| Puralube Vet Opthalmic Ointment (sterile occular lubricant) | Dechra | 17033-211-38 | |
| Self-retaining toothed mouse retractor | Kent Scientific | INS600240 | ALM serrated self-retaining retractor, 7 cm long |
| Straight forceps | Kent Scientific | INS650908-4 | Super fine dressing forceps, 12.5 cm Long, serrated tips, 0.35 x 0.10 mm; stainless steel. |
| Surgical magnifying glasses | Kent Scientific | SL-001 | |
| VetFlo vaporizer | Kent Scientific | VetFlo-1205S-M | |
| Xylazine 100 mg, 50 mL | Randlab | XYLA I R01 |
Referenzen
- Lund, L. H., et al. The registry of the International Society for Heart and Lung Transplantation: thirty-fourth adult heart transplantation report-2017; focus theme: allograft ischemic time. Journal of Heart and Lung Transplantation. 36 (10), 1037-1046 (2017).
- Roche, C. D., Brereton, R. J. L., Ashton, A. W., Jackson, C., Gentile, C. Current challenges in three-dimensional bioprinting heart tissues for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 58 (3), 500-510 (2020).
- Wang, H., Roche, C. D., Gentile, C. Omentum support for cardiac regeneration in ischaemic cardiomyopathy models: a systematic scoping review. European Journal of Cardio-Thoracic Surgery. , ezaa205 (2020).
- Mattapally, S., et al. Spheroids of cardiomyocytes derived from human-induced pluripotent stem cells improve recovery from myocardial injury in mice. American Journal of Physiology-Heart and Circulatory Physiology. 315 (2), 327-339 (2018).
- Gao, L., et al. Large cardiac muscle patches engineered from human induced-pluripotent stem cell-derived cardiac cells improve recovery from myocardial infarction in swine. Circulation. 137 (16), 1712-1730 (2018).
- Yang, B., et al. A net mold-based method of biomaterial-free three-dimensional cardiac tissue creation. Tissue Engineering Methods (Part C). 25 (4), 243-252 (2019).
- Menasché, P., et al. Human embryonic stem cell-derived cardiac progenitors for severe heart failure treatment: first clinical case report. European Heart Journal. 36 (30), 2011-2017 (2015).
- Menasché, P., et al. Transplantation of human embryonic stem cell-derived cardiovascular progenitors for severe ischemic left ventricular dysfunction. Journal of the American College of Cardiology. 71 (4), 429-438 (2018).
- Beyersdorf, F. Three-dimensional bioprinting: new horizon for cardiac surgery. European Journal of Cardio-Thoracic Surgery. 46 (3), 339-341 (2014).
- Noor, N., et al. 3D printing of personalized thick and perfusable cardiac patches and hearts. Advanced Science. 6 (11), 1900344 (2019).
- Maiullari, F., et al. A multi-cellular 3D bioprinting approach for vascularized heart tissue engineering based on HUVECs and iPSC-derived cardiomyocytes. Scientific Reports. 8 (1), 13532 (2018).
- Zhang, Y. S., et al. Bioprinting 3D microfibrous scaffolds for engineering endothelialized myocardium and heart-on-a-chip. Biomaterials. 110, 45-59 (2016).
- Chachques, J. C., et al. Myocardial assistance by grafting a new bioartificial upgraded myocardium (MAGNUM clinical trial): one year follow-up. Cell Transplant. 16 (9), 927-934 (2007).
- Chachques, J. C., et al. Elastomeric cardiopatch scaffold for myocardial repair and ventricular support. European Journal of Cardio-Thoracic Surgery. 57 (3), 545-555 (2020).
- Reichert, K., et al. Murine left anterior descending (LAD) coronary artery ligation: an improved and simplified model for myocardial infarction. Journal of Visualized Experiments. (122), e55353 (2017).
- van den Borne, S. W. M., et al. Mouse strain determines the outcome of wound healing after myocardial infarction. Cardiovascular Research. 84 (2), 273-282 (2009).
- Noguchi, R., et al. Development of a three-dimensional pre-vascularized scaffold-free contractile cardiac patch for treating heart disease. Journal of Heart and Lung Transplantation. 35 (1), 137-145 (2016).
- Walker, R. L., Eggel, M. From mice to monkeys? Beyond orthodox approaches to the ethics of animal model choice. Animals. 10 (1), 77 (2020).
- Vagnozzi, R. J., et al. An acute immune response underlies the benefit of cardiac stem-cell therapy. Nature. 577, 405-409 (2019).
- Waters, R., et al. Stem cell-inspired secretome-rich injectable hydrogel to repair injured cardiac tissue. Acta Biomaterialia. 69, 95-106 (2018).
- Cossu, G., et al. Lancet Commission: stem cells and regenerative medicine. Lancet. 391 (10123), 883-910 (2018).
- Kawamura, M., et al. Enhanced therapeutic effects of human iPS cell derived-cardiomyocyte by combined cell-sheets with omental flap technique in porcine ischemic cardiomyopathy model. Scientific Reports. 7 (1), 8824 (2017).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kainuma, S., et al. Cell-sheet therapy with omentopexy promotes arteriogenesis and improves coronary circulation physiology in failing heart. Molecular Therapy. 23 (2), 374-386 (2015).
- Suzuki, R., et al. Omentopexy enhances graft function in myocardial cell sheet transplantation. Biochemical and Biophysical Research Communications. 387 (2), 353-359 (2009).
- Zhou, Q., Zhou, J. Y., Zheng, Z., Zhang, H., Hu, S. S. A novel vascularized patch enhances cell survival and modifies ventricular remodeling in a rat myocardial infarction model. Journal of Thoracic and Cardiovascular Surgery. 140 (6), 1388-1396 (2010).
- Lilyanna, S., et al. Cord lining-mesenchymal stem cells graft supplemented with an omental flap induces myocardial revascularization and ameliorates cardiac dysfunction in a rat model of chronic ischemic heart failure. Tissue Engineering (Part A). 19 (11-12), 1303-1315 (2013).
- Miller, J. S., et al. Rapid casting of patterned vascular networks for perfusable engineered three-dimensional tissues. Nature Materials. 11 (9), 768-774 (2012).
- Zhang, B., et al. Biodegradable scaffold with built-in vasculature for organ-on-a-chip engineering and direct surgical anastomosis. Nature Materials. 15 (6), 669-678 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten