Method Article
عزل وتوصيف الحويصلات خارج الخلية المشتقة من الخلايا الشحمية البشرية باستخدام الترشيح والطرد المركزي الفائق
In This Article
Summary
نصف عزل الحويصلات خارج الخلية المشتقة من الخلايا الشحمية البشرية (EVs) من الأنسجة الدهنية الألوية والبطن باستخدام الترشيح والطرد المركزي الفائق. نقوم بتمييز المركبات الكهربائية المعزولة المشتقة من الخلايا الشحمية من خلال تحديد حجمها وتركيزها عن طريق تحليل تتبع الجسيمات النانوية والنشاف الغربي لوجود جين قابلية الورم لبروتين EV 101 (TSG101).
Abstract
الحويصلات خارج الخلية (EVs) عبارة عن مغلفات محاطة بالدهون تحمل مواد نشطة بيولوجيا مثل البروتينات والحمض النووي الريبي والمستقلبات والدهون. يمكن للمركبات الكهربائية تعديل الحالة الخلوية للخلايا الأخرى محليا في البيئات الدقيقة للأنسجة أو من خلال التحرير في الدم المحيطي. ترتفع المركبات الكهربائية المشتقة من الخلايا الشحمية في الدم المحيطي وتظهر تغيرات في حمولتها (الحمض النووي الريبي والبروتين) أثناء اضطرابات التمثيل الغذائي ، بما في ذلك السمنة والسكري. يمكن للمركبات الكهربائية المشتقة من الخلايا الشحمية تنظيم الحالة الخلوية لخلايا الأوعية الدموية المجاورة ، مثل الخلايا البطانية والضامة المقيمة في الأنسجة الدهنية لتعزيز التهاب الأنسجة الدهنية. يعد التحقيق في التغيرات في المركبات الكهربائية المشتقة من الخلايا الشحمية في الجسم الحي أمرا معقدا لأن المركبات الكهربائية المشتقة من الدم المحيطي غير متجانسة للغاية وتحتوي على مركبات كهربائية من مصادر أخرى ، وهي الصفائح الدموية والخلايا البطانية وكريات الدم الحمراء والعضلات. لذلك ، توفر ثقافة الخلايا الشحمية البشرية نظاما نموذجيا لدراسة المركبات الكهربائية المشتقة من الخلايا الشحمية. هنا ، نقدم بروتوكولا مفصلا لاستخراج إجمالي المركبات الكهربائية الصغيرة من وسط زراعة الخلايا للخلايا الشحمية الألوية والبطن البشرية باستخدام الترشيح والطرد المركزي الفائق. نوضح أيضا استخدام تحليل تتبع الجسيمات النانوية (NTA) لقياس حجم EV وتركيزه ونظهر وجود جين حساسية ورم بروتين EV 101 (TSG101) في الخلايا الشحمية المشتقة من الألوية والبطن. يمكن استخدام المركبات الكهربائية المعزولة من هذا البروتوكول لتحليل المصب ، بما في ذلك المجهر الإلكتروني للإرسال ، والبروتينات ، والتمثيل الغذائي ، وتسلسل الحمض النووي الريبي الصغير ، والمصفوفات الدقيقة ويمكن استخدامها في الدراسات الوظيفية في المختبر / في الجسم الحي.
Introduction
الحويصلات خارج الخلية (EVs) عبارة عن مظاريف محاطة بالدهون تحمل مواد نشطة بيولوجيا مثل البروتينات والحمض النووي الريبي الميكروي والمستقلبات والدهون. يشير مصطلح EVs إلى مجموعات سكانية فرعية مختلفة ، والتي تشمل الإكسوسومات والحويصلات الدقيقة (الجسيمات الدقيقة / الجسيمات الخارجية) والأجسام موت الخلاياالمبرمج 1. قد تعمل المركبات الكهربائية كمؤشرات حيوية لأنها متورطة في الإشارات المرضية ويتم إطلاقها في السوائل الحيوية ، بما في ذلك الدم والبول. يمكن للمركبات الكهربائية تعديل الحالة الخلوية للخلايا الأخرى محليا في البيئات الدقيقة للأنسجة أو من خلال التحرير في الدم المحيطي2. تحمل المركبات الكهربائية ميزات الخلية الأم ولكن التمايز بين كل مجموعة سكانية فرعية يعتمد بشكل أساسي على حجم EV ومحتوى البروتين مثل علامات EVs ، بما في ذلك وجود التتراسبانين (CD9 و CD63 و CD81) ، وجين الحساسية للورم 101 (TSG101) ، والبروتين المتفاعل مع ALG-2 X (ALIX). تمثل علامات البروتين هذه الأصل الداخلي (CD9 و CD63 و CD81) للإكسوسومات الخارجية ، والتي يتم إنشاؤها داخل أجسام متعددة الحويصلات أو تمثل البروتينات المرتبطة بالتبرعم أو الفقاع مباشرة من غشاء البلازما للحويصلات الدقيقة. ومع ذلك ، هناك تداخل كبير بين هذه المجموعات السكانية الفرعية ، ومن الصعب التمييز بين المجموعات السكانية الفرعية الفردية في السوائل الحيوية المعقدة مثل البلازما أو المصل أو البول.
يمكن أن تؤدي الاضطرابات الأيضية ، بما في ذلك السمنة ومقاومة الأنسولين والاضطرابات في الجلوكوز خارج الخلية والأكسجين والالتهابات إلى تغيير حجم وتركيز المركبات الكهربائية وحمولتها. تحمل المركبات الكهربائية المشتقة من الخلايا الشحمية Perilipin A و adiponectin وتظهر تغيرات في حمولة البروتين والحمض النووي الريبي أثناء السمنة ومرض السكري3،4،5،6. تنظم المركبات الكهربائية المشتقة من الخلايا الشحمية الحالة الخلوية للخلايا البطانية الوعائية المجاورة7 والضامة المقيمة في الأنسجة الدهنية لتعزيز التهاب الأنسجة الدهنية ومقاومة الأنسولين8،9،10،11. يعد التحقيق في التغيرات في المركبات الكهربائية المشتقة من الخلايا الشحمية في الجسم الحي أمرا معقدا لأن مجموعات المركبات الكهربائية المشتقة من السوائل الحيوية المعقدة مثل البلازما أو المصل أو البول تحتوي على مركبات كهربائية من مصادر متعددة ، مثل الصفائح الدموية والخلايا البطانية وكريات الدم الحمراء والعضلات ، والتي تشارك في التسبب في الخلل الأيضي والمرض.
وبالتالي ، فإن الثقافة والتمايز في المختبر للخلايا الشحمية البشرية يوفر نظاما نموذجيا لدراسة المركبات الكهربائية المشتقة من الخلايا الشحمية. هنا ، نقدم بروتوكولا مفصلا لاستخراج إجمالي المركبات الكهربائية الصغيرة من وسائط زراعة الخلايا للخلايا الشحمية البشرية باستخدام ترشيح الحقنة والطرد المركزي الفائق. لا يزال الطرد المركزي الفائق طريقة شائعة لعزل المركبات الكهربائية لأنه يسهل الوصول إليه ولا يتطلب سوى القليل من المعرفة المتخصصة المسبقة. ومع ذلك ، فإن الطرق الأخرى مثل هطول الأمطار ، وكروماتوغرافيا استبعاد الحجم ، والتقاط التقارب المناعي باستخدام التتراسبانين تمكن من عزل EV من مجموعة من السوائل الحيوية ، بما في ذلك البلازما والمصل والبول ووسائط زراعة الخلايا المكيفة. تنتج كل طريقة ، بما في ذلك بروتوكول الطرد المركزي الفائق الموصوف هنا ، مستحضرات EV ذات نقاء متفاوتة لأن الطرق يمكن أن تشارك في عزل البروتينات القابلة للذوبان والبروتينات الدهنية ، والتي قد تخفي على أنها EVs. يؤدي الجمع بين بروتوكول الطرد المركزي الفائق هذا مع طرق أخرى مثل الطرد المركزي للكثافة ، وكروماتوغرافيا استبعاد الحجم ، والتقاط التقارب المناعي إلى زيادة نقاء المركبات الكهربائية المعزولة بشكل كبير. ولكن على غرار الطرد المركزي الفائق ، لا تسمح هذه الطرق الأخرى بالتقاط مجموعات سكانية فرعية مستقلة من المركبات الكهربائية من عينات معقدة مثل الدم والبلازما والبول. لذلك ، تظل مزارع مجموعات الخلايا المختارة واحدة من أقوى الطرق لتوليد عوائد عالية من المركبات الكهربائية الخاصة بالخلايا. تحتوي كل طريقة EV على عدد من المحاذير ويمكن أن يؤثر اختيار الطريقة على أنواع المركبات الكهربائية المعزولة وتركيزاتها ، مما قد يؤدي إلى تحيز التحقيقات الميكانيكية النهائية في الإشارات الخلوية والأنسجة وتحديد شحنة EV للدراسات التشخيصية ؛ تتم مناقشة هذه القضايا المنهجية لعزل المركبات الكهربائية في مكان آخر وفي أقسام القيود أدناه4،12. هنا ، نصف عزل المركبات الكهربائية البشرية المشتقة من الخلايا الشحمية باستخدام الترشيح والطرد المركزي الفائق. نوضح أيضا استخدام تحليل تتبع الجسيمات النانوية (NTA) لقياس حجم وتركيز EV ونظهر وجود جين قابلية الورم لبروتين EV 101 (TSG101) في المركبات الكهربائية المشتقة من الخلايا الشحمية البشرية. يمكن استخدام المركبات الكهربائية المعزولة من هذا البروتوكول لتحليل المصب ، بما في ذلك المجهر الإلكتروني للإرسال ، والبروتينات ، والتمثيل الغذائي ، وتسلسل الحمض النووي الريبي الصغير ، والمصفوفة الدقيقة ، ويمكن استخدامها في الدراسات الوظيفية في المختبر / في الجسم الحي.
Protocol
تمت الموافقة على جميع الأساليب من قبل مجلس مراجعة الأخلاقيات المؤسسية في جامعة أكسفورد. تم الحصول على الأنسجة الدهنية عن طريق الخزعة بالإبرة تحت التخدير الموضعي من متطوعين أصحاء.
1. تحضير وسط زراعة الخلايا والمخازن المؤقتة
- قم بإعداد مخزن مؤقت لهضم الكولاجيناز عن طريق إذابة الكولاجيناز H (1 مجم / مل) في محلول الملح المتوازن هانكس (HBSS) (بدون كلوريد الكالسيوم وبدون كلوريد المغنيسيوم) وفلتر معقم باستخدام مرشح حقنة مسام 0.2 ميكرومتر.
- قم بإعداد المخزن المؤقت لهضم الكولاجيناز قبل الاستخدام بمدة لا تزيد عن 10 دقائق.
- تحضير وسط النمو (GM) على النحو التالي: خليط المغذيات F12 (DMEM / F12) من Dulbecco's Modified Eagle's Medium / Ham Nutrition F12 (DMEM / F12) مع 10٪ مصل بقري الجنين (FBS) ، و 100 وحدة / مل من البنسلين ، و 100 ميكروغرام / مل من الستربتومايسين ، و 2 ملي مولار L-glutamine ، و 0.5 نانوغرام / مل عامل نمو الخلايا الليفية (FGF).
- تحضير وسط التمايز الأساسي (DM الأساسي) على النحو التالي: DMEM / F12 مكمل ب 100 وحدة / مل بنسلين ، 100 ميكروغرام / مل ستربتومايسين ، 2 ملي لتر جلوتامين ، 17 ميكرومتر بانتوثينات ، 100 نانومتر أنسولين بشري ، 10 نانومتر ثلاثي يودو-L-ثيرونين ، 33 ميكرومتر بيوتين ، 10 ميكروغرام / مل ترانسفيرين ، و 1 ميكرومتر ديكساميثازون.
- قم بإعداد وسيط تمايز كامل (DM كامل) عن طريق استكمال DM الأساسي من الخطوة 1.3 ب 0.25 ملي مولار 3-isobutyl-1-methylxanthine و 4 ميكرومتر troglitazone.
- قم بإعداد 10 ملي مولار من محاليل مخزون الأحماض الدهنية المعقدة بنسبة 10٪ من ألبومين مصل الأبقار الخالي من الأحماض الدهنية (BSA) على النحو التالي.
- قم بإذابة 16 جم من BSA في 160 مل من DMEM / F12 المتوسط والدافئ إلى 37 درجة مئوية. في ثلاثة أنابيب مخروطية منفصلة سعة 50 مل ، قم بوزن 150 مجم من أوليات الصوديوم ، و 139 مجم من بالميتات الصوديوم ، و 151 مجم من لينوليات الصوديوم. أضف 50 مل من محلول BSA الدافئ إلى كل أنبوب واخلطه جيدا عن طريق الدوامة المتكررة.
- أعد أنابيب الأولات واللينوليات إلى الحمام المائي بدرجة حرارة 37 درجة مئوية لمدة 15 دقيقة. تخلط عن طريق الدوامة حتى تذوب تماما.
- بالنسبة لمحلول البالميتات ، ضع الأنبوب في حمام مائي 65 درجة مئوية لمدة 2-3 دقائق. تخلط بقوة عن طريق الدوامة.
- كرر الخطوة 1.5.3 حتى تذوب تماما - حوالي 30 دقيقة.
ملاحظة: قد تظل بعض الجسيمات الصغيرة مرئية. - قم بتصفية محاليل الأحماض الدهنية المعقمة باستخدام مرشح حقنة المسام 0.2 ميكرومتر.
- تأكد من تركيز الأحماض الدهنية غير الأسترية لكل محلول مخزون باستخدام اختبار مناسب.
ملاحظة: يجب أن تكون مخزونات الأحماض الدهنية 10 ملي مولار (±10٪) لإعطاء نسبة مولية 6: 1 بين الأحماض الدهنية و BSA. إذا كان التركيز خارج هذا النطاق ، فيجب إعادة صنع محلول المخزون. يمكن تسعير محاليل المخزون وتخزينها عند -30 درجة مئوية.
2. هضم خزعات الأنسجة الدهنية البشرية
- قم بتصفية محتويات حقنة الخزعة ببطء من خلال مصفاة خلية معقمة سعة 200 ميكرومتر متصلة بأنبوب مخروطي سعة 50 مل بحيث يتم جمع الأنسجة الدهنية في المصفاة.
- انقل المصفاة إلى أنبوب مخروطي جديد سعة 50 مل واغسل الأنسجة الدهنية ثلاث مرات باستخدام 10 مل من HBSS.
ملاحظة: قد يكون من الضروري إزالة الجلطات الدموية والأنسجة الليفية باستخدام مقص جراحي أو تكرار غسل HBSS لإزالة خلايا الدم الحمراء الزائدة. - وزن الأنسجة المغسولة.
ملاحظة: نحصل عادة على 400-800 مجم من الأنسجة عن طريق الخزعة بالإبرة. - ضع المخزن المؤقت لهضم الكولاجيناز في أنبوب مخروطي معقم سعة 50 مل وأضف المنديل المغسول. يمكن استخدام المقص الجراحي في هذه الخطوة لفرم الأنسجة إلى قطع متساوية الحجم.
ملاحظة: استخدم 5 مل من المخزن المؤقت لكل 0.5 جرام من الأنسجة. بالنسبة للأنسجة الكبيرة ، يمكن تقطيع العينات في طبق بتري. - ضع الأنبوب في حمام مائي مهتز بدرجة حرارة 37 درجة مئوية واحتضنه لمدة 35-40 دقيقة.
ملاحظة: بعد الهضم الناجح ، يجب أن يظهر المحلول حليبي. إذا كانت القطع الصغيرة من الأنسجة لا تزال مرئية ، فقم بهزها باليد لمدة 10-20 ثانية أخرى.
3. عزل الخلايا الشحمية
- لتكوير جهاز الطرد المركزي لكسر الخلايا الشحمية عند 1,000 × جم لمدة 5 دقائق.
- شفط وتخلص من طبقة الخلايا الشحمية العائمة والمادة الطافية ، تاركا ما يقرب من 1 مل من HBSS تغطي حبيبات الخلية.
- أعد تعليق الحبيبات في 5 مل من HBSS وقم بتمرير تعليق الخلية عبر شبكة بحجم المسام 250 ميكرومتر متبوعة بشبكة 100 ميكرومتر لإزالة أي مادة غير مهضومة. اجمع معلق الخلية في أنبوب مخروطي سعة 15 مل.
- جهاز طرد مركزي عند 1,000 × جم لمدة 5 دقائق.
ملاحظة: بعد هذه الخطوة ، يمكن علاج جزء الخلايا الشحمية بمحلول تحلل خلايا الدم الحمراء إذا كان تلوث خلايا الدم الحمراء يمثل مشكلة. - استنشق وتخلص من المادة الطافية.
- أعد تعليق حبيبات الخلية في 5 مل من GM (الخطوة 1.2) والبذور في قارورة ثقافة الأنسجة الملتصقة مقاس 25 سم2 . ضع القارورة في حاضنة زراعة الخلايا (5٪ ثاني أكسيد الكربون2 ، 37 درجة مئوية).
4. الحفاظ على مزارع الخلايا الشحمية
- استبدل GM كل يومين أثناء تكاثر الخلايا
ملاحظة: قد تختلف معدلات تكاثر الخلايا بين المتبرعين.- عندما تصل الخلايا إلى ما يقرب من 80٪ من التقاء ، انقلها إلى قارورة ثقافة الأنسجة الملتصقة مقاس 75 سم2 . قم بإزالة GM وغسل الخلايا بمحلول ملحي مخزن بالفوسفات (PBS).
- تخلص من PBS وأضف 0.5 مل من إنزيمات تفكك الخلايا عالية النقاء لفصل الخلايا المرفقة. احتضان عند 37 درجة مئوية لمدة 5 دقائق.
- اضغط على القارورة بحدة لتحرير الخلايا وإضافة 5 مل من GM. اجمع معلق الخلية في أنبوب مخروطي 15 مل.
- جهاز طرد مركزي عند 1,000 × جم لمدة 5 دقائق.
- استنشق وتخلص من المادة الطافية. أعد تعليق حبيبات الخلية في 5 مل من GM ونقل إلى قارورة 75 سم2 . قم بتعبئة الأداة المعدلة وراثيا إلى حجم نهائي يبلغ 12 مل واستبدل القارورة في حاضنة زراعة الخلايا (5٪ ثاني أكسيد الكربون2 ، 37 درجة مئوية).
ملاحظة: للحفاظ على الخلايا ، استمر في تغيير GM كل 2-3 أيام. عندما تصل الخلايا إلى 80٪ من التقاء ، كرر الخطوات 4.2-4.3 وقسم الخلايا 1: 3 إلى قوارير جديدة مقاس 75 سم2 . يمكن تكرار ذلك لعدة مقاطع حتى يتم إنشاء عدد كاف من الخلايا للإعداد التجريبي. لا نوصي بأكثر من 10 مقاطع مع انخفاض قدرة الانتشار والتمايز للخلايا الشحمية.
5. بذر الخلايا الشحمية للتمايز الشحمي
- عد الخلايا باستخدام مقياس كثافة الدم وبذر 200,000 خلية في آبار متعددة من صفيحة 6 آبار في 2 مل من GM. بدلا من ذلك ، قم بزرع 3.5 مليون خلية لكل قارورة 175 سم2 في 22 مل من الوسائط المعدلة وراثيا.
- اسمح للخلايا بالتكاثر لمدة 2-4 أيام أخرى حتى تصل إلى التقاء كامل ، وتغيير GM في اليوم الثاني من الثقافة.
- لبدء التمايز الشادي ، قم بإزالة GM واستبدلها ب DM كامل لمدة 4 أيام (2 مل من DM كامل لكل بئر من صفيحة 6 آبار أو 22 مل لقارورة 175 سم2 ).
ملاحظة: استبدل ب DM كامل جديد في اليوم 2. - في اليوم 4 ، قم بإزالة DM الكامل واستبدله ب 2 مل DM أساسي مكمل ب 22.5 ميكرومتر من الأوليات و 15 ميكرومتر بالميتات و 12.5 ميكرومتر لينوليات لإعطاء تركيز إجمالي للأحماض الدهنية يبلغ 50 ميكرومتر لكل بئر من صفيحة 6 آبار أو 22 مل لقارورة 175 سم2 . استبدلها بالوسائط كل يومين لمدة 10 أيام أخرى.
ملاحظة: من اليوم 7 فصاعدا ، يجب أن تكون قطرات الدهون مرئية في الخلايا الشحمية المتمايزة. - في يوم الثقافة 14 ، اجمع الوسائط من الخلايا لعزل المركبات الكهربائية المشتقة من الخلايا الشحمية.
6. تحضير طافي لزراعة الخلايا لعزل الحويصلة خارج الخلية أو تخزينها وعزل الحويصلة خارج الخلية في المستقبل
- قم بإزالة المواد الطافية لزراعة الخلايا من كل طبق مكون من 6 آبار وامزجها. أضفه إلى أنبوب سعة 15 مل أو قم بإزالة جميع المواد الطافية لزراعة الخلايا من قارورة 175 سم2 وأضفها إلى أنبوب سعة 50 مل.
- جهاز طرد مركزي عند 1000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- صب الطاف في أنبوب جديد نظيف 15 مل أو 50 مل عن طريق الصب ، على التوالي.
- قم بإزالة برميل حقنة سعة 10 مل وقم بتوصيل مرشح حقنة 0.45 ميكرومتر.
- صب المادة الطافية في خزان الحقنة واضغط برفق على فتحة برميل المحقنة بإبهام أو راحة حتى يمر الطافي بحرية عبر الفلتر.
ملاحظة: يمكن أن تختلف سرعة خطوة الترشيح هذه حسب نوع مرشح المحقنة. - اجمع المرشح في أنبوب نظيف سعة 50 مل.
ملاحظة: إذا لزم الأمر، يمكن تخزين الوسائط المفلترة المكيفة في هذه المرحلة عند -80 درجة مئوية لعدة أسابيع. عند الحاجة ، قم بإذابة المواد الطافية لزراعة الخلايا عند 4 درجات مئوية وأجهزة الطرد المركزي عند 1000 × جم لمدة 10 دقائق عند 4 درجات مئوية. صب المادة الطافية في أنبوب نظيف عن طريق سكبها قبل الاستمرار في عزل المركبات الكهربائية.
7. عزل الحويصلات خارج الخلية
- قم بتسمية أنبوب طرد مركزي فائق سعة 13 مل عن طريق رسم دائرة في الجزء السفلي من الأنبوب ، حيث ستتشكل حبيبات EV المتوقعة وتحدد خطا حول عنق الأنبوب للتوجيه في دوار أنبوب الطرد المركزي الفائق. قم بتسمية الأنبوب بعينة من المعرف.
- ضع الأنبوب في حامل الأنبوب.
- قم بتوصيل إبرة 16 جم بحقنة سعة 10 مل وقم بإزالة برميل المحقنة.
- قم بإزالة الغطاء الواقي من الإبرة وأدخل الإبرة في عنق أنبوب الطرد المركزي الفائق.
- صب المادة الطافية لثقافة الخلية مباشرة في برميل المحقنة لملء أنبوب الطرد المركزي الفائق.
- قم بتعبئة الأنبوب ب PBS حسب الضرورة حتى ممتلئ.
ملاحظة: اسمح للأنبوب بالتدفق قليلا إذا لزم الأمر ، مع ضمان عدم وجود مساحات هوائية في أنبوب الطرد المركزي الفائق وعدم وجود فقاعات هواء. - أغلق أنبوب الطرد المركزي الفائق باستخدام مكواة لحام ، مع التأكد من أن الأنبوب محكم الإغلاق عن طريق الضغط على الأنبوب برفق.
- ضع أنابيب الطرد المركزي الفائق في دوار الطرد المركزي الفائق ؛ تأكد من أن الخط المحدد في الجزء العلوي من الأنبوب والدائرة المرسومة في قاعدة الأنبوب متجهة للخارج, حيث ستتشكل حبيبات EV.
- جهاز طرد مركزي فائق عند 120،000 × جم لمدة ساعتين عند 4 درجات مئوية.
- قم بإزالة الدوار بعناية من جهاز الطرد المركزي الفائق.
- قم بإزالة أنابيب الطرد المركزي الفائق من الدوار وضعها في حامل الأنبوب.
- قم بتوصيل إبرة 16 جم بحقنة سعة 10 مل.
- اثقب الجزء العلوي من أنبوب الطرد المركزي الفائق وأدخل الإبرة 2 سم في الجزء العلوي من الأنبوب وشفط المادة الطافية في المحقنة.
- صب هذا المطاف المستنفد من EV في أنبوب سعة 1.5 مل وقم بتجميده عند -80 درجة مئوية.
- أعد إدخال الإبرة في الأنبوب وشفط المادة الطافية المتبقية بعناية وتخلص منها.
- قطع الجزء العلوي من الأنبوب مع زوج من المقص.
- اسكب المادة الطافية المتبقية في إجراء واحد سريع.
- اترك الأنبوب يتدلى رأسا على عقب لمدة 1 دقيقة.
- جفف أي سائل يتشكل على الأنبوب بمنشفة ورقية.
- اقلب الأنبوب وضعه في حامل الأنبوب.
- أضف 100 ميكرولتر من PBS إلى الأنبوب.
- باستخدام طرف الماصة، قم بإزاحة حبيبات EV برفق عند قاعدة الأنبوب باستخدام حركة دائرية في المنطقة الموضحة في الخطوة 7.1.
- دوامة لفترة وجيزة (1-2 ثانية) ، مرتين.
- قم بتسمية أنبوب طرد مركزي فائق جديد سعة 13 مل عن طريق رسم دائرة في الجزء السفلي من الأنبوب ، حيث ستتشكل حبيبات EV المتوقعة وتحدد خطا حول عنق الأنبوب للتوجيه في دوار أنبوب الطرد المركزي الفائق. قم بتسمية الأنبوب بعينة من المعرف.
- ضع الأنبوب في حامل الأنبوب.
- أضف 12 مل من PBS إلى أنبوب طرد مركزي جديد باستخدام حقنة وإبرة نظيفة.
- باستخدام حقنة وإبرة ، اجمع عينة EV سعة 100 ميكرولتر وأضفها إلى الأنبوب. امزج المركبات الكهربائية و PBS بعناية واشطف المحقنة والإبرة عن طريق جمع PBS برفق والشفط في الأنبوب.
ملاحظة: تجنب تكوين الفقاعات. - أغلق أنبوب الطرد المركزي الفائق باستخدام مكواة لحام ، مع التأكد من أن الأنبوب محكم الإغلاق عن طريق الضغط على الأنبوب برفق.
- ضع أنابيب الطرد المركزي الفائق في دوار الطرد المركزي الفائق ؛ تأكد من أن الخط المحدد في الجزء العلوي من الأنبوب والدائرة المرسومة في قاعدة الأنبوب متجهة للخارج.
- جهاز طرد مركزي فائق عند 120،000 × جم لمدة ساعة واحدة عند 4 درجات مئوية.
- قم بإزالة الدوار بعناية من جهاز الطرد المركزي الفائق.
- قم بتوصيل إبرة 16 جم بحقنة سعة 12 مل.
- اخترق الجزء العلوي من أنبوب الطرد المركزي الفائق وأدخل الإبرة حتى 2 سم في الجزء العلوي من الأنبوب ؛ استنشق المادة الطافية في المحقنة وتخلص منها.
- قطع الجزء العلوي من الأنبوب مع زوج من المقص.
- اسكب المادة الطافية المتبقية في إجراء واحد سريع.
- اترك الأنبوب يتدلى رأسا على عقب لمدة 1 دقيقة.
- جفف أي سائل يتكون على حافة الأنبوب.
- ضع الأنبوب في حامل الأنبوب.
- أضف 100 ميكرولتر من PBS إلى الأنبوب.
- باستخدام طرف الماصة ، قم بإزاحة حبيبات EV برفق عند قاعدة الأنبوب باستخدام حركة دائرية في المنطقة الموضحة في الخطوة 7.24.
- دوامة لفترة وجيزة (1-2 ثانية) ، مرتين.
- ماصة 100 ميكرولتر من محلول PBS / EV في أنبوب نظيف سعة 1.5 مل والحفاظ على الثلج الرطب.
ملاحظة: EV جاهزة للمعالجة النهائية ويمكن تجميدها وتخزينها عند -80 درجة مئوية.
8. تحديد حجم وتركيز EV باستخدام تحليل تتبع الجسيمات النانوية (NTA)
- تجهيز النظام
ملاحظة: تم الإبلاغ عن طريقة مفصلة لاستخدام تحليل تتبع الجسيمات النانوية (NTA) لتحديد حجم وتركيز EV بواسطة Mehdiani et al.13.- قم بإذابة العينات واحتفظ بها عند 4 درجات مئوية.
- ابدأ تشغيل برنامج NTA بالنقر فوق رمز البرنامج.
- سيتم فتح البرنامج في "فحص الخلية" ويطالب بملء خلية التدفق بالماء منزوع الأيونات. املأ حقنة سعة 10 مل بالماء منزوع الأيونات وادفعها إلى الماكينة ، مما يضمن عدم مرور فقاعات الهواء إلى غرفة التحميل.
- اتبع التعليمات التي تظهر على الشاشة لإعداد النظام من خلال فحص الجودة (QC). سيقوم البرنامج بإجراء فحص للخلية وإعطاء مقياس لجودة الخلية. يجب أن يكون هذا جيدا جدا إلى ممتاز.
- تحضير مراقبة الجودة المكونة من حبات البوليسترين 100 نانومتر. الماصة 1 ميكرولتر من المعيار إلى 999 ميكرولتر من الماء منزوع الأيونات (مخزون مخفف). بعد ذلك ، أضف 10 ميكرولتر من المخزون المخفف إلى 2.5 مل من الماء منزوع الأيونات (عينة مراقبة الجودة). امزج المحلول عن طريق الدوامة برفق لمدة 2-3 ثوان وعن طريق سحب العينات.
ملاحظة: يجب تحضير عينات مراقبة الجودة طازجة كل يوم ، لكن عينة المخزون المخففة الأولية مستقرة لمدة أسبوع واحد عند 4 درجات مئوية. - املأ حقنة سعة 1 مل ب 1 مل من عينة مراقبة الجودة وقم بإزالة جميع فقاعات الهواء من المحقنة.
- قم بحقن، دون إدخال فقاعات الهواء، في غرفة تحميل عينة NTA عن طريق إمالة طرف المحقنة برفق في غرفة الحقن، مع دفع المكبس في نفس الوقت. حقن ما يصل إلى 950 ميكرولتر من عينة مراقبة الجودة في الغرفة.
ملاحظة: لا تدخل فقاعات الهواء في غرفة تحميل العينة. - انتظر حتى يقوم البرنامج بإجراء محاذاة تلقائية (لتركيز الكاميرا) ويتحقق من الجهد لقراءات إمكانات Z - يجب أن يكون الرسم البياني للجهد منحنى سلس على شكل حرف U.
ملاحظة: إذا كانت هناك رسالة خطأ "خطأ الجهد المنخفض جدا" ، فقد تكون الخلية مبللة من التنظيف أو غير آمنة أو قد تكون هناك فقاعة هواء. - بمجرد اكتمال فحص المحاذاة التلقائي/الجهد، استخدم القائمة المنسدلة لموضع الكاميرا للتحقق من جميع المواضع (0.1-0.9) بحثا عن علامات غير عادية - يشير وجودها إلى أن الخلية قد تحتاج إلى التنظيف و/أو التنظيف. بعد مراقبة الجودة ، سيعرض النظام "جاهز للقياسات".
- قم بتجهيز خلية التدفق باستخدام PBS. افتح علامة التبويب Pump / Temp وضمن Pump ، انقر فوق Run for pump 2 (خزان PBS). سيؤدي هذا إلى تشغيل PBS عبر الخلية لمدة 1 دقيقة ، ثم يتوقف تلقائيا.
ملاحظة: قد تكون هناك جزيئات في الغرفة ، ولكن يمكن إزالتها عن طريق دفع 10 مل من PBS عبر منفذ التحميل. - املأ حقنة سعة 10 مل ب PBS وقم بتحميلها في الغرفة بدون فقاعات هواء.
- قم بإنشاء بروتوكول للجهاز لتشغيله يقيس مواضع متعددة لليزر ومتوسط الجسيمات لكل إطار.
- تحقق من أن عدد الجسيمات أقل من 5 (أقرب ما يمكن إلى 0) قبل المتابعة - قم بتدفق المزيد من PBS ، إذا لزم الأمر.
- قبل التخفيف، امزج عينة EV عن طريق سحب العينات.
- خفف العينة 1: 1,000 في PBS واخلطها عن طريق سحب العينات. املأ حقنة سعة 1 مل بالعينة وقم بتحميلها في الغرفة بدون فقاعات هواء.
- تأكد من أن عدد الجسيمات ضمن النطاق المقبول (يجب أن يكون الشريط الموجود أعلى قيمة العد في المنطقة الخضراء أو بالقرب منها). إذا لم يكن الأمر كذلك ، فاضبط تخفيف العينة وفقا لذلك. بين العينات وتخفيفات العينة ، قم بتحميل 10 مل من PBS في مقدمة الماكينة لمسح الغرفة ، ثم قم بتحميل 1 مل من العينة المخففة.
ملاحظة: سيكون لكل عينة تخفيف مستقل بناء على تركيز العينة. يجب أن يتراوح عدد الجسيمات في الجهاز بين 50-200 جسيم لكل إطار لإجراء قياسات دقيقة. - انتقل إلى علامة التبويب "القياس" في البرنامج.
- انقر فوق الزر تشغيل الحصول على الفيديو .
- أدخل اسم عينة وحدد مجلد وجهة لحفظ القياس.
- إنشاء إجراء تشغيل قياسي للمركبات الكهربائية (SOP).
- قم بإنشاء > حفظ > قم بتحميل إجراء التشغيل القياسي للمركبات الكهربائية الذي سيقيس عدد الجسيمات وحجمها بسرعة غالق تبلغ 100 وحساسية الكاميرا 80 ، 11 وضعا للكاميرا لمدة دورتين.
ملاحظة: ما لم يكن للعينة متطلبات خاصة ، فلا داعي لتغيير هذه الإعدادات. - أدخل تخفيف العينة وأضف أي ملاحظات أخرى ترغب في إضافتها.
- انقر فوق "موافق " وسيبدأ البرنامج في التسجيل تلقائيا. بمجرد الانتهاء ، سيقوم البرنامج تلقائيا بتحميل جدول منبثق يعرض متوسط عدد الجسيمات وأحجامها لكل موضع للكاميرا.
ملاحظة: لا تلمس الماكينة أو أسطح العمل القريبة خلال هذا الوقت لأن الاهتزازات ستؤثر على القراءات النهائية. - سيتم استبعاد مواضع الكاميرا ذات القراءات غير العادية إحصائيا تلقائيا - لاستبعاد أي مواضع للكاميرا يدويا (أو إعادة تضمين مواضع المستبعدة لأي سبب من الأسباب) ، انقر فوق مربع الاختيار الموجود على يسار تفاصيل العينة.
- انقر فوق متابعة وسيقوم البرنامج بإنشاء وفتح ملف PDF للعينة مع نتائج الحجم والتركيز.
- قم بإنشاء > حفظ > قم بتحميل إجراء التشغيل القياسي للمركبات الكهربائية الذي سيقيس عدد الجسيمات وحجمها بسرعة غالق تبلغ 100 وحساسية الكاميرا 80 ، 11 وضعا للكاميرا لمدة دورتين.
- التحليل الإحصائي
- قم بتحليل بيانات NTA عن طريق ANOVA أحادي الاتجاه أو ثنائي الاتجاه باستخدام تصحيح Tukey اللاحق. رسم البيانات كمجموعة يعني ± الانحراف المعياري. واعتبرت قيمة P البالغة <0.05 ذات معنوية.
النتائج
حددنا كمية المركبات الكهربائية المعزولة من الخلايا الشحمية الألوية البشرية باتباع البروتوكول الموصوف. قمنا بحساب حجم وتركيز المركبات الكهربائية المشتقة من الخلايا الشحمية باستخدام NTA (الشكل 1 أ ، ب). استخدمنا ضوابط الوسائط الزائفة ، والتي كانت كميات متساوية من الوسائط التي لم تكن على اتصال بالخلايا ، ولكنها مستزرعة وتخضع لإجراء العزل الموصوف أعلاه. قمنا بقياس تركيز EV المشتق من الخلايا الشحمية بعد العزل الأولي وبعد غسل الخلايا الشحمية المعزولة EVs في PBS (الشكل 1 أ ، ب) ورسمت وسائل المجموعة ± الانحراف المعياري (SD) ، والتي تم تحليلها بواسطة ANOVA ثنائي الاتجاه مع تصحيح Tukey اللاحق.
تراوح تركيز المركبات الكهربائية المشتقة من الخلايا الشحمية التي حددتها NTA منالعزل الأول من 6.10 × 106 إلى 2.70 × 107 بمتوسط 2.60 × 107 EVs / مل (الشكل 1 أ ، ب). بعد غسل PBS ، كان هناك عدد أقل بكثير من المركبات الكهربائية المشتقة من الخلايا الشحمية لكل عينة (الشكل 1 أ ، ب) (ص < 0.001) ، والتي تراوحت من 5.00 × 105 إلى 4.30 × 106 بمتوسط 2.70 × 106 EVs / مل. لم تحتوي عناصر التحكم في الوسائط الزائفة على مركبات كهربائية على النحو الذي تحدده NTA (الشكل 1 أ ، ب). كان الحجم المشروط للمركبات الكهربائية من العزل الأول 125 نانومتر و 105 نانومتر بعد غسل PBS (الشكل 1 أ ، ب). تم تطبيق البروتوكول الموصوف أيضا على الخلايا الشحمية المشتقة من البطن والألوية من قوارير T175 سم2 أكبر. تراوحت عينات المركبات الكهربائية الألوية هذه المشتقة من قوارير T175 سم2 في التركيز من 3.60 × 107 إلى 7.50 × 107 / مل بمتوسط 5.40 × 107 EVs / مل. تراوحت المركبات الكهربائية المشتقة من الخلايا الشحمية في البطن من T175 سم2 قارورة في التركيز من 6.30 × 107 إلى 8.60 × 107 / مل بمتوسط 7.60 × 107 EVs / مل (الشكل 1 ج ، د). كان الحجم المشروط للمركبات الكهربائية المشتقة من قوارير T175 سم2 115 نانومتر للمركبات الكهربائية الألوية و 125 نانومتر للمركبات الكهربائية البطنية. أكدنا وجود بروتين EV في EVs المشتقة من الألوية والبطن عن طريق النشاف المناعي لجين الحساسية للورم 101 (TSG101) ووجدنا أن كريات الخلايا الشحمية البطنية والألوية والمركبات الكهربائية المشتقة من الخلايا الشحمية البطنية والألوية كانت إيجابية ل TSG101 ، في حين أن وسائط التحكم الزائفة ، التي لم تكن على اتصال بالخلايا كانت سلبية (الشكل 1E).
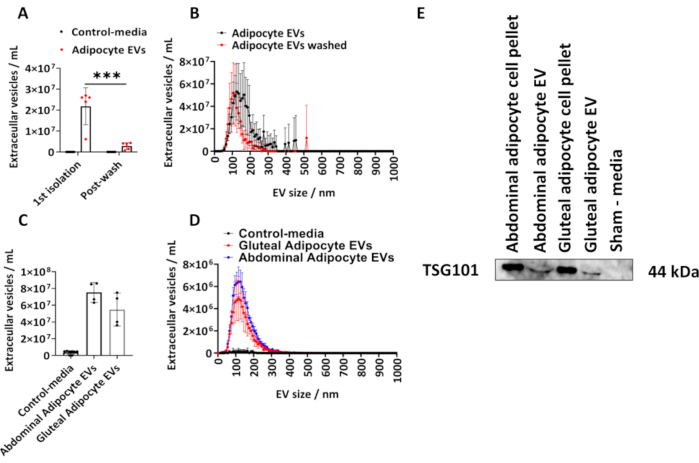
الشكل 1: حجم وتوزيع المركبات الكهربائية المشتقة من الخلايا الشحمية من وسائط زراعة الخلايا وتحديد بروتين EV TSG101. إجمالي تركيزات EV وملامح توزيع الحجم والتركيز على النحو الذي يحدده تحليل تتبع الجسيمات النانوية (NTA)من العزل الأول (N = 5) وبعد الغسيل باستخدام PBS (N = 6). (ج) إجمالي التركيزات و (د) الحجم وتوزيع التركيز التي تحددها NTA للمركبات الكهربائية المشتقة من البطن والألوية من قوارير T175 سم2 (N = 4 لكل مجموعة). (ه) اللطخة الغربية للمركبات الكهربائية المشتقة من الألوية والبطن ل TSG101. تم استخدام كريات الخلايا والوسائط الوهمية كعناصر تحكم إيجابية وسلبية ، على التوالي. البيانات هي مجموعة تعني ± الانحراف المعياري (SD). ANOVA أحادي الاتجاه أو ثنائي الاتجاه مع تصحيح Tukey اللاحق. P < 0.001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نعرض بروتوكولا لعزل المركبات الكهربائية المشتقة من الخلايا الشحمية والألوية والبطن عن المواد الطافية لزراعة الخلايا وتحديد حجمها وتركيزها بواسطة NTA7،14،15. نظهر أن الخلايا الشحمية البشرية المستزرعة تنتج وتطلق المركبات الكهربائية في وسط زراعة الخلايا ، والتي يمكن عزلها لاحقا باستخدام الترشيح والطرد المركزي الفائق. حددنا حجم وتركيز المركبات الكهربائية المعزولة المشتقة من الخلايا الشحمية وأظهرنا أن الطرد المركزي الفائق من المحتمل أن يكون الملوثات المعزولة من وسط زراعة الخلايا وأن غسل كريات EV المعزولة في PBS يقلل بشكل كبير من تركيزها في قياس NTA الثاني. حددنا كذلك نقاء المركبات الكهربائية المعزولة المشتقة من الألوية والبطن عن طريق النشاف الغربي ل TSG101 علامة EV. كانت مستحضرات EV المشتقة من الألوية والبطن إيجابية ل TSG101 ، ولكن الأهم من ذلك ، كان هذا غائبا في وسائط التحكم التي لم تتعرض للخلايا. استخدمت التجارب المقدمة الخلايا الشحمية البشرية كخلية أم تولد EVs ، لكن الطريقة الموصوفة مناسبة لأنواع الخلايا الأخرى ، بما في ذلك الخلايا البطانية ، والعضلات الملساء الوعائية ، والعضلات الهيكلية ، والخلايا المناعية ، وعزل المركبات الكهربائية من البلازما أو المصل الضعيف للصفائح الدموية.
ترتفع المركبات الكهربائية المشتقة من الخلايا الشحمية في أمراض التمثيل الغذائي وتحديد التغيرات في حجم وعدد الخلايا الشحمية EVs في الجسم الحي أمر معقد لأن السوائل البيولوجية مثل الدم تحتوي على EVs من عدد من مصادر الخلايا المتورطة أيضا في التسبب في مرض التمثيل الغذائي ، بما في ذلك EVs من الخلايا البطانية والعضلات الهيكلية وكريات الدم الحمراء والخلايا المناعية. تسمح الطريقة الموضحة هنا بتحديد الخلايا الشحمية البشرية EVs ، والتي قد توفر نموذجا مفيدا للدراسات الميكانيكية التي تبحث في العوامل التي تؤدي إلى التكوين الحيوي للمركبات الكهربائية في الخلايا الشحمية ، وهو أمر غير معروف حاليا. الأهم من ذلك ، أن تحديد التكوين الحيوي للخلايا الشحمية EV وكيفية تنسيق تحميل RNAs والبروتينات والمستقلبات في الخلايا الشحمية قد يكشف عن فرص علاجية جديدة لإزعاج إشارات الخلايا الشحمية المسببة للأمراض EV في الخلل الأيضي. ستوفر الدراسات التفصيلية فهما أفضل لكيفية تغيير حجم EV وعددها ومسار التكوين الحيوي وشحنة EV (الحمض النووي الريبي والبروتينات والمستقلبات) استجابة للأمراض أو المحفزات مثل الاضطرابات في الأكسجين والجلوكوز والدهون والأنسولين. قد تكشف المعلومات حول دور العوامل البيئية في إشارات الخلايا الشحمية EV في أمراض التمثيل الغذائي وكيف تساهم المركبات الكهربائية المشتقة من الخلايا الشحمية في التهاب الأنسجة الدهنية عن أهداف علاجية جديدة في أمراض التمثيل الغذائي.
القيود
الجيل في المختبر من المركبات الكهربائية المشتقة من الخلايا الشحمية
يوفر استخدام الخلايا الشحمية البشرية في المختبر نظاما نموذجيا لدراسة إطلاق وتوليد المركبات الكهربائية المشتقة من الخلايا الشحمية بعد تمايز الخلايا الشحمية في المختبر ولكن هناك عددا من القيود. على وجه الخصوص ، من المحتمل أن تختلف الخلايا الشحمية المشتقة في المختبر عن المركبات الكهربائية المشتقة من الدهون المسترجعة من السوائل الحيوية ، مثل البلازما14 في حجمها وتركيزها وبروتين EV و -RNA و -مستقلبات ووظيفتها. يمكن أن تتأثر هذه الاختلافات في EV بالخلايا الأخرى غير الشحمية الموجودة في الأنسجة الدهنية في الجسم الحي ، مثل الخلايا الجذعية المشتقة من الأنسجة الدهنية والخلايا البطانية والضامة ، والتي ترتبط ارتباطا وثيقا بفسيولوجيا الأنسجة الدهنية وأظهرت أدوارا في أمراض الأنسجة الدهنية ، بما في ذلك التهاب الأنسجة الدهنية.
تجدر الإشارة إلى أن بروتوكول التمايز في المختبر لمدة أسبوعين الموصوف هنا قد لا يكون كافيا لتوليد خلايا شحمية ناضجة تماما مكافئة لتلك التي شوهدت في الجسم الحي. في المختبر ، تظهر الخلايا الشحمية المتمايزة المزروعة بتنسيق ثنائي الأبعاد (2D) مورفولوجيا مختلفة عن الخلايا في الجسم الحي ولا تطور قطرات دهنية أحادية الموضع. علاوة على ذلك ، يتم الحصول على الخلايا الشحمية الموضحة في هذا البروتوكول من الجزء اللحمي الوعائي الدهني ولم نقم بتقييم المساهمة في تجمع EV من أنواع الخلايا الأخرى التي لم يتم التخلص منها تماما أثناء عزل الخلية.
قد يؤثر فقدان التفاعلات المهمة من خلية إلى خلية للخلايا الشحمية مع الخلايا الشحمية الأخرى غير الشحمية في الأنسجة الدهنية على توليد الخلايا الشحمية EV ، وإطلاقها ، وبروتين EV و EV-RNA من الخلايا الشحمية ، والخلايا الجذعية المشتقة من الأنسجة الدهنية16. ومع ذلك ، لم يتم إجراء تقييم شامل لكيفية اختلاف الخلايا الشحمية المشتقة في المختبر عن تلك التي يتم إنتاجها في الجسم الحي بشكل شامل.
تحتوي خزعات الأنسجة الأولية على دم ، وبالتالي قد تحتوي مزارع الخلايا المشتقة على كريات الدم الحمراء والمركبات الكهربائية المشتقة من كريات الدم الحمراء بغض النظر عن عمليات الغسيل المتعددة وتغييرات الوسائط الموضحة في بروتوكولنا. قد تكون خطوة تحلل خلايا الدم الحمراء الإضافية بعد عزل الجزء اللحمي الوعائي ضرورية للقضاء على آثار كريات الدم الحمراء على الخلايا الشحمية. هذا مهم لأن المركبات الكهربائية المشتقة من كريات الدم الحمراء يمكن أن تؤثر على الوظيفة الخلوية للخلايا الأخرى17 والمركبات الكهربائية المشتقة من كريات الدم الحمراء مرتفعة في وجود الإجهاد التأكسدي18 وفي المرضى الذين يعانون من متلازمة التمثيل الغذائي19،20. لذلك ، قد تحتوي الأنسجة الدهنية المشتقة من مرضى التمثيل الغذائي على مستويات مرتفعة من المركبات الكهربائية المشتقة من كريات الدم الحمراء ، والتي قد تؤثر على النمط الظاهري في المختبر للخلايا الشحمية.
القضاء على FBS
استخدم البروتوكول الموصوف FBS في وسائط النمو أثناء التمايز الشحمي ولكن بعد ذلك خضعت الخلايا الشحمية لتغييرات متعددة في الوسائط قبل مجموعة الوسائط النهائية لعزل المركبات الكهربائية المشتقة من الخلايا الشحمية. لذلك ، افترضنا أن الخطر الإجمالي لتلوث المركبات الكهربائية المشتقة من FBS في مستحضرات المركبات الكهربائية منخفضا وأكدنا لاحقا أن المركبات الكهربائية المتبقية لم تكن موجودة في وسط زراعة الخلايا عن طريق النشاف الغربي ل TSG101. يجب أن يستخدم عزل المركبات الكهربائية المستزرعة بالخلايا عن مصادر الخلايا التي تتطلب FBS FBS المستنفد من EV أو EVs البقرية المستنفدة من خلال الطرد المركزي الفائق لمنع المركبات الكهربائية البقرية المربكة بين الخلايا الشحمية وتحليل شحنات الخلايا الشحمية EV. من المعروف أن استنفاد المصل من الخلايا الشحمية يغير استجاباتها الخلوية21 ، وبالتالي يجب أن يضمن التحقيق أن استنفاد المصل أو استنفاد EV من المصل يجعل ثقافات الخلايا الشحمية ممثلة حقا لبيولوجيا الخلايا الشحمية.
القيود الفنية لعزل المركبات الكهربائية باستخدام الترشيح والطرد المركزي الفائق
نصف طريقة الطرد المركزي الفائق باستخدام أنابيب بلاستيكية ذات استخدام واحد تتطلب إحكاما قبل الطرد المركزي الفائق لعزل المركبات الكهربائية. نحن ندرك أن هذه الأنابيب المختومة ذات الاستخدام الواحد قد لا تكون خيارا اقتصاديا للعديد من الأفراد ونقترح استكشاف أنابيب مماثلة ، والتي لا تتطلب إحكاما وقابلة لإعادة الاستخدام. ومع ذلك ، يجب على الباحثين التأكد من أن غسل الأنابيب القابلة لإعادة الاستخدام كاف ولا يؤدي إلى تراكم تدريجي للبروتين والدهون وملوثات الحمض النووي الريبي بمرور الوقت ، مما قد يؤثر على التحقيقات النهائية للشحنات المرتبطة بالمركبات الكهربائية أو التأثير على دراسات الوظائف الخلوية.
تم استخدام بروتوكول الترشيح والطرد المركزي الفائق الموصوف هنا لسنوات عديدة وقد سلطت دراسات متعددة الضوء على السقوط القصير لهذه الطريقة ، بما في ذلك العزلات غير المحددة للمكونات الخلوية الملوثة مثل الميتوكوندريا الخلوية ، ووجود شظايا نووية ، ومكونات غشاء الخلية. علاوة على ذلك ، فإن الطريقة الموضحة هنا ستشارك في عزل البروتينات الدهنية الموجودة في FBS المستنفد من EV. يمكن تطوير الطريقة هنا بشكل أكبر عن طريق استخدام الكثافة والطرد المركزي الفائق وكروماتوغرافيا استبعاد الحجم (SEC) للقضاء على البروتينات القابلة للذوبان الملوثة وبعض البروتينات الدهنية. إلى جانب غسل PBS للمركبات الكهربائية المعزولة و SEC ، يمكن الحد من الملوثات المعزولة بشكل مشترك ولكن لا يمكن التخلص منها تماما. لذلك ، يجب على المستخدمين التأكد من تضمين الضوابط المناسبة ، بما في ذلك الوسائط الزائفة التي لم تكن على اتصال بالخلايا لحساب البروتينات والبروتينات الدهنية القابلة للذوبان في وسط الثقافة والتحكم في المواد الطافية المستنفدة من EV لإثبات العزل الناجح للمركبات الكهربائية عن الوسائط المكيفة التي لا تزال تحتوي على البروتينات والبروتينات الدهنية القابلة للذوبان.
يعتمد عزل المركبات الكهربائية باستخدام الترشيح والطرد المركزي الفائق على ضمان المشغل لعدم تطبيق ضغط غير مبرر على المواد الطافية لزراعة الخلايا أثناء تمريرها عبر تجويف المرشح أو تجويف الإبرة / المحقنة. قد يؤدي تطبيق القوة غير المبررة خلال هذه المرحلة من البروتوكول الموصوف إلى تمزق المركبات الكهربائية ، والتأثير على التركيزات النهائية للمركبات الكهربائية وتوليد الحمض النووي الريبي والبروتينات والمستقلبات الحرة ، والتي كانت مغلفة في المركبات الكهربائية ذات مرة. لقد وصفنا طريقة هنا ، والتي لا تتطلب برميل المحقنة وبالتالي تطبيق القوة على المركبات الكهربائية في وسائط مكيفة أثناء مرورها عبر المرشح أو الإبرة إلى خزانات التجميع وأنابيب الطرد المركزي الفائق. ومع ذلك ، يجب توخي مزيد من الحذر عند تعليق حبيبات EV في PBS. يجب استخدام دوامة قصيرة فقط ، لأن الدوامة القوية قد تعطل أغشية EV.
بعد الطرد المركزي الفائق ، يجب على المشغلين توخي الحذر مع أنابيب الطرد المركزي الفائق حتى لا تزعج حبيبات EV. يمكن تحقيق ذلك عن طريق التعامل مع الأنابيب بعناية وتحريكها ببطء بين دوار الطرد المركزي الفائق ورف الأنبوب. يجب توخي مزيد من الحذر عند ثقب ثقب في الجزء العلوي من أنبوب الطرد المركزي الفائق لشفط المواد الطفية المستنفدة من EV. سيؤدي إدخال الإبرة في الجزء العلوي من الأنبوب وشفط المواد الطافية بسرعة إلى إنشاء فراغ في برميل المحقنة ، مما قد يجبر المادة الطافية بعنف على العودة إلى أنبوب الطرد المركزي الفائق وتعطيل حبيبات EV. بعد قطع أنبوب الطرد المركزي الفائق لصب المادة الطافية المتبقية ، يجب توخي الحذر لأن حبيبات EV قد تصبح فضفاضة وسيؤدي الصب إلى التخلص من حبيبات EV. بدلا من ذلك ، يمكن استخدام حقنة وإبرة لإزالة المادة الطافية المتبقية ببطء دون صب الأنبوب أو قلبه.
يعد الترشيح والطرد المركزي الفائق للمواد الطافية لعزل المركبات الكهربائية طريقة مفيدة وفعالة. لكنها عرضة للعزل المشترك للبروتينات الدهنية والبروتينات القابلة للذوبان. يمكن التخفيف من حدتها عن طريق غسل المركبات الكهربائية باستخدام PBS (كما هو موضح) ، لكن هذا لن يقضي على جميع الملوثات. يمكن التخلص من البروتينات القابلة للذوبان من جزء EV باستخدام SEC ، ومع ذلك ، فإن هذه الطريقة لا تميز بين البروتينات الدهنية والمركبات الكهربائية. يمكن دمج مخروطات SEC التي تحتوي على EVs مع الطرد المركزي الفائق إلى المركبات الكهربائية الحبيباتية. يعد الترشيح والطرد المركزي التفاضلي طريقة مفضلة لعزل EV على تقنيات الترسيب ، والتي تستخدم البولي إيثيلين جلايكول لأن طرق الترسيب هذه تشارك في عزل كميات كبيرة من البروتينات القابلة للذوبان والبروتينات الدهنية في المواد الطافية لزراعة الخلايا والسوائل البيولوجية الأخرى. من المرجح أن يظل الطرد المركزي الفائق هو الشكل الأكثر سهولة لعزل المركبات الكهربائية بالنسبة للكثيرين لأن معظم المختبرات مجهزة بجهاز طرد مركزي فائق ، وبالتالي يخفف من تكاليف بدء التشغيل الأولية. ولكن بالنسبة للكثيرين ، فإن الطرد المركزي الفائق لعزل المركبات الكهربائية يعيقه حجم أنابيب الطرد المركزي الفائق وحجم البداية للمواد. قد تكون هناك حاجة إلى عدة مئات من المليلتر من المواد الطافية المزروعة لإنتاج كمية كافية من المركبات الكهربائية للبروتينات النهائية أو تسلسل الحمض النووي الريبي. ومع ذلك ، فمن المحتمل أن تكون تقنيات الطرد المركزي الفائق لعزل المركبات الكهربائية مصحوبة بتقنيات أخرى مثل SEC والتقاط التقارب المناعي باستخدام رباعي السبانين CD9 و CD63 و CD81 لتحسين نقاء المركبات الكهربائية المعزولة. قد تكون التقنيات الأخرى مثل محاليل الترسيب المتاحة تجاريا وقياس التدفق الخلوي ذات فائدة في تحقيقات محددة.
نقاء مستحضرات المركبات الكهربائية
لقد أكدنا عزل المركبات الكهربائية المشتقة من الخلايا الشحمية عن طريق النشاف الغربي ل TSG101 ، لكن هذه اللطخة الغربية المفردة لا ترقى إلى مستوى الإرشادات التي نشرتها الجمعية الدولية للحويصلات خارج الخلية (ISEV). سيكون التوصيف الإضافي لهذه المركبات الكهربائية المشتقة من الخلايا الشحمية مثاليا باستخدام التتراسبانين CD9 و CD63 و CD81 لتحديد الإكسوسومات وعلامات التلوث الخلوي مثل هيستون H3 والألبومين وبروتين شحمي A1.
يسمح البروتوكول المقدم هنا بعزل المركبات الكهربائية عن المواد الطافية لزراعة الخلايا من مجموعة من مصادر الخلايا بما في ذلك الخلايا الشحمية لتحديد حجم EV وتركيزه وعلامات EV بواسطة اللطخة الغربية والمنفعة في التقنيات القائمة على omics مثل البروتينات وتسلسل الحمض النووي الريبي.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
إن إيه وآر سي يعترفان بالدعم من خلال المنح البحثية من مؤسسة القلب البريطانية ، مركز التميز البحثي ، أكسفورد (NA و R.C. ؛ RE/13/1/30181 و RE/18/3/34214) ، منحة مشروع مؤسسة القلب البريطانية (NA و R.C. ؛ PG / 18/53/33895) ، واتحاد التمثيل الغذائي المناعي الثلاثي ، ومؤسسة نوفو نورديسك (NNF15CC0018486) ، والمعهد الوطني للبحوث الصحية (NIHR) ، ومركز أكسفورد للبحوث الطبية الحيوية (BRC) ، ومؤسسة نوفيلد للدعم الاستراتيجي للطب ، وصندوق الدعم الاستراتيجي المؤسسي Wellcome (ISSF). الآراء المعبر عنها هي آراء المؤلف (المؤلفين) وليس بالضرورة آراء NHS أو NIHR أو وزارة الصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
References
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677 (2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974 (2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252 (2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313 (2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -. S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved