Method Article
Isolamento e Caracterização de Vesículas Extracelulares Derivadas de Adipócitos Humanos usando Filtração e Ultracentrifugação
Neste Artigo
Resumo
Descrevemos o isolamento de vesículas extracelulares (EVs) derivadas de adipócitos humanos do tecido adiposo glúteo e abdominal usando filtração e ultracentrifugação. Caracterizamos os EVs derivados de adipócitos isolados determinando seu tamanho e concentração por Análise de Rastreamento de Nanopartículas e por western blotting para a presença do gene de suscetibilidade tumoral da proteína EV 101 (TSG101).
Resumo
As vesículas extracelulares (EVs) são envelopes lipídicos fechados que carregam material biologicamente ativo, como proteínas, RNA, metabólitos e lipídios. As EVs podem modular o estado celular de outras células localmente em microambientes teciduais ou por meio da liberação no sangue periférico. As EVs derivadas de adipócitos são elevadas no sangue periférico e apresentam alterações em sua carga (RNA e proteína) durante distúrbios metabólicos, incluindo obesidade e diabetes. As EVs derivadas de adipócitos podem regular o estado celular das células vasculares vizinhas, como células endoteliais e macrófagos residentes no tecido adiposo, para promover a inflamação do tecido adiposo. A investigação de alterações em EVs derivadas de adipócitos in vivo é complexa porque as EVs derivadas do sangue periférico são altamente heterogêneas e contêm EVs de outras fontes, como plaquetas, células endoteliais, eritrócitos e músculos. Portanto, a cultura de adipócitos humanos fornece um sistema modelo para o estudo de EVs derivados de adipócitos. Aqui, fornecemos um protocolo detalhado para a extração de pequenos EVs totais de meios de cultura de células de adipócitos glúteos e abdominais humanos usando filtração e ultracentrifugação. Demonstramos ainda o uso da Análise de Rastreamento de Nanopartículas (NTA) para quantificação do tamanho e concentração de EV e mostramos a presença do gene de suscetibilidade tumoral de proteína EV 101 (TSG101) nos EVs derivados de adipócitos glúteos e abdominais. EVs isolados deste protocolo podem ser usados para análise downstream, incluindo microscopia eletrônica de transmissão, proteômica, metabolômica, sequenciamento de RNA pequeno, microarrays e podem ser utilizados em estudos funcionais in vitro / in vivo.
Introdução
As vesículas extracelulares (EVs) são envelopes lipídicos fechados que carregam material biologicamente ativo, como proteínas, microRNAs, metabólitos e lipídios. O termo EVs denota várias subpopulações, que incluem exossomos, microvesículas (micropartículas/ectossomos) e corpos apoptóticos1. Os EVs podem servir como biomarcadores porque estão implicados na sinalização patológica e liberados em biofluidos, incluindo sangue e urina. Os EVs podem modular o estado celular de outras células localmente em microambientes teciduais ou por meio da liberação no sangue periférico2. As EVs apresentam características de sua célula-mãe, mas a diferenciação de cada subpopulação é baseada principalmente no tamanho da EV e no conteúdo de proteínas, como marcadores de EVs, incluindo a presença de tetraspaninas (CD9, CD63 e CD81), gene de suscetibilidade tumoral 101 (TSG101) e proteína X de interação ALG-2 (ALIX). Esses marcadores proteicos são representativos da origem endossômica (CD9, CD63 e CD81) para exossomos, que são gerados dentro de corpos multivesiculares ou representam proteínas associadas a brotamento ou bolhas diretamente da membrana plasmática para microvesículas. No entanto, há uma sobreposição significativa entre essas subpopulações e é difícil distinguir subpopulações individuais em biofluidos complexos, como plasma, soro ou urina.
Distúrbios metabólicos, incluindo obesidade, resistência à insulina e perturbações na glicose extracelular, oxigênio e inflamação, podem alterar o tamanho e a concentração de EVs e sua carga. As EVs derivadas de adipócitos carregam perilipina A, adiponectina e apresentam alterações em sua carga de proteínas e RNA durante a obesidade e diabetes 3,4,5,6. As EVs derivadas de adipócitos regulam o estado celular das células endoteliais vasculares vizinhas7 e dos macrófagos residentes no tecido adiposo para promover a inflamação do tecido adiposo e a resistência à insulina 8,9,10,11. A investigação de alterações em EVs derivadas de adipócitos in vivo é complexa porque as populações de EV derivadas de biofluidos complexos, como plasma, soro ou urina, contêm EVs de várias fontes, como plaquetas, células endoteliais, eritrócitos e músculos, que estão implicados na patogênese da disfunção metabólica e da doença.
A cultura e a diferenciação in vitro de pré-adipócitos humanos, portanto, fornecem um sistema modelo para o estudo de EVs derivados de adipócitos. Aqui, fornecemos um protocolo detalhado para a extração de pequenos EVs totais de meios de cultura de células de adipócitos humanos usando filtração por seringa e ultracentrifugação. A ultracentrifugação continua sendo um método popular de isolamento para EVs porque é facilmente acessível e requer pouco conhecimento especializado prévio. No entanto, outros métodos, como precipitação, cromatografia de exclusão de tamanho e captura de imunoafinidade usando tetraspaninas, permitem o isolamento de EV de uma variedade de biofluidos, incluindo plasma, soro, urina e meios de cultura de células condicionados. Cada método, incluindo o protocolo de ultracentrifugação descrito aqui, produz preparações EV de pureza variável porque os métodos podem co-isolar proteínas solúveis e lipoproteínas, que podem mascarar como EVs. A combinação deste protocolo de ultracentrifugação com outros métodos, como centrifugação por densidade, cromatografia de exclusão de tamanho e captura de imunoafinidade, aumenta drasticamente a pureza dos EVs isolados. Mas, semelhante à ultracentrifugação, esses outros métodos não permitem a captura de subpopulações independentes de EVs de amostras complexas, como sangue, plasma e urina. Portanto, as culturas de populações de células selecionadas continuam sendo um dos métodos mais robustos para gerar altos rendimentos de EVs específicos para células. Cada método EV tem uma série de ressalvas e a escolha do método pode afetar os tipos de EVs isolados e suas concentrações, o que pode influenciar as investigações mecanicistas a jusante na sinalização celular e tecidual e na determinação da carga EV para estudos diagnósticos; essas questões metodológicas do isolamento do VE são discutidas em outro lugar e nas seções de limitações abaixo 4,12. Aqui, descrevemos o isolamento de EVs derivados de adipócitos humanos usando filtração e ultracentrifugação. Demonstramos ainda o uso da Análise de Rastreamento de Nanopartículas (NTA) para quantificação do tamanho e concentração de EV e mostramos a presença do gene de suscetibilidade tumoral de proteína EV 101 (TSG101) em nossos EVs derivados de adipócitos humanos. EVs isolados deste protocolo podem ser usados para análise downstream, incluindo microscopia eletrônica de transmissão, proteômica, metabolômica, sequenciamento de RNA pequeno, microarray e podem ser utilizados em estudos funcionais in vitro/in vivo.
Protocolo
Todos os métodos foram aprovados pelo conselho de revisão de ética institucional da Universidade de Oxford. O tecido adiposo foi obtido por biópsia por agulha sob anestesia local de voluntários saudáveis.
1. Preparação do meio de cultura celular e tampões
- Prepare um tampão de digestão da colagenase dissolvendo a colagenase H (1 mg / mL) em solução salina balanceada de Hanks (HBSS) (sem cloreto de cálcio e sem cloreto de magnésio) e filtro estéril usando um filtro de seringa de poros de 0,2 μm.
- Prepare o tampão de digestão da colagenase no máximo 10 minutos antes de usar.
- Prepare o meio de crescimento (GM) da seguinte forma: Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 (DMEM/F12) suplementado com 10% de soro fetal bovino (FBS), 100 unidades/mL de penicilina, 100 μg/mL de estreptomicina, 2 mM de L-glutamina e 0,5 ng/mL de fator de crescimento de fibroblastos (FGF).
- Prepare o meio de diferenciação básico (DM básico) da seguinte forma: DMEM/F12 suplementado com 100 unidades/mL de penicilina, 100 μg/mL de estreptomicina, 2 mM de L-glutamina, 17 μM de pantotenato, 100 nM de insulina humana, 10 nM de triiodo-L-tireonina, 33 μM de biotina, 10 μg/mL de transferrina e 1 μM de dexametasona.
- Preparar o meio de diferenciação completo (MS completo) suplementando o MS básico do passo 1.3 com 0,25 mM de 3-isobutil-1-metilxantina e 4 μM de troglitazona.
- Preparar 10 mM de soluções de reserva de ácidos gordos complexadas com 10% de albumina de soro bovino (BSA) essencialmente isenta de ácidos gordos do seguinte modo:
- Dissolver 16 g de BSA em 160 ml de meio DMEM/F12 e aquecer a 37 °C. Em três tubos cônicos separados de 50 mL, pesar 150 mg de oleato de sódio, 139 mg de palmitato de sódio e 151 mg de linoleato de sódio. Adicione 50 mL da solução BSA aquecida a cada tubo e misture bem por vórtice repetido.
- Retorne os tubos de oleato e linoleato ao banho-maria a 37 °C por 15 min. Misture por vórtice até dissolver completamente.
- Para a solução de palmitato, coloque o tubo em banho-maria a 65 °C por 2-3 min. Misture vigorosamente por vórtice.
- Repita o passo 1.5.3 até dissolver completamente - aproximadamente 30 min.
NOTA: Algumas partículas pequenas ainda podem estar visíveis. - Filtrar as soluções de ácidos gordos com um filtro de seringa de poros de 0,2 μm.
- Confirmar a concentração de ácidos gordos não esterificados de cada solução-mãe utilizando um ensaio adequado.
NOTA: Os estoques de ácidos graxos devem ser de 10 mM (±10%) para obter uma proporção molar de 6:1 entre ácidos graxos e BSA. Se a concentração estiver fora deste intervalo, a solução-mãe deve ser refeita. As soluções de reserva podem ser aliquotadas e armazenadas a -30 °C.
2. Digestão de biópsias de tecido adiposo humano
- Coe lentamente o conteúdo da seringa de biópsia através de um filtro de células estéreis de 200 μm conectado a um tubo cônico de 50 mL para que o tecido adiposo seja coletado no filtro.
- Transfira o filtro para um novo tubo cônico de 50 mL e lave o tecido adiposo três vezes com 10 mL de HBSS.
NOTA: Pode ser necessário remover coágulos sanguíneos e tecido fibroso com tesoura cirúrgica ou repetir a lavagem HBSS para remover o excesso de glóbulos vermelhos. - Pese o lenço lavado.
NOTA: Normalmente obtemos 400-800 mg de tecido por biópsia por agulha. - Coloque o tampão de digestão da colagenase em um tubo cônico estéril de 50 mL e adicione o tecido lavado. Tesouras cirúrgicas podem ser usadas nesta etapa para picar o tecido em pedaços de tamanhos iguais.
NOTA: Use 5 mL de tampão por 0,5 g de tecido. Para tecidos maiores, as amostras podem ser picadas em uma placa de Petri. - Coloque o tubo em um banho-maria agitado a 37 °C e incube por 35-40 min.
NOTA: Após a digestão bem-sucedida, a solução deve parecer leitosa. Se pequenos pedaços de tecido ainda estiverem visíveis, agite com a mão por mais 10-20 s.
3. Isolamento de pré-adipócitos
- Para granular a fração de pré-adipócitos, centrifugue a 1.000 x g por 5 min.
- Aspire e descarte a camada de adipócitos flutuante e o sobrenadante, deixando aproximadamente 1 mL de HBSS cobrindo o pellet celular.
- Ressuspenda o pellet em 5 mL de HBSS e passe a suspensão celular por uma malha de poros de 250 μm seguida por uma malha de 100 μm para remover qualquer material não digerido. Recolha a suspensão celular num tubo cónico de 15 ml.
- Centrifugue a 1.000 x g por 5 min.
NOTA: Após esta etapa, a fração de pré-adipócitos pode ser tratada com uma solução de lise de glóbulos vermelhos se a contaminação dos glóbulos vermelhos for um problema. - Aspire e descarte o sobrenadante.
- Ressuspender o sedimento celular em 5 ml de GM (passo 1.2) e semear para um balão de cultura de tecidos aderente de 25 cm2 . Colocar o balão numa estufa de cultura de células (CO2 a 5%, 37 °C).
4. Manutenção de culturas de pré-adipócitos
- Substitua o GM a cada 2 dias enquanto as células estão proliferando
NOTA: As taxas de proliferação celular podem variar entre os doadores.- Quando as células atingirem aproximadamente 80% de confluência, transfira-as para um balão de cultura de tecidos aderente de 75 cm2 . Remova o GM e lave as células com solução salina tamponada com fosfato (PBS).
- Descarte o PBS e adicione 0,5 mL de enzimas de dissociação celular altamente purificadas para dissociar as células ligadas. Incubar a 37 °C durante 5 min.
- Bata forte no frasco para liberar as células e adicione 5 mL de GM. Colete a suspensão celular em um tubo cônico de 15 mL.
- Centrifugue a 1.000 x g por 5 min.
- Aspire e descarte o sobrenadante. Ressuspender o sedimento celular em 5 ml de GM e transferir para um balão de 75 cm2 . Completar o GM até um volume final de 12 ml e substituir o balão na incubadora de cultura celular (CO2 a 5%, 37 °C).
NOTA: Para manter as células, continue a trocar o GM a cada 2-3 dias. Quando as células atingirem 80% de confluência, repita as etapas 4.2-4.3 e divida as células 1:3 em novos frascos de 75 cm2 . Isso pode ser repetido por várias passagens até que um número suficiente de células tenha sido gerado para a configuração experimental. Não recomendamos mais de 10 passagens, pois a capacidade de proliferação e diferenciação dos pré-adipócitos diminui.
5. Semeando pré-adipócitos para diferenciação adipogênica
- Conte as células usando um hemocitômetro e semeie 200.000 células em vários poços de uma placa de 6 poços em 2 mL de GM. Alternativamente, semeie 3,5 milhões de células por frasco de 175 cm2 em 22 mL de meio GM.
- Permita que as células proliferem por mais 2-4 dias até atingirem a confluência total, alterando o GM no segundo dia da cultura.
- Para iniciar a diferenciação adipogênica, remova o GM e substitua por MS completo por 4 dias (2 mL de MS completo por poço de uma placa de 6 poços ou 22 mL para um frasco de175 cm 2 ).
NOTA: Substitua por DM completo novo no dia 2. - No dia 4, remova o MS completo e substitua por 2 mL de MS básico suplementado com 22,5 μM de oleato, 15 μM de palmitato e 12,5 μM de linoleato para obter uma concentração total de ácidos graxos de 50 μM por alvéolo de uma placa de 6 poços ou 22 mL para um frasco de 175 cm2 . Substitua por mídia a cada 2 dias por mais 10 dias.
NOTA: A partir do dia 7, as gotículas lipídicas devem ser visíveis nos pré-adipócitos diferenciados. - No dia 14 da cultura, colete o meio das células para isolamento de EVs derivados de adipócitos.
6. Preparação do sobrenadante de cultura celular para isolamento ou armazenamento de vesículas extracelulares e futuro isolamento de vesículas extracelulares
- Remova os sobrenadantes de cultura de células de cada placa de 6 poços e misture. Adicionar a um tubo de 15 ml ou retirar todos os sobrenadantes de cultura de células de um balão de 175 cm2 e adicionar a um tubo de 50 ml.
- Centrifugue a 1000 x g por 10 min a 4 °C.
- Transvase o sobrenadante para um novo tubo limpo de 15 ml ou 50 ml, vertendo respectivamente.
- Remova o cilindro de uma seringa de 10 mL e coloque um filtro de seringa de 0,45 μm.
- Despeje o sobrenadante no reservatório da seringa e aplique uma leve pressão na abertura do corpo da seringa com o polegar ou a palma da mão até que o sobrenadante da cultura de células passe livremente pelo filtro.
NOTA: A velocidade desta etapa de filtração pode variar dependendo do tipo de filtro de seringa. - Recolha o filtrado num tubo limpo de 50 ml.
NOTA: Se necessário, o meio filtrado condicionado pode ser armazenado neste ponto a -80 °C por várias semanas. Quando necessário, descongelar os sobrenadantes da cultura de células a 4 °C e centrifugar a 1000 x g durante 10 min a 4 °C. Transvase o sobrenadante para um tubo limpo, despejando antes de continuar com os isolamentos EV.
7. Isolamento de vesículas extracelulares
- Rotule um tubo de ultracentrifugação de 13 mL desenhando um círculo na parte inferior do tubo, onde o pellet EV esperado se formará e marque uma linha ao redor do gargalo do tubo para orientação no rotor do tubo de ultracentrifugação. Rotule o tubo com um identificador de amostra.
- Coloque o tubo no suporte do tubo.
- Coloque uma agulha de 16 G a uma seringa de 10 ml e retire o corpo da seringa.
- Remova a tampa protetora da agulha e insira a agulha no gargalo do tubo de ultracentrifugação.
- Despeje o sobrenadante de cultura de células diretamente no corpo da seringa para encher o tubo de ultracentrifugação.
- Encha o tubo com PBS conforme necessário até ficar cheio.
NOTA: Deixe o tubo transbordar ligeiramente, se necessário, garantindo que não haja espaços de ar no tubo de ultracentrifugação e nem bolhas de ar. - Sele o tubo de ultracentrifugação usando um ferro de solda, garantindo que o tubo esteja hermético, apertando o tubo suavemente.
- Coloque os tubos de ultracentrifugação no rotor de ultracentrifugação; certifique-se de que a linha marcada na parte superior do tubo e o círculo desenhado na base do tubo estejam voltados para fora, onde o pellet EV se formará.
- Ultracentrífuga a 120.000 x g por 2 h a 4 °C.
- Remova cuidadosamente o rotor da ultracentrífuga.
- Remova os tubos de ultracentrifugação do rotor e coloque-os no suporte do tubo.
- Coloque uma agulha de 16 G a uma seringa de 10 mL.
- Perfure a parte superior do tubo de ultracentrifugação e insira a agulha 2 cm na parte superior do tubo e aspire o sobrenadante para a seringa.
- Transvase este sobrenadante empobrecido em EV para um tubo de 1,5 ml e congele a -80 °C.
- Reinsira a agulha no tubo e aspire cuidadosamente o sobrenadante restante e descarte.
- Corte a parte superior do tubo com uma tesoura.
- Despeje o sobrenadante restante em uma ação rápida.
- Deixe o tubo pendurado de cabeça para baixo por 1 min.
- Seque qualquer líquido que se forme no tubo com papel toalha.
- Inverta o tubo e coloque no suporte do tubo.
- Adicione 100 μL de PBS ao tubo.
- Usando a ponta de uma pipeta, desaloje suavemente o pellet EV na base do tubo usando um movimento circular na área marcada na etapa 7.1.
- Vórtice brevemente (1-2 segundos), duas vezes.
- Rotule um novo tubo de ultracentrifugação de 13 mL desenhando um círculo na parte inferior do tubo, onde o pellet EV esperado se formará e marque uma linha ao redor do gargalo do tubo para orientação no rotor do tubo de ultracentrifugação. Rotule o tubo com um identificador de amostra.
- Coloque o tubo no suporte do tubo.
- Adicione 12 mL de PBS a um novo tubo de ultracentrifugação usando uma seringa e uma agulha limpas.
- Usando uma seringa e uma agulha, colete a amostra de 100 μL EV e adicione ao tubo. Misture cuidadosamente os EVs e PBS e enxágue a seringa e a agulha coletando suavemente o PBS e aspirando para dentro do tubo.
NOTA: Evite criar bolhas. - Sele o tubo de ultracentrifugação usando um ferro de solda, garantindo que o tubo esteja hermético, apertando o tubo suavemente.
- Coloque os tubos de ultracentrifugação no rotor de ultracentrifugação; Certifique-se de que a linha marcada na parte superior do tubo e o círculo desenhado na base do tubo estejam voltados para fora.
- Ultracentrífuga a 120.000 x g por 1 h a 4 °C.
- Remova cuidadosamente o rotor da ultracentrífuga.
- Coloque uma agulha de 16 G a uma seringa de 12 ml.
- Perfure a parte superior do tubo de ultracentrifugação e insira a agulha até 2 cm na parte superior do tubo; aspirar o sobrenadante para a seringa e eliminar.
- Corte a parte superior do tubo com uma tesoura.
- Despeje o sobrenadante restante em uma ação rápida.
- Deixe o tubo pendurado de cabeça para baixo por 1 min.
- Seque qualquer líquido que se forme na borda do tubo.
- Coloque o tubo no suporte do tubo.
- Adicione 100 μL de PBS ao tubo.
- Usando a ponta de uma pipeta, desaloje suavemente o pellet EV na base do tubo usando um movimento circular na área marcada na etapa 7.24.
- Vórtice brevemente (1-2 segundos), duas vezes.
- Pipete 100 μL de solução PBS/EV em um tubo limpo de 1,5 mL e mantenha em gelo úmido.
NOTA: Os EV estão prontos para processamento a jusante e podem ser congelados e armazenados a -80 °C.
8. Determinação do tamanho e concentração de EV usando Análise de Rastreamento de Nanopartículas (NTA)
- Preparando o sistema
NOTA: Um método detalhado para o uso da Análise de Rastreamento de Nanopartículas (NTA) para determinação do tamanho e concentração de EV foi relatado por Mehdiani et al.13.- Descongelar as amostras e mantê-las a 4 °C.
- Inicie o software NTA clicando no ícone do software.
- O software será aberto em "verificação de célula" e solicitará o preenchimento da célula de fluxo com água deionizada. Encha uma seringa de 10 mL com água deionizada e empurre para dentro da máquina, garantindo que nenhuma bolha de ar passe para a câmara de carregamento.
- Siga as instruções na tela para preparar o sistema por meio de uma verificação de qualidade (CQ). O software realizará uma verificação da célula e fornecerá uma medida da qualidade da célula. Isso deve ser muito bom a excelente.
- Prepare o controle de qualidade que consiste em grânulos de poliestireno de 100 nanômetros. Pipetar 1 μL do padrão para 999 μL de água deionizada (estoque diluído). Em seguida, adicione 10 μL do estoque diluído a 2,5 mL de água deionizada (amostra de CQ). Misture a solução por vórtice suave por 2-3 s e pipetagem.
NOTA: As amostras de controle de qualidade devem ser preparadas todos os dias, mas a amostra de estoque diluída inicial é estável por 1 semana a 4 °C. - Encha uma seringa de 1 mL com 1 mL da amostra de CQ e remova todas as bolhas de ar da seringa.
- Injete, sem introduzir bolhas de ar, na câmara de carregamento de amostras NTA, inclinando suavemente a ponta da seringa para dentro da câmara de injeção, empurrando simultaneamente o êmbolo. Injete até 950 μL da amostra de CQ na câmara.
NOTA: Não introduza bolhas de ar na câmara de carregamento de amostras. - Aguarde enquanto o software executa um alinhamento automático (para focar a câmera) e verifica a tensão para leituras de potencial Z - o gráfico de tensão deve ser uma curva suave em forma de U.
NOTA: Se houver uma mensagem de erro "voltage erro muito baixo", a célula pode estar molhada devido à limpeza ou não segura ou pode haver uma bolha de ar. - Assim que a verificação automática de alinhamento/tensão estiver concluída, use o menu suspenso de posição da câmera para verificar todas as posições (0.1-0.9) em busca de marcas incomuns - a presença delas indica que a célula pode precisar de lavagem e/ou limpeza. Após o controle de qualidade, o sistema exibirá "pronto para medições".
- Prepare a célula de fluxo com PBS. Abra a guia Bomba/Temperatura e, em Bomba, clique em Executar para a bomba 2 (reservatório PBS). Isso executará o PBS pela célula por 1 minuto e, em seguida, parará automaticamente.
NOTA: Pode haver partículas na câmara, mas elas podem ser eliminadas empurrando 10 mL de PBS através da porta de carregamento. - Encha uma seringa de 10 ml com PBS e carregue na câmara sem bolhas de ar.
- Crie um protocolo para a execução do dispositivo que meça várias posições do laser e calcule a média das partículas por quadro.
- Verifique se a contagem de partículas é inferior a 5 (o mais próximo possível de 0) antes de prosseguir - lave com mais PBS, se necessário.
- Antes da diluição, misturar a amostra EV pipetando.
- Diluir a amostra 1:1.000 em PBS e misturar por pipetagem. Encha uma seringa de 1 mL com a amostra e carregue na câmara sem bolhas de ar.
- Verifique se a contagem de partículas está dentro do intervalo aceitável (a barra acima do valor da contagem deve estar na região verde ou próxima a ela). Caso contrário, ajustar a diluição da amostra em conformidade. Entre as amostras e as diluições da amostra, carregue 10 mL de PBS na frente da máquina para limpar a câmara e, em seguida, carregue 1 mL da amostra diluída.
NOTA: Cada amostra terá diluição independente com base na concentração da amostra. A contagem de partículas do dispositivo deve estar entre 50-200 partículas por quadro para medições precisas. - Vá para a guia Medição no software.
- Clique no botão Executar aquisição de vídeo .
- Insira um nome de amostra e selecione uma pasta de destino para salvar a medição.
- Crie um procedimento operacional padrão (SOP) EV.
- Crie > Salve > Carregue um EV SOP que medirá o número e o tamanho das partículas a uma velocidade do obturador de 100 e sensibilidade da câmera de 80, 11 posições da câmera por 2 ciclos.
NOTA: A menos que a amostra tenha requisitos especiais, não há necessidade de alterar essas configurações. - Insira a diluição da amostra e adicione quaisquer outras notas que deseja adicionar.
- Clique em OK e o software começará a gravar automaticamente. Uma vez concluído, o software carregará automaticamente uma tabela pop-up mostrando a contagem média de partículas e tamanhos para cada posição da câmera.
NOTA: Não toque na máquina ou nas bancadas próximas durante esse período, pois as vibrações influenciarão as leituras finais. - As posições da câmera com leituras estatisticamente incomuns serão excluídas automaticamente - para excluir manualmente as posições da câmera (ou reincluir as excluídas por qualquer motivo), clique na caixa de seleção à esquerda dos detalhes da amostra.
- Clique em Continuar e o software criará e abrirá um PDF da amostra com os resultados de tamanho e concentração.
- Crie > Salve > Carregue um EV SOP que medirá o número e o tamanho das partículas a uma velocidade do obturador de 100 e sensibilidade da câmera de 80, 11 posições da câmera por 2 ciclos.
- Análise estatística
- Analise os dados NTA por ANOVA unidirecional ou bidirecional com correção post-hoc de Tukey. Plotar dados como médias de grupo ± desvio padrão. Um valor de P de <0,05 foi considerado significativo.
Resultados
Determinamos a quantidade de EVs isoladas de adipócitos glúteos humanos seguindo o protocolo descrito. Calculamos o tamanho e a concentração de EVs derivados de adipócitos usando NTA (Figura 1A, B). Utilizamos controles sham-media, que eram volumes iguais de meios que não estiveram em contato com as células, mas cultivados e submetidos ao procedimento de isolamento descrito acima. Medimos a concentração de EV derivada de adipócitos após o isolamento inicial e após a lavagem dos EVs de adipócitos isolados em PBS (Figura 1A,B) e plotamos as médias dos grupos ± desvio padrão (DP), que foi analisado por uma ANOVA de duas vias com correção post-hoc de Tukey.
A concentração de EVs derivadas de adipócitos determinada por NTA a partir do1º isolamento variou de 6,10 x10,6 a 2,70 x 10,7com mediana de 2,60 x 10,7 EVs/mL (Figura 1 A,B). Após uma lavagem de PBS, houve significativamente menos EVs derivados de adipócitos por amostra (Figura 1A, B) (P < 0,001), que variou de 5,00 x 105 a 4,30 x 106 com uma mediana de 2,70 x 106 EVs / mL. Os controles de mídia simulada não continham EVs, conforme determinado pela NTA (Figura 1A, B). O tamanho modal dos EVs do primeiro isolamento foi de 125 nm e 105 nm após uma lavagem de PBS ( Figura 1A , B ). O protocolo descrito foi posteriormente aplicado a adipócitos abdominais e derivados de glúteos de frascos T175 cm2 maiores. Essas amostras de EV glúteas derivadas de frascos T175 cm2 variaram em concentração de 3,60 x 107 a 7,50 x 107/mL com mediana de 5,40 x 107 EVs/mL. As VE derivadas de adipócitos abdominais de frascos T175 cm2 variaram em concentração de 6,30 x 107 a 8,60 x 107/mL com mediana de 7,60 x 10,7 EVs/mL (Figura 1C,D). O tamanho modal das EVs derivadas dos frascos T175 cm2 foi de 115 nm para EVs glúteas e EVs abdominais de 125 nm. Confirmamos a presença da proteína EV em EVs derivadas de glúteos e abdominais por immunoblotting para o gene de suscetibilidade tumoral 101 (TSG101) e descobrimos que os pellets de células de adipócitos abdominais e glúteos e EVs derivados de adipócitos abdominais e glúteos foram positivos para TSG101, enquanto como meio de controle simulado, que não estiveram em contato com as células, foram negativos (Figura 1E).
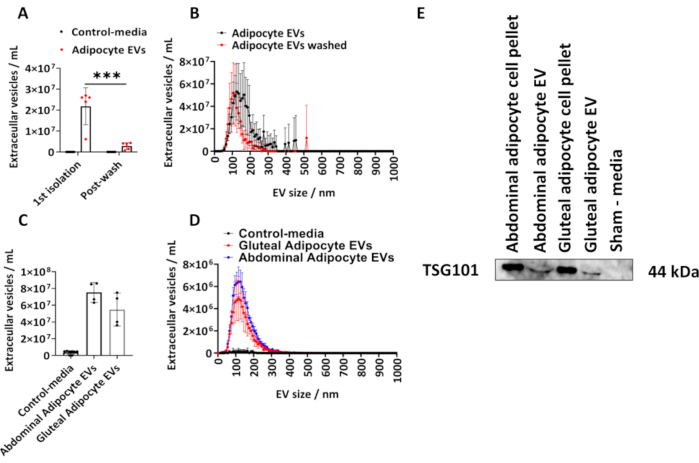
Figura 1: Tamanho e perfil de distribuição de EVs derivados de adipócitos de meios de cultura de células e determinação da proteína EV TSG101. Concentrações totais de EV e perfis de distribuição de tamanho e concentração conforme determinado por Análise de Rastreamento de Nanopartículas (NTA) a partir do1º isolamento (N = 5) e após lavagem com PBS (N = 6). (C) Concentrações totais e (D) perfis de distribuição de tamanho e concentração determinados por NTA para EVs derivados de abdominais e glúteos de frascos T175cm2 (N = 4 por grupo). (E) Western blot de EVs derivados de glúteos e abdominais para TSG101. Pellets celulares e sham-media foram usados como controles positivos e negativos, respectivamente. Os dados são médias de grupo ± desvio padrão (DP). Uma ANOVA unidirecional ou bidirecional com correção post-hoc de Tukey. P < 0,001. Clique aqui para ver uma versão maior desta figura.
Discussão
Demonstramos um protocolo para o isolamento de EVs derivados de adipócitos glúteos e abdominais de sobrenadantes de cultura de células e determinamos seu tamanho e concentração por NTA 7,14,15. Mostramos que os adipócitos humanos cultivados produzem e liberam EVs nos meios de cultura de células, que podem ser posteriormente isolados usando filtração e ultracentrifugação. Determinamos o tamanho e o perfil de concentração de EVs isolados derivados de adipócitos e mostramos que a ultracentrifugação provavelmente co-isolou contaminantes do meio de cultura de células e que a lavagem dos pellets EV isolados em PBS reduz significativamente sua concentração em uma segunda medição de NTA. Além disso, determinamos a pureza dos EVs isolados derivados de glúteos e abdominais por western blotting para TSG101, um marcador EV. As preparações de EV derivadas de glúteos e abdominais foram positivas para TSG101, mas, mais importante, isso estava ausente em meios de controle que não foram expostos às células. Os experimentos apresentados usaram adipócitos humanos como a célula-mãe geradora de EVs, mas o método descrito é adequado para outros tipos de células, incluindo células endoteliais, músculo liso vascular, músculo esquelético, células imunes e para o isolamento de EVs de plasma ou soro pobre em plaquetas do paciente.
As EVs derivadas de adipócitos são elevadas em doenças metabólicas e a determinação de alterações no tamanho e número de EVs de adipócitos in vivo é complexa porque fluidos biológicos, como o sangue, contêm EVs de várias fontes celulares que também estão implicadas na patogênese da doença metabólica, incluindo EVs de células endoteliais, músculo esquelético, eritrócitos e células imunes. O método aqui descrito permite a determinação de EVs de adipócitos humanos, o que pode fornecer um modelo útil para estudos mecanísticos que investigam os fatores que levam à biogênese de EV em adipócitos, que atualmente é desconhecida. É importante ressaltar que determinar a biogênese do EV dos adipócitos e como o carregamento de RNAs, proteínas e metabólitos específicos é orquestrado em EVs de adipócitos pode revelar novas oportunidades terapêuticas para perturbar a sinalização de EV de adipócitos patogênicos na disfunção metabólica. Estudos detalhados fornecerão uma melhor compreensão de como o tamanho, o número, a via de biogênese e a carga de EV (RNA, proteínas e metabólitos) são alterados em resposta a doenças ou estímulos, como perturbações em oxigênio, glicose, lipídios e insulina. Informações sobre o papel dos fatores ambientais na sinalização de EV de adipócitos em doenças metabólicas e como EVs derivados de adipócitos contribuem para a inflamação do tecido adiposo podem descobrir novos alvos terapêuticos em doenças metabólicas.
Limitações
Geração in vitro de EVs derivados de adipócitos
O uso de pré-adipócitos humanos in vitro fornece um sistema modelo para estudar a liberação e geração de EVs derivados de adipócitos após a diferenciação de adipócitos in vitro, mas há uma série de limitações. Em particular, os EVs de adipócitos derivados in vitro provavelmente diferem dos EVs derivados de tecido adiposo recuperados de biofluidos, como o plasma14 em seu tamanho, concentração, proteína EV, -RNA, -metabólitos e função. Essas diferenças de EV podem ser influenciadas por outras células não adipócitos que residem no tecido adiposo in vivo, como células-tronco derivadas do tecido adiposo, células endoteliais e macrófagos, que estão intimamente ligados à fisiologia do tecido adiposo e têm mostrado papéis na patologia do tecido adiposo, incluindo inflamação do tecido adiposo.
Deve-se notar que o protocolo de diferenciação in vitro de 2 semanas descrito aqui pode não ser suficiente para gerar adipócitos totalmente maduros equivalentes aos observados in vivo; Os adipócitos diferenciados in vitro cultivados em formato bidimensional (2D) apresentam uma morfologia diferente das células in vivo e não desenvolvem gotículas lipídicas uniloculares. Além disso, os pré-adipócitos descritos neste protocolo são obtidos da fração estromal-vascular adiposa e não avaliamos a contribuição para o pool de EV de outros tipos celulares que não foram completamente eliminados durante o isolamento celular.
A perda de importantes interações célula a célula dos adipócitos com outros não adipócitos no tecido adiposo pode influenciar a geração, liberação, proteína EV e EV-RNA dos adipócitos e células-tronco derivadas do tecido adiposo16. No entanto, uma avaliação de como os EVs de adipócitos derivados in vitro diferem daqueles produzidos in vivo não foi realizada exaustivamente.
As biópsias de tecido primário contêm sangue e, portanto, as culturas de células derivadas podem conter eritrócitos e EVs derivados de eritrócitos, independentemente das múltiplas lavagens e alterações de mídia destacadas em nosso protocolo. Uma etapa adicional de lise dos glóbulos vermelhos após o isolamento da fração estromal-vascular pode ser necessária para eliminar os efeitos dos eritrócitos nos adipócitos. Isso é importante porque as EVs derivadas de eritrócitos podem afetar a função celular de outras células17 e as EVs derivadas de eritrócitos são elevadas na presença de estresse oxidativo18 e em pacientes com síndrome metabólica19,20. Portanto, o tecido adiposo derivado de pacientes com doenças metabólicas pode conter níveis elevados de EVs derivados de eritrócitos, o que pode influenciar o fenótipo in vitro dos adipócitos.
Eliminação da FBS
O protocolo descrito utilizou FBS no meio de crescimento durante a diferenciação adipogênica, mas posteriormente os adipócitos foram submetidos a múltiplas alterações de meio antes da coleta final do meio para o isolamento de EVs derivados de adipócitos. Portanto, assumimos que o risco geral de contaminação de EVs derivados de FBS nas preparações de EVs era baixo e, posteriormente, confirmamos que EVs residuais não estavam presentes nos meios de cultura de células por western blotting para TSG101. O isolamento de EVs cultivados em células de fontes celulares que requerem FBS deve usar FBS esgotado em EV ou esgotar EVs bovinos por meio de ultracentrifugação para evitar que EVs bovinos confundam as concentrações de EV de adipócitos e análise da carga de EV de adipócitos. Sabe-se que a depleção do soro dos adipócitos altera suas respostas celulares21 e, portanto, a investigação deve garantir que a depleção sérica ou a depleção EV do soro torne suas culturas de adipócitos verdadeiramente representativas da biologia dos adipócitos.
Limitação técnica do isolamento EV usando filtração e ultracentrifugação
Descrevemos um método de ultracentrifugação com tubos de plástico de uso único que requerem vedação antes da ultracentrifugação para isolamentos EV. Reconhecemos que esses tubos selados de uso único podem não ser uma opção econômica para muitos indivíduos e sugerimos a exploração de tubos semelhantes, que não requerem vedação e são reutilizáveis. No entanto, os investigadores devem garantir que a lavagem dos tubos reutilizáveis seja adequada e não leve ao acúmulo progressivo de contaminantes de proteínas, lipídios e RNA ao longo do tempo, o que pode afetar as investigações a jusante da carga associada a EV ou impactar nos estudos de função celular.
O protocolo de filtração e ultracentrifugação descrito aqui tem sido usado há vários anos e vários estudos destacaram as deficiências desse método, incluindo os isolamentos não específicos de componentes celulares contaminantes, como mitocôndrias celulares, a presença de fragmentos nucleares e constituintes da membrana celular. Além disso, o método descrito aqui irá co-isolar as lipoproteínas presentes na FBS depletada de EV. O método aqui pode ser desenvolvido pelo uso de ultracentrifugação de densidade e cromatografia de exclusão de tamanho (SEC) para eliminar proteínas solúveis contaminantes e algumas lipoproteínas. Juntamente com a lavagem PBS dos EVs isolados e SEC, os contaminantes co-isolados podem ser limitados, mas não completamente eliminados. Por conseguinte, os utilizadores devem assegurar a inclusão de controlos adequados, incluindo um meio simulado que não tenha estado em contacto com as células para ter em conta as proteínas solúveis e as lipoproteínas nos meios de cultura e um controlo sobrenadante com depleção de EV para demonstrar o isolamento bem sucedido de EV de meios condicionados que ainda contenham proteínas solúveis e lipoproteínas.
O isolamento de EVs usando filtração e ultracentrifugação depende do operador garantir que pressão indevida não seja aplicada aos sobrenadantes da cultura de células enquanto ela passa pelo orifício do filtro ou pelo orifício da agulha/seringa. A aplicação de força indevida durante esta etapa do protocolo descrito pode romper EVs, influenciar as concentrações finais de EVs e gerar RNA, proteínas e metabólitos livres, que antes estavam envoltos em EVs. Descrevemos um método aqui, que não requer o corpo da seringa e, portanto, a aplicação de força aos EVs em meios condicionados à medida que passam pelo filtro ou agulha para seus reservatórios de coleta e tubos de ultracentrifugação. No entanto, deve-se tomar mais cuidado ao ressuspender o pellet EV em PBS. Apenas um breve vórtice deve ser usado, pois um vórtice vigoroso pode romper as membranas EV.
Após a ultracentrifugação, os operadores devem ter cuidado com os tubos de ultracentrifugação para não perturbar o pellet EV. Isso pode ser alcançado manuseando os tubos com cuidado e movendo-os lentamente entre o rotor de ultracentrifugação e o rack de tubos. Deve-se tomar cuidado adicional ao perfurar um orifício na parte superior do tubo de ultracentrifugação para aspirar os sobrenadantes depletados de EV. Inserir a agulha na parte superior do tubo e aspirar os sobrenadantes rapidamente criará um vácuo no corpo da seringa, o que pode forçar violentamente o sobrenadante de volta ao tubo de ultracentrifugação e interromper o pellet EV. Depois de cortar o tubo de ultracentrifugação para despejar o sobrenadante restante, deve-se tomar cuidado porque o pellet EV pode se soltar e o vazamento descartará o pellet EV. Alternativamente, uma seringa e uma agulha podem ser usadas para remover lentamente o sobrenadante restante sem derramar ou inverter o tubo.
A filtração e ultracentrifugação de sobrenadantes para o isolamento de EVs é um método útil e eficiente. Mas é passível de co-isolamento de lipoproteínas e proteínas solúveis. Isso pode ser mitigado lavando os EVs com PBS (conforme descrito), mas isso não eliminará todos os contaminantes. As proteínas solúveis podem ser eluídas da fração EV utilizando SEC, no entanto, este método não distingue entre lipoproteínas e EVs. As eluições SEC que contêm EVs podem ser combinadas com ultracentrifugação para pellet EVs. A filtração e a ultracentrifugação diferencial são um método preferido de isolamento EV em relação às técnicas de precipitação, que usam polietilenoglicol porque esses métodos de precipitação co-isolam grandes quantidades de proteínas solúveis e lipoproteínas em sobrenadantes de cultura de células e outros fluidos biológicos. É provável que a ultracentrifugação continue sendo a forma mais acessível de isolamento de EV para muitos, porque a maioria dos laboratórios está equipada com uma ultracentrífuga, mitigando os custos iniciais de inicialização. Mas, para muitos, a ultracentrifugação para isolamento EV é prejudicada pelo volume dos tubos de ultracentrifugação e pelo volume inicial do material. Várias centenas de mililitros de sobrenadantes de cultura podem ser necessários para produzir quantidade EV suficiente para proteômica a jusante ou sequenciamento de RNA. No entanto, é provável que as técnicas de ultracentrifugação para isolamento de EV sejam acompanhadas por outras técnicas, como SEC e captura de imunoafinidade usando tetraspaninas CD9, CD63 e CD81 para melhorar a pureza de EVs isolados. Outras técnicas, como soluções de precipitação disponíveis comercialmente e citometria de fluxo, podem ser úteis em investigações específicas.
Pureza das preparações EV
Confirmamos o isolamento de EVs derivados de adipócitos por western blotting para TSG101, mas este único western blot fica aquém das diretrizes publicadas pela sociedade internacional de vesículas extracelulares (ISEV). Uma caracterização mais aprofundada desses EVs derivados de adipócitos seria ideal usando tetraspaninas CD9, CD63 e CD81 para identificar exossomos e marcadores de contaminação celular, como histona H3, albumina e apolipoproteína A1.
O protocolo apresentado aqui permite o isolamento de EVs de sobrenadantes de cultura de células de uma variedade de fontes celulares, incluindo adipócitos para determinação do tamanho de EV, concentração, marcadores EV por western blot e utilidade em tecnologias baseadas em ômicas, como proteômica e sequenciamento de RNA.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
N.A. e R.C. reconhecem o apoio de bolsas de pesquisa da British Heart Foundation, do Centro de Excelência em Pesquisa, Oxford (N.A. e R.C.; RE/13/1/30181 e RE/18/3/34214), Subsídio de Projeto da Fundação Britânica do Coração (N.A. e R.C.; PG / 18/53/33895), o Consórcio de Imunometabolismo Tripartite, a Fundação Novo Nordisk (NNF15CC0018486), o Instituto Nacional de Pesquisa em Saúde (NIHR), o Centro de Pesquisa Biomédica de Oxford (BRC), Nuffield Benefaction for Medicine e o Fundo de Apoio Estratégico Institucional Wellcome (ISSF). As opiniões expressas são do(s) autor(es) e não necessariamente do NHS, do NIHR ou do Departamento de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
Referências
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados