Method Article
Isolierung und Charakterisierung von extrazellulären Vesikeln aus humanen Adipozyten mittels Filtration und Ultrazentrifugation
In diesem Artikel
Zusammenfassung
Wir beschreiben die Isolierung von humanen Adipozyten-abgeleiteten extrazellulären Vesikeln (EVs) aus Gesäß- und Bauchfettgewebe mittels Filtration und Ultrazentrifugation. Wir charakterisieren die isolierten EVs, die von Adipozyten abgeleitet sind, indem wir ihre Größe und Konzentration mittels Nanoparticle Tracking Analysis und durch Western Blotting auf das Vorhandensein des EV-Protein-Tumor-Suszeptibilitätsgens 101 (TSG101) bestimmen.
Zusammenfassung
Extrazelluläre Vesikel (EVs) sind lipidumschlossene Hüllkurven, die biologisch aktives Material wie Proteine, RNA, Metaboliten und Lipide tragen. EVs können den zellulären Status anderer Zellen lokal in Mikroumgebungen des Gewebes oder durch Freisetzung in das periphere Blut modulieren. Von Adipozyten abgeleitete EVs sind im peripheren Blut erhöht und zeigen Veränderungen in ihrer Fracht (RNA und Protein) bei Stoffwechselstörungen, einschließlich Fettleibigkeit und Diabetes. Aus Adipozyten gewonnene EVs können den zellulären Status benachbarter Gefäßzellen wie Endothelzellen und im Fettgewebe ansässiger Makrophagen regulieren, um die Entzündung des Fettgewebes zu fördern. Die Untersuchung von Veränderungen in Adipozyten-abgeleiteten EVs in vivo ist komplex, da EVs, die aus peripherem Blut gewonnen werden, sehr heterogen sind und EVs aus anderen Quellen enthalten, nämlich Blutplättchen, Endothelzellen, Erythrozyten und Muskeln. Daher stellt die Kultur humaner Adipozyten ein Modellsystem für die Untersuchung von Adipozyten-abgeleiteten EVs dar. Hier stellen wir ein detailliertes Protokoll für die Extraktion von insgesamt kleinen EVs aus Zellkulturmedien menschlicher Gesäß- und Bauchadipozyten mittels Filtration und Ultrazentrifugation zur Verfügung. Darüber hinaus demonstrieren wir die Verwendung der Nanoparticle Tracking Analysis (NTA) zur Quantifizierung der EV-Größe und -Konzentration und zeigen das Vorhandensein des EV-Protein-Tumor-Suszeptibilitätsgens 101 (TSG101) in den von Gesäß- und Bauchadipozyten abgeleiteten EVs. Isolierte EVs aus diesem Protokoll können für Downstream-Analysen verwendet werden, einschließlich Transmissionselektronenmikroskopie, Proteomik, Metabolomik, kleine RNA-Sequenzierung, Microarrays und können in funktionellen in vitro/in vivo-Studien verwendet werden.
Einleitung
Extrazelluläre Vesikel (EVs) sind lipidumschlossene Hüllen, die biologisch aktives Material wie Proteine, microRNAs, Metaboliten und Lipide tragen. Der Begriff EVs bezeichnet verschiedene Subpopulationen, zu denen Exosomen, Mikrovesikel (Mikropartikel/Ektosomen) und apoptotische Körpergehören 1. EVs können als Biomarker dienen, da sie an der pathologischen Signalübertragung beteiligt sind und in Bioflüssigkeiten, einschließlich Blut und Urin, freigesetzt werden. EVs können den zellulären Status anderer Zellen lokal in Gewebemikroumgebungen oder durch Freisetzung in peripheres Blut modulieren2. EVs tragen Merkmale ihrer Elternzelle, aber die Differenzierung jeder Subpopulation basiert in erster Linie auf der EV-Größe und dem Proteingehalt wie EVs-Markern, einschließlich des Vorhandenseins von Tetraspaninen (CD9, CD63 und CD81), dem Tumoranfälligkeitsgen 101 (TSG101) und dem ALG-2-interagierenden Protein X (ALIX). Diese Proteinmarker sind repräsentativ für den endosomalen Ursprung (CD9, CD63 und CD81) für Exosomen, die in multivesikulären Körpern erzeugt werden, oder repräsentieren Proteine, die mit dem Knospen oder Blubben direkt aus der Plasmamembran für Mikrovesikel assoziiert sind. Es gibt jedoch eine signifikante Überlappung zwischen diesen Subpopulationen, und es ist schwierig, einzelne Subpopulationen in komplexen Bioflüssigkeiten wie Plasma, Serum oder Urin zu unterscheiden.
Stoffwechselstörungen, einschließlich Fettleibigkeit, Insulinresistenz und Störungen der extrazellulären Glukose, des Sauerstoffs und der Entzündung, können die Größe und Konzentration von EVs und ihrer Fracht verändern. Von Adipozyten abgeleitete EVs tragen Perilipin A, Adiponektin und zeigen Veränderungen in ihrer Protein- und RNA-Fracht bei Fettleibigkeit und Diabetes 3,4,5,6. Von Adipozyten abgeleitete EVs regulieren den zellulären Status benachbarter vaskulärer Endothelzellen7 und im Fettgewebe residenter Makrophagen, um die Entzündung des Fettgewebes und die Insulinresistenz zu fördern 8,9,10,11. Die Untersuchung von Veränderungen in von Adipozyten abgeleiteten EVs in vivo ist komplex, da EV-Populationen, die aus komplexen Bioflüssigkeiten wie Plasma, Serum oder Urin stammen, EVs aus mehreren Quellen wie Blutplättchen, Endothelzellen, Erythrozyten und Muskeln enthalten, die an der Pathogenese von metabolischer Dysfunktion und Krankheit beteiligt sind.
Die Kultur und in vitro Differenzierung humaner Präadipozyten stellt daher ein Modellsystem für die Untersuchung von Adipozyten-abgeleiteten EVs dar. Hier stellen wir ein detailliertes Protokoll für die Extraktion von insgesamt kleinen EVs aus Zellkulturmedien menschlicher Adipozyten mittels Spritzenfiltration und Ultrazentrifugation zur Verfügung. Die Ultrazentrifugation ist nach wie vor eine beliebte Methode zur Isolierung von Elektrofahrzeugen, da sie leicht zugänglich ist und wenig Vorkenntnisse erfordert. Andere Methoden wie Fällung, Größenausschlusschromatographie und Immunaffinitätserfassung mit Tetraspaninen ermöglichen jedoch die EV-Isolierung aus einer Reihe von Bioflüssigkeiten, einschließlich Plasma, Serum, Urin und konditionierten Zellkulturmedien. Jedes Verfahren, einschließlich des hier beschriebenen Ultrazentrifugationsprotokolls, produziert EV-Präparate unterschiedlicher Reinheit, da die Verfahren lösliche Proteine und Lipoproteine co-isolieren können, die sich als EVs maskieren können. Die Kombination dieses Ultra-Zentrifugationsprotokolls mit anderen Methoden wie Dichtezentrifugation, Größenausschlusschromatographie und Immunaffinitätserfassung erhöht die Reinheit isolierter EVs erheblich. Ähnlich wie bei der Ultrazentrifugation erlauben diese anderen Methoden jedoch nicht die Erfassung unabhängiger Subpopulationen von EVs aus komplexen Proben wie Blut, Plasma und Urin. Daher sind Kulturen ausgewählter Zellpopulationen nach wie vor eine der robustesten Methoden, um hohe Ausbeuten an zellspezifischen EVs zu erzielen. Jede EV-Methode hat eine Reihe von Vorbehalten, und die Wahl der Methode kann sich auf die Art der isolierten EVs und ihre Konzentrationen auswirken, was nachgelagerte mechanistische Untersuchungen der Zell- und Gewebesignalisierung und die Bestimmung der EV-Fracht für diagnostische Studien verzerren kann; Diese methodischen Fragen der EV-Isolierung werden an anderer Stelle und in den Abschnitten zu den Einschränkungen unter 4,12 diskutiert. Hier beschreiben wir die Isolierung von humanen Adipozyten-abgeleiteten EVs mittels Filtration und Ultrazentrifugation. Darüber hinaus demonstrieren wir die Verwendung der Nanopartikel-Tracking-Analyse (NTA) zur Quantifizierung der EV-Größe und -Konzentration und zeigen das Vorhandensein des EV-Protein-Tumor-Suszeptibilitätsgens 101 (TSG101) in unseren humanen Adipozyten-abgeleiteten EVs. Isolierte EVs aus diesem Protokoll können für Downstream-Analysen verwendet werden, einschließlich Transmissionselektronenmikroskopie, Proteomik, Metabolomik, Small-RNA-Sequenzierung, Microarrays und können in funktionellen In-vitro/In-vivo-Studien verwendet werden.
Protokoll
Alle Methoden wurden vom institutionellen Ethik-Prüfungsausschuss der Universität Oxford genehmigt. Das Fettgewebe wurde durch Nadelbiopsie unter örtlicher Betäubung von gesunden Probanden gewonnen.
1. Vorbereitung von Zellkulturmedium und Puffern
- Bereiten Sie einen Kollagenase-Aufschlusspuffer vor, indem Sie Kollagenase H (1 mg/ml) in Hanks Balanced Salt Solution (HBSS) (ohne Calciumchlorid und ohne Magnesiumchlorid) und einen Sterilfilter mit einem 0,2 μm Porenspritzenfilter auflösen.
- Bereiten Sie den Kollagenase-Verdauungspuffer nicht länger als 10 Minuten vor Gebrauch vor.
- Bereiten Sie das Wachstumsmedium (GM) wie folgt vor: Dulbecco's Modified Eagle's Medium/Ham's Nährstoffmischung F12 (DMEM/F12), ergänzt mit 10% fötalem Rinderserum (FBS), 100 Einheiten/ml Penicillin, 100 μg/ml Streptomycin, 2 mM L-Glutamin und 0,5 ng/ml Fibroblasten-Wachstumsfaktor (FGF).
- Bereiten Sie das basische Differenzierungsmedium (basisches TM) wie folgt vor: DMEM/F12 ergänzt mit 100 Einheiten/ml Penicillin, 100 μg/ml Streptomycin, 2 mM L-Glutamin, 17 μM Pantothenat, 100 nM Humaninsulin, 10 nM Trijod-L-Thyronin, 33 μM Biotin, 10 μg/ml Transferrin und 1 μM Dexamethason.
- Bereiten Sie das vollständige Differenzierungsmedium (vollständige TM) vor, indem Sie die basische TM aus Schritt 1.3 mit 0,25 mM 3-Isobutyl-1-methylxanthin und 4 μM Troglitazon ergänzen.
- 10 mM Fettsäure-Stammlösungen, komplexiert mit 10 % im Wesentlichen fettsäurefreiem Rinderserumalbumin (BSA), werden wie folgt hergestellt.
- 16 g BSA in 160 mL DMEM/F12 Medium auflösen und auf 37 °C erwärmen. Wiegen Sie in drei separaten konischen 50-ml-Röhrchen 150 mg Natriumoleat, 139 mg Natriumpalmitat und 151 mg Natriumlinoleat ab. Geben Sie 50 ml der erwärmten BSA-Lösung in jedes Röhrchen und mischen Sie es gut durch wiederholtes Vortexen.
- Stellen Sie die Öl- und Linoleattuben für 15 min wieder in das 37 °C warme Wasserbad. Durch Vortexen mischen, bis es sich vollständig aufgelöst hat.
- Für die Palmitatlösung legen Sie die Tube für 2-3 min in ein 65 °C heißes Wasserbad. Kräftig mischen, indem Sie es vortexen.
- Schritt 1.5.3 wiederholen, bis er sich vollständig aufgelöst hat - ca. 30 Minuten.
HINWEIS: Einige kleine Partikel können noch sichtbar sein. - Sterilfiltrieren Sie die Fettsäurelösungen mit einem 0,2 μm Porenspritzenfilter.
- Die Konzentration der nicht veresterten Fettsäuren jeder Stammlösung ist mit einem geeigneten Assay zu bestätigen.
HINWEIS: Die Fettsäureaktien sollten 10 mM (±10 %) betragen, um ein molares Verhältnis von 6:1 zwischen Fettsäure und BSA zu erhalten. Liegt die Konzentration außerhalb dieses Bereichs, sollte die Stammlösung neu hergestellt werden. Stammlösungen können aliquotiert und bei -30 °C gelagert werden.
2. Verdauung von Biopsien aus menschlichem Fettgewebe
- Der Inhalt der Biopsiespritze wird langsam durch ein steriles 200-μm-Zellsieb abgeseiht, das an einem konischen 50-ml-Röhrchen befestigt ist, so dass das Fettgewebe im Sieb gesammelt wird.
- Übertragen Sie das Sieb in ein neues konisches 50-ml-Röhrchen und waschen Sie das Fettgewebe dreimal mit 10 mL HBSS.
HINWEIS: Es kann erforderlich sein, Blutgerinnsel und fibröses Gewebe mit einer chirurgischen Schere zu entfernen oder die HBSS-Waschung zu wiederholen, um überschüssige rote Blutkörperchen zu entfernen. - Wiegen Sie das gewaschene Tuch.
HINWEIS: In der Regel erhalten wir 400-800 mg Gewebe durch Nadelbiopsie. - Geben Sie den Kollagenase-Verdauungspuffer in ein steriles konisches 50-ml-Röhrchen und fügen Sie das gewaschene Gewebe hinzu. In diesem Schritt kann eine chirurgische Schere verwendet werden, um das Gewebe in gleich große Stücke zu zerkleinern.
HINWEIS: Verwenden Sie 5 ml Puffer pro 0,5 g Gewebe. Für größeres Gewebe können die Proben in einer Petrischale zerkleinert werden. - Legen Sie das Röhrchen in ein 37 °C heißes Schüttelwasserbad und inkubieren Sie es 35-40 Minuten lang.
HINWEIS: Nach erfolgreichem Aufschluss sollte die Lösung milchig erscheinen. Wenn noch kleine Gewebestücke sichtbar sind, mit der Hand weitere 10-20 s schütteln.
3. Isolierung von Präadipozyten
- Zum Pelletieren der Präadipozytenfraktion zentrifugieren Sie 5 min lang bei 1.000 x g .
- Aspirieren und verwerfen Sie die schwimmende Adipozytenschicht und den Überstand, so dass etwa 1 ml HBSS das Zellpellet bedeckt.
- Resuspendieren Sie das Pellet in 5 mL HBSS und leiten Sie die Zellsuspension durch ein Netz mit einer Porengröße von 250 μm, gefolgt von einem 100 μm Netz, um unverdautes Material zu entfernen. Sammeln Sie die Zellsuspension in einem konischen 15-ml-Röhrchen.
- Zentrifugieren Sie bei 1.000 x g für 5 min.
HINWEIS: Nach diesem Schritt kann die Präadipozytenfraktion mit einer Lyselösung für rote Blutkörperchen behandelt werden, wenn eine Kontamination der roten Blutkörperchen ein Problem darstellt. - Aspirieren Sie den Überstand und entsorgen Sie ihn.
- Das Zellpellet wird in 5 ml GM (Schritt 1.2) resuspendiert und in einen 25 cm2 adhärenten Gewebekulturkolben ausgesät. Den Kolben in einen Zellkultur-Inkubator (5 % CO2, 37 °C) stellen.
4. Pflege von Präadipozytenkulturen
- Ersetzen Sie den GM alle 2 Tage, während sich die Zellen vermehren
HINWEIS: Die Zellproliferationsraten können zwischen den Spendern variieren.- Wenn die Zellen eine Konfluenz von etwa 80 % erreichen, werden sie in einen 75 cm2 adhärenten Gewebekulturkolben überführt. Entfernen Sie das GM und waschen Sie die Zellen mit phosphatgepufferter Kochsalzlösung (PBS).
- Verwerfen Sie das PBS und fügen Sie 0,5 ml hochgereinigte Zelldissoziationsenzyme hinzu, um die anhaftenden Zellen zu dissoziieren. Bei 37 °C 5 min inkubieren.
- Klopfen Sie scharf auf den Kolben, um die Zellen freizusetzen, und fügen Sie 5 ml GM hinzu. Die Zellsuspension wird in einem konischen 15-ml-Röhrchen aufgefangen.
- Zentrifugieren Sie bei 1.000 x g für 5 min.
- Aspirieren Sie den Überstand und entsorgen Sie ihn. Das Küvettenpellet wird in 5 ml GM resuspendiert und in einen 75 cm2 Kolben überführt. Füllen Sie den GM auf ein Endvolumen von 12 mL auf und setzen Sie den Kolben wieder in den Zellkultur-Inkubator (5 % CO2, 37 °C) ein.
HINWEIS: Um die Zellen zu erhalten, wechseln Sie den GM weiterhin alle 2-3 Tage. Wenn die Zellen eine Konfluenz von 80 % erreichen, wiederholen Sie die Schritte 4.2-4.3 und teilen Sie die Zellen 1:3 in neue 75 cm2 Kolben auf. Dies kann über mehrere Durchgänge wiederholt werden, bis eine ausreichende Anzahl von Zellen für den Versuchsaufbau erzeugt wurde. Wir würden nicht mehr als 10 Passagen empfehlen, da die Proliferations- und Differenzierungsfähigkeit der Präadipozyten abnimmt.
5. Aussaat von Präadipozyten für die adipogene Differenzierung
- Zählen Sie die Zellen mit einem Hämozytometer und säen Sie 200.000 Zellen in mehrere Vertiefungen einer 6-Well-Platte in 2 ml GM aus. Alternativ können Sie 3,5 Millionen Zellen pro 175 cm2 Kolben in 22 ml GM-Medien säen.
- Lassen Sie die Zellen weitere 2-4 Tage vermehren, bis sie die volle Konfluenz erreichen, und wechseln Sie den GM am zweiten Tag der Kultur.
- Um mit der adipogenen Differenzierung zu beginnen, entfernen Sie den GM und ersetzen Sie ihn 4 Tage lang durch vollständiges TM (2 ml vollständiges TM pro Vertiefung einer 6-Well-Platte oder 22 mL für einen 175-cm-2-Kolben).
HINWEIS: An Tag 2 durch frisches, komplettes DM ersetzen. - An Tag 4 wird das vollständige TM entfernt und durch 2 ml basisches TM ersetzt, das mit 22,5 μM Oleat, 15 μM Palmitat und 12,5 μM Linoleat ergänzt wurde, um eine Gesamtfettsäurekonzentration von 50 μM pro Vertiefung einer 6-Well-Platte oder 22 mL für einen 175 cm2 Kolben zu erhalten. Für weitere 10 Tage alle 2 Tage durch das Medium ersetzen.
HINWEIS: Ab Tag 7 sollten Lipidtröpfchen in den differenzierenden Präadipozyten sichtbar sein. - Entnehmen Sie am 14. Kulturtag das Medium aus den Zellen für die Isolierung von Adipozyten-abgeleiteten EVs.
6. Vorbereitung eines Zellkulturüberstands für die Isolierung oder Lagerung extrazellulärer Vesikel und die zukünftige Isolierung extrazellulärer Vesikel
- Entfernen Sie die Zellkulturüberstände von jeder 6-Well-Platte und kombinieren Sie sie. In ein 15-ml-Röhrchen geben oder alle Zellkulturüberstände aus einem 175-cm-2-Kolben entfernen und in ein 50-ml-Röhrchen geben.
- Zentrifugieren Sie bei 1000 x g für 10 min bei 4 °C.
- Überstand durch Gießen in ein neues, sauberes 15-ml- bzw. 50-ml-Röhrchen umfüllen.
- Entfernen Sie den Zylinder einer 10-ml-Spritze und setzen Sie einen 0,45-μm-Spritzenvorsatzfilter ein.
- Gießen Sie den Überstand in das Spritzenreservoir und üben Sie mit dem Daumen oder der Handfläche leichten Druck auf die Öffnung des Spritzenzylinders aus, bis der Zellkulturüberstand frei durch den Filter läuft.
HINWEIS: Die Geschwindigkeit dieses Filtrationsschritts kann je nach Art des Spritzenvorsatzfilters variieren. - Sammeln Sie das Filtrat in einem sauberen 50-ml-Röhrchen.
HINWEIS: Bei Bedarf können die konditionierten gefilterten Medien an dieser Stelle bei -80 °C für mehrere Wochen gelagert werden. Bei Bedarf die Zellkulturüberstände bei 4 °C auftauen und bei 1000 x g für 10 min bei 4 °C zentrifugieren. Dekantieren Sie den Überstand durch Gießen in ein sauberes Röhrchen, bevor Sie mit den EV-Isolierungen fortfahren.
7. Isolierung extrazellulärer Vesikel
- Beschriften Sie ein 13-ml-Ultrazentrifugationsröhrchen, indem Sie am Boden des Röhrchens einen Kreis zeichnen, an dem sich das erwartete EV-Granulat bildet, und markieren Sie eine Linie um den Hals des Röhrchens zur Orientierung im Rotor des Ultrazentrifugationsröhrchens. Beschriften Sie das Röhrchen mit einer Probenkennung.
- Setzen Sie den Schlauch in den Schlauchhalter ein.
- Befestigen Sie eine 16-g-Nadel an einer 10-ml-Spritze und entfernen Sie den Spritzenzylinder.
- Entfernen Sie die Schutzhülle von der Nadel und führen Sie die Nadel in den Hals des Ultrazentrifugationsröhrchens ein.
- Gießen Sie den Zellkulturüberstand direkt in den Spritzenzylinder, um das Ultrazentrifugationsröhrchen zu füllen.
- Füllen Sie die Tube nach Bedarf mit PBS auf, bis sie voll ist.
HINWEIS: Lassen Sie das Röhrchen bei Bedarf leicht überlaufen, um sicherzustellen, dass sich keine Lufträume im Ultrazentrifugationsröhrchen und keine Luftblasen befinden. - Verschließen Sie das Ultrazentrifugationsröhrchen mit einem Lötkolben und stellen Sie sicher, dass das Röhrchen luftdicht ist, indem Sie das Röhrchen vorsichtig zusammendrücken.
- Setzen Sie die Ultrazentrifugationsröhrchen in den Ultrazentrifugationsrotor ein. Stellen Sie sicher, dass die oben am Rohr markierte Linie und der an der Basis des Rohrs gezeichnete Kreis nach außen zeigen, wo sich das EV-Pellet bildet.
- Ultrazentrifuge bei 120.000 x g für 2 h bei 4 °C.
- Entfernen Sie den Rotor vorsichtig aus der Ultrazentrifuge.
- Nehmen Sie die Ultrazentrifugationsröhrchen aus dem Rotor und setzen Sie sie in den Röhrchenhalter ein.
- Befestigen Sie eine 16-g-Nadel an einer 10-ml-Spritze.
- Durchstechen Sie die Oberseite des Ultrazentrifugationsröhrchens und führen Sie die Nadel 2 cm in die Oberseite des Röhrchens ein und aspirieren Sie den Überstand in die Spritze.
- Dieser EV-abgereicherte Überstand wird in ein 1,5-ml-Röhrchen umgefüllt und bei -80 °C eingefroren.
- Führen Sie die Nadel wieder in das Röhrchen ein, saugen Sie den restlichen Überstand vorsichtig ab und entsorgen Sie ihn.
- Schneide die Oberseite des Rohrs mit einer Schere ab.
- Gießen Sie den restlichen Überstand in einem schnellen Zug ab.
- Lassen Sie die Tube 1 min kopfüber hängen.
- Tupfen Sie die Flüssigkeit, die sich auf der Tube bildet, mit Küchenpapier trocken.
- Drehen Sie das Rohr um und setzen Sie es in den Rohrhalter ein.
- Geben Sie 100 μl PBS in das Röhrchen.
- Lösen Sie das EV-Pellet mit der Spitze einer Pipette vorsichtig mit kreisenden Bewegungen in dem in Schritt 7.1 markierten Bereich am Boden des Röhrchens.
- Vortex kurz (1-2 Sekunden), zweimal.
- Beschriften Sie ein neues 13-ml-Ultrazentrifugationsröhrchen, indem Sie einen Kreis an der Unterseite des Röhrchens zeichnen, an dem sich das erwartete EV-Granulat bilden wird, und eine Linie um den Röhrchenhals zur Orientierung im Rotor des Ultrazentrifugationsröhrchens markieren. Beschriften Sie das Röhrchen mit einer Probenkennung.
- Setzen Sie das Rohr in den Rohrhalter ein.
- Geben Sie 12 ml PBS mit einer sauberen Spritze und Nadel in ein neues Ultrazentrifugationsröhrchen.
- Entnehmen Sie mit einer Spritze und einer Nadel die 100 μl EV-Probe und geben Sie sie in das Röhrchen. Mischen Sie die EVs und PBS vorsichtig und spülen Sie die Spritze und die Nadel, indem Sie PBS vorsichtig auffangen und in den Schlauch aspirieren.
HINWEIS: Vermeiden Sie die Bildung von Blasen. - Verschließen Sie das Ultrazentrifugationsröhrchen mit einem Lötkolben und stellen Sie sicher, dass das Röhrchen luftdicht ist, indem Sie das Röhrchen vorsichtig zusammendrücken.
- Setzen Sie die Ultrazentrifugationsröhrchen in den Ultrazentrifugationsrotor ein. Stellen Sie sicher, dass die oben auf der Röhre markierte Linie und der Kreis an der Basis der Röhre nach außen zeigen.
- Ultrazentrifuge bei 120.000 x g für 1 h bei 4 °C.
- Entfernen Sie den Rotor vorsichtig aus der Ultrazentrifuge.
- Befestigen Sie eine 16-g-Nadel an einer 12-ml-Spritze.
- Durchstechen Sie die Oberseite des Ultrazentrifugationsröhrchens und führen Sie die Nadel bis zu 2 cm in die Oberseite des Röhrchens ein; Den Überstand in die Spritze aspirieren und verwerfen.
- Schneide die Oberseite des Rohrs mit einer Schere ab.
- Gießen Sie den restlichen Überstand in einem schnellen Zug ab.
- Lassen Sie die Tube 1 min kopfüber hängen.
- Tupfen Sie alle Flüssigkeiten, die sich am Rand des Rohrs bilden, trocken.
- Setzen Sie das Rohr in den Rohrhalter ein.
- Geben Sie 100 μl PBS in das Röhrchen.
- Lösen Sie das EV-Pellet mit der Spitze einer Pipette vorsichtig mit kreisenden Bewegungen in dem in Schritt 7.24 markierten Bereich am Boden des Röhrchens.
- Vortex kurz (1-2 Sekunden), zweimal.
- Pipettieren Sie 100 μl PBS/EV-Lösung in ein sauberes 1,5-ml-Röhrchen und bewahren Sie es auf nassem Eis auf.
HINWEIS: EV sind bereit für die Weiterverarbeitung und können eingefroren und bei -80 °C gelagert werden.
8. Bestimmung der EV-Größe und -Konzentration mittels Nanoparticle Tracking Analysis (NTA)
- Vorbereiten des Systems
HINWEIS: Eine detaillierte Methode zur Verwendung der Nanopartikel-Tracking-Analyse (NTA) zur Bestimmung der EV-Größe und -Konzentration wurde von Mehdiani et al. berichtet13.- Tauen Sie die Proben auf und halten Sie sie bei 4 °C.
- Starten Sie die NTA-Software, indem Sie auf das Software-Symbol klicken.
- Die Software öffnet sich unter "Zellenprüfung" und fordert Sie auf, die Durchflusszelle mit deionisiertem Wasser zu füllen. Füllen Sie eine 10-ml-Spritze mit entionisiertem Wasser und schieben Sie sie in die Maschine, wobei Sie sicherstellen, dass keine Luftblasen in die Ladekammer gelangen.
- Befolgen Sie die Anweisungen auf dem Bildschirm, um das System durch eine Qualitätsprüfung (QC) vorzubereiten. Die Software führt eine Zellprüfung durch und gibt ein Maß für die Zellqualität an. Dies sollte sehr gut bis ausgezeichnet sein.
- Bereiten Sie die Qualitätskontrolle vor, die aus einer 100 Nanometer großen Polystyrolkugel besteht. Pipettieren Sie 1 μl des Standards in 999 μl deionisiertes Wasser (verdünntes Material). Geben Sie anschließend 10 μl des verdünnten Stoffes zu 2,5 mL deionisiertem Wasser (QC-Probe). Mischen Sie die Lösung, indem Sie sie 2-3 s lang vorsichtig vortexen und pipettieren.
HINWEIS: Qualitätskontrollproben sollten jeden Tag frisch zubereitet werden, aber die anfängliche verdünnte Stammprobe ist 1 Woche lang bei 4 °C haltbar. - Füllen Sie eine 1-ml-Spritze mit dem 1 ml der QC-Probe und entfernen Sie alle Luftblasen aus der Spritze.
- Injizieren Sie, ohne Luftblasen einzubringen, in die NTA-Probenladekammer, indem Sie die Spitze der Spritze vorsichtig in die Injektionskammer kippen und gleichzeitig den Kolben drücken. Injizieren Sie bis zu 950 μl der QC-Probe in die Kammer.
HINWEIS: Führen Sie keine Luftblasen in die Probenladekammer ein. - Warten Sie, bis die Software eine automatische Ausrichtung durchführt (um die Kamera zu fokussieren) und die Spannung auf Z-Potential-Messwerte überprüft - das Spannungsdiagramm sollte eine glatte U-förmige Kurve sein.
HINWEIS: Wenn die Fehlermeldung "Spannung zu niedrig Fehler" angezeigt wird, ist die Zelle möglicherweise durch die Reinigung nass oder nicht sicher oder es kann eine Luftblase vorhanden sein. - Sobald die automatische Ausrichtungs-/Spannungsprüfung abgeschlossen ist, verwenden Sie das Dropdown-Menü Kameraposition, um alle Positionen (0,1-0,9) auf ungewöhnliche Markierungen zu überprüfen - das Vorhandensein dieser Markierungen deutet darauf hin, dass die Zelle möglicherweise gespült und/oder gereinigt werden muss. Nach der Qualitätskontrolle zeigt das System "Bereit für Messungen" an.
- Grundieren Sie die Durchflusszelle mit PBS. Öffnen Sie die Registerkarte Pumpe/Temperatur und klicken Sie unter Pumpe auf Run for pump 2 (PBS reservoir). Dadurch wird PBS 1 Minute lang durch die Zelle geleitet und dann automatisch gestoppt.
HINWEIS: Es können sich Partikel in der Kammer befinden, die jedoch durch Drücken von 10 ml PBS durch die Ladeöffnung entfernt werden können. - Füllen Sie eine 10-ml-Spritze mit PBS und laden Sie sie ohne Luftblasen in die Kammer.
- Erstellen Sie ein Protokoll für die Ausführung des Geräts, das mehrere Positionen des Lasers misst und den Durchschnitt der Partikel pro Frame bildet.
- Überprüfen Sie, ob die Partikelzahl kleiner als 5 (so nah wie möglich an 0) ist, bevor Sie fortfahren - spülen Sie bei Bedarf mit mehr PBS.
- Mischen Sie die EV-Probe vor der Verdünnung durch Pipettieren.
- Die Probe wird im Verhältnis 1:1.000 in PBS verdünnt und durch Pipettieren gemischt. Füllen Sie eine 1-ml-Spritze mit der Probe und laden Sie sie ohne Luftblasen in die Kammer.
- Vergewissern Sie sich, dass die Partikelanzahl innerhalb des akzeptablen Bereichs liegt (der Balken über dem Zählwert sollte sich im grünen Bereich oder in der Nähe davon befinden). Ist dies nicht der Fall, passen Sie die Probenverdünnung entsprechend an. Geben Sie zwischen den Proben und Probenverdünnungen 10 ml PBS in die Vorderseite des Geräts, um die Kammer zu reinigen, und laden Sie dann 1 ml der verdünnten Probe.
HINWEIS: Jede Probe hat eine unabhängige Verdünnung, die auf der Konzentration der Probe basiert. Die Partikelzahl des Geräts sollte zwischen 50 und 200 Partikeln pro Bild liegen, um genaue Messungen zu ermöglichen. - Gehen Sie in der Software auf die Registerkarte Messung .
- Klicken Sie auf die Schaltfläche Videoaufnahme ausführen .
- Geben Sie einen Probennamen ein und wählen Sie einen Zielordner aus, um die Messung zu speichern.
- Erstellen Sie eine EV-Standardarbeitsanweisung (SOP).
- Erstellen > Speichern > Laden Sie eine EV-SOP, die die Partikelanzahl und -größe bei einer Verschlusszeit von 100 und einer Kameraempfindlichkeit von 80 misst, 11 Kamerapositionen für 2 Zyklen.
HINWEIS: Sofern die Probe keine besonderen Anforderungen stellt, müssen diese Einstellungen nicht geändert werden. - Geben Sie die Verdünnung der Probe ein und fügen Sie alle anderen Noten hinzu, die Sie hinzufügen möchten.
- Klicken Sie auf OK und die Software beginnt automatisch mit der Aufnahme. Sobald der Vorgang abgeschlossen ist, lädt die Software automatisch eine Popup-Tabelle, in der die durchschnittliche Partikelanzahl und -größe für jede Kameraposition angezeigt wird.
HINWEIS: Berühren Sie während dieser Zeit nicht das Gerät oder in der Nähe befindliche Arbeitsplatten, da Vibrationen die endgültigen Messwerte beeinflussen. - Kamerapositionen mit statistisch ungewöhnlichen Messwerten werden automatisch ausgeschlossen – um Kamerapositionen manuell auszuschließen (oder ausgeschlossene Positionen aus irgendeinem Grund wieder einzubeziehen), klicken Sie auf das Kontrollkästchen links neben den Beispieldetails.
- Klicken Sie auf Weiter und die Software erstellt und öffnet eine PDF-Datei der Probe mit den Größen- und Konzentrationsergebnissen.
- Erstellen > Speichern > Laden Sie eine EV-SOP, die die Partikelanzahl und -größe bei einer Verschlusszeit von 100 und einer Kameraempfindlichkeit von 80 misst, 11 Kamerapositionen für 2 Zyklen.
- Statistische Analyse
- Analysieren Sie die NTA-Daten durch unidirektionale oder bidirektionale ANOVA mit Post-hoc-Tukey-Korrektur. Daten als Gruppe darstellen bedeutet ± Standardabweichung. Ein P-Wert von <0,05 wurde als signifikant angesehen.
Ergebnisse
Wir bestimmten die Menge der aus humanen Gesäß-Adipozyten isolierten EVs nach dem beschriebenen Protokoll. Wir berechneten die Größe und Konzentration von Adipozyten-abgeleiteten EVs mit Hilfe von NTA (Abbildung 1A,B). Wir verwendeten Scheinmedienkontrollen, bei denen es sich um gleiche Volumina von Medien handelte, die nicht mit Zellen in Kontakt waren, aber kultiviert und dem oben beschriebenen Isolationsverfahren unterzogen wurden. Wir maßen die von Adipozyten abgeleitete EV-Konzentration nach der anfänglichen Isolierung und nach dem Waschen der isolierten Adipozyten-EVs in PBS (Abbildung 1A,B) und zeichneten die Gruppenmittelwerte ± Standardabweichung (SD) auf, die durch eine bidirektionale ANOVA mit post-hoc-Tukey-Korrektur analysiert wurde.
Die Konzentration von Adipozyten-abgeleiteten EVs, die durch NTA aus der 1. Isolierung bestimmt wurde, reichte von 6,10 x 106 bis 2,70 x 107 mit einem Median von 2,60 x 107 EVs/ml (Abbildung 1 A, B). Nach einer PBS-Wäsche gab es signifikant weniger von Adipozyten abgeleitete EVs pro Probe (Abbildung 1A,B) (P < 0,001), die zwischen 5,00 x 105 und 4,30 x 106 lagen, mit einem Median von 2,70 x 106 EVs/ml. Die Scheinmedienkontrollen enthielten keine EVs, wie von NTA bestimmt (Abbildung 1A, B). Die modale Größe der EVs aus der ersten Isolierung betrug 125 nm und 105 nm nach einer PBS-Wäsche (Abbildung 1A,B). Das beschriebene Protokoll wurde weiterhin auf abdominale und von Gesäßmuskeln abgeleitete Adipozyten aus größeren T175 cm2 Flaschen angewendet. Diese Gesäß-EV-Proben, die aus T175 cm2-Flaschen gewonnen wurden, reichten in der Konzentration von 3,60 x 107 bis 7,50 x 107/ml mit einem Median von 5,40 x 107 EVs/ml. Die Konzentration der von abdominalen Adipozyten abgeleiteten EVs aus T175 cm2 Kolben reichte von 6,30 x 107 bis 8,60 x 107/ml mit einem Median von 7,60 x 107 EVs/ml (Abbildung 1C, D). Die modale Größe der EVs, die aus den T175 cm2-Kolben abgeleitet wurden, betrug 115 nm für gesäßige EVs und 125 nm abdominale EVs. Wir bestätigten das Vorhandensein von EV-Protein in von Gesäß- und Bauchadipozyten abgeleiteten EVs durch Immunblotting für das Tumor-Suszeptibilitätsgen 101 (TSG101) und fanden heraus, dass abdominale und gesäßliche Adipozyten-Zellpellets und abdominale und gesäßliche Adipozyten-abgeleitete EVs positiv für TSG101 waren, während sie als Scheinkontrollmedien, die nicht mit Zellen in Kontakt gekommen waren, negativ waren (Abbildung 1E).
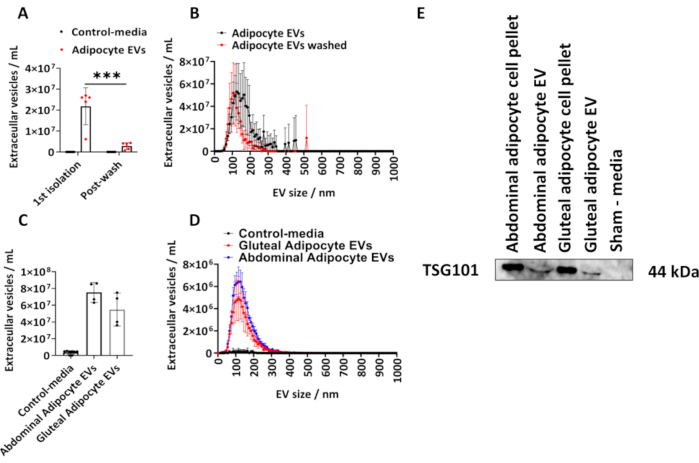
Abbildung 1: Größe und Verteilungsprofil von Adipozyten-abgeleiteten EVs aus Zellkulturmedien und Bestimmung des EV-Proteins TSG101. Gesamt-EV-Konzentrationen und Größen- und Konzentrationsverteilungsprofile, bestimmt durch Nanoparticle Tracking Analysis (NTA) ab der 1. Isolierung (N = 5) und nach dem Waschen mit PBS (N = 6). (C) Gesamtkonzentrationen und (D) Größen- und Konzentrationsverteilungsprofile, bestimmt durch NTA für abdominale und gesäßliche EVs aus T175cm2-Kolben (N = 4 pro Gruppe). (E) Western Blot von von Gesäß und Bauch abgeleiteten EVs für TSG101. Zellpellets und Scheinmedien wurden als Positiv- bzw. Negativkontrollen verwendet. Bei den Daten handelt es sich um Gruppenmittelwerte ± Standardabweichung (SD). Eine unidirektionale oder bidirektionale ANOVA mit Post-hoc-Tukey-Korrektur. P < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir demonstrieren ein Protokoll für die Isolierung von gesäß- und abdominalen Adipozyten-abgeleiteten EVs aus Zellkulturüberständen und bestimmen deren Größe und Konzentration mit NTA 7,14,15. Wir zeigen, dass kultivierte humane Adipozyten EVs produzieren und in die Zellkulturmedien abgeben, die anschließend durch Filtration und Ultrazentrifugation isoliert werden können. Wir bestimmten das Größen- und Konzentrationsprofil von isolierten Adipozyten-abgeleiteten EVs und zeigen, dass die Ultrazentrifugation wahrscheinlich Kontaminanten aus den Zellkulturmedien co-isoliert hat und dass das Waschen der isolierten EV-Pellets in PBS ihre Konzentration in einer zweiten NTA-Messung signifikant senkt. Des Weiteren wurde die Reinheit der isolierten von Gesäß und Bauch abgeleiteten EVs durch Western Blotting für TSG101, einen EV-Marker, bestimmt. Aus dem Gesäß und dem Bauch gewonnene EV-Präparate waren positiv für TSG101, aber vor allem fehlte dies in Kontrollmedien, die nicht den Zellen ausgesetzt waren. In den vorgestellten Experimenten wurden humane Adipozyten als Elternzellen verwendet, die EVs erzeugen, aber die beschriebene Methode eignet sich auch für andere Zelltypen, einschließlich Endothelzellen, glatte Gefäßmuskulatur, Skelettmuskulatur, Immunzellen und für die Isolierung von EVs aus plättchenarmem Plasma oder Serum von Patienten.
Von Adipozyten abgeleitete EVs sind bei Stoffwechselerkrankungen erhöht, und die Bestimmung von Veränderungen in der Größe und Anzahl der Adipozyten-EVs in vivo ist komplex, da biologische Flüssigkeiten wie Blut EVs aus einer Reihe von Zellquellen enthalten, die auch an der Pathogenese von Stoffwechselerkrankungen beteiligt sind, einschließlich EVs aus Endothelzellen, Skelettmuskulatur, Erythrozyten und Immunzellen. Die hier beschriebene Methode ermöglicht die Bestimmung von humanen Adipozyten-EVs, was ein nützliches Modell für mechanistische Studien darstellen könnte, die die Faktoren untersuchen, die zur EV-Biogenese in Adipozyten führen, was derzeit unbekannt ist. Wichtig ist, dass die Bestimmung der EV-Biogenese von Adipozyten und die Art und Weise, wie die Beladung bestimmter RNAs, Proteine und Metaboliten in Adipozyten-EVs orchestriert wird, neue therapeutische Möglichkeiten aufzeigen könnte, um die pathogene EV-Signalgebung von Adipozyten bei metabolischer Dysfunktion zu stören. Detaillierte Studien werden ein besseres Verständnis dafür liefern, wie sich die Größe, Anzahl, der Biogeneseweg und die EV-Fracht (RNA, Proteine und Metaboliten) als Reaktion auf Krankheiten oder Reize wie Störungen von Sauerstoff, Glukose, Lipiden und Insulin verändern. Informationen über die Rolle von Umweltfaktoren auf die EV-Signalgebung von Adipozyten bei Stoffwechselerkrankungen und darüber, wie von Adipozyten abgeleitete EVs zur Entzündung des Fettgewebes beitragen, könnten neue therapeutische Ziele bei Stoffwechselerkrankungen aufdecken.
Begrenzungen
In-vitro-Generierung von aus Adipozyten gewonnenen EVs
Die Verwendung von humanen Präadipozyten in vitro stellt ein Modellsystem dar, um die Freisetzung und Bildung von Adipozyten-abgeleiteten EVs nach der In-vitro-Adipozytendifferenzierung zu untersuchen, aber es gibt eine Reihe von Einschränkungen. Insbesondere unterscheiden sich in vitro abgeleitete Adipozyten-EVs wahrscheinlich von aus Fett gewonnenen EVs, wie z. B.Plasma-14 , in ihrer Größe, Konzentration, EV-Protein, -RNA, -Metaboliten und Funktion. Diese EV-Unterschiede könnten durch andere Nicht-Adipozytenzellen beeinflusst werden, die in vivo im Fettgewebe ansässig sind, wie z. B. aus Fettgewebe gewonnene Stammzellen, Endothelzellen und Makrophagen, die eng mit der Physiologie des Fettgewebes verbunden sind und eine Rolle bei der Pathologie des Fettgewebes, einschließlich der Entzündung des Fettgewebes, gezeigt haben.
Es sollte beachtet werden, dass das hier beschriebene 2-wöchige In-vitro-Differenzierungsprotokoll möglicherweise nicht ausreicht, um vollständig ausgereifte Adipozyten zu erzeugen, die den in vivo beobachteten Adipozyten entsprechen. In vitro differenzierte Adipozyten, die in einem zweidimensionalen (2D) Format gezüchtet wurden, weisen eine andere Morphologie auf als in vivo-Zellen und entwickeln keine unilokulären Lipidtröpfchen. Darüber hinaus werden die in diesem Protokoll beschriebenen Präadipozyten aus der fetten stroma-vaskulären Fraktion gewonnen, und wir haben den Beitrag anderer Zelltypen, die während der Zellisolierung nicht vollständig eliminiert wurden, zum EV-Pool nicht bewertet.
Der Verlust wichtiger Zell-zu-Zell-Wechselwirkungen von Adipozyten mit anderen Nicht-Adipozyten im Fettgewebe kann die EV-Erzeugung, Freisetzung, das EV-Protein und die EV-RNA von Adipozyten und aus Fettgewebe gewonnene Stammzellen beeinflussen16. Eine Bewertung, wie sich in vitro abgeleitete Adipozyten-EV von den in vivo hergestellten EV unterscheiden, wurde jedoch nicht erschöpfend durchgeführt.
Primäre Gewebebiopsien enthalten Blut und daher können die abgeleiteten Zellkulturen Erythrozyten und von Erythrozyten abgeleitete EVs enthalten, unabhängig von den mehrfachen Waschungen und Medienwechseln, die in unserem Protokoll hervorgehoben werden. Ein zusätzlicher Lyseschritt der roten Blutkörperchen nach der Isolierung der stroma-vaskulären Fraktion kann erforderlich sein, um die Auswirkungen von Erythrozyten auf Adipozyten zu eliminieren. Dies ist wichtig, da von Erythrozyten abgeleitete EVs die zelluläre Funktion anderer Zellen beeinflussen können17 und von Erythrozyten abgeleitete EVs bei oxidativem Stress18 und bei Patienten mit metabolischem Syndrom erhöht sind19,20. Daher kann Fettgewebe, das von Patienten mit Stoffwechselerkrankungen stammt, erhöhte Konzentrationen von Erythrozyten-abgeleiteten EVs enthalten, die den In-vitro-Phänotyp von Adipozyten beeinflussen können.
Beseitigung von FBS
Das beschriebene Protokoll verwendete FBS in den Wachstumsmedien während der adipogenen Differenzierung, aber anschließend wurden die Adipozyten vor der endgültigen Medienentnahme für die Isolierung von Adipozyten-abgeleiteten EVs mehreren Medienveränderungen unterzogen. Daher gingen wir davon aus, dass das Gesamtrisiko für eine Kontamination von FBS-abgeleiteten EVs in den EVs-Präparaten gering war und bestätigten anschließend durch Western Blotting auf TSG101, dass keine verbleibenden EVs in den Zellkulturmedien vorhanden waren. Bei der Isolierung von zellkultivierten EVs aus Zellquellen, die FBS erfordern, muss EV-abgereichertes FBS verwendet oder bovine EVs durch Ultrazentrifugation depleugiert werden, um zu verhindern, dass bovine EVs die EV-Konzentrationen der Adipozyten und die Analyse der EV-Fracht der Adipozyten verfälschen. Es ist bekannt, dass die Depletion von Serum aus Adipozyten ihre zellulären Reaktionen verändert21 , und daher muss die Untersuchung sicherstellen, dass die Serumdepletion oder EV-Depletion aus dem Serum ihre Adipozytenkulturen wirklich repräsentativ für die Adipozytenbiologie macht.
Technische Begrenzung der EV-Isolierung durch Filtration und Ultrazentrifugation
Wir beschreiben eine Methode der Ultrazentrifugation mit Einweg-Kunststoffröhrchen, die vor der Ultrazentrifugation für EV-Isolierungen abgedichtet werden müssen. Wir sind uns bewusst, dass diese versiegelten Einwegtuben für viele Menschen möglicherweise keine wirtschaftliche Option sind, und schlagen vor, ähnliche Tuben zu untersuchen, die keine Abdichtung erfordern und wiederverwendbar sind. Die Prüfärzte müssen jedoch sicherstellen, dass das Waschen von wiederverwendbaren Röhrchen angemessen ist und nicht zu einer fortschreitenden Akkumulation von Protein-, Lipid- und RNA-Verunreinigungen im Laufe der Zeit führt, was sich auf nachgelagerte Untersuchungen von EV-assoziierter Fracht oder auf zelluläre Funktionsstudien auswirken kann.
Das hier beschriebene Filtrations- und Ultrazentrifugationsprotokoll wird seit vielen Jahren verwendet, und mehrere Studien haben die Mängel dieser Methode hervorgehoben, einschließlich der unspezifischen Isolierung von kontaminierenden zellulären Komponenten wie zellulären Mitochondrien, dem Vorhandensein von Kernfragmenten und Bestandteilen der Zellmembran. Darüber hinaus wird das hier beschriebene Verfahren Lipoproteine co-isolieren, die in EV-depletierten FBS vorhanden sind. Das Verfahren kann hier durch den Einsatz von Dichteultrazentrifugation und Größenausschlusschromatographie (SEC) weiterentwickelt werden, um kontaminierende lösliche Proteine und einige Lipoproteine zu eliminieren. In Verbindung mit der PBS-Waschung der isolierten EVs und SEC können die co-isolierten Verunreinigungen begrenzt, aber nicht vollständig eliminiert werden. Daher sollten die Anwender sicherstellen, dass geeignete Kontrollen eingeschlossen werden, einschließlich eines Scheinmediums, das nicht mit Zellen in Kontakt gekommen ist, um lösliche Proteine und Lipoproteine in den Kulturmedien zu berücksichtigen, und einer EV-abgereicherten Überstandskontrolle, um die erfolgreiche Isolierung von EVs aus konditionierten Medien zu demonstrieren, die noch lösliche Proteine und Lipoproteine enthalten.
Die Isolierung von Elektrofahrzeugen durch Filtration und Ultrazentrifugation beruht darauf, dass der Bediener sicherstellt, dass kein übermäßiger Druck auf die Zellkulturüberstände ausgeübt wird, während er durch die Bohrung des Filters oder die Bohrung der Nadel/Spritze geführt wird. Die Anwendung unangemessener Gewalt während dieser Phase des beschriebenen Protokolls kann EVs aufbrechen, die endgültigen EVs-Konzentrationen beeinflussen und freie RNA, Proteine und Metaboliten erzeugen, die einst in EVs eingeschlossen waren. Wir haben hier ein Verfahren beschrieben, das den Spritzenzylinder und damit die Krafteinwirkung auf die EVs in konditionierten Medien nicht erfordert, wenn sie durch den Filter oder die Nadel in ihre Sammelbehälter und Ultrazentrifugationsröhrchen gelangen. Nichtsdestotrotz ist bei der Resuspension des EV-Pellets in PBS weitere Vorsicht geboten. Es muss nur ein kurzer Wirbel verwendet werden, da ein kräftiges Vortexen die EV-Membranen aufbrechen kann.
Nach der Ultrazentrifugation muss der Bediener vorsichtig mit den Ultrazentrifugationsröhrchen umgehen, um das EV-Granulat nicht zu stören. Dies kann erreicht werden, indem die Röhrchen vorsichtig behandelt und langsam zwischen dem Ultrazentrifugationsrotor und dem Röhrchengestell bewegt werden. Weitere Vorsicht ist geboten, wenn ein Loch in die Oberseite des Ultrazentrifugationsröhrchens gestochen wird, um die EV-abgereicherten Überstände abzusaugen. Wenn Sie die Nadel in den oberen Teil des Röhrchens einführen und die Überstände schnell ansaugen, entsteht ein Vakuum im Spritzenzylinder, das den Überstand gewaltsam in das Ultrazentrifugationsröhrchen zurückdrücken und das EV-Pellet aufbrechen kann. Nach dem Schneiden des Ultrazentrifugationsröhrchens zum Abgießen des restlichen Überstands ist Vorsicht geboten, da sich das EV-Pellet lösen kann und das EV-Pellet beim Gießen verworfen wird. Alternativ kann mit einer Spritze und einer Nadel der restliche Überstand langsam entfernt werden, ohne den Schlauch zu gießen oder umzudrehen.
Die Filtration und Ultrazentrifugation von Überständen zur Isolierung von Elektrofahrzeugen ist eine nützliche und effiziente Methode. Es ist jedoch anfällig für die Co-Isolierung von Lipoproteinen und löslichen Proteinen. Diese können gemildert werden, indem die Elektrofahrzeuge (wie beschrieben) mit PBS gewaschen werden, aber dadurch werden nicht alle Verunreinigungen beseitigt. Lösliche Proteine können unter Verwendung von SEC aus der EV-Fraktion eluiert werden, jedoch unterscheidet diese Methode nicht zwischen Lipoproteinen und EVs. SEC-Elutionen, die EVs enthalten, können mit Ultrazentrifugation kombiniert werden, um EVs zu pelletieren. Die Filtration und differentielle Ultrazentrifugation ist eine bevorzugte Methode zur EV-Isolierung gegenüber Fällungstechniken, bei denen Polyethylenglykol verwendet wird, da bei diesen Fällungsmethoden große Mengen löslicher Proteine und Lipoproteine in Zellkulturüberständen und anderen biologischen Flüssigkeiten co-isoliert werden. Die Ultrazentrifugation wird wahrscheinlich für viele die am leichtesten zugängliche Form der EV-Isolierung bleiben, da die meisten Labore mit einer Ultrazentrifuge ausgestattet sind, wodurch die anfänglichen Anlaufkosten gesenkt werden. Für viele wird die Ultrazentrifugation zur Isolierung von Elektrofahrzeugen jedoch durch das Volumen der Ultrazentrifugationsröhrchen und das Ausgangsvolumen des Materials behindert. Mehrere hundert Milliliter Kulturüberstände können benötigt werden, um eine ausreichende EV-Menge für die nachgeschaltete Proteomik oder RNA-Sequenzierung zu produzieren. Es ist jedoch wahrscheinlich, dass Ultrazentrifugationstechniken für die EV-Isolierung von anderen Techniken wie SEC und Immunaffinitätserfassung mit den Tetraspaninen CD9, CD63 und CD81 begleitet werden, um die Reinheit isolierter EVs zu verbessern. Andere Techniken, wie z. B. kommerziell erhältliche Fällungslösungen und Durchflusszytometrie, können bei spezifischen Untersuchungen von gewissem Nutzen sein.
Reinheit von EV-Präparaten
Wir bestätigten die Isolierung von Adipozyten-abgeleiteten EVs durch Western Blot für TSG101, aber dieser einzelne Western Blot entspricht nicht den von der International Society for Extracellular Vesicles (ISEV) veröffentlichten Richtlinien. Eine weitere Charakterisierung dieser von Adipozyten abgeleiteten EVs wäre ideal mit den Tetraspaninen CD9, CD63 und CD81, um Exosomen und Marker zellulärer Kontamination wie Histon H3, Albumin und Apolipoprotein A1 zu identifizieren.
Das hier vorgestellte Protokoll ermöglicht die Isolierung von EVs aus Zellkulturüberständen aus einer Reihe von Zellquellen, einschließlich Adipozyten zur Bestimmung der EV-Größe, Konzentration, EV-Marker durch Western Blot und des Nutzens in Omics-basierten Technologien wie Proteomik und RNA-Sequenzierung.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
N.A. und R.C. bekennen sich zur Unterstützung durch Forschungsstipendien der British Heart Foundation, des Centre of Research Excellence, Oxford (N.A. und R.C.; RE/13/1/30181 und RE/18/3/34214), British Heart Foundation Project Grant (N.A. und R.C.; PG/18/53/33895), das Tripartite Immunometabolism Consortium, die Novo Nordisk Foundation (NNF15CC0018486), das National Institute for Health Research (NIHR), das Oxford Biomedical Research Centre (BRC), die Nuffield Benefaction for Medicine und der Wellcome Institutional Strategic Support Fund (ISSF). Die geäußerten Ansichten sind die des Autors/der Autoren und nicht unbedingt die des NHS, des NIHR oder des Gesundheitsministeriums.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
Referenzen
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677 (2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974 (2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252 (2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313 (2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -. S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten