Method Article
Aislamiento y caracterización de vesículas extracelulares derivadas de adipocitos humanos mediante filtración y ultracentrifugación
En este artículo
Resumen
Describimos el aislamiento de vesículas extracelulares (VE) derivadas de adipocitos humanos a partir de tejido adiposo glúteo y abdominal mediante filtración y ultracentrifugación. Caracterizamos las VE derivadas de adipocitos aisladas mediante la determinación de su tamaño y concentración mediante análisis de seguimiento de nanopartículas y mediante western blot para detectar la presencia del gen de susceptibilidad tumoral 101 de la proteína EV (TSG101).
Resumen
Las vesículas extracelulares (VE) son envolturas encerradas en lípidos que transportan material biológicamente activo como proteínas, ARN, metabolitos y lípidos. Las VE pueden modular el estado celular de otras células localmente en microambientes tisulares o a través de la liberación en sangre periférica. Las VE derivadas de adipocitos están elevadas en la sangre periférica y muestran alteraciones en su carga (ARN y proteína) durante las alteraciones metabólicas, como la obesidad y la diabetes. Las VE derivadas de los adipocitos pueden regular el estado celular de las células vasculares vecinas, como las células endoteliales y los macrófagos residentes en el tejido adiposo, para promover la inflamación del tejido adiposo. La investigación de las alteraciones en las VE derivadas de los adipocitos in vivo es compleja porque las VE derivadas de la sangre periférica son muy heterogéneas y contienen VE de otras fuentes, a saber, plaquetas, células endoteliales, eritrocitos y músculo. Por lo tanto, el cultivo de adipocitos humanos proporciona un sistema modelo para el estudio de las VE derivadas de adipocitos. Aquí, proporcionamos un protocolo detallado para la extracción de EV pequeños totales de medios de cultivo celular de adipocitos glúteos y abdominales humanos mediante filtración y ultracentrifugación. Además, demostramos el uso del análisis de seguimiento de nanopartículas (NTA) para la cuantificación del tamaño y la concentración de EV y mostramos la presencia del gen de susceptibilidad tumoral 101 de la proteína EV (TSG101) en los EV derivados de los adipocitos glúteos y abdominales. Los EV aislados de este protocolo se pueden utilizar para el análisis posterior, incluida la microscopía electrónica de transmisión, la proteómica, la metabolómica, la secuenciación de ARN pequeño, los microarrays, y se pueden utilizar en estudios funcionales in vitro/in vivo.
Introducción
Las vesículas extracelulares (VE) son envolturas encerradas en lípidos que transportan material biológicamente activo como proteínas, microARN, metabolitos y lípidos. El término VE denota varias subpoblaciones, que incluyen exosomas, microvesículas (micropartículas/ectosomas) y cuerpos apoptóticos1. Las VE pueden servir como biomarcadores porque están implicadas en la señalización patológica y se liberan en los biofluidos, como la sangre y la orina. Las VE pueden modular el estado celular de otras células localmente en microambientes tisulares o a través de la liberación en sangre periférica2. Las VE tienen características de su célula madre, pero la diferenciación de cada subpoblación se basa principalmente en el tamaño de la EV y el contenido de proteínas, como los marcadores de las EV, incluida la presencia de tetraspaninas (CD9, CD63 y CD81), el gen de susceptibilidad tumoral 101 (TSG101) y la proteína X que interactúa con ALG-2 (ALIX). Estos marcadores proteicos son representativos del origen endosomal (CD9, CD63 y CD81) de los exosomas, que se generan dentro de cuerpos multivesiculares o representan proteínas asociadas con la gemación o la formación de burbujas directamente desde la membrana plasmática para las microvesículas. Sin embargo, existe una superposición significativa entre estas subpoblaciones, y es difícil distinguir subpoblaciones individuales en biofluidos complejos como el plasma, el suero o la orina.
Los trastornos metabólicos, como la obesidad, la resistencia a la insulina y las alteraciones de la glucosa extracelular, el oxígeno y la inflamación, pueden alterar el tamaño y la concentración de los VE y su carga. Los VE derivados de adipocitos transportan perilipina A, adiponectina y muestran alteraciones en su carga proteica y de ARN durante la obesidad y la diabetes 3,4,5,6. Las VE derivadas de los adipocitos regulan el estado celular de las células endoteliales vasculares vecinas7 y los macrófagos residentes en el tejido adiposo para promover la inflamación del tejido adiposo y la resistencia a la insulina 8,9,10,11. La investigación de las alteraciones en las VE derivadas de los adipocitos in vivo es compleja porque las poblaciones de VE derivadas de biofluidos complejos como el plasma, el suero o la orina contienen VE de múltiples fuentes, como plaquetas, células endoteliales, eritrocitos y músculo, que están implicadas en la patogénesis de la disfunción metabólica y la enfermedad.
Por lo tanto, el cultivo y la diferenciación in vitro de preadipocitos humanos proporcionan un sistema modelo para el estudio de las VE derivadas de adipocitos. Aquí, proporcionamos un protocolo detallado para la extracción de EV pequeños totales de medios de cultivo celular de adipocitos humanos utilizando filtración con jeringa y ultracentrifugación. La ultracentrifugación sigue siendo un método popular de aislamiento para los vehículos eléctricos porque es fácilmente accesible y requiere poco conocimiento especializado previo. Sin embargo, otros métodos, como la precipitación, la cromatografía de exclusión por tamaño y la captura de inmunoafinidad mediante tetraspaninas, permiten el aislamiento de EV a partir de una variedad de biofluidos, incluidos plasma, suero, orina y medios de cultivo celular acondicionados. Cada método, incluido el protocolo de ultracentrifugación descrito aquí, produce preparaciones de EV de pureza variable porque los métodos pueden coaislar proteínas solubles y lipoproteínas, que pueden enmascararse como EV. La combinación de este protocolo de ultracentrifugación con otros métodos como la centrifugación por densidad, la cromatografía de exclusión por tamaño y la captura por inmunoafinidad aumenta drásticamente la pureza de los VE aislados. Pero al igual que la ultracentrifugación, estos otros métodos no permiten la captura de subpoblaciones independientes de VE a partir de muestras complejas como sangre, plasma y orina. Por lo tanto, los cultivos de poblaciones celulares seleccionadas siguen siendo uno de los métodos más sólidos para generar altos rendimientos de EV específicos de celdas. Cada método de VE tiene una serie de advertencias y la elección del método puede afectar los tipos de VE aislados y sus concentraciones, lo que puede sesgar las investigaciones mecanicistas posteriores sobre la señalización celular y tisular y la determinación de la carga de VE para estudios de diagnóstico; estos problemas metodológicos del aislamiento de EV se discuten en otro lugar y en las secciones de limitaciones a continuación 4,12. En este artículo, describimos el aislamiento de VE derivadas de adipocitos humanos mediante filtración y ultracentrifugación. Además, demostramos el uso del análisis de seguimiento de nanopartículas (NTA) para la cuantificación del tamaño y la concentración de EV y mostramos la presencia del gen de susceptibilidad tumoral 101 (TSG101) de la proteína EV en nuestros EV derivados de adipocitos humanos. Los EV aislados de este protocolo se pueden utilizar para el análisis posterior, incluida la microscopía electrónica de transmisión, la proteómica, la metabolómica, la secuenciación de ARN pequeño, los microarrays, y se pueden utilizar en estudios funcionales in vitro/in vivo.
Protocolo
Todos los métodos fueron aprobados por la junta de revisión de ética institucional de la Universidad de Oxford. El tejido adiposo se obtuvo mediante biopsia con aguja bajo anestesia local de voluntarios sanos.
1. Preparación del medio de cultivo celular y tampones
- Prepare un tampón de digestión de colagenasa disolviendo colagenasa H (1 mg/mL) en una solución salina equilibrada de Hanks (HBSS) (sin cloruro de calcio y sin cloruro de magnesio) y un filtro estéril utilizando un filtro de jeringa de poro de 0,2 μm.
- Prepare el tampón de digestión de colagenasa no más de 10 minutos antes de usarlo.
- Prepare el medio de crecimiento (GM) de la siguiente manera: Dulbecco's Modified Eagle's Medium/Ham mezcla de nutrientes F12 (DMEM/F12) suplementada con 10% de suero fetal bovino (FBS), 100 unidades/mL de penicilina, 100 μg/mL de estreptomicina, 2 mM de L-glutamina y 0,5 ng/mL de factor de crecimiento de fibroblastos (FGF).
- Prepare el medio de diferenciación básico (DM básico) de la siguiente manera: DMEM/F12 suplementado con 100 unidades/mL de penicilina, 100 μg/mL de estreptomicina, 2 mM de L-glutamina, 17 μM de pantotenato, 100 nM de insulina humana, 10 nM de triyodo-L-tironina, 33 μM de biotina, 10 μg/mL de transferrina y 1 μM de dexametasona.
- Prepare el medio de diferenciación completo (DM completa) complementando la MS básica del paso 1.3 con 0,25 mM de 3-isobutil-1-metilxantina y 4 μM de troglitazona.
- Prepare 10 mM de soluciones madre de ácidos grasos complejadas al 10% de albúmina sérica bovina (BSA) esencialmente libre de ácidos grasos de la siguiente manera.
- Disolver 16 g de BSA en 160 mL de medio DMEM/F12 y calentar a 37 °C. En tres tubos cónicos separados de 50 ml, pese 150 mg de oleato de sodio, 139 mg de palmitato de sodio y 151 mg de linoleato de sodio. Agregue 50 mL de la solución BSA calentada a cada tubo y mezcle bien mediante vórtice repetido.
- Vuelva a colocar los tubos de oleato y linoleato en el baño de agua a 37 °C durante 15 min. Mezclar en vórtice hasta que se disuelva por completo.
- Para la solución de palmitato, coloque el tubo en un baño de agua a 65 °C durante 2-3 min. Mezclar vigorosamente por vórtice.
- Repita el paso 1.5.3 hasta que se disuelva por completo, aproximadamente 30 min.
NOTA: Es posible que algunas partículas pequeñas aún sean visibles. - Filtre las soluciones de ácidos grasos estériles con un filtro de jeringa de poro de 0,2 μm.
- Confirmar la concentración de ácidos grasos no esterificados de cada solución madre mediante un ensayo adecuado.
NOTA: Las reservas de ácidos grasos deben ser de 10 mM (±10%) para dar una relación molar de 6:1 entre el ácido graso y el BSA. Si la concentración está fuera de este rango, la solución madre debe rehacerse. Las soluciones madre pueden alícuota y almacenarse a -30 °C.
2. Digestión de biopsias de tejido adiposo humano
- Cuele lentamente el contenido de la jeringa de biopsia a través de un filtro de células estériles de 200 μm conectado a un tubo cónico de 50 ml para que el tejido adiposo se recoja en el filtro.
- Transfiera el colador a un nuevo tubo cónico de 50 mL y lave el tejido adiposo tres veces con 10 mL de HBSS.
NOTA: Puede ser necesario eliminar los coágulos de sangre y el tejido fibroso con tijeras quirúrgicas o repetir el lavado con HBSS para eliminar el exceso de glóbulos rojos. - Pesa el pañuelo lavado.
NOTA: Por lo general, obtenemos 400-800 mg de tejido mediante biopsia con aguja. - Coloque el tampón de digestión de colagenasa en un tubo cónico estéril de 50 ml y agregue el pañuelo lavado. Las tijeras quirúrgicas se pueden usar en este paso para picar el tejido en pedazos de igual tamaño.
NOTA: Utilice 5 mL de tampón por cada 0,5 g de tejido. Para tejidos más grandes, las muestras se pueden picar en una placa de Petri. - Coloque el tubo en un baño de agua agitado a 37 °C e incube durante 35-40 min.
NOTA: Después de una digestión exitosa, la solución debe tener un aspecto lechoso. Si todavía quedan pequeños trozos de tejido visibles, agite con la mano durante 10-20 segundos más.
3. Aislamiento de preadipocitos
- Para peletizar la fracción preadipocitaria centrífuga a 1.000 x g durante 5 min.
- Aspire y deseche la capa de adipocitos flotantes y el sobrenadante, dejando aproximadamente 1 mL de HBSS cubriendo la célula granulada.
- Vuelva a suspender el pellet en 5 mL de HBSS y pase la suspensión celular a través de una malla de 250 μm de tamaño de poro seguida de una malla de 100 μm para eliminar cualquier material no digerido. Recoja la suspensión celular en un tubo cónico de 15 mL.
- Centrifugar a 1.000 x g durante 5 min.
NOTA: Después de este paso, la fracción de preadipocitos se puede tratar con una solución de lisis de glóbulos rojos si la contaminación de los glóbulos rojos es un problema. - Aspirar y desechar el sobrenadante.
- Vuelva a suspender el pellet de células en 5 mL de GM (paso 1.2) y siembre en un matraz de cultivo de tejidos adherente de 25cm2 . Colocar el matraz en una incubadora de cultivos celulares (5% CO2, 37 °C).
4. Mantenimiento de cultivos de preadipocitos
- Reemplace el MI cada 2 días mientras las células están proliferando
NOTA: Las tasas de proliferación celular pueden variar entre donantes.- Cuando las células alcancen aproximadamente el 80% de confluencia, transfiéralas a un matraz de cultivo de tejido adherente de 75cm2 . Retire el GM y lave las células con solución salina tamponada con fosfato (PBS).
- Deseche el PBS y agregue 0,5 mL de enzimas de disociación celular altamente purificadas para disociar las células adheridas. Incubar a 37 °C durante 5 min.
- Golpee el matraz con fuerza para liberar las células y agregue 5 mL de GM. Recoja la suspensión de células en un tubo cónico de 15 mL.
- Centrifugar a 1.000 x g durante 5 min.
- Aspirar y desechar el sobrenadante. Vuelva a suspender el pellet de celda en 5 mL de GM y transfiéralo a un matraz de 75cm2 . Rellene el GM hasta un volumen final de 12 mL y sustituya el matraz en la incubadora de cultivos celulares (5% CO2, 37 °C).
NOTA: Para mantener las células, continúe cambiando el GM cada 2-3 días. Cuando las celdas alcancen el 80% de confluencia, repita los pasos 4.2-4.3 y divida las celdas 1:3 en nuevos matraces de 75cm2 . Esto se puede repetir durante varios pasajes hasta que se haya generado un número suficiente de células para la configuración experimental. No recomendaríamos más de 10 pasajes ya que la capacidad de proliferación y diferenciación de los preadipocitos disminuye.
5. Siembra de preadipocitos para la diferenciación adipogénica
- Cuente las células usando un hemocitómetro y siembre 200,000 células en múltiples pocillos de una placa de 6 pocillos en 2 mL de GM. Alternativamente, siembre 3.5 millones de celdas por cada matraz de 175cm2 en 22 mL de medio GM.
- Deje que las células proliferen durante 2-4 días más hasta que alcancen la confluencia completa, cambiando el MI en el segundo día del cultivo.
- Para iniciar la diferenciación adipogénica, retire el GM y reemplácelo con MS completa durante 4 días (2 mL de MS completa por pocillo de una placa de 6 pocillos o 22 mL para un matraz de175 cm2 ).
NOTA: Reemplácelo con DM completo nuevo el día 2. - En el día 4, retire la MS completa y reemplácela con 2 mL de MS básica suplementada con 22,5 μM de oleato, 15 μM de palmitato y 12,5 μM de linoleato para obtener una concentración total de ácidos grasos de 50 μM por pocillo en una placa de 6 pocillos o 22 mL para un matraz de 175cm2 . Reemplace con medios cada 2 días durante 10 días más.
NOTA: A partir del día 7, las gotas de lípidos deben ser visibles en los preadipocitos diferenciadores. - En el día 14 de cultivo, recoja los medios de las células para el aislamiento de los VE derivados de adipocitos.
6. Preparación del sobrenadante de cultivo celular para el aislamiento o almacenamiento de vesículas extracelulares y el futuro aislamiento de vesículas extracelulares
- Retire los sobrenadantes de cultivo celular de cada placa de 6 pocillos y combíne. Añadir a un tubo de 15 mL o retirar todos los sobrenadantes de cultivo celular de un matraz de 175cm2 y añadir a un tubo de 50 mL.
- Centrifugar a 1000 x g durante 10 min a 4 °C.
- Decantar el sobrenadante en un nuevo tubo limpio de 15 mL o 50 mL vertiéndolo, respectivamente.
- Retire el cilindro de una jeringa de 10 ml y coloque un filtro de jeringa de 0,45 μm.
- Vierta el sobrenadante en el depósito de la jeringa y aplique una presión suave en la abertura del cilindro de la jeringa con el pulgar o la palma de la mano hasta que el sobrenadante del cultivo celular pase libremente a través del filtro.
NOTA: La velocidad de este paso de filtración puede variar según el tipo de filtro de jeringa. - Recoja el filtrado en un tubo limpio de 50 ml.
NOTA: Si es necesario, los medios filtrados acondicionados se pueden almacenar en este punto a -80 °C durante varias semanas. Cuando sea necesario, descongele los sobrenadantes del cultivo celular a 4 °C y centrifugar a 1000 x g durante 10 min a 4 °C. Decantar el sobrenadante en un tubo limpio vertiéndolo antes de continuar con los aislamientos EV.
7. Aislamiento de vesículas extracelulares
- Etiquete un tubo de ultracentrifugación de 13 ml dibujando un círculo en la parte inferior del tubo, donde se formará el pellet EV esperado y marque una línea alrededor del cuello del tubo para orientarse en el rotor del tubo de ultracentrifugación. Etiquete el tubo con un identificador de muestra.
- Coloque el tubo en el soporte del tubo.
- Coloque una aguja de 16 g en una jeringa de 10 ml y retire el cilindro de la jeringa.
- Retire la cubierta protectora de la aguja e inserte la aguja en el cuello del tubo de ultracentrifugación.
- Vierta el sobrenadante de cultivo celular directamente en el cilindro de la jeringa para llenar el tubo de ultracentrifugación.
- Rellene el tubo con PBS según sea necesario hasta que esté lleno.
NOTA: Deje que el tubo se desborde ligeramente si es necesario, asegurándose de que no haya espacios de aire en el tubo de ultracentrifugación ni burbujas de aire. - Selle el tubo de ultracentrifugación con un soldador, asegurándose de que el tubo sea hermético apretando el tubo suavemente.
- Coloque los tubos de ultracentrifugación en el rotor de ultracentrifugación; asegúrese de que la línea marcada en la parte superior del tubo y el círculo dibujado en la base del tubo estén hacia afuera, donde se formará el pellet EV.
- Ultracentrífuga a 120.000 x g durante 2 h a 4 °C.
- Retire con cuidado el rotor de la ultracentrífuga.
- Retire los tubos de ultracentrifugación del rotor y colóquelos en el soporte del tubo.
- Conecte una aguja de 16 g a una jeringa de 10 ml.
- Perfore la parte superior del tubo de ultracentrifugación e inserte la aguja 2 cm en la parte superior del tubo y aspire el sobrenadante en la jeringa.
- Decantar este sobrenadante agotado en EV en un tubo de 1,5 mL y congelar a -80 °C.
- Vuelva a insertar la aguja en el tubo y aspire cuidadosamente el sobrenadante restante y deséchelo.
- Corta la parte superior del tubo con unas tijeras.
- Vierta el sobrenadante restante en una acción rápida.
- Deje que el tubo cuelgue boca abajo durante 1 minuto.
- Seque cualquier líquido que se forme en el tubo con una toalla de papel.
- Invierta el tubo y colóquelo en el soporte del tubo.
- Agregue 100 μL de PBS al tubo.
- Con la punta de una pipeta, desaloje suavemente el pellet EV en la base del tubo con un movimiento circular en el área marcada en el paso 7.1.
- Vórtice brevemente (1-2 segundos), dos veces.
- Etiquete un nuevo tubo de ultracentrifugación de 13 mL dibujando un círculo en la parte inferior del tubo, donde se formará el pellet EV esperado y marque una línea alrededor del cuello del tubo para orientarse en el rotor del tubo de ultracentrifugación. Etiquete el tubo con un identificador de muestra.
- Coloque el tubo en el soporte del tubo.
- Agregue 12 mL de PBS a un nuevo tubo de ultracentrifugación usando una jeringa y una aguja limpias.
- Con una jeringa y una aguja, recoja la muestra de EV de 100 μL y añádala al tubo. Mezcle cuidadosamente los EV y PBS y enjuague la jeringa y la aguja recogiendo suavemente el PBS y aspirando en el tubo.
NOTA: Evite crear burbujas. - Selle el tubo de ultracentrifugación con un soldador, asegurándose de que el tubo sea hermético apretando el tubo suavemente.
- Coloque los tubos de ultracentrifugación en el rotor de ultracentrifugación; Asegúrese de que la línea marcada en la parte superior del tubo y el círculo dibujado en la base del tubo estén hacia afuera.
- Ultracentrífuga a 120.000 x g durante 1 h a 4 °C.
- Retire con cuidado el rotor de la ultracentrífuga.
- Coloque una aguja de 16 g en una jeringa de 12 ml.
- Perfore la parte superior del tubo de ultracentrifugación e inserte la aguja hasta 2 cm en la parte superior del tubo; Aspire el sobrenadante en la jeringa y deséchelo.
- Corta la parte superior del tubo con unas tijeras.
- Vierta el sobrenadante restante en una acción rápida.
- Deje que el tubo cuelgue boca abajo durante 1 minuto.
- Seca con palmaditas cualquier líquido que se forme en el borde del tubo.
- Coloque el tubo en el soporte del tubo.
- Agregue 100 μL de PBS al tubo.
- Con la punta de una pipeta, desaloje suavemente el pellet EV en la base del tubo con un movimiento circular en el área marcada en el paso 7.24.
- Vórtice brevemente (1-2 segundos), dos veces.
- Pipetear 100 μL de solución de PBS/EV en un tubo limpio de 1,5 mL y mantener el hielo húmedo.
NOTA: Los vehículos eléctricos están listos para el procesamiento posterior y pueden congelarse y almacenarse a -80 °C.
8. Determinación del tamaño y la concentración de EV mediante el análisis de seguimiento de nanopartículas (NTA)
- Preparación del sistema
NOTA: Mehdiani et al.13 informaron sobre un método detallado para el uso del Análisis de Seguimiento de Nanopartículas (NTA) para la determinación del tamaño y la concentración de EV.13.- Descongele las muestras y manténgalas a 4 °C.
- Inicie el software NTA haciendo clic en el icono del software.
- El software se abrirá en "verificación de celda" y le pedirá que llene la celda de flujo con agua desionizada. Llene una jeringa de 10 ml con agua desionizada y empújela dentro de la máquina, asegurándose de que no pasen burbujas de aire a la cámara de carga.
- Siga las instrucciones en pantalla para preparar el sistema a través de un control de calidad (QC). El software realizará una comprobación de la célula y dará una medida de la calidad de la célula. Esto debería ser de muy bueno a excelente.
- Preparar el control de calidad que consiste en perlas de poliestireno de 100 nanómetros. Pipetear 1 μL del patrón en 999 μL de agua desionizada (material diluido). A continuación, añadir 10 μL de caldo diluido a 2,5 mL de agua desionizada (muestra de control de calidad). Mezcle la solución mediante vórtice suave durante 2-3 s y pipeteando.
NOTA: Las muestras de control de calidad deben prepararse frescas todos los días, pero la muestra inicial de material diluido es estable durante 1 semana a 4 °C. - Llene una jeringa de 1 mL con 1 mL de la muestra de control de calidad y elimine todas las burbujas de aire de la jeringa.
- Inyecte, sin introducir burbujas de aire, en la cámara de carga de muestras NTA inclinando suavemente la punta de la jeringa en la cámara de inyección, mientras empuja simultáneamente el émbolo. Inyecte hasta 950 μL de la muestra de control de calidad en la cámara.
NOTA: No introduzca burbujas de aire en la cámara de carga de muestras. - Espere a que el software realice una alineación automática (para enfocar la cámara) y verifique el voltaje para las lecturas de potencial Z: el gráfico de voltaje debe ser una curva suave en forma de U.
NOTA: Si hay un mensaje de error "error de voltaje demasiado bajo", es posible que la celda esté mojada por la limpieza o que no esté segura o que haya una burbuja de aire. - Una vez que se complete la verificación automática de alineación/voltaje, use el menú desplegable de posición de la cámara para verificar todas las posiciones (0.1-0.9) en busca de marcas inusuales: la presencia de estas indica que la celda puede necesitar lavado y / o limpieza. Después del control de calidad, el sistema mostrará "listo para mediciones".
- Prepare la celda de flujo con PBS. Abra la pestaña Bomba/Temperatura y, en Bomba, haga clic en Ejecutar para la bomba 2 (depósito de PBS). Esto hará que PBS pase por la celda durante 1 minuto y luego se detendrá automáticamente.
NOTA: Puede haber partículas en la cámara, pero estas se pueden eliminar empujando 10 mL de PBS a través del puerto de carga. - Llene una jeringa de 10 ml con PBS y cárguela en la cámara sin burbujas de aire.
- Cree un protocolo para que el dispositivo funcione que medirá múltiples posiciones del láser y promediará las partículas por fotograma.
- Verifique que el recuento de partículas sea inferior a 5 (lo más cerca posible de 0) antes de continuar: enjuague con más PBS, si es necesario.
- Antes de la dilución, mezcle la muestra de EV mediante pipeteo.
- Diluir la muestra 1:1.000 en PBS y mezclar mediante pipeteo. Llene una jeringa de 1 ml con la muestra y cárguela en la cámara sin burbujas de aire.
- Compruebe que el recuento de partículas esté dentro del rango aceptable (la barra sobre el valor del recuento debe estar en la región verde o cerca de ella). De lo contrario, ajuste la dilución de la muestra en consecuencia. Entre las muestras y las diluciones de muestras, cargue 10 ml de PBS en la parte delantera de la máquina para limpiar la cámara, luego cargue 1 ml de la muestra diluida.
NOTA: Cada muestra tendrá una dilución independiente basada en la concentración de la muestra. El recuento de partículas del dispositivo debe estar entre 50 y 200 partículas por fotograma para obtener mediciones precisas. - Vaya a la pestaña Medición en el software.
- Haga clic en el botón Ejecutar adquisición de video .
- Introduzca un nombre de muestra y seleccione una carpeta de destino para guardar la medición.
- Cree un procedimiento operativo estándar (SOP) para vehículos eléctricos.
- Cree > Guarde > cargue un SOP EV que medirá el número y el tamaño de las partículas a una velocidad de obturación de 100 y una sensibilidad de la cámara de 80, 11 posiciones de cámara durante 2 ciclos.
NOTA: A menos que la muestra tenga requisitos especiales, no es necesario cambiar estos ajustes. - Introduzca la dilución de la muestra y añada cualquier otra nota que desee añadir.
- Haga clic en Aceptar y el software comenzará a grabar automáticamente. Una vez finalizado, el software cargará automáticamente una tabla emergente que muestra el recuento y el tamaño promedio de las partículas para cada posición de la cámara.
NOTA: No toque la máquina ni las encimeras cercanas durante este tiempo, ya que las vibraciones influirán en las lecturas finales. - Las posiciones de la cámara con lecturas estadísticamente inusuales se excluirán automáticamente: para excluir manualmente cualquier posición de la cámara (o volver a incluir las excluidas por cualquier motivo), haga clic en la casilla de verificación a la izquierda de los detalles de la muestra.
- Haga clic en Continuar y el software creará y abrirá un PDF de la muestra con los resultados de tamaño y concentración.
- Cree > Guarde > cargue un SOP EV que medirá el número y el tamaño de las partículas a una velocidad de obturación de 100 y una sensibilidad de la cámara de 80, 11 posiciones de cámara durante 2 ciclos.
- Análisis estadístico
- Analice los datos de NTA mediante ANOVA de uno o dos factores con corrección de Tukey post-hoc. Trazar los datos como medias de grupo ± desviación estándar. Se consideró significativo un valor de p de <0,05.
Resultados
Se determinó la cantidad de VEs aisladas de adipocitos glúteos humanos siguiendo el protocolo descrito. Calculamos el tamaño y la concentración de VE derivados de adipocitos utilizando NTA (Figura 1A,B). Utilizamos controles de medios simulados, que eran volúmenes iguales de medios que no habían estado en contacto con las células, sino cultivados y sujetos al procedimiento de aislamiento descrito anteriormente. Se midió la concentración de EV derivada de adipocitos después del aislamiento inicial y después del lavado de los EV de adipocitos aislados en PBS (Figura 1A,B) y se trazaron las medias del grupo ± desviación estándar (DE), que se analizó mediante un ANOVA de dos vías con corrección de Tukey post-hoc.
La concentración de VEs derivadas de adipocitos determinada por NTA a partir del1º aislamiento osciló entre 6,10 x 10,6 y 2,70 x 10,77, con una mediana de 2,60 x 10,7 EVs/mL (Figura 1 A,B). Después de un lavado con PBS, hubo significativamente menos EV derivados de adipocitos por muestra (Figura 1A,B) (P < 0,001), que oscilaron entre 5,00 x 105 y 4,30 x 106 con una mediana de 2,70 x 106 EV/mL. Los controles de medios simulados no contenían EV según lo determinado por NTA (Figura 1A, B). El tamaño modal de los EV del primer aislamiento fue de 125 nm y 105 nm después de un lavado PBS (Figura 1A,B). El protocolo descrito se aplicó además a adipocitos abdominales y derivados de glúteos de matraces más grandes de 175cm2. Estas muestras de EV glúteo derivadas de frascos T175cm2 variaron en concentración de 3,60 x 107 a 7,50 x 107/mL, con una mediana de 5,40 x 107 EVs/mL. Las concentraciones de EV derivadas de adipocitos abdominales de 175 cm2 frascos oscilaron entre 6,30 x 107 y 8,60 x 107/mL, con una mediana de 7,60 x 107 EV/mL (Figura 1C,D). El tamaño modal de los EV derivados de los matraces T175cm2 fue de 115 nm para los EV glúteos y de 125 nm para los EV abdominales. Confirmamos la presencia de la proteína EV en las VE derivadas de los glúteos y el abdomen mediante inmunotransferencia para el gen de susceptibilidad tumoral 101 (TSG101) y encontramos que los gránulos de células de adipocitos abdominales y glúteos y los VE derivados de adipocitos abdominales y glúteos eran positivos para TSG101, mientras que los medios de control simulados, que no habían estado en contacto con las células, eran negativos (Figura 1E).
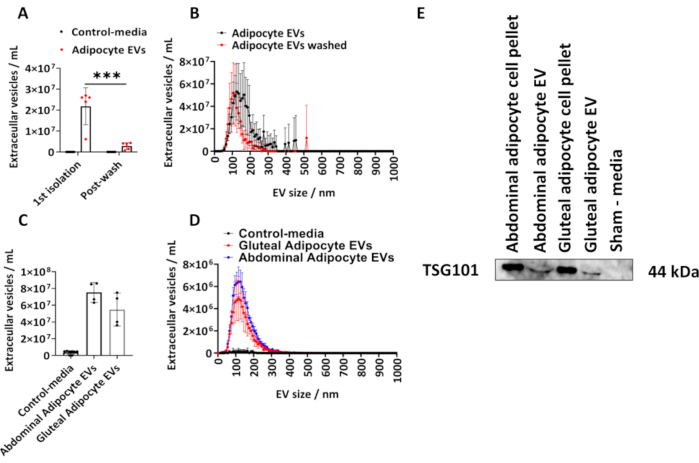
Figura 1: Tamaño y perfil de distribución de EVs derivados de adipocitos a partir de medios de cultivo celular y determinación de la proteína EV-TSG101. Concentraciones totales de EV y perfiles de distribución de tamaño y concentración determinados por el análisis de seguimiento de nanopartículas (NTA) desde elprimer aislamiento ( N = 5) y después del lavado con PBS (N = 6). (C) Concentraciones totales y (D) perfiles de tamaño y distribución de concentraciones determinados por NTA para EV derivados de abdomen y glúteos a partir de matraces T175cm2 (N = 4 por grupo). (E) Western blot de EV derivados de glúteos y abdominales para TSG101. Se utilizaron gránulos de células y medios simulados como controles positivos y negativos, respectivamente. Los datos son medias de grupo ± desviación estándar (DE). Un ANOVA de uno o dos factores con corrección de Tukey post-hoc. P < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Demostramos un protocolo para el aislamiento de EVs derivados de adipocitos glúteos y abdominales a partir de sobrenadantes de cultivos celulares y determinamos su tamaño y concentración mediante NTA 7,14,15. Demostramos que los adipocitos humanos cultivados producen y liberan EV en los medios de cultivo celular, que posteriormente pueden aislarse mediante filtración y ultracentrifugación. Determinamos el tamaño y el perfil de concentración de los EV derivados de adipocitos aislados y mostramos que la ultracentrifugación probablemente coaisló contaminantes de los medios de cultivo celular y que el lavado de los gránulos de EV aislados en PBS reduce significativamente su concentración en una segunda medición de NTA. Además, determinamos la pureza de las VE aisladas derivadas de glúteos y abdominales mediante Western blot para TSG101, un marcador de EV. Las preparaciones de EV derivadas de glúteos y abdominales fueron positivas para TSG101, pero, lo que es más importante, esto estuvo ausente en los medios de control que no estuvieron expuestos a las células. Los experimentos presentados utilizaron adipocitos humanos como célula madre generadora de VE, pero el método descrito es adecuado para otros tipos de células, incluidas las células endoteliales, el músculo liso vascular, el músculo esquelético, las células inmunitarias y para el aislamiento de EV a partir de plasma o suero pobre en plaquetas del paciente.
Las VE derivadas de los adipocitos están elevadas en las enfermedades metabólicas y la determinación de las alteraciones en el tamaño y el número de VE de los adipocitos in vivo es compleja porque los fluidos biológicos, como la sangre, contienen VE de varias fuentes celulares que también están implicadas en la patogénesis de las enfermedades metabólicas, incluidas las VE de las células endoteliales, el músculo esquelético, los eritrocitos y las células inmunitarias. El método descrito aquí permite la determinación de EV de adipocitos humanos, lo que puede proporcionar un modelo útil para estudios mecanicistas que investigan los factores que conducen a la biogénesis de EV en adipocitos, que actualmente se desconoce. Es importante destacar que la determinación de la biogénesis de los EV de los adipocitos y cómo se orquesta la carga de ARN, proteínas y metabolitos particulares en los EV de los adipocitos puede revelar nuevas oportunidades terapéuticas para perturbar la señalización de los EV de los adipocitos patogénicos en la disfunción metabólica. Los estudios detallados proporcionarán una mejor comprensión de cómo el tamaño, el número, la vía de biogénesis y la carga de EV (ARN, proteínas y metabolitos) se alteran en respuesta a enfermedades o estímulos como perturbaciones en el oxígeno, la glucosa, los lípidos y la insulina. La información sobre el papel de los factores ambientales en la señalización de los VE de los adipocitos en las enfermedades metabólicas y cómo los VE derivados de los adipocitos contribuyen a la inflamación del tejido adiposo puede descubrir nuevas dianas terapéuticas en las enfermedades metabólicas.
Limitaciones
Generación in vitro de VEs derivadas de adipocitos
El uso de preadipocitos humanos in vitro proporciona un sistema modelo para estudiar la liberación y generación de VE derivadas de adipocitos después de la diferenciación in vitro de adipocitos, pero existen una serie de limitaciones. En particular, es probable que las VE de adipocitos derivadas in vitro difieran de las VE derivadas del tejido adiposo recuperadas de biofluidos, como el plasma14 , en su tamaño, concentración, proteína EV, ARN, metabolitos y función. Estas diferencias de EV podrían estar influenciadas por otras células no adipocitarias que residen en el tejido adiposo in vivo, como las células madre derivadas del tejido adiposo, las células endoteliales y los macrófagos, que están íntimamente relacionados con la fisiología del tejido adiposo y han demostrado su papel en la patología del tejido adiposo, incluida la inflamación del tejido adiposo.
Cabe señalar que el protocolo de diferenciación in vitro de 2 semanas descrito aquí puede no ser suficiente para generar adipocitos completamente maduros equivalentes a los observados in vivo; Los adipocitos diferenciados in vitro cultivados en formato bidimensional (2D) muestran una morfología diferente a la de las células in vivo y no desarrollan gotas lipídicas uniloculares. Además, los preadipocitos descritos en este protocolo se obtienen de la fracción estroma-vascular adiposa y no hemos evaluado la contribución al pool de EV de otros tipos celulares que no se eliminaron completamente durante el aislamiento celular.
La pérdida de importantes interacciones de célula a célula de los adipocitos con otros no adipocitos en el tejido adiposo puede influir en la generación de EV de los adipocitos, en la liberación, de la proteína EV y del ARN EV de los adipocitos y en las células madre derivadas del tejido adiposo16. Sin embargo, no se ha llevado a cabo una evaluación exhaustiva de las diferencias entre las VE de los adipocitos derivados in vitro de las producidas in vivo.
Las biopsias de tejido primario contienen sangre y, por lo tanto, los cultivos celulares derivados pueden contener eritrocitos y VE derivados de eritrocitos, independientemente de los múltiples lavados y cambios de medios destacados en nuestro protocolo. Puede ser necesario un paso adicional de lisis de glóbulos rojos después del aislamiento de la fracción estromal-vascular para eliminar los efectos de los eritrocitos en los adipocitos. Esto es importante porque las VE derivadas de eritrocitos pueden afectar la función celular de otras células17 y las VE derivadas de eritrocitos se elevan en presencia de estrés oxidativo18 y en pacientes con síndrome metabólico19,20. Por lo tanto, el tejido adiposo derivado de pacientes con enfermedades metabólicas puede contener niveles elevados de EV derivados de eritrocitos, lo que puede influir en el fenotipo in vitro de los adipocitos.
Eliminación de FBS
El protocolo descrito utilizó FBS en los medios de crecimiento durante la diferenciación adipogénica, pero posteriormente los adipocitos estuvieron sujetos a múltiples cambios de medios antes de la recolección final de los medios para el aislamiento de los VE derivados de los adipocitos. Por lo tanto, asumimos que el riesgo general de contaminación de los VE derivados de FBS en las preparaciones de VE era bajo y, posteriormente, confirmamos que los VE residuales no estaban presentes en los medios de cultivo celular mediante Western blot para TSG101. El aislamiento de VE cultivadas en células de fuentes celulares que requieren FBS debe utilizar FBS agotados en EV o VE bovinos agotados mediante ultracentrifugación para evitar que los VE bovinos confundan las concentraciones de VE de adipocitos y el análisis de la carga de VE de adipocitos. Se sabe que la depleción de suero de los adipocitos altera sus respuestas celulares21 y, por lo tanto, la investigación debe garantizar que la depleción sérica o la depleción de EV del suero haga que sus cultivos de adipocitos sean verdaderamente representativos de la biología de los adipocitos.
Limitación técnica del aislamiento de vehículos eléctricos mediante filtración y ultracentrifugación
Describimos un método de ultracentrifugación con tubos de plástico de un solo uso que requieren sellado antes de la ultracentrifugación para aislamientos de vehículos eléctricos. Reconocemos que estos tubos sellados de un solo uso pueden no ser una opción económica para muchas personas y sugerimos explorar tubos similares, que no requieren sellado y son reutilizables. Sin embargo, los investigadores deben asegurarse de que el lavado de los tubos reutilizables sea adecuado y no conduzca a la acumulación progresiva de contaminantes de proteínas, lípidos y ARN con el tiempo, lo que puede afectar las investigaciones posteriores de la carga asociada a EV o afectar los estudios de función celular.
El protocolo de filtración y ultracentrifugación descrito aquí se ha utilizado durante muchos años y múltiples estudios han destacado las deficiencias de este método, incluidos los aislamientos inespecíficos de componentes celulares contaminantes como las mitocondrias celulares, la presencia de fragmentos nucleares y constituyentes de la membrana celular. Además, el método descrito aquí co-aislará las lipoproteínas presentes en el FBS deplecionado por EV. El método aquí puede desarrollarse aún más mediante el uso de ultracentrifugación por densidad y cromatografía de exclusión por tamaño (SEC) para eliminar proteínas solubles contaminantes y algunas lipoproteínas. Junto con el lavado PBS de los vehículos eléctricos aislados y la SEC, los contaminantes coaislados se pueden limitar, pero no eliminar por completo. Por lo tanto, los usuarios deben asegurarse de que se incluyan controles adecuados, incluido un medio simulado que no haya estado en contacto con las células para tener en cuenta las proteínas solubles y las lipoproteínas en los medios de cultivo y un control de sobrenadante empobrecido en EV para demostrar el aislamiento exitoso de los VE de los medios acondicionados que aún contienen proteínas solubles y lipoproteínas.
El aislamiento de los VE mediante filtración y ultracentrifugación depende de que el operador se asegure de que no se aplique una presión indebida a los sobrenadantes del cultivo celular mientras pasan a través del orificio del filtro o el orificio de la aguja/jeringa. La aplicación de fuerza indebida durante esta etapa del protocolo descrito puede romper los EV, influir en las concentraciones finales de EV y generar ARN, proteínas y metabolitos libres, que alguna vez estuvieron encerrados en los EV. Hemos descrito aquí un método que no requiere el cilindro de la jeringa y, por lo tanto, la aplicación de fuerza a los EV en medios acondicionados a medida que pasan a través del filtro o la aguja hacia sus depósitos de recolección y tubos de ultracentrifugación. No obstante, se debe tener más cuidado al volver a suspender el pellet EV en PBS. Solo se debe usar un vórtice breve, ya que un vórtice vigoroso puede alterar las membranas EV.
Después de la ultracentrifugación, los operadores deben tener cuidado con los tubos de ultracentrifugación para no perturbar el pellet EV. Esto se puede lograr manipulando los tubos con cuidado y moviéndolos lentamente entre el rotor de ultracentrifugación y la gradilla de tubos. Se debe tener más cuidado al perforar un orificio en la parte superior del tubo de ultracentrifugación para aspirar los sobrenadantes agotados en EV. Insertar la aguja en la parte superior del tubo y aspirar los sobrenadantes rápidamente creará un vacío en el cilindro de la jeringa, lo que puede forzar violentamente el sobrenadante de regreso al tubo de ultracentrifugación e interrumpir la bolita EV. Después de cortar el tubo de ultracentrifugación para verter el sobrenadante restante, se debe tener cuidado porque el pellet EV puede aflojarse y al verterse se desechará el pellet EV. Alternativamente, se puede usar una jeringa y una aguja para eliminar lentamente el sobrenadante restante sin verter o invertir el tubo.
La filtración y ultracentrifugación de sobrenadantes para el aislamiento de vehículos eléctricos es un método útil y eficiente. Pero es susceptible al co-aislamiento de lipoproteínas y proteínas solubles. Estos pueden mitigarse lavando los vehículos eléctricos con PBS (como se describe), pero esto no eliminará todos los contaminantes. Las proteínas solubles se pueden eluir de la fracción EV utilizando SEC, sin embargo, este método no distingue entre lipoproteínas y EV. Las eluciones de SEC que contienen VE se pueden combinar con la ultracentrifugación para pellets EV. La filtración y la ultracentrifugación diferencial son un método preferido de aislamiento de EV sobre las técnicas de precipitación, que utilizan polietilenglicol porque estos métodos de precipitación aíslan conjuntamente grandes cantidades de proteínas solubles y lipoproteínas en sobrenadantes de cultivos celulares y otros fluidos biológicos. Es probable que la ultracentrifugación siga siendo la forma más accesible de aislamiento de vehículos eléctricos para muchos porque la mayoría de los laboratorios están equipados con una ultracentrífuga, lo que mitiga los costos iniciales de puesta en marcha. Pero para muchos, la ultracentrifugación para el aislamiento de vehículos eléctricos se ve obstaculizada por el volumen de los tubos de ultracentrifugación y el volumen inicial del material. Es posible que se necesiten varios cientos de mililitros de sobrenadantes de cultivo para producir una cantidad suficiente de EV para la proteómica posterior o la secuenciación de ARN. Sin embargo, es probable que las técnicas de ultracentrifugación para el aislamiento de VE vayan acompañadas de otras técnicas como la SEC y la captura por inmunoafinidad utilizando tetraspaninas CD9, CD63 y CD81 para mejorar la pureza de las VE aisladas. Otras técnicas, como las soluciones de precipitación disponibles comercialmente y la citometría de flujo, pueden ser de alguna utilidad en investigaciones específicas.
Pureza de las preparaciones de EV
Confirmamos el aislamiento de VE derivadas de adipocitos mediante Western blot para TSG101, pero este único western blot no cumple con las directrices publicadas por la sociedad internacional de vesículas extracelulares (ISEV). Sería ideal una mayor caracterización de estos VE derivados de adipocitos utilizando las tetraspaninas CD9, CD63 y CD81 para identificar exosomas y marcadores de contaminación celular como la histona H3, la albúmina y la apolipoproteína A1.
El protocolo presentado aquí permite el aislamiento de EV a partir de sobrenadantes de cultivo celular de una variedad de fuentes celulares, incluidos los adipocitos, para la determinación del tamaño de EV, la concentración, los marcadores EV por Western blot y la utilidad en tecnologías basadas en ómicas como la proteómica y la secuenciación de ARN.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
N.A. y R.C. reconocen el apoyo de las becas de investigación de la Fundación Británica del Corazón, el Centro de Excelencia en Investigación, Oxford (N.A. y R.C.; RE/13/1/30181 y RE/18/3/34214), Subvención del Proyecto de la Fundación Británica del Corazón (N.A. y R.C.; PG/18/53/33895), el Consorcio Tripartito de Inmunometabolismo, la Fundación Novo Nordisk (NNF15CC0018486), el Instituto Nacional de Investigación en Salud (NIHR), el Centro de Investigación Biomédica de Oxford (BRC), Nuffield Benefaction for Medicine y el Fondo de Apoyo Estratégico Institucional Wellcome (ISSF). Las opiniones expresadas son las del autor o autores y no necesariamente las del NHS, el NIHR o el Departamento de Salud.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
Referencias
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677 (2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974 (2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252 (2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313 (2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -. S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados