Method Article
تحديد وقياس آليات التحلل في بطاريات الليثيوم أيون ؛ مدخلات لمحاكاة تدفق الحرارة لنمذجة الهروب الحراري
In This Article
Summary
يهدف هذا العمل إلى تحديد حركية التفاعل لكاثود بطارية Li-ion ومواد الأنود التي تخضع للهروب الحراري (TR). تم استخدام التحليل الحراري المتزامن (STA) / مطياف الأشعة تحت الحمراء لتحويل فورييه (FTIR) / قياس الطيف الكتلي لكروماتوغرافيا الغاز (GC-MS) للكشف عن الأحداث الحرارية والكشف عن الغازات المتصاعدة.
Abstract
لا تزال المخاطر والحوادث المحتملة المتعلقة بالاستخدام العادي لبطاريات الليثيوم أيون مصدر قلق بالغ. من أجل الحصول على فهم أفضل للهروب الحراري (TR) ، تمت دراسة تفاعلات التحلل الطارد للحرارة في الأنود والكاثود ، باستخدام التحليل الحراري المتزامن (STA) / كروماتوغرافيا الغاز - مطياف الكتلة (GC-MS) / نظام مطياف تحويل فورييه بالأشعة تحت الحمراء (FTIR). سمحت هذه التقنيات بتحديد آليات التفاعل في كل قطب كهربائي ، بسبب تحليل الأنواع الغازية المتطورة ، وكمية الحرارة المنبعثة وفقدان الكتلة. قدمت هذه النتائج نظرة ثاقبة للأحداث الحرارية التي تحدث ضمن نطاق درجة حرارة أوسع مما تمت تغطيته في النماذج المنشورة سابقا. سمح ذلك بصياغة نموذج حراري محسن لتصوير TR. تم فحص حرارة التفاعل وطاقة التنشيط وعامل التردد (ثلاثة توائم حرارية) لكل عملية طاردة للحرارة رئيسية على مستوى المادة في خلية بطارية ليثيوم نيكل - منغنيز - كوبالت - أكسيد (NMC (111)) - جرافيت. تم تحليل النتائج ، وتم اشتقاق حركيتها. يمكن استخدام هذه البيانات لمحاكاة تدفق الحرارة التجريبي بنجاح.
Introduction
تتطلب الحاجة إلى إزالة الكربون من الاقتصاد جنبا إلى جنب مع زيادة الطلب على الطاقة - الناتجة عن التطورات الاجتماعية والاقتصادية وتغير المناخ - تحولا كبيرا في نظام الطاقة لمواجهة التحديات التي يفرضها الاحترار العالمي ونقص الوقود 1,2. وتعتبر تكنولوجيات الطاقة النظيفة مثل طاقة الرياح والطاقة الشمسية أفضل البدائل لنظام الطاقة الذي يهيمن عليه الوقود الأحفوري3؛ ومع ذلك ، فهي متقطعة وسيساعد تخزين الطاقة على ضمان استمرارية إمدادات الطاقة. خصائص مثل كثافة الطاقة المحددة العالية ، وأداء ركوب الدراجات المستقر والكفاءة تجعل بطاريات الليثيوم أيون (LIBs) مرشحة واعدة كنظام تخزين الطاقة الكهروكيميائية. قد تؤدي التكلفة وعدم التشغيل الموثوق به ل LIBs إلى إعاقة تطبيق أوسع في شبكة الطاقة ، في شكل نظام بطارية ثابت كبير 4,5. هناك جانب إضافي يجب مراعاته وهو أن الجمع بين المواد عالية الطاقة والإلكتروليتات العضوية القابلة للاشتعال القائمة على المذيبات يمكن أن يؤدي إلى ظروف خطرة مثل الحريق وإطلاق الغازات السامة والانفجار 6,7. لذلك ، يجب على المرء معالجة قضايا السلامة في LIBs.
منذ التسويق المبكر ، تم الإبلاغ عن عدد من الحوادث في التطبيقات الحالية (الأجهزة الإلكترونية المحمولة ، والسيارات الكهربائية ، ووحدة الطاقة المساعدة في الطائرات) في الأخبار 8,9. على سبيل المثال ، على الرغم من الإنتاج عالي الجودة ، فإن حادث بطاريات الكمبيوتر المحمول من سوني10 ، وحادثتي بوينج 787 11,12 ، وحوادث Samsung Galaxy Notes 713 يفترض أن تحدث عن طريق دوائر قصر داخلية في خلية. تم تطوير اختبارات لتقييم مخاطر السلامة14،15،16،17. الشحن الزائد ، والإفراط في التفريغ ، والتدفئة الخارجية ، وسوء الاستخدام الميكانيكي ، وقصر الدائرة الداخلية / الخارجية هي آليات فشل معروفة بإطلاق الهروب الحراري (TR) 18 وقد تم تضمينها في بعض المعايير واللوائح. خلال هذه العملية ، تحدث سلسلة من التفاعلات الطاردة للحرارة مما يؤدي إلى زيادة حادة وسريعة في درجة الحرارة. عندما لا يمكن تبديد الحرارة المتولدة بسرعة كافية ، تتطور هذه الحالة إلىTR 19,20. بالإضافة إلى ذلك ، يمكن لخلية واحدة بعد ذلك توليد حرارة كافية لتشغيل الخلايا المجاورة ، داخل وحدة نمطية أو داخل مجموعة حزمة ، إلى TR ؛ إنشاء حدث انتشار حراري (TP). أثبتت استراتيجيات التخفيف مثل زيادة تباعد الخلايا في الوحدة النمطية ، واستخدام مواد العزل ونمط معين من علامة تبويب ربط الخلايا ، أنها تحد من ظاهرة الانتشار21. أيضا ، تم التحقيق في استقرار المنحل بالكهرباء واستقرار هيكل مواد الكاثود المختلفة في وجود المنحل بالكهرباء ، عند درجة حرارة مرتفعة ، من أجل تقليل احتمالية TR22.
أظهر Juarez-Robles et al. التأثيرات المشتركة لآليات التحلل من الدورة طويلة الأجل والإفراط في التفريغ على خلايا LIB23. اعتمادا على شدة التفريغ ، تم الإبلاغ عن ظواهر مثل طلاء Li ، وتكسير جسيمات الكاثود ، وانحلال مجمع تيار النحاس ، وتفكك جزيئات الكاثود ، وتشكيل جسور Cu و Li كآليات تحلل رئيسية لوحظت في هذه الاختبارات. علاوة على ذلك ، درسوا التأثير المشترك الناتج عن الشيخوخة والشحن الزائد على خلية LIB لإلقاء الضوء على آليات التحلل24. نظرا لمدى نظام الشحن الزائد ، كانت سلوكيات التدهور التي لوحظت للخلية هي تلاشي السعة ، وتحلل المنحل بالكهرباء ، وطلاء Li ، وتفريغ المواد الفعالة ، وتكسير الجسيمات وإنتاج الغازات. قد تتسبب ظروف الإساءة المركبة هذه في خضوع المواد الفعالة لتفاعلات طاردة للحرارة يمكن أن تولد حرارة كافية لبدء الهروب الحراري.
لتجنب المشاكل المتعلقة بالسلامة ، يجب أن تجتاز بطاريات الليثيوم أيون العديد من الاختبارات المحددة في مختلف المعايير واللوائح14. ومع ذلك ، فإن التنوع في تصميمات الخلايا (الحقيبة ، المنشورية ، الأسطواني) ، وقابلية تطبيق الاختبارات التي تقتصر على مستوى معين (خلية ، وحدة ، عبوة) ، معايير تقييم وقبول مختلفة محددة ، تسلط الضوء على الحاجة إلى توحيد المبادئ التوجيهية ومتطلبات السلامة في المعايير واللوائح25،26،27. منهجية موثوقة وقابلة للتكرار ويمكن التحكم فيها ، مع ظروف اختبار موحدة لتحريك دائرة قصر داخلية (ISC) مع TR لاحقة ، إلى جانب معايير تقييم موحدة ، لا تزال قيد التطوير28. علاوة على ذلك ، لا يوجد بروتوكول واحد متفق عليه لتقييم المخاطر المرتبطة بحدوث TP في البطارية أثناء التشغيل العادي20,25.
من أجل إنشاء بروتوكول اختبار يحاكي سيناريو فشل مجال واقعي ، يجب التحقيق في عدد هائل من مجموعات معلمات الإدخال (على سبيل المثال ، معلمات تصميم الخلية مثل السعة ، ونسبة السطح إلى الحجم ، وسمك الأقطاب الكهربائية ، وطريقة تشغيل ISC ، والموقع ، وما إلى ذلك) تجريبيا لتحديد أفضل طريقة لتشغيل TR الناجم عن ماس كهربائى داخلي. وهذا يتطلب جهودا وتكاليف معملية باهظة. يتكون النهج البديل من استخدام النمذجة والمحاكاة لتصميم طريقة تشغيل مناسبة. ومع ذلك ، يمكن أن تكون النمذجة الحرارية 3D للبطاريات باهظة التكلفة من الناحية الحسابية ، مع الأخذ في الاعتبار عدد التقييمات اللازمة لتغطية تأثير جميع المجموعات الممكنة من المعلمات التي يحتمل أن تحكم TR الناجم عن ماس كهربائى داخلي.
في الأدبيات ، تم تطوير نماذج التحلل الحراري لمحاكاة التفاعلات الكهروكيميائية والاستجابة الحرارية لأنواع مختلفة من بطاريات الليثيوم أيون في ظل ظروف إساءة استخدام مختلفة ، مثل اختراق الأظافر29 ، أو الشحن الزائد30 ، أو اختبار الفرن التقليدي31. في محاولة لفهم استقرار مادة الكاثود ، قام Parmananda et al. بتجميع البيانات التجريبية لمسعر معدل المتسارع (ARC) من الأدبيات32. لقد استخلصوا المعلمات الحركية من هذه البيانات ، وطوروا نموذجا لمحاكاة التجربة المسعرية واستخدام هذه المعلمات الحركية للتنبؤ بالاستقرار الحراري لمجموعة من مواد الكاثود32.
في المراجع29،30،31 والعديد من الدراسات الأخرى ، مزيج من نفس النماذج33،34،35،36 ─ وصف على التوالي ؛ إطلاق الحرارة من تحلل الأنود وطبقة واجهة المنحل بالكهرباء الصلبة (SEI) ؛ تحلل الكاثود وتحلل المنحل بالكهرباء ─ تم استخدامه مرارا وتكرارا خلال عدة سنوات كأساس لنمذجة الهروب الحراري. كما تم تحسين هذا الأخير بمرور الوقت ، على سبيل المثال ، بإضافة شروط التنفيس37. ومع ذلك ، تم تطوير هذه السلسلة من النماذج في البداية لالتقاط درجة حرارة بداية TR وليس لنمذجة شدة الهروب الحراري.
نظرا لأن الهروب الحراري هو تحلل حراري غير متحكم فيه لمكونات البطارية ، فمن الأهمية بمكان تحديد تفاعلات التحلل في الأنود والكاثود لتكون قادرا على تصميم خلايا بطاريات Li-ion أكثر أمانا ومنهجيات اختبار أكثر دقة. لهذا الغرض ، فإن الهدف من هذه الدراسة هو التحقيق في آليات التحلل الحراري في نام سي (111) الكاثود وأنود الجرافيت لتطوير نموذج حركي تفاعل مبسط ولكنه دقيق بما فيه الكفاية ، والذي يمكن استخدامه في محاكاة TR.
هنا ، نقترح استخدام المعدات التحليلية المقترنة: كالوريمتر المسح الضوئي التفاضلي (DSC) والتحليل الوزني الحراري (TGA) في أداة تحليل حراري متزامن واحد (STA). يقترن هذا الجهاز بنظام تحليل الغاز ، والذي يتكون من التحليل الطيفي بالأشعة تحت الحمراء لتحويل فورييه (FTIR) وقياس الطيف الكتلي اللوني للغاز (GC-MS). ستسمح لنا تقنيات STA / FTIR / GC-MS الموصولة باكتساب فهم أفضل لأسباب وعمليات الهروب الحراري في خلية واحدة. علاوة على ذلك ، سيساعد هذا في تحديد عمليات التحلل الحراري. تشير الواصلة إلى الجمع عبر الإنترنت بين التقنيات التحليلية المختلفة.
يظهر إعداد هذا النظام المتكامل المصنوع خصيصا في الشكل 1. توجد معدات STA ، المستخدمة في هذه الدراسة ، داخل صندوق قفازات ، مما يضمن التعامل مع المكونات في جو وقائي. يقترن الأخير ب FTIR و GC-MS عبر خطوط نقل ساخنة (150 درجة مئوية) لتجنب تكثيف المواد المتبخرة على طول الخطوط. تسمح واصلة هذه التقنيات التحليلية بالدراسة المتزامنة للخصائص الحرارية وتحديد الغازات المنبعثة ، مما يوفر معلومات عن آليات تفاعلات التحلل المستحثة حراريا. من أجل تقليل تأثير التفاعلات الكيميائية غير المرغوب فيها في الأقطاب الكهربائية أثناء تحضير العينة ، يتم إجراء معالجة العينات وتحميل العينات داخل صندوق قفازات مملوء بالأرجون. لا يتم شطف الأقطاب الكهربائية المفككة ولا يتم إضافة أي إلكتروليتات إضافية إلى البوتقة.
يسمح STA بتحديد انتقالات الطور أثناء عملية التسخين ، إلى جانب التحديد الدقيق لدرجات الحرارة والمحتوى الحراري المرتبط بهذه التحولات الطورية ، بما في ذلك تلك التي لا تحتوي على تغيير في الكتلة. يوفر الجمع بين طرق FTIR و GC-MS عبر الإنترنت مع STA تقييما نوعيا للغازات المتصاعدة من العينة أثناء تحللها الحراري. هذا هو المفتاح في تحديد آليات التفاعل المستحث حراريا. في الواقع ، يسمح النظام المقترن STA / FTIR / GC-MS بربط تغيرات الكتلة وتدفق الحرارة والغازات المكتشفة.
لكل من FTIR و GC-MS مزاياها وقيودها. تسمح الحساسية العالية ل GC-MS بالكشف السريع والسهل عن الجزيئات من قمم الكثافة المنخفضة. علاوة على ذلك ، تكمل بيانات FTIR بشكل جيد المعلومات التي توفرها أنماط طيف MS لتحقيق التحديد الهيكلي للأنواع العضوية المتطايرة. ومع ذلك ، فإن FTIR أقل حساسية. بالإضافة إلى ذلك ، لا تمتلك الجزيئات ثنائية الذرة ، مثل H 2 و N 2 و O2 ، لحظة ثنائية القطب دائمة وليست نشطة بالأشعة تحت الحمراء. لذلك ، لا يمكن اكتشافها باستخدام امتصاص الأشعة تحت الحمراء. على العكس من ذلك ، يمكن تحديد الجزيئات الصغيرة مثل CO 2 و CO و NH3 و H2O بدرجة عالية من اليقين38. وإجمالا، فإن المعلومات التي توفرها هذه الطرق التكميلية تجعل من الممكن الحصول على نظرة ثاقبة للغازات المنبعثة أثناء التوصيف الحراري.
من أجل التحقق من أحدث ما توصلت إليه التكنولوجيا من حيث تفاعلات التحلل الحراري المحددة لأكسيد الكوبالت والنيكل والمنغنيز الليثيوم (NMC (111)) الكاثود ، أنود الجرافيت (Gr) و 1M LiPF6 في كربونات الإيثيلين (EC) / كربونات ثنائي ميثيل (DMC) = 50/50 (v / v) المنحل بالكهرباء ، تم إجراء مراجعة الأدبيات. يلخص الجدول 1 والجدول 2 والجدول 3 النتائج الرئيسية.
في مجال التوصيف الحراري لمكونات البطارية، فإن طريقة تحضير العينة لها تأثير معنوي على النتائج التجريبية لكالوريمتر المسح الضوئي التفاضلي (DSC) لأن ذلك له تأثير على إشارة DSC. أبلغت العديد من الدراسات عن طرق مختلفة من حيث التعامل مع القطب الكهربائي. تتضمن بعض الاختلافات 1) خدش المادة الفعالة من القطب دون شطف مسبق أو إضافة كمية إضافية من المنحل بالكهرباء ، على سبيل المثال ، 54،55 ؛ 2) شطف / تجفيف / خدش المواد الفعالة وإضافة كمية معينة من المنحل بالكهرباء معها في البوتقة ، على سبيل المثال ، 55،56 ؛ 3) شطف / تجفيف / خدش المواد الفعالة دون إضافة المنحل بالكهرباء في مرحلة لاحقة (على سبيل المثال ، انظر المرجع57). ومع ذلك ، في الأدبيات ، لا يوجد اتفاق عام على تقنيات إعداد العينة. يؤثر غسل القطب على السلامة والمواد المتفاعلة في SEI58 ، والتي بدورها تعدل كمية الحرارة المتولدة من تحللها 34,59. من ناحية أخرى ، لا يوجد مؤشر واضح أو تفاصيل كافية حول كمية المنحل بالكهرباء المضافة إلى المواد المحصودة قبل التحليل الحراري.
في هذا العمل ، يتم تقليل تعديل SEI إلى الحد الأدنى من خلال عدم غسل القطب واستبعاد إضافة المنحل بالكهرباء ، في محاولة لتوصيف مادة القطب في حالتها الأصلية ، مع الحفاظ على محتوى المنحل بالكهرباء المتبقي. مع إدراك أن التحلل الحراري SEI هو محفز محتمل للهروب الحراري ، من المتوقع أن تسمح طريقة التحضير هذه بفهم أفضل للخصائص الحرارية للقطب ، في ظل ظروف الاختبار ، دون إذابة بعض منتجات SEI. في الواقع ، فإن انهيار طبقة SEI على الأنود هو بشكل عام المرحلة الأولى من فشل البطارية التي تبدأ عملية التسخين الذاتي39،41،60.
هناك مسألة أخرى مهمة في التحليل الحراري وهي ظروف القياس (نوع البوتقة، البوتقة المفتوحة/المغلقة، الغلاف الجوي) التي تؤثر على إشارة DSC المراد قياسها. في هذه الحالة ، من الواضح أن استخدام بوتقة مغلقة بإحكام غير مناسب لتقنيات STA / GC-MS / FTIR الواصلة ، مما يعني تحديد الغازات المتصاعدة. في النظام شبه المغلق ، يمكن أن يكون لحجم الفتحة في غطاء البوتقة المثقبة تأثير قوي على نتائج القياس. إذا كان الحجم صغيرا ، فإن البيانات الحرارية قابلة للمقارنة مع بوتقةمختومة 61. على العكس من ذلك ، من المتوقع أن يؤدي وجود ثقب كبير في الغطاء إلى تقليل الإشارة الحرارية المقاسة بسبب الإطلاق المبكر لمنتجات التحلل ذات درجة الحرارة المنخفضة. نتيجة لذلك ، لن تشارك هذه الأنواع في عمليات درجات الحرارة المرتفعة61. في الواقع ، يسمح النظام المغلق أو شبه المغلق بوقت إقامة أطول للأنواع ، يتحول من مرحلة مكثفة إلى مرحلة بخار داخل البوتقة. تم اختيار فتحة تهوية مقطوعة بالليزر تبلغ 5 ميكرومتر في غطاء البوتقة للتحقيق في السلوك الحراري والغازات المتصاعدة لأنود الجرافيت وكاثود NMC (111). بالنظر إلى حجم الثقب المقطوع بالليزر ، نفترض أن النظام الموجود داخل البوتقة قد يصور على الأرجح ، تقريب بسيط ولكنه معقول للديناميكية داخل كليهما ، خلية بطارية مغلقة وتنفيس خلية بطارية.
هذا العمل الحالي مبني على منشور سابق لنفس المؤلفين48. ومع ذلك ، تركز هذه الورقة بمزيد من التفصيل على الجزء التجريبي ، مع تسليط الضوء على فوائد التقنيات المستخدمة وظروف الاختبار للوصول إلى هدف هذا العمل.
على حد علم المؤلفين ، هناك بحث محدود منشور حول السلوك الحراري لمادة القطب ، باستخدام التركيبة الدقيقة لهذه الأدوات التحليلية STA / FTIR / GC-MS ، والمعلمات التحليلية وإعداد / معالجة العينات لتوضيح آليات التفاعل الكيميائي على مستوى المواد أثناء التحلل الحراري. على مستوى الخلية ، قام Fernandes et al. بالتحقيق في الغازات المتصاعدة بطريقة مستمرة ، باستخدام FTIR و GC-MS ، في خلية أسطوانية للبطارية تخضع لاختبار إساءة استخدام مفرط الشحن ، في غرفة مغلقة62. لقد حددوا الغازات وحددوها كميا خلال هذا الاختبار ، لكن فهم آليات التفاعل لا يزال غير واضح. علاوة على ذلك، لتطوير نموذج هارب TR، أجرى Ren et al. أيضا تجارب DSC على مستوى المواد لحساب المعلمات الثلاثية الحركية للتفاعلات الطاردة للحرارة55. لقد حددوا ست عمليات طاردة للحرارة ، ولكن لم يتم تحديد آليات التفاعل ، ولم يستخدموا تقنيات تحليل الغاز المقترن.
من ناحية أخرى ، اقترح Feng et al. آلية TR ثلاثية المراحل في خلية LIB مع ثلاث درجات حرارة مميزة يمكن استخدامها كمؤشرات لتقييم السلامة الحرارية للبطارية63. لهذا الغرض ، استخدموا قاعدة بيانات حرارية مع بيانات من ARC. ومع ذلك ، لم يتم توفير تفاصيل التفاعلات الكيميائية الكامنة وراء هذه الآليات الثلاث.
في هذه الدراسة ، تعد البيانات التي تم الحصول عليها من خلال طرق التحليل الحراري هذه ضرورية لتطوير النموذج الحركي حيث يجب تحديد عمليات التحلل الحراري الرئيسية ووصفها بشكل صحيح. يتم حساب الثلاثي الحراري الحركي ، أي طاقة التنشيط وعامل التردد وحرارة التفاعل ، للعمليات الفرعية المختلفة التي تحدث في كلا القطبين أثناء التحلل المستحث حراريا ، باستخدام ثلاثة معدلات تسخين مختلفة: 5 و 10 و 15 درجة مئوية / دقيقة. عند الاقتضاء ، تم استخدام طريقة كيسنجر64,65 لتحديد طاقة التنشيط وعامل التردد ، باتباع معادلة أرهينيوس. طريقة كيسنجر قابلة للتطبيق عندما تتحول ذروة DSC إلى درجة حرارة أعلى مع زيادة معدل التسخين. يتم الحصول على المحتوى الحراري للتفاعل من خلال دمج مساحة ذروة التفاعل، كما تم قياسها بواسطة DSC. من هذه البيانات الحرارية وعدم اليقين في القياس ، يتم اقتراح نموذج حركي للتفاعل لمحاكاة ديناميكيات الهروب الحراري. في الجزء الثاني من هذا العمل66 ، سيتم استخدام هذا النموذج المطور حديثا لتحديد احتمال حدوث حدث TR كدالة لمعلمات طريقة تشغيل ISC.
يلخص المخطط الموضح في الشكل 2 تسلسل الخطوات اللازمة لتنفيذ البروتوكول. تتكون الخطوة الأولى من تجميع الخلية الكهروكيميائية مع مواد البطارية قيد التحقيق ، وهي NMC (111) / Gr.
من أجل التمكن من حصاد مواد البطارية بعد الدورة الكهروكيميائية وتعديل حالة الشحن (SOC) إلى 100٪ ، تم استخدام خلية كهروكيميائية قابلة لإعادة الإغلاق توفرها EL-CELL (ECC-PAT-Core). سمح ذلك بعملية فتح خلية سلسة دون الإضرار بالأقطاب الكهربائية. بمجرد حصاد مواد البطارية ، يتم إجراء التوصيف الحراري.
Protocol
ملاحظة: للحصول على شرح مفصل لكل خطوة ، راجع الأقسام الفرعية الموضحة في الشكل 2.
1. إجراء تحضير الخلايا الكهروكيميائية داخل صندوق قفازات مملوء بالأرجون
- مجموعة غلاف العزل مع فاصل لخلية كهروكيميائية 2 أو 3 أقطاب كهربائية
- خذ قرص فاصل بوليمر (قطره 22 مم ، سمك 25 ميكرومتر) وضعه في الجزء العلوي من الجزء السفلي من غلاف عزل البولي بروبلين.
- اضغط بعناية على الجزء العلوي من غلاف العزل لتجميعه. تأكد من أن الفاصل مسطح.
- تجميع الخلايا الكهروكيميائية
ملاحظة: تأكد من أن جميع الخطوات المتعلقة بتجميع الخلايا الكهروكيميائية تتم داخل صندوق قفازات مملوء بالأرجون مع O 2 و H2O < 0.1 جزء في المليون.- اجمع الأدوات والمواد اللازمة لهذه الخطوة وأدخلها داخل صندوق القفازات: ملاقط التقاط الفراغ ، خلية EL-CELL الكهروكيميائية (تتكون من: مكبس سفلي من الفولاذ المقاوم للصدأ من النوع 50 ، مكبس علوي من الفولاذ المقاوم للصدأ ، غلاف العزل المجمع من الفقرة 1.1 ، أجزاء الخلية الأساسية المصنوعة من الفولاذ المقاوم للصدأ) ، قرص جرافيت 18 مم بسعة مساحة مقدرة تبلغ 2.24 مللي أمبير / سم2 ، قرص NMC (111) مقاس 18 مم بسعة مساحية مقدرة تبلغ 2.0 مللي أمبير / سم2 ، 1.0 M LiPF6 في EC / DMC = 50/50 (v / v) ، ماصة دقيقة 100-1000 ميكرولتر ، أطراف ماصة دقيقة.
ملاحظة: السعة المحددة للجرافيت و NMC (111) هي 350 مللي أمبير / جم و 145 مللي أمبير / جم ، على التوالي ، ويتم توفيرها من قبل الشركة المصنعة. تأكد من أن قطب الأنود مصمم ليكون له سعة أعلى من الكاثود لتجنب طلاء Li على أنود الجرافيت. تعتبر الموازنة المناسبة لقدرات القطب ذات أهمية حاسمة لتجنب الشحن الزائد للجرافيت وطلاء Li. يتم توفير القدرات المساحية للأقطاب الكهربائية أيضا من قبل الشركة المصنعة. - قم بوزن أقراص القطب على ميزان تحليلي مكون من 4 أرقام وسجل القيم لتحديد تحميل المواد الفعالة (انظر القسم 2 حساب سعة قرص القطب).
ملاحظة: استخدم أقراص أنود الجرافيت من فئة الإنتاج (96٪ مادة فعالة ، 2٪ مادة رابطة كربوكسي ميثيل السليلوز (CMC) ، 2٪ مادة مضافة موصلة) وأقراص الكاثود NMC (111) (86٪ مادة فعالة ، 8٪ مادة مضافة موصلة ، و 6٪ مادة رابطة فلوريد بوليفينيلدين) لتجميع 2 و 3 خلايا كهروكيميائية كهربائية (EL-CELL). يسمح التجميع في خلية كهروكيميائية 2 / 3 أقطاب بإعادة إنتاج نفس محتوى Li في حالة مشحونة كما هو الحال في خلية كبيرة الحجم حقيقية ، مقارنة بمجموعة نصف خلية Li-metal. ما يصل إلى 40 غرام ، دقة الميزان الرقمي هي 0.01 ملغ. - خذ 150 ميكرولتر من المنحل بالكهرباء باستخدام الماصة الدقيقة وضع قطرة على الفاصل المواجه للجزء السفلي من غلاف العزل. أدخل أنود الجرافيت بمساعدة ملقط التقاط الفراغ متبوعا بالمكبس السفلي.
- استدر حول غلاف العزل ووزع المنحل بالكهرباء المتبقي على الفاصل. أدخل قرص الكاثود NMC (111) بمساعدة ملقط التقاط الفراغ وضع المكبس العلوي.
- قم بتركيب التجميع داخل الجزء الأساسي للخلية. ضع الحلقة O واربط كل شيء معا باستخدام مشبك الترباس.
- قم بقياس الجهد الاسمي للخلية الطازجة بمقياس متعدد لضمان اتصال جيد بين مكونات الخلية وتحديد الأخطاء المحتملة. دقة الجهد المتعدد هي 1 مللي فولت عند 3 فولت و 10 مللي فولت عند 30 فولت.
ملاحظة: لتجنب أوقات الانتظار الطويلة بعد فتح الخلية ، والتي قد تغير تكوين المواد الفعالة ، قم بتجميع خلية كهروكيميائية جديدة مقاس 18 مم NMC (111) / Gr لكل تجربة حرارية. يجب ألا تتجاوز المهلة الزمنية بين فتح الخلية وتحليل STA / الغاز المتصاعد (بما في ذلك جميع المستحضرات) أكثر من 2 أيام. يعد التجميع والإغلاق المناسبين للخلية أمرا في غاية الأهمية لنجاح الدورة الكهروكيميائية للخلية وبالتالي لإعداد أقطاب كهربائية لتوصيف STA / GC-MS / FTIR.
- اجمع الأدوات والمواد اللازمة لهذه الخطوة وأدخلها داخل صندوق القفازات: ملاقط التقاط الفراغ ، خلية EL-CELL الكهروكيميائية (تتكون من: مكبس سفلي من الفولاذ المقاوم للصدأ من النوع 50 ، مكبس علوي من الفولاذ المقاوم للصدأ ، غلاف العزل المجمع من الفقرة 1.1 ، أجزاء الخلية الأساسية المصنوعة من الفولاذ المقاوم للصدأ) ، قرص جرافيت 18 مم بسعة مساحة مقدرة تبلغ 2.24 مللي أمبير / سم2 ، قرص NMC (111) مقاس 18 مم بسعة مساحية مقدرة تبلغ 2.0 مللي أمبير / سم2 ، 1.0 M LiPF6 في EC / DMC = 50/50 (v / v) ، ماصة دقيقة 100-1000 ميكرولتر ، أطراف ماصة دقيقة.
2. حساب سعة قرص القطب
ملاحظة: تم تقطيع رقائق النحاس والألمنيوم العارية (غير المطلية) من نفس المورد إلى أقراص بقطر ثابت 18 مم.
- وزن (على الأقل) 5 أقراص Al وخمسة أقراص Cu بقطر 18 مم لحساب متوسط وزن كل مجمع حالي.
- قبل كل تجميع خلية ، قم بوزن قطب NMC القرصي مقاس 18 مم وأنود القرص Gr مقاس 18 مم ، كما هو مذكور في الخطوة 1.2.2 ، من أجل حساب تحميل المواد والسعة المساحية المحسوبة بدقة ، في مرحلة لاحقة.
- اشتق تحميل مادة القطب عن طريق طرح متوسط الكتلة (W مجمع التيار غير المطلي) لمجمع التيار (رقائق غير مطلية) من وزن قرص القطب:
Wمادة القطب (ملغ) = W المغلفة قرص القطب (ملغ) - Wجامع التيار غير المغلفة (ملغ) - احسب محتوى المادة النشطة:
W المادة الفعالة (ملغ) = Wمادة القطب (ملغ) * X٪
حيث X٪ هو الجزء الكتلي للمادة الفعالة ويتم توفيره من قبل الشركة المصنعة (انظر الملاحظة بعد الخطوة 1.2.2). - حدد السعة الفعلية لقرص القطب بضرب محتوى المادة النشطة في السعة المحددة المقدرة التي يوفرها المورد (انظر الملاحظة بعد الخطوة 1.2.1). بعد ذلك ، احسب السعة المساحية للقرص:
السعة المحسوبة قرص القطب (مللي أمبير) = Wالمادة الفعالة (ز) * السعة النوعية المقدرة (مللي أمبير / جم)
قرص قطب كهربائي محسوب سعة مساحية (مللي أمبير / سم 2) = قرص قطب كهربائي محسوب (مللي أمبير) / πr2
r = نصف قطر قرص القطب
ملاحظة: يتم تنفيذ الخطوات 2.1-2.4 لتحديد الحمل الكتلي بدقة والسعة المساحية لكل قطب كهربائي والتحقق من القيم المبلغ عنها من قبل المورد (أي 2.24 مللي أمبير / سم 2 لأنود الجرافيت و 2.0 مللي أمبير / سم2 لكاثود NMC (111).
3. ركوب الدراجات الكهروكيميائية
- قم بإنشاء بروتوكول ركوب الدراجات باستخدام برنامج دورة البطارية كما هو موضح من قبل Ruiz et al.67 تحت القسم 1 (تحضير خلية الحقيبة وتشكيلها) ، الفقرة 3 والملفات التكميلية لمخطوطة Ruiz et al.67.
ملاحظة: الدورة الكهروكيميائية التي يتم إجراؤها في القسم 3 هي دورة تكوين أولية لتنشيط الخلية ، لقياس السعة وأخيرا لضبط SOC. تخضع كل خلية لدورتين للشحن والتفريغ ثم يتم شحنها بالكامل (عند جهد القطع 4.2 فولت). تم اختيار عدد الدورات وفقا لتوصية المورد. - باتباع الإجراء الذي وصفه Ruiz et al.67 ، قم بتضمين الخطوات التالية في إجراء الدورة الكهروكيميائية (انظر الملف التكميلي 1): شحنة التيار المستمر (CC) عند C / 20 لقطع الجهد 4.2 فولت ؛ 1 ساعة راحة الوقت (OCV) ؛ تفريغ CC عند C / 20 لقطع الجهد 3 فولت ؛ 1 ساعة راحة الوقت (OCV) ؛ شحن CC عند C / 20 لقطع الجهد 4.2 فولت ؛ 1 ساعة راحة الوقت (OCV) ؛ تفريغ CC عند C / 20 لقطع الجهد 3 فولت ؛ 1 ساعة راحة الوقت (OCV) ؛ شحنة CC عند C / 20 لقطع الجهد 4.2 فولت.
ملاحظة: نظرا لأنه لا يمكن تحديد السعة الحقيقية للخلية الكهروكيميائية قبل دورة التكوين الأولية ، فقد تم تحديد تيار الاختبار المقابل لمعدل C البالغ C / 20 بناء على السعة المحسوبة لقرص القطب (انظر التفاصيل في الخطوة 2.4). نتيجة لذلك ، يمكن تقدير سعة 5.18 مللي أمبير في الساعة. نظرا لأن معدل 1C يشير إلى الشحن الكامل أو التفريغ للخلية الكهروكيميائية في 1 ساعة ، فإن التيار المقابل لمعدل C / 20 يتم حسابه على أنه 5.18 مللي أمبير / 20 ساعة = 0.259 مللي أمبير. لذلك ، تم تطبيق تيار ثابت قدره 0.259 مللي أمبير حتى معايير القطع المقابلة للشحن والتفريغ. - أدخل اسم ملف لهذا البروتوكول (على سبيل المثال ، دراسات STA ، شحنة حالة الخلية).
- اضبط حجرة درجة الحرارة على درجة حرارة ثابتة تبلغ 25 درجة مئوية.
- أخرج الخلية الكهروكيميائية من صندوق القفازات وضعها داخل حجرة درجة الحرارة. قم بتوصيل الكابلات المناسبة لتوصيل الخلية بالدراجة.
- قم بتشغيل الإجراء عن طريق تحديد اسم ملف البروتوكول ، وإدخال التيار المقابل لمعدل C / 20 C وحدد رقم الغرفة. بعد ذلك ، انقر فوق الزر " ابدأ ".
- تحقق بانتظام من ملف تعريف الشحن / التفريغ مقابل الوقت لتحديد أي مشكلات أثناء ركوب الدراجات. للقيام بذلك ، حدد القناة وانقر على شعار الرسم لعرض الرسم البياني. إذا كانت السعة المقاسة تختلف بأكثر من 10٪ عن السعة المحسوبة ، فلا تستخدم الخلية لأنه ربما كانت هناك تفاعلات غير مرغوب فيها (قد تعدل البيانات الحرارية لاحقا) أو أن تجميع الخلية لم ينجح.
- احسب درجة تثبيط الجرافيت ، باستخدام الصيغة التالية:
درجة التحلل Gr (٪) = (سعة التفريغ التجريبية / سعة المساحة المحسوبة) * 100
ملاحظة: يتم الحصول على قدرة التفريغ التجريبية من خطوة التفريغ الثانية في الفقرة 3.2. في الواقع ، يشير البرنامج إلى قدرة تجريبية على الشحن والتفريغ لكل دورة. يتم الحصول على السعة المساحية المحسوبة (مللي أمبير / سم 2) وفقا للخطوة2.4.
4. تفكيك الخلية والتحضير لتحليل STA / GC-MS / FTIR
- بعد خطوة ركوب الدراجات ، أحضر الخلية الكهروكيميائية داخل صندوق القفازات للتفكيك. افتح الخلية ، وأزل المكبس ، وأخرج قطبا كهربائيا واحدا (الكاثود أو الأنود) ، وأعد تجميع الخلية لحماية القطب المتبقي من الجفاف.
- قم بوزن القطب باستخدام ميزان الدقة من الخطوة 1.2.2 وضعه على ورق ألومنيوم طازج. قم بطي الرقاقة ووضعها لمدة 2 ساعة في غرفة انتظار صندوق القفازات تحت الفراغ ، لتجفيف القطب.
ملاحظة: وجد من خلال الاختبارات الأولية أن وقت التجفيف لمدة 2 ساعة هو الأمثل للوصول إلى وزن ثابت. كان معيار التثبيت هو عدم وجود تذبذب كبير في الوزن بين قياسين للقطب الكهربائي لمدة لا تقل عن 5 دقائق. يعتبر التذبذب كبيرا عندما يختلف الوزن أكثر من الفاصل الزمني المحدد أدناه:
X ملغ ± 0.01 ملغ - عندما يستقر الوزن عند X ملغ ± 0.01 ملغ ، لاحظ وزن القطب المجفف. انتقل إلى خدش قطب القرص ، باستخدام ملاقط وملعقة ، لحصاد المواد المطلية لمزيد من التوصيف.
5. التوصيف الحراري وتحليل الغاز
ملاحظة: يتم إجراء التوصيف الحراري وتحليل الغاز في الإعداد كما هو موضح في الشكل 1.
- إعداد STA
- قم بإنشاء طريقة جديدة عن طريق فتح برنامج STA والنقر فوق ملف ، ثم على جديد. ضمن علامة التبويب إعداد في نافذة تعريف القياس ، حدد المعلمات وفقا للجدول 4.
- انتقل إلى علامة التبويب الرأس وحدد تصحيح لتنفيذ عملية تصحيح ببوتقة فارغة لتصحيح خط الأساس. اكتب اسم العينة (على سبيل المثال ، تصحيح تشغيل NMC-Gr-16_Gr) وحدد ملف معايرة درجة الحرارة والحساسية لاستخدامها في التشغيل. انتقل إلى غازات MFC وحدد الهيليوم كغاز تطهير وغاز واقي.
ملاحظة: تشغيل التصحيح هو تشغيل لإنشاء خط أساس دقيق. - قم بإنشاء برنامج درجة الحرارة ضمن علامة التبويب برنامج درجة الحرارة ، كما هو موضح في الجدول 5 ، لتحديد عملية التسخين والتبريد.
- اضبط معدل تدفق الهيليوم على 100 مل / دقيقة و 20 مل / دقيقة للتطهير والغاز الواقي ، على التوالي. انقر فوق GN2 (نيتروجين الغاز) كوسيط تبريد و STC للتحكم في درجة حرارة العينة لجميع أجزاء برنامج درجة الحرارة ، بدءا من الخطوة متساوية الحرارة عند 5 درجات مئوية إلى نهاية جزء التسخين.
- انتقل إلى علامة التبويب العناصر الأخيرة وأعط اسم ملف لهذا التشغيل (والذي قد يكون هو نفسه اسم العينة).
- استخدم ميزان الدقة (نفس الميزان المستخدم في الخطوة 1.2.2) وقم بقياس وزن البوتقة الفارغة. أدخل كتلة البوتقة بجوار اسم العينة.
- افتح فرن الفضة وضع البوتقة، مع البوتقة المرجعية، على حامل عينة DSC/TG الخاص ب STA.
ملاحظة: البوتقات مصنوعة من الألومنيوم بغطاء مثقوب بالليزر مع فتحة قطرها 5 ميكرومتر. - تأكد من أن حامل العينة متمركز جيدا لتجنب الاصطدام أثناء إغلاق الفرن. تحقيقا لهذه الغاية ، قم بخفض الفرن الفضي بحذر وعندما يكون الفرن قريبا من حامل العينة ، تحقق من موضع حامل العينة فيما يتعلق بالجدران الداخلية لفرن الفضة.
- قم بإخلاء الفرن (لإزالة الأرجون) ببطء وأعد تعبئته بالهيليوم بأقصى معدل تدفق (350 مل / دقيقة من غاز التطهير و 350 مل / دقيقة من الغاز الواقي). كرر الإخلاء / إعادة التعبئة مرتين على الأقل للتخلص من الأرجون القادم من جو صندوق القفازات (عند فتح الفرن لوضع البوتقات).
ملاحظة: تعتبر خطوة الإخلاء والردم (خطوة إعادة تعبئة الهيليوم) مهمة لأن التوصيل الحراري من فرن STA إلى العينة يتأثر بنوع بيئة الغاز داخل الفرن. - بعد خطوة الإخلاء وإعادة التعبئة ، انتظر لمدة 15 دقيقة لتثبيت الوزن. قم بتنفيذ تشغيل التصحيح ، باستخدام برنامج درجة الحرارة ، بالضغط على Measure لبدء التشغيل.
- عند الانتهاء من الجري ، أخرج البوتقة الفارغة. ضع كتلة عينة ، عادة 6-8 ملغ ، من المادة المخدوشة (الأنود أو الكاثود) في البوتقة. بعد وزن العينة في البوتقة وتسجيل الكتلة ، أغلق المقلاة والغطاء باستخدام مكبس مانع للتسرب.
- كرر الخطوات من 5.1.7 إلى 5.1.9 مع البوتقة المملوءة.
ملاحظة: يجب استخدام نفس البوتقة والغطاء كما في عملية التصحيح. - افتح ملف تشغيل التصحيح بالانتقال إلى ملف وفتح. حدد تصحيح > عينة كنوع قياس ضمن علامة التبويب تعريف سريع. اكتب اسم العينة ووزنها (على سبيل المثال ، NMC-Gr-16_Gr) واختر اسم ملف.
- انتقل إلى علامة التبويب برنامج درجة الحرارة وقم بتنشيط خيار FT (FTIR) للخطوة متساوية الحرارة البالغة 5 درجات مئوية وجزء التسخين إلى 590 درجة مئوية من أجل إطلاق مراقبة غاز FTIR لهذين الجزأين. ضع علامة في مربع GC لجزء التسخين (5 درجات مئوية إلى 590 درجة مئوية) لبدء تحليل GC-MS.
ملاحظة: قبل بدء الاختبار ، يجب تحضير معدات الغاز المقترنة كما هو موضح في القسم المقابل (أي القسمين 5.2 و 5.3) أدناه.
- إعداد FTIR
- خذ قمعا ، وأدخله في Dewar من منفذ كاشف تيلورايد الكادميوم الزئبقي (MCT) واملأه بعناية بالسائل N2.
- افتح برنامج FTIR. في علامة التبويب المعلمة الأساسية ، قم بتحميل أسلوب TG-FTIR المسمى TGA. إكس بي إم. ويشار إلى معلمات قياس المدخلات المستخدمة لهذه الطريقة في الجدول 6 (انظر أيضا الملف التكميلي 2 للاطلاع على لقطات شاشة معلمة التحليل الحراري الوزني (TGA). برنامج XPM).
ملاحظة: تأكد من معدل تدفق غاز الأرجون الثابت مع وضع مقياس تدفق الكتلة عند مدخل خلية غاز الأشعة تحت الحمراء. عندما لا تكون قيد التشغيل ، هناك حاجة إلى تدفق 10 لتر / ساعة لإزالة وجود الرطوبة وثاني أكسيد الكربون2. أثناء التشغيل ، يتم استخدام تدفق 20 لتر / ساعة. خلية غاز الأشعة تحت الحمراء ذات المسار 10 سم هي خلية غاز خارجية (يتم تسخينها هنا عند 200 درجة مئوية) مقترنة ب STA لتحديد الغازات المتصاعدة أثناء التحليل الحراري. - تحقق من مخطط التداخل بالنقر فوق علامة التبويب Check Signal . انتظر حتى يستقر مخطط التداخل قبل بدء التحليل الحراري.
- إعداد GC-MS
- ضع المعلمات التالية في طريقة GC-MS لمراقبة الغاز عبر الإنترنت ، كما هو موضح في الجدول 7.
- قم بتشغيل خط مضخة التفريغ لسحب الأنواع الغازية المتطورة من STA إلى FTIR و GC-MS. اضبط معدل الضخ على تدفق مستقر ، وهو حوالي 60 مل / دقيقة.
- بعد تحميل الطريقة بالمعلمات المذكورة أعلاه (انظر الجدول 7) ، انقر فوق بدء التشغيل واملأ اسم العينة واسم ملف البيانات ؛ ثم ، انقر فوق " موافق" ، ثم فوق "طريقة التشغيل".
- إطلاق تشغيل STA / GC-MS / FTIR
- في برنامج STA ، تحقق من برنامج درجة الحرارة وتدفق الغاز وتأكد من تمكين خيارات GC-MS و FTIR.
- اضغط على Measure وانقر فوق بدء اتصال FTIR لإنشاء الاتصال بين برنامج STA وبرنامج FTIR .
- بمجرد إنشاء الاتصال ، انقر فوق Tare لوضع الرصيد عند الصفر والتحقق من تدفق الغاز عن طريق تحديد تعيين الغازات الأولية. يجب أن يكون تدفق غاز التطهير في حجرة العينة عند 100 مل / دقيقة ويجب أن يكون تدفق الغاز الواقي عند 20 مل / دقيقة.
- اضغط على الزر "ابدأ" لبدء التشغيل.
ملاحظة: كرر التوصيف الحراري وتحليل الغاز المتصاعد مع مواد الأنود والكاثود عند 5 و 10 و 15 درجة مئوية / دقيقة.
- تقييم بيانات DSC وTGA
- بعد اكتمال التجربة ، افتح برنامج معالجة بيانات Netzsch Proteus بالنقر المزدوج على الرمز.
- على شريط الشريط أعلاه ، حدد T / t مع سهم أسفله لوضع مقياس درجة الحرارة (T) على المحور x بدلا من الوقت ( t ). للتوضيح ، قم بإزالة منحنيات التبريد بالنقر فوق الزر "مقطع " على شريط الشريط وإلغاء تحديدها. أيضا ، قم بإزالة تدفق غاز حجرة العينة ، و TGA ، ومنحنيات Gram-Schmidt بالضغط على أيقونة المحاور / المنحنيات ، ثم قم بإلغاء تحديدها.
- قم بقياس إجمالي إطلاق الحرارة ومناطق كل قمة DSC رئيسية بالنقر بزر الماوس الأيمن على الرسم البياني، ثم حدد تقييم. بعد ذلك ، انقر فوق المنطقة الجزئية وحدد نطاق درجة الحرارة حيث سيتم قياس إجمالي إطلاق الحرارة ، باستخدام خطي كنوع خط الأساس. فيما يتعلق بتفضيلات المنطقة الجزئية ، حدد بدء اليسار.
- بعد ذلك، حرك المؤشر وانقر في نهاية كل قمة DSC رئيسية لقياس إطلاق الحرارة المتعلقة بها واضغط على تطبيق.
ملاحظة: تنتهي الذروة عندما تعود الإشارة إلى خط الأساس.
- بعد ذلك، حرك المؤشر وانقر في نهاية كل قمة DSC رئيسية لقياس إطلاق الحرارة المتعلقة بها واضغط على تطبيق.
- قم بقياس درجة حرارة الذروة لكل قمة رئيسية (3 في أنود الجرافيت و 3 في كاثود NMC (111)) بالنقر بزر الماوس الأيمن على الرسم البياني DSC وانتقل إلى تقييم > الذروة.
- بعد ذلك، حرك المؤشر عند كل طرف من أطراف الذروة الطاردة للحرارة الرئيسية لكالوريمتر المسح الضوئي التفاضلي (DSC) وانقر لتحديد درجة حرارة الذروة.
- اجمع قيم درجة حرارة الذروة ومعدل التسخين وتدفق الحرارة لكل قمة وإجمالي تدفق الحرارة. ارسم درجة حرارة الذروة مقابل معدل التسخين في رسم بياني.
ملاحظة: من البيانات التجريبية لكالوريمتر المسح الضوئي التفاضلي (DSC)، يستخدم تحليل كيسنجر لحساب طاقة التنشيط للقمم التي تتبع حركية من نوع أرهينيوس. - أعد منحنى التحليل الحراري الوزني (TGA) إلى الرسم البياني عن طريق تحديد أيقونة المحاور/المنحنيات وتحديد مربع TG .
- قم بتقييم فقدان الكتلة مقابل درجة الحرارة، بالتوازي مع منحنى DSC، لإجراء تقييم أولي لتغيرات انتقال الطور/المحتوى الحراري المرتبطة بمنحنى التحليل الحراري الوزني (TGA). لهذا الغرض ، انقر بزر الماوس الأيمن على منحنى TGA ، ثم حدد تقييم > تغيير الكتلة. حرك المؤشرات قبل وبعد فقدان الوزن ، واضغط على تطبيق ، ثم موافق.
- قم بتبديل المحور X من درجة الحرارة إلى المقياس الزمني.
- تحقق من الغازات المتصاعدة بالنقر فوق رمز تحليل بيانات GC-MSD Netzsch في محطة GC-MS . قم بتحميل ملف بيانات التحليل الحراري المقابل وتحقق من قمم GC.
- قم بتكبير الذروة المراد تحليلها ، وبعد ذلك ، انقر بزر الماوس الأيمن على خط الأساس والذروة. بعد ذلك ، انتقل إلى شريط الرموز وحدد الطيف > طرح. سيؤدي هذا إلى طرح خط الأساس من الطيف.
- انقر نقرا مزدوجا فوق الرسم البياني MS للتحقق من المرشحين / المطابقات المحتملة المقابلة للذروة في قاعدة بيانات NIST.
ملاحظة: هناك اختلاف في النطاق الزمني بين تحليل GC-MS وتحليل STA. في الواقع ، يتم إطلاق GC-MS دائما بعد 20 دقيقة من البدء الأولي للبرنامج الحراري. تبدأ مراقبة GC-MS في بداية مرحلة التسخين STA من 5 درجات مئوية إلى 590 درجة مئوية. درجة الحرارة الأولية ل GC-MS هي 100 درجة مئوية ودرجة الحرارة الأولية لقطاع التسخين STA هي 5 درجات مئوية. - فيما يتعلق بتقييم بيانات FTIR ، افتح برنامج Opus. قم بتحميل الأطياف المسجلة أثناء التجربة بالانتقال إلى ملف على أدوات الشريط، ثم تحديد تحميل ملف واسترداد ملف البيانات من المجلد. الآن ، TRS (الأطياف التي تم حلها زمنيا) عرض Postrun مفتوح.
ملاحظة: يسمح تصور البيانات ثلاثي الأبعاد بعرض أطياف الأشعة تحت الحمراء التي تم جمعها برقم طول موجي مختلف (cm-1) كدالة للوقت (بالثواني) ، مما يدل على المنتجات الغازية المكتشفة بواسطة مطياف FTIR القادم من التحلل الحراري لمواد القطب في STA. يظهر المحور Y سعة إشارة الامتصاص ؛ المحور Z ، الوقت والمحور X هو الرقم الموجي. - على منحنى DSC ثنائي الأبعاد (2 بعد) الموجود على الجانب الأيمن من الرسم البياني ثلاثي الأبعاد ، قم بتغيير المحور X من وقت لآخر عن طريق الضغط على الزر الأيمن للماوس وانتقل إلى تحديد محور الوقت وحدد درجة الحرارة.
- بعد ذلك، على نفس الرسم البياني 2D DSC، حرك مؤشر السهم الأزرق على طول المحور السيني (درجة الحرارة) لمنحنى DSC لمراقبة تباين امتصاص الأشعة تحت الحمراء على نطاق واسع من الأرقام الموجية، المعروض على النافذة السفلية اليمنى (كثافة امتصاص الأشعة تحت الحمراء مقابل الرقم الموجي cm-1). بعد هذا التقييم ، حدد مجموعة من نطاقات الامتصاص التي تظهر اتجاها مشابها (نفس العدد الأقصى عند نفس درجة الحرارة) ، ثم ضع مؤشر السهم الأزرق في مكان يعكس أقصى امتصاص لهذه النطاقات.
ملاحظة: تسمح هذه الخطوة بتحديد نطاقات امتصاص الأشعة تحت الحمراء المقابلة لمركبات الغاز المتصاعدة ، المرتبطة بنطاق درجة حرارة معين. - في نافذة طيف امتصاص الأشعة تحت الحمراء ، يتم عرض منحنيات الامتصاص الزرقاء (غير المعروفة) والحمراء (خط الأساس) من التحديد في منحنى 2D DSC. تحديد مواقع ذروة الامتصاص المختلفة لطيف الأشعة تحت الحمراء الزرقاء (بيانات طيفية غير معروفة) عن طريق تحريك مؤشرات الأسهم الخضراء والفوشيه على طول المحور X (رقم الطول الموجي cm-1).
- في قائمة المسح الموجودة في النافذة الوسطى ، يتم عرض درجة الحرارة والتاريخ / الوقت ومعلومات الفهرس لكل طيف. قم بالتمرير لأسفل القائمة للعثور على عمليات المسح باللونين الأحمر والأزرق التي تم تمييزها بنفس رمز اللون.
- قم باستخراج الطيف الأحمر (خط الأساس) عن طريق النقر بزر الماوس الأيمن أولا على القائمة وتحديد استخراج الأطياف المحددة. كرر نفس العملية مع مسح الطيف الأزرق. في علامة التبويب عرض، يتم عرض الأطياف المستخرجة مع رقم الفهرس ومعلومات درجة الحرارة.
- في متصفح OPUS الموجود على الجانب الأيسر من النافذة ، انقر فوق اسم ملف مسح الطيف (الطيف غير المعروف) واضغط على أيقونة الطرح لفتح نافذة طرح الطيف . في متصفح OPUS ، انقر فوق رمز AB من ملف الأساس واسحبه داخل ملف (ملفات) إلى مربع طرح . في علامة التبويب نطاق التردد للطرح ، حدد المربع استخدام حدود الملفات .
- انقر فوق بدء الوضع التفاعلي. الآن ، تعرض النافذة رسمين بيانيين. يعرض الجزء العلوي الطيف المجهول (باللون الأحمر الآن بدلا من الأزرق) وخط الأساس المراد طرحه (باللون الأزرق الآن). الرسم البياني الموجود في الجزء السفلي من النافذة هو المنحنى الناتج من عملية الطرح. انقر فوق طرح تلقائي ، ثم على المتجر عند الانتهاء. بعد هذه العملية ، تتم إضافة الرمز التالي SUBTR إلى ملف طيف الامتصاص غير المعروف في متصفح OPUS ، مما يدل على معالجة الطيف.
ملاحظة: يسمح الخيار تغيير الرقم بتخصيص وتحسين ثابت الطرح الذي تم تعيينه إلى واحد بشكل افتراضي. في حالة الشك ، حدد طرح تلقائي وسيقوم البرنامج بذلك تلقائيا. - أغلق الملف الأساسي من مستعرض OPUS لإزالته من الرسم البياني.
- حدد ملف طيف الامتصاص غير المعروف من متصفح OPUS وانقر على أيقونة Spectrum Search من شريط أدوات الشريط. في علامة التبويب معلمات البحث ، ضع القيمة 30 كحد أقصى لعدد الزيارات والقيمة 100 للحد الأدنى لجودة النتائج. ضع علامة في مربع عدة مكونات ليتم البحث عنها في الطيف. في علامة التبويب تحديد مكتبات ، تأكد من وجود المكتبة ذات الصلة المسماة قاعدة بيانات الأشعة تحت الحمراء لمرحلة الغاز EPA-NIST . إذا لم يكن كذلك ، أضفه إلى المكتبة. بعد إجراء جميع الإعدادات ، انقر فوق مكتبة البحث. يتم سرد قائمة بالتطابقات المحتملة بعد هذا الإجراء.
- تحقق من قائمة المركبات الغازية المحتملة الموجودة في طيف امتصاص الأشعة تحت الحمراء غير المعروف (الذي تم تحديده بواسطة المؤشر الأزرق في الخطوة 5.14). من خلال الفحص البصري ، قارن ميزات التردد من الطيف المرجعي التحليلي المختلف (من المركبات المرشحة المحتملة) مع الطيف المجهول. ابحث عن أفضل تطابقات الذروة لتحديد أنواع الغاز المنبعثة عند درجة حرارة معينة.
- حدد الأرقام الموجية الأكثر تمثيلا لكل مركب غاز محدد. يمكن استخدام مخطط كثافة الوقت في الزاوية اليمنى العليا لقياس تباين تركيز الغازات المتولدة.
- قم بتصدير بيانات تطور الغاز للغازات المختلفة المحددة (في هذه الحالة ، CO2 و EC) بتنسيق ASCII لمزيد من المعالجة في Excel أو Origin أو برامج معالجة البيانات الأخرى. لهذا الغرض ، انتقل إلى نافذة TRS Postrun-Display .
ملاحظة: في النافذة العلوية اليمنى، يوجد طولان موجيان في القائمة. أحدهما يتوافق مع سهم المؤشر الأخضر والآخر مع سهم المؤشر الوردي ، وكلاهما من الرسم البياني للامتصاص (لدرجة حرارة معينة) في القسم الأيمن السفلي. في هذه الحالة ، تتوافق الأطوال الموجية للقمم الممتصة الموضحة بالأسهم الخضراء والوردية مع EC مع 1,863 cm-1 و CO 2 مع 2,346 cm-1. - حدد طولا موجيا واحدا ، وانقر بزر الماوس الأيمن ، وانتقل إلى تصدير التتبع > عادي ASCII (z ، y). كرر نفس العملية مع الطول الموجي الآخر.
النتائج
الأرقام المبينة في هذا القسم مأخوذة من المرجع48.
التوصيف الكهروكيميائي للخلايا الكهروكيميائية
تم توصيف ما مجموعه اثنتي عشرة خلية كهروكيميائيا قبل التجارب الحرارية والنتائج موضحة في الجدول 8. تم حساب سعة كل خلية (انظر القسم 2 من البروتوكول) مع مراعاة كتلة المادة النشطة وبافتراض قدرة نظرية تبلغ 145 مللي أمبير / جم ل NMC (111) و 350 مللي أمبير / جم للجرافيت. تم الحصول على قدرة التفريغ التجريبية من خطوة التفريغ الثانية. ويبين الجدول 8 أيضا درجة التثليخ، محسوبة بعد القسم 3-8 .
تم تصميم تحميل أنود الجرافيت من قبل الشركة المصنعة ليحتوي على مادة نشطة زائدة بنسبة 10٪ مقارنة بالكاثود لتجنب طلاء الليثيوم في تكوين خلية NMC (111) / Gr قطبين كهربائيين. أظهرت قياساتنا زيادة بنسبة 11٪ في المتوسط.
يتم عرض ملامح إمكانات الشحن والتفريغ للدورة الثانية من الخلية الكهروكيميائية NMC (111) / Gr ، العينة رقم 5 من الجدول 8 ، في الشكل 3. يوضح هذا الرسم البياني أن منحنى التفريغ يتوقف عند جهد أنود يبلغ حوالي 50 مللي فولت مقابل Li ، مما يؤكد بالتالي عدم وجود طلاء بالليثيوم. في الواقع ، لا تصل إمكانات الأنود إلى 0 فولت مقابل لي.
التحلل الحراري للجرافيت الدهني
بناء على قياساتنا وملاحظاتنا التجريبية ، يتم تحديد آليات التحلل الحراري المحتملة لأنود الجرافيت من ملخص مسح الأدبيات المدرج في الجدول 1 والجدول 2 والجدول 3 ومناقشتها لاحقا في قسم المناقشة.
يظهر ملف تعريف التحلل الحراري النموذجي للمسحوق المخدوش من الأنود (العينة رقم 5 من الجدول 8) في الشكل 4 أ. يتم عرض تدفق الحرارة (ميغاواط / ملغ) ، وفقدان الكتلة (بالوزن٪) ، وشدة FTIR النسبية لثاني أكسيد الكربون2 (2,346 سم −1) و EC (1,863 سم −1) كدالة لدرجة الحرارة (من 5 درجات مئوية إلى 590 درجة مئوية يتم الحصول عليها عند معدل تسخين 10 درجات مئوية / دقيقة). يمكن تقسيم ملف تعريف التحلل إلى أربع مناطق حرارية متميزة (موضحة بالأرقام العربية). يشار إلى أبرز القمم في منحنى DSC بالأرقام الرومانية. يتم عرض أطياف FTIR للغاز المتصاعد عند 110 درجة مئوية و 250 درجة مئوية في الشكل 4 ب والشكل 4 ج ، على التوالي. لأغراض المقارنة ، تتم إضافة الأطياف المرجعية NIST لثاني أكسيد الكربون2 والإيثيلين و EC في الأشكال.
تظهر قمة ماصة للحرارة حادة في المنطقة 1. في نطاق درجة الحرارة هذا أقل من 100 درجة مئوية ، لم يتم الكشف عن أي فقد في الكتلة ولم يتم توليد الغاز. ومن المثير للاهتمام ، أن هذه القمة موجودة أيضا مع قطب الجرافيت البكر الملامس للكهارل (غير معروض) دون دورة كهروكيميائية مسبقة. تشير هذه الملاحظة إلى أن هذه الذروة لا تنتمي إلى الخصائص الحرارية للجرافيت المليث. لهذا السبب ، لم يتم أخذها في الاعتبار لحساب الخصائص الحرارية في مرحلة لاحقة.
تظهر المنطقة 2 أنه مع زيادة درجة الحرارة، لوحظ تحلل حراري واسع النطاق لكالوريمتر المسح الضوئي التفاضلي، مع ذروة حوالي 150 درجة مئوية -170 درجة مئوية (الذروة الأولى). يظهر امتصاص الأشعة تحت الحمراء المميز لثاني أكسيد الكربون2 (2346 سم -1) حوالي 100 درجة مئوية ويظهر بالتوازي أو بعد درجة حرارة بداية الذروة الطاردة للحرارة العريضة. يوضح الشكل 4 ب أطياف FTIR عند 110 درجة مئوية حيث يكون CO2 مرئيا بوضوح. تم اكتشافه أيضا بواسطة GC-MS في الشكل 5. ومع ذلك ، تنخفض شدة الذروة ، كما يتضح من الامتصاص عند 2,346 سم -1 في الشكل 4 أ. علاوة على ذلك ، يبدأ EC في التبخر بالقرب من 150 درجة مئوية ، كما هو موضح في منحنى FTIR 1,863 cm-1 في الشكل 4 أ. تطور الغاز وفقدان الكتلة في نطاق درجة الحرارة 100 °C -220 °C هو الحد الأدنى. في نهاية المنطقة 2 ، تجدر الإشارة إلى ذروة ماصة للحرارة صغيرة حوالي 200 درجة مئوية بعد إطلاق الحرارة المعتدل. يتم توفير الأصل المحتمل لهذه المرحلة الانتقالية لاحقا في قسم المناقشة.
كما يتضح من المنطقة 3 ، مع ارتفاع درجة الحرارة إلى ما بعد 220 درجة مئوية ، يزداد توليد الحرارة ، كما يتضح من ذروة طاردة للحرارة حادة (الذروة الثانية) ، المرتبطة بفقدان كبير للكتلة وتطور الغاز المتزامن. يظهر تحليل الغاز بوضوح CO2 (عبر FTIR في الشكل 4 أ و GC-MS في الشكل 5) ، EC (عبر FTIR الشكل 4 أ والشكل 4 ج) ، PF3 (عبر GC-MS في الشكل 6) والإيثيلين (عبر GC-MS في الشكل 7) كمنتجات غازية رئيسية للتفاعلات الحرارية. وتجدر الإشارة إلى أنه في ملف تعريف أطياف الأشعة تحت الحمراء عند 250 درجة مئوية (الشكل 4 ج) ، من الصعب تعيين جميع نطاقات الامتصاص بسبب تعقيد نمط الأشعة تحت الحمراء مقارنة بالنمط الذي تم الحصول عليه عند 110 درجة مئوية (الشكل 4 ب). وتشير السمات التي لوحظت في هذه المنطقة، ولا سيما التغير في تطور الغاز مقارنة بالمنطقة 2، إلى آليات تحلل متتالية ومتوازية .
عندما تتجاوز درجة الحرارة 280 درجة مئوية ، تنخفض كمية إطلاق الحرارة مع ظهور قمم صغيرة متداخلة جزئيا في المنطقة 4. تكشف بيانات التحليل الحراري الوزني (TGA) عن تغيرات طفيفة في فقدان الكتلة مع منتجات الغاز المتولدة والمحددة فقط عند 15 درجة مئوية / دقيقة. مع GC-MS ، لوحظت آثار الإيثيلين في الشكل 7 ، C2H 6 في الشكل 8 ، CH4 (تم قياسها ولكن لم يتم عرضها) ، C3H6 (تم قياسها ولكن لم يتم عرضها). تشير أنواع التحلل الغازي والكمية الأقل من الحرارة المنبعثة (من هذه القمم الطاردة للحرارة المتداخلة) ، مقارنة بالمنطقة 3 ، إلى أن العمليات الحرارية التي تحدث في هذه المنطقة تختلف عن العمليات السابقة. علاوة على ذلك ، تجدر الإشارة إلى أن منتجات التحلل الأكثر استقرارا التي تشكلت في المراحل الحرارية السابقة قد تبدأ أيضا في التحلل في نطاق درجة الحرارة هذا. بين 400 °C -590 °C ، لا يتم ملاحظة تفاعلات التحلل التي تؤدي إلى تغيرات المحتوى الحراري.
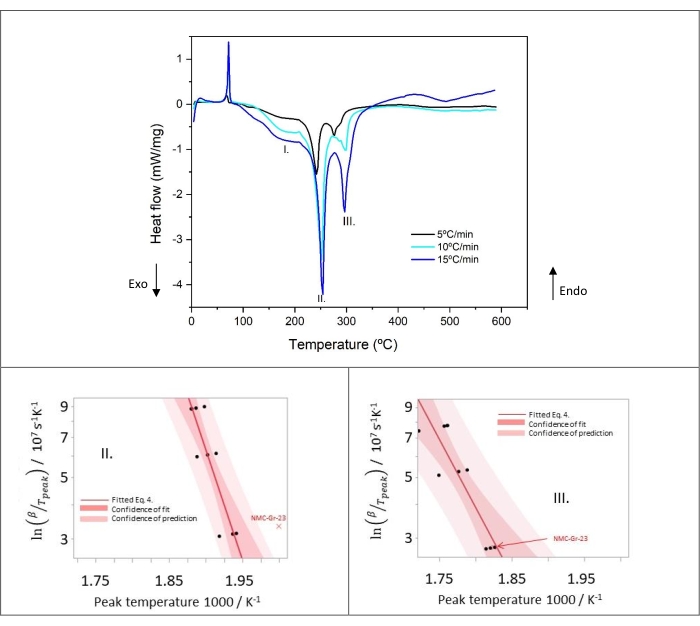
يوضح الشكل 9 ملف التحلل الحراري للجرافيت الصخري عند ثلاثة معدلات تسخين مختلفة (5 و 10 و 15 درجة مئوية / دقيقة). التحليل الحركي المطبق هنا ، أي طريقة كيسنجر القائمة على معادلات أرهينيوس ، يستمد طاقة التنشيط وعامل التردد بناء على ذروة درجة الحرارة القصوى لكل معدل تسخين. تكشف منحنيات DSC أن معدلات التسخين الأعلى تؤدي إلى ارتفاع درجة حرارة الذروة باستثناء الذروة I. تتحول درجة الحرارة القصوى القصوى لهذا الأخير إلى درجة حرارة منخفضة مع زيادة معدل التسخين. تشير هذه الملاحظة إلى أن الذروة الأولى لا تتبع حركية من نوع أرهينيوس ، وبالتالي ، فإن طريقة كيسنجر غير قابلة للتطبيق. تظهر القمم الصغيرة الطاردة للحرارة المتداخلة جزئيا المرئية في الذروة الثالثة تغيرا معتدلا في الشكل مع تصبح الذروة الفرعية أكثر وضوحا وحادة عند معدل تسخين أعلى. ربما يعني هذا تأثير منتجات التفاعل في المنطقة 2 و 3 على الذروة الثالثة (الموجودة في المنطقة 4). ومع ذلك ، من الجدير بالذكر أنه يمكن تطبيق تحليل كيسنجر في هذه الحالة.
يوضح الشكل 9 مخططات كيسنجر التي تم الحصول عليها من تحليل DSC للذروة الثانية والذروة الثالثة. تكررت جميع تجارب كالوريمتر المسح الضوئي التفاضلي (DSC) ثلاث مرات على الأقل لكل معدل تسخين (انظر الجدول 8). فيما يتعلق بالذروة الثانية ، تم تحديد NMC-Gr-23 على أنه قيمة شاذة لأنه خارج ثقة التنبؤ بالبيانات الأخرى ، بافتراض التوزيع الطبيعي. لذلك ، تم تجاهل هذه البيانات من مزيد من الحسابات لتحديد المعلمات الحركية (طاقة التنشيط ، عامل التردد ، إطلاق الحرارة) للذروة الثانية ، ولكن ليس للذروة الثالثة. في الواقع ، في الذروة الثالثة ، يقع NMC-Gr-23 ضمن ثقة التنبؤ ، كما هو موضح في الشكل 9. على الرغم من التحلل الحراري متعدد الخطوات المتداخل جزئيا للذروة الثالثة ، فإن علاقة كيسنجر الخطية لا تزال قابلة للتطبيق في عمليات التفاعل الطاردة للحرارة هذه التي تحدث في المنطقة 4.
يتم سرد المعلمات الحركية المحددة للجرافيت الصخري في الجدول 9. تم استخراج قيم إطلاق الحرارة وطاقة التنشيط وعامل التردد للذروة الأولى من الأدبيات34. ومن هذه البيانات، أجريت محاكاة لملف تعريف DSC للأنود من خلال بناء نموذج حركي تقريبي لوصف تفاعلات التحلل التي تحدث في كيمياء القطب هذا. يتم تحديد وصف مسارات التحلل المحددة التي تم أخذها في الاعتبار للنمذجة في قسم المناقشة.
التحلل الحراري لكاثود NMC (111)
تم فحص السلوك الحراري واستقرار مادة الكاثود باتباع نفس النهج المتبع في الأنود. تم تحديد آليات التفاعل الرئيسية من الجدول 1 والجدول 2 والجدول 3 وتمت مناقشتها في مرحلة لاحقة.
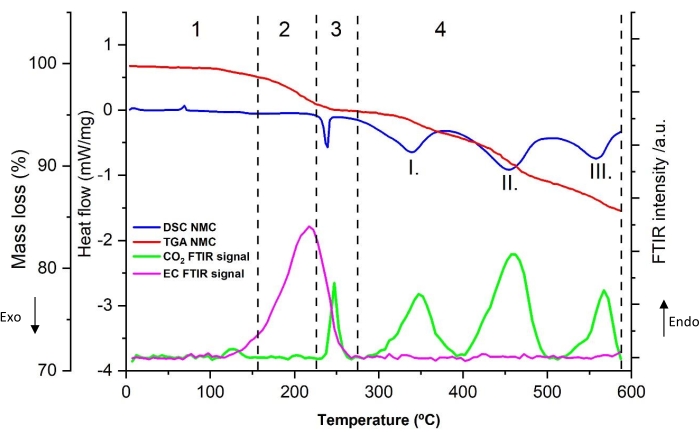
يوضح الشكل 10 ملف تعريف التحلل الحراري التمثيلي للمسحوق المستخرج من الكاثود (العينة رقم 5 من الجدول 8). يتم عرض تدفق الحرارة (ميغاواط / ملغ) ، وفقدان الكتلة (بالوزن٪) ، وشدة FTIR النسبية لثاني أكسيد الكربون2 (2,346 سم −1) و EC (1,863 سم −1) كدالة لدرجة الحرارة (من 5 درجات مئوية إلى 590 درجة مئوية عند معدل تسخين 10 درجة مئوية / دقيقة) في الرسم البياني. عند مقارنة ملامح كالوريمتر المسح الضوئي التفاضلي (DSC) للأنود والكاثود، هناك فرق بين كمية الحرارة المتولدة، مع إطلاق حرارة أكبر للأنود. هذا يشير إلى أن القطب السالب أكثر تفاعلا حراريا. كما يشير إلى أن الأحداث الحرارية للأنود تساهم بطريقة أكثر أهمية في إطلاق الحرارة من الكاثود. تم تحديد أربع مناطق حرارية في الرسم البياني للتحلل الحراري لمادة الكاثود NMC (111) (الموضحة بالأرقام العربية).
في المنطقة 1 ، أقل من 150 درجة مئوية ، تظهر قمة ماصة للحرارة صغيرة حوالي 70 درجة مئوية ، كما لوحظ في الأنود ، على الرغم من أنها أقل كثافة. بالإضافة إلى ذلك ، لوحظ تطور طفيف لثاني أكسيد الكربون2 فوق 100 درجة مئوية ، دون تغيير كبير في سلوك تدفق الحرارة ومطابق تقريبا للتطور المعروض في الشكل 4 أ. قد ينبع حدوث هذه الظاهرة الماصة للحرارة وتطور CO2 في كل من الأقطاب الموجبة والسالبة من تفاعلات تحلل مماثلة. لذلك ، يمكن إهمال هذه الذروة من اعتبارات أخرى في التحليل والحسابات اللاحقة.
عندما تدخل درجة الحرارة نطاق 155 °C -230 °C في المنطقة 2 ، هناك زيادة في منحنى امتصاص EC FTIR في الشكل 10. يكشف مخطط DSC عن قمة ماصة للحرارة صغيرة تبلغ حوالي 200 درجة مئوية تكون أكثر وضوحا عند 15 درجة مئوية / دقيقة في الشكل 11. يتداخل هذا مع تفاعلات التحلل الطاردة للحرارة ، مما يجعل التقييم المنفصل صعبا. لسبب عملي ، لا يمكن تضمين هذه الذروة في حساب التوائم الثلاثية. وتجدر الإشارة إلى أن ملف تعريف التحليل الحراري الوزني (TGA) في منطقة درجة الحرارة هذه يعرض فقدانا سريعا للكتلة يمكن أن يرتبط بتبخر EC.
تتميز المنطقة 3 بذروة طاردة للحرارة حادة مع زيادة مفاجئة في ثاني أكسيد الكربون2 وانخفاض مستمر في EC ، كما هو موضح في شدة إشارة FTIR بين 240 درجة مئوية و 290 درجة مئوية .TGA تشير النتائج إلى فقدان طفيف للكتلة يتعلق بهذه المنطقة.
بين 290 درجة مئوية و 590 درجة مئوية ، تحدث ثلاث عمليات تحلل طاردة للحرارة متتالية تتضمن تطورا متزامنا لثاني أكسيد الكربون2 لكل ذروة طاردة للحرارة. تتسبب هذه العمليات الحرارية في المنطقة 4 في فقدان مستمر للكتلة لا يبدو أنه يتوقف بعد 590 درجة مئوية، كما هو موضح في ملف تعريف فقدان الوزن TGA.
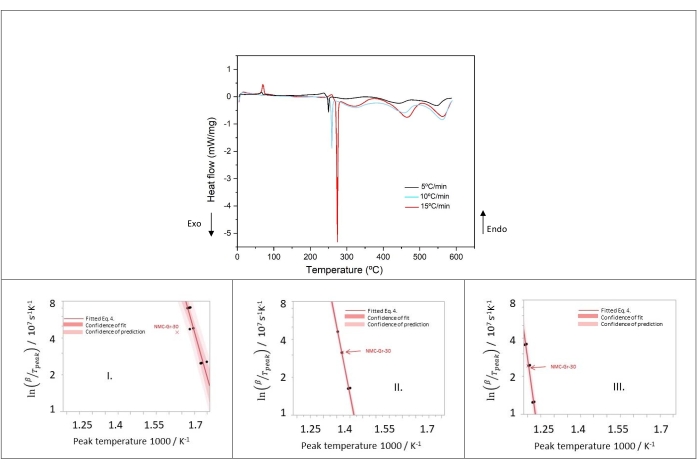
لدراسة المعلمات الحركية للتحلل الحراري للكاثود، أجريت قياسات كالوريمتر المسح الضوئي التفاضلي (DSC) عند 5 و10 و15 درجة مئوية/دقيقة. كما يمكن ملاحظته في الشكل 11 ، تؤدي زيادة معدل التسخين إلى تحول القمم إلى درجات حرارة أعلى. يوضح هذا مدى ملاءمة تحليل الحركة من نوع Arrhenius و Kissinger لوصف هذه التفاعلات الحرارية. يتم حساب التوائم الثلاثية الحرارية لقمم NMC I-III وتظهر مخططات كيسنجر في الشكل 11.
تظهر النتائج من Peak I في الشكل 11 بوضوح أن NMC-Gr-30 يحدث أن يكون قيمة شاذة لأن هذه البيانات تخرج عن ثقة نطاق التنبؤ للبيانات الأخرى. لهذا السبب ، تم تجاهله للتحليل اللاحق. تم الحصول على توافقات خطية جيدة مع جميع البيانات للذروة الثانية والذروة الثالثة في الشكل 11. لم يتم اعتبار NMC-Gr-30 قيمة شاذة في الذروة الثانية والذروة الثالثة لأن NMC-Gr-30 يقع ضمن ثقة التنبؤ في كلتا الحالتين ، كما هو موضح في الشكل 11. من منحدر مؤامرات كيسنجر ، يمكن بسهولة حساب طاقة التنشيط.
يوضح الجدول 10 المعلمات الحركية وأخطائها النسبية للذروة الأولى والذروة الثانية والذروة الثالثة ، بافتراض التوزيع الطبيعي. وفيما يتعلق بالإلكتروليت، ولا سيما EC حيث يتوقع أن يتبخر DMC تماما (بسبب نقطة غليانه المنخفضة البالغة 90 درجة مئوية عند 760 مم زئبق)، فإن المعلمات الحركية للعمليات المتزامنة لتبخر EC واحتراق EC وتحلل EC التي تحدث في المنطقتين 2 و 3 مدرجة في الجدول 11. فيما يتعلق بتبخر EC ، تم تحديد طاقة التنشيط وعامل التردد من مخططات القياس الحراري الوزني المشتق (DTG) بمعدل تسخين مختلف. يصور الرسم البياني DTG فقدان الكتلة عند التسخين مقابل درجة الحرارة وتتحول ذروة DTG إلى درجة حرارة أعلى مع زيادة معدل التسخين (تم قياسه ولكن لم يتم عرضه). علاوة على ذلك ، تظهر هذه الملاحظة أن تبخر EC يحدث بشكل أسرع من تفاعل EC مع NMC. لذلك ، تم استخدام طريقة كيسنجر لحساب المعلمات الحركية لتبخر EC ، مع أخذ حرارة تبخر EC من قاعدة بيانات NIST. أما بالنسبة لاحتراق EC ، فقد تم تقريب البيانات من المرجع69,70. فيما يتعلق بتحلل EC ، تم أخذ المعلمات الحرارية من المرجع71.
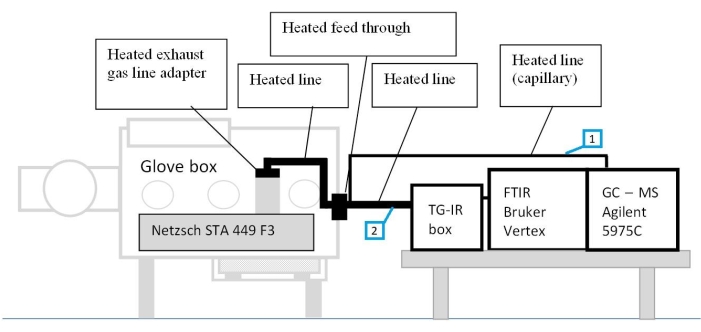
الشكل 1: إعداد نظام القياس المقترن. 1-خط اقتران بين STA و GC-MS ؛ 2-خط اقتران بين نظام STA و FTIR مع صندوق TG-IR. تم استنساخ الشكل بإذن من المرجع48. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 2: تمثيل تخطيطي للخطوات الموضحة في البروتوكول. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
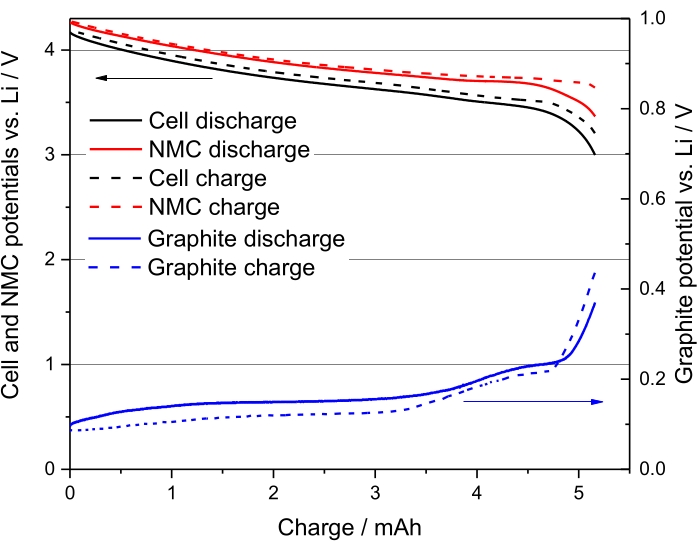
الشكل 3. الدورة الثانية للعينة رقم 5 ، في الجدول 8 ، وهي NMC-Gr-30 في C / 20. مستنسخة بإذن من المرجع48. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
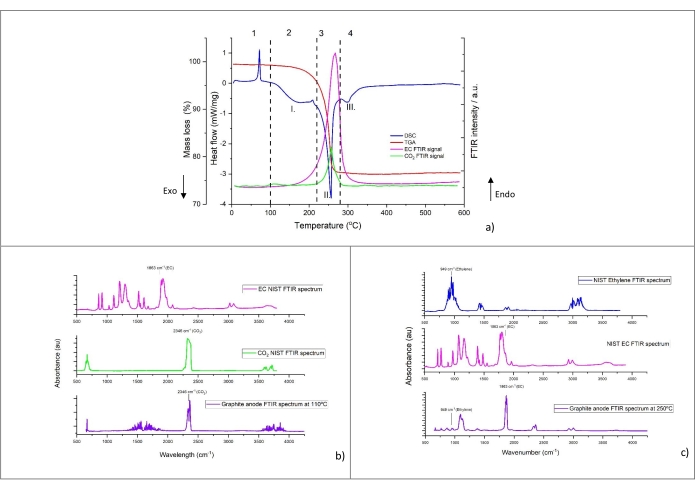
الشكل 4: إشارات التحليل الحراري الوزني (TGA) وكالوريمتر المسح الضوئي التفاضلي (DSC) وFTIR للجرافيت الصخري رقم 5 في الجدول 8، أي NMC-Gr-30. (أ) إشارات التحليل الحراري و FTIR المتزامنة للجرافيت الليثي مع قمم امتصاص FTIR المسجلة عند 1863 سم -1 ل EC و 2346 سم − 1 لثاني أكسيد الكربون2 ، (ب) أطياف FTIR للغازات المتصاعدة من الجرافيت الصخري المسجل عند 110 درجة مئوية ، (ج) تطورت أطياف FTIR للغازات من الجرافيت الصخري المسجل عند درجة حرارة 250 س. كان معدل التسخين لهذه التجربة 10 درجة مئوية / دقيقة. يتم رسم الأطياف المرجعية على أساس البيانات من NIST Chemistry WebBook68. تمثل الأرقام العربية المناطق الحرارية المختلفة ، والتي قد تتكون من عدة قمم. تظهر الأرقام الرومانية القمم الأكثر بروزا ونمذجة. هذا الرقم مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
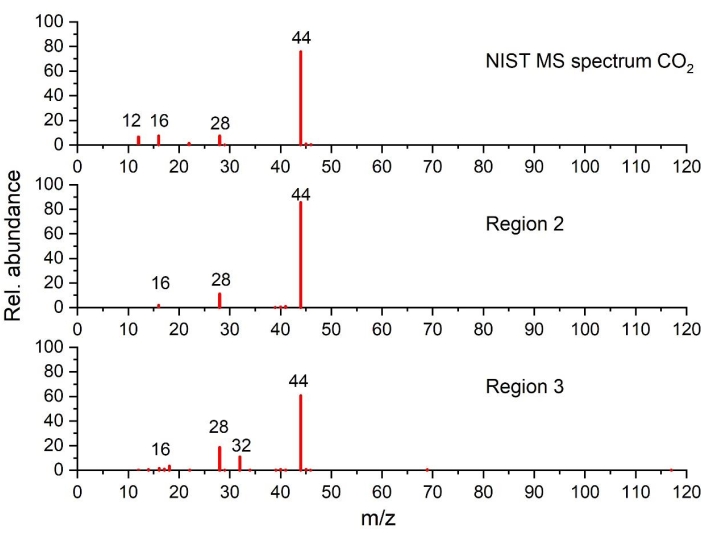
الشكل 5: الأطياف الكتلية لثاني أكسيد الكربون 2 المكتشفة في المنطقتين2 و 3 مقارنة بطيف NIST (مرسومة على أساس البيانات من NIST Chemistry WebBook68). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
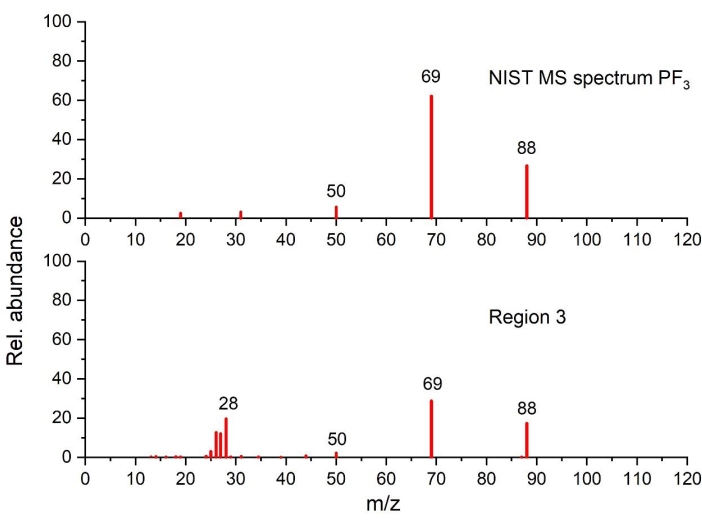
الشكل 6: الطيف الكتلي ل PF 3 المكتشف في منطقة درجة الحرارة3 مقارنة بطيف NIST (مرسوم على أساس البيانات من NIST Chemistry WebBook68). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
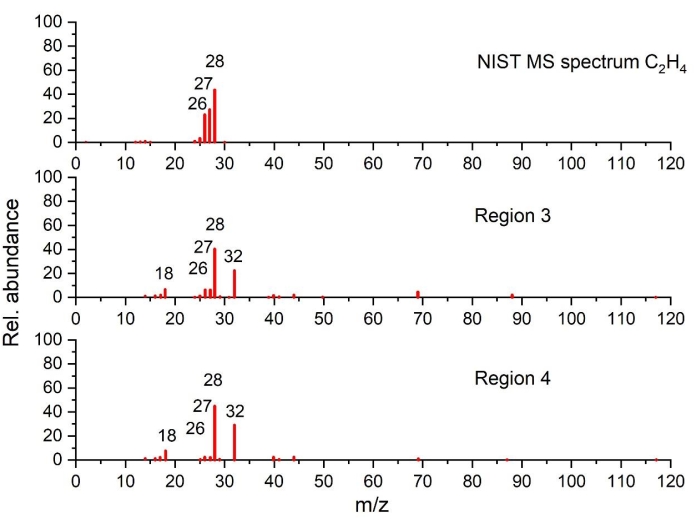
الشكل 7: أطياف كتلة الإيثيلين المكتشفة في منطقتي درجة الحرارة 3 و 4 مقارنة بطيف NIST (مرسومة على أساس البيانات من NIST Chemistry WebBook68). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
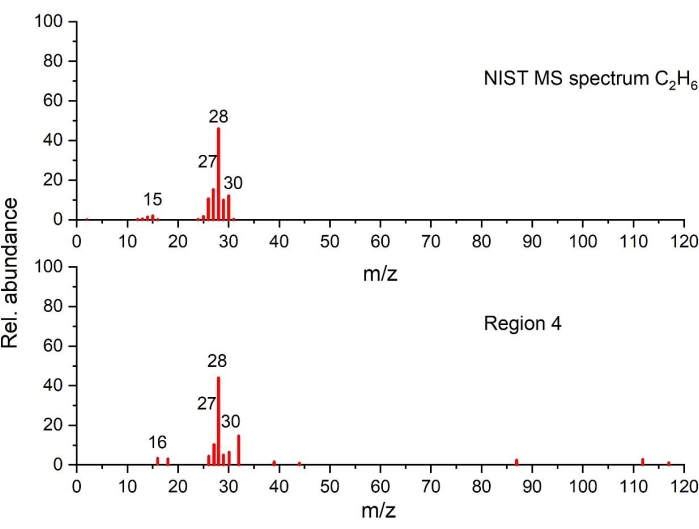
الشكل 8: تم اكتشاف طيف كتلة C2H6 في منطقة درجة الحرارة 4 مقارنة بطيف NIST (تم رسمه على أساس البيانات من NIST Chemistry WebBook68). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 9: التدفق الحراري للجرافيت الصخري بمعدلات تسخين 5 و 10 و 15 درجة مئوية / دقيقة للعينات رقم 2 و 6 و 9 في الجدول 8 ومخططات كيسنجر للقمم الثانية والثالثة. هذا الرقم مستنسخ بإذن منالمرجع48. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 10: إشارات التحليل الحراري الوزني (TGA) وDSC وFTIR للجرافيت الصخري رقم 5 في الجدول 8، أي NMC-Gr-30، مع تسجيل قمم امتصاص FTIR عند 1863 سم-1 ل EC و2346 سم−1 لثاني أكسيد الكربون2. هذا الرقم مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 11: التدفق الحراري للكاثود المخفف عند معدلات تسخين 5 و 10 و 15 درجة مئوية / دقيقة للعينات رقم 1 و 5 و 9 في الجدول 8 ومخططات كيسنجر للقمم الأول والثاني والثالث. هذا الرقم مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 12: ملامح DSC للجرافيت المستخرج من الخلايا . (أسود) المهلة 4 ساعات ، (أزرق) المهلة 2 أيام ، (أخضر) المهلة 4 أيام. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
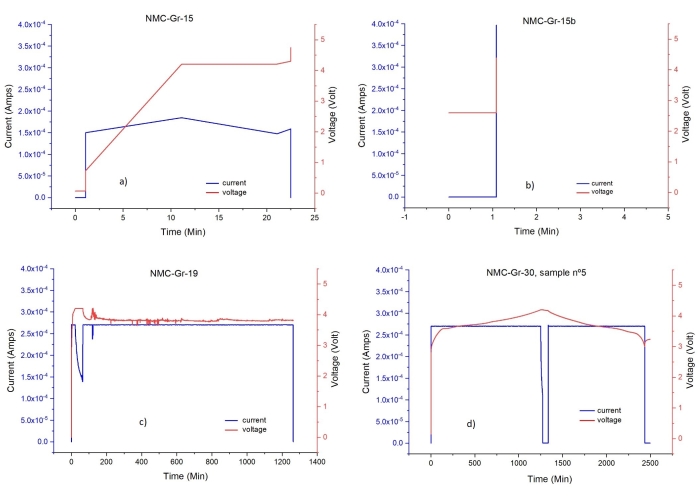
الشكل 13: ملامح وقت الجهد والوقت الحالي لخلايا EL المختلفة . (أ) ، (ب) ، (ج): التوقيع الدوراني للخلايا غير المجمعة / المغلقة / المتصلة بشكل صحيح ، (د) التوقيع الدوراني للخلية المجمعة / المغلقة / المتصلة بشكل صحيح. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
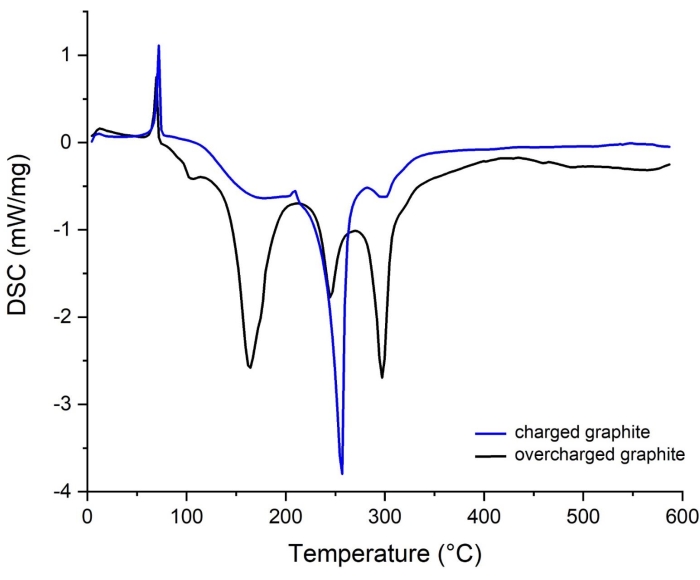
الشكل 14: أطياف كالوريمتر المسح الضوئي التفاضلي (DSC) للجرافيت من خلية متوازنة وغير متوازنة السعة. (أزرق) مشحونة ، (سوداء) مشحونة بشكل زائد. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: تفاعلات تحلل الأنود (عند درجة حرارة مرتفعة) المحددة في الأدبيات. EC: كربونات الإيثيلين ، CMC: كربوكسي ميثيل سلولوز ، R: مجموعة ألكيل منخفضة الوزن الجزيئي ، SEI: واجهة إلكتروليت صلبة ، p-SEI تعني SEI الأولية التي تم تطويرها أثناء الدورة الكهروكيميائية و s-SEI ل SEI الثانوي ، والتي قد تتشكل عند درجة حرارة مرتفعة في بداية TR. كربونات الإيثيلين (EC) وكربونات ثنائي ميثيل (DMC) هي المذيبات المستخدمة في القطب. كربوكسي ميثيل السليلوز (CMC) هو مادة الموثق. هذا الجدول مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 2: تفاعلات التحلل المحددة لكاثود NMC (111) منزوع الليثيات. NMC: الليثيوم والنيكل والمنغنيز والكوبالت ، HF: حمض الهيدروفلوريك. هذا الجدول مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 3: تفاعلات التحلل المحددة ل 1M LiPF6 في EC / DMC = 50/50 (v / v) إلكتروليت. PEO: أكسيد الفلورو البولي إيثيلين. هذا الجدول مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 4: المعلمات المستخدمة في علامة التبويب "إعداد" في نافذة "تعريف القياس" في STA. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 5: برنامج درجة الحرارة لقياسات STA بمعدل تسخين 10 °C / دقيقة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 6: إعدادات قياس التحليل الطيفي TG-FTIR لتحديد الغازات المتصاعدة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 7: إعدادات معلمات GC-MS للقياس النوعي للغازات المنبعثة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 8: مصفوفة اختبار لتجارب STA والخصائص الكهروكيميائية الرئيسية للخلايا التي تم فحصها. تستخدم السعة المحسوبة التحميل الكتلي المقاس للمادة الفعالة لكل قطب كهربائي والقدرة المقدرة على النحو المنصوص عليه من قبل الشركة المصنعة. يتم حساب قدرة التفريغ التجريبية من دورة التفريغ الثانية. n.a. = ملف ركوب الدراجات تالف ؛ لذلك ، لم يكن حساب SOC ممكنا ، ولكن تم إجراء STA. * عينة مخدوشة فقدت أثناء التحضير. تم تصميم تحميل أنود الجرافيت من قبل الشركة المصنعة ليحتوي على مادة نشطة زائدة بنسبة 10٪ مقارنة بالكاثود لتجنب طلاء الليثيوم في تكوين خلية Gr / NMC (111) القطبين. أظهرت قياساتنا زيادة بنسبة 11٪ في المتوسط. هذا الجدول مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 9: ثلاثة توائم حرارية محددة وخطأ معياري (st.err.) لتفاعلات تحلل الجرافيت الصخري. تم استخدام طريقة كيسنجر لحساب المعلمات الحركية (إطلاق الحرارة ، طاقة التنشيط ، وعامل التردد) وعدم اليقين فيها. نظرا لأن طريقة كيسنجر لا تنطبق على Peak I ، فقد تم استخراج البيانات من الأدبيات. هذا الجدول مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 10: ثلاثة توائم حرارية محددة وخطأ معياري لتفاعلات تحلل NMC (111). يظهر الخطأ القياسي بين قوسين. تم استخدام طريقة كيسنجر لحساب المعلمات الحركية (إطلاق الحرارة ، طاقة التنشيط ، وعامل التردد) وعدم اليقين فيها. هذا الجدول مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 11: الثوابت الحركية لتبخر EC والتحلل والاحتراق. يتم قياس تبخر EC في هذا العمل ويتم إعطاء البيانات المحسوبة والخطأ المعياري بين قوسين. تم تقدير الاحتراق من المرجع69,70 وتستند بيانات التحلل إلى قيم الأدبيات 71. هذا الجدول مستنسخ بإذن من المرجع48. الرجاء الضغط هنا لتحميل هذا الجدول.
الملف التكميلي 1: لقطة شاشة للإجراء الكهروكيميائي في دورة Maccor. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: لقطة شاشة للمعلمات من TGA. برنامج XPM. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
في القسم أدناه ، يتم تحديد آليات التفاعل ومناقشتها لكل قطب كهربائي ، بناء على النتائج التي تم جمعها من STA لدراسة السلوك الحراري ، ونظام تحليل الغاز الواصلة (FTIR و GC-MS) لتوصيف الغازات المتصاعدة أثناء التحليل الحراري.
ومع ذلك ، سنناقش أولا الجوانب المهمة لهذه التقنية ، والمزالق واستكشاف الأخطاء وإصلاحها التي نواجهها لضمان التنفيذ الناجح للطريقة من منظور المستخدم.
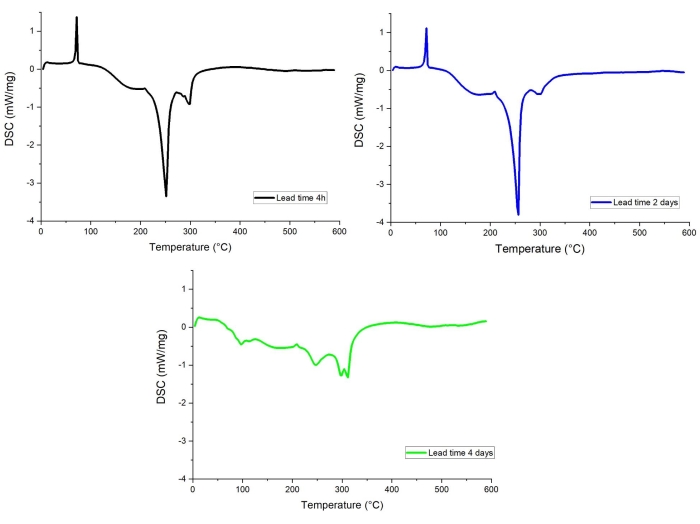
أظهر بحثنا أن المهلة الزمنية ، أي الوقت المنقضي بين فتح الخلية وتحليل STA / الغاز المتصاعد (بما في ذلك جميع المستحضرات) ، لها تأثير واضح على منحنى DSC للمواد. من المحتمل أن يكون هذا مرتبطا بتبخر المنحل بالكهرباء والتفاعلات الجانبية غير المرغوب فيها التي تحدث على سطح الأنود المشحون بالكامل ، وهو شديد التفاعل ، في وجود كميات ضئيلة من الأكسجين و / أو الماء72,73. ويرد مثال على هذا التأثير في الشكل 12، حيث تتم مقارنة منحنيات DSC لقطب الجرافيت مع مهلة 4 ساعات ويومين و4 أيام. يظهر ملف تعريف DSC لأنود مهلة 4 أيام إشارات طاردة للحرارة أصغر بكثير ، في حين أن منحنيات المهل الزمنية الطويلة لمدة 4 ساعات و 2 أيام متشابهة جدا.
يعد تجميع خلية بطارية Li-ion كاملة مصنوعة يدويا مع فاصل رفيع وأقراص قطب كهربائي بأقطار متساوية عملية دقيقة. لذلك ، فإن التجميع والإغلاق المناسبين للخلية لهما أهمية قصوى لنجاح الدورة الكهروكيميائية للخلية ، وبالتالي ، لإعداد الأقطاب الكهربائية لتوصيف STA / GC-MS / FTIR. على سبيل المثال ، يمكن أن يؤدي اختلال أقراص القطب و / أو الفاصل المجعد إلى تغييرات كبيرة في سلوك ركوب الدراجات لخلية Li-ionالكاملة 74. يمكن رؤية ما إذا كانت الخلية مجمعة ومغلقة ومتصلة بالدراجة بشكل صحيح من ملف تعريف الجهد مقابل الوقت. يوضح الشكل 13 عددا من ملفات تعريف الدراجات للخلايا المعيبة ويقارنها بالدورة الأولى للخلية المعدة بشكل صحيح. لذلك ، فإننا نعتبر جميع الخطوات في إعداد الخلية حرجة.
في الملاحظة التالية للخطوة 1.2.1 والفقرة 2 (حساب سعة قرص القطب) في قسم البروتوكول ، تم ذكر أن التوازن المناسب لسعة القرص المساحي للقرص الكهربائي هو مطلب أساسي قبل التجميع الكامل لخلية بطارية Li-ion. لذلك ، فإن هذا الجانب له أهمية حاسمة لتجنب الشحن الزائد للجرافيت وطلاء Li75،76،77. يقارن الشكل 14 منحنيات DSC للجرافيت المشحون بالكامل والشحن الزائد ، مما يدل بوضوح على تأثير كبير للشحن الزائد على السلوك الحراري للمادة. يرتبط الجرافيت الزائد الشحن بتجميع الأقطاب الكهربائية غير المتوازنة حيث تكون السعة المساحية النظرية للكاثود (المقدمة من المورد: 3.54 مللي أمبير / سم 2) أعلى من سعة الأنود (المقدمة من المورد: 2.24 مللي أمبير / سم2). نتيجة لذلك ، يصبح الجرافيت مفرطا ويمكن ترسيب فائض Li + المنقول إلى مصفوفة الجرافيت على السطح كمعدن Li.
قبل إطلاق الحملة التجريبية ، تم إجراء الاختبارات الأولية. تم تحسين هذه التقنية لاستكشاف المشكلات وإصلاحها من أجل تحقيق نتائج موثوقة وقابلة للتكرار. على سبيل المثال ، يعد اختيار المكبس الصحيح لخلية EL-CELL الكهروكيميائية أمرا ضروريا لتجنب ثني الفاصل. يعتمد ارتفاع المكبس المناسب على المواد وسمك مكونات الخلية78. بالنسبة للنظام الموصوف في هذه الدراسة ، توصلنا إلى استنتاج مفاده أن المكبس 50 هو خيار أفضل من المكبس 150. لذلك ، تم استخدام المكبس 50 باستمرار في تجاربنا.
وبالمثل ، يجب ضبط الكمية المثلى من المنحل بالكهرباء بعناية لضمان ترطيب جيد لجميع مكونات الخلية. هذا ضروري لتجنب قيود النقل الأيوني إلى أقصى درجة ممكنة. لا ينتج عن عدم كفاية المنحل بالكهرباء زيادة المقاومة الأومية وفقدان السعة79,80. تم العثور على الكمية المثلى من المنحل بالكهرباء لتكون 150 ميكرولتر للنظام المقدم في هذه الدراسة.
أما بالنسبة لقيود الطريقة المقترحة ، فقد تمت مناقشة بعضها بالفعل في قسم المقدمة من الورقة. بالإضافة إلى ذلك ، فيما يتعلق بمطياف الكتلة ، يتم تحليل منتجات التحلل عادة باستخدام تأين الإلكترون (EI) مع رباعي الأقطاب MS بعد الفصل الكروماتوجرافي بواسطة GC. هذا يجعل من الممكن تحديد كل مركب داخل خليط معقد من المنتجات الغازية المتصاعدة. ومع ذلك ، فإن الإعدادات المختارة ل STA / GC-MS تحد من الكشف عن منتجات التحلل الصغيرة ذات الكتل الأقل من m / z = 150 (يشير m إلى عدد الكتلة الجزيئية أو الذرية و z إلى رقم شحنة الأيون). ومع ذلك ، فإن المعلمات المختارة لنظام STA / GC-MS تعتبر مناسبة من قبل المؤلفين لتحليل الغازات المنبعثة القادمة من مواد القطب.
عيب آخر محتمل هو التكثيف الجزئي لمنتجات درجة الغليان العالية مثل كربونات الإيثيلين في خط النقل (يتم تسخينه عند 150 درجة مئوية). نتيجة لذلك ، فإن التطهير الدقيق للأنظمة بأكملها بعد كل تجربة له أهمية لتجنب التلوث المتبادل للتجارب.
فيما يتعلق ب FTIR ، يتم نقل الغازات المتصاعدة عبر خط ساخن عند 150 درجة مئوية إلى خلية قياس TG-IR ساخنة عند 200 درجة مئوية. يتيح تحليل المجموعات الوظيفية التي تظهر في الغازات المتصاعدة تحديد الأنواع الغازية. من العيوب المحتملة لاقتران STA / FTIR الإشارات المتداخلة من الخليط الغازي (عدة غازات تتطور في نفس الوقت) مما يؤدي إلى أطياف معقدة يصعب تفسيرها. على وجه الخصوص ، على عكس نظام STA / GC-MS ، لا يوجد فصل لمنتجات التحلل قبل تحليل امتصاص الأشعة تحت الحمراء.
يسمح الإعداد الحالي لنظام تحليل الغاز بتحديد المركبات الغازية ، مما يعني أن الطريقة نوعية. في الواقع ، لم يتم تناول القياس الكمي في هذه الدراسة ، مما يترك إمكانية لجمع معلومات كيميائية إضافية. ومع ذلك ، سيتطلب ذلك توصيل الأدوات في سلسلة وليس بالتوازي ، أي STA / GC-MS و STA / FTIR ، لزيادة الحساسية والدقة. وبالإضافة إلى ذلك، فإن وجود نظام لاحتجاز الغازات بعد تحليل STA سيمكن من استخدام GC-MS للقياس الكمي بعد التوصيف النوعي ل FTIR. يمكن للمرء أن ينظر في النظام التالي: STA / الغازات المحبوسة / FTIR / GC-MS متصلة في سلسلة. وثمة اعتبار آخر هو أنه يمكن أيضا استخدام FTIR للقياس الكمي والتحقق المتبادل من البيانات الكمية التي تم الحصول عليها من GC-MS. سيتطلب احتمال القياس الكمي على أي حال مزيدا من البحث لتحديد قابليته للتطبيق في هذه التقنيات الموصولة ، والتي لم تكن نطاق عملنا.
في حين أن العمل الحالي نوعي ، إلا أنه يقدم تحسينا على العمل السابق لأنه ، كما هو مذكور في جزء المقدمة ، توجد معدات STA داخل صندوق قفازات ، مما يضمن التعامل مع المكونات في جو وقائي. مرة أخرى ، على حد علم المؤلفين ، هناك بحث محدود منشور حول السلوك الحراري لمواد القطب ، باستخدام التركيبة الدقيقة لهذه الأدوات التحليلية STA / FTIR / GC-MS ، والمعلمات التحليلية وإعداد / معالجة العينات لتوضيح آليات التفاعل الكيميائي على مستوى المواد أثناء التحلل الحراري. يتم توفير مزيد من التفاصيل حول أهمية هذه الطريقة في قسم المقدمة.
أظهر بحثنا قوة تقنية STA / GC-MS / FTIR الواصلة للتوصيف الحراري لمواد البطارية وتحليل الغازات المتصاعدة. من الواضح أنه يمكن تطبيق هذه التقنية على مجموعة مختلفة من المواد ، على سبيل المثال ، لدراسة المواد الجديدة ، وخصائص المواد في ظل ظروف ركوب الدراجات القاسية ، وما إلى ذلك. هذه التقنية مناسبة في نهاية المطاف لدراسة السلوك الحراري للمواد وطرق تحللها الحراري وتحليل الغازات المتصاعدة. مثال آخر على هذا الاستخدام لتقنية STA / GC-MS / FTIR الموصولة هو التطبيق على توصيف المواد النشطة ، بما في ذلك المتفجرات والوقود الدافع والألعاب النارية81.
التحلل الحراري للجرافيت الدهني
عند درجة حرارة منخفضة ، أقل من 100 درجة مئوية ، تم اكتشاف قمة ماصة للحرارة حوالي 70 درجة مئوية دون فقدان الكتلة ذات الصلة. كما ذكرنا سابقا ، فإن هذه الذروة مرئية أيضا في أنود الجرافيت البكر الملامس للكهارل. لا تتوافق درجة الحرارة القصوى القصوى مع ذوبان EC (حوالي 36 درجة مئوية) ولا تبخر DMC (90 درجة مئوية). تتضمن بعض التفسيرات المحتملة ذوبان LiPF 6-EC أو تطور HF من ملح LiPF6 الناتج عن كميات ضئيلة من الرطوبة82. ومع ذلك ، فإن هذا الحدث الماص للحرارة ليس ذا صلة لغرض هذه الدراسة لأنه لا يرتبط بالجرافيت الصخري. ومن ثم ، فقد تم إهماله من مزيد من التحليل.
تبدأ المنطقة 2 بتطور CO2 صغير حوالي 100 °C -110 °C. تم تأكيد ذلك بشكل أكبر من خلال بيانات GC-MS في الشكل 5 ومع نتائج FTIR المعروضة في الشكل 4 ب والتي تظهر وجود CO 2 و H2 O. واجهة الإلكتروليت الصلبة (SEI) هي طبقة واقية على سطح الأنود تنمو أثناء الشحن الأول للخلية. إنه نتيجة لتحلل المنحل بالكهرباء على الجرافيت الطازج. تعمل هذه الطبقة على تثبيت سطح الأنود التفاعلي عن طريق منع المزيد من تحلل المنحل بالكهرباء والإقحام المشترك للمذيبات في طبقات الجرافيت في دورات الشحن اللاحقة83. من المعروف أن المكونات الأقل استقرارا لطبقة SEI تبدأ في التحلل بشكل طارد للحرارة مع درجة حرارة بداية حوالي 100 °C -130 °C35،41،61،84،85. غالبا ما يتم تحديد هذه الظاهرة على أنها تحلل SEI الأولي (pSEI). وهذا يتفق مع الذروة الطاردة للحرارة الواسعة التي تظهر فوق 100 درجة مئوية. ومن المثير للاهتمام ، أنه لا يوجد تطور للإيثيلين تم اكتشافه بواسطة FTIR أو GC-MS ، على عكس التوقعات من التفاعلات 3 و 4 و 9 في الجدول 1. في الواقع ، من المفترض أن يحدث انهيار SEI والتفاعل اللاحق ل Li مع المنحل بالكهرباء خلال هذه الخطوة الطاردة للحرارة ، وفقا للتفاعلات المذكورة سابقا. علاوة على ذلك ، فإن فقدان الكتلة في نطاق درجة الحرارة هذا هو فقط حوالي 4٪ بالوزن ، وهو منخفض جدا ولا يتطابق مع فقدان الكتلة المتوقع من الآليات المقترحة. ينتج هذا الاختلاف في الكتلة على الأرجح عن بداية تبخر EC الذي يبدأ حوالي 150 درجة مئوية ، كما هو موضح في ذروة امتصاص FTIR المميزة 1,863 سم -1 في الشكل 4 أ والشكل 4 ج.
تشير هذه الملاحظات إلى أن طبقة SEI لا تتحلل في خطوة واحدة ، كما هو محدد في التفاعلات 3 و 4 و 9. لذلك ، لا تعكس هذه التفاعلات بدقة العمليات الحرارية في المنطقة 2. بدلا من ذلك ، قد توفر التفاعلات 1 و 2 و 5 من الجدول 1 تمثيلا أفضل لتفاعلات التحلل كما هو موضح في النطاق التالي 100 °C -220 °C. تجدر الإشارة إلى أن تطور CO 2 بالقرب من 100 درجة مئوية يمكن أن يتولد من التفاعل2 عندما تتبخر آثار الماء. من الممكن أيضا أنه مع ارتفاع درجة الحرارة ، لا يتفكك SEI ولكن يتم تعديل هيكله وتكوينه ، مع احتمال نمو سمك الطبقة. يشير توليد الحرارة المعتدل ، وغياب فقدان الكتلة الكبير ، والغاز المتصاعد إلى أن التفاعل 2 في الجدول 1 ربما يكون قد تسبب في تغيير من بنية SEI العازلة إلى بنية مسامية تسمح بتفاعل EC أو نقل Li-ion مع سطح الجرافيت الصخري. ومع ذلك ، فإن هذا الفيلم الجديد أو المحول ، المسمى SEI الثانوي ، يحافظ على طبيعته الوقائية ، كما يتضح من انخفاض كمية إطلاق الحرارة مقارنة بالمنطقة 3. لقد وجد ، عن طريق XRD ، أن محتوى الليثيوم في الجرافيت انخفض تدريجيا أثناء التكثيف الحراري من 110 درجة مئوية إلى 250 درجة مئوية ، مما يشير إلى استهلاك Li في فترة درجة الحرارةهذه 86. عند النظر في المتفاعلات المشاركة في آلية التفاعل 1 و 5 (الجدول 1) ، يكون التحلل الحراري 5 أكثر وضوحا وقد تم اختياره لوصف العملية في المنطقة 2. يمكن أن تعزى الذروة الماصة للحرارة الصغيرة التالية حوالي 200 درجة مئوية إلى ذوبان LiPF6 ، أو طلاء Li77,87 ، أو تقشير الجرافيت 88. هذا الحدث الانتقالي له تأثير ضئيل على TR وبالتالي تم تجاهله من مزيد من التحليل والنظر في حساب التوائم الثلاثية.
في المنطقة 3 (240 درجة مئوية -290 درجة مئوية) ، تشير زيادة الحرارة المتولدة مع زيادة واضحة في فقدان الكتلة مع تطور الغاز المقابل إلى انتقال طور شديد. استنادا إلى نتائج التحليل الحراري جنبا إلى جنب مع طبيعة الأنواع الغازية ، تولد مسارات تفاعل متعددة متتالية ومتوازية / أو متزامنة ، على الأرجح ، الذروة الثانية. فيما يتعلق بتطور EC (الشكل 4 أ والشكل 4 ج) ، تشير نتائج STA من الجرافيت البكر الملامس للكهارل إلى أن تبخر EC أسرع من التحلل الحراري EC في ظل هذه الظروف (تم قياسه ولكن لم يتم عرضه). تظهر بيانات GC-MS وجود PF3 والإيثيلين في الشكل 6 والشكل 7 ، على التوالي ، بالإضافة إلى تطور CO2 و EC المكتشف بواسطة FTIR (الشكل 4 أ). لذلك ، من المحتمل أن تحدث مسارات التفاعل التالية في نفس الوقت: أ) التحلل الجزئي ل SEI الثانوي ، ب) تفاعلات Li-electrolyte (التفاعلات 3 و 4 و 6 و 7 و 8 و 9 في الجدول 1) ، ج) تحلل EC (التفاعل 20 ، الجدول 3) ، تحلل LiPF6 (التفاعل 17 ، الجدول 3) وتبخر EC (الجدول 3 ). عند مقارنة ملف تعريف طارد الحرارة الذي تم الحصول عليه للمنطقة 2 والمنطقة 3 ، من الواضح جدا أن الأحداث الحرارية التي تحدث في كل منطقة ذات طبيعة مختلفة. هذا يتناقض مع آلية التفاعل الفردي التي أبلغت عنها بعض الدراسات33،35،41 التي تشمل انهيار SEI وتفاعلات الجرافيت والكهارل ، كما هو موضح في التفاعلين 3 و 4. علاوة على ذلك ، تشير المعرفة المكتسبة من نتائجنا إلى أن هذا ليس حدثا حراريا واحدا بل عملية من خطوتين. تصف آليات التحلل المفصلة في التفاعلات 6 و 8 و 9 بشكل أفضل الحدث الحراري في المنطقة 3 ، والذي يؤكده الكشف الغازي عن ثاني أكسيد الكربون2 والإيثيلين و PF3 (منتجات التحلل في LiPF6). لم يتم سرد PF 3 كمنتج أولي لأي تفاعلات في الجدول 1 والجدول 3 ولكن يمكن توليده في عمود GC أو الخطوط الساخنة. لم يتم توليد PF 3 في مكان آخر لأن بداية التحلل الحراري ل LiPF6 (كما هو موضح في التفاعل 17 ، الجدول 3) من المتوقع أن تحدث بين 100 درجة مئوية و 200 درجة مئوية ، اعتمادا على الظروف التجريبية (أي الحاويات المختومة أو المفتوحة ، حجم العينة)89. يخضع أحد منتجات هذا التحلل الحراري (أي PF5) لتحول لاحق يؤدي إلى تكوين POF3 ، كما هو موضح في التفاعل 6.
يرجع فقدان الكتلة في المنطقة 3 بشكل أساسي إلى تبخر EC. بناء على هذه الملاحظات ، يجب نمذجة المنطقتين 2 و 3 بشكل مختلف. لذلك نقترح ونصيغ آلية انهيار مزدوجة حيث لا تتحلل SEI الأولية بالكامل ، ولكنها تغير هيكلها وتكوينها مع التكوين المتزامن لطبقة SEI الثانوية. مع زيادة درجة الحرارة ، يحدث انهيار ثان حيث تتحلل طبقة SEI الثانوية ، مما يسمح باستهلاك الليثيوم المقحم في الأنود.
في المنطقة 4 ، ترتبط القمم الصغيرة والمتداخلة جزئيا بالعديد من تفاعلات التحلل. يعرض تحليل تطور الغاز باستخدام GC-MS آثار الإيثيلين في الشكل 7 مع C2H 6 في الشكل 8 ، CH4 (تم قياسه ، ولكن لم يتم عرضه) ، و C3H6 (تم قياسه ، ولكن لم يتم عرضه) يمكن اكتشافه فقط عند 15 درجة مئوية / دقيقة. أظهر التحليل الحراري المنفصل للموثق البكر (الذي تم قياسه ، ولكن لم يتم عرضه) أن كربوكسي ميثيل السليلوز (CMC) يتحلل على نطاق درجة الحرارة هذا. في المرجع90 ، تم الإبلاغ عن دليل على تفاعل محدد لرابط CMC مع المنحل بالكهرباء. هذا على الأرجح ينبع من مجموعات الهيدروكسيل الوظيفية في CMC (التفاعل 12 ، الجدول 1). تسمح هذه العملية بتكوين الأنواع التي تشكل جزءا من طبقة SEI. قد يتحلل الأخير مع حرارة تفاعل أعلى من الموثق وحده. ومع ذلك ، فإن الموثق يمثل 2٪ فقط من مادة الأنود ، والتي وحدها لا يمكن أن تسبب إطلاق الحرارة المرصود. تفسير آخر هو التحلل اللاحق للمنتجات الأكثر استقرارا التي تشكلت في المناطق السابقة أثناء المنحدر الحراري. علاوة على ذلك ، تم الكشف عن أنه عند 330 درجة مئوية و 430 درجة مئوية ، تحدث تفاعلات طاردة للحرارة بسبب كربونات ألكيل الليثيوم وتحلل أكسالات الليثيوم43. هذه المكونات هي اثنين من الأنواع الرئيسية SEI. نظرا لأن EC قد تبخرت / تحللت تماما هنا ، فإن التفاعلات الوحيدة الممكنة هي تلك الموضحة في 6 و 7 و 11 و 12 من الجدول 1. لكن هذه التفاعلات لا تفسر الغازات المتكونة في المنطقة 4. تجدر الإشارة إلى أن العمليات الطاردة للحرارة المقابلة لنطاق درجة الحرارة هذا تختلف مقارنة بالمنطقتين 2 و 3 ، كما يتضح من الغازات المنتجة ، والحد الأدنى من فقدان الكتلة ، وشكل الذروة ، والحرارة المتصاعدة. ومع ذلك ، فإن منتجات التحلل المتولدة في الأحداث الحرارية السابقة ، وكذلك كمياتها ، قد تؤثر على التفاعلات في المنطقة 4.
التحلل الحراري لكاثود NMC (111)
على غرار أنماط DSC التي تم الحصول عليها في الأنود عند درجة حرارة منخفضة، لوحظت ذروة ماصة للحرارة حوالي 70 درجة مئوية في المنطقة 1 في الشكل 10، على الرغم من أنها أقل وضوحا إلى حد ما في هذه الحالة. تم الكشف عن تطور CO2 أعلى بقليل من 100 درجة مئوية. قد تكون كلتا الظاهرتين بسبب آلية متطابقة ، بناء على الملاحظات في أنماط التحلل الحراري للأنود. لذلك ، تم إهمال هذه الذروة من مزيد من النظر.
كما ذكرنا سابقا ، فإن ماص الحرارة حوالي 200 درجة مئوية (أكثر وضوحا عند 15 درجة مئوية / دقيقة في الشكل 11) في المنطقة 2 يرجع إلى تبخر EC. تتداخل هذه الذروة مع الأحداث الحرارية الطاردة للحرارة ، مما يجعل من الصعب تحليلها باستخدام طريقة كيسنجر. ومع ذلك ، لم يتم تجاهل هذا الحدث الماص للحرارة وبدلا من ذلك ، تم تطبيق نهج مختلف في هذا العمل. في الواقع ، كما ذكرنا سابقا في قسم النتائج التمثيلية للكاثود ، تم استخدام مخططات DTG بمعدل تسخين مختلف بدلا من ذلك ، من أجل حساب المعلمات الحركية باستخدام طريقة كيسنجر ، لتبخر EC.
في المنطقة 3 ، يشير الشكل 10 إلى ذروة طاردة للحرارة مفاجئة مع إطلاق حاد لثاني أكسيد الكربون2 وانخفاض في تطور EC بين 240 درجة مئوية و 290 درجة مئوية. يمكن أن تكون التفاعلات المحتملة لوصف تطور الغاز وفقدان الكتلة وإطلاق الحرارة: أ) التفاعل 15 في الجدول 2 مع HF من LiPF 6 المتحلل مع NMC ، ب) التفاعل 19 و 20 لتفاعل EC مع LiPF6 (PF5) والتحلل الحراري EC ، على التوالي ، ج) احتراق EC مع O2 المنطلق من تحلل NMC91 (التفاعل 16 والتفاعل 13 ، على التوالي) ، د) تحلل NMC التحفيز الذاتي ، على غرار ذلك المبلغ عنه لتحلل LCO33،35،41.
ينتج عن التفاعل 15 ماء لم يكتشفه نظام تحليل الغاز. علاوة على ذلك ، لا يساهم هذا التفاعل في انبعاث CO2. لذلك ، لا يعتبر رد الفعل هذا عملية ذات صلة في المنطقة 3. من الصعب التمييز بين الخيارين ب) وج) ولهذا السبب ، يتم النظر في كليهما لمزيد من الحساب. يتم تحديد التفاعل الحاكم في مرحلة لاحقة ، عند تحسين الاستجابة الحرارية المحاكاة في فترة درجة الحرارة هذه. يتم الحصول على إشارة تدفق حراري محاكاة أفضل عندما يتم تضمين المعلمات الحرارية لاحتراق EC والتبخر في الحساب (غير موضح في هذه الورقة). في دراسة سابقة لكالوريمتر المسح الضوئي التفاضلي، لم يظهر المنحنى الحراري ل NMC(111) طاردا حادا للحرارة عند 250 °C-290 °C92. ومن المثير للاهتمام ، عندما يتم استبعاد احتراق EC من الحساب ، تختفي الذروة الحادة الطاردة للحرارة في المحاكاة وتتوافق مع الدراسة المذكورة أعلاه. قد يكون غياب الذروة الحادة مرتبطا باستخدام البوتقات المثقوبة يدويا المستخدمة في المرجع92 والتي من شأنها أن تسمح بتبخر EC بشكل أسرع وإطلاق O2 بسبب فتحة أكبر في الغطاء. ومن ثم ، فإن الذروة الحادة الطاردة للحرارة مرتبطة باحتراق EC (التفاعل 16 ، الجدول 3) مع O 2 المنطلق الذي نشأ من تحلل NMC (التفاعل 13 ، الجدول 2).
تشير المنطقة 4 إلى ثلاث قمم طاردة للحرارة تحمل علامة I-III. عندما تصل درجة الحرارة إلى 300 درجة مئوية ، يتم إنتاج المزيد من الأكسجين بسبب تحلل NMC المتسارع. ترتبط هذه العملية الحرارية بإطلاق الأكسجين الممتص جسديا91. من المحتمل أن يكون إطلاق ثاني أكسيد الكربونالذي لاحظه FTIR في الشكل 10 نتيجة لإجراء تفاعل مضاف للكربون مع الأكسجين المنطلق من قطب الكاثود المخفف (التفاعل 14 ، الجدول 2). يتباطأ هذا التفاعل فوق 350 درجة مئوية ، حيث يتم استنفاد الأكسجين الممتص جسديا. يتوافق نطاق درجة حرارة التفاعل الطارد للحرارة الثاني بشكل جيد مع تحلل رابط PVDF الذي يحدث بين 400 درجة مئوية -500 درجة مئوية، كما لوحظ من قياس كالوريمتر المسح الضوئي التفاضلي (DSC) لرابط NMC النقي (تم قياسه ولكن لم يتم عرضه). تظهر نتائج التحليل الحراري الوزني (TGA) خسائر في الوزن بين 2.97 و 3.54٪ بالوزن٪ ، والتي تتطابق مع فقدان الوزن المتوقع المرتبط بتحلل PVDF. ترتبط العملية الطاردة للحرارة التالية الكامنة وراء الذروة الثالثة بإطلاق الأكسجين المرتبط كيميائيا في الكاثود91. يتفاعل هذا الأكسجين بشكل أكبر مع توصيل مادة مضافة للكربون لتكوين ثاني أكسيد الكربون2 (التفاعل 14 ، الجدول 2).
نظرة عامة
يسلط هذا العمل الضوء على مزيج خاص من الميزات التجريبية ومعالجة العينات من أجل جمع معلومات حول العمليات الحرارية في أقطاب LIBs. نظرا لأن المعدات موجودة داخل صندوق قفازات مملوء بالأرجون ، فقد تم تنفيذ المناولة المستخدمة من تجميع الخلايا الكهروكيميائية لإعداد العينات وتحميلها في أداة STA دون تلوث غير مقصود للعينات. نتيجة لذلك ، يمكن الوصول إلى دقة محسنة في تحديد المعلمات الحرارية. تم الاحتفاظ بالقطب الكهربائي غير مغسول ، لفهم الظواهر الحرارية على مستوى المواد بشكل أفضل مما يؤدي إلى توليد الحرارة ، وبالتالي ، من المحتمل أن يساهم في TR. يضمن اختيار بوتقة بغطاء مثقوب بالليزر ، يحتوي على ثقب صغير بقطر 5 ميكرومتر فقط ، نظاما شبه مفتوح ، مع نتائج مماثلة لتلك التي تم الحصول عليها في بوتقة محكمة الغلق ، ولكن مع ميزة تمكين جمع الغاز.
علاوة على ذلك ، قد يعكس الحجم الصغير للثقب ظواهر الخلية بشكل أفضل من خلال تفاعلاتها المستحثة حراريا ، والتي تتضمن مكونات غازية لا يتم إطلاقها على الفور ، ولكنها تؤدي إلى تراكم الضغط الداخلي داخل خلية البطارية. هذه الظاهرة ، إلى جانب الزيادة التي لا يمكن السيطرة عليها في درجة حرارة الخلية ، قد تؤدي إلى TR والتنفيس. ميزة خاصة أخرى هي نطاق درجة الحرارة الواسع ، من 5 درجات مئوية و 600 درجة مئوية ، المستخدمة في التوصيف الحراري لمواد القطب بواسطة تقنية STA / FTIR / GC-MS المقترنة.
من هذه الميزات والمعلمات التجريبية الخاصة المذكورة أعلاه ، تم تحديد العمليات الحرارية الأكثر صلة ويمكن تحديد ثلاثة توائم حرارية حركية واستخدامها لمحاكاة إشارة تدفق الحرارة لكل قطب.
للتلخيص ، تم اقتراح آلية انهيار مزدوجة لتعكس تفاعلات التحلل التي تحدث في الأنود. أظهرت البيانات التي تم الحصول عليها من STA و FTIR و GC-MS أن طبقة SEI الأولية لا تتحلل بالكامل في خطوة واحدة. في الواقع ، هناك تراكم متزامن لطبقة SEI الثانوية. يتم نمذجة هذه التفاعلات مع تحلل نوع الانتشار وحركية التكوين. في مرحلة لاحقة عند التسخين ، يحدث انهيار ثان مع تحلل SEI الثانوي واستهلاك Li المخزن في الجرافيت ، وتبخر EC ، وتحلل EC الذي يحدث في نفس الوقت. تتضمن العملية الثالثة الطاردة للحرارة تحلل المنتجات المستقرة التي تشكلت في المناطق السابقة والموثق.
تتكون العمليات الحرارية المحددة لتحلل الكاثود NMC (111) من: تبخر EC ، وتحلل NMC مع تحرير الأكسجين ، واحتراق EC مع الأكسجين المحرر ، وتحلل المادة الرابطة ، واحتراق مادة الكربون المضافة. يتفاعل O2 المتطور على الفور مع إضافات الكربون. علاوة على ذلك ، لا يحدث تحلل EC لأن تبخر EC أسرع.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يشكر المؤلفون برشاقة مارك ستين وناتاليا ليبيديفا على الدعم الممتاز لمراجعة هذه المخطوطة ومناقشتها.
Materials
| Name | Company | Catalog Number | Comments |
| Glove box MB 200B | MBraun | Glove box filled with argon to ensure inert atmosphere. H2O < 0.1 ppm; O2 < 0.1 ppm | |
| STA 449 F3 Jupiter® | Netzsch | Simultaneous Thermal Analysis for thermal characterization. The STA equipment is located inside the glove box. Type of furnace used: silver | |
| Agilent 7820A GC- Agilent 5977E MS | Agilent | Gas Chromatograph equipped with an quadrupole Mass Spectrometer. GC-MS is coupled to STA via heated lines in order to identify the released gases during thermal characterization | |
| Bruker Vertex 70 V FTIR | Bruker | Fourier Transform Infrared spectrometer equipped with a TG-IR box. FTIR is coupled to STA via heated lines in order to identify the released gases during thermal characterization | |
| 18mm graphite electrode disc | Customcell | 363586011 | graphite electrode disc with an area capacity of 2.24 mAh.cm-2 |
| 18mm NMC (111) electrode disc | Customcell | 363662011 | LiNiMnCoO2 electrode disc with stochiometry ratio 111 and an area capacity of 2.0 mAh.cm-2 |
| 1.0 M LiPF6 in EC/DMC=50/50 (v/v) | Sigma-Aldrich | 746711-100ML | Electrolyte |
| 2325 trilayer film separator | Celgard® | Film separator. 22 mm diameter discs should be cut from the film | |
| High precision cutting pliers | EL Cell | 1) Used in paragraph 2 for cutting with a fixed 18 mm diameter the bare copper and aluminum foils (non-coated). These current collectors were bought from the same supplier as for the elecrode discs 2) Used for cutting 22 mm diameter Cegard separator discs | |
| ECC-PAT-Core (2014 version) kit using: a) reusable stainless steel (SS) upper plunger, b) reusable SS lower plunger of type 50 (size in µm), c) single-use PP insulation sleeves | EL Cell | Electrochemical cell assembly | |
| Maccor Series 4000 | Maccor | Battery cycler. It was used to cycle 2 times the electrochemical cell and to adjust afterwards the SOC to 100% | |
| aluminum crucibles with 5 µm laser-pierced lid | Netzsch | 6.239.2-64.81.00 | Crucible used for the thermal analysis and identification of released gases from cycled electrode material (graphite anode or NMC (111) cathode) |
| Precision balance AE240 type AE240-S inside Glove box | Mettler Toledo | Battery materials are measured at µg precision | |
| Analogue digital multimeter ABB model MetraWatt M2005 | Gossen MetraWatt | Used to measure of the freshly assembled electrochemical cell in paragraph 1.2.6 |
References
- van Ruijven, B. J., De Cian, E., Sue Wing, I. Amplification of future energy demand growth due to climate change. Nature Communications. 10, 2762 (2019).
- De Cian, E., Sue Wing, I. Global energy consumption in a warming climate. Environmental and Resource Economics. 72, 365-410 (2019).
- Sivaram, V., Dabiri, J. O., Hart, D. M. The need for continued innovation in solar, wind, and energy storage. Joule. 2, 1639-1642 (2018).
- Rosewater, D., Williams, A. Analyzing system safety in lithium-ion grid energy storage. Journal of Power Sources. 300, 460-471 (2015).
- . Fundamental Aspects of Large-Scale Energy Storage SystemSafety Available from: https://www.osti.gov/servlets/purl/1365118 (2016)
- Zhong, G., et al. Thermal runaway and fire behavior investigation of lithium ion batteries using modified cone calorimeter. Journal of Thermal Analysis and Calorimetry. 135, 2879-2889 (2016).
- Chen, M., Yuen, R., Wang, J. An experimental study about the effect of arrangement on the fire behaviors of lithium-ion batteries. Journal of Thermal Analysis and Calorimetry. 129, 181-188 (2017).
- Bubbico, R., Greco, V., Menale, C. Hazardous scenarios identification for Li-ion secondary batteries. Safety Science. 108, 72-88 (2018).
- Ouyang, D. A review on the thermal hazards of the lithium-ion battery and the corresponding countermeasures. Applied Sciences. 9. 9, 2483 (2019).
- Christman, J. The case of the burning laptops. Journal of Case Studies. 30, 88-97 (2012).
- Boeing 787 Battery Fire. Accident No: DCA13IA037. US National Transportation Safety Board Available from: https://www.ntsb.gob/investigations/pages/boeing_787.aspx (2013)
- Aircraft serious incident investigation report, all Nippon Airways Co. Ltd. JA804A. Japan Transport Safety Board Available from: https://www.mlit.go.jp/jtsb/eng-air_report/JA804A.pdf (2014)
- Loveridge, M. J., et al. Looking deeper into the galaxy (Note 7). Batteries. 4, (2018).
- Ruiz, V., et al. A review of international abuse testing standards and regulations for lithium ion batteries in electric and hybrid electric vehicles. Renewable and Sustainable Energy Reviews. 81, 1427-1452 (2018).
- United Nations, E. And S. C. United Nations Global technical Regulation on Electrical vehicle Safety (UN GTR-EVS) on electric vehicle safety: Phase 1. International Organization. ECE/TRANS. United Nations. , (2017).
- ISO 6469-1:2019 Electrically propelled road vehicles - Safety specifications - Part 1: rechargeable energy storage system (RESS). International Organization for Standardization Available from: https://www.iso.org/standard/68665.html (2019)
- UL Standard for Safety for Lithium Batteries, UL 1642:2007. Underwriters Laboratories Inc Available from: https://standardscatalog.ul.com/ProductDetal.aspx?productid=UL1642 (2007)
- Walker, W. Q., Ali, O. A., Theriot, D. H. Future Lithium-ion Batteries. The Royal Society of Chemistry. , 290-315 (2019).
- Ziebert, C., Melcher, A., Lei, B., Zhao, W. R., M, H. J. S., Rodriguez-Martinez, L. M., Omar, N. Chapter Six - Electrochemical-Thermal Characterization and Thermal Modeling for Batteries. Emerging Nanotechnologies in Rechargeable Energy Storage Systems. , (2017).
- Ruiz Ruiz, V., Pfrang, A. . JRC Exploratory Research: Safer Li-ion Batteries by Preventing Thermal Propagation. , (2018).
- Lopez, C. F., Jeevarajan, J. A., Mukherjee, P. P. Experimental analysis of thermal runaway and propagation in lithium-ion battery modules. Journal of The Electrochemical Society. 162, 1905-1915 (2015).
- Xiang, H. F., et al. Thermal stability of LiPF6-based electrolyte and effect of contact with various delithiated cathodes of Li-ion batteries. Journal of Power Sources. 191, 575-581 (2009).
- Juarez-Robles, D., Vyas, A. A., Fear, C., Jeevarajan, J. A., Mukherjee, P. P. Overdischarge and aging analytics of li-ion cells. Journal of The Electrochemical Society. 167, 90558 (2020).
- Juarez-Robles, D., Vyas, A. A., Fear, C., Jeevarajan, J. A., Mukherjee, P. P. Overcharge and aging analytics of li-ion cells. Journal of The Electrochemical Society. 167, 90547 (2020).
- Ruiz, V., Brett, L., Steen, M., Van Den Berghe, L. . Putting Science into Standards - Driving Towards Decarbonisation of Transport: Safety, Performance, Second Life and Recycling of Automotive Batteries for e-Vehicles. , (2016).
- Xiong, R., Ma, S., Li, H., Sun, F., Li, J. Toward a safer battery management system: A critical review on diagnosis and prognosis of battery short circuit. iScience. 23, 101010 (2020).
- Börger, A., Mertens, J., Wenzl, H. Thermal runaway and thermal runaway propagation in batteries: What do we talk about. Journal of Energy Storage. 24, 100649 (2019).
- . JUnited Nations Global technical Regulation for Electrical vehicle Safety (UN GTR-EVS): Authorization to develop Phase 2 Available from: https://unece-modl.dotsoft.gr/DAM/trans/doc/2017/wp29other/ECE-TRANS-WP29-AC3-49e.pdf (2018)
- Zhao, W., Luo, G., Wang, C. -. Y. Modeling nail penetration process in large-format li-ion cells. Journal of The Electrochemical Society. 162, 207-217 (2015).
- Ren, D., et al. An electrochemical-thermal coupled overcharge-to-thermal-runaway model for lithium ion battery. Journal of Power Sources. 364, 328-340 (2017).
- Lopez, C. F., Jeevarajan, J. A., Mukherjee, P. P. Characterization of lithium-ion battery thermal abuse behavior using experimental and computational analysis. Journal of The Electrochemical Society. 162, 2163-2173 (2015).
- Parmananda, M., Ryali, B., Mukherjee, P. P. Thermo-electrochemical stability analytics of electrode materials. The Journal of Physical Chemistry C. 123, 30106-30120 (2019).
- Richard, M. N., Dahn, J. R. Accelerating rate calorimetry study on the thermal stability of lithium intercalated graphite in electrolyte. II. Modeling the results and predicting differential scanning calorimeter curves. Journal of the Electrochemical Society. 146, 2078-2084 (1999).
- Richard, M. N., Dahn, J. R. Accelerating rate calorimetry study on the thermal stability of lithium intercalated graphite in electrolyte. I. Experimental. Journal of the Electrochemical Society. 146, 2068-2077 (1999).
- Hatchard, T. D., MacNeil, D. D., Basu, A., Dahn, J. R. Thermal model of cylindrical and prismatic lithium-ion cells. Journal of The Electrochemical Society. 148, 755 (2001).
- Kim, G. -. H., Pesaran, A., Spotnitz, R. A three-dimensional thermal abuse model for lithium-ion cells. Journal of Power Sources. 170, 476-489 (2007).
- Coman, P. T., Rayman, S., White, R. E. A lumped model of venting during thermal runaway in a cylindrical Lithium Cobalt Oxide lithium-ion cell. Journal of Power Sources. 307, 56-62 (2016).
- Duemichen, E., Braun, U., Senz, R., Fabian, G., Sturm, H. Assessment of a new method for the analysis of decomposition gases of polymers by a combining thermogravimetric solid-phase extraction and thermal desorption gas chromatography mass spectrometry. Journal of Chromatography A. 1354, 117-128 (2014).
- Yang, H., Shen, X. -. D. Dynamic TGA-FTIR studies on the thermal stability of lithium/graphite with electrolyte in lithium-ion cell. Journal of Power Sources. 167, 515-519 (2007).
- Golubkov, A. W., et al. Thermal-runaway experiments on consumer Li-ion batteries with metal-oxide and olivin-type cathodes. RSC Advances. 4, 3633-3642 (2014).
- Spotnitz, R., Franklin, J. Abuse behavior of high-power, lithium-ion cells. Journal of Power Sources. 113, 81-100 (2003).
- Wang, Q., Sun, J., Yao, X., Chen, C. Thermal behavior of lithiated graphite with electrolyte in lithium-ion batteries. Journal of the Electrochemical Society. 153, 329-333 (2006).
- Zhao, L., Watanabe, I., Doi, T., Okada, S., Yamaki, J. TG-MS analysis of solid electrolyte interphase (SEI) on graphite negative-electrode in lithium-ion batteries. Journal of Power Sources. 161, 1275-1280 (2006).
- Choi, N. -. S., Profatilova, I. A., Kim, S. -. S., Song, E. -. H. Thermal reactions of lithiated graphite anode in LiPF6-based electrolyte. Thermochimica Acta. 480, 10-14 (2008).
- Wang, Q., Sun, J., Yao, X., Chen, C. Thermal stability of LiPF6/EC+DEC electrolyte with charged electrodes for lithium ion batteries. Thermochimica Acta. 437, 12-16 (2005).
- Parimalam, B. S., MacIntosh, A. D., Kadam, R., Lucht, B. L. Decomposition Reactions of Anode Solid Electrolyte Interphase (SEI) Components with LiPF6. The Journal of Physical Chemistry C. 121, 22733-22738 (2017).
- Jakab, E., Mészáros, E., Borsa, J. Effect of slight chemical modification on the pyrolysis behavior of cellulose fibers. Journal of Analytical and Applied Pyrolysis. 87, 117-123 (2010).
- Kriston, A., Adanouj, I., Ruiz, V., Pfrang, A. Quantification and simulation of thermal decomposition reactions of Li-ion battery materials by simultaneous thermal analysis coupled with gas analysis. Journal of Power Sources. 435, 226774 (2019).
- Jung, R., Metzger, M., Maglia, F., Stinner, C., Gasteiger, H. A. Oxygen release and its effect on the cycling stability of LiNixMnyCozO2 (NMC) cathode materials for li-ion batteries. Journal of the Electrochemical Society. 164, 1361-1377 (2017).
- Buchberger, I., et al. Aging analysis of Graphite/LiNi1/3Mn1/3Co1/3O2Cells using XRD, PGAA, and AC impedance. Journal of The Electrochemical Society. 162, 2737-2746 (2015).
- Wang, Q. S., Sun, J. H., Chu, G. Q., Yao, X. L., Chen, C. H. Effect of LiPF6 on the thermal behaviors of four organic solvents for lithium ion batteries. Journal of Thermal Analysis and Calorimetry. 89, 245-250 (2007).
- Yang, H., Zhuang, G. V., Ross, P. N. Thermal stability of LiPF6 salt and Li-ion battery electrolytes containing LiPF6. Journal of Power Sources. 161, 573-579 (2006).
- Campion, C. L., Li, W., Lucht, B. L. Thermal decomposition of LiPF 6-based electrolytes for lithium-ion batteries. Journal of the Electrochemical Society. 152, 2327-2334 (2005).
- Zheng, S., Wang, L., Feng, X., He, X. Probing the heat sources during thermal runaway process by thermal analysis of different battery chemistries. Journal of Power Sources. 378, 527-536 (2018).
- Ren, D., et al. Model-based thermal runaway prediction of lithium-ion batteries from kinetics analysis of cell components. Applied Energy. 228, 633-644 (2018).
- Chen, Z., et al. Electrochemical degradation mechanism and thermal behaviors of the stored LiNi0.5Co0.2Mn0.3O2 cathode materials. ACS Applied Materials & Interfaces. 10, 25454-25464 (2018).
- Yu, H. -. Y., Zhang, D., Zhu, Z., Lu, Q. Thermal reactivity study of spinel lithium titanium oxide material for lithium ion battery by thermal and spectral analysis. Journal of Power Sources. 257, 96-101 (2014).
- Zhuang, G. V., Ross, P. N. Analysis of the chemical composition of the passive film on li-ion battery anodes using attentuated total reflection infrared spectroscopy. Electrochemical and Solid-State Letters. 6, 136 (2003).
- Shurtz, R. C., Engerer, J. D., Hewson, J. C. Predicting high-temperature decomposition of lithiated graphite: Part II. Passivation layer evolution and the role of surface area. Journal of The Electrochemical Society. 165, 3891-3902 (2018).
- Mao, B., Huang, P., Chen, H., Wang, Q., Sun, J. Self-heating reaction and thermal runaway criticality of the lithium ion battery. International Journal of Heat and Mass Transfer. 149, 119178 (2020).
- Watanabe, I., Yamaki, J. Thermalgravimetry-mass spectrometry studies on the thermal stability of graphite anodes with electrolyte in lithium-ion battery. Journal of Power Sources. 153, 402-404 (2006).
- Fernandes, Y., Bry, A., de Persis, S. Identification and quantification of gases emitted during abuse tests by overcharge of a commercial Li-ion battery. Journal of Power Sources. 389, 106-119 (2018).
- Feng, X., et al. Investigating the thermal runaway mechanisms of lithium-ion batteries based on thermal analysis database. Applied Energy. 246, 53-64 (2019).
- Kissinger, H. E. Variation of peak temperature with heating rate in differential thermal analysis. Journal of Research of the National Bureau of Standards. 57, 2712 (1956).
- Kissinger, H. E. Reaction kinetics in differential thermal analysis. Analytical Chemistry. 29, 1702-1706 (1957).
- Kriston, A., Podias, A., Adanouj, I., Pfrang, A. Analysis of the effect of thermal runaway initiation conditions on the severity of thermal runaway-Numerical simulation and machine learning study. Journal of The Electrochemical Society. 167, 90555 (2020).
- Ruiz Ruiz, V., et al. The effect of charging and discharging lithium iron phosphate-graphite cells at different temperatures on degradation. Journal of Visualized Editors: JoVE. , e57501 (2018).
- National Institute of Standards and Technology. NIST Chemistry Workbook. National Institute of Standards and Technology. , (2018).
- Sun, Y. -. Y., Hsieh, T. -. Y., Duh, Y. -. S., Kao, C. -. S. Thermal behaviors of electrolytes in lithium-ion batteries determined by differential scanning calorimeter. Journal of Thermal Analysis and Calorimetry. 116, 1175-1179 (2014).
- Larsson, F., Anderson, J., Andersson, P., Mellander, B. E. Thermal modelling of cell-to-cell fire propagation and cascading thermal runaway failure effects for lithium-ion battery cells and modules using fire walls. Journal of the Electrochemical Society. 163, 2854-2865 (2016).
- Peng, P., Jiang, F. Thermal behavior analyses of stacked prismatic LiCoO2 lithium-ion batteries during oven tests. International Journal of Heat and Mass Transfer. 88, 411-423 (2015).
- An, S. J., et al. The state of understanding of the lithium-ion-battery graphite solid electrolyte interphase (SEI) and its relationship to formation cycling. Carbon. 105, 52-76 (2016).
- Malmgren, S., et al. Consequences of air exposure on the lithiated graphite SEI. Electrochimica Acta. 105, 83-91 (2013).
- Murray, V., Hall, D. S., Dahn, J. R. A guide to full coin cell making for academic researchers. Journal of The Electrochemical Society. 166, 329-333 (2019).
- Kasnatscheew, J., et al. A tutorial into practical capacity and mass balancing of lithium ion batteries. Journal of The Electrochemical Society. 164, 2479-2486 (2017).
- Mei, W., Jiang, L., Liang, C., Sun, J., Wang, Q. Understanding of Li-plating on graphite electrode: detection, quantification and mechanism revelation. Energy Storage Materials. 41, 209-221 (2021).
- Waldmann, T., Hogg, B. -. I., Wohlfahrt-Mehrens, M. Li plating as unwanted side reaction in commercial Li-ion cells - A review. Journal of Power Sources. 384, 107-124 (2018).
- PAT-Core: Lower Plunder Configurator. EL-Cell GmbH Available from: https://el-cell.com/pat-series/the-pat-core-concept/lower-plunger-configurator/ (2021)
- Günter, F. J., Burgstaller, C., Konwitschny, F., Reinhart, G. Influence of the electrolyte quantity on lithium-ion cells. Journal of The Electrochemical Society. 166, 1709-1714 (2019).
- An, S. J., et al. Correlation of electrolyte volume and electrochemical performance in lithium-ion pouch cells with graphite anodes and NMC532 cathodes. Journal of The Electrochemical Society. 164, 1195-1202 (2017).
- Benhammada, A., Trache, D. Thermal decomposition of energetic materials using TG-FTIR and TG-MS: a state-of-the-art review. Applied Spectroscopy Reviews. 55, 724-777 (2020).
- Ryou, M. -. H., et al. Effects of lithium salts on thermal stabilities of lithium alkyl carbonates in SEI layer. Electrochimica Acta. 83, 259-263 (2012).
- Mao, C., et al. Balancing formation time and electrochemical performance of high energy lithium-ion batteries. Journal of Power Sources. 402, 107-115 (2018).
- Bandhauer, T. M., Garimella, S., Fuller, T. F. A critical review of thermal issues in lithium-ion batteries. Journal of the Electrochemical Society. 158, 1-25 (2011).
- Andersson, A. M., Herstedt, M., Bishop, A. G., Edström, K. The influence of lithium salt on the interfacial reactions controlling the thermal stability of graphite anodes. Electrochimica Acta. 47, 1885-1898 (2002).
- Chen, Z., et al. Multi-scale study of thermal stability of lithiated graphite. Energy & Environmental Science. 4, 4023-4030 (2011).
- Waldmann, T., et al. Electrochemical, post-mortem, and ARC analysis of li-ion cell safety in second-life applications. Journal of the Electrochemical Society. 164, 3154-3162 (2017).
- Haik, O., et al. On the thermal behavior of lithium intercalated graphites. Journal of the Electrochemical Society. 158, 913-923 (2011).
- Solchenbach, S., Metzger, M., Egawa, M., Beyer, H., Gasteiger, H. A. Quantification of PF 5 and POF 3 from side reactions of LiPF 6 in li-ion batteries. Journal of The Electrochemical Society. 165, 3022-3028 (2018).
- El Ouatani, L., et al. Surface film formation on a carbonaceous electrode: Influence of the binder chemistry. Journal of Power Sources. 189, 72-80 (2009).
- Li, J., Zhang, Z. R., Guo, X. J., Yang, Y. The studies on structural and thermal properties of delithiated LixNi1/3Co1/3Mn1/3O2 (0 Solid State Ionics. 177, 1509-1516 (2006).
- Fleischhammer, M., Waldmann, T., Bisle, G., Hogg, B. -. I., Wohlfahrt-Mehrens, M. Interaction of cyclic ageing at high-rate and low temperatures and safety in lithium-ion batteries. Journal of Power Sources. 274, 432-439 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved