Method Article
identificazione e quantificazione dei meccanismi di decomposizione nelle batterie agli ioni di litio; Input per la simulazione del flusso di calore per la modellazione del runaway termico
In questo articolo
Riepilogo
Questo lavoro mira a determinare la cinetica di reazione dei materiali catodici e anodici delle batterie agli ioni di litio sottoposti a runaway termico (TR). Lo spettrometro FTIR (Simultaneous Thermal Analysis)/FTIR (Fourier Transform Infrared) / Gas Chromatography Mass Spectrometry (GC-MS) è stato utilizzato per rivelare eventi termici e rilevare gas evoluti.
Abstract
I rischi e i possibili incidenti legati al normale utilizzo delle batterie agli ioni di litio rimangono una seria preoccupazione. Al fine di ottenere una migliore comprensione del runaway termico (TR), sono state studiate le reazioni di decomposizione esotermica nell'anodo e nel catodo, utilizzando un sistema di spettrometro spettrometrico Simultaneous Thermal Analysis (STA)/Gas Chromatography-Mass Spectrometry (GC-MS)/Fourier Transform Infrared (FTIR). Queste tecniche hanno permesso di identificare i meccanismi di reazione in ciascun elettrodo, grazie all'analisi delle specie gassose evolute, alla quantità di calore rilasciato e alla perdita di massa. Questi risultati hanno fornito informazioni sugli eventi termici che si verificano all'interno di un intervallo di temperatura più ampio rispetto a quello coperto nei modelli pubblicati in precedenza. Ciò ha permesso la formulazione di un modello termico migliorato per rappresentare TR. Il calore di reazione, l'energia di attivazione e il fattore di frequenza (triplette termiche) per ciascun processo esotermico principale a livello di materiale sono stati studiati in una cella di batteria al litio nichel-manganese-cobalto-ossido (NMC (111))-grafite. I risultati sono stati analizzati e la loro cinetica è stata derivata. Questi dati possono essere utilizzati per simulare con successo il flusso di calore sperimentale.
Introduzione
La necessità di decarbonizzare l'economia, combinata con l'aumento della domanda di energia, derivante dagli sviluppi socioeconomici e dai cambiamenti climatici, richiede un cambiamento importante nel sistema energetico per affrontare le sfide poste dal riscaldamento globale e dalla carenza di carburante 1,2 . Le tecnologie energetiche pulite come l'energia eolica e l'energia solare sono considerate le migliori alternative a un sistema energetico dominato dai combustibili fossili3; Tuttavia, sono intermittenti e lo stoccaggio di energia contribuirà a garantire la continuità dell'approvvigionamento energetico. Proprietà come l'alta densità di energia specifica, le prestazioni cicliche stabili e l'efficienza rendono le batterie agli ioni di litio (LIB) candidati promettenti come sistema di accumulo di energia elettrochimica. Il costo e la mancanza di un funzionamento affidabile delle LIB possono ostacolare una più ampia applicazione nella rete elettrica, sotto forma di un grande sistema di batterie stazionarie 4,5. Un ulteriore aspetto da considerare è che la combinazione di materiali ad alta energia con elettroliti organici infiammabili a base di solventi può portare a condizioni pericolose come incendio, rilascio di gas tossici ed esplosione 6,7. Pertanto, è necessario affrontare i problemi di sicurezza nelle LIB.
Fin dalla commercializzazione iniziale, un certo numero di incidenti nelle applicazioni attuali (dispositivi elettronici portatili, auto elettriche e unità di potenza ausiliaria negli aeromobili) sono stati riportati nelle notizie 8,9. Ad esempio, nonostante la produzione di alta qualità, si presume che le batterie dei laptop Sony10, i due incidenti Boeing 78711,12, Samsung Galaxy Notes 7 incidenti13 si verifichino da cortocircuiti interni in una cella. Sono stati sviluppati test per valutare i rischi per la sicurezza14,15,16,17. Sovraccarico, sovraccarico, riscaldamento esterno, abuso meccanico e cortocircuito interno/esterno sono meccanismi di guasto noti per innescare il runaway termico (TR)18 e sono stati inclusi in alcuni standard e regolamenti. Durante questo processo, si verificano una serie di reazioni esotermiche che causano un drastico e rapido aumento della temperatura. Quando il calore generato non può essere dissipato abbastanza velocemente, questa condizione si sviluppa in un TR19,20. Inoltre, una singola cella può generare calore sufficiente per innescare le celle vicine, all'interno di un modulo o all'interno di un gruppo di pacchetti, in TR; creazione di un evento di propagazione termica (TP). Strategie di mitigazione come l'aumento della spaziatura delle celle in un modulo, l'uso di materiali isolanti e uno stile specifico di linguetta di interconnessione delle celle hanno tutti dimostrato di frenare il fenomeno di propagazione21. Inoltre, la stabilità elettrolitica e la stabilità della struttura di vari materiali catodici in presenza di elettrolita, a temperatura elevata, sono state studiate al fine di ridurre la probabilità di TR22.
Juarez-Robles et al. hanno mostrato gli effetti combinati dei meccanismi di degradazione da cicli a lungo termine e sovrascarica sulle cellule LIB23. A seconda della gravità della scarica, fenomeni come la placcatura Li, la fessurazione delle particelle catodiche, la dissoluzione del collettore di corrente di Cu, la disintegrazione delle particelle catodiche, la formazione di ponti Cu e Li sono stati riportati come i principali meccanismi di degradazione osservati in questi test. Inoltre, hanno studiato l'effetto combinato derivante dall'invecchiamento e dal sovraccarico su una cella LIB per far luce sui meccanismi di degradazione24. A causa dell'entità del regime di sovraccarico, i comportamenti di degradazione osservati per la cella erano la dissolvenza della capacità, la decomposizione elettrolitica, la placcatura Li, la delaminazione del materiale attivo, il cracking delle particelle e la produzione di gas. Queste condizioni di abuso combinate possono causare reazioni esotermiche dei materiali attivi che possono generare calore sufficiente per avviare il runaway termico.
Per evitare problemi legati alla sicurezza, le batterie agli ioni di litio devono superare diversi test definiti in varie norme e regolamenti14. Tuttavia, la varietà nella progettazione delle celle (sacchetto, prismatico, cilindrico), l'applicabilità di prove limitate a un certo livello (cella, modulo, confezione), diversi criteri di valutazione e accettazione definiti, evidenziano la necessità di unificare le linee guida e i requisiti di sicurezza nelle norme e nei regolamenti25,26,27. Una metodologia affidabile, riproducibile e controllabile, con condizioni di prova uniformi per innescare un cortocircuito interno (ISC) con successivo TR, insieme a criteri di valutazione uniformi, è ancora in fase di sviluppo28. Inoltre, non esiste un unico protocollo concordato per valutare i rischi associati alla presenza di TP in una batteria durante il normale funzionamento20,25.
Al fine di stabilire un protocollo di test che simuli uno scenario realistico di guasto del campo, è necessario studiare sperimentalmente un numero enorme di combinazioni di parametri di input (ad esempio, parametri di progettazione della cella come capacità, rapporto superficie-volume, spessore degli elettrodi, metodo di attivazione ISC, posizione, ecc.) per determinare il modo migliore per innescare TR indotto da cortocircuito interno. Ciò richiede sforzi e costi di laboratorio proibitivi. Un approccio alternativo consiste nell'uso della modellazione e della simulazione per progettare un metodo di innesco adatto. Tuttavia, la modellazione termica 3D delle batterie può essere proibitivamente costosa dal punto di vista computazionale, considerando il numero di valutazioni necessarie per coprire l'effetto di tutte le possibili combinazioni di parametri che potenzialmente governano la TR indotta da un cortocircuito interno.
In letteratura, sono stati sviluppati modelli di decomposizione termica per simulare reazioni elettrochimiche e risposta termica di diversi tipi di batterie agli ioni di litio in varie condizioni di abuso, come la penetrazione del chiodo29, il sovraccarico30 o il test del forno convenzionale31. Nel tentativo di comprendere la stabilità del materiale catodico, Parmananda et al. hanno compilato dati sperimentali di calorimetro a velocità accelerata (ARC) dalla letteratura32. Hanno estratto parametri cinetici da questi dati, sviluppato un modello per simulare l'esperimento calorimetrico e utilizzare questi parametri cinetici per la previsione della stabilità termica di una gamma di materiali catodici32.
Nei riferimenti 29,30,31 e numerosi altri studi, una combinazione degli stessi modelli33,34,35,36 ─ che descrivono rispettivamente; rilascio di calore dalla decomposizione dell'anodo e dello strato di interfaccia elettrolitica solida (SEI); decomposizione del catodo e decomposizione dell'elettrolita ─ è stato utilizzato ripetutamente per diversi anni come base per la modellazione del runaway termico. Anche quest'ultimo è stato migliorato nel tempo, ad esempio aggiungendo condizioni di sfiato37. Tuttavia, questa serie di modelli è stata inizialmente sviluppata per catturare la temperatura di insorgenza di un TR e non per modellare la gravità del runaway termico.
Poiché il runaway termico è una decomposizione termica incontrollata dei componenti della batteria, è della massima importanza identificare le reazioni di decomposizione in anodo e catodo per poter progettare celle di batterie agli ioni di litio più sicure e metodologie di test più accurate. A questo scopo, l'obiettivo di questo studio è lo studio dei meccanismi di decomposizione termica nel catodo NMC (111) e nell'anodo di grafite per lo sviluppo di un modello cinetico di reazione semplificato ma sufficientemente accurato, che possa essere utilizzato nella simulazione di TR.
Qui, proponiamo l'uso di apparecchiature analitiche accoppiate: Calorimetria Differenziale a Scansione (DSC) e Analisi Gravimetrica Termica (TGA) in un unico strumento di analisi termica simultanea (STA). Questa apparecchiatura è accoppiata al sistema di analisi dei gas, che consiste nella spettroscopia infrarossa in trasformata di Fourier (FTIR) e nella gascromatografia-spettrometria di massa (GC-MS). Le tecniche STA/FTIR/GC-MS con trattino ci permetteranno di acquisire una migliore comprensione delle cause e dei processi di fuga termica in una singola cella. Inoltre, ciò contribuirà a identificare i processi di decomposizione termica. La sillabazione si riferisce alla combinazione online di diverse tecniche analitiche.
La configurazione di questo sistema integrato su misura è illustrata nella Figura 1. L'apparecchiatura STA, utilizzata nel presente studio, si trova all'interno di un vano portaoggetti, che garantisce la manipolazione dei componenti in atmosfera protettiva. Quest'ultimo è accoppiato con FTIR e GC-MS tramite linee di trasferimento riscaldate (150 °C) per evitare la condensazione di materiali evaporati lungo le linee. La sillabazione di queste tecniche analitiche consente lo studio simultaneo delle proprietà termiche e l'identificazione dei gas rilasciati, fornendo informazioni sui meccanismi delle reazioni di decomposizione indotte termicamente. Al fine di ridurre ulteriormente l'impatto di reazioni chimiche indesiderate negli elettrodi durante la preparazione del campione, la manipolazione e il caricamento del campione vengono eseguiti all'interno di un vano portaoggetti riempito di argon. Gli elettrodi smontati non vengono risciacquati né vengono aggiunti elettroliti aggiuntivi al crogiolo.
STA consente l'identificazione delle transizioni di fase durante il processo di riscaldamento, insieme a una determinazione accurata delle temperature e delle entalpie associate a queste transizioni di fase, comprese quelle senza cambiamento di massa. La combinazione dei metodi FTIR e GC-MS in linea con lo STA fornisce una valutazione qualitativa dei gas evoluti dal campione durante la sua decomposizione termica. Questa è la chiave per identificare i meccanismi di reazione indotti termicamente. Infatti, il sistema accoppiato STA/FTIR/GC-MS consente di correlare le variazioni di massa, il flusso di calore e i gas rilevati.
FTIR e GC-MS hanno ciascuno i loro vantaggi e limiti. L'elevata sensibilità di GC-MS consente una rapida e facile rilevazione di molecole da picchi di bassa intensità. Inoltre, i dati FTIR integrano bene le informazioni fornite dai modelli dello spettro degli Stati membri per ottenere l'identificazione strutturale delle specie volatili organiche. Tuttavia, FTIR è meno sensibile. Inoltre, le molecole biatomiche, come H 2, N 2, O2, non possiedono un momento di dipolo permanente e non sono attive nell'infrarosso. Pertanto, non possono essere rilevati utilizzando l'assorbimento a infrarossi. Al contrario, piccole molecole come CO 2, CO, NH3 e H2 O possono essereidentificate con un alto grado di certezza38. Nel complesso, le informazioni fornite da questi metodi complementari consentono di ottenere informazioni sui gas emessi durante la caratterizzazione termica.
Al fine di verificare lo stato dell'arte in termini di reazioni di decomposizione termica identificate per il catodo di ossido di litio nichel manganese cobalto (NMC (111), l'anodo di grafite (Gr) e 1M LiPF6 in carbonato di etilene (EC)/carbonato di dimetile (DMC) = 50/50 (v/v) elettrolita, è stata eseguita una revisione della letteratura. La Tabella 1, la Tabella 2 e la Tabella 3 riassumono i risultati principali.
Nel campo della caratterizzazione termica dei componenti delle batterie, il metodo di preparazione del campione ha un effetto significativo sui risultati sperimentali DSC poiché questo ha un'influenza sul segnale DSC. Molti studi hanno riportato approcci diversi in termini di gestione degli elettrodi. Alcune varianti includono 1) graffiare il materiale attivo dall'elettrodo senza risciacquo preventivo né aggiungere quantità extra di elettrolita, ad esempio, 54,55; 2) risciacquare/asciugare/graffiare il materiale attivo e aggiungere una determinata quantità di elettrolita con esso nel crogiolo, ad esempio 55,56; 3) risciacquare/asciugare/graffiare il materiale attivo senza aggiungere elettrolita in una fase successiva (ad esempio, vedi riferimento57). Tuttavia, in letteratura, non esiste un accordo generale sulle tecniche di preparazione del campione. Il lavaggio dell'elettrodo influisce sull'integrità e sui reagenti nel SEI58, che a loro volta modificano la quantità di calore generato dalla sua decomposizione 34,59. D'altra parte, non vi è alcuna indicazione chiara o dettagli sufficienti sulla quantità di elettrolita aggiunto ai materiali raccolti prima dell'analisi termica.
In questo lavoro, la modifica SEI è ridotta al minimo non lavando l'elettrodo ed escludendo l'aggiunta di elettrolita, nel tentativo di caratterizzare il materiale dell'elettrodo nel suo stato originale, mantenendo il suo contenuto di elettrolita residuo. Rendendosi conto che la decomposizione termica SEI è un potenziale fattore scatenante del runaway termico, questo metodo di preparazione dovrebbe consentire una migliore comprensione delle proprietà termiche dell'elettrodo, in condizioni di test, senza la dissoluzione di alcuni prodotti SEI. Infatti, la rottura dello strato SEI sull'anodo è generalmente il primo stadio di guasto della batteria che avvia un processo di autoriscaldamento 39,41,60.
Un altro aspetto importante nell'analisi termica sono le condizioni di misura (tipo di crogiolo, crogiolo aperto/chiuso, atmosfera) che influenzano il segnale DSC da misurare. In questo caso, l'uso di un crogiolo chiuso ermeticamente non è chiaramente adatto per le tecniche STA/GC-MS/FTIR con trattino, il che implica l'identificazione di gas evoluti. In un sistema semichiuso, la dimensione dell'apertura nel coperchio del crogiolo perforato può avere una forte influenza sui risultati della misurazione. Se la dimensione è piccola, i dati termici sono paragonabili a un crogiolo sigillato61. Al contrario, un grande foro nel coperchio dovrebbe diminuire il segnale termico misurato a causa del rilascio precoce di prodotti di decomposizione a bassa temperatura. Di conseguenza, queste specie non sarebbero coinvolte in processi di temperatura più elevata61. Infatti, un sistema chiuso o semichiuso consente un tempo di permanenza più lungo della specie, trasformata dalla fase condensata a quella vapore all'interno del crogiolo. Un foro di sfiato tagliato al laser di 5 μm nel coperchio del crogiolo è stato selezionato per lo studio del comportamento termico e dei gas evoluti dell'anodo di grafite e del catodo NMC (111). Considerando le dimensioni del foro tagliato al laser, assumiamo che il sistema all'interno del crogiolo possa molto probabilmente rappresentare una semplice ma ragionevole approssimazione della dinamica all'interno di entrambi, una cella della batteria chiusa e una cella di ventilazione della batteria.
Il presente lavoro si basa su una precedente pubblicazione degli stessi autori48. Tuttavia, questo articolo si concentra in modo più dettagliato sulla parte sperimentale, evidenziando i benefici delle tecniche utilizzate e le condizioni di test per raggiungere l'obiettivo di questo lavoro.
Per quanto a conoscenza degli autori, vi è una ricerca limitata pubblicata sul comportamento termico del materiale degli elettrodi, utilizzando l'esatta combinazione di questi strumenti analitici STA / FTIR / GC-MS, parametri analitici e preparazione / manipolazione del campione per chiarire i meccanismi di reazione chimica a livello di materiale durante la decomposizione termica. A livello cellulare, Fernandes et al. hanno studiato i gas evoluti in modo continuo, utilizzando FTIR e GC-MS, in una cella cilindrica della batteria sottoposta a un test di abuso sovraccaricato, in una camera chiusa62. Hanno identificato e quantificato i gas durante questo test, ma la comprensione dei meccanismi di reazione rimane ancora poco chiara. Inoltre, per sviluppare un modello di fuga TR, Ren et al. hanno anche condotto esperimenti DSC a livello di materiale per calcolare i parametri cinetici della tripletta delle reazioni esotermiche55. Hanno identificato sei processi esotermici, ma i meccanismi di reazione non sono stati determinati e non hanno usato tecniche di analisi dei gas accoppiati.
D'altra parte, Feng et al. hanno proposto un meccanismo TR a tre stadi in cella LIB con tre temperature caratteristiche che possono essere utilizzate come indici per valutare la sicurezza termica della batteria63. A tale scopo, hanno utilizzato un database termico con i dati di ARC. Tuttavia, non vengono forniti dettagli sulle reazioni chimiche alla base di questi tre meccanismi.
In questo studio, i dati ottenuti attraverso questi metodi di analisi termica sono essenziali per lo sviluppo del modello cinetico in cui i principali processi di decomposizione termica dovrebbero essere determinati e correttamente descritti. La tripletta termica cinetica, cioè l'energia di attivazione, il fattore di frequenza e il calore di reazione, sono calcolati per i diversi sottoprocessi che avvengono in entrambi gli elettrodi durante la decomposizione indotta termicamente, utilizzando tre diverse velocità di riscaldamento: 5, 10 e 15 °C / min. Quando applicabile, il metodo di Kissinger64,65 è stato utilizzato per la determinazione dell'energia di attivazione e del fattore di frequenza, seguendo l'equazione di Arrhenius. Il metodo di Kissinger è applicabile quando il picco DSC passa a temperature più elevate con l'aumentare della velocità di riscaldamento. L'entalpia di reazione si ottiene integrando l'area del picco di reazione, misurata mediante DSC. Da questi dati termici e dalle incertezze di misura, viene proposto un modello cinetico di reazione per simulare la dinamica di un runaway termico. Nella seconda parte di questo lavoro66, questo modello di nuova concezione sarà utilizzato per determinare la probabilità di un evento TR in funzione dei parametri di un metodo di innesco ISC.
Lo schema illustrato nella Figura 2 riassume la sequenza di passaggi necessari per intraprendere il protocollo. Il primo passo consiste nell'assemblare la cella elettrochimica con i materiali della batteria in esame, vale a dire NMC (111)/Gr.
Per poter raccogliere i materiali della batteria dopo il ciclo elettrochimico e la regolazione dello stato di carica (SOC) al 100%, è stata utilizzata una cella elettrochimica richiudibile fornita da EL-CELL (ECC-PAT-Core). Ciò ha permesso un processo di apertura della cella regolare senza danneggiare gli elettrodi. Una volta raccolti i materiali della batteria, viene eseguita la caratterizzazione termica.
Protocollo
NOTA: per una spiegazione dettagliata di ogni passaggio, fare riferimento alle sottosezioni illustrate nella Figura 2.
1. Procedura di preparazione della cella elettrochimica all'interno di un vano portaoggetti riempito di argon
- Gruppo manicotto isolante con separatore per cella elettrochimica a 2 o 3 elettrodi
- Prendi un disco separatore polimerico (diametro 22 mm, spessore 25 μm) e posizionalo sulla parte superiore della parte inferiore del manicotto isolante in polipropilene.
- Premere con attenzione la parte superiore del manicotto isolante per assemblarlo. Assicurarsi che il separatore sia piatto.
- Assemblaggio di celle elettrochimiche
NOTA: Assicurarsi che tutte le fasi relative all'assemblaggio della cella elettrochimica avvengano all'interno di un vano portaoggetti riempito di argon conO 2 e H2 O < 0,1 ppm.- Raccogliere gli strumenti e i materiali necessari per questo passaggio e inserirli all'interno del vano portaoggetti: pinzette per il prelievo del vuoto, cella elettrochimica EL-CELL (costituita da: stantuffo inferiore in acciaio inossidabile del tipo 50, stantuffo superiore in acciaio inossidabile, manicotto isolante assemblato dal punto 1.1, parti della cella centrale in acciaio inossidabile), disco di grafite da 18 mm con capacità areale nominale di 2,24 mAh/cm2, Disco NMC (111) da 18 mm con capacità areale nominale di 2,0 mAh/cm2, 1,0 M LiPF6 in EC/DMC = 50/50 (v/v), micropipetta 100-1.000 μL, punte per micropipette.
NOTA: La capacità specifica di grafite e NMC (111) è rispettivamente di 350 mAh/g e 145 mAh/g ed è fornita dal produttore. Assicurarsi che l'elettrodo anodico sia stato progettato per avere una capacità superiore rispetto al catodo per evitare la placcatura Li sull'anodo di grafite. Il corretto bilanciamento delle capacità degli elettrodi è di fondamentale importanza per evitare il sovraccarico di grafite e Liplating. Anche le capacità areali degli elettrodi sono fornite dal produttore. - Pesare i dischi degli elettrodi su una bilancia analitica a 4 cifre e registrare i valori per determinare il carico attivo del materiale (vedere paragrafo 2 Calcolo della capacità del disco dell'elettrodo).
NOTA: Utilizzare dischi anodici di grafite di grado produttivo (96% materiale attivo, 2% legante carbossimetilcellulosa (CMC), 2% additivo conduttivo) e dischi catodici NMC (111) (86% materiale attivo, 8% additivo conduttivo e 6% legante di polivinilidenfluoruro) per assemblare celle elettrochimiche a 2 e 3 elettrodi (EL-CELL). L'assemblaggio in una cella elettrochimica a 2/3 elettrodi permette di riprodurre lo stesso contenuto di Li in uno stato carico come in una vera cella di grande formato, rispetto ad un gruppo semicella Li-metal. Fino a 40 g, la precisione della bilancia digitale è di 0,01 mg. - Prelevare 150 μL dell'elettrolita con la micropipetta e mettere una goccia sul separatore rivolto verso la parte inferiore del manicotto isolante. Inserire l'anodo di grafite con l'aiuto di una pinzetta pick-up a vuoto seguita dallo stantuffo inferiore.
- Ruotare attorno al manicotto isolante ed erogare l'elettrolita rimanente sul separatore. Inserire il disco catodico NMC (111) con l'aiuto di una pinzetta a vuoto e posizionare lo stantuffo superiore.
- Montare l'assieme all'interno della parte centrale della cella. Metti l'O-ring e fissa tutto insieme usando il morsetto del bullone.
- Misurare la tensione nominale della cella fresca con un multimetro per garantire un buon contatto tra i componenti della cella e identificare potenziali guasti. La risoluzione della tensione del multimetro è di 1 mV a 3 V e 10 mV a 30 V.
NOTA: Per evitare lunghi tempi di attesa dopo l'apertura della cella, che potrebbero potenzialmente alterare la composizione dei materiali attivi, assemblare una nuova cella elettrochimica NMC (111)/Gr da 18 mm per ogni esperimento termico. Il tempo di consegna tra l'apertura di una cella e l'analisi STA/gas evoluto (compresi tutti i preparati) non deve superare più di 2 giorni. Il corretto assemblaggio e chiusura della cella è della massima importanza per il successo del ciclo elettrochimico della cella e quindi per la preparazione degli elettrodi per la caratterizzazione STA / GC-MS / FTIR.
- Raccogliere gli strumenti e i materiali necessari per questo passaggio e inserirli all'interno del vano portaoggetti: pinzette per il prelievo del vuoto, cella elettrochimica EL-CELL (costituita da: stantuffo inferiore in acciaio inossidabile del tipo 50, stantuffo superiore in acciaio inossidabile, manicotto isolante assemblato dal punto 1.1, parti della cella centrale in acciaio inossidabile), disco di grafite da 18 mm con capacità areale nominale di 2,24 mAh/cm2, Disco NMC (111) da 18 mm con capacità areale nominale di 2,0 mAh/cm2, 1,0 M LiPF6 in EC/DMC = 50/50 (v/v), micropipetta 100-1.000 μL, punte per micropipette.
2. Calcolo della capacità del disco dell'elettrodo
NOTA: I fogli di rame e alluminio nudi (non rivestiti) dello stesso fornitore sono stati tagliati in dischi con un diametro fisso di 18 mm.
- Pesare (almeno) 5 dischi Al e cinque dischi Cu di diametro 18 mm per calcolare il peso medio di ciascun collettore di corrente.
- Prima di ogni assemblaggio di celle, pesare l'elettrodo NMC a disco da 18 mm e l'anodo Gr a disco da 18 mm, come indicato al punto 1.2.2, al fine di calcolare con precisione, in una fase successiva, il carico di materiale e la capacità areale calcolata.
- Derivare il carico del materiale dell'elettrodo sottraendo la massa media (collettore di corrente W non rivestito) del collettore di corrente (foglio non rivestito) dal peso del disco dell'elettrodo:
Wmateriale elettrodo (mg) = W disco elettrodo rivestito (mg) - Wcollettore di corrente non rivestito (mg) - Calcola il contenuto di materiale attivo:
W materiale attivo (mg) = Wmateriale dell'elettrodo (mg) * X%
dove X% è la frazione di massa del materiale attivo ed è fornita dal fabbricante (cfr. nota dopo il punto 1.2.2). - Determinare la capacità effettiva del disco dell'elettrodo moltiplicando il contenuto di materiale attivo per la capacità specifica nominale fornita dal fornitore (cfr. nota dopo il punto 1.2.1). Successivamente, calcola la capacità areale del disco:
Capacità calcolata disco elettrodo (mAh) = Wmateriale attivo (g) * Capacità specifica nominale (mAh/g)
Capacità areale calcolata del disco dell'elettrodo (mAh/cm 2) = Disco dell'elettrodo di apacità c calcolato (mAh) / πr2
r = raggio del disco dell'elettrodo
NOTA: I passaggi 2.1-2.4 vengono eseguiti per determinare con precisione il carico di massa e la capacità areale di ciascun elettrodo e verificare i valori riportati dal fornitore (ad esempio, 2,24 mAh / cm 2 per l'anodo di grafite e 2,0 mAh / cm2 per il catodo NMC (111).
3. Ciclo elettrochimico
- Stabilire un protocollo di ciclismo con il software del ciclatore a batteria come descritto da Ruiz et al.67 nella sezione 1 (Pouch Cell Preparation and Formation), paragrafo 3 e nei file supplementari del manoscritto di Ruiz et al.67.
NOTA: Il ciclo elettrochimico eseguito nella sezione 3 è un ciclo di formazione iniziale per attivare la cella, misurare la capacità e infine regolare il SOC. Ogni cella subisce due cicli di carica-scarica e viene quindi completamente caricata (alla tensione di interruzione di 4,2 V). Il numero di cicli è stato selezionato in base alla raccomandazione del fornitore. - Seguendo la procedura descritta da Ruiz et al.67, includere i seguenti passaggi nella procedura di ciclo elettrochimico (vedi file supplementare 1): carica a corrente costante (CC) a C / 20 a tensione di taglio 4,2 V; 1 h di riposo (OCV); scarica CC a C/20 a tensione di taglio 3 V; 1 h di riposo (OCV); Carica CC a C/20 a tensione di interruzione 4,2 V; 1 h di riposo (OCV); scarica CC a C/20 a tensione di taglio 3 V; 1 h di riposo (OCV); Carica CC a C/20 a tensione di taglio 4,2 V.
NOTA: Poiché la capacità reale della cella elettrochimica non può essere determinata prima del ciclo di formazione iniziale, la corrente di prova corrispondente a un tasso C di C/20 è stata determinata in base alla capacità calcolata del disco dell'elettrodo (vedere i dettagli al punto 2.4). Di conseguenza, è possibile stimare una capacità di 5.18 mAh. Poiché una velocità 1C si riferisce a una carica o scarica completa della cella elettrochimica in 1 h, una corrente corrispondente a una velocità C / 20 viene quindi calcolata come 5,18 mAh / 20 h = 0,259 mA. Pertanto, è stata applicata una corrente costante di 0,259 mA fino ai corrispondenti criteri di interruzione per carica e scarica. - Fornire un nome file a questo protocollo (ad esempio, studi STA, carica di condizione della cella).
- Impostare la camera di temperatura su una temperatura costante di 25 °C.
- Rimuovere la cella elettrochimica dal vano portaoggetti e posizionarla all'interno della camera di temperatura. Collegare i cavi appropriati per collegare la cella al ciclatore.
- Eseguire la procedura selezionando il nome file del protocollo, inserendo la corrente corrispondente per una velocità C C/20 e selezionando il numero della camera. Successivamente, fai clic sul pulsante Start .
- Controllare regolarmente il profilo di carica / scarica rispetto al tempo per identificare eventuali problemi durante il ciclismo. Per fare ciò, selezionare il canale e fare clic sul logo grafico per visualizzare il grafico. Se la capacità misurata differisce di oltre il 10% dalla capacità calcolata, non utilizzare la cella perché potrebbero verificarsi reazioni indesiderate (che potrebbero successivamente modificare i dati termici) o l'assemblaggio della cella non ha avuto esito positivo.
- Calcolare il grado di litiazione della grafite, utilizzando la seguente formula:
Grado di litizzazione Gr (%) = (Capacità di scarico sperimentale / Capacità areale calcolata) * 100
NOTA: La capacità di scarico sperimentale è ottenuta dalla seconda fase di scarico di cui al punto 3.2. Il software, infatti, indica una capacità sperimentale di carica e scarica per ogni ciclo. La capacità areale calcolata (mAh/cm 2) si ottiene secondo il punto2.4.
4. Smontaggio e preparazione delle cellule per l'analisi STA/GC-MS/FTIR
- Dopo la fase di ciclo, portare la cella elettrochimica all'interno del vano portaoggetti per lo smontaggio. Aprire la cella, rimuovere lo stantuffo, estrarre un elettrodo (catodo o anodo) e riassemblare la cella per proteggere l'elettrodo rimanente dall'essiccazione.
- Pesare l'elettrodo utilizzando la bilancia di precisione del punto 1.2.2 e posizionarla su un foglio di alluminio fresco. Piegare la pellicola e posizionarla per 2 ore nell'anticamera del vano portaoggetti di trasferimento sotto vuoto, per asciugare l'elettrodo.
NOTA: È stato riscontrato tramite test preliminari che un tempo di asciugatura di 2 ore era ottimale per raggiungere un peso stabile. Il criterio di stabilizzazione era l'assenza di fluttuazioni di peso significative tra due misurazioni dell'elettrodo per un tempo minimo di 5 minuti. Una fluttuazione è stata considerata significativa quando il peso varia più dell'intervallo specificato di seguito:
X mg ± 0,01 mg - Quando il peso si è stabilizzato a X mg ± 0,01 mg, annotare il peso dell'elettrodo essiccato. Procedere alla graffiatura dell'elettrodo a disco, utilizzando una pinzetta e una spatola, per raccogliere il materiale rivestito per un'ulteriore caratterizzazione.
5. Caratterizzazione termica e analisi dei gas
NOTA: La caratterizzazione termica e l'analisi dei gas vengono eseguite nel set up come descritto nella Figura 1.
- Preparazione STA
- Creare un nuovo metodo aprendo il software STA e facendo clic su File, quindi su Nuovo. Nella scheda Impostazione della finestra Definizione misura , selezionare i parametri in base alla tabella 4.
- Vai alla scheda Intestazione e seleziona Correzione per eseguire un'esecuzione di correzione con un crogiolo vuoto per la correzione della linea di base. Scrivere il nome del campione (ad esempio, eseguire la correzione NMC-Gr-16_Gr) e selezionare il file per la calibrazione della temperatura e della sensibilità da utilizzare per l'esecuzione. Vai a Gas MFC e seleziona Elio come gas di spurgo e gas protettivo.
NOTA: l'esecuzione della correzione è un'esecuzione per stabilire una linea di base accurata. - Creare il programma di temperatura nella scheda Programma di temperatura , come descritto nella Tabella 5, per definire il processo di riscaldamento e raffreddamento.
- Impostare la portata dell'elio su 100 ml/min e 20 mL/min rispettivamente per lo spurgo e il gas protettivo. Fare clic su GN2 (azoto gassoso) come mezzo di raffreddamento e STC per il controllo della temperatura del campione per tutti i segmenti del programma di temperatura, a partire dalla fase isotermica a 5 °C fino alla fine del segmento di riscaldamento.
- Passare alla scheda Ultimi elementi e assegnare un nome file a questa esecuzione (che potrebbe essere uguale al nome dell'esempio).
- Utilizzare la bilancia di precisione (la stessa bilancia utilizzata al punto 1.2.2) e misurare il peso del crogiolo vuoto. Immettere la massa del crogiolo accanto al nome del campione.
- Aprire il forno d'argento e posizionare il crogiolo, insieme al crogiolo di riferimento, sul portacampioni DSC/TG dello STA.
NOTA: I crogioli sono di alluminio con coperchio forato al laser con un foro di 5 μm di diametro. - Assicurarsi che il portacampioni sia ben centrato per evitare collisioni durante la chiusura del forno. A tal fine, abbassare il forno d'argento con cautela e quando il forno è vicino al portacampioni, controllare la posizione del supporto del campione rispetto alle pareti interne del forno d'argento.
- Evacuare lentamente il forno (per rimuovere l'argon) e riempirlo nuovamente con elio alla massima portata (350 ml/min di gas di spurgo e 350 ml/min di gas protettivo). Ripetere l'evacuazione/ricarica almeno due volte per eliminare l'argon proveniente dall'atmosfera del vano portaoggetti (quando si apre il forno per posizionare i crogioli).
NOTA: La fase di evacuazione e riempimento (la fase di riempimento dell'elio) è importante poiché la conduttività termica dal forno STA al campione è influenzata dal tipo di ambiente gassoso all'interno del forno. - Dopo la fase di evacuazione e riempimento, attendere 15 minuti per stabilizzare il peso. Eseguire l'esecuzione di correzione, utilizzando il programma di temperatura, premendo Misura per avviare la corsa.
- Quando la corsa è finita, estrarre il crogiolo vuoto. Mettere una massa campione, tipicamente 6-8 mg, del materiale graffiato (anodo o catodo) nel crogiolo. Dopo aver pesato il campione nel crogiolo e registrato la massa, sigillare la padella e il coperchio con una pressa sigillante.
- Ripetere i punti da 5.1.7 a 5.1.9 con il crogiolo pieno.
NOTA: È necessario utilizzare lo stesso crogiolo e coperchio della corsa di correzione. - Apri il file di esecuzione della correzione andando su File e Apri. Selezionare Correzione > campione come tipo di misura nella scheda Definizione rapida . Scrivi il nome e il peso del campione (ad esempio, NMC-Gr-16_Gr) e scegli un nome file.
- Vai alla scheda Programma di temperatura e attiva l'opzione FT (FTIR) per il passo isotermico di 5 °C e il segmento di riscaldamento a 590 °C per avviare il monitoraggio del gas FTIR per questi due segmenti. Selezionare la casella GC per il segmento di riscaldamento (da 5 °C a 590 °C) per attivare l'analisi GC-MS .
NOTA: Prima di avviare la prova, è necessario preparare l'apparecchiatura a gas accoppiato come spiegato nella sezione corrispondente (cioè sezioni 5.2 e 5.3) di seguito.
- Preparazione FTIR
- Prendi un imbuto, inseriscilo nel Dewar della porta del rivelatore di tellururo di cadmio di mercurio (MCT) e riempilo con cura con liquido N2.
- Aprire il software FTIR. Nella scheda Parametro di base caricare il metodo TG-FTIR denominato TGA. XPM. I parametri di misurazione utilizzati per questo metodo sono indicati nella tabella 6 (cfr. anche il file supplementare 2 per le schermate dei parametri di TGA. XPM).
NOTA: Garantire una portata costante di gas argon con un misuratore di portata massica posto all'ingresso della cella a gas IR. Quando non è in funzione, è necessario un flusso di 10 L/h per rimuovere la presenza di umidità e CO2. Durante il funzionamento, viene utilizzato un flusso di 20 L/h. La cella a gas IR a percorso di 10 cm è una cella a gas esterna (riscaldata qui a 200 °C) accoppiata allo STA per identificare i gas evoluti durante l'analisi termica. - Controllare l'interferogramma facendo clic sulla scheda Controlla segnale . Attendere che l'interferogramma si sia stabilizzato prima di iniziare l'analisi termica.
- Configurazione GC-MS
- Inserire i seguenti parametri nel metodo GC-MS per il monitoraggio online dei gas, come mostrato nella Tabella 7.
- Accendere la linea della pompa per vuoto per attirare specie gassose evolute da STA a FTIR e GC-MS. Regolare la velocità di pompaggio su un flusso stabile, che è di circa 60 ml / min.
- Dopo aver caricato il metodo con i parametri sopra indicati (vedi Tabella 7), fare clic su Start Run e compilare il nome del campione e il nome del file di dati; quindi, fare clic su OK, quindi su Esegui metodo.
- Lancio dell'esecuzione STA/GC-MS/FTIR
- Nel software STA, verificare il programma di temperatura, il flusso di gas e assicurarsi che le opzioni GC-MS e FTIR siano abilitate.
- Premere Misura e fare clic su Avvia connessione FTIR per stabilire la connessione tra il software STA e il software FTIR.
- Una volta stabilita la connessione, cliccare su Tara per azzerare la bilancia e controllare il flusso di gas selezionando Imposta gas iniziali. Il flusso del gas di spurgo nel compartimento del campione deve essere di 100 ml/min e il flusso del gas protettivo deve essere di 20 ml/min.
- Premere il pulsante Start per avviare la corsa.
NOTA: Ripetere la caratterizzazione termica e l'analisi dei gas evoluti con materiali anodici e catodici a 5, 10 e 15 °C/min.
- Valutazione dei dati DSC e TGA
- Al termine dell'esperimento, aprire il programma di trattamento dati Netzsch Proteus facendo doppio clic sull'icona.
- Sulla barra multifunzione sopra selezionare T/t con una freccia sotto per posizionare la scala della temperatura (T) sull'asse x anziché sul tempo ( t ). Per chiarezza, rimuovere le curve di raffreddamento facendo clic sul pulsante Segmento sulla barra multifunzione e deselezionandole. Inoltre, rimuovere il flusso di gas del compartimento del campione, il TGA e le curve di Gram-Schmidt premendo sull'icona Assi/Curve , quindi deselezionarli.
- Misurare il rilascio totale di calore e le aree di ciascun picco DSC principale facendo clic con il pulsante destro del mouse sul grafico, quindi selezionare Valuta. Successivamente, fare clic su Area parziale e selezionare l'intervallo di temperatura in cui verrà misurato il rilascio totale di calore, utilizzando Lineare come tipo di base. Per quanto riguarda le preferenze di area parziale, selezionare Avviato a sinistra.
- Quindi, spostare il cursore e fare clic alla fine di ciascun picco DSC principale per misurare il rilascio di calore correlato ad essi e premere Applica.
NOTA: un picco termina quando il segnale ritorna alla linea di base.
- Quindi, spostare il cursore e fare clic alla fine di ciascun picco DSC principale per misurare il rilascio di calore correlato ad essi e premere Applica.
- Misurare la temperatura di picco di ciascun picco maggiore (3 nell'anodo di grafite e 3 nel catodo NMC (111)) facendo clic con il tasto destro sul grafico DSC e andare su Valutare > picco.
- Quindi, spostare il cursore a ciascuna estremità del picco esotermico DSC principale e fare clic per determinare la temperatura di picco.
- Raccogliere i valori di temperatura di picco, velocità di riscaldamento e flusso di calore per ogni picco e il flusso di calore totale. Tracciare la temperatura di picco rispetto alla velocità di riscaldamento in un grafico.
NOTA: Dai dati sperimentali del DSC, l'analisi di Kissinger viene utilizzata per calcolare l'energia di attivazione per i picchi che seguono una cinetica di tipo Arrhenius. - Inserisci nuovamente la curva TGA nel grafico selezionando l'icona assi/curve e spuntando la casella TG .
- Valutare la perdita di massa rispetto alla temperatura, in parallelo con la curva DSC, per una prima valutazione delle variazioni di transizione di fase/entalpia correlate alla curva TGA. A tale scopo, fare clic con il pulsante destro del mouse sulla curva TGA, quindi selezionare Valuta > cambiamento di massa. Spostare i cursori prima e dopo la perdita di peso, premere Applica e quindi OK.
- Passare l'asse X dalla temperatura alla scala temporale.
- Controllare i gas evoluti facendo clic sull'icona di analisi dei dati GC-MSD Netzsch nella stazione GC-MS . Caricare il file di dati dell'analisi termica corrispondente e controllare i picchi GC.
- Ingrandire il picco da analizzare e, successivamente, fare doppio clic con il pulsante destro del mouse sulla linea di base e sul picco. Successivamente, vai alla barra delle icone e seleziona Spettro > Sottrai. Questo sottrarrà la linea di base dallo spettro.
- Fare doppio clic sul grafico MS per verificare i potenziali candidati/corrispondenze corrispondenti al picco nel database NIST.
NOTA: esiste una differenza nella scala temporale tra l'analisi GC-MS e l'analisi STA. Infatti, il GC-MS viene sempre lanciato 20 minuti dopo l'inizio iniziale del programma termico. Il monitoraggio GC-MS inizia all'inizio della fase di riscaldamento STA da 5 °C a 590 °C. La temperatura iniziale del GC-MS è di 100 °C e la temperatura iniziale del segmento di riscaldamento STA è di 5 °C. - Per quanto riguarda la valutazione dei dati FTIR, apri il software Opus . Caricare gli spettri registrati durante l'esperimento passando a File negli strumenti della barra multifunzione, quindi selezionando Carica file e recupera il file di dati dalla cartella. Ora, TRS (spettri risolti nel tempo) Postrun Display è aperto.
NOTA: La visualizzazione dei dati 3D consente di visualizzare gli spettri IR raccolti a diverse lunghezze d'onda (cm-1) in funzione del tempo (secondi), mostrando i prodotti gassosi rilevati dallo spettrometro FTIR provenienti dalla decomposizione termica del materiale dell'elettrodo nello STA. L'asse Y mostra l'ampiezza del segnale di assorbanza; Asse Z, il tempo e l'asse X il numero d'onda. - Sulla curva DSC 2D (2 dimensioni) situata sul lato destro del grafico 3D, modificare l'asse X di volta in volta alla temperatura premendo il tasto destro del mouse e andare a Seleziona asse temporale e selezionare Temperatura.
- Successivamente, sullo stesso grafico DSC 2D, spostare il cursore della freccia blu lungo l'asse X (temperatura) della curva DSC per monitorare la variazione dell'assorbimento IR su un ampio intervallo di numeri d'onda, visualizzato nella finestra in basso a destra (intensità di assorbanza IR rispetto al numero d'onda cm-1). Dopo questa valutazione, identificare un gruppo di bande di assorbimento che mostra una tendenza simile (stesso numero di massimi alla stessa temperatura), quindi posizionare il cursore della freccia blu in una posizione che rifletta il massimo assorbimento di queste bande.
NOTA: Questo passaggio consente la determinazione delle bande di assorbimento IR corrispondenti ai composti gassosi evoluti, associati a un determinato intervallo di temperatura. - Nella finestra dello spettro di assorbanza IR, vengono visualizzate le curve di assorbanza blu (sconosciuta) e rossa (linea di base) della selezione nella curva DSC 2D. Identificare le varie posizioni di picco di assorbimento dello spettro IR blu (dati spettrali sconosciuti) spostando i cursori freccia verde e fucsia lungo l'asse X (numero di lunghezza d'onda cm-1).
- Nell'elenco di scansione situato nella finestra centrale, vengono visualizzate le informazioni su temperatura, data/ora e indice per ogni spettro. Scorri verso il basso l'elenco per trovare le scansioni rosse e blu evidenziate con lo stesso codice colore.
- Estrarre lo spettro rosso (linea di base) facendo prima clic con il pulsante destro del mouse sull'elenco e selezionare Estrai spettri selezionati. Ripetere la stessa operazione con la scansione dello spettro blu. Nella scheda Visualizza , gli spettri estratti vengono visualizzati con il loro numero indice e le informazioni sulla temperatura.
- Sul browser OPUS situato sul lato sinistro della finestra, fare clic sul nome del file della scansione dello spettro (lo spettro sconosciuto) e premere l'icona di sottrazione per aprire la finestra Sottrazione dello spettro . Nel browser OPUS, fare clic sull'icona AB dal file di base e trascinarlo all'interno della casella File/i da sottrarre . Nella scheda Intervallo di frequenza per la sottrazione, selezionare la casella Usa limiti file .
- Fare clic su Avvia modalità interattiva. Ora, la finestra mostra due grafici. Quello superiore visualizza lo spettro sconosciuto (in rosso ora anziché in blu) e la linea di base da sottrarre (in blu ora). Il grafico situato nella parte inferiore della finestra è la curva risultante dall'operazione di sottrazione. Fare clic su Sottrai automaticamente, quindi su Store al termine. Dopo questa operazione, la seguente icona SUBTR viene quindi aggiunta al file dello spettro di assorbanza sconosciuto nel browser OPUS, mostrando che lo spettro è stato elaborato.
NOTA: l'opzione Modifica cifra consente di personalizzare e ottimizzare la costante di sottrazione impostata su uno per impostazione predefinita. In caso di dubbio, seleziona Auto Subtract e il software lo farà automaticamente. - Chiudere il file di base dal browser OPUS per rimuoverlo dal grafico.
- Selezionare il file dello spettro di assorbanza sconosciuto dal browser OPUS e fare clic sull'icona Ricerca spettro dalla barra degli strumenti della barra multifunzione. Nella scheda Parametri di ricerca , inserisci il valore di 30 come numero massimo di riscontri e il valore di 100 per la qualità minima dei risultati. Spuntare la casella di Diversi componenti da cercare nello spettro. Nella scheda Seleziona librerie , assicurarsi che sia presente la libreria pertinente denominata EPA-NIST Gas Phase Infrared Database . In caso contrario, aggiungilo alla libreria. Dopo aver effettuato tutte le impostazioni, fai clic su Cerca nella libreria. Un elenco di potenziali corrispondenze viene elencato dopo questa azione.
- Controllare l'elenco dei potenziali composti gassosi presenti nello spettro di assorbanza IR sconosciuto (che è stato selezionato dal cursore blu nel passaggio 5.14). Con l'ispezione visiva, confrontare le caratteristiche di frequenza del diverso spettro di riferimento dell'analita (dai potenziali composti candidati) con lo spettro incognito. Cerca le migliori corrispondenze di picco per identificare le specie di gas rilasciate a una determinata temperatura.
- Selezionare i numeri d'onda più rappresentativi di ciascun composto gassoso identificato. Il diagramma di intensità temporale nell'angolo in alto a destra può essere utilizzato per misurare la variazione di concentrazione dei gas generati.
- Esportare i dati di evoluzione dei gas per i diversi gas identificati (in questo caso, CO2 e EC) come formato ASCII per ulteriori elaborazioni in Excel, Origin o altri software di elaborazione dati. A tale scopo, andare alla finestra TRS Postrun-Display .
NOTA: nella finestra in alto a destra, due lunghezze d'onda sono presenti nell'elenco. Uno corrisponde alla freccia del cursore verde e l'altro alla freccia del cursore rosa, entrambi dal grafico di assorbanza (di una data temperatura) nella sezione in basso a destra. In questo caso, le lunghezze d'onda dei picchi assorbenti mostrati dalle frecce verdi e rosa corrispondono a EC con 1.863 cm-1 e CO 2 con 2.346 cm-1. - Selezionare una lunghezza d'onda, fare clic con il pulsante destro del mouse e passare a Esporta traccia > ASCII semplice (z, y). Ripetete lo stesso processo con l'altra lunghezza d'onda.
Risultati
Le cifre riportate in questa sezione sono state tratte dal riferimento48.
Caratterizzazione elettrochimica di celle elettrochimiche
Un totale di dodici cellule sono state caratterizzate elettrochimicamente prima degli esperimenti termici e i risultati sono mostrati nella Tabella 8. La capacità di ciascuna cella è stata calcolata (cfr. sezione 2 del protocollo) prendendo in considerazione la massa del materiale attivo e assumendo una capacità teorica di 145 mAh/g per NMC (111) e 350 mAh/g per la grafite. La capacità di scarico sperimentale è stata ottenuta dalla seconda fase di scarico. La tabella 8 mostra anche il grado di litiazione, calcolato seguendo la sezione 3.8.
Il carico dell'anodo di grafite è stato progettato dal produttore per avere un eccesso di materiale attivo del 10% rispetto a quello del catodo per evitare la placcatura al litio nella configurazione a due elettrodi NMC (111)/Gr. Le nostre misurazioni hanno mostrato un eccesso dell'11% in media.
I profili di potenziale di carica e scarica per il secondo ciclo della cella elettrochimica NMC (111)/Gr, campione numero 5 dalla Tabella 8, sono presentati nella Figura 3. Questo grafico mostra che la curva di scarica si ferma ad un potenziale anodico di circa 50 mV vs Li, il che conferma quindi l'assenza di litio. Infatti, il potenziale anodico non raggiunge 0 V vs Li.
Decomposizione termica della grafite litiata
Sulla base delle nostre misurazioni e osservazioni sperimentali, i possibili meccanismi di decomposizione termica per l'anodo di grafite sono identificati dal riassunto dell'indagine bibliografica elencato nella Tabella 1, Tabella 2 e Tabella 3 e discusso più avanti nella sezione di discussione.
Un tipico profilo di decomposizione termica della polvere graffiata dall'anodo (campione numero 5 dalla tabella 8) è mostrato nella figura 4a. Il flusso di calore (mW/mg), la perdita di massa (wt%) e l'intensità relativa FTIR di CO 2 (2.346 cm−1) e EC (1.863 cm−1) sono visualizzati in funzione della temperatura (da 5 °C a 590 °C ottenuta a 10 °C/min di velocità di riscaldamento). Il profilo di decomposizione può essere suddiviso in quattro regioni termiche distinte (mostrate da numeri arabi). I picchi più importanti nella curva DSC sono indicati con numeri romani. Gli spettri FTIR del gas evoluto a 110 °C e 250 °C sono mostrati rispettivamente nella figura 4b e nella figura 4c. A scopo di confronto, gli spettri di riferimento NIST di CO2, etilene ed EC sono aggiunti nelle figure.
Un forte picco endotermico è visibile nella regione 1. In questo intervallo di temperatura inferiore a 100 °C, non è stata rilevata alcuna perdita di massa né generato gas. È interessante notare che questo picco si trova anche con elettrodo di grafite incontaminata a contatto con l'elettrolita (non mostrato) senza un precedente ciclo elettrochimico. Questa osservazione suggerisce che questo picco non appartiene alle caratteristiche termiche della grafite litiata. Per questo motivo, non è stato preso in considerazione per il calcolo delle proprietà termiche in una fase successiva.
La regione 2 mostra che con l'aumentare della temperatura, si osserva un'ampia decomposizione termica DSC, con un picco intorno a 150 ° C-170 ° C (picco I.). L'assorbimento IR caratteristico di CO 2 (2.346 cm-1) si osserva intorno a 100 °C e appare in parallelo o dopo la temperatura di inizio dell'ampio picco esotermico. La figura 4b mostra gli spettri FTIR a 110 °C dove la CO2 è chiaramente visibile. È stato anche rilevato da GC-MS nella Figura 5. Tuttavia, la sua intensità di picco diminuisce, come evidenziato dall'assorbimento a 2.346 cm-1 nella Figura 4a. Inoltre, l'EC inizia ad evaporare vicino a 150 °C, come evidenziato dalla curva FTIR di 1.863 cm-1 nella Figura 4a. L'evoluzione del gas e la perdita di massa nell'intervallo di temperatura 100 °C-220 °C sono minimi. Alla fine della regione 2, vale la pena notare un piccolo picco endotermico intorno ai 200 °C dopo il rilascio di calore mite. La possibile origine di questa transizione di fase viene fornita più avanti nella sezione di discussione.
Come si può vedere nella regione 3, quando la temperatura sale oltre i 220 °C, la generazione di calore aumenta, come evidenziato da un forte picco esotermico (picco II), associato a una significativa perdita di massa e alla simultanea evoluzione del gas. L'analisi dei gas mostra chiaramente CO2 (tramite FTIR nella figura 4a e GC-MS nella figura 5), EC (tramite FTIR Figura 4a e Figura 4c), PF3 (tramite GC-MS nella Figura 6) ed etilene (tramite GC-MS nella Figura 7) come principali prodotti gassosi delle reazioni termiche. Va detto che nel profilo degli spettri infrarossi a 250 °C (Figura 4c), è difficile assegnare tutte le bande di assorbimento a causa della complessità del pattern IR rispetto a quello ottenuto a 110 °C (Figura 4b). Le caratteristiche osservate in questa regione, in particolare il cambiamento nell'evoluzione del gas rispetto alla regione 2, suggeriscono meccanismi di decomposizione consecutivi e paralleli.
Quando la temperatura supera i 280 °C, la quantità di rilascio di calore diminuisce con piccoli picchi parzialmente sovrapposti visibili nella regione 4. I dati TGA rivelano piccole variazioni nella perdita di massa con prodotti gassosi generati e identificati solo a 15 °C / min. Con GC-MS, sono state osservate tracce di etilene nella Figura 7, C2H 6 nella Figura 8, CH4 (misurato ma non mostrato), C3H6 (misurato ma non mostrato). Le specie di decomposizione gassosa e la minore quantità di calore rilasciata (da questi picchi esotermici sovrapposti), rispetto alla regione 3, indicano che i processi termici che si verificano in questa regione sono diversi dai precedenti. Inoltre, va notato che i prodotti di decomposizione più stabili formati nelle precedenti fasi termiche potrebbero anche iniziare a decomporsi in questo intervallo di temperatura. Tra 400 °C e 590 °C, non si osservano reazioni di decomposizione che portano a cambiamenti di entalpia.
La figura 9 mostra il profilo di decomposizione termica della grafite litiata a tre diverse velocità di riscaldamento (5, 10 e 15 °C/min). L'analisi cinetica applicata qui, vale a dire il metodo di Kissinger basato sulle equazioni di Arrhenius, deriva l'energia di attivazione e il fattore di frequenza in base alla temperatura massima di picco per ogni velocità di riscaldamento. Le curve DSC rivelano che velocità di riscaldamento più elevate si traducono in temperature di picco più elevate, ad eccezione del picco I. La temperatura massima di picco per quest'ultimo si sposta verso una temperatura più bassa con l'aumento della velocità di riscaldamento. Questa osservazione suggerisce che il Picco I non segue una cinetica di tipo Arrhenius e, di conseguenza, il metodo di Kissinger non è applicabile. I piccoli picchi esotermici parzialmente sovrapposti visibili nel Picco III mostrano un moderato cambiamento di forma con un sub-picco che diventa più pronunciato e acuto a velocità di riscaldamento più elevate. Ciò implica probabilmente un'influenza dei prodotti di reazione delle regioni 2 e 3 sul Picco III (situato nella regione 4). Tuttavia, è degno di nota che l'analisi di Kissinger può essere applicata in questo caso.
I grafici di Kissinger acquisiti dall'analisi DSC del Picco II e del Picco III sono mostrati nella Figura 9. Tutti gli esperimenti DSC sono stati ripetuti almeno tre volte per velocità di riscaldamento (vedere Tabella 8). Per quanto riguarda il picco II, NMC-Gr-23 è stato identificato come un valore anomalo perché è al di fuori della fiducia della previsione di altri dati, assumendo una distribuzione normale. Pertanto, questi dati sono stati scartati da ulteriori calcoli per determinare i parametri cinetici (energia di attivazione, fattore di frequenza, rilascio di calore) del picco II, ma non del picco III. Infatti, nel Picco III, NMC-Gr-23 rientra nella confidenza della previsione, come illustrato nella Figura 9. Nonostante la decomposizione termica multistep parzialmente sovrapposta di Peak III, la relazione lineare di Kissinger è ancora applicabile in questi processi di reazione esotermica che avvengono nella regione 4.
I parametri cinetici identificati per la grafite litiata sono elencati nella tabella 9. I valori di rilascio di calore, energia di attivazione e fattore di frequenza per il picco I sono stati estratti dalla letteratura34. Da questi dati, la simulazione del profilo DSC è stata condotta per l'anodo costruendo un modello cinetico approssimato per descrivere le reazioni di decomposizione che si verificano in questa chimica dell'elettrodo. La descrizione dei percorsi di scomposizione identificati che sono stati presi in considerazione per la modellazione è specificata nella sezione di discussione.
Decomposizione termica del catodo NMC(111)
Il comportamento termico e la stabilità del materiale catodico sono stati studiati seguendo lo stesso approccio dell'anodo. I principali meccanismi di reazione sono stati identificati dalla Tabella 1, Tabella 2 e Tabella 3 e sono discussi in una fase successiva.
Un profilo rappresentativo di decomposizione termica della polvere raschiata dal catodo (campione numero 5 della tabella 8) è rappresentato nella figura 10. Il flusso di calore (mW/mg), la perdita di massa (wt.%) e l'intensità relativa FTIR di CO 2 (2.346 cm−1) e EC (1.863 cm−1) in funzione della temperatura (da 5 °C a 590 °C a 10 °C/min velocità di riscaldamento) sono visualizzati nel grafico. Quando si confrontano i profili DSC dell'anodo e del catodo, c'è una differenza tra la quantità di calore generato, con un rilascio di calore maggiore per l'anodo. Ciò suggerisce che l'elettrodo negativo è più reattivo termicamente. Indica inoltre che gli eventi termici anodici contribuiscono in modo più significativo al rilascio di calore rispetto al catodo. Quattro regioni termiche sono state identificate nel grafico di decomposizione termica del materiale catodico NMC (111) delithiated (mostrato con numeri arabi).
Nella regione 1, al di sotto di 150 °C, un piccolo picco endotermico è visibile intorno ai 70 °C, come osservato nell'anodo, anche se meno intenso. Inoltre, si osserva un'evoluzione minore di CO2 superiore a 100 °C, senza cambiamenti significativi nel comportamento del flusso di calore, quasi identica a quella mostrata nella Figura 4a. Il verificarsi di questo fenomeno endotermico e l'evoluzione della CO2 negli elettrodi sia positivi che negativi possono derivare da reazioni di decomposizione simili. Pertanto, questo picco può essere trascurato da ulteriori considerazioni nelle successive analisi e calcoli.
Quando la temperatura entra nell'intervallo 155 °C-230 °C nella regione 2, vi è un aumento della curva di assorbimento FTIR EC nella figura 10. Il grafico DSC rivela un piccolo picco endotermico intorno a 200 °C che è più evidente a 15 °C/min nella Figura 11. Questo si sovrappone alle reazioni di decomposizione esotermica, il che rende difficile una valutazione separata. Per motivi pratici, questo picco non può essere incluso nel calcolo delle terzine termiche. Va notato che il profilo TGA in questa zona di temperatura mostra una rapida perdita di massa che potrebbe essere correlata con l'evaporazione di EC.
La regione 3 è caratterizzata da un forte picco esotermico con un improvviso aumento di CO2 e un calo continuo di EC, come mostrato dall'intensità del segnale FTIR tra 240 ° C e 290 ° C.TGA i risultati suggeriscono una perdita di massa minore correlata a questa regione.
Tra 290 °C e 590 °C avvengono tre processi consecutivi di decomposizione esotermica che comportano un'evoluzione coincidente di CO2 per ogni picco esotermico. Questi processi termici nella regione 4 causano una continua perdita di massa che non sembra fermarsi oltre i 590 °C, come mostrato dal profilo di perdita di peso TGA.
Per studiare i parametri cinetici della decomposizione termica del catodo, sono state eseguite misurazioni DSC a 5, 10 e 15 °C/min. Come si può notare nella figura 11, l'aumento della velocità di riscaldamento porta ad uno spostamento dei picchi a temperature più elevate. Ciò dimostra l'idoneità della cinetica di tipo Arrhenius e dell'analisi di Kissinger per descrivere queste reazioni termiche. Le triplette termiche dei picchi NMC I-III sono calcolate e i grafici di Kissinger sono mostrati in Figura 11.
I risultati del picco I nella Figura 11 mostrano chiaramente che NMC-Gr-30 sembra essere un'anomalia poiché questi dati non rientrano nella banda di confidenza degli altri dati. Per questo motivo, è stato scartato per l'analisi successiva. Buoni adattamenti lineari con tutti i dati sono stati ottenuti per il picco II e il picco III nella figura 11. NMC-Gr-30 non è stato considerato come un valore anomalo nel picco II e nel picco III perché NMC-Gr-30 rientra nell'affidabilità della previsione in entrambi i casi, come mostrato nella Figura 11. Dalla pendenza dei diagrammi di Kissinger, l'energia di attivazione può essere facilmente calcolata.
La Tabella 10 mostra i parametri cinetici e i loro errori relativi di Picco I, Picco II e Picco III, assumendo una distribuzione normale. Per quanto riguarda l'elettrolita, in particolare EC poiché si prevede che DMC evapori completamente (a causa del suo basso punto di ebollizione di 90 °C a 760 mm Hg), i parametri cinetici dei processi simultanei di evaporazione CE, combustione EC e decomposizione EC che avvengono nelle regioni 2 e 3 sono elencati nella tabella 11. Per quanto riguarda l'evaporazione CE, l'energia di attivazione e il fattore di frequenza sono stati determinati dai grafici della termogravimetria derivata (DTG) a diversa velocità di riscaldamento. Il grafico DTG rappresenta la perdita di massa durante il riscaldamento rispetto alla temperatura e il picco DTG passa a temperature più elevate all'aumentare della velocità di riscaldamento (misurata ma non mostrata). Inoltre, questa osservazione mostra che l'evaporazione EC avviene più velocemente della reazione EC con NMC. Pertanto, il metodo di Kissinger è stato utilizzato per calcolare i parametri cinetici dell'evaporazione della CE, prendendo il calore di evaporazione della EC dal database del NIST. Per quanto riguarda la combustione CE, i dati sono stati approssimati dalla referenza69,70. Per quanto riguarda la decomposizione CE, i parametri termici sono stati presi dal riferimento71.
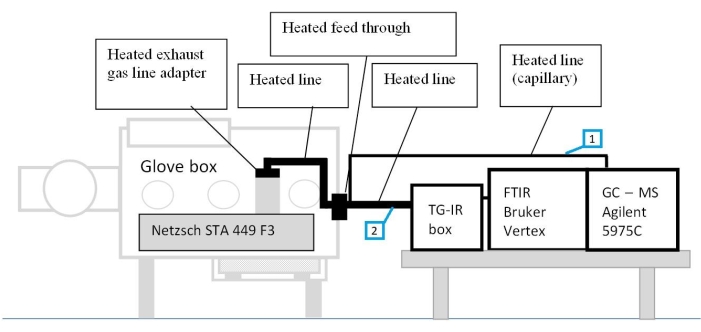
Figura 1: La configurazione del sistema di misura accoppiato. 1-linea di accoppiamento tra STA e GC-MS; Linea a 2 accoppiamenti tra sistema STA e FTIR con box TG-IR. La figura è riprodotta con il permesso del riferimento48. Fare clic qui per visualizzare una versione ingrandita di questa figura.
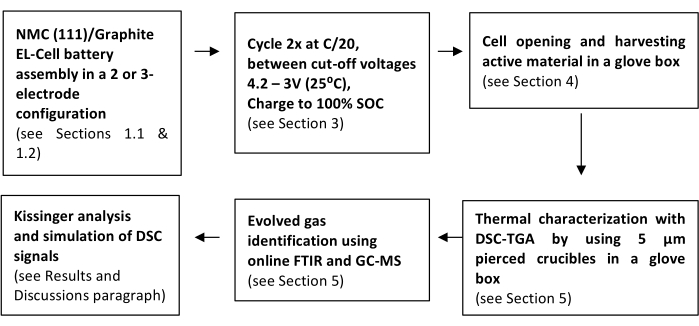
Figura 2: Rappresentazione schematica dei passaggi descritti nel protocollo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
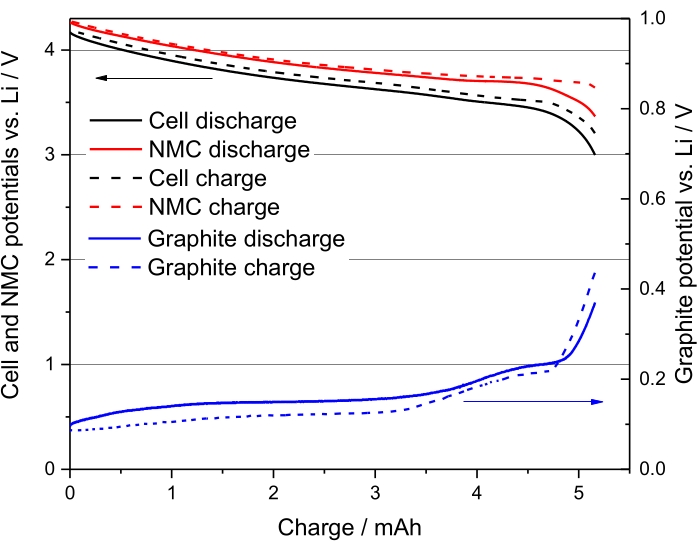
Figura 3. Il secondo ciclo del campione numero 5, nella tabella 8, vale a dire NMC-Gr-30 a C/20. Riprodotto con il permesso della referenza48. Fare clic qui per visualizzare una versione ingrandita di questa figura.
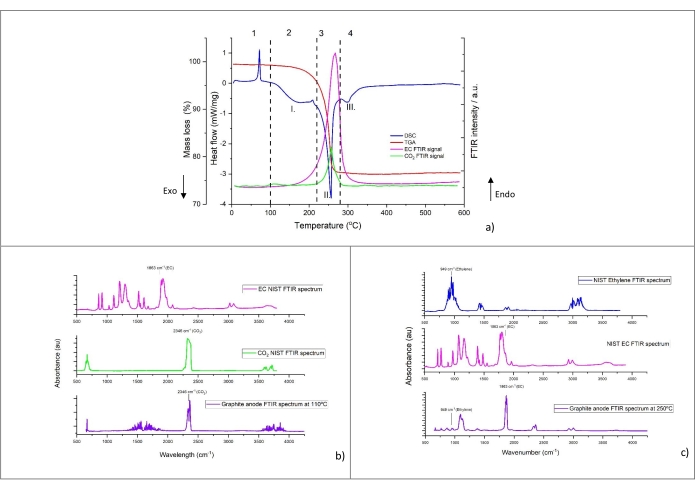
Figura 4: Segnali TGA, DSC e FTIR per grafite litiata numero 5 nella tabella 8, vale a dire NMC-Gr-30. a) Segnali di analisi termica e FTIR simultanei di grafite litiata con picchi di assorbanza FTIR registrati a 1.863 cm-1 per EC e 2.346 cm−1 per CO2; b) spettri FTIR dei gas evoluti dalla grafite litiata registrata a 110 °C, c) Spettri FTIR dei gas evoluti dalla grafite litiata registrata a 250 °C. La velocità di riscaldamento per questo esperimento era di 10 °C/min. Gli spettri di riferimento sono tracciati sulla base dei dati del NIST Chemistry WebBook68. I numeri arabi rappresentano le diverse regioni termali, che possono essere costituite da diversi picchi. I numeri romani mostrano le cime più importanti e modellate. Questa cifra è riprodotta con il permesso del riferimento48. Fare clic qui per visualizzare una versione ingrandita di questa figura.
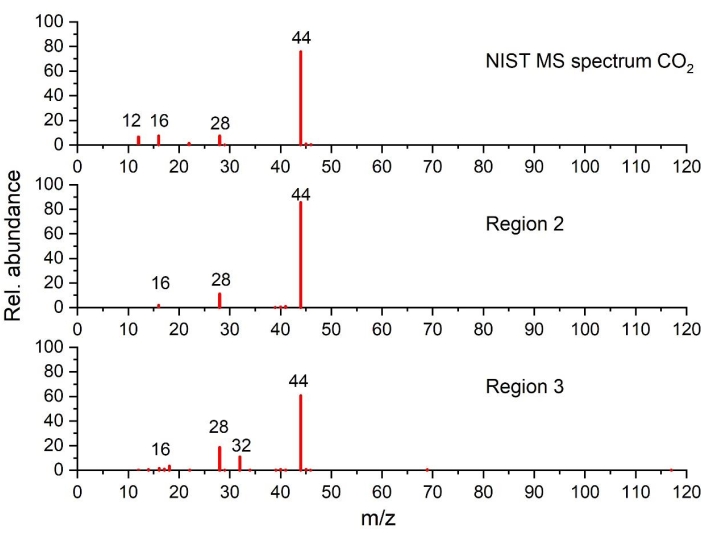
Figura 5: Spettri di massa di CO 2 rilevati nelle regioni2 e 3 rispetto allo spettro NIST (tracciato sulla base dei dati del NIST Chemistry WebBook68). Fare clic qui per visualizzare una versione ingrandita di questa figura.
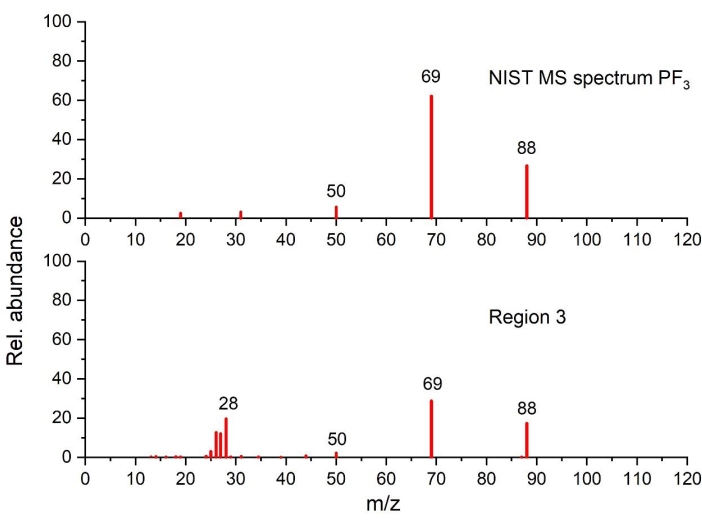
Figura 6: Spettro di massa di PF 3 rilevato nella regione di temperatura3 rispetto allo spettro NIST (tracciato sulla base dei dati del NIST Chemistry WebBook68). Fare clic qui per visualizzare una versione ingrandita di questa figura.
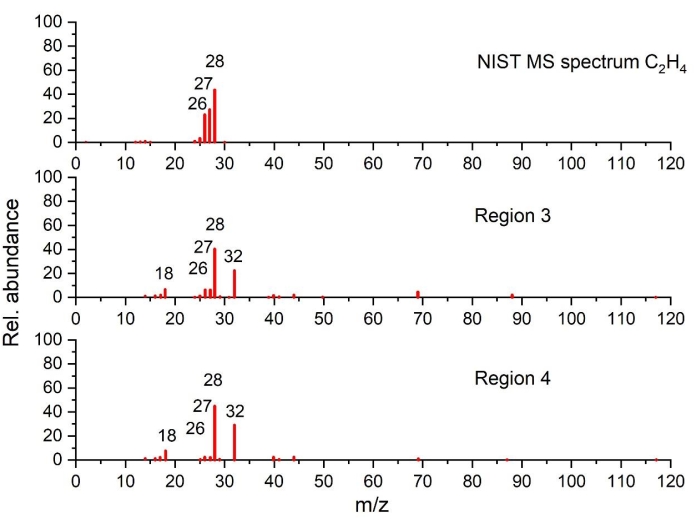
Figura 7: Spettri di massa dell'etilene rilevati nelle regioni di temperatura 3 e 4 rispetto allo spettro NIST (tracciato sulla base dei dati del NIST Chemistry WebBook68). Fare clic qui per visualizzare una versione ingrandita di questa figura.
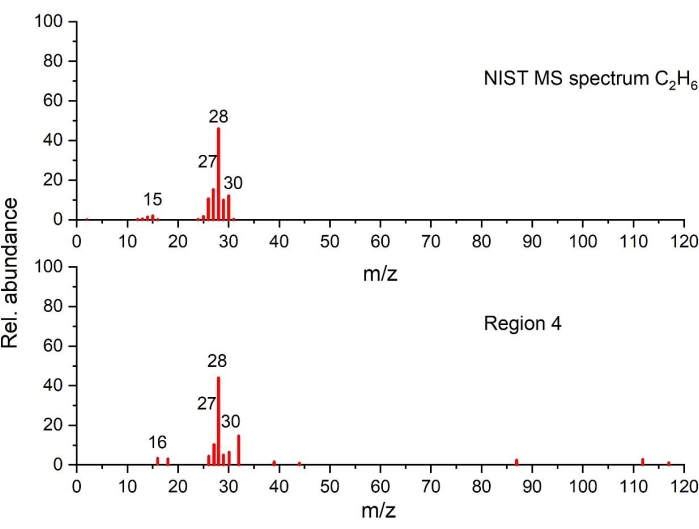
Figura 8: Spettro di massa di C2H6 rilevato nella regione di temperatura 4 rispetto allo spettro NIST (tracciato sulla base dei dati del NIST Chemistry WebBook68). Fare clic qui per visualizzare una versione ingrandita di questa figura.
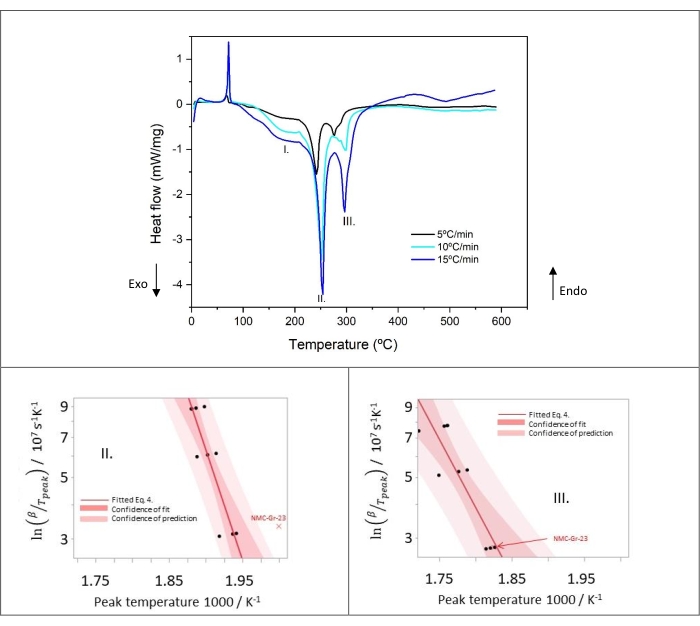
Figura 9: Flusso di calore della grafite litiata a velocità di riscaldamento di 5, 10 e 15 °C/min dei campioni numero 2, 6, 9 nella tabella 8 e nei diagrammi di Kissinger dei picchi II e III. Questa cifra è riprodotta con il permesso della referenza48. Fare clic qui per visualizzare una versione ingrandita di questa figura.
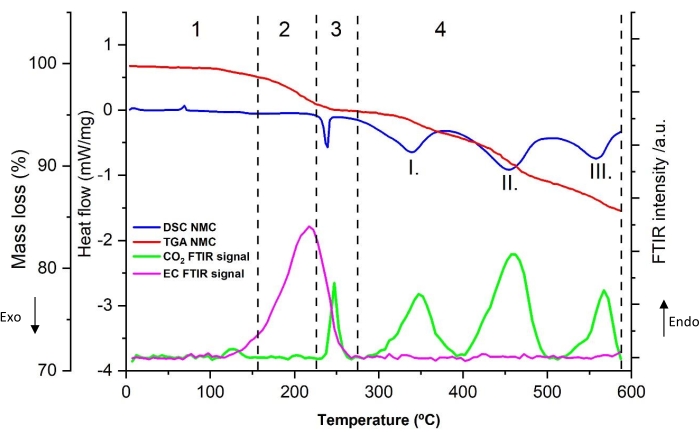
Figura 10: Segnali TGA, DSC e FTIR per grafite litiata numero 5 nella Tabella 8, vale a dire NMC-Gr-30, con picchi di assorbanza FTIR registrati a 1.863 cm-1 per EC e 2.346 cm-1 per CO 2. Questa cifra è riprodotta con il permesso del riferimento48. Fare clic qui per visualizzare una versione ingrandita di questa figura.
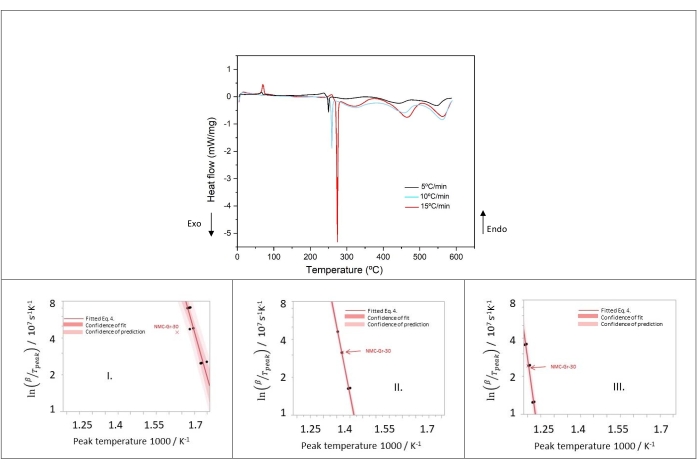
Figura 11: Flusso di calore del catodo delithiated a velocità di riscaldamento di 5, 10 e 15 °C/min dei campioni numero 1, 5, 9 nella Tabella 8 e nei grafici di Kissinger dei picchi I, II e III. Questa cifra è riprodotta con il permesso del riferimento48. Fare clic qui per visualizzare una versione ingrandita di questa figura.
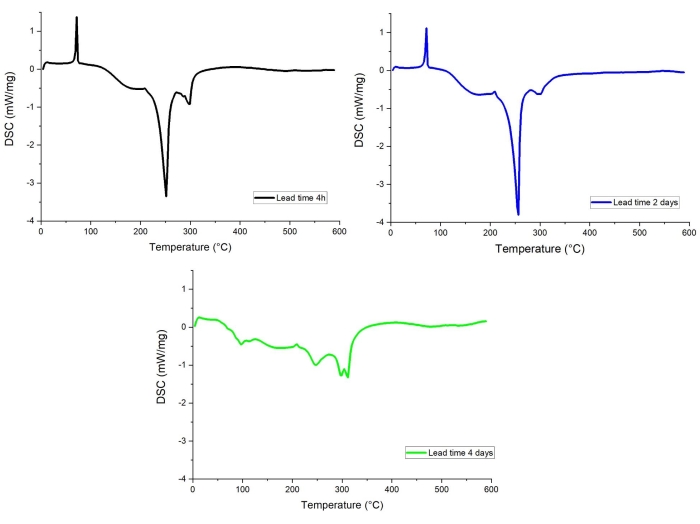
Figura 12: Profili DSC della grafite estratta dalle cellule . (nero) Termine d'esecuzione 4 h, (blu) Tempi di consegna 2 giorni, (verde) Tempi di consegna 4 giorni. Fare clic qui per visualizzare una versione ingrandita di questa figura.
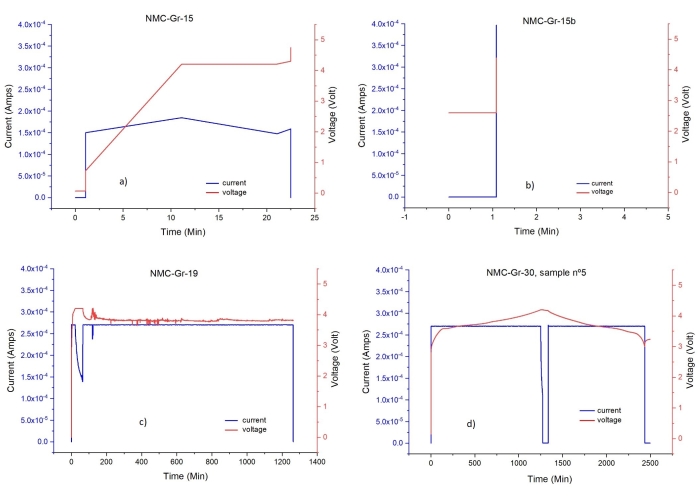
Figura 13: Profili tensione-tempo e corrente-tempo di varie celle EL . (a), (b), (c): firma ciclica di celle non correttamente assemblate/chiuse/collegate, (d) firma ciclica di celle correttamente assemblate/chiuse/collegate. Fare clic qui per visualizzare una versione ingrandita di questa figura.
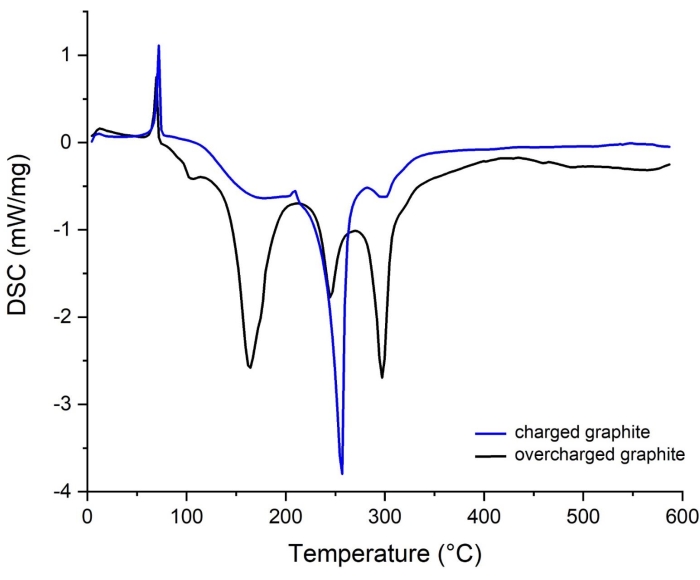
Figura 14: Spettri DSC di grafite da celle bilanciate e sbilanciate di capacità. (blu) caricato, (nero) sovraccaricato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Reazioni di decomposizione anodica (a temperatura elevata) identificate in letteratura. EC: carbonato di etilene, CMC: carbossimetilcellulosa, R: gruppo alchilico a basso peso molecolare, SEI: interfaccia elettrolitica solida, p-SEI sta per il SEI primario sviluppato durante il ciclo elettrochimico e s-SEI per SEI secondario, che può formarsi a temperatura elevata all'inizio della TR. Il carbonato di etilene (EC) e il carbonato di dimetile (DMC) sono i solventi utilizzati nell'elettrodo. La carbossimetilcellulosa (CMC) è il materiale legante. Questa tabella è riprodotta con il permesso della referenza48. Clicca qui per scaricare questa tabella.
Tabella 2: Reazioni di decomposizione identificate del catodo delitiato NMC(111). NMC: Litio Nichel Manganese Cobalto, HF: Acido fluoridrico. Questa tabella è riprodotta con il permesso della referenza48. Clicca qui per scaricare questa tabella.
Tabella 3: Reazioni di decomposizione identificate di 1M LiPF6 in EC/DMC = 50/50 (v/v) elettrolita. PEO: Ossido di fluoro-polietilene. Questa tabella è riprodotta con il permesso della referenza48. Clicca qui per scaricare questa tabella.
Tabella 4: Parametri utilizzati nella scheda Impostazione della finestra Definizione misura dell'STA. Clicca qui per scaricare questa tabella.
Tabella 5: Programma di temperatura per misure STA con una velocità di riscaldamento di 10 °C/min. Clicca qui per scaricare questa tabella.
Tabella 6: Impostazioni di misura della spettroscopia TG-FTIR per l'identificazione di gas evoluti. Clicca qui per scaricare questa tabella.
Tabella 7: Impostazioni dei parametri GC-MS per la misurazione qualitativa dei gas emessi. Clicca qui per scaricare questa tabella.
Tabella 8: Matrice di prova per gli esperimenti STA e principali proprietà elettrochimiche delle cellule studiate. La capacità calcolata utilizza il carico di massa misurato del materiale attivo per ciascun elettrodo e la capacità nominale fornita dal produttore. La capacità di scarica sperimentale è calcolata dal secondo ciclo di scarica. n.d. = file ciclico danneggiato; pertanto, il calcolo SOC non è stato possibile, ma è stato eseguito STA. *campione graffiato perso durante la preparazione. Il carico dell'anodo di grafite è stato progettato dal produttore per avere un eccesso di materiale attivo del 10% rispetto a quello del catodo per evitare la placcatura al litio nella configurazione a due celle Gr/NMC (111) a due elettrodi. Le nostre misurazioni hanno mostrato un eccesso dell'11% in media. Questa tabella è riprodotta con il permesso della referenza48. Clicca qui per scaricare questa tabella.
Tabella 9: Triplette termiche determinate ed errore standard (st.err.) delle reazioni di decomposizione della grafite litiata. Il metodo di Kissinger è stato utilizzato per calcolare i parametri cinetici (rilascio di calore, energia di attivazione e fattore di frequenza) e le loro incertezze. Poiché il metodo Kissinger non è applicabile al Picco I, i dati sono stati estratti dalla letteratura. Questa tabella è riprodotta con il permesso della referenza48. Clicca qui per scaricare questa tabella.
Tabella 10: Triplette termiche determinate ed errore standard delle reazioni di decomposizione di NMC(111) delithihated. L'errore standard viene visualizzato tra parentesi. Il metodo di Kissinger è stato utilizzato per calcolare i parametri cinetici (rilascio di calore, energia di attivazione e fattore di frequenza) e le loro incertezze. Questa tabella è riprodotta con il permesso della referenza48. Clicca qui per scaricare questa tabella.
Tabella 11: Costanti cinetiche di evaporazione, decomposizione e combustione CE. L'evaporazione di EC viene misurata in questo lavoro e vengono forniti i dati calcolati e l'errore standard tra parentesi. La combustione è stimata a partire dalla referenza69,70 e i dati di decomposizione si basano sui valori di letteratura 71. Questa tabella è riprodotta con il permesso della referenza48. Clicca qui per scaricare questa tabella.
File supplementare 1: screenshot della procedura elettrochimica nel ciclatore Maccor. Clicca qui per scaricare questo file.
File supplementare 2: screenshot dei parametri di TGA. Programma XPM. Clicca qui per scaricare questo file.
Discussione
Nella sezione seguente, i meccanismi di reazione sono identificati e discussi per ciascun elettrodo, sulla base dei risultati raccolti dallo STA per studiare il comportamento termico, e dal sistema di analisi dei gas sillabati (FTIR e GC-MS) per la caratterizzazione dei gas evoluti durante l'analisi termica.
Tuttavia, discuteremo prima gli aspetti importanti di questa tecnica, le insidie e la risoluzione dei problemi che incontriamo per garantire, dal punto di vista dell'utente, l'implementazione di successo del metodo.
La nostra ricerca ha dimostrato che un lead time, cioè il tempo trascorso tra l'apertura della cella e l'analisi STA/gas evoluti (compresi tutti i preparati), ha un effetto pronunciato sulla curva DSC dei materiali. Ciò è probabilmente correlato all'evaporazione elettrolitica e alle reazioni collaterali indesiderate che avvengono sulla superficie dell'anodo completamente carico, che è altamente reattivo, in presenza di tracce di ossigeno e/o acqua72,73. Un esempio di tale effetto è dato nella Figura 12, dove vengono confrontate le curve DSC per elettrodo di grafite con tempi di consegna di 4 ore, 2 giorni e 4 giorni. Il profilo DSC dell'anodo a tempo di consegna di 4 giorni mostra segnali esotermici significativamente più piccoli, mentre le curve per tempi di consegna lunghi 4 ore e 2 giorni sono molto simili.
L'assemblaggio di una cella batteria agli ioni di litio completa fatta a mano con un separatore sottile e dischi di elettrodi di uguale diametro è un'operazione delicata. Pertanto, il corretto assemblaggio e chiusura della cella è della massima importanza per il successo del ciclo elettrochimico della cella e, quindi, per la preparazione degli elettrodi per la caratterizzazione STA / GC-MS / FTIR. Ad esempio, il disallineamento dei dischi degli elettrodi e/o il separatore crimpato possono comportare cambiamenti significativi nel comportamento ciclico di una cella completa agli ioni di litio74. Se la cella è correttamente assemblata, chiusa e collegata al ciclatore può essere visto dal profilo di tensione rispetto al tempo. La figura 13 mostra una serie di profili ciclici per le celle difettose e li confronta con il primo ciclo della cella adeguatamente preparata. Pertanto, consideriamo tutti i passaggi nella preparazione delle cellule come critici.
Nella nota successiva al punto 1.2.1 e al paragrafo 2 (Calcolo della capacità del disco dell'elettrodo) nella sezione protocollo, è stato menzionato che il corretto bilanciamento della capacità areale del disco dell'elettrodo è un requisito essenziale prima dell'assemblaggio completo della cella della batteria agli ioni di litio. Pertanto, questo aspetto è di fondamentale importanza per evitare il sovraccarico di grafite e la liplaccatura75,76,77. La figura 14 confronta le curve DSC della grafite completamente carica e sovraccarica, mostrando chiaramente un effetto sostanziale del sovraccarico sul comportamento termico del materiale. La grafite sovraccaricata è correlata all'assemblaggio di elettrodi sbilanciati in cui la capacità areale teorica del catodo (fornita dal fornitore: 3,54 mAh / cm 2) è superiore a quella dell'anodo (fornita dal fornitore: 2,24 mAh / cm2). Di conseguenza, la grafite diventa sovralitica e il surplus di Li+ trasportato nella matrice di grafite può essere depositato sulla superficie come metallo Li.
Prima di lanciare la campagna sperimentale, sono stati effettuati test preliminari. La tecnica è stata ottimizzata per risolvere i problemi al fine di ottenere risultati affidabili e riproducibili. Ad esempio, la scelta di uno stantuffo corretto per la cella elettrochimica EL-CELL è essenziale per evitare la flessione del separatore. L'altezza corretta dello stantuffo dipende dai materiali e dallo spessore dei componenti della cella78. Per il sistema descritto in questo studio, siamo giunti alla conclusione che lo stantuffo 50 è una scelta migliore rispetto allo stantuffo 150. Pertanto, lo stantuffo 50 è stato costantemente utilizzato nei nostri esperimenti.
Allo stesso modo, la quantità ottimale di elettrolita doveva essere attentamente regolata per garantire una buona bagnatura di tutti i componenti della cella. Ciò è necessario per evitare il massimo possibile limitazioni al trasporto ionico. L'elettrolita insufficiente comporta un aumento della resistenza ohmica e una perdita di capacità79,80. La quantità ottimizzata di elettrolita è risultata essere di 150 μL per il sistema presentato in questo studio.
Per quanto riguarda i limiti del metodo proposto, alcuni di essi sono già discussi nella sezione introduttiva del documento. Inoltre, per quanto riguarda la spettrometria di massa, i prodotti di decomposizione sono tipicamente analizzati utilizzando la ionizzazione elettronica (EI) con MS quadrupolo dopo separazione cromatografica mediante GC. Ciò consente di identificare ciascun composto all'interno di una miscela complessa di prodotti gassosi evoluti. Tuttavia, le impostazioni scelte del STA/GC-MS limitano la rilevazione a piccoli prodotti di decomposizione con masse inferiori a m/z = 150 (la m si riferisce al numero di massa molecolare o atomica e z al numero di carica dello ione). Tuttavia, i parametri selezionati per il sistema STA/GC-MS sono ritenuti appropriati dagli autori per l'analisi dei gas rilasciati provenienti dai materiali degli elettrodi.
Un altro potenziale inconveniente sarebbe una parziale condensazione di prodotti ad alto punto di ebollizione come il carbonato di etilene nella linea di trasferimento (riscaldata a 150 °C). Di conseguenza, un'attenta eliminazione di tutti i sistemi dopo ogni esperimento è importante per evitare la contaminazione incrociata degli esperimenti.
Per quanto riguarda l'FTIR, i gas evoluti vengono trasferiti attraverso una linea riscaldata a 150 °C a una cella di misura TG-IR riscaldata a 200 °C. L'analisi dei gruppi funzionali presenti nei gas evoluti consente l'identificazione delle specie gassose. Un possibile svantaggio dell'accoppiamento STA/FTIR è la sovrapposizione dei segnali provenienti dalla miscela gassosa (diversi gas che si evolvono contemporaneamente) che si traduce in spettri complessi difficili da interpretare. In particolare, contrariamente al sistema STA/GC-MS, non vi è separazione dei prodotti di decomposizione prima dell'analisi di assorbanza infrarossa.
L'attuale configurazione del sistema di analisi dei gas consente l'identificazione di composti gassosi, il che significa che il metodo è qualitativo. In effetti, la quantificazione non è stata affrontata in questo studio, il che lascia la possibilità di raccogliere ulteriori informazioni chimiche. Questo, tuttavia, richiederebbe che gli strumenti fossero collegati in serie e non in parallelo, cioè STA / GC-MS e STA / FTIR, per massimizzare la sensibilità e la precisione. Inoltre, un sistema per intrappolare i gas dopo l'analisi STA consentirebbe l'uso di GC-MS per la quantificazione dopo la caratterizzazione qualitativa FTIR. Si potrebbe considerare il seguente sistema: STA/gas intrappolati/FTIR/GC-MS collegati in serie. Un'altra considerazione è che FTIR potrebbe anche essere utilizzato per la quantificazione e la convalida incrociata dei dati quantitativi ottenuti da GC-MS. La prospettiva di quantificazione richiederebbe comunque ulteriori ricerche per determinare la sua applicabilità in queste tecniche con trattino, che non era lo scopo del nostro lavoro.
Sebbene il presente lavoro sia qualitativo, offre un miglioramento rispetto al lavoro precedente poiché, come menzionato nella parte introduttiva, l'apparecchiatura STA si trova all'interno di un vano portaoggetti, che garantisce la manipolazione dei componenti in atmosfera protettiva. Ancora una volta, per quanto a conoscenza degli autori, vi è una ricerca limitata pubblicata sul comportamento termico dei materiali degli elettrodi, utilizzando l'esatta combinazione di questi strumenti analitici STA / FTIR / GC-MS, parametri analitici e preparazione / manipolazione del campione per chiarire i meccanismi di reazione chimica a livello di materiali durante la decomposizione termica. Ulteriori dettagli sul significato di questo metodo sono forniti nella sezione introduttiva.
La nostra ricerca ha dimostrato la potenza di questa tecnica STA/GC-MS/FTIR per la caratterizzazione termica dei materiali delle batterie e l'analisi dei gas evoluti. Ovviamente, questa tecnica può essere applicata a diversi set di materiali, ad esempio, per studiare nuovi materiali, proprietà dei materiali in condizioni di ciclismo estreme, ecc. Questa tecnica è in definitiva adatta per studiare il comportamento termico dei materiali e le loro vie di decomposizione termica e per analizzare i gas in evoluzione. Un altro esempio di tale uso di questa tecnica STA/GC-MS/FTIR con trattini è l'applicazione alla caratterizzazione di materiali energetici, inclusi esplosivi, propellenti e pirotecnica81.
Decomposizione termica della grafite litiata
A bassa temperatura, al di sotto dei 100 °C, è stato rilevato un picco endotermico intorno ai 70 °C senza relativa perdita di massa. Come accennato in precedenza, questo picco è visibile anche nell'anodo di grafite incontaminata a contatto con l'elettrolita. La temperatura massima di picco non corrisponde alla fusione EC (circa 36 °C) né all'evaporazione DMC (90 °C). Alcune possibili spiegazioni includono la fusione di LiPF 6-EC o l'evoluzione di HF dal sale LiPF6 generato da tracce di umidità82. Tuttavia, questo evento endotermico non è rilevante ai fini di questo studio poiché non è correlato alla grafite litiata. Quindi, è stato trascurato da ulteriori analisi.
La regione 2 inizia con una piccola evoluzione di CO2 intorno a 100 ° C-110 ° C. Ciò è ulteriormente confermato dai dati GC-MS in Figura 5 e dai risultati FTIR visualizzati nella Figura 4b che mostrano la presenza di CO 2 e H2 O. L'interfaccia elettrolitica solida (SEI) è uno strato protettivo sulla superficie dell'anodo che cresce durante la prima carica di una cella. È il risultato della decomposizione elettrolitica su grafite litiata fresca. Questo strato stabilizza la superficie dell'anodo reattivo impedendo un'ulteriore decomposizione elettrolitica e la cointercalazione del solvente in strati grafitici nei successivi cicli di carica83. E' noto che i componenti meno stabili dello strato SEI iniziano a decomporsi esotermicamente con una temperatura di esordio intorno ai 100 °C-130 °C 35,41,61,84,85. Questo fenomeno è spesso identificato come decomposizione primaria di SEI (pSEI). Ciò è coerente con l'ampio picco esotermico che appare sopra i 100 °C. È interessante notare che non vi è alcuna evoluzione dell'etilene rilevata da FTIR o GC-MS, contrariamente alle aspettative delle reazioni 3, 4 e 9 nella Tabella 1. In effetti, la rottura di SEI e la successiva reazione di Li con elettrolita dovrebbero avvenire durante questa fase esotermica, secondo le reazioni precedentemente menzionate. Inoltre, la perdita di massa in questo intervallo di temperatura è solo di circa il 4 wt%, che è piuttosto bassa e non corrisponde alla perdita di massa prevista dai meccanismi proposti. Questa variazione di massa deriva più probabilmente dall'inizio dell'evaporazione EC che inizia intorno a 150 °C, come illustrato dal picco di assorbimento FTIR caratteristico di 1.863 cm-1 nella Figura 4a e nella Figura 4c.
Queste osservazioni indicano che lo strato SEI non si decompone in un singolo passaggio, come specificato nelle reazioni 3, 4 e 9. Pertanto, queste reazioni non riflettono accuratamente i processi termici nella regione 2. In alternativa, le reazioni 1, 2 e 5 della Tabella 1 possono fornire una migliore rappresentazione delle reazioni di decomposizione elaborate nel seguente intervallo 100 °C-220 °C. Vale la pena ricordare che l'evoluzione di CO 2 vicina a 100 °C potrebbe essere generata dalla reazione2 quando le tracce di acqua evaporano. È anche possibile che, all'aumentare della temperatura, il SEI non si disintegri ma la sua struttura e composizione modifichi, con possibile crescita dello spessore dello strato. La lieve generazione di calore, l'assenza di una significativa perdita di massa e il gas evoluto suggeriscono che la reazione 2 nella Tabella 1 potrebbe aver indotto un cambiamento da una struttura SEI isolante a una porosa che consente l'interazione EC o il trasporto agli ioni di litio con la superficie di grafite litiata. Tuttavia, questo film nuovo o trasformato, chiamato SEI secondario, mantiene la sua natura protettiva, come dimostra la bassa quantità di rilascio di calore rispetto alla regione 3. È stato trovato, per mezzo di XRD, che il contenuto di litio nella grafite è diminuito gradualmente durante il ramping termico da 110 °C a 250 °C, suggerendo il consumo di Li in questo intervallo di temperatura86. Quando si considerano i reagenti coinvolti nel meccanismo di reazione 1 e 5 (Tabella 1), la decomposizione termica 5 è più semplice ed è stata selezionata per descrivere il processo nella regione 2. Il seguente piccolo picco endotermico intorno ai 200 °C può essere attribuito alla fusione di LiPF6, o placcatura Li77,87, o esfoliazione della grafite 88. Questo evento di transizione ha un impatto trascurabile sulla TR ed è stato quindi scartato da ulteriori analisi e considerazioni nel calcolo delle terzine termiche.
Nella regione 3 (240 °C-290 °C), l'incremento del calore generato con un evidente aumento della perdita di massa con la corrispondente evoluzione del gas denota una grave transizione di fase. Sulla base dei risultati dell'analisi termica combinati con la natura delle specie gassose, più vie di reazione consecutive e parallele/o concorrenti generano, molto probabilmente, il picco II. Per quanto riguarda l'evoluzione EC (Figura 4a e Figura 4c), i risultati STA dalla grafite incontaminata a contatto con l'elettrolita suggeriscono che l'evaporazione EC è più veloce della decomposizione termica EC in queste condizioni (misurata ma non mostrata). I dati GC-MS mostrano la presenza di PF3 ed etilene rispettivamente nella Figura 6 e nella Figura 7, oltre all'evoluzione di CO2 e EC rilevata da FTIR (Figura 4a). Pertanto, le seguenti vie di reazione stanno probabilmente avvenendo contemporaneamente: a) decomposizione parziale del SEI secondario, b) reazioni Li-elettrolitiche (reazioni 3, 4, 6, 7, 8 e 9 nella Tabella 1), c) decomposizione EC (reazione 20, Tabella 3), decomposizione LiPF6 (reazione 17, Tabella 3) ed evaporazione EC (Tabella 3 ). Quando si confronta il profilo esotermico ottenuto per la regione 2 e la regione 3, è molto chiaro che gli eventi termici che si verificano in ciascuna regione sono di natura diversa. Ciò contraddice il meccanismo di reazione singola riportato da alcuni studi33,35,41 che comprendono la rottura di SEI e le reazioni litiate-grafite-elettrolitico, come evidenziato dalle reazioni 3 e 4. Inoltre, le conoscenze acquisite dai nostri risultati suggeriscono che non si tratta di un singolo evento termico, ma piuttosto di un processo in due fasi. I meccanismi di decomposizione dettagliati nelle reazioni 6, 8 e 9 descrivono meglio l'evento termico nella regione 3, che è corroborato dalla rilevazione gassosa di CO2, etilene e PF3 (prodotti di decomposizione di LiPF6). PF3 non è elencato come prodotto primario di alcuna reazione nella Tabella 1 e nella Tabella 3, ma può essere generato nella colonna GC o nelle linee riscaldate. Il PF 3 non è stato generato altrove perché si prevede che l'inizio della decomposizione termica di LiPF6 (come mostrato nella reazione 17, Tabella 3) avvenga tra 100 °C e 200 °C, a seconda delle condizioni sperimentali (cioè contenitori sigillati o aperti, dimensione del campione)89. Uno dei prodotti di questa decomposizione termica (cioè PF5) subisce una successiva trasformazione che porta alla formazione di POF3, come mostrato nella reazione 6.
La perdita di massa nella regione 3 è dovuta principalmente all'evaporazione della CE. Sulla base di queste osservazioni, le regioni 2 e 3 dovrebbero essere modellate in modo diverso. Proponiamo e formuliamo quindi un doppio meccanismo di rottura in cui il SEI primario non si decompone completamente, ma cambia la sua struttura e composizione con la formazione simultanea di uno strato SEI secondario. All'aumentare della temperatura, si verifica una seconda rottura in cui lo strato secondario SEI si decompone, consentendo il consumo di litio intercalato nell'anodo.
Nella regione 4, picchi piccoli e parzialmente sovrapposti sono correlati a diverse reazioni di decomposizione. L'analisi dell'evoluzione dei gas con GC-MS mostra tracce di etilene nella Figura 7 insieme a C2H 6 nella Figura 8, CH4 (misurato, ma non mostrato) e C3H6 (misurato, ma non mostrato) rilevabile solo a 15 °C/min. L'analisi termica separata del legante incontaminato (misurata, ma non mostrata) ha dimostrato che la carbossimetilcellulosa (CMC) si decompone in questo intervallo di temperatura. Nel riferimento90 è stata riportata evidenza di reattività specifica del legante CMC con elettrolita. Questo è molto probabilmente derivante dai gruppi funzionali idrossilici in CMC (reazione 12, Tabella 1). Questo processo consente la formazione delle specie che fanno parte dello strato SEI. Quest'ultimo può decomporsi con un calore di reazione più elevato rispetto al legante da solo. Tuttavia, il legante rappresenta solo il 2% in peso del materiale anodico, che da solo non può causare il rilascio di calore osservato. Un'altra spiegazione sarebbe la successiva decomposizione di prodotti più stabili formatisi nelle regioni precedenti durante la rampa termica. Inoltre, è stato rivelato che, a 330 °C e 430 °C, si verificano reazioni esotermiche a causa della decomposizione del carbonato alchilico di litio e dell'ossalato di litio43. Questi componenti sono due delle principali specie SEI. Poiché la CE è completamente evaporata/decomposta qui, le uniche reazioni possibili sono quelle rappresentate in 6, 7, 11 e 12 della Tabella 1. Tuttavia, queste reazioni non spiegano i gas evoluti nella regione 4. Vale la pena sottolineare che i processi esotermici corrispondenti a questo intervallo di temperatura sono diversi rispetto alle regioni 2 e 3, come evidenziato dai gas prodotti, dalla minima perdita di massa, dalla forma del picco e dal calore evoluto. Tuttavia, i prodotti di decomposizione generati nei precedenti eventi termici, così come le loro quantità, possono influenzare le reazioni nella regione 4.
Decomposizione termica del catodo NMC (111)
Analogamente ai modelli DSC ottenuti nell'anodo a bassa temperatura, nella Figura 10 è stato osservato un picco endotermico intorno a 70 °C nella regione 1, anche se in questo caso un po' meno pronunciato. È stata rilevata un'evoluzione di CO2 leggermente superiore a 100 °C. Entrambi i fenomeni possono essere dovuti a un meccanismo identico, basato sulle osservazioni nei modelli di decomposizione termica dell'anodo. Pertanto, questo picco è stato trascurato da ulteriori considerazioni.
Come accennato in precedenza, l'endoterma intorno a 200 °C (più visibile a 15 °C/min nella Figura 11) nella regione 2 è dovuta all'evaporazione EC. Questo picco si sovrappone agli eventi termici esotermici, il che rende difficile analizzarlo usando il metodo di Kissinger. Tuttavia, questo evento endotermico non è stato scartato e invece, in questo lavoro è stato applicato un approccio diverso. Infatti, come accennato in precedenza nella sezione dei risultati rappresentativi del catodo, sono stati invece utilizzati diagrammi DTG a diversa velocità di riscaldamento, al fine di calcolare i parametri cinetici con il metodo Kissinger, per l'evaporazione EC.
Nella regione 3, la figura 10 indica un brusco picco esotermico con forte rilascio di CO2 e un calo dell'evoluzione EC tra 240 °C e 290 °C. Le possibili reazioni per descrivere l'evoluzione del gas, la perdita di massa e il rilascio di calore potrebbero essere: a) reazione 15 nella Tabella 2 con HF da LiPF 6 decomposto con NMC, b) reazione 19 e 20 per reazione EC con LiPF6 (PF5) e decomposizione termica EC, rispettivamente, c) combustioneEC con rilascio di O2 dalla decomposizione NMC91 (reazione 16 e reazione 13, rispettivamente), d) decomposizione autocatalitica di NMC, simile a quella riportata per la decomposizione LCO33,35,41.
La reazione 15 produce acqua che non è stata rilevata dal sistema di analisi dei gas. Inoltre, questa reazione non contribuisce all'emissione di CO2. Pertanto, questa reazione non è considerata un processo rilevante nella regione 3. Le opzioni b) e c) sono difficili da distinguere e per questo motivo sono entrambe considerate per ulteriori calcoli. La reazione governativa viene identificata in una fase successiva, quando si ottimizza la risposta termica simulata in questo intervallo di temperatura. Un segnale di flusso di calore meglio simulato si ottiene quando i parametri termici della combustione e dell'evaporazione EC sono inclusi nel calcolo (non mostrati in questo documento). In un precedente studio DSC, la curva termica di NMC(111) non ha mostrato un esoterma netto a 250 °C-290 °C92. È interessante notare che, quando la combustione EC è esclusa dal calcolo, il picco esotermico acuto scompare nella simulazione ed è coerente con lo studio sopra menzionato. L'assenza del picco acuminato può essere correlata all'uso di crogioli forati manualmente utilizzati nella referenza92 che consentirebbero un'evaporazione EC più rapida e il rilascio di O2 grazie a un'apertura più ampia nel coperchio. Quindi, il picco esotermico acuto è correlato alla combustione EC (reazione 16, Tabella 3) con O 2 rilasciato originato dalla decomposizione NMC (reazione 13, Tabella 2).
La regione 4 indica tre picchi esotermici marcati I-III. Quando la temperatura raggiunge i 300 °C, viene prodotto più ossigeno a causa della decomposizione accelerata di NMC. Questo processo termico è legato al rilascio di ossigeno assorbito fisicamente91. Il rilascio di CO 2 osservato da FTIR nella Figura 10 è probabilmente il risultato della conduzione di una reazione additiva al carbonio con ossigeno rilasciato dall'elettrodo catodico delithiato (reazione 14, Tabella 2). Questa reazione rallenta oltre i 350 °C, poiché l'ossigeno assorbito fisicamente si sta esaurendo. L'intervallo di temperatura della seconda reazione esotermica è in buon accordo con la decomposizione del legante PVDF che avviene tra 400 °C e 500 °C, come osservato dalla misurazione DSC del legante NMC puro (misurato ma non mostrato). I risultati del TGA mostrano perdite di peso tra il 2,97 e il 3,54% in peso, che corrispondono alla perdita di peso prevista associata alla decomposizione del PVDF. Il successivo processo esotermico alla base del Picco III è correlato al rilascio di ossigeno che è chimicamente legato nel catodo91. Questo ossigeno reagisce ulteriormente con l'additivo di carbonio conduttore per formare CO 2 (reazione 14, Tabella 2).
Panoramica generale
Questo lavoro evidenzia una speciale combinazione di caratteristiche sperimentali e gestione dei campioni al fine di raccogliere informazioni sui processi termici negli elettrodi delle LIB. Poiché l'apparecchiatura è alloggiata all'interno di un vano portaoggetti riempito di argon, le manipolazioni coinvolte dall'assemblaggio della cella elettrochimica alla preparazione del campione e al caricamento nello strumento STA sono state eseguite senza contaminazione involontaria dei campioni. Di conseguenza, è stato possibile raggiungere una maggiore precisione nella determinazione dei parametri termici. L'elettrodo è stato tenuto non lavato, per comprendere meglio i fenomeni termici a livello di materiale che portano alla generazione di calore e, quindi, potenzialmente contribuiscono al TR. La scelta di un crogiolo con coperchio forato al laser, contenente un piccolo foro di soli 5 μm di diametro, garantisce un sistema semiaperto, con risultati simili a quelli ottenuti in un crogiolo sigillato, ma con il vantaggio di consentire la raccolta del gas.
Inoltre, le piccole dimensioni del foro possono potenzialmente riflettere meglio i fenomeni della cella con le sue reazioni indotte termicamente, coinvolgendo componenti gassosi che non vengono rilasciati istantaneamente, ma portano all'accumulo di pressione interna all'interno della cella della batteria. Questo fenomeno, insieme all'aumento incontrollabile della temperatura cellulare, può portare a TR e sfiato. Un'altra particolarità è l'ampio intervallo di temperatura, da 5 °C a 600 °C, utilizzato nella caratterizzazione termica dei materiali degli elettrodi mediante tecnica accoppiata STA/FTIR/GC-MS.
Da queste speciali caratteristiche sperimentali e parametri sopra citati, sono stati identificati i processi termici più rilevanti e le loro triplette termiche cinetiche hanno potuto essere determinate e utilizzate per simulare il segnale del flusso di calore per ciascun elettrodo.
Per riassumere, viene proposto un doppio meccanismo di rottura per riflettere le reazioni di decomposizione che avvengono nell'anodo. I dati ottenuti da STA, FTIR e GC-MS hanno mostrato che lo strato primario di SEI non si decompone completamente in un singolo passaggio. In effetti, c'è un accumulo simultaneo di uno strato SEI secondario. Queste reazioni sono modellate con la decomposizione di tipo diffusionale e la cinetica di formazione. In una fase successiva dopo il riscaldamento, si verifica una seconda rottura con la decomposizione secondaria di SEI e il consumo di Li immagazzinato in grafite, l'evaporazione EC e la decomposizione EC che si verificano contemporaneamente. Il terzo processo esotermico comporta la decomposizione dei prodotti stabili formati nelle regioni precedenti e il legante.
I processi termici identificati per la decomposizione catodica NMC (111) consistono in: evaporazione di EC, decomposizione di NMC con liberazione di ossigeno, combustione di EC con l'ossigeno liberato, decomposizione del legante e combustione dell'additivo di carbonio. L'O2 evoluto reagisce immediatamente con gli additivi carbonici. Inoltre, la decomposizione EC non si verifica poiché l'evaporazione EC è più veloce.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano con grazia Marc Steen e Natalia Lebedeva per l'eccellente supporto nella revisione e nella discussione di questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Glove box MB 200B | MBraun | Glove box filled with argon to ensure inert atmosphere. H2O < 0.1 ppm; O2 < 0.1 ppm | |
| STA 449 F3 Jupiter® | Netzsch | Simultaneous Thermal Analysis for thermal characterization. The STA equipment is located inside the glove box. Type of furnace used: silver | |
| Agilent 7820A GC- Agilent 5977E MS | Agilent | Gas Chromatograph equipped with an quadrupole Mass Spectrometer. GC-MS is coupled to STA via heated lines in order to identify the released gases during thermal characterization | |
| Bruker Vertex 70 V FTIR | Bruker | Fourier Transform Infrared spectrometer equipped with a TG-IR box. FTIR is coupled to STA via heated lines in order to identify the released gases during thermal characterization | |
| 18mm graphite electrode disc | Customcell | 363586011 | graphite electrode disc with an area capacity of 2.24 mAh.cm-2 |
| 18mm NMC (111) electrode disc | Customcell | 363662011 | LiNiMnCoO2 electrode disc with stochiometry ratio 111 and an area capacity of 2.0 mAh.cm-2 |
| 1.0 M LiPF6 in EC/DMC=50/50 (v/v) | Sigma-Aldrich | 746711-100ML | Electrolyte |
| 2325 trilayer film separator | Celgard® | Film separator. 22 mm diameter discs should be cut from the film | |
| High precision cutting pliers | EL Cell | 1) Used in paragraph 2 for cutting with a fixed 18 mm diameter the bare copper and aluminum foils (non-coated). These current collectors were bought from the same supplier as for the elecrode discs 2) Used for cutting 22 mm diameter Cegard separator discs | |
| ECC-PAT-Core (2014 version) kit using: a) reusable stainless steel (SS) upper plunger, b) reusable SS lower plunger of type 50 (size in µm), c) single-use PP insulation sleeves | EL Cell | Electrochemical cell assembly | |
| Maccor Series 4000 | Maccor | Battery cycler. It was used to cycle 2 times the electrochemical cell and to adjust afterwards the SOC to 100% | |
| aluminum crucibles with 5 µm laser-pierced lid | Netzsch | 6.239.2-64.81.00 | Crucible used for the thermal analysis and identification of released gases from cycled electrode material (graphite anode or NMC (111) cathode) |
| Precision balance AE240 type AE240-S inside Glove box | Mettler Toledo | Battery materials are measured at µg precision | |
| Analogue digital multimeter ABB model MetraWatt M2005 | Gossen MetraWatt | Used to measure of the freshly assembled electrochemical cell in paragraph 1.2.6 |
Riferimenti
- van Ruijven, B. J., De Cian, E., Sue Wing, I. Amplification of future energy demand growth due to climate change. Nature Communications. 10, 2762 (2019).
- De Cian, E., Sue Wing, I. Global energy consumption in a warming climate. Environmental and Resource Economics. 72, 365-410 (2019).
- Sivaram, V., Dabiri, J. O., Hart, D. M. The need for continued innovation in solar, wind, and energy storage. Joule. 2, 1639-1642 (2018).
- Rosewater, D., Williams, A. Analyzing system safety in lithium-ion grid energy storage. Journal of Power Sources. 300, 460-471 (2015).
- . Fundamental Aspects of Large-Scale Energy Storage SystemSafety Available from: https://www.osti.gov/servlets/purl/1365118 (2016)
- Zhong, G., et al. Thermal runaway and fire behavior investigation of lithium ion batteries using modified cone calorimeter. Journal of Thermal Analysis and Calorimetry. 135, 2879-2889 (2016).
- Chen, M., Yuen, R., Wang, J. An experimental study about the effect of arrangement on the fire behaviors of lithium-ion batteries. Journal of Thermal Analysis and Calorimetry. 129, 181-188 (2017).
- Bubbico, R., Greco, V., Menale, C. Hazardous scenarios identification for Li-ion secondary batteries. Safety Science. 108, 72-88 (2018).
- Ouyang, D. A review on the thermal hazards of the lithium-ion battery and the corresponding countermeasures. Applied Sciences. 9. 9, 2483 (2019).
- Christman, J. The case of the burning laptops. Journal of Case Studies. 30, 88-97 (2012).
- Boeing 787 Battery Fire. Accident No: DCA13IA037. US National Transportation Safety Board Available from: https://www.ntsb.gob/investigations/pages/boeing_787.aspx (2013)
- Aircraft serious incident investigation report, all Nippon Airways Co. Ltd. JA804A. Japan Transport Safety Board Available from: https://www.mlit.go.jp/jtsb/eng-air_report/JA804A.pdf (2014)
- Loveridge, M. J., et al. Looking deeper into the galaxy (Note 7). Batteries. 4, (2018).
- Ruiz, V., et al. A review of international abuse testing standards and regulations for lithium ion batteries in electric and hybrid electric vehicles. Renewable and Sustainable Energy Reviews. 81, 1427-1452 (2018).
- United Nations, E. And S. C. United Nations Global technical Regulation on Electrical vehicle Safety (UN GTR-EVS) on electric vehicle safety: Phase 1. International Organization. ECE/TRANS. United Nations. , (2017).
- ISO 6469-1:2019 Electrically propelled road vehicles - Safety specifications - Part 1: rechargeable energy storage system (RESS). International Organization for Standardization Available from: https://www.iso.org/standard/68665.html (2019)
- UL Standard for Safety for Lithium Batteries, UL 1642:2007. Underwriters Laboratories Inc Available from: https://standardscatalog.ul.com/ProductDetal.aspx?productid=UL1642 (2007)
- Walker, W. Q., Ali, O. A., Theriot, D. H. Future Lithium-ion Batteries. The Royal Society of Chemistry. , 290-315 (2019).
- Ziebert, C., Melcher, A., Lei, B., Zhao, W. R., M, H. J. S., Rodriguez-Martinez, L. M., Omar, N. Chapter Six - Electrochemical-Thermal Characterization and Thermal Modeling for Batteries. Emerging Nanotechnologies in Rechargeable Energy Storage Systems. , (2017).
- Ruiz Ruiz, V., Pfrang, A. . JRC Exploratory Research: Safer Li-ion Batteries by Preventing Thermal Propagation. , (2018).
- Lopez, C. F., Jeevarajan, J. A., Mukherjee, P. P. Experimental analysis of thermal runaway and propagation in lithium-ion battery modules. Journal of The Electrochemical Society. 162, 1905-1915 (2015).
- Xiang, H. F., et al. Thermal stability of LiPF6-based electrolyte and effect of contact with various delithiated cathodes of Li-ion batteries. Journal of Power Sources. 191, 575-581 (2009).
- Juarez-Robles, D., Vyas, A. A., Fear, C., Jeevarajan, J. A., Mukherjee, P. P. Overdischarge and aging analytics of li-ion cells. Journal of The Electrochemical Society. 167, 90558 (2020).
- Juarez-Robles, D., Vyas, A. A., Fear, C., Jeevarajan, J. A., Mukherjee, P. P. Overcharge and aging analytics of li-ion cells. Journal of The Electrochemical Society. 167, 90547 (2020).
- Ruiz, V., Brett, L., Steen, M., Van Den Berghe, L. . Putting Science into Standards - Driving Towards Decarbonisation of Transport: Safety, Performance, Second Life and Recycling of Automotive Batteries for e-Vehicles. , (2016).
- Xiong, R., Ma, S., Li, H., Sun, F., Li, J. Toward a safer battery management system: A critical review on diagnosis and prognosis of battery short circuit. iScience. 23, 101010 (2020).
- Börger, A., Mertens, J., Wenzl, H. Thermal runaway and thermal runaway propagation in batteries: What do we talk about. Journal of Energy Storage. 24, 100649 (2019).
- . JUnited Nations Global technical Regulation for Electrical vehicle Safety (UN GTR-EVS): Authorization to develop Phase 2 Available from: https://unece-modl.dotsoft.gr/DAM/trans/doc/2017/wp29other/ECE-TRANS-WP29-AC3-49e.pdf (2018)
- Zhao, W., Luo, G., Wang, C. -. Y. Modeling nail penetration process in large-format li-ion cells. Journal of The Electrochemical Society. 162, 207-217 (2015).
- Ren, D., et al. An electrochemical-thermal coupled overcharge-to-thermal-runaway model for lithium ion battery. Journal of Power Sources. 364, 328-340 (2017).
- Lopez, C. F., Jeevarajan, J. A., Mukherjee, P. P. Characterization of lithium-ion battery thermal abuse behavior using experimental and computational analysis. Journal of The Electrochemical Society. 162, 2163-2173 (2015).
- Parmananda, M., Ryali, B., Mukherjee, P. P. Thermo-electrochemical stability analytics of electrode materials. The Journal of Physical Chemistry C. 123, 30106-30120 (2019).
- Richard, M. N., Dahn, J. R. Accelerating rate calorimetry study on the thermal stability of lithium intercalated graphite in electrolyte. II. Modeling the results and predicting differential scanning calorimeter curves. Journal of the Electrochemical Society. 146, 2078-2084 (1999).
- Richard, M. N., Dahn, J. R. Accelerating rate calorimetry study on the thermal stability of lithium intercalated graphite in electrolyte. I. Experimental. Journal of the Electrochemical Society. 146, 2068-2077 (1999).
- Hatchard, T. D., MacNeil, D. D., Basu, A., Dahn, J. R. Thermal model of cylindrical and prismatic lithium-ion cells. Journal of The Electrochemical Society. 148, 755 (2001).
- Kim, G. -. H., Pesaran, A., Spotnitz, R. A three-dimensional thermal abuse model for lithium-ion cells. Journal of Power Sources. 170, 476-489 (2007).
- Coman, P. T., Rayman, S., White, R. E. A lumped model of venting during thermal runaway in a cylindrical Lithium Cobalt Oxide lithium-ion cell. Journal of Power Sources. 307, 56-62 (2016).
- Duemichen, E., Braun, U., Senz, R., Fabian, G., Sturm, H. Assessment of a new method for the analysis of decomposition gases of polymers by a combining thermogravimetric solid-phase extraction and thermal desorption gas chromatography mass spectrometry. Journal of Chromatography A. 1354, 117-128 (2014).
- Yang, H., Shen, X. -. D. Dynamic TGA-FTIR studies on the thermal stability of lithium/graphite with electrolyte in lithium-ion cell. Journal of Power Sources. 167, 515-519 (2007).
- Golubkov, A. W., et al. Thermal-runaway experiments on consumer Li-ion batteries with metal-oxide and olivin-type cathodes. RSC Advances. 4, 3633-3642 (2014).
- Spotnitz, R., Franklin, J. Abuse behavior of high-power, lithium-ion cells. Journal of Power Sources. 113, 81-100 (2003).
- Wang, Q., Sun, J., Yao, X., Chen, C. Thermal behavior of lithiated graphite with electrolyte in lithium-ion batteries. Journal of the Electrochemical Society. 153, 329-333 (2006).
- Zhao, L., Watanabe, I., Doi, T., Okada, S., Yamaki, J. TG-MS analysis of solid electrolyte interphase (SEI) on graphite negative-electrode in lithium-ion batteries. Journal of Power Sources. 161, 1275-1280 (2006).
- Choi, N. -. S., Profatilova, I. A., Kim, S. -. S., Song, E. -. H. Thermal reactions of lithiated graphite anode in LiPF6-based electrolyte. Thermochimica Acta. 480, 10-14 (2008).
- Wang, Q., Sun, J., Yao, X., Chen, C. Thermal stability of LiPF6/EC+DEC electrolyte with charged electrodes for lithium ion batteries. Thermochimica Acta. 437, 12-16 (2005).
- Parimalam, B. S., MacIntosh, A. D., Kadam, R., Lucht, B. L. Decomposition Reactions of Anode Solid Electrolyte Interphase (SEI) Components with LiPF6. The Journal of Physical Chemistry C. 121, 22733-22738 (2017).
- Jakab, E., Mészáros, E., Borsa, J. Effect of slight chemical modification on the pyrolysis behavior of cellulose fibers. Journal of Analytical and Applied Pyrolysis. 87, 117-123 (2010).
- Kriston, A., Adanouj, I., Ruiz, V., Pfrang, A. Quantification and simulation of thermal decomposition reactions of Li-ion battery materials by simultaneous thermal analysis coupled with gas analysis. Journal of Power Sources. 435, 226774 (2019).
- Jung, R., Metzger, M., Maglia, F., Stinner, C., Gasteiger, H. A. Oxygen release and its effect on the cycling stability of LiNixMnyCozO2 (NMC) cathode materials for li-ion batteries. Journal of the Electrochemical Society. 164, 1361-1377 (2017).
- Buchberger, I., et al. Aging analysis of Graphite/LiNi1/3Mn1/3Co1/3O2Cells using XRD, PGAA, and AC impedance. Journal of The Electrochemical Society. 162, 2737-2746 (2015).
- Wang, Q. S., Sun, J. H., Chu, G. Q., Yao, X. L., Chen, C. H. Effect of LiPF6 on the thermal behaviors of four organic solvents for lithium ion batteries. Journal of Thermal Analysis and Calorimetry. 89, 245-250 (2007).
- Yang, H., Zhuang, G. V., Ross, P. N. Thermal stability of LiPF6 salt and Li-ion battery electrolytes containing LiPF6. Journal of Power Sources. 161, 573-579 (2006).
- Campion, C. L., Li, W., Lucht, B. L. Thermal decomposition of LiPF 6-based electrolytes for lithium-ion batteries. Journal of the Electrochemical Society. 152, 2327-2334 (2005).
- Zheng, S., Wang, L., Feng, X., He, X. Probing the heat sources during thermal runaway process by thermal analysis of different battery chemistries. Journal of Power Sources. 378, 527-536 (2018).
- Ren, D., et al. Model-based thermal runaway prediction of lithium-ion batteries from kinetics analysis of cell components. Applied Energy. 228, 633-644 (2018).
- Chen, Z., et al. Electrochemical degradation mechanism and thermal behaviors of the stored LiNi0.5Co0.2Mn0.3O2 cathode materials. ACS Applied Materials & Interfaces. 10, 25454-25464 (2018).
- Yu, H. -. Y., Zhang, D., Zhu, Z., Lu, Q. Thermal reactivity study of spinel lithium titanium oxide material for lithium ion battery by thermal and spectral analysis. Journal of Power Sources. 257, 96-101 (2014).
- Zhuang, G. V., Ross, P. N. Analysis of the chemical composition of the passive film on li-ion battery anodes using attentuated total reflection infrared spectroscopy. Electrochemical and Solid-State Letters. 6, 136 (2003).
- Shurtz, R. C., Engerer, J. D., Hewson, J. C. Predicting high-temperature decomposition of lithiated graphite: Part II. Passivation layer evolution and the role of surface area. Journal of The Electrochemical Society. 165, 3891-3902 (2018).
- Mao, B., Huang, P., Chen, H., Wang, Q., Sun, J. Self-heating reaction and thermal runaway criticality of the lithium ion battery. International Journal of Heat and Mass Transfer. 149, 119178 (2020).
- Watanabe, I., Yamaki, J. Thermalgravimetry-mass spectrometry studies on the thermal stability of graphite anodes with electrolyte in lithium-ion battery. Journal of Power Sources. 153, 402-404 (2006).
- Fernandes, Y., Bry, A., de Persis, S. Identification and quantification of gases emitted during abuse tests by overcharge of a commercial Li-ion battery. Journal of Power Sources. 389, 106-119 (2018).
- Feng, X., et al. Investigating the thermal runaway mechanisms of lithium-ion batteries based on thermal analysis database. Applied Energy. 246, 53-64 (2019).
- Kissinger, H. E. Variation of peak temperature with heating rate in differential thermal analysis. Journal of Research of the National Bureau of Standards. 57, 2712 (1956).
- Kissinger, H. E. Reaction kinetics in differential thermal analysis. Analytical Chemistry. 29, 1702-1706 (1957).
- Kriston, A., Podias, A., Adanouj, I., Pfrang, A. Analysis of the effect of thermal runaway initiation conditions on the severity of thermal runaway-Numerical simulation and machine learning study. Journal of The Electrochemical Society. 167, 90555 (2020).
- Ruiz Ruiz, V., et al. The effect of charging and discharging lithium iron phosphate-graphite cells at different temperatures on degradation. Journal of Visualized Editors: JoVE. , e57501 (2018).
- National Institute of Standards and Technology. NIST Chemistry Workbook. National Institute of Standards and Technology. , (2018).
- Sun, Y. -. Y., Hsieh, T. -. Y., Duh, Y. -. S., Kao, C. -. S. Thermal behaviors of electrolytes in lithium-ion batteries determined by differential scanning calorimeter. Journal of Thermal Analysis and Calorimetry. 116, 1175-1179 (2014).
- Larsson, F., Anderson, J., Andersson, P., Mellander, B. E. Thermal modelling of cell-to-cell fire propagation and cascading thermal runaway failure effects for lithium-ion battery cells and modules using fire walls. Journal of the Electrochemical Society. 163, 2854-2865 (2016).
- Peng, P., Jiang, F. Thermal behavior analyses of stacked prismatic LiCoO2 lithium-ion batteries during oven tests. International Journal of Heat and Mass Transfer. 88, 411-423 (2015).
- An, S. J., et al. The state of understanding of the lithium-ion-battery graphite solid electrolyte interphase (SEI) and its relationship to formation cycling. Carbon. 105, 52-76 (2016).
- Malmgren, S., et al. Consequences of air exposure on the lithiated graphite SEI. Electrochimica Acta. 105, 83-91 (2013).
- Murray, V., Hall, D. S., Dahn, J. R. A guide to full coin cell making for academic researchers. Journal of The Electrochemical Society. 166, 329-333 (2019).
- Kasnatscheew, J., et al. A tutorial into practical capacity and mass balancing of lithium ion batteries. Journal of The Electrochemical Society. 164, 2479-2486 (2017).
- Mei, W., Jiang, L., Liang, C., Sun, J., Wang, Q. Understanding of Li-plating on graphite electrode: detection, quantification and mechanism revelation. Energy Storage Materials. 41, 209-221 (2021).
- Waldmann, T., Hogg, B. -. I., Wohlfahrt-Mehrens, M. Li plating as unwanted side reaction in commercial Li-ion cells - A review. Journal of Power Sources. 384, 107-124 (2018).
- PAT-Core: Lower Plunder Configurator. EL-Cell GmbH Available from: https://el-cell.com/pat-series/the-pat-core-concept/lower-plunger-configurator/ (2021)
- Günter, F. J., Burgstaller, C., Konwitschny, F., Reinhart, G. Influence of the electrolyte quantity on lithium-ion cells. Journal of The Electrochemical Society. 166, 1709-1714 (2019).
- An, S. J., et al. Correlation of electrolyte volume and electrochemical performance in lithium-ion pouch cells with graphite anodes and NMC532 cathodes. Journal of The Electrochemical Society. 164, 1195-1202 (2017).
- Benhammada, A., Trache, D. Thermal decomposition of energetic materials using TG-FTIR and TG-MS: a state-of-the-art review. Applied Spectroscopy Reviews. 55, 724-777 (2020).
- Ryou, M. -. H., et al. Effects of lithium salts on thermal stabilities of lithium alkyl carbonates in SEI layer. Electrochimica Acta. 83, 259-263 (2012).
- Mao, C., et al. Balancing formation time and electrochemical performance of high energy lithium-ion batteries. Journal of Power Sources. 402, 107-115 (2018).
- Bandhauer, T. M., Garimella, S., Fuller, T. F. A critical review of thermal issues in lithium-ion batteries. Journal of the Electrochemical Society. 158, 1-25 (2011).
- Andersson, A. M., Herstedt, M., Bishop, A. G., Edström, K. The influence of lithium salt on the interfacial reactions controlling the thermal stability of graphite anodes. Electrochimica Acta. 47, 1885-1898 (2002).
- Chen, Z., et al. Multi-scale study of thermal stability of lithiated graphite. Energy & Environmental Science. 4, 4023-4030 (2011).
- Waldmann, T., et al. Electrochemical, post-mortem, and ARC analysis of li-ion cell safety in second-life applications. Journal of the Electrochemical Society. 164, 3154-3162 (2017).
- Haik, O., et al. On the thermal behavior of lithium intercalated graphites. Journal of the Electrochemical Society. 158, 913-923 (2011).
- Solchenbach, S., Metzger, M., Egawa, M., Beyer, H., Gasteiger, H. A. Quantification of PF 5 and POF 3 from side reactions of LiPF 6 in li-ion batteries. Journal of The Electrochemical Society. 165, 3022-3028 (2018).
- El Ouatani, L., et al. Surface film formation on a carbonaceous electrode: Influence of the binder chemistry. Journal of Power Sources. 189, 72-80 (2009).
- Li, J., Zhang, Z. R., Guo, X. J., Yang, Y. The studies on structural and thermal properties of delithiated LixNi1/3Co1/3Mn1/3O2 (0 Solid State Ionics. 177, 1509-1516 (2006).
- Fleischhammer, M., Waldmann, T., Bisle, G., Hogg, B. -. I., Wohlfahrt-Mehrens, M. Interaction of cyclic ageing at high-rate and low temperatures and safety in lithium-ion batteries. Journal of Power Sources. 274, 432-439 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon