Method Article
الحقن المجهري لنطاط الذرة ، Peregrinus maidis ، الأجنة لتحرير جينوم CRISPR / Cas9
In This Article
Summary
فيما يلي بروتوكولات لجمع وحقن أجنة نطاط الذرة قبل الخلوية لغرض تعديل الجينوم الخاص بها عن طريق تحرير الجينوم القائم على CRISPR / Cas9 أو لإضافة عناصر قابلة للنقل ملحوظة من خلال تحويل الخط الجرثومي.
Abstract
نطاط نبات الذرة ، Peregrinus maidis ، هو آفة من الذرة وناقل للعديد من فيروسات الذرة. تصف الطرق المنشورة سابقا تحفيز تداخل الحمض النووي الريبي (RNAi) في P. maidis من خلال الحقن المجهري للحمض النووي الريبي المزدوج (dsRNAs) في الحوريات والبالغين. على الرغم من قوة الحمض النووي الريبي ، فإن الأنماط الظاهرية المتولدة عن طريق هذه التقنية عابرة وتفتقر إلى الوراثة المندلية طويلة الأجل. لذلك ، يجب توسيع صندوق أدوات P. maidis ليشمل أدوات جينومية وظيفية من شأنها أن تمكن من إنتاج سلالات متحولة مستقرة ، مما يفتح الباب أمام الباحثين لتقديم طرق مكافحة جديدة للتأثير على هذه الآفة المهمة اقتصاديا. ومع ذلك ، على عكس dsRNAs المستخدمة في RNAi ، فإن المكونات المستخدمة في تحرير الجينوم القائم على CRISPR / Cas9 وتحويل الخط الجرثومي لا تعبر بسهولة أغشية الخلايا. نتيجة لذلك ، يجب حقن الحمض النووي البلازميد و / أو الحمض النووي الريبي و / أو البروتينات في الأجنة قبل أن يتحول الجنين إلى الخلايا ، مما يجعل توقيت الحقن عاملا حاسما للنجاح. وتحقيقا لهذه الغاية ، تم تطوير طريقة وضع البيض القائمة على الأغاروز للسماح بحصاد الأجنة من إناث P. maidis على فترات قصيرة نسبيا. هنا يتم توفير بروتوكولات مفصلة لجمع وحقن أجنة P. maidis قبل الخلوية بمكونات CRISPR (Cas9 nuclease الذي تم تعقيده مع الحمض النووي الريبي التوجيهي) ، ويتم تقديم نتائج الضربة القاضية الجينية المستندة إلى Cas9 لجين P. maidis بلون العين ، أبيض. على الرغم من أن هذه البروتوكولات تصف تحرير جينوم CRISPR / Cas9 في P. maidis ، إلا أنه يمكن استخدامها أيضا لإنتاج P. maidis المعدلة وراثيا عن طريق تحويل الخط الجرثومي ببساطة عن طريق تغيير تكوين محلول الحقن.
Introduction
نطاط نبات الذرة ، Peregrinus maidis ، هو آفة مهمة اقتصاديا للذرة1،2،3. إنها تسبب أضرارا جسدية مباشرة للنبات ، سواء أثناء الرضاعة بأجزاء الفم الماصة للثقب ، وأثناء التكاثر عندما تضع أجنةها مباشرة في الأنسجة النباتية 2,4. على الرغم من الطرق المتعددة للضرر المباشر للمحاصيل ، فإن التأثير الأكبر لهذه الحشرات على صحة المحاصيل غير مباشر ، من خلال العمل كناقل لفيروس موزاييك الذرة (MMV) وفيروس شريط الذرة 5,6. MMV قادر على التكاثر في جسم ناقل P. maidis ، مما يسمح للفيروس بالاستمرار في الحشرات الفردية طوال حياتها ، حتى يتمكنوا من الاستمرار في نشر الفيروس إلى النباتات المضيفة الجديدة 7,8. الطرق الأكثر شيوعا للسيطرة على P. maidis ، وبالتالي الفيروسات التي تنقلها ، هي المبيدات الحشرية.
لسوء الحظ ، تسبب سوء إدارة هذه المنتجات في تطوير المقاومة في الآفة المستهدفة وكذلك تلوث البيئة9. لذلك ، هناك حاجة إلى استراتيجيات جديدة للحد من خسائر المحاصيل من هذا المزيج من الحشرات / الفيروسات والآفات. أظهر العمل السابق أن تداخل الحمض النووي الريبي (RNAi) يمكن أن يكون طريقة تحكم فعالة ل P. maidis لأنها عرضة لخفض التنظيم في التعبير الجيني حتى عند تناول الحمض النووي الريبي المزدوج (dsRNA) 10. ومع ذلك ، فإن الطريقة الأكثر فعالية لإدارة dsRNA في الحقل ستكون من خلال النباتات التي تتغذى عليها الحشرات. وبالتالي ، يمكن أن تظل المحاصيل عرضة لأي فيروسات تحملها الحشرات بالفعل. مع ظهور تحرير جينوم CRISPR / Cas9 ، أصبحت استراتيجيات مكافحة الآفات الجديدة ممكنة ، بما في ذلك محرك الجينات القائم على Cas911,12 ، والذي يمكن استخدامه لتقليل حجم مجموعة الآفات ، أو لاستبدال السكان المذكورين بأفراد مقاومين للفيروسات التي ينقلونها.
ومع ذلك ، فإن تطوير ونشر أي نوع من أنظمة محرك الجينات سيتطلب تطوير تقنيات محورة وراثيا. لم تكن هذه الطرق ضرورية لإجراء تجارب الحمض النووي الريبي في P. maidis لأنه من المفترض أن تكون dsRNAs و / أو siRNAs قادرة على عبور أغشية الخلايا بسبب كفاءة RNAi في P. maidis10،13. هذا لا ينطبق على الحمض النووي و / أو البروتينات المستخدمة في الجينات المحورة التقليدية أو في تحرير الجينات القائمة على Cas9 ، وكلاهما سيكون مقدمة لإنشاء حشرات تحمل محركا جينيا. لإنجاز تحرير الجينات أو أشكال أخرى من التحول الجرثومي ، يتم حقن هذه الحمض النووي والبروتينات بشكل مثالي في الأجنة خلال مرحلة البلاستوديرم المخلوي ، قبل وقت تعدد خلايا جنين الحشرات. التوقيت أمر بالغ الأهمية ، لأن المرحلة المخلوية هي الجزء الأول من التطور14,15. نظرا لأن إناث P. maidis تضع بيضها بشكل تفضيلي في الأنسجة النباتية ، فإن استخراج كميات كافية من الأجنة قبل الخلوية للحقن المجهري يمكن أن يكون كثيف العمالة ويستغرق وقتا طويلا. لذلك ، تم تطوير تقنيات جديدة لجمع أجنة P. maidis وحقنها الدقيق بسرعة قبل الخلوية.
Protocol
1. تربية P. maidis البالغة على مستوى المستعمرة
- ازرع ما لا يقل عن أربعة أواني من الذرة أسبوعيا لكل قفص تربية ، مع 3-4 بذور لكل وعاء. تنمو في بيئة خالية من الحشرات.
- عندما يبلغ عمر النباتات ~ 5 أسابيع ، ضعها داخل قفص 30 سم × 30 سم × 60 سم.
- احصل على كمية كافية من P. maidis البالغة (~ 500) من مختبر الأبحاث أو البرية ، وضعها في قفص مقاوم للحشرات مع 9-12 نبات ذرة (3-4 أواني).
- الحفاظ على المستعمرة في حاضنة تربية الحشرات عند 25 درجة مئوية (± 1 درجة مئوية) ، مع رطوبة 70٪ على الأقل ودورة ضوئية 14:10.
- لتوليد مستعمرة معايرة حسب العمر ، قم بإزالة جميع البالغين الأوائل بعد أربعة أيام من وضع البيض ، واترك الأجنة الموضوعة في القفص تفقس وتتقدم في العمر بشكل طبيعي.
- انقل حشرات P. maidis البالغة من العمر 5 أسابيع (البالغين) إلى نباتات الذرة الطازجة للاستزراع الفرعي الأسبوعي عن طريق التجميع باستخدام شفاط (الشكل 1). ثم حرر البالغين في قفص نظيف مع نباتات الذرة الطازجة. للحفاظ على إمدادات ثابتة من الشباب للأغراض التجريبية ، قم بإعداد أقفاص جديدة معايرة حسب العمر كل أسبوع.
- سقي الأواني في الأقفاص مرتين يوميا. قم بقص السيقان بشكل دوري ، وإزالة المواد النباتية المتحللة ، واستبدالها بأواني الذرة الطازجة حسب الحاجة.
ملاحظة: مع الصيانة المناسبة ، يمكن أن تستمر المستعمرة ~ 5 أسابيع (أي طويلة بما يكفي للأجنة الموضوعة في القفص لتصبح بالغة).
2. غرفة وضع البيض القائمة على الأغاروز
- اصنع أطباق جمع البيض (وسط وضع البيض) عن طريق سكب 1٪ وزن / وزن أغاروز في الماء في أطباق بتري نظيفة 100 مم × 15 مم. قم بتخزين وسط وضع البيض عند 4 درجات مئوية بعد أن يصلب.
- تحضير 10٪ وزن / فولت محلول السكروز لتغذية البالغين. قم بتخزين محلول السكروز في درجة حرارة -20 درجة مئوية لمدة تصل إلى شهر.
- اصنع حجرة لحمل البالغين عن طريق قطع ثقب في قاع كوب سعة 1 أونصة (انظر جدول المواد) ولصق شاشة فوق الفتحة لتبادل الهواء (الشكل 2).
- قطع فيلم شمع البارافين البلاستيكي إلى مربعات 5 سم × 5 سم ؛ توضع جانبا 2 مربعات لكل كوب.
- جمع ~ 15 1 من الإناث البالغات من العمر أسبوع من مستعمرة P. maidis معايرة العمر. لاختيار الإناث ، افحص الجانب البطني من البطن ، وابحث عن ovipositor ، والذي عادة ما يكون أغمق من بقية البطن (الشكل 3). احتفظ بالبالغين لمدة تصل إلى ساعة واحدة في قنينة مخروطية سعة 15 مل في حالة إعداد غرف متعددة لوضع البيض. برد الحشرات لفترة وجيزة على الثلج قبل ممارسة الجنس وانقلها إلى حاوية البالغين.
ملاحظة: يمكن إجراء هذا الفحص بدون مجهر. الإناث البالغات اللواتي لديهن وقت للتغذية والتزاوج عادة ما يكون لديهن بطون أكبر من الذكور البالغين وأكثر قابلية للانقياد. وبالتالي ، يمكن اختيارهم بسهولة أكبر من مجموعة أقفاص. - نقل الإناث في حاوية الكبار ، وختم الكأس مع 1 طبقة من فيلم شمع البارافين البلاستيك عن طريق تمديده بالتساوي 3-4 أضعاف حجمه الأصلي (الشكل 4A ، B).
- ضع 400 ميكرولتر من محلول السكروز 10٪ w / v على الجزء العلوي من ختم فيلم شمع البارافين البلاستيكي ، وأضف طبقة ثانية من فيلم شمع البارافين البلاستيكي ، وتمتد فيلم شمع البارافين البلاستيكي تماما كما هو مذكور أعلاه (الشكل 4C ، D).
ملاحظة: شطيرة فيلم شمع البارافين البلاستيكي الممتد تضغط على محلول السكروز ، وهو أمر مهم جدا لتغذية البالغين ، ولكنه لن يمنع الإناث من ثقب المبيضات الخاصة بها على طول الطريق إلى وسط وضع البيض. - ضع حجرة البالغين على طبق جمع البيض مع جانب فيلم شمع البارافين البلاستيكي مباشرة على وسط وضع البيض ، ولف غرفة وضع البيض بأكملها بغلاف بلاستيكي دون تغطية فتحات الهواء ، لأنها مطلوبة لتبادل الهواء (الشكل 5).
- احتضان كل غرفة وضع البيض في 25 درجة مئوية مع رطوبة 70٪ ودورة ضوئية 14:10.
- قم بتغيير شطيرة فيلم شمع البارافين البلاستيكي ومحلول السكروز 10٪ بدون وزن / وزن يوميا ، وقم بإزالة أي ماء يتراكم داخل الكوب.
3. جمع الأجنة ومحاذاتها في بيئة عالية الرطوبة
- قم بإعداد نظام حقن مجهري قائم على المجهر المجسم في مساحة أو غطاء مرطب (غطاء مرطب ؛ الشكل 6) لضمان أن بيئة العمل تحقق رطوبة بنسبة 70٪ على الأقل طوال عملية الحقن المجهري.
- تحقق من وسط وضع البيض للبيض بعد فترة وضع البيض المطلوبة. افعل ذلك في غطاء مرطب أو بيئة رطبة أخرى.
ملاحظة: كانت فترة وضع البيض المستخدمة عادة بين عشية وضحاها ، من الساعة 6 مساء حتى الساعة 10 صباحا ، واستمرت ~ 16 ساعة. - إذا تم وضع أي بيض في الأغاروز ، فاستخدم ملقطا دقيقا لحفره بعناية ، وضعه على سطح الأغاروز للحفاظ على رطوبته (الشكل 7 أ).
- ضع شريطا من 1 مم × 15 مم على شريط على الوجهين مقاس 22 مم × 30 مم (الشكل 7 ب). ضع جانب شريط الغطاء لأعلى على وسط وضع البيض (الشكل 7 ج).
- التقط كل بيضة فردية من سطح أجار ، وانتقل إلى الشريط على الوجهين باستخدام فرشاة ناعمة. قم بإزالة أي بيض أبيض تماما أو به لون أسود. البيض الصحي سيكون شبه شفاف.
- ضع البيض على شكل موز على جانبه ، مع تعليق الطرف الأكبر على الشريط على الوجهين (الشكل 7 د).
ملاحظة: احتفظ دائما بالبيض في بيئة عالية الرطوبة ، مثل طبق بتري المصبوب بطبقة من 1٪ أجار في الأسفل.
4. تحضير كواشف كريسبر وإبر الحقن
- اسحب إبر الكوارتز باستخدام مجتذب ماصة دقيقة من النوع المشتعل / البني.
- شطبة إبر الكوارتز باستخدام شطبة ميكروماصة.
- استخدم شريطا لاصقا على الوجهين لتثبيت الإبر المسحوبة في وعاء شفاف ، مثل طبق بتري ، حتى تصبح جاهزة للاستخدام.
- قم بإعداد محلول الحقن عن طريق الجمع بين 0.5 ميكرولتر من بروتين Cas9 (محلول مخزون 5 ميكروغرام / ميكرولتر) و 0.5 ميكرولتر من sgRNA (محلول مخزون 4 ميكروغرام / ميكرولتر ؛ انظر جدول المواد) مع 1 ميكرولتر من المخزن المؤقت الأحمر الفينول في حجم نهائي قدره 5 ميكرولتر. لترسيب الجسيمات التي يمكن أن تسد الإبرة ، دوامة الحل لفترة وجيزة ، وأجهزة الطرد المركزي لمدة 3 دقائق بأقصى سرعة.
- ردم إبرة الحقن ، مع الحرص على ترك مزيج الحقن بالقرب من الطرف المدبب للإبرة. قم بإزالة الفقاعات ، إن وجدت ، من طرف الإبرة.
- ضع الإبرة المملوءة بعناية في حامل الإبرة ، وشد طوق الفولاذ المقاوم للصدأ لتثبيت الإبرة بإحكام في مكانها أثناء الحقن المجهري.
- قم بتوليد تدفق موثوق لمحلول الحقن من الإبرة عن طريق ضرب الطرف المشطوف برفق باستخدام فرشاة طلاء دقيقة ومبللة ، مع توصيل دفعات من ضغط الهواء إلى الإبرة باستخدام نظام الحقن.
ملاحظة: تكون الإبرة جاهزة للحقن عندما يترك مزيج الحقن الطرف بكميات صغيرة.
5. الحقن المجهري ورعاية ما بعد الحقن
- قم بإعداد منصة حقن مجهرية عن طريق ملء طبق بتري نظيف مقاس 100 مم × 15 مم بأجار 1٪ لتشكيل طبقة مستوية من الآجار تتدفق مع الجزء العلوي من الطبق.
- ضع قسيمة غطاء معدة مسبقا مع ~ 25 جنينا على منصة أجار (الشكل 8 أ).
ملاحظة: يجب إجراء جميع خطوات الحقن داخل غطاء مرطب (~ 70٪ رطوبة). - تحقق من ضغط الحقن عن طريق وضع طرف الإبرة في قطرة ماء وبدء دورة الحقن.
ملاحظة: يجب أن تنتشر كمية صغيرة من محلول الحقن في الماء إذا كان إعداد الضغط صحيحا (الشكل 8 ب). - أدخل الإبرة في الطرف الأكبر من الجنين ، واقترب من الجانب الأيسر من غطاء الغطاء (الشكل 8C). قم بتوصيل محلول الحقن في البويضة ، واسحب الإبرة بسرعة.
- بعد حقن جميع البيض ، ضع الغطاء على سطح طبق أجار جديد بنسبة 1٪ ، وانقل الطبق إلى غرفة الرطوبة (الشكل 9).
6. حضانة وفقس الأجنة
- ضع غرفة الفقس في حاضنة 25 درجة مئوية لمدة 6 أيام.
- انقل أي أجنة على قيد الحياة ، باستخدام الماء النظيف وفرشاة ناعمة ، إلى طبق بتري 35 مم × 10 مم مع ورق ترشيح مبلل بالماء يغطي قاع الطبق. أغلق طبق بتري بغشاء شمع البارافين البلاستيكي ، وامسكه عند 25 درجة مئوية للسماح للأجنة بالفقس. ابدأ بفحص الأجنة بعد 6 أيام من الحقن للبقاء على قيد الحياة.
ملاحظة: ستبدأ الحوريات الأولى في الفقس في حوالي اليوم 8. - انقل الحوريات ، باستخدام فرشاة ناعمة ، إلى طبق بتري يحتوي على قصاصات أوراق. غطي الطبق وختمه بغشاء شمع البارافين البلاستيكي.
- احتضان طبق الفقس المختوم على قصاصات الأوراق لمدة 48 ساعة عند 25 درجة مئوية.
- نقل جميع الحوريات البالغة من العمر 2 يوم من جولة من الحقن إلى قفص تربية مع نباتات الذرة باستخدام فرشاة ناعمة. إذا تم استرداد الحقن ذات النمط الظاهري المرئي بأعداد كافية ، فقم بتربيتها بشكل منفصل لتحقيق أقصى قدر من استعادة السمة المستهدفة في الجيل التالي. خلاف ذلك ، أداء التزاوج الشامل لجميع الحقن.
ملاحظة: ضع صغار الدجاج برفق في دوامة نبات الذرة لتوفير الملجأ وضمان الرطوبة المناسبة لبيئتها المباشرة. - قم بتربية الحشرات في الظروف الموضحة أعلاه ، مع ضمان درجة الحرارة المناسبة والرطوبة والنقل المنتظم إلى نباتات الذرة الطازجة.
- ذرية الشاشة للأنماط الظاهرية المتوقعة. ضع الأفراد الذين يظهرون النمط الظاهري المطلوب في قفصهم الخاص لإنشاء خطوط متماثلة الزيجوت.
النتائج
تم تصميم غرفة وضع البيض خصيصا لتمكين إناث P. maidis من الرضاعة أثناء وضع البيض في وسط وقائي يمكن من خلاله استعادة بيضها بسهولة. باستخدام هذه الطريقة ، تم استرداد كميات كافية من الأجنة قبل الخلوية للحقن المجهري باستخدام الحمض النووي و / أو الحمض النووي الريبي و / أو البروتينات. عادة ما تضع إناث P. maidis البالغة البيض داخل أنسجة أوراق نباتات الذرة ، مما يجعل الحصول على ما يكفي من البيض في فترة زمنية قصيرة تحديا لأنه يتطلب الكثير من تشريح الأوراق. توفر بيئة وضع البيض الاصطناعي حلا للتغلب على هذه المشاكل. كما هو موضح في الجدول 1 ، تم جمع 6,483 بيضة من إجمالي 645 أنثى في 4 أسابيع. تبدأ الإناث عادة في وضع البيض بعد اليوم 2 وتوفر معظم البيض من اليوم 4 إلى اليوم 6. تباطأ نشاط وضع البيض بحلول اليوم 9. تم إنشاء كل غرفة وضع البيض يوم الجمعة وفحصها بحثا عن البيض من الأحد حتى يوم الأحد التالي. سمح اتباع هذا الجدول الزمني بجمع معظم البويضات للحقن المجهري خلال أسبوع العمل.
كان أول تطبيق عملي لنظام وضع البيض هذا هو اختبار فعالية الضربة القاضية الجينية بوساطة Cas9 ، باستخدام P. maidis ortholog لجين لون العين ، الأبيض (Pmw) ، كهدف. من المعروف أن الطفرات في اللون الأبيض تؤدي إلى فقدان كبير لتصبغ العين في أنواع الحشرات الأخرى ، والأبيض مستقل عن الخلايا ، مما يسمح باكتشاف الطفرات في الأفراد الذين تم حقنهم16,17. لزيادة فرصة أن تؤدي حتى طفرة صغيرة إلى فقدان الوظيفة ، تم تصميم الحمض النووي الريبي الموجه للقطع داخل منطقة الكاسيت المرتبط ب ATP ، وهو أمر ضروري للوظيفة البيضاء16. تم حقن أجنة P. maidis إما ب 20٪ أحمر الفينول (مخزن الحقن) ، أو محلول الحقن مع Cas9 بتركيز نهائي قدره 800 نانوغرام / ميكرولتر (تحكم Cas9) ، أو Cas9 في محلول الحقن جنبا إلى جنب مع ثلاثة RNAs إرشادية مضافة بتركيز 400 نانوغرام / ميكرولتر لكل منها. كان الهدف من الجمع بين ثلاثة أدلة في مزيج حقن واحد هو زيادة فرص توليد الطفرات إلى أقصى حد ، سواء عن طريق إنشاء حذف كبير ، أو عن طريق التعويض عن احتمال أن يكون أي دليل واحد غير فعال للقطع. كانت معدلات النمو لكل علاج قابلة للمقارنة (الجدول 2) ، حيث أظهر 50-60٪ من الأفراد الذين تم حقنهم علامات التطور. كانت معدلات الفتحة للمخزن المؤقت وأدوات التحكم Cas9 قابلة للمقارنة أيضا. ومع ذلك ، كانت معدلات الفقس للأفراد الذين يتلقون مزيج الأدلة الثلاثة أقل نسبيا. في هذا الوقت ، من غير الواضح ما إذا كان انخفاض البقاء على قيد الحياة ناتجا عن فقدان الوظيفة البيضاء أو نتيجة لعواقب غير مقصودة لمزيج الأدلة الثلاثة ، مثل التأثيرات غير المستهدفة (انظر قسم المناقشة). ومع ذلك ، لم يفقس أي من الأفراد الذين يعانون من فقدان كامل لتصبغ العين (أي الضربة القاضية الكاملة) ، ولم يكن لدى أي من ذرية الأفراد الذين تم حقنهم عيون بيضاء. تم التحقق من الفعالية المستهدفة للطفرات المستندة إلى Cas9 بطريقتين. أولا ، تم فحص الحقن لفقدان تصبغ العين.
من بين 71 فردا تم حقنهم بالدليل ، أظهر 23 درجة معينة من فقدان الصباغ (الشكل 10) ، وفقس 9 من هؤلاء الأفراد ، مما أدى إلى معدل خروج المغلوب بنسبة ≥32٪. لم يلاحظ فقدان صبغة العين في أي من العلاجين الضابطين. ثانيا ، تم تأكيد الطفرات الكروموسومية عن طريق تفاعل البوليميراز المتسلسل (PCR) 18 والتسلسل19. نظرا لعدم إمكانية استعادة الخط الطافر ، تم تحليل الحمض النووي الجينومي من برك من الأجنة المحقونة إما بمزيج ثلاثي الأدلة أو عازلة. من المتوقع أن يزيل المزيج ثلاثي الأدلة ~ 180 زوجا أساسيا من الموضع الأبيض . يمكن ملاحظة ذلك في منتجات تفاعل البوليميراز المتسلسل المضخمة من الحمض النووي الجينومي المعزول من الأفراد الذين تم حقنهم ، بالإضافة إلى بيانات التسلسل المرتبطة الناتجة عن تلك المنتجات (الشكل 11). تشير هذه الأدلة المجمعة إلى أن الأجنة تم حقنها قبل حدوث الخلوية.

الشكل 1: الشفاط. يمكن تجميع شفاط فعال من توصيل مضخة تفريغ عند المدخول ، عبر أنابيب بلاستيكية ، بأنبوب مخروطي بلاستيكي سعة 15 مل. يجب إزالة حوالي 0.5 سم بعناية من أسفل الأنبوب المخروطي. يجب وضع كرة قطنية في الأنبوب المخروطي ، فوق فتحة الأنبوب البلاستيكي ، للقبض على P. maidis البالغة أثناء جمعها وإبعادها عن مضخة التفريغ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: بناء حاويات للبالغين. (أ) الإمدادات اللازمة (في اتجاه عقارب الساعة من أعلى اليسار): شاشة ، مسدس غراء ساخن ، شفرة حلاقة ، حاوية 1 أونصة. (ب) يجب قطع ثقب كبير في قاع الحاوية سعة 1 أونصة ، ويتم قطع مربع من الشاشة كبير بما يكفي لتغطية هذه الفتحة. (ج) بعد ذلك، يتم لصق الشاشة فوق الفتحة باستخدام الغراء الساخن. (د) بمجرد ضبط الغراء، يجب إزالة أي شبكة زائدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: ممارسة الجنس مع P. maidis البالغين. تظهر الجوانب البطنية للذكور (يسار) والإناث (يمين ) P. maidis البالغين. المبيض ، المرئي فوق بطن الأنثى ، هو أوضح مؤشر على جنس الفرد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: ختم البالغين في حاويات . (أ) طبقة من شمع البارافين البلاستيكي مقاس 5 سم × 5 سم. (ب) يجب شد الفيلم بالتساوي إلى 3-4 أضعاف حجمه الأصلي. (ج) بمجرد وضع البالغين في حاوية البالغين، يجب وضع الفيلم الممتد فوق الفتحة لتثبيت البالغين. يجب بعد ذلك وضع قطرة 400 ميكرولتر من محلول السكروز بنسبة 10٪ وزن / وزن فوق الفيلم. (د) لتوفير ضغط تغذية كاف للبالغين، يجب تمديد طبقة ثانية مربعة بحجم 5 سم × 5 سم من طبقة البارافين البلاستيكية بالمثل ووضعها فوق قطرة السكروز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
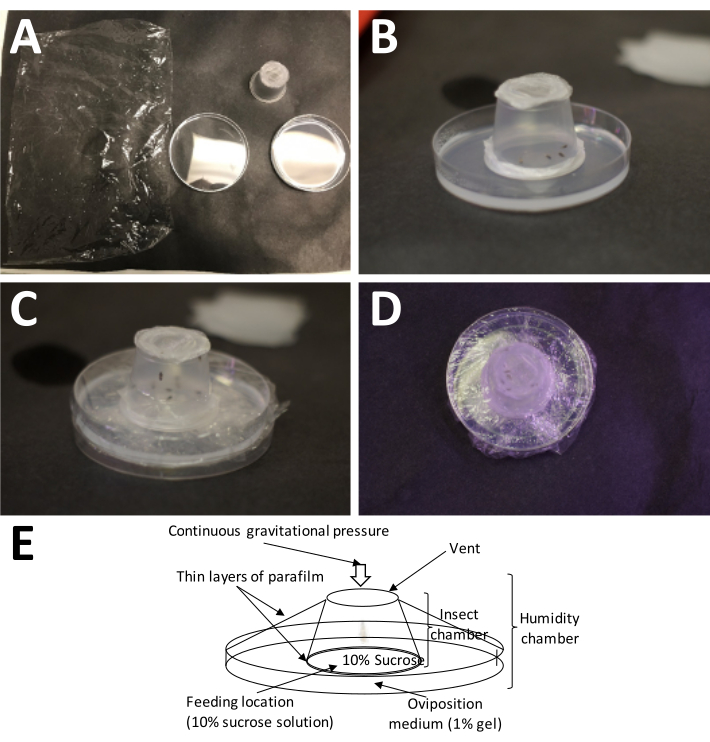
الشكل 5: إعداد غرفة وضع البيض. (أ) الإمدادات اللازمة (في اتجاه عقارب الساعة من أعلى اليسار): غلاف بلاستيكي ، حاوية مكتملة للبالغين (مع البالغين) ، وطبق بتري مع 1٪ أغاروز (وسط وضع البيض). (ب) يجب وضع الحاوية البالغة على الأغاروز مع وضع فيلم البارافين البلاستيكي / 10٪ "شطيرة" السكروز مباشرة على وسط وضع البيض. (ج) يستخدم غلاف بلاستيكي لتثبيت الحاوية البالغة في وسط وضع البيض. هذا يمنع الوسط من الجفاف بسرعة كبيرة. (د) يجب توخي الحذر لتجنب تغطية شاشة حاوية البالغين ، بحيث يستمر تبادل الهواء. ه: مخطط لغرفة وضع البيض. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: شفاط مرطب. تم تركيب غطاء مزود بجهاز ترطيب حول نطاق الحقن لتقليل تيارات الهواء والحفاظ على الرطوبة أثناء التعامل مع الأجنة. يمكن طي اللوحات فوق المدخل بعد أن يكون العامل في مكانه ، للمساعدة في الحفاظ على مستويات الرطوبة المناسبة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
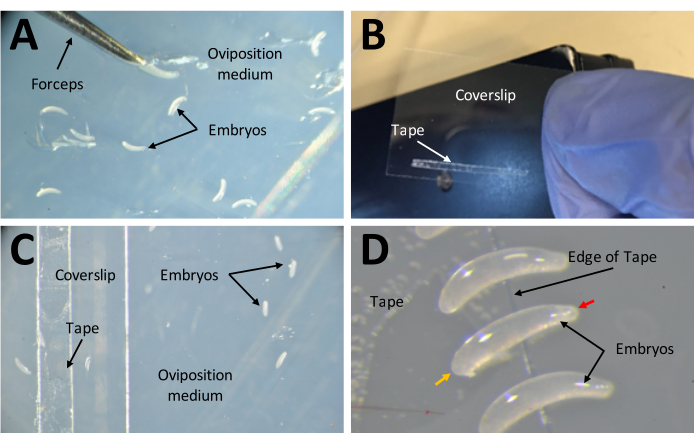
الشكل 7: جمع الأجنة استعدادا للحقن. أ: الأجنة التي ترسبت في وسط وضع البيض. يتم استخدام زوج من الملقط الدقيق لاستخراج الأجنة من الوسط ووضعها على سطحه. (ب) شريط ضيق من 1 مم × 15 مم على الوجهين على غطاء 22 مم × 30 مم. (ج) يمكن وضع غطاء الغطاء على وسط وضع البيض لسهولة نقل الأجنة من سطح الوسط إلى الشريط الموجود على قسيمة الغطاء. (د) أجنة P. maidis على شكل موزة، وأحد طرفيها أضيق من الطرف الآخر (الطرف الضيق مشار إليه برأس سهم أحمر؛ والطرف الأوسع مشار إليه برأس سهم أصفر في مثال الجنين). يجب وضع الطرف العريض للجنين على الشريط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
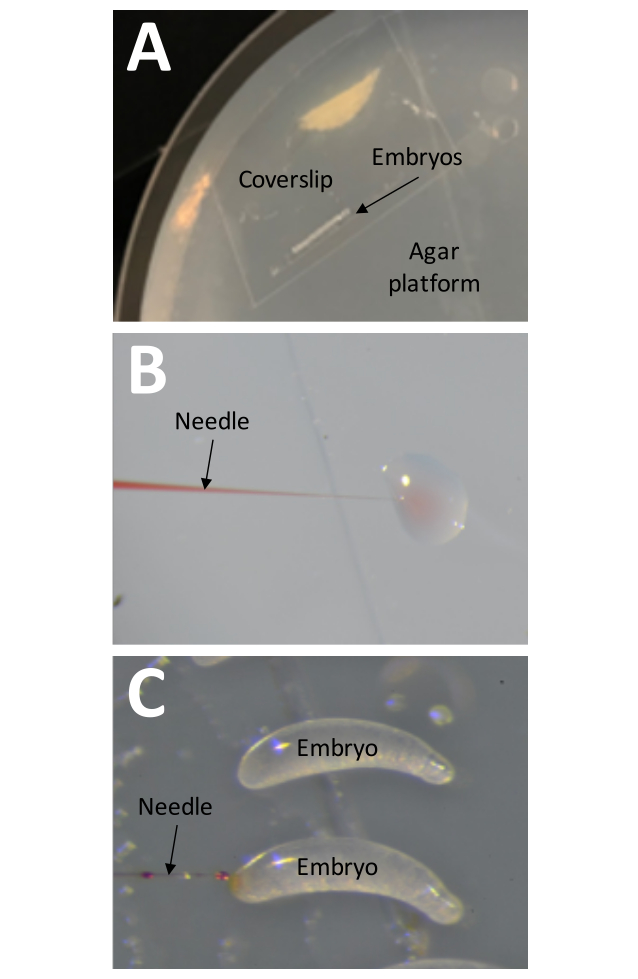
الشكل 8: الحقن . (أ) منصة الحقن عبارة عن طبق بتري مملوء حتى أسنانه بأجار 1٪. يجب وضع غطاء الغطاء مع شريط من الشريط الذي يحمل الأجنة مباشرة على سطح منصة الحقن. (ب) يجب اختبار ضغط الحقن قبل حقن الأجنة عن طريق "حقن" كمية صغيرة من محلول الحقن في قطرة ماء. يمكن أيضا استخدام هذه الطريقة في أي وقت أثناء عملية الحقن لفحص الإبرة بحثا عن الانسدادات. (ج) يجب حقن الأجنة عن طريق إدخال الإبرة في الطرف الأكبر من الجنين. يجب أن يكون محلول الحقن مرئيا إذا كان الحقن ناجحا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: رعاية ما بعد الحقن . (أ) بمجرد حقن جميع الأجنة الموجودة على غطاء ، يجب وضع غطاء الغطاء في طبق بتري طازج يحتوي على 1٪ أغاروز. (ب) يمكن بعد ذلك الاحتفاظ بطبق بتري مع غطاء الغطاء في غرفة رطوبة (مثل تلك الموضحة) حتى تفقس الأجنة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
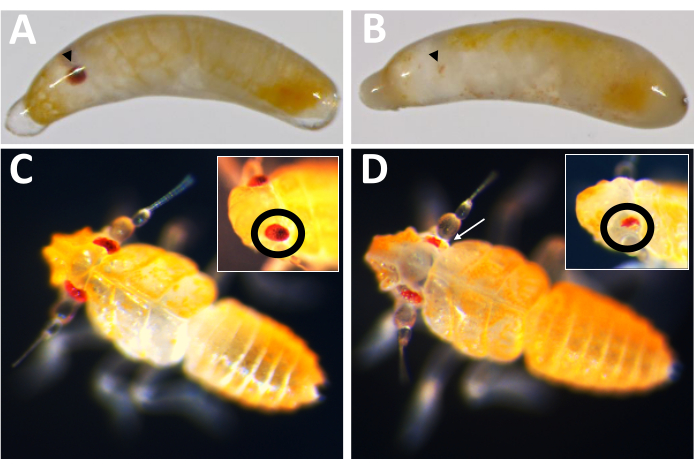
الشكل 10: النمط الظاهري للضربة القاضية PMW . (أ) التحكم المطابق للعمر و (ب) أجنة Pmw بالضربة القاضية ، مع عيون نامية يشار إليها برؤوس أسهم سوداء. الجنين في B هو فسيفساء ، حيث يمكن رؤية شريط صغير من التصبغ. (ج) التحكم المطابق للعمر و (د) تفريخ الضربة القاضية Pmw ، مع إدخال داخلي يظهر زاوية مختلفة على العينين. الفقس في D هو أيضا فسيفساء. يشير سهم أبيض إلى منطقة في الصورة الرئيسية تظهر فقدان التصبغ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
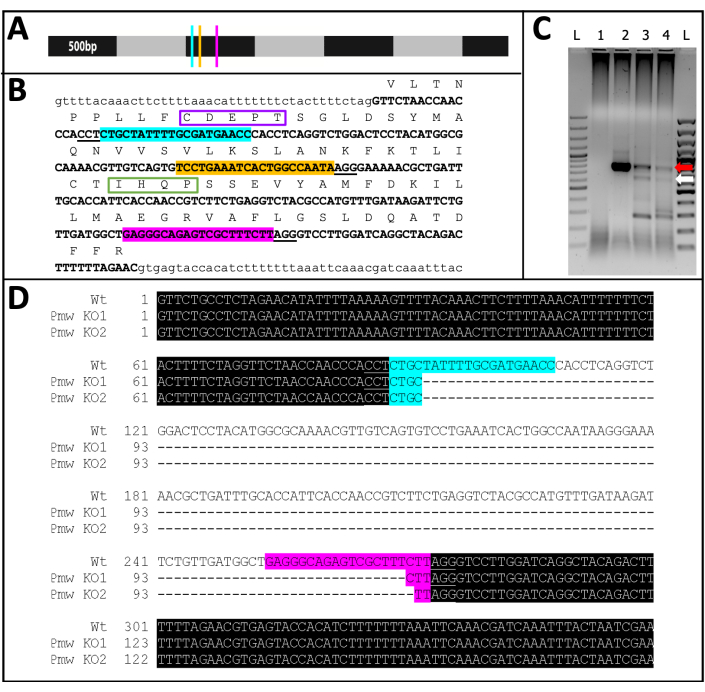
الشكل 11: تسلسل خروج المغلوب PMW . (أ) نموذج مصغر ل Pmw mRNA ، محدد بزيادات قدرها 500 نقطة أساس ، مع تحديد مواقع ربط gRNA: G1 ، أزرق ؛ G2 ، أصفر ؛ G3 ، وردي. أي طفرات في إزاحة الإطار يتم إنشاؤها في هذه المرحلة ستعطل غالبية منتج الترجمة. (ب) السياق الجينومي لمواقع gRNA ، كل ذلك في إكسون واحد (نص كبير غامق). يتم تمييز مواقع ربط الدليل بنفس ألوان A، ويتم تسطير PAMs. الامتداد هو ~ 300 نقطة أساس. تظهر الترجمة داخل الإطار ل exon أعلاه ، كاختصارات من حرف واحد في النص الكبير. تم تمييز اثنين من الزخارف الخاصة بناقلات صبغة العين. تم تغليف شكل CDEPT للمجال الوظيفي Walker B باللون الأرجواني ، وتم وضع شكل IHQP لمجال H-loop باللون الأخضر. كلا المجالين مهمان لوظيفة ناقل ATP. (ج) تم تضخيم المنطقة المستهدفة من Pmw باستخدام جولتين من تفاعل البوليميراز المتسلسل. تم فحص منتج الجولة الثانية على هلام بحثا عن دليل على تحول الحجم بسبب الإزالة الناجحة للمنطقة بين الأدلة. الممرات: L = سلم 100 bp ؛ 1 = التحكم في المياه PCR ؛ 2 = بيض محقون بمحلول عضوي ؛ 3-4 = مجموعتان منفصلتان من البيض المحقون بمزيج ثلاثي الإرشادات. فقط الأجنة التي تتلقى مزيج الدليل الثلاثي أنتجت كلا من WT band (السهم الأحمر) والشريط الناتج عن الاستئصال الكامل (السهم الأبيض). (د) للتأكد من هوية الشريط السفلي (السهم الأبيض)، تم تنقية هذا الحمض النووي واستنساخه وتتابعه. السطر العلوي هو تسلسل النوع البري. الخطان الآخران هما تتابعان من نسختين. ثلاث نسخ إضافية تتطابق مع التسلسل السفلي. يشير التمييز الأزرق إلى موقع الربط للدليل 1 ، بينما يشير التمييز الوردي إلى موقع الربط للدليل 3. في كلا الأليلين ، تم حذف المنطقة بأكملها بين هذين الموقعين الدليليين. الاختصارات: Pmw = Peregrinus maidis الجين الأبيض . gRNA = دليل الحمض النووي الريبي ؛ PAM = الشكل المجاور للفضاء الأولي ؛ ATP = أدينوسين ثلاثي الفوسفات. PCR = تفاعل البلمرة المتسلسل ؛ WT = النوع البري ؛ KO = خروج المغلوب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| جبر | # من الكؤوس | # من الإناث في كل كوب | # من البيض | مجموع # من البيض | |||||||
| اليوم 2 | اليوم 3 | اليوم 4 | اليوم 5 | اليوم 6 | اليوم 7 | اليوم 8 | اليوم 9 | ||||
| 1 | 10 | 15 | 0 | 26 | 166 | 355 | 530 | 193 | 91 | 37 | 1398 |
| 2 | 15 | 15 | 22 | 238 | 489 | 699 | 520 | 379 | 203 | 58 | 2608 |
| 3 | 8 | 15 | 0 | 57 | 230 | 190 | 116 | 80 | 34 | 1 | 708 |
| 4 | 10 | 15 | 0 | 226 | 446 | 519 | 301 | 179 | 24 | 15 | 1710 |
| مجموع | 43 | 15 | 23 | 547 | 1331 | 1763 | 1467 | 831 | 352 | 111 | 6483 |
الجدول 1: مجموعات البيض التمثيلية من بيئة وضع البيض الاصطناعي. يتم عرض البيانات من أربع مجموعات من أكواب جمع البيض ، مع بدء إحصاء البيض في اليوم الثاني بعد الإعداد ويستمر حتى اليوم التاسع.
| العلاج بالحقن | إجمالي الحقن | المجموع المتقدمة | مجموع الفقس | معدل التنمية (٪) | معدل الفقس (٪) |
| مخزن مؤقت | 39 | 20 | 12 | 51 | 31 |
| كاس 9 | 39 | 24 | 14 | 61 | 36 |
| Cas9 + Pmw gRNAs | 121 | 71 | 28 | 59 | 28 |
الجدول 2: معدلات البقاء على قيد الحياة والضربة القاضية من حقن 3 خلطات حقن مختلفة.
Discussion
جودة وضع البيض والتغذية
في الآونة الأخيرة ، حصل الباحثون الذين يعملون مع نوع ذي صلة ، Nilaparvata lugens ، على البيض الذي استخدموه للحقن المجهري مباشرة من الورقة ، مع الاحتفاظ بالبيض المحقون في أنسجة الأوراق حتى يفقس17. في حين أن هذه الطريقة القائمة على الأوراق وفرت بيئة طبيعية أكثر للتطور الجنيني ، إلا أنها زادت أيضا من فرص الإصابة بالعدوى وتلف البويضات أثناء عملية الإزالة. يوفر نظام وضع البيض الاصطناعي المقدم هنا بيئة أكثر اتساقا ويقلل من فرص تلف البيض من المناولة. من خلال إعداد أكواب وضع البيض يوم الجمعة ، تم جمع غالبية البيض المبيض خلال أسبوع عمل نموذجي ، لصالح أولئك الذين يقومون بأعمال الحقن المجهري. ومع ذلك ، فإن أحد التحذيرات لهذه الطريقة هو أن نقص العناصر الغذائية في النظام الغذائي لمحلول السكروز بنسبة 10٪ سيؤثر في النهاية على صحة الحشرات ، وعادة ما تبدأ الإناث في الكؤوس في الموت بعد 10 أيام فقط. تبدأ جودة البيض أيضا في الانخفاض بعد 6 أيام ، كما يتضح من زيادة البيض الميت أو غير الصحي. نتيجة لذلك ، من المهم أن تكون انتقائيا للبيض المستخدم في الحقن المجهري وعدم الاحتفاظ بالإناث بعد اليوم 6.
معدل البقاء على قيد الحياة والرطوبة
يبدو أن هناك عاملين حاسمين لبقاء الجنين من خلال عملية الحقن المجهري. يتمثل الجانب الأكثر تحديا في التعامل مع أجنة P. maidis في منعها من الجفاف بعد إزالتها من وسط وضع البيض وخلال الحقن المجهري. نظرا لأن البيض يوضع عادة داخل الأنسجة النباتية ، فإنه يفتقر إلى قشرة كافية لمنع الجفاف. حتى في غطاء المحرك المرطب ، فقدت مجموعات كاملة من البيض بسبب الجفاف. ومع ذلك ، يمكن أن تؤثر الرطوبة العالية بشكل مفرط أيضا على الحقن المجهري إذا تراكمت المياه على الشريط على الوجهين أو على النطاق. لسوء الحظ ، لم يكن من السهل عادة ملاحظة جفاف البيض أثناء عملية الحقن المجهري ، وكثيرا ما بدا طبيعيا حتى بعد 2 أو 3 أيام ، عندما أصبحت شفافة تماما ، ولم تظهر أي علامات على التطور.
يبدو أن جودة الإبرة تلعب أيضا دورا مهما في البقاء على قيد الحياة. يجب أن تكون الإبرة مشطوفة لتقليل الأضرار غير الضرورية للبيضة. عندما يتم حظر الإبرة ، فإن استخدام وظيفة المقاصة على الحاقن أثناء ضرب طرف الإبرة برفق باستخدام فرشاة طلاء مبللة (انظر الخطوة 4.7) عادة ما يعيد الإبرة إلى حالة وظيفية. بغض النظر ، يوصى بوضع كميات صغيرة فقط من محلول الحقن (~ 0.25 ميكرولتر) في كل إبرة والتحول إلى إبرة جديدة كل بضع شرائح (~ 50-60 بيضة) لضمان الحفاظ على جودة الإبرة طوال عملية الحقن.
جيل ناجح من النمط الظاهري بالضربة القاضية
لتحويل الخلايا الجرثومية بنجاح ، يجب إجراء الحقن المجهري للأجنة في أقرب وقت ممكن قبل الخلوي. اعتمادا على أنواع الحشرات ، تتراوح النافذة الزمنية لإكمال الحقن المجهري من ساعتين فقط إلى ما يصل إلى يوم كامل14،15،20. لا يزال من غير الواضح متى تخضع أجنة P. maidis لعملية خلوية. تم اختبار الضربة القاضية بوساطة Cas9 على أجنة لا تتجاوز 4 ساعات بعد وضع البويضة (pel) إلى ما يصل إلى 16 ساعة pel ، ولوحظت الأنماط الظاهرية المتوقعة في جميع التجارب ، مما يشير إلى أن جميع الحقن المجهري تم إجراؤها داخل نافذة ما قبل التخليق.
تم اختيار تقويم P. maidis لجين لون العين ، الأبيض ، لأنه كان من المتوقع أن يكون النمط الظاهري بالضربة القاضية سهل الفحص في الحقن بسبب طبيعته المستقلة للخلية. في الواقع ، كما هو متوقع ، كان من الممكن تحديد كل من الفسيفساء والضربة القاضية الكلية بوضوح بين الأجنة التي تتلقى خليط الحقن الذي يحتوي على Cas9 وتوجيه الحمض النووي الريبي. لسوء الحظ ، لم يفقس أي حقن بالضربة القاضية الكاملة ، وفشل التزاوج الجماعي للحقن الباقين على قيد الحياة في توليد ذرية بيضاء العينين. ومع ذلك ، تم إنشاء خط متحور بنجاح في وقت لاحق من خلال استهداف جين مختلف (Klobasa et al. ، قيد التقدم). قد يشير هذا إلى أن الفشل في إنشاء خط متحور أبيض يرجع على الأرجح إما إلى تأثيرات خارج الهدف (أي قطع Cas9 مناطق مهمة في أماكن أخرى من الجينوم) مما يولد طفرة قاتلة مرتبطة ارتباطا وثيقا ، أو إلى دور حرج غير متوقع للبيض في P. maidis.
تؤكد بيانات النمط الظاهري والجزيئي (الشكل 8 والشكل 9) أنه تم إنشاء ضربة قاضية كبيرة في الموضع الأبيض في عينة من الأجنة المحقونة ، مما قد يؤدي إلى فقدان كامل لوظيفة الجينات. علاوة على ذلك ، في حين أن الطفرات في اللون الأبيض قابلة للحياة في بعض الأنواع ، إلا أن هناك سابقة لانخفاض النشاط الأبيض ضارا21,22. ومع ذلك ، لا يمكن استبعاد التأثيرات خارج الهدف تماما. يتطلب التنبؤ بالأهداف المحتملة خارج الأهداف بيانات دقيقة لتسلسل الجينوم23 ، وهو ما يجعل الوضع الحالي للموارد الجينومية في P. maidis من المستحيل القيام به في هذا الوقت. بغض النظر ، مع هذه الأساليب الجديدة ، يمكن إجراء اختبار الجينات المستهدفة الأخرى بثقة ، حتى التحرك نحو المزيد من الجينات المحورة التقليدية في محاولة لجلب أدوات وراثية جديدة لهذه الآفة الخبيثة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
جامعة ولاية كارولينا الشمالية ، قسم علم الحشرات وأمراض النبات ، هي جزء من فريق يدعم برنامج حلفاء الحشرات التابع ل DARPA. وجهات النظر والآراء و / أو النتائج المعبر عنها هي آراء المؤلفين ولا ينبغي تفسيرها على أنها تمثل وجهات النظر أو السياسات الرسمية لوزارة الدفاع أو حكومة الولايات المتحدة. يعلن المؤلفون عدم وجود مصالح متنافسة. صممت MDL و DR و AEW المشروع وقدمت الحصول على التمويل وإدارة المشروع والموارد. قامت FC و WK و NG و MDL بتصميم وتصميم تجارب الحقن المجهري. OH تصور وتصميم طريقة وضع البيض. أجرى FC و WK التجارب. قام FC و WK بتحليل النتائج. وكتب FC و WK و NG و MDL المخطوطة. يود المؤلفون تقديم شكر خاص لكايل سوزانسكي وفيكتوريا بارنيت لمساعدتهما في الحفاظ على مستعمرات P. maidis.
Materials
| Name | Company | Catalog Number | Comments |
| 1 oz Containers | Dart | P100N | Adult container for egg-laying setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-103 | Serves as collection tube on vacuum aspirator setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-106 | For making 10% sucorose solution and for holding adults when chilling before screening |
| Aspirator | Bioquip | 1135A | For handling planthoppers |
| Vacuum Aspirator | Fischer Technical | LAV-3 | Vacuum for aspirating larger numbers of insects |
| Blue Spectrum LED Lights | Home Depot | GLP24FS/19W/LED | Grow lights for potted corn plants hoppers are feeding on |
| Cas9 | TrueCut Cas9 Protein v2 | A36498 | Endonuclease for cutting planthopper genes |
| Clear Vinyl Tubing | Home Depot | 3/8 in. I.D. x 1/2 in. O.D. x 10 ft. | Connects collection tube to pump on vacuum aspirator setup |
| Corn planthoppers | North Carolina State University | N/A | Request from Dr. Anna Whitfield's lab |
| Cotton balls | Genessee | 51-101 | Serves as a filter/insect catcher in collection tube on vacuum aspirator setup |
| Double sided tape | Scotch Double Sided Tape | NA | Holding eggs for microinjection |
| Early Sunglow corn | Park Seed Company | 05093-PK-N | Corn for rearing planthoppers |
| epTIPS Microloader Tips | Eppendorf | C2554691 | Backfilling needle loading tips |
| Femtojet Microinjection System | Eppendorf | 5247 | Controls injection pressure (12-20 psi, depending on needle bore size) |
| Nutri-Fly Drosophila Agar | Genessee | 66-103 | Substrate for everything except egg-laying dish |
| Fine forceps | Bioquip | 4731 | Egg handling |
| General Purpose LE Agarose | Apex | 20-102 | Substrate inn egg-laying dish (oviposition medium) |
| Guide RNA 1 - GGUUCAUCGCAAAAUAGCAG | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 2 - UCUGAAAUCACUGGCCAAUA | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 3 - GAGGGCAGAGUCGCUUUCUU | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Humidifyer | Homedics | UHE-CM45 | For providing humidity in humidified hood |
| Humidity chamber | Billups-Rothenberg | MIC-101 | For holding injected embryos until hatching |
| Insect rearing cages | Bioquip (special order) | Close to 1450 L (has plastic front and mesh fabric sides) | Cage for planthoppers on corn |
| Laser-based Micropipiette Puller | Sutter Instruments | P-2000/G | For making injection needles / Heat = 700, FIL = 4, VEL = 40, DEL = 170, PUL = 160 |
| Leica M165 FC Fluorescence Stereomicroscope | Leica | M165 FC | Planthopper screening |
| Microinjection Scope | Leica | MZ12-5 | Microinjection scope outfited with an XY stage |
| Micromanipulator | Narishige | MN-151 | For positioning microinjection needle |
| Micropipette beveler | Sutter Instruments | FG-BV10-D | For beveling injection needles / Used 'fine' graded plate at 20° angle |
| Microscope Stage | AmScope | GT100 X-Y Gliding Table | For positioning and moving embryos under microscope |
| Miniature Paint Brush | Testor #2 8733 | Sold in 3 pack 281206 | Fine paintbrushes for embryo handling |
| Needle Holder | Narishige | HI-7 | For holding the microinjection needle |
| Percival Incubator | Percival | I41VLH3C8 | Rearing injectees until hatch |
| Petri Dishes (100 x 15 mm) | VWR | 89038-968 | Making agar dish for egg-lay |
| pGEM-T Easy Vector System I cloning kit | Promega | A1360 | Cloning Pm white target site |
| Phenol Red | Sigma | 143-78-8 | Microinjection buffer |
| Plain Microscope Slides or coverslip | Fisher Scientific | 12-549-3 | Hold eggs for microinjection |
| Plasmid DNA Midi Kit | Zymo | D4200 | Purification of injection-ready plasmid DNAs |
| Plastic paraffin film | Pechiney Plastic Packaging | PM-996 | Roll size 4 in. x 125 ft |
| Plastic wrap | Glad ClingWrap Plastic Wrap | NA | Wrap the entire egg-laying chamber |
| Primer - PmW CRISPR check F1 - AAGGAATTTCTGGAGGTGAAA | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R1 - GATTCCTCGCTGTTGGGT | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check F3 - TCACAGACCCTGGTGCTAATC | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R3 - GTCCACAATCCACACTTCTGA | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Quartz capillaries | Sutter Instruments | QF100-50-10 | For making microinjection needles / O.D. 1 mm, I.D. 0.7 mm, 10 cm length |
| Screen (White Organza Fabric) | Joann Fabrics | 16023889 | For covering the adult container |
| Sparkleen | Fisher Scientific | 04-320-4 | Wash dishes |
| Sucrose | Fisher Scientific | BP220-1 | To make 10% sucorose solution |
References
- Namba, R., Higa, S. Y. Host plant studies of the corn planthopper, Peregrinus maidis (Ashmead) in Hawaii. Proceedings of the Hawaiian Entomological Society. 21, 105-108 (1971).
- Singh, B. U., Seetharama, N. Host plant interactions of the corn planthopper, Peregrinus maidis Ashm.(Homoptera: Delphacidae) in maize and sorghum agroecosystems. Arthropod-Plant Interactions. 2 (3), 163-196 (2008).
- Tsai, J. Occurrence of a corn disease in Florida transmitted by Peregrinus maidis. Plant Disease Reporter. 59 (10), 830-833 (1975).
- Chelliah, S., Basheer, M. Biological studies of Peregrinus maidis (Ashmead) (Araeopidae: Homoptera) on sorghum. Indian Journal of Entomology. 27, 466-471 (1965).
- Lastra, J., Esparza, J. Multiplication of vesicular stomatitis virus in the leafhopper Peregrinus maidis (Ashm.), a vector of a plant rhabdovirus. Journal of General Virology. 32 (1), 139-142 (1976).
- Nault, L. R., Ammar, E. -. D. Leafhopper and planthopper transmission of plant viruses. Annual Review of Entomology. 34 (1), 503-529 (1989).
- Ammar, E. -. D., Tsai, C. -. W., Whitfield, A. E., Redinbaugh, M. G., Hogenhout, S. A. Cellular and molecular aspects of rhabdovirus interactions with insect and plant hosts. Annual Review of Entomology. 54, 447-468 (2009).
- Barandoc-Alviar, K., Ramirez, G. M., Rotenberg, D., Whitfield, A. E. Analysis of acquisition and titer of Maize mosaic rhabdovirus in its vector, Peregrinus maidis (Hemiptera: Delphacidae). Journal of Insect Science. 16 (1), 14 (2016).
- Tsai, J. H., Steinberg, B., Falk, B. W. Effectiveness and residual effects of seven insecticides on Dalbulus maidis (Homoptera: Cicadellidae) and Peregrinus maidis (Homoptera: Delphacidae). Journal of Entomological Science. 25 (1), 106-111 (1990).
- Yao, J., Rotenberg, D., Afsharifar, A., Barandoc-Alviar, K., Whitfield, A. E. Development of RNAi methods for Peregrinus maidis, the corn planthopper. PloS One. 8 (8), 70243 (2013).
- Esvelt, K. M., Smidler, A. L., Catteruccia, F., Church, G. M. Emerging technology: concerning RNA-guided gene drives for the alteration of wild populations. Elife. 3, 03401 (2014).
- Gantz, V. M., Bier, E. The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science. 348 (6233), 442-444 (2015).
- Yao, J., Rotenberg, D., Whitfield, A. E. Delivery of maize mosaic virus to planthopper vectors by microinjection increases infection efficiency and facilitates functional genomics experiments in the vector. Journal of Virological Methods. 270, 153-162 (2019).
- Kimelman, D., Martin, B. L. Anterior-posterior patterning in early development: three strategies. Wiley Interdisciplinary Reviews: Developmental Biology. 1 (2), 253-266 (2012).
- Mito, T., Nakamura, T., Noji, S. Evolution of insect development: to the hemimetabolous paradigm. Current Opinion in Genetics & Development. 20 (4), 355-361 (2010).
- Grubbs, N., Haas, S., Beeman, R. W., Lorenzen, M. D. The ABCs of eye color in Tribolium castaneum: orthologs of the Drosophila white, scarlet, and brown Genes. Genetics. 199 (3), 749-759 (2015).
- Xue, W. H., et al. CRISPR/Cas9-mediated knockout of two eye pigmentation genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae). Insect Biochemistry and Molecular Biology. 93, 19-26 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments: JoVE. (63), e3998 (2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. Journal of Molecular Biology. 94 (3), 441-448 (1975).
- Chu, F. C., Wu, P. S., Pinzi, S., Grubbs, N., Lorenzen, M. D. Microinjection of Western Corn Rootworm, Diabrotica virgifera virgifera, embryos for germline transformation, or CRISPR/Cas9 genome editing. Journal of Visualized Experiments: JoVE. (134), e57497 (2018).
- Brent, C. S., Hull, J. J. RNA interference-mediated knockdown of eye coloration genes in the western tarnished plant bug (Lygus hesperus Knight). Archives of Insect Biochemistry and Physiology. 100 (2), 21527 (2019).
- Khan, S. A., Reichelt, M., Heckel, D. G. Functional analysis of the ABCs of eye color in Helicoverpa armigera with CRISPR/Cas9-induced mutations. Scientific Reports. 7 (1), 1-14 (2017).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved