Method Article
トウモロコシウンカ、 ペレグリヌスマイディス、CRISPR/Cas9ゲノム編集のための胚のマイクロインジェクション
要約
ここには、CRISPR/Cas9ベースのゲノム編集を介してゲノムを改変する目的で、または生殖系列形質転換を介して顕著な転移性要素を追加する目的で、前細胞トウモロコシウンカ胚を収集してマイクロ注入するためのプロトコルがあります。
要約
トウモロコシのウンカ、Peregrinus maidisは、トウモロコシの害虫であり、いくつかのトウモロコシウイルスのベクターです。以前に発表された方法は、ニンフおよび成体への二本鎖RNA(dsRNA)のマイクロインジェクションによるP.maidisにおけるRNA干渉(RNAi)の誘発を説明している。RNAiの力にもかかわらず、この技術によって生成された表現型は一過性であり、長期的なメンデル遺伝を欠いています。したがって、P. maidis toolboxを拡張して、安定した変異株の生産を可能にする機能的ゲノムツールを含める必要があり、研究者がこの経済的に重要な害虫に耐える新しい防除方法をもたらすための扉を開きます。しかし、RNAiに使用されるdsRNAとは異なり、CRISPR/Cas9ベースのゲノム編集および生殖細胞系列形質転換に使用される成分は、細胞膜を容易に通過しません。その結果、胚が細胞化する前にプラスミドDNA、RNA、および/またはタンパク質を胚にマイクロインジェクションする必要があり、注入のタイミングが成功の重要な要素になります。そのために、アガロースを用いた産卵法を開発し、比較的短い間隔でP. maidis 雌から胚を採取できるようにしました。本明細書には、CRISPR成分(ガイドRNAと複合体化されたCas9ヌクレアーゼ)を有する前細胞P. maidis 胚を収集およびマイクロ注入するための詳細なプロトコルが提供され、P. maidis 目の色遺伝子である白色のCas9ベースの遺伝子ノックアウトの結果が提示される。これらのプロトコルは、P. maidisにおけるCRISPR/Cas9ゲノム編集を記述していますが、注射液の組成を変更するだけで、生殖細胞系列形質転換を介してトランスジェニックP. maidisを製造するためにも使用できます。
概要
トウモロコシのウンカ、ペレグリヌスマイディスは、トウモロコシ1,2,3の経済的に重要な害虫です。それらは、穿刺吸引口器で餌を与えている間、および胚を植物組織に直接産む生殖中の両方で、植物に直接物理的損傷を引き起こします2,4。作物への直接的な被害の複数の経路にもかかわらず、これらの昆虫が作物の健康に与える最大の影響は、トウモロコシモザイクウイルス(MMV)およびトウモロコシストライプウイルスのベクターとして機能することにより、間接的です5,6。MMVは、そのP. maidis ベクターの体内で複製することができ、ウイルスが一生を通じて個々の昆虫に存続することを可能にするため、ウイルスを新しい宿主植物に拡散し続けることができます7,8。P. maidis、したがってそれが媒介するウイルスを制御するための最も一般的な方法は殺虫剤です。
残念ながら、これらの製品の管理ミスは、標的害虫の耐性の発達と環境の汚染を引き起こしました9。したがって、この昆虫/ウイルス害虫の組み合わせによる作物の損失を減らすには、新しい戦略が必要です。これまでの研究では、RNA干渉(RNAi)は、二本鎖RNA(dsRNA)を摂取しても遺伝子発現のダウンレギュレーションを受けやすいため、P. maidisの効果的な制御方法となることが実証されました10。しかし、野外でdsRNAを投与する最も効果的な方法は、昆虫が餌とする植物を使用することです。したがって、作物は昆虫がすでに運んでいるウイルスの影響を受けやすい可能性があります。CRISPR/Cas9ゲノム編集の出現により、Cas9ベースの遺伝子ドライブ11,12を含む新しい害虫駆除戦略が可能になり、害虫集団のサイズを縮小したり、当該個体群をベクターウイルスに耐性のある個体に置き換えることができます。
しかし、あらゆる種類の遺伝子駆動システムの開発と展開には、トランスジェニック技術の開発が必要です。P. maidis では RNAi の効率により、dsRNA および/または siRNA が細胞膜を通過できると推定されるため、このような方法は P. maidis で RNAi 実験を行うのに必要ではなかった 10,13。これは、従来のトランスジェネシスやCas9ベースの遺伝子編集で採用されているDNAやタンパク質には当てはまらず、どちらも遺伝子ドライブを運ぶ昆虫を作る前兆となるでしょう。遺伝子編集または他の形態の生殖細胞系変換を達成するために、これらのDNAおよびタンパク質は、昆虫の胚が細胞化する前の合胞体胚葉段階で胚にマイクロインジェクションするのが理想的です。合胞子期は開発の最も初期の部分であるため、タイミングは重要です14,15。P. maidis の雌は植物組織に優先的に卵を産むため、マイクロインジェクションのために十分な量の前細胞胚を抽出することは、労働集約的で時間がかかる可能性があります。そのため、細胞化の前にP. maidis胚を迅速に収集してマイクロ注入するための新しい技術が開発されました。
プロトコル
1. P. maidis 成虫のコロニーレベルでの飼育
- 飼育ケージごとに週に最低4ポットのトウモロコシを植え、ポットごとに3〜4個の種子を植えます。昆虫のいない環境で育ちます。
- 植物が~5週齢になったら、30cm×30cm×60cmのケージに入れます。
- 研究所または野生から十分な量の P. maidis 成虫(~500)を入手し、9〜12個のトウモロコシ植物(3〜4鉢)が植えられた防虫ケージに入れます。
- コロニーを昆虫飼育インキュベーターで25°C(±1°C)、湿度70%以上、光サイクル14:10に維持します。
- 年齢調整されたコロニーを生成するには、4日間の産卵後にすべての初期成虫を取り除き、ケージに産まれた胚を孵化させて自然に老化させます。
- 5週齢の P. maidis 昆虫(成虫)を新鮮なトウモロコシ植物に移し、アスピレーターで採取して毎週継代培養します(図1)。次に、成虫を新鮮なトウモロコシの入ったきれいなケージに放します。実験目的で若年成人の安定した供給を維持するために、毎週新鮮な年齢調整されたケージを準備します。
- ケージ内のポットに毎日2回水をまきます。定期的に茎を切り取り、腐敗している植物材料を取り除き、必要に応じて新鮮なコーンポットと交換します。
注:適切なメンテナンスがあれば、コロニーは~5週間続くことがあります(つまり、ケージに置かれた胚が成虫になるのに十分な長さ)。
2. アガロース系産卵室
- きれいな100mm×15mmのペトリ皿に1%w/vアガロースを水に注ぎ、採卵皿(産卵培地)を作ります。産卵培地が固化した後、4°Cで保存する。
- 成人に給餌するための10%w / vショ糖溶液を調製します。ショ糖溶液を-20°Cで最大1か月間保存します。
- 1オンスのカップの底に穴を開け( 材料の表を参照)、空気交換のために穴の上にスクリーンを接着することにより、大人を保持するチャンバーを作ります(図2)。
- プラスチックパラフィンワックスフィルムを5 cm x 5 cmの正方形にカットします。カップごとに2つの正方形を取っておきます。
- 年齢調整された P. maidis コロニーから ~15 人の 1 週齢の成体雌を採取する。雌を選択するには、腹部の腹側を調べ、通常は腹部の他の部分よりも暗い産卵管を探します(図3)。複数の産卵室を設置する場合は、15 mLの円錐形バイアルに最大1時間成人を保持します。性別になる前に氷上で昆虫を短時間冷やし、成体の容器に移します。
注:この検査は顕微鏡なしで行うことができます。餌を与えて交尾する時間があった成人女性も、通常、成人男性よりも腹部が大きく、より従順です。したがって、ケージの個体群からより簡単に選択できます。 - メスを大人の容器に移し、カップを元のサイズの3〜4倍に均等に伸ばして、1層のプラスチックパラフィンワックスフィルムで密封します(図4A、B)。
- プラスチックパラフィンワックスフィルムシールの上部に400μLの10%w / vショ糖溶液を塗布し、プラスチックパラフィンワックスフィルムの2番目の層を追加して、プラスチックパラフィンワックスフィルムを上記とまったく同じように伸ばします(図4C、D)。
注:引き伸ばされたプラスチックパラフィンワックスフィルムのサンドイッチは、成人の摂食にとって非常に重要なショ糖溶液を加圧しますが、女性が産卵管を産卵培地に突き刺すのを防ぐことはできません。 - 成虫室を採卵皿の上に置き、プラスチックパラフィンワックスフィルム側を直接産卵培地の上に置き、空気交換に必要なため、産卵室全体を空気穴を覆わずにラップで包みます(図5)。
- 各産卵室を25°C、湿度70%、光サイクル14:10でインキュベートします。
- プラスチックパラフィンワックスフィルムと10%w / vショ糖溶液のサンドイッチを毎日交換し、カップ内に溜まった水を取り除きます。
3. 高湿度環境下での胚採取と位置合わせ
- 実体顕微鏡ベースのマイクロインジェクションシステムを加湿スペースまたはフード(加湿フード; 図6)作業環境がマイクロインジェクションプロセス全体で少なくとも70%の湿度を達成するようにします。
- 希望の産卵期間後に産卵培地で卵を確認します。加湿フードまたは別の湿気の多い環境でこれを行います。
注:通常使用される産卵期間は、午後6時から午前10時までの一晩で、~16時間続きました。 - アガロースに卵が産まれている場合は、細かい鉗子を使用して慎重に掘り出し、アガロースの表面に置いて湿らせます(図7A)。
- 22 mm x 30 mmのカバーガラスに1 mm x 15 mmの両面テープのストリップを貼り付けます(図7B)。カバーガラステープ面を上にして産卵培地の上に置きます(図7C)。
- 寒天表面から個々の卵を拾い上げ、細かいブラシを使用して両面テープに移動します。完全に白い卵や黒い色の卵を取り除きます。健康な卵は半透明になります。
- バナナの形をした卵を横に置き、大きい方の端を両面テープに貼り付けます(図7D)。
注意: 卵は、底に1%寒天の層が付いたペトリ皿など、常に高湿度の環境に保管してください。
4. CRISPR試薬および注射針の調製
- フレイミング/ブラウンタイプのマイクロピペットプーラーを使用して石英針を引きます。
- マイクロピペットベベルを使用して石英針を面取りします。
- 両面粘着テープを使用して、使用する準備ができるまで、引っ張った針をペトリ皿などの透明な容器に固定します。
- 0.5 μLのCas9タンパク質(5 μg/μLストック溶液)と0.5 μLのsgRNA(4 μg/μLストック溶液; 材料表を参照)を1 μLのフェノールレッドバッファーと最終容量5 μLで組み合わせて注射液を調製します。針を詰まらせる可能性のある粒子を沈殿させるには、溶液を短時間ボルテックスし、最高速度で3分間遠心分離します。
- 注射針の先細りの端近くに注射ミックスを残すように注意しながら、注射針を埋め戻します。もしあれば、針の先端から泡を取り除きます。
- 埋め戻された針をニードルホルダーに慎重に置き、ステンレス鋼のカラーを締めて、マイクロインジェクション中に針をしっかりと固定します。
- 注入システムで針に空気圧のバーストを供給しながら、細かい湿らせた絵筆で斜めの先端をそっとなでることにより、針から注入液の信頼性の高い流れを生成します。
注意: 注射混合物が少量で先端を離れる可能性がある場合、針は注射の準備ができています。
5.マイクロインジェクションとインジェクション後のケア
- 清潔な100 mm x 15 mmのペトリ皿に1%寒天を満たし、皿の上部と同じ高さの寒天の水平層を形成することにより、マイクロインジェクションプラットフォームを準備します。
- 事前に準備したカバーガラスを~25個の胚とともに寒天プラットフォームに置きます(図8A)。
注意: すべての注入手順は、加湿フード(湿度~70%)内で実行する必要があります。 - 針先を水滴に入れ、注入サイクルを開始して、射出圧力を確認します。
注意: 圧力設定が正しい場合、少量の注射液が水に分散するはずです(図8B)。 - カバーガラスの左側から近づいて、胚の大きい方の端に針を挿入します(図8C)。注射液を卵の中に届け、針を素早く引き抜きます。
- すべての卵を注入した後、カバーガラスを新しい1%寒天皿の表面に置き、皿を湿度チャンバーに移します(図9)。
6.胚の孵化と孵化
- 孵化室を25°Cのインキュベーターに6日間入れた。
- きれいな水と細かいブラシを使用して、生き残った胚を、皿の底を覆う水で湿らせたろ紙で35 mm x 10 mmのペトリ皿に移します。ペトリ皿をプラスチックパラフィンワックスフィルムで密封し、25°Cで保持して胚を孵化させます。生存のために注射の6日後に胚のチェックを開始します。
注:最初の齢のニンフは8日目頃に孵化し始めます。 - 細いブラシを使用して、ニンフを葉の切り抜きを含むペトリ皿に移します。皿を覆い、プラスチックパラフィンワックスフィルムで密封します。
- 孵化したばかりの子ガメの密封皿を葉の挿し木で25°Cで48時間インキュベートします。
- 細かいブラシを使用して、すべての2日齢のニンフを注射のラウンドからトウモロコシ植物のある飼育ケージに移します。目に見える表現型を持つ注射者が十分な数で回復した場合は、次世代の標的形質の回復を最大化するために、それらを別々に飼育します。それ以外の場合は、すべての注入者の大量嵌合を実行します。
注意: 孵化したばかりの子ガメをトウモロコシ植物の渦巻きにそっと置き、避難所を提供し、身近な環境の適切な湿度を確保します。 - 上記の条件で昆虫を飼育し、適切な温度、湿度、および新鮮なトウモロコシ植物への定期的な移動を確保します。
- 予想される表現型の子孫をスクリーニングします。目的の表現型を示す個体を自分のケージに入れて、ホモ接合系統を確立します。
結果
産卵室は、 P. maidis の雌が卵子を簡単に回収できる保護培地で産卵しながら餌を与えることができるように特別に設計されました。この方法を用いて、DNA、RNA、および/またはタンパク質をマイクロインジェクションするために十分な量の前細胞胚を回収した。成虫の P. maidis の雌は通常、トウモロコシ植物の葉の組織内に卵を産みますが、多くの葉の解剖が必要なため、短時間で十分な卵を得ることは困難です。人工産卵環境は、これらの問題を克服するための解決策を提供します。 表1に示すように、4週間で合計645頭の雌から6,483個の卵子が採取されました。女性は通常、2日目以降に産卵を開始し、4日目から6日目までほとんどの卵を提供します。産卵活動は9日目までに減速した。各産卵室は金曜日に設置され、日曜日から次の日曜日まで卵をチェックしました。このスケジュールに従うと、ほとんどの卵子を平日にマイクロインジェクションのために収集することができました。
この産卵システムの最初の実用化は、目の色遺伝子である白(Pmw)のP. maidis orthologを標的として、Cas9を介した遺伝子ノックアウトの有効性をテストすることでした。白の突然変異は、他の昆虫種の目の色素沈着の実質的な喪失をもたらすことが知られており、白は細胞自律的であり、注射された個体で突然変異を検出することを可能にする16,17。小さな突然変異でも機能が失われる可能性を高めるために、ガイドRNAは、ホワイト機能16に必要なATP結合カセットの領域内で切断するように設計されました。P. maidis 胚には、20% フェノールレッド(注射バッファー)、最終濃度800 ng/μLのCas9を含む注射バッファー(Cas9コントロール)、または注入バッファー中のCas9のいずれかを注入し、それぞれ400 ng/μLの濃度で添加した3つのガイドRNAを注入しました。1つのインジェクションミックス内の3つのガイドの組み合わせは、大きな欠失を作成することと、1つのガイドが切断に効果がない可能性を補うことの両方によって、変異体を生成する可能性をさらに最大化することを目的としていました。各治療の発達率は同等であり(表2)、注射された個人の50〜60%が発達の兆候を示しました。.バッファとCas9コントロールのハッチ率も同等でした。しかし、3ガイドミックスを受けた個体の孵化率は比較的低かった。現時点では、生存率の低下が白色機能の喪失の結果なのか、オフターゲット効果などの3つのガイドミックスの意図しない結果の結果なのかは不明です(ディスカッションセクションを参照)。しかし、眼の色素沈着が完全に失われた(すなわち、完全なノックアウト)個体はいずれも孵化せず、注射された個体の子孫のいずれも白い目を有していなかった。Cas9ベースの突然変異誘発のオンターゲット有効性は、2つの方法で検証されました。まず、注射対象者を眼の色素沈着の喪失についてスクリーニングした。
発症した71人のガイド注射個体のうち、23個体はある程度の色素喪失を示し(図10)、そのうち9個体は孵化し、ノックアウト率は≥32%でした。いずれの対照処置においても眼色素喪失は観察されなかった。第二に、ポリメラーゼ連鎖反応(PCR)18 およびシーケンシング19を介して染色体変異が確認されました。変異株を回収できなかったため、3ガイドミックスまたはバッファーのいずれかを注入した胚のプールからゲノムDNAを分析しました。3つのガイドミックスは、 白い 遺伝子座から~180塩基対を除去することが期待されています。これは、注射された個人から単離されたゲノムDNAから増幅されたPCR産物、およびそれらの産物から生成された関連する配列データで見ることができます(図11)。この組み合わせた証拠は、細胞化が起こる前に胚が注射されたことを示しています。

図1:アスピレーター。 効果的なアスピレーターは、プラスチックチューブを介して吸気口に真空ポンプを取り付けることから、15mLのプラスチック円錐管に組み立てることができます。円錐形のチューブの底から約0.5 cmを慎重に取り外す必要があります。綿球を円錐形のチューブのプラスチックチューブの開口部の上に配置して、 P.maidis の成虫が収集されるときにキャッチし、真空ポンプから遠ざける必要があります。 この図の拡大版を表示するには、ここをクリックしてください。

図2:成人用コンテナの構造。 (A)必要な消耗品(左上から時計回り):スクリーン、ホットグルーガン、かみそりの刃、1オンスの容器。(B)1オンスの容器の底に大きな穴を開け、この穴を覆うのに十分な大きさのスクリーンを正方形に切ります。(C)次に、ホットグルーを使用してスクリーンを穴に接着します。(D)接着剤をセットしたら、余分なメッシュを取り除く必要があります。 この図の拡大版を表示するには、ここをクリックしてください。

図3:性別P .メイド成人 。 オス(左)とメス(右) のP. maidis 成虫の腹側が示されています。女性の腹部の上に見える産卵管は、個人の性別の最も明確な指標です。 この図の拡大版を表示するには、ここをクリックしてください。

図4:大人を容器に密封する 。 (A)5cm×5cm角のプラスチックパラフィンワックスフィルム。(B)フィルムは、元のサイズの3〜4倍に均等に伸ばす必要があります。(C)成虫が成体の容器に入れられたら、引き伸ばされたフィルムを開口部の上に置き、成虫を固定する必要があります。次に、10%w/vショ糖溶液の400 μL滴をフィルムの上に置きます。(D)成人に適切な給餌圧力を与えるために、2番目の5 cm x 5 cmの正方形のプラスチックパラフィンフィルムを同様に引き伸ばし、スクロースの滴の上に置く必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
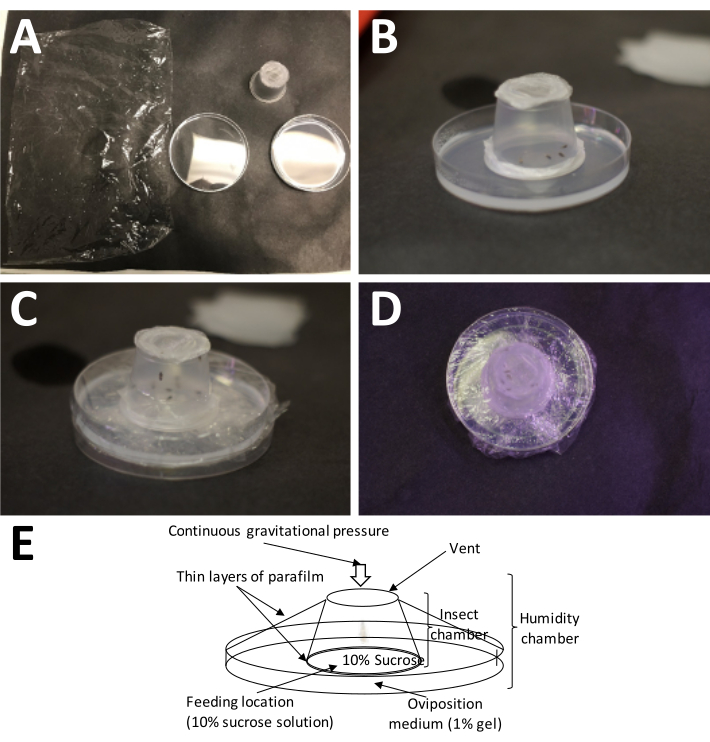
図5:産卵室の設置 。 (A)必要な物資(左上から時計回り):ラップ、完成した成人用容器(成人用)、および1%アガロース(産卵培地)を含むペトリ皿。(B)成体容器をアガロースの上に置き、プラスチックパラフィンフィルム/10%スクロース「サンドイッチ」を産卵培地に直接置く必要があります。(C)ラップは、成体容器を産卵培地に固定するために使用されます。これにより、培地の乾燥が早すぎるのを防ぎます。(D)空気交換が継続できるように、成人用コンテナの画面を覆わないように注意する必要があります。(E)産卵室の図。 この図の拡大版を表示するには、ここをクリックしてください。

図6:加湿フード。 注入スコープの周りに加湿器を装備したフードが設置され、空気の通風を最小限に抑え、胚の取り扱い中に湿度を維持します。作業者が所定の位置に配置された後、フラップを入り口に折りたたむことができ、適切な湿度レベルを維持するのに役立ちます。 この図の拡大版を表示するには、ここをクリックしてください。
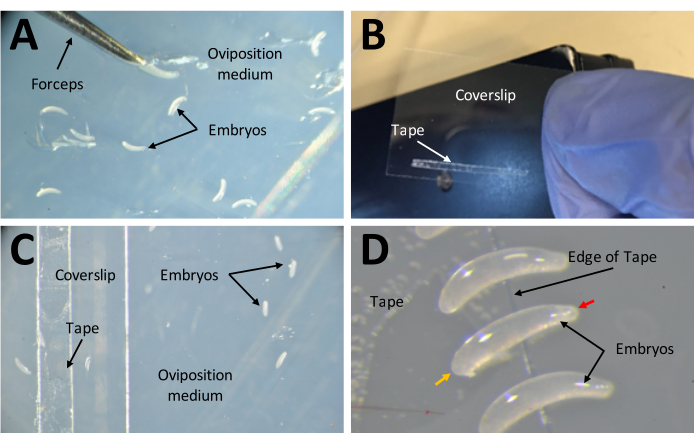
図7:注射の準備として胚を採取 する。 (A)産卵培地に沈着した胚。一対の細かい鉗子を使用して、培地から胚を抽出し、それらをその表面に配置する。(B)22 mm x 30 mmのカバーガラスに1 mm x 15 mmの両面テープの細いストリップ。(C)カバーガラスは、培地の表面からカバーガラス上のテープに胚を移すことを容易にするために、産卵培地上に置くことができる。(D) P. maidis 胚はバナナの形をしており、一方の端がもう一方の端よりも狭い(狭い端は赤い矢印の頭で示され、広い端は黄色の矢印の頭で示されます)。胚の広い端をテープの上に置く必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
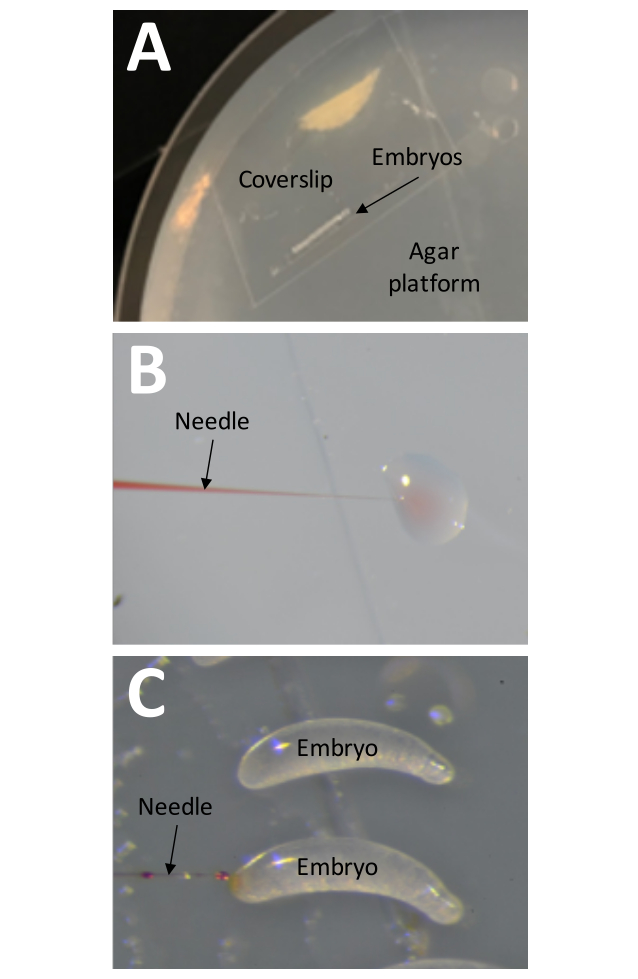
図8:注射。 (A)注入プラットフォームは、1%寒天で縁まで満たされたペトリ皿です。胚を保持するテープのストリップを備えたカバーガラスは、注射プラットフォームの表面に直接配置する必要があります。(B)注入圧力は、胚が注入される前に、少量の注射液を水滴に「注入」することによってテストする必要があります。この方法は、注射プロセス中にいつでも針の詰まりをチェックするためにも使用できます。(C)胚は、胚の大きい方の端に針を挿入することによって注入する必要があります。注射が成功した場合、注射液が見えるはずです。 この図の拡大版を表示するには、ここをクリックしてください。

図9:注射後のケア 。 (A)カバーガラス上のすべての胚が注入されたら、カバーガラスを1%アガロースを含む新鮮なペトリ皿に入れる必要があります。(B)カバーガラス付きのペトリ皿は、胚が孵化するまで湿度チャンバー(図のような)に維持することができます。 この図の拡大版を表示するには、ここをクリックしてください。
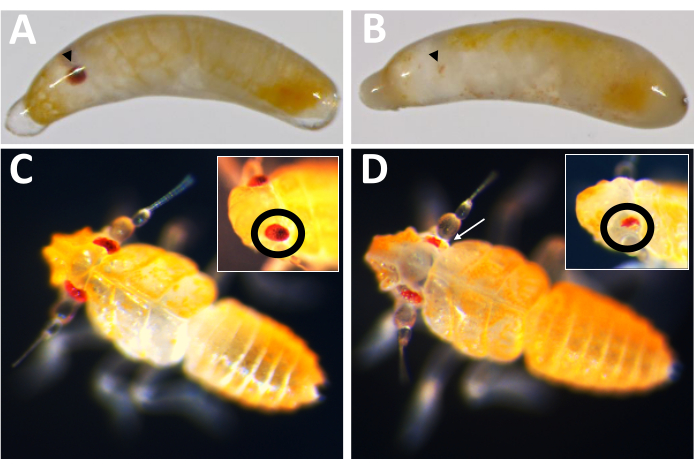
図10: Pmw ノックアウト表現型。 (A)年齢を一致させたコントロールおよび(B) Pmw ノックアウト胚、発達中の目は黒い矢じりで示されています。 B の胚はモザイクで、色素沈着の小さな縞模様が見られます。(C)年齢を一致させた対照と(D) Pmw ノックアウト孵化したばかりの子ガメで、挿入図は目に異なる角度を示しています。 D の孵化したばかりの子ガメもモザイクです。白い矢印は、色素沈着の喪失を示すメイン画像の領域を指しています。 この図の拡大版を表示するには、ここをクリックしてください。
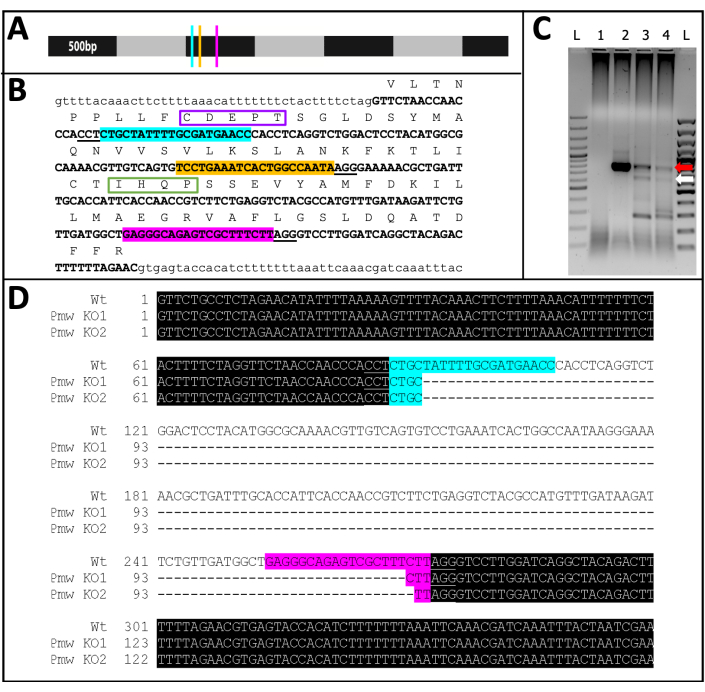
図11: Pmw ノックアウトシーケンス。 (A)500 bp刻みでマークされた Pmw mRNAのスケールモデルで、gRNA結合部位の位置が示されています:G1、青;G2、黄色。G3、ピンク。この時点で発生するフレームシフト変異は、翻訳製品の大部分を混乱させます。(B)gRNAサイトのゲノムコンテキスト、すべて1つのエクソン(太字の大文字のテキスト)。ガイド結合部位は Aと同じ色で強調表示され、PAMには下線が引かれます。スパンは~300 bpです。エクソンのフレーム内翻訳は、大文字のテキストの1文字の略語として上に示されています。眼色素トランスポーターに特有の2つのモチーフがマークされている。ウォーカーB機能ドメインのCDEPTモチーフは紫色で囲まれ、HループドメインのIHQPモチーフは緑色で囲まれています。どちらのドメインもATPトランスポーターの機能にとって重要です。(C) Pmw 標的領域を2ラウンドのPCRを用いて増幅した。第2ラウンドの製品は、ガイド間の領域の除去に成功したことによるサイズシフトの証拠についてゲル上で調べられました。レーン: L = 100 bp ラダー;1 = PCR水制御;2 =バッファー注入卵;3-4 =3つのガイドミックスを注入した2セットの卵。3ガイドミックスを受けた胚のみが、WTバンド(赤い矢印)と完全な切除から生じるバンド(白い矢印)の両方を産生した。(D)下(白矢印)バンドの同一性を確認するために、このDNAを精製、クローニング、および配列決定した。一番上の行は野生型の配列です。他の2行は、2つのクローンからのシーケンスです。さらに3つのクローンが一番下の配列と一致しました。青色のハイライトはガイド1の結合部位を示し、ピンク色のハイライトはガイド3の結合部位を示します。両方の対立遺伝子において、これら2つのガイド部位の間の領域全体が削除されている。略語: Pmw = ペレグリヌスマイディスホワイト 遺伝子;gRNA = ガイドRNA;PAM = プロトスペーサー隣接モチーフ;ATP =アデノシン三リン酸;PCR =ポリメラーゼ連鎖反応;WT =野生型;KO =ノックアウト。 この図の拡大版を表示するには、ここをクリックしてください。
| セット | # カップ数 | 各カップの女性の#数 | #卵の | 卵の合計#数 | |||||||
| 2日目 | 3日目 | 4日目 | 5日目 | 6日目 | 7日目 | 8日目 | 9日目 | ||||
| 1 | 10 | 15 | 0 | 26 | 166 | 355 | 530 | 193 | 91 | 37 | 1398 |
| 2 | 15 | 15 | 22 | 238 | 489 | 699 | 520 | 379 | 203 | 58 | 2608 |
| 3 | 8 | 15 | 0 | 57 | 230 | 190 | 116 | 80 | 34 | 1 | 708 |
| 4 | 10 | 15 | 0 | 226 | 446 | 519 | 301 | 179 | 24 | 15 | 1710 |
| トータル | 43 | 15 | 23 | 547 | 1331 | 1763 | 1467 | 831 | 352 | 111 | 6483 |
表1:人工産卵環境からの代表的な採卵 。4セットの採卵カップのデータが表示され、卵の集計はセットアップ後2日目から9日目まで続きます。
| 注射治療 | 注入総量 | 開発総数 | ハッチングされた合計 | 開発率(%) | ハッチ率(%) |
| バッファ | 39 | 20 | 12 | 51 | 31 |
| キャス9 | 39 | 24 | 14 | 61 | 36 |
| Cas9 +Pmw gRNA | 121 | 71 | 28 | 59 | 28 |
表2:3つの異なる注射ミックスの注射による生存率とノックアウト率。
ディスカッション
産卵の質と栄養
最近、近縁種である Nilaparvata lugensと協力している研究者は、マイクロインジェクションに使用した卵を葉から直接入手し、注入された卵を孵化するまで葉の組織に保持しました17。この葉ベースの方法は、胚発生のためのより自然な環境を提供しましたが、それはまた、除去プロセス中の感染や卵の損傷の可能性を高めました。ここで紹介する人工産卵システムは、より均一な環境を提供し、取り扱いによる卵への損傷の可能性を減らします。金曜日に産卵カップを設置することにより、産卵卵の大部分は、マイクロインジェクション作業を行う人々の利益のために、典型的な週の作業中に収集されました。ただし、この方法の注意点の1つは、10%ショ糖溶液ダイエットの栄養素の不足が最終的に昆虫の健康に影響を及ぼし、カップ内の女性は通常、わずか10日後に死に始めることです。死んだ卵や不健康な卵の増加によって証明されるように、卵の質も6日後に低下し始めます。その結果、マイクロインジェクションに使用される卵を選択し、6日目以降は雌を飼わないことが重要です。
生存率と湿度
マイクロインジェクションプロセスによる胚の生存には、2つの要因が重要であるように思われます。 P. maidis 胚の取り扱いで最も困難な側面は、産卵培地から取り出した後、およびマイクロインジェクション全体を通して、胚が乾燥しないようにすることです。卵は通常植物組織の中に産まれるため、脱水を防ぐための適切な殻がありません。加湿されたフードでさえ、卵のセット全体が乾燥のために失われました。ただし、湿度が高すぎると、両面テープやスコープに水が溜まると、マイクロインジェクションにも影響を与える可能性があります。残念ながら、卵の脱水は通常、マイクロインジェクションプロセス中に気付くのは容易ではなく、2〜3日後に完全に透明になり、発達の兆候を示さないまで、正常に見えることがよくありました。
針の質も生存に重要な役割を果たしているようです。卵への不必要な損傷を最小限に抑えるために、針を面取りする必要があります。針が詰まった場合、湿らせた絵筆で針の先端をそっと撫でながらインジェクターのクリア機能を使用すると(手順4.7を参照)、通常、針は機能状態に戻りました。いずれにしても、注射プロセス全体を通して針の品質を維持するために、各針に少量の注射液(~0.25 μL)のみを入れ、数回スライドごとに新しい針(~50〜60個の卵)に切り替えることをお勧めします。
ノックアウト表現型の生成に成功
生殖細胞をうまく形質転換するには、通常、細胞化の前にできるだけ早く胚マイクロインジェクションを行う必要があります。昆虫種に応じて、マイクロインジェクションを完了するための時間枠は、わずか数時間から丸一日の長さの範囲です14,15,20。P. maidis 胚がいつ細胞化を受けるかはまだ不明である。Cas9を介したノックアウトは、産卵後4時間から16時間までの若い胚でテストされ、予想される表現型がすべての実験で観察され、すべてのマイクロインジェクションがプレセル化ウィンドウ内で行われたことが示唆されました。
目の色遺伝子である白のP. maidis オルソログが選択されたのは、ノックアウト表現型が細胞自律性の性質により注射対象者でスクリーニングが容易であると予想されたためです。実際、予想通り、モザイクノックアウトとトータルノックアウトの両方が、Cas9とガイドRNAを含む注射混合物を受けた胚の間で明確に識別できました。残念ながら、完全なノックアウトの注射者は孵化せず、生き残った注射者の大量交配は白い目の子孫を生成することができませんでした。しかし、後に別の遺伝子を標的とすることで変異株が成功裏に生成された(Klobasa et al., 進行中)。これは、白色変異株の確立の失敗は、密接に関連した致死的突然変異を生成するオフターゲット効果(すなわち、Cas9がゲノムの他の場所で重要な領域を切断する)またはP. maidisの白色の予測不可能な重要な役割のいずれかによる可能性が最も高いことを示唆している。
表現型および分子データ(図8および図9)は、注射された胚のサンプルで白い遺伝子座の有意なノックアウトが作成され、遺伝子機能が完全に失われることを確認しています。さらに、白の突然変異は一部の種で実行可能ですが、白人の活動の低下が有害であるという前例があります21,22。とはいえ、オフターゲット効果を完全に排除することはできません。オフターゲットの可能性を予測するには、正確なゲノム配列データ23が必要であり、P. maidisのゲノムリソースの現在の状態は、現時点では不可能である。とにかく、これらの新しい方法では、他の標的遺伝子を自信を持ってテストすることができ、この有害な害虫に新しい遺伝的ツールをもたらすために、より伝統的な遺伝子導入に移行することさえできます。
開示事項
著者は開示するものは何もありません。
謝辞
ノースカロライナ州立大学昆虫学および植物病理学部は、DARPAの昆虫同盟プログラムをサポートするチームの一員です。表明された見解、意見、および/または調査結果は著者のものであり、国防総省または米国政府の公式見解または方針を表すものとして解釈されるべきではありません。著者は競合する利益を宣言しません。MDL、DR、およびAEWはプロジェクトを構想し、資金獲得、プロジェクト管理、およびリソースを提供しました。FC、WK、NG、およびMDLは、マイクロインジェクション実験を考案および設計しました。OHは産卵法を考案し、設計しました。FCとWKが実験を行った。FCとWKは結果を分析しました。FC、WK、NG、MDLが原稿を書きました。著者らは、 P. maidis コロニーの維持に協力してくれた Kyle Sozanski と Victoria Barnett に特別な感謝を捧げたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 1 oz Containers | Dart | P100N | Adult container for egg-laying setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-103 | Serves as collection tube on vacuum aspirator setup |
| 15 mL Conical Tubes | Olympus | Genesee 28-106 | For making 10% sucorose solution and for holding adults when chilling before screening |
| Aspirator | Bioquip | 1135A | For handling planthoppers |
| Vacuum Aspirator | Fischer Technical | LAV-3 | Vacuum for aspirating larger numbers of insects |
| Blue Spectrum LED Lights | Home Depot | GLP24FS/19W/LED | Grow lights for potted corn plants hoppers are feeding on |
| Cas9 | TrueCut Cas9 Protein v2 | A36498 | Endonuclease for cutting planthopper genes |
| Clear Vinyl Tubing | Home Depot | 3/8 in. I.D. x 1/2 in. O.D. x 10 ft. | Connects collection tube to pump on vacuum aspirator setup |
| Corn planthoppers | North Carolina State University | N/A | Request from Dr. Anna Whitfield's lab |
| Cotton balls | Genessee | 51-101 | Serves as a filter/insect catcher in collection tube on vacuum aspirator setup |
| Double sided tape | Scotch Double Sided Tape | NA | Holding eggs for microinjection |
| Early Sunglow corn | Park Seed Company | 05093-PK-N | Corn for rearing planthoppers |
| epTIPS Microloader Tips | Eppendorf | C2554691 | Backfilling needle loading tips |
| Femtojet Microinjection System | Eppendorf | 5247 | Controls injection pressure (12-20 psi, depending on needle bore size) |
| Nutri-Fly Drosophila Agar | Genessee | 66-103 | Substrate for everything except egg-laying dish |
| Fine forceps | Bioquip | 4731 | Egg handling |
| General Purpose LE Agarose | Apex | 20-102 | Substrate inn egg-laying dish (oviposition medium) |
| Guide RNA 1 - GGUUCAUCGCAAAAUAGCAG | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 2 - UCUGAAAUCACUGGCCAAUA | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Guide RNA 3 - GAGGGCAGAGUCGCUUUCUU | Synthego | CRISPRevolution sgRNA EZ Kit (1.5 nmol) | RNA guides for targeting planthopper white gene |
| Humidifyer | Homedics | UHE-CM45 | For providing humidity in humidified hood |
| Humidity chamber | Billups-Rothenberg | MIC-101 | For holding injected embryos until hatching |
| Insect rearing cages | Bioquip (special order) | Close to 1450 L (has plastic front and mesh fabric sides) | Cage for planthoppers on corn |
| Laser-based Micropipiette Puller | Sutter Instruments | P-2000/G | For making injection needles / Heat = 700, FIL = 4, VEL = 40, DEL = 170, PUL = 160 |
| Leica M165 FC Fluorescence Stereomicroscope | Leica | M165 FC | Planthopper screening |
| Microinjection Scope | Leica | MZ12-5 | Microinjection scope outfited with an XY stage |
| Micromanipulator | Narishige | MN-151 | For positioning microinjection needle |
| Micropipette beveler | Sutter Instruments | FG-BV10-D | For beveling injection needles / Used 'fine' graded plate at 20° angle |
| Microscope Stage | AmScope | GT100 X-Y Gliding Table | For positioning and moving embryos under microscope |
| Miniature Paint Brush | Testor #2 8733 | Sold in 3 pack 281206 | Fine paintbrushes for embryo handling |
| Needle Holder | Narishige | HI-7 | For holding the microinjection needle |
| Percival Incubator | Percival | I41VLH3C8 | Rearing injectees until hatch |
| Petri Dishes (100 x 15 mm) | VWR | 89038-968 | Making agar dish for egg-lay |
| pGEM-T Easy Vector System I cloning kit | Promega | A1360 | Cloning Pm white target site |
| Phenol Red | Sigma | 143-78-8 | Microinjection buffer |
| Plain Microscope Slides or coverslip | Fisher Scientific | 12-549-3 | Hold eggs for microinjection |
| Plasmid DNA Midi Kit | Zymo | D4200 | Purification of injection-ready plasmid DNAs |
| Plastic paraffin film | Pechiney Plastic Packaging | PM-996 | Roll size 4 in. x 125 ft |
| Plastic wrap | Glad ClingWrap Plastic Wrap | NA | Wrap the entire egg-laying chamber |
| Primer - PmW CRISPR check F1 - AAGGAATTTCTGGAGGTGAAA | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R1 - GATTCCTCGCTGTTGGGT | IDT | 25 nmole DNA Oligo | First-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check F3 - TCACAGACCCTGGTGCTAATC | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Primer - PmW CRISPR check R3 - GTCCACAATCCACACTTCTGA | IDT | 25 nmole DNA Oligo | Second-round Primer for amplifing across target site within the Pm white gene |
| Quartz capillaries | Sutter Instruments | QF100-50-10 | For making microinjection needles / O.D. 1 mm, I.D. 0.7 mm, 10 cm length |
| Screen (White Organza Fabric) | Joann Fabrics | 16023889 | For covering the adult container |
| Sparkleen | Fisher Scientific | 04-320-4 | Wash dishes |
| Sucrose | Fisher Scientific | BP220-1 | To make 10% sucorose solution |
参考文献
- Namba, R., Higa, S. Y. Host plant studies of the corn planthopper, Peregrinus maidis (Ashmead) in Hawaii. Proceedings of the Hawaiian Entomological Society. 21, 105-108 (1971).
- Singh, B. U., Seetharama, N. Host plant interactions of the corn planthopper, Peregrinus maidis Ashm.(Homoptera: Delphacidae) in maize and sorghum agroecosystems. Arthropod-Plant Interactions. 2 (3), 163-196 (2008).
- Tsai, J. Occurrence of a corn disease in Florida transmitted by Peregrinus maidis. Plant Disease Reporter. 59 (10), 830-833 (1975).
- Chelliah, S., Basheer, M. Biological studies of Peregrinus maidis (Ashmead) (Araeopidae: Homoptera) on sorghum. Indian Journal of Entomology. 27, 466-471 (1965).
- Lastra, J., Esparza, J. Multiplication of vesicular stomatitis virus in the leafhopper Peregrinus maidis (Ashm.), a vector of a plant rhabdovirus. Journal of General Virology. 32 (1), 139-142 (1976).
- Nault, L. R., Ammar, E. -. D. Leafhopper and planthopper transmission of plant viruses. Annual Review of Entomology. 34 (1), 503-529 (1989).
- Ammar, E. -. D., Tsai, C. -. W., Whitfield, A. E., Redinbaugh, M. G., Hogenhout, S. A. Cellular and molecular aspects of rhabdovirus interactions with insect and plant hosts. Annual Review of Entomology. 54, 447-468 (2009).
- Barandoc-Alviar, K., Ramirez, G. M., Rotenberg, D., Whitfield, A. E. Analysis of acquisition and titer of Maize mosaic rhabdovirus in its vector, Peregrinus maidis (Hemiptera: Delphacidae). Journal of Insect Science. 16 (1), 14 (2016).
- Tsai, J. H., Steinberg, B., Falk, B. W. Effectiveness and residual effects of seven insecticides on Dalbulus maidis (Homoptera: Cicadellidae) and Peregrinus maidis (Homoptera: Delphacidae). Journal of Entomological Science. 25 (1), 106-111 (1990).
- Yao, J., Rotenberg, D., Afsharifar, A., Barandoc-Alviar, K., Whitfield, A. E. Development of RNAi methods for Peregrinus maidis, the corn planthopper. PloS One. 8 (8), 70243 (2013).
- Esvelt, K. M., Smidler, A. L., Catteruccia, F., Church, G. M. Emerging technology: concerning RNA-guided gene drives for the alteration of wild populations. Elife. 3, 03401 (2014).
- Gantz, V. M., Bier, E. The mutagenic chain reaction: a method for converting heterozygous to homozygous mutations. Science. 348 (6233), 442-444 (2015).
- Yao, J., Rotenberg, D., Whitfield, A. E. Delivery of maize mosaic virus to planthopper vectors by microinjection increases infection efficiency and facilitates functional genomics experiments in the vector. Journal of Virological Methods. 270, 153-162 (2019).
- Kimelman, D., Martin, B. L. Anterior-posterior patterning in early development: three strategies. Wiley Interdisciplinary Reviews: Developmental Biology. 1 (2), 253-266 (2012).
- Mito, T., Nakamura, T., Noji, S. Evolution of insect development: to the hemimetabolous paradigm. Current Opinion in Genetics & Development. 20 (4), 355-361 (2010).
- Grubbs, N., Haas, S., Beeman, R. W., Lorenzen, M. D. The ABCs of eye color in Tribolium castaneum: orthologs of the Drosophila white, scarlet, and brown Genes. Genetics. 199 (3), 749-759 (2015).
- Xue, W. H., et al. CRISPR/Cas9-mediated knockout of two eye pigmentation genes in the brown planthopper, Nilaparvata lugens (Hemiptera: Delphacidae). Insect Biochemistry and Molecular Biology. 93, 19-26 (2018).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visualized Experiments: JoVE. (63), e3998 (2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. Journal of Molecular Biology. 94 (3), 441-448 (1975).
- Chu, F. C., Wu, P. S., Pinzi, S., Grubbs, N., Lorenzen, M. D. Microinjection of Western Corn Rootworm, Diabrotica virgifera virgifera, embryos for germline transformation, or CRISPR/Cas9 genome editing. Journal of Visualized Experiments: JoVE. (134), e57497 (2018).
- Brent, C. S., Hull, J. J. RNA interference-mediated knockdown of eye coloration genes in the western tarnished plant bug (Lygus hesperus Knight). Archives of Insect Biochemistry and Physiology. 100 (2), 21527 (2019).
- Khan, S. A., Reichelt, M., Heckel, D. G. Functional analysis of the ABCs of eye color in Helicoverpa armigera with CRISPR/Cas9-induced mutations. Scientific Reports. 7 (1), 1-14 (2017).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved