Method Article
بروتيوميك لمحة عن EPS البول من خلال FASP الهضم وتحليل البيانات المستقلة
In This Article
Summary
هنا، نقدم بروتوكول هضم محسن على فلتر مع معلومات مفصلة حول ما يلي: هضم البروتين، وتنقية الببتيد وتحليل اقتناء البيانات المستقلة. يتم تطبيق هذه الاستراتيجية على تحليل عينات إفرازات البول البروستاتا المعبر عنها وتسمح بتغطية عالية للبروتيوم وتنميط خالي من التسمية منخفض القيمة المفقودة للبروتيوم البولي.
Abstract
يستخدم بروتوكول العينة بمساعدة المرشح (FASP) على نطاق واسع لإعداد عينات البروتيوميات لأنه يسمح بتركيز العينات المخففة وهو متوافق مع مجموعة واسعة من المنظفات. تعتمد سير عمل البروتيوميات من أسفل إلى أعلى مثل FASP بشكل متزايد على أساليب LC-MS/MS التي يتم إجراؤها في وضع التحليل المستقل للبيانات (DIA) ، وهي طريقة مسح تسمح بتغطية البروتيوم العميقة وانخفاض معدل حدوث القيم المفقودة.
في هذا التقرير، سنقدم تفاصيل سير العمل الذي يجمع بين بروتوكول FASP، وخطوة تنقية مزدوجة StageTip وLC-MS/MS في وضع DIA لرسم خرائط البروتيوم البولي. كعينة نموذجية، قمنا بتحليل الإفرازات البروستاتا المعبر عنها (EPS) - البول، وهي عينة تم جمعها بعد فحص المستقيم الرقمي (DRE)، والتي هي ذات أهمية في دراسات اكتشاف العلامات الحيوية لسرطان البروستاتا.
Introduction
التطور المستمر للتكنولوجيات بروتيوميك وعود أن يكون لها تأثير كبير في المساعدة على تشخيص المرض والتنبؤ بالاستجابة للعلاج من خلال توفير خرائط عالية الدقة من التأثيرات الجزيئية الرئيسية الموجودة في مجموعة واسعة من العينات مثل الأنسجة والفلوريدات الحيوية. من وجهة نظر تحليلية ، يقدم البول العديد من المزايا مثل سهولة جمع البروتيوم والاستقرار الكبير فيما يتعلق بالآخرين بيوفلويدس1. تحليل بروتيوميك البول هو من مصلحة خاصة في دراسات اكتشاف العلامات الحيوية على سرطان المسالك البولية، لأنه يسمح أخذ العينات غير الباضعة على مقربة من الأنسجة ذات الأهمية2. على وجه الخصوص ، عينة يبدو أنها واعدة لدراسة الأمراض المرتبطة بالبروستاتا هي EPS-urine3،4 (أي عينة البول التي تم جمعها بعد فحص المستقيم الرقمي (DRE)). هذه العملية الأخيرة قبل جمع العينات يثري البول مع بروتينات البروستاتا محددة. EPS-البول هو مرشح جيد للتحقيق في الاضطرابات المتعلقة غدة البروستاتا5 بما في ذلك سرطان البروستاتا (PCa)، منذ من خلال DRE، يمكن سكب البروتينات التي يفرزها الورم في عينة البول، مما يزيد من فرصة الكشف عن البروتينات سرطان الأنسجة الخاصة.
يلعب قياس الطيف الكتلي دورا حاسما في السماح بالكشف عن المؤشرات الحيوية المحتملة للبروتين وتحديد كميتها. على مدى العقدين الماضيين، سمحت البروتوكولات القائمة على التصلب المتعدد للتحليل البروتيني بالكشف عن عدد متزايد من البروتينات في تشغيل LC-MS/MS واحد بفضل التحسينات المستمرة في أجهزة التصلب المتعدد وفي برنامج تحليل البيانات6.
MS القائم على إعداد عينة بروتيوميك عموما ينطوي على الهضم الأنزيمي من خليط البروتين، والتي يمكن تحقيقها من خلال مجموعة واسعة من البروتوكولات مثل: الهضم في الحل، MStern النشاف7،تعليق محاصرة (S-فخ)8،الصلبة مرحلة تعزيز إعداد العينة (SP3)9،في المرحلة الهضم10 ومرشح إعداد العينة بمساعدة (FASP)11. يمكن استخدام جميع البروتوكولات لعلم البروتيومات البولية، على الرغم من أن النتائج قد تختلف فيما يتعلق بعدد البروتينات والببتيدات المحددة ومن حيث القابلية للاستنساخ12.
وفي هذا العمل، تركز اهتمامنا على تحليل بول EPS بواسطة بروتوكول FASP. تم تصميم بروتوكول FASP في الأصل لتحليل البروتينات المستخرجة من الأنسجة وثقافات الخلايا ، ولكن تم توسيع استخدامه بعد ذلك إلى تحليل أنواع العينات الأخرى ، مثل البول13. فيما يتعلق مباشرة في حل الهضم FASP هو نهج أكثر مرونة بروتيوميك14، لأنه من خلال تحقيق إزالة فعالة من المنظفات وغيرها من الملوثات مثل الأملاح من خليط البروتين قبل الهضم الأنزيمي15، فإنه يسمح باختيار ظروف التشحيم البروتين الأمثل. وعلاوة على ذلك، هناك خاصية إضافية ل FASP وهي أنها توفر وسيلة لتركيز العينة. هذا هو ذات أهمية خاصة لتحليل بروتيوميك البولية، لأنه يسمح للبدء من أحجام عينة كبيرة نسبيا (مئات من microliters). وفي ضوء إمكانات بروتوكول نظام الدراسة المتعلقة بالمعاملات المناخية، ركزت عدة دراسات الاهتمام على أتمتة سير العمل، بهدف الحد من التباين التجريبي ومعالجة عدد مرتفع من العينات بالتوازي مع16عينة.
في سير العمل لدينا، ويتبع FASP من قبل LC-MS / MS اكتساب في تحليل البيانات المستقلة (DIA)، الذي يوفر تغطية البروتيوم عالية، والدقة الكمية الجيدة وانخفاض معدل الإصابة بالقيم المفقودة. أسلوب DIA هو أسلوب حساس حيث يتم تحديد كافة الأيونات لأحداث MS/MS، عكس ما يحدث في تحليل البيانات المعتمدة (DDA) حيث يتم تجزئة الأيونات ذات الكثافة الأعلى فقط. يقوم مطياف الكتلة، الذي يعمل في وضع DIA، بإجراء دورات المسح الضوئي بعرض عزل مختلف يغطي مجموعة السلائف m/z بأكملها. هذا النهج يسمح للكشف عن عدد كبير من الببتيدات في وقت الوحدة ، وتوفير لقطة بروتيوميكس من العينة17. وعلاوة على ذلك، البيانات التي تم إنشاؤها بواسطة DIA لها سمة أخرى مثيرة للاهتمام: إمكانية التحليل الخلفي18. بيانات DIA أكثر تعقيدا من تلك التي تم الحصول عليها من قبل DDA، لأن أطياف MS/MS في DIA ناتجة عن العزل المشترك للعديد من أيونات السلائف داخل كل نافذة m/z 19. يتم فصل أطياف MS/MS المركبة إلى إشارات ببتيد متميزة ومحددة باستخدام عنصرين أساسيين: مكتبة طيفية وبرنامج مخصص لتحليل البيانات. يتم إنشاء المكتبة الطيفية من خلال تجربة تعتمد على البيانات ، وعادة ما تنطوي على تجزئة الببتيد لتحقيق أقصى قدر من تغطية البروتيوم ، والتي توفر قائمة بالآلاف من أيونات السلائف المحددة تجريبيا وأطياف MS / MS من الببتيدات التي يمكن اكتشافها في العينة قيد النظر. وبدلا من ذلك، يستخدم برنامج تحليل البيانات المعلومات الواردة في المكتبة الطيفية لتفسير بيانات DIA من خلال توليد كروماتوجرامات أيونية مستخرجة محددة تسمح باكتشاف الببتيد وتحديد كميتها. في حين أن تحليل بيانات DIA الخالي من المكتبة أصبح ممكنا الآن ، إلا أن DIA المستندة إلى المكتبة لا تزال توفر نتائج أفضل من حيث تغطية البروتيوم20.
بروتوكول إعداد العينة هنا وصف(الشكل 1)يتكون من الخطوات التالية: خطوة الطرد المركزي (لإزالة حطام الخلية)، FASP الهضم، StageTip تنقية21،كمية من البروتينات وتحليل DIA. وقد تم تصميم هذا البروتوكول لتحليل EPS البول في سياق اكتشاف العلامات الحيوية لسرطان البروستاتا، ولكن يمكن تطبيقه على التحليل البروتيني لأي عينة البول.
Protocol
تمت الموافقة على الدراسة من قبل اللجنة الأخلاقية المؤسسية لجامعة ماجنا غراسيا في كاتانزارو، RP 41/2018. تم الحصول على موافقة خطية مستنيرة من جميع المرضى المسجلين في الدراسة.
1. إعداد العينة
- عينات من البول EPS الطرد المركزي في غضون 2 ساعة من جمع في 2100 × ز لمدة 10 دقائق في درجة حرارة الغرفة (RT). تخزين supernatant في -80 درجة مئوية حتى الاستخدام.
2. ذوبان عينة
- نقل العينة من -80 درجة مئوية إلى -20 درجة مئوية في اليوم السابق للهضم.
- قبل معالجة العينة، قم بنقل العينة لمدة 15-20 دقيقة عند درجة حرارة 4 درجات مئوية ثم في RT.
3. إعداد الكاشف لFASP
- في نفس اليوم، قم بإعداد الحلول التالية: العازلة اليوريا، 50 mm iodoacetamide (IAA) في العازلة اليوريا، 50 mM ثلاثي اليايثلاممونيوم بيكربونات و 500 م dithiothreitol (DTT).
- إعداد العازلة اليوريا (اليوريا 8 M، 100 mM تريس-HCl درجة الحموضة 8): ل10 مل، تزن 4800 ملغ من اليوريا وحله في الكمية المناسبة من المياه HPLC بعد إضافة 1 مل من 1 M تريس درجة الحموضة 8. وهناك حاجة إلى حجم 800 ميكرولتر من اليوريا لكل عينة.
- إعداد 500 م ديثيوثيريتول (DTT): حل 38.5 ملغ من DTT في 500 ميكرولتر من الماء HPLC. لكل عينة، هناك حاجة إلى 66.7 ميكرولتر من DTT.
- إعداد 50 MM IAA في العازلة اليوريا: حل 9.25 ملغ من IAA في 1 مل من العازلة اليوريا. لكل عينة هناك حاجة 50 ميكرولتر من IAA.
- إعداد بيكربونات ثلاثية اليثلاميوميوم (TEAB) 50 مليون متر. أضف 150 ميكرولتر من 1 M TEAB إلى 2.85 مل من مياه HPLC. لكل عينة 460 μL من TEAB هناك حاجة.
- إعداد حل من التريبسين (100 نانوغرام / ميكرولتر) في مياه HPLC. يمكن تخزين هذا الحل عند -80 درجة مئوية و إذابته مباشرة قبل الاستخدام. لكل عينة، هناك حاجة إلى 2 ميكرولتر (200 نانوغرام).
4. هضم البروتين من قبل FASP
- تمييع 500 ميكرولتر من كل عينة من عينات البول EPS مع 66.7 ميكرولتر من 10٪ (ث / v) كبريتات دودسيل الصوديوم (SDS)، 66.7 ميكرولتر من 500 mM DTT و 33.3 ميكروغرام من 1 M Tris pH 8 لتشحيم البروتينات والحد من سندات الديسولفيد. احتضان 10 دقائق في 95 درجة مئوية مع اهتزاز لطيف.
- أضف 300 ميكرولتر من عينة البول المخفف EPS على وحدة التصفية (10 كيلودا) والطرد المركزي عند 14000 × غرام لمدة 20 دقيقة.
- أضف 200 ميكرولتر من عازل اليوريا إلى الفلتر والطرد المركزي عند 14000 × غرام لمدة 15 دقيقة. كرر هذه الخطوة ثم تجاهل التدفق عبر.
- أضف 50 ميكرولتر من محلول IAA والطرد المركزي بمعدل 6000 × غرام لمدة 25 دقيقة.
- أضف 200 ميكرولتر من عازل اليوريا والطرد المركزي عند 14000 × غرام لمدة 20 دقيقة. كرر هذه الخطوة ثم تجاهل التدفق عبر.
- أضف 200 ميكرولتر من 50 ميليمتر ثلاثي الثيلاممونيوم ثنائي الكربون العازل (TEAB) والطرد المركزي عند 14000 × غرام لمدة 20 دقيقة. كرر هذه الخطوة.
- نقل وحدة التصفية إلى أنبوب جمع جديد.
- إضافة 60 ميكرولتر من 50 MM TEAB العازلة و 200 نانوغرام من تريبسين واحتضان العينة في خلاط الحرارية في 37 درجة مئوية بين عشية وضحاها.
ملاحظة: لتجنب تبخر العينة أثناء الحضانة بين عشية وضحاها، قم بتغليف كل وحدة تصفية بطبقة من رقائق الألومنيوم ثم طبقة من البارافيلم. - بعد حضانة التريبسين، أضف 140 ميكرولتر من الماء والطرد المركزي القارورة عند 14000 × غرام لمدة 25 دقيقة لجمع حجم الهضم (180-200 ميكرولتر).
5. إعداد الكاشف لتنقية SCX
- إعداد 1 مل من غسل 1 (0.5٪ حمض الفورميك (FA) و 20٪ أسيتونيتريل (ACN)) على النحو التالي: إضافة 50 ميكرولتر من 10٪ FA و 200 ميكرولتر من ACN 100٪ إلى 750 ميكروغرام من مياه HLPC. لكل عينة، هناك حاجة إلى 100 ميكرولتر من الغسيل 1.
- إعداد 1.5 مل من غسل 2 (0.5٪ FA و 80٪ من ACN) على النحو التالي: إضافة 75 ميكرولتر من 10 ٪ FA و 1.2 مل من ACN 100٪ إلى 225 ميكروغرام من مياه HPLC. لكل عينة 190 μL من غسل 2 هناك حاجة.
- إعداد 100 ميكرولتر من محلول التتحزير (خلات الأمونيوم 500 mM (AA) و 20٪ من ACN): إضافة 25 ميكرولتر من 2 M AA و 20 ميكرولتر من ACN 100٪ إلى 55 ميكرولتر من مياه HPLC.
- إعداد تلميحات المرحلة كما يلي.
- حزمة تلميح ماصة 200 ميكرولتر مع طبقة من راتنج SCX باستخدام إبرة حقنة حادة (قياس 16). أدخل تلميح المرحلة في غطاء جهاز طرد مركزي صغير تم اختراقه سابقا من أجل استيعاب الميكروفون.
- قم بتجميع الغطاء على جهاز طرد مركزي صغير سعة 2 مل تمت إزالة الغطاء الأصلي منه. جهاز الطرد المركزي MICRO-SPE تجميعها فقط ينبغي أن تندرج في جهاز الطرد المركزي benchtop. منذ أغطية مثقبة مملة لإعداد، ويمكن استخدامها عدة مرات.
6. تنقية SCX
- تمييع 30 ميكرولتر من كل عينة إلى 120 ميكرولتر باستخدام غسل 2.
- قم بتكبيس المرحلة بإضافة 50 ميكرولتر من الغسيل 1 فوق راتنج الاستخراج والطرد المركزي عند 400 × ز لمدة دقيقتين. وبما أن مقاومة التدفق تعتمد على مدى قوة تعبئة راتنج الاستخراج في طرف المصصة، فقد تحتاج سرعة الطرد المركزي إلى تعديل من أجل الحصول على معدل تدفق من 20-30 ميكرولتر/دقيقة. حاول عدم ترك الطرف جافا أثناء تحميل العينة وغسلها.
- قم بتكميل تلميح المرحلة مع 50 ميكرولتر من الغسيل 2 والطرد المركزي عند 400 × ز لمدة دقيقتين.
- قم بتحميل العينة المخففة (120 ميكرولتر) باستخدام سرعة دوران أقل.
- اغسل تلميح المرحلة مع 50 ميكرولتر من الغسيل 2 والطرد المركزي عند 400 × ز لمدة دقيقتين. كرر مع 50 ميكرولتر من غسل 1.
ملاحظة: بعد هذا غسل الراتنج يجب أن تكون جافة تماما. - خليط الببتيد Elute مع 7 ميكرولتر من محلول اليواتي (خلات الأمونيوم 500 mM (AA) و 20٪ من ACN) ببطء باستخدام سرعة دوران أقل.
- إضافة 27 ميكرولتر من 0.1٪ FA لتخفيف AA والحصول على عينة للحقن الأولي LC-MS/MS. سيؤدي التخفيف النهائي إلى 34 ميكرولتر إلى نسبة حجمية 1:1 بين محلول البول والببتيد (1 ميكرولتر من الهضم المنقى ستتوافق مع 1 ميكرولتر من عينة البول الأصلية).
7. تحديد كمية البروتين حسب المعيار الخارجي باستخدام تحليل DDA (الشكل 2)
- تحديد كمية البروتين في العينات عن طريق حقن 2 ميكرولتر من هضم الببتيد الناتج في LC-MS/MS وتجسيد إجمالي مساحة الببتيد الناتجة عن ذلك مع منحنى معايرة مبني على النحو التالي:
- إعداد خمسة حلول مختلفة لهضم هيلا (1 نانوغرام / ميكرولتر، 2.5 نانوغرام / ميكرولتر، 7.5 نانوغرام / ميكرولتر، 25 نانوغرام / ميكرولتر، 75 نانوغرام / ميكرولتر) باستخدام مخزون هضم هيلا (100 ميكروغرام / ميكرولتر).
- حقن كل حل هيلا في مكررة (2 ميكرولتر).
- تعيين أسلوب LC-MS/MS.
- حقن 2 ميكرولتر من خمسة خليط الببتيد هيلا والببتيدات منفصلة من خلال التدرج الخطي من 75 دقيقة بمعدل تدفق 230 nL/minute على عمود 15 سم، 75 ميكرومتر أي دي معبأة مع 3 ميكرومتر C18 جزيئات السيليكا. استخدم تدرج ثنائي تشكله المرحلة A المتنقلة (0.1٪ FA، 2٪ ACN) والمرحلة B المتنقلة (0.1٪ FA و80٪ من ACN).
- نفذ التدرج من خلال زيادة محتوى المرحلة B من 6٪ إلى 42٪ في 60 دقيقة ومن 42٪ إلى 100٪ في 8 دقائق إضافية. الحفاظ على لمدة 5 دقائق 100٪ B ثم الانتقال مرة أخرى إلى 0٪ B في دقيقتين.
- تعمل في وضع DDA باستخدام طريقة أعلى 12 وتعيين MS نطاق المسح الكامل في 350-1800 م / ض، القرار 70،000، ACG الهدف 1e6 والحد الأقصى لحقن الوقت 50 مللي ثانية. تعيين نافذة كتلة لعزل أيون السلائف في 1.6 م / ض، القرار 35000 ، ACG الهدف 1e5 ، أقصى وقت الحقن 120 مللي ثانية ، تجزئة HCD في 25 NCE (تطبيع طاقة الاصطدام) والاستبعاد الديناميكي 15 ثانية.
- تحليل الملفات الخام باستخدام Sequest كمحرك بحث ، وتسلسل البروتين الكامل Uniprot الإنسان كقاعدة بيانات. في التجارب المعروضة هنا، تم تنزيل قاعدة البيانات في مارس 2016 وتضمنت 42.013 تسلسل.
- استخدام الإعدادات التالية: MS التسامح 15 صفحة في الدقيقة، MS / MS التسامح 0.02 دا، تريبسين كما انزيم عن طريق تعيين موقعين الانقسام غاب. تعيين كارباميدوميثيليشن من اليسين، سيرين، ثريونين، التيروزين (+57.021) وأكسدة الميثيونين كتعديلات ديناميكية وكاربيدوميثيليشن من السيستين (+57.021) كتعديلات ثابتة. استخدام قطع معدل اكتشاف كاذبة (FDR) للببتيدات والبروتينات تحديد إلى 0.01 وتصفية من قبل percolator.
- حساب منطقة الذروة لجميع إشارات الببتيد MS1. حساب المساحة الإجمالية للببتيدات.
- حقن 2 ميكرولتر من خليط الببتيد التي تم الحصول عليها من عينات البول EPS باستخدام نفس طريقة LC-MS/MS المستخدمة لعينات HeLa وتحليل الملف الخام باستخدام نفس المعلمات المستخدمة لمعالجة بيانات HeLa.
- حساب الكثافة الإجمالية للإشارات الببتيد عن طريق تلخيص قيم المنطقة من جميع الببتيدات المحددة والإستيفاء منحنى القياسية الخارجية. وهذا سيوفر تقديرا مقبولا لكمية الببتيد الموجودة في هضم البروتين EPS البول.
8. إعداد الكاشف لبروتوكول C18 StageTip
- إعداد 500 ميكرولتر من الحل A (0.1٪ حمض ثلاثي فلوريوستيك (TFA)، 50٪ ACN): إضافة 250 ميكرولتر من 100٪ ACN و 10 ميكرولتر من 5٪ TFA إلى 240 ميكروغرام من مياه HPLC.
- إعداد 2 مل من الحل B (0.1 ٪ TFA): أضف 40 ميكرولتر من 5٪ TFA إلى 1960 ميكرولتر من مياه HPLC.
- إعداد 100 ميكرولتر من محلول التميي (0.1٪ FA، 50٪ ACN): إضافة 1 ميكرولتر من 10٪ FA و 50 ميكرولتر من ACN 100٪ إلى 49 ميكرولتر من مياه HPLC.
- إعداد تلميحات المرحلة كما هو موضح سابقا. في هذه الحالة، يتم استخدام أقراص استخراج C18.
9. بروتوكول تلميح المرحلة SCX/C18
ملاحظة: تنقية EPS-urine هضمات بواسطة بروتوكول C18 StageTip لإزالة الأملاح.
- تبدأ من 2 ميكروغرام من الببتيدات (كما هو محدد كميا من الحقن الأولي). تمييع حل الهضم 4 أضعاف في غسل 2 SCX والمضي قدما على النحو المبين أعلاه (في القسم "تنقية SCX"). Elute خليط الببتيد مع 7 ميكرولتر من محلول اليواتي (خلات الأمونيوم 500 mM (AA) و 20٪ من ACN) ببطء باستخدام سرعة دوران أقل (5 ميكرولتر / معدل تدفق دقيقة).
- تحمض السيلوات SCX مع 150 ميكرولتر من 0.1٪ من حمض ثلاثي فلوري (TFA) من أجل تحقيق درجة الحموضة أقل من 3 وتركيز المذيبات العضوية أقل من 5٪.
- قم بتكفير تلميح المرحلة C18 مع 50 ميكرولتر من المحلول A والطرد المركزي عند 400 × ز لمدة دقيقتين. توازن C18 StageTip مع 50 ميكرولتر من الحل B والطرد المركزي في 400 × ز لمدة 2 دقيقة.
- قم بتحميل العينة على طرف المرحلة ببطء باستخدام سرعة دوران أقل.
- اغسل C18 StageTip مع 50 ميكرولتر من المحلول B والطرد المركزي.
- ببطء elute خليط الببتيد مع 10 ميكرولتر من محلول elution باستخدام سرعة دوران أقل.
- جفف اليواتي (10 ميكرولتر) عند 30 درجة مئوية في جهاز طرد مركزي فراغي لمدة 3 دقائق. إضافة 47 ميكرولتر من 0.1٪ FA. تركيز الببتيد المتوقع سيكون 40 نانوغرام / ميكرولتر. تحليل بواسطة LC-MS/ MS في وضع DIA.
10. تحليل DIA (الشكل 3)
- فصل نانولك: فصل خليط الببتيد باستخدام تدرج خطي من 140 دقيقة بمعدل تدفق 230 نانولتر / دقيقة على عمود معرف 15 سم، 75 ميكرومتر معبأة مع 3 ميكرومتر C18 جزيئات السيليكا.
- نفذ التدرج بمعدل تدفق 230 nL/minute وزاد محتوى المرحلة B للجوال من 3٪ إلى 25٪ في 90 دقيقة، ثم من 25٪ إلى 40٪ في 30 دقيقة وأخيرا من 40٪ إلى 100٪ في 8 دقائق.
- بعد 10 دقائق في 100٪ B، توازن العمود مع المرحلة المتنقلة A لمدة 15 دقيقة.
- المعلمات الطيفية الشاملة: إجراء تحليل DIA باستخدام طريقة تستخدم دورة المسح الضوئي التالية: (1) حدث MS المسح الكامل بدقة 17500 (AGC الهدف 1e6، أقصى مدة حقن 50 مللي ثانية) متبوعة ب (ii) 20 نافذة بعرض عزل 20 م/ض، بدءا من m/z 350، (ii) 5 نوافذ بعرض عزل 50 م/ض و(4) نافذة واحدة بعرض عزل 200 م/ض، مما ينهي نطاق المسح الضوئي ل DIA عند 1200 م/ض. إجراء عمليات مسح DIA عند الدقة 35,000 (الهدف 5e5 AGC، أقصى مدة حقن 120 مللي ثانية و 25 NCE).
11. ارتفاع درجة الحموضة عكس المرحلة C18 تجزئة لتوليد المكتبة
ملاحظة: تجمع عينات ممثل EPS البول في كمية أعلى من 10 ميكروغرام من أجل بناء مكتبة تعتمد على البيانات لتحليل DIA عن طريق الإجراء التالي:
- تحمض خليط الببتيد (11 ميكروغرام) بنسبة 0.2٪ من TFA وتحميل الحل الناتج على C18 StageTip معبأة مع طبقتين من أقراص الاستخراج للسماح بقدرة أعلى. قدرنا قدرة التحميل على قرص صغير واحد (من إبرة حقنة قياس 16) لتكون في نطاق 5-10 ميكروغرام.
- حالة ومرحلة ثابتة متساوية كما هو موضح بالفعل لتنقية C18.
- تنفيذ تجزئة الببتيد عن طريق الإلتواء التدريجي (ن = 10) من درجة الحموضة العالية عكس المرحلة C18 باستخدام حلول elution التي تحتوي على 0.2٪ من هيدروكسيد الأمونيوم، 10 mM TEAB، وزيادة تركيزات v/v من ACN (4٪، 8٪، 12٪، 16٪، 20٪، 24٪، 28٪، 32٪، 40٪، 80٪).
- تحليل الكسور 10 باستخدام نفس المعلمات الكروماتوغرافية من طريقة DIA. تشغيل مطياف الكتلة في وضع DDA باستخدام الإعدادات المعتمدة سابقا للتحليل الأولي (انظر "قياس البروتين حسب المعيار الخارجي باستخدام تحليل DDA").
12. تحليل البيانات
- توليد المكتبة الطيفية عن طريق استيراد نتائج تحديد البروتين التي تم الحصول عليها من تجارب DDA LC-MS/MS من تجزئة المرحلة C18 عالية الانعكاس في برنامج مخصص لتحليل DIA.
- تعيين الحد الأدنى والحد الأقصى لعدد أيونات الأجزاء المستخدمة لتحديد الهوية وتحديدها كميا إلى 3 و6 على التوالي. تصفية النتائج التي تم الحصول عليها بواسطة قيمة Q من 0.01.
- استيراد ملفات DIA الخام وإقران إلى كل ملف الخام نفس الملف FASTA المستخدمة لإنشاء مكتبة الطيفية.
- تعيين الحد الأدنى والحد الأقصى لعدد الببتيدات الفريدة المستخدمة في تحديد كمي البروتين إلى 1 و 10، على التوالي.
- حساب كثافة لكل بروتين عن طريق تلخيص جزء أيون منطقة الذروة.
- توليد مصفوفة مع كثافة البروتينات كميا في كل عينة.
النتائج
يتضمن هذا البروتوكول للتحليل البروتيوميكي البولي الخطوات التالية: هضم FASP ، وتقدير كمية البروتين عن طريق المعايرة القياسية الخارجية ، وتنقية StageTip المزدوجة (SCX و C18)، وتحليل LC-MS / MS في وضع DIA.
بعد هضم البروتين، يتم إجراء الحقن الأولية بعد تنقية StageTip SCX للببتيدات الناتجة. تتم معالجة ملفات LC-MS/MS الخام للحصول على عدد الببتيدات المحددة وعدد البروتينات المحددة ومنطقة الببتيدات المكتشفة. يتم استخدام المساحة الإجمالية التي تم الحصول عليها من خلال تلخيص جميع الببتيدات المحددة لتقدير محتوى البروتين عن طريق الاستيفاء إلى معيار خارجي: هضم بروتين HeLa يتم حقنه بخمس كميات مختلفة (2، 5، 15، 50، 150 نانوغرام، على التوالي). تنوعت كمية البروتين للعينات الست التي تم تحليلها في هذه الدراسة من عينة إلى عينة، مما يدل على متوسط قيمة 78 نانوغرام/ميكرولتر.
بعد تقدير البروتين، يتم تنقية 2 ميكروغرام من البروتينات المهضومة من كل عينة من قبل SCX المتتالية وC18 StageTip قبل تحليل DIA. يتم إنشاء المكتبة الطيفية للبحث في بيانات DIA بعد الكسر المنعكس عالي الأسي رقم الحموضة وتحليل DDA LC-MS/MS لعينة تمثيلية (على سبيل المثال، تجمع عينات). باستخدام المعلمات المذكورة أعلاه، قمنا بتحديد وقياس كمية، تراكميا، 2387 مجموعة بروتين في عينات البول EPS الست قيد النظر(الجدول التكميلي 1 والشكل 4).
من أجل تقييم من وجهة نظر نوعية أهمية قائمة البروتينات المحددة والمحددة كميا ، تمت مقارنة المصفوفة التي تم الحصول عليها بقائمة من 624 بروتينا تم تحديدها سابقا في DIRECT- EPS22، وهي عينة تم جمعها في إجراء أكثر توغلا ، والتي أثبتت أنها مصدر مؤشرات بيولوجية لسرطان البروستاتا مرشح مثير للاهتمام. في المجموع، تم الكشف بنجاح عن 508 من أصل 624 بروتينا من خلال بروتوكول FASP/DIA الخاص بنا على بول EPS.
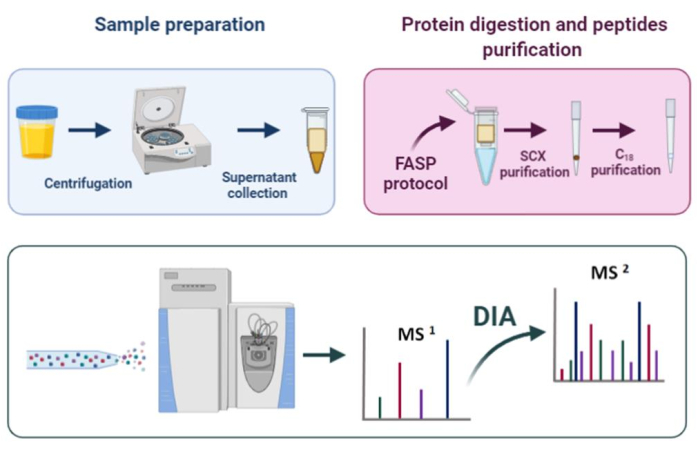
الشكل 1: سير العمل Proteomic. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
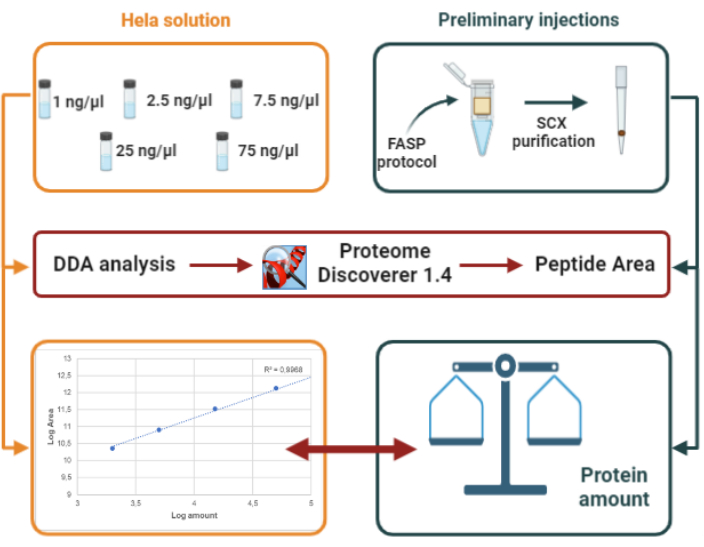
الشكل 2:تمثيل تصميمنا التجريبي لتحديد كمية البروتين على أساس المعيار الخارجي (هلا هضم).
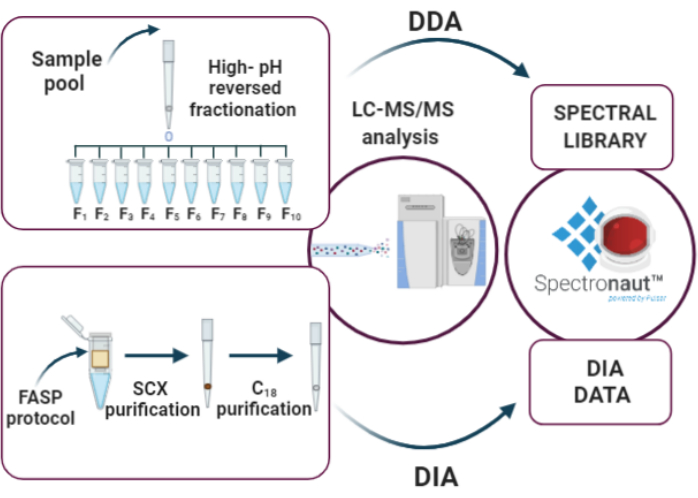
الشكل 3:الخطوات الرئيسية لتحليل DIA: '1' وضع المكتبة الطيفية من خلال الكسر المنعكس بدرجة الحموضة العالية وتحليل DDA، '2' تحليل العينة باستخدام نهج DIA، '3' تحليل البيانات بواسطة سبكترونوت. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
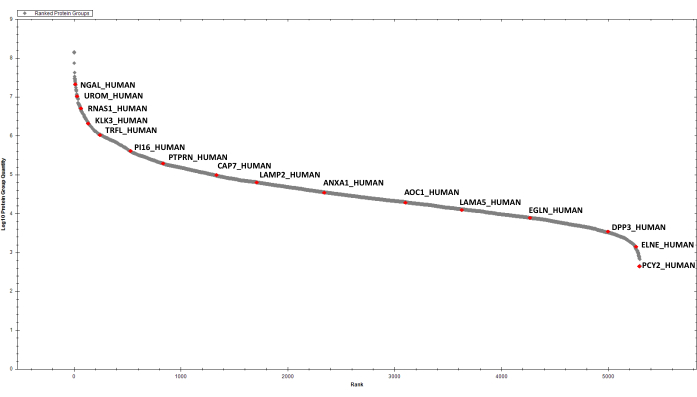
الشكل 4: مؤامرة المرتبة للبروتينات المبامسالك البولية EPS الكشف عنها. يتم وضع علامة على عدد قليل من الزيارات المختارة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: جدول تمثيلي للبروتينات الكمية في ست عينات من البول EPS في سبكترونوت. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
في هذا العمل، يتم تقديم استراتيجية لتحليل عينات البول EPS. بروتوكول FASP هو الخيار المثالي لعلم البروتيوميات البولية لأنه يسمح بتركيز العينة قبل الهضم الأنزيمي. في الواقع، باستخدام سير العمل هذا، يمكن تحميل عدة مئات من ميكرولترات البول على مرشح واحد ومعالجتها. وعلاوة على ذلك، يوفر الهضم على مرشح الحرية النسبية في اختيار ظروف التشبع. في عملنا، يتم تحقيق تشبع البروتين عن طريق تمييع عينات البول في العازلة التي تحتوي على تريس، SDS وDTT (التركيز النهائي: 50 mM تريس، 1٪ SDS، 50 mM DTT). يتم تشوهات البروتينات بكفاءة مباشرة بعد إذابة العينة ، من أجل تجنب التدهور غير المرغوب فيه عن طريق البروتياز النشط. وقد تم تحسين البروتوكول الأصلي FASP بزيادة حجم يغسل من 100 ميكرولتر إلى 200 ميكرولتر. وبهذه الطريقة، يتم تحقيق إزالة أفضل للمخلفات، وخاصة المنظفات من المرشح.
بعد الهضم الأنزيمي، وتقدير البروتين حسب المعيار الخارجي باستخدام LC-MS/MS سريع، يتم تنفيذ طريقة تعتمد على البيانات قبل الخطوات الأخيرة من البروتوكول، والتي تشمل تنقية StageTip مزدوجة وتحليل LC-MS/MS في وضع DIA، على مواد البدء المتساوية لجميع العينات (2 ميكروغرام).
ويرتبط براعة FASP مع نهج DIA، وهي طريقة حساسة توفير عدد قليل من القيم المفقودة17. في عملنا، تم تحديد 2387 بروتينا وقياسها كميا، مما مكن من رسم ملف تعريف بروتيومي مفصل لبول EPS. كان تحديد 2387 بروتينا وتحديدها كميا ممكنا من خلال إنشاء مكتبة طيفية غنية ، تم الحصول عليها عن طريق تجزئة الببتيدات ذات درجة الحموضة العالية ، وعن طريق طريقة DIA الخاصة بنا ، الموجهة إلى مجموعة واسعة من السلائف m / z. هذا سير العمل حددت أكثر من 80٪ من البروتينات الموجودة سابقا في التحليل المباشر EPS، مما يدل على أن جزءا كبيرا من البروتيوم EPS-البولية مشتق في الواقع من إفرازات البروستاتا أعرب، وبالتالي هو مصدر غني من البروتينات أنسجة البروستاتا محددة26.
في الختام، لدينا تصميم تجريبي الأزواج براعة FASP مع حساسية DIA من أجل الحصول على خريطة غنية من البروتيوم البولية. يوصى بهذه الاستراتيجية لتحليل عينات البول EPS، ولكن يمكن توسيع نطاق استخدامها إلى البروتيوميات البولية بشكل عام، أو حتى لأنواع العينات الأخرى.
Disclosures
جميع المؤلفين يعلنون عدم وجود تضارب في المصالح.
Acknowledgements
وقد دعم هذا العمل من قبل MIUR (الوزير الجامعي Ricerca، PRIN 2017 إلى MG) وPOR كالابريا FESR 2014-2020، الإجراء 1.2.2، "INNOPROST".
Materials
| Name | Company | Catalog Number | Comments |
| 1 M Tris HCL pH 8.0 | Lonza | 51238 | |
| 2-iodoacetamide for synthesis | Merck | 8047440100 | |
| Acetonitrile for HPLC LC-MS grade | VWR | 83640.290 | |
| Ammonium acetate | Fluka | 9690 | |
| ammonium hydroxide solution | Sigma | 30501 | |
| ammonium hydroxide volumetric standard, 5N solution in water | Merck | 318612-500ML | |
| Dithiothreitol | Amresco | 0281-25G | |
| Empore Cation 47mm Extraction Disks | Microcolumn | 2251 | |
| Empore Disk C18 | Varian | 12145004 | |
| Formic acid optima | Fisher Scientific | A117-50 | |
| Hela Protein Digest Standard | Fisher Scientific | 88329 | |
| Microcon-10kDa Centrifugal Filter Unit with Ultracel-10 membrane | MERCK | MRCPRT010 | |
| sodium dodecyl sulfate solution | Merck | 71736-500ML | |
| Thiethylammonium bicarbonate buffer | Merck | T7408-100ML | |
| trifluoroacetic acid | Riedel-de Haën | 34957 | |
| Trypsin from porcine pancreas | Merck | T6567-1MG | |
| Urea | Merck | U6504-500G | |
| Water HPLC gradient grade | Fisher Scientific | W/0106/17 | |
| Proteome Discoverer 1,4 | Thermo Fisher Scientific | ||
| Spectronaut 14.0 | Biognosys |
References
- Hüttenhain, R., Soste, M., Selevsek, N., et al. Reproducible quantification of cancer-associated proteins in body fluids using targeted proteomics. Sci Transl Med. 4 (142), 10 (2013).
- Roobol, M. J., Carlsson, S. V. Risk stratification in prostate cancer screening. Nature Reviews Urology. 10 (1), 38-48 (2013).
- Principe, S., et al. Identification of prostate-enriched proteins by in-depth proteomic analyses of expressed prostatic secretions in urine. Journal of Proteome Research. 11 (4), 2386-2396 (2012).
- Kim, Y., et al. Targeted proteomics identifies liquid-biopsy signatures for extracapsular prostate cancer. Nature Communications. 7, 1-10 (2016).
- Drake, R. R., et al. Clinical collection and protein properties of expressed prostatic secretions as a source for biomarkers of prostatic disease. Journal of Proteomics. 72 (6), 907-917 (2009).
- Macklin, A., Khan, S., Kislinger, T. Recent advances in mass spectrometry based clinical proteomics: Applications to cancer research. Clinical Proteomics. 17 (1), 1-25 (2020).
- Berger, S. T., et al. MStern blotting-high throughput polyvinylidene fluoride (PVDF) membrane-based proteomic sample preparation for 96-well plates. Molecular and Cellular Proteomics. 14 (10), 2814-2823 (2015).
- Zougman, A., Selby, P. J., Banks, R. E. Suspension trapping (STrap) sample preparation method for bottom-up proteomics analysis. Proteomics. 14 (9), 1006 (2014).
- Hughes, C. S., et al. Ultrasensitive proteome analysis using paramagnetic bead technology. Molecular Systems Biology. 10 (10), 757 (2014).
- Kulak, N. A., Pichler, G., Paron, I., Nagaraj, N., Mann, M. Minimal, encapsulated proteomic-sample processing applied to copy-number estimation in eukaryotic cells. Nature Methods. 11 (3), 319-324 (2014).
- Wiśniewski, J. R., Zougman, A., Nagaraj, N., Mann, M. Universal sample preparation method for proteome analysis. Nature Methods. 6 (5), 359-362 (2009).
- Ding, H., et al. Urine Proteomics: Evaluation of Different Sample Preparation Workflows for Quantitative, Reproducible, and Improved Depth of Analysis. Journal of Proteome Research. 19 (4), 1857-1862 (2020).
- Zhao, M., et al. A comprehensive analysis and annotation of human normal urinary proteome. Scientific Reports. 7 (1), 1-13 (2017).
- Wiśniewski, J. R. Quantitative Evaluation of Filter Aided Sample Preparation (FASP) and Multienzyme Digestion FASP Protocols. Analytical Chemistry. 88 (10), 5438-5443 (2016).
- Wiśniewski, J. R., Zielinska, D. F., Mann, M. Comparison of ultrafiltration units for proteomic and N-glycoproteomic analysis by the filter-aided sample preparation method. Analytical Biochemistry. 410 (2), 307-309 (2011).
- Yu, Y., et al. Urine sample preparation in 96-well filter plates for quantitative clinical proteomics. Analytical Chemistry. 86 (11), (2014).
- Gillet, L. C., et al. Targeted data extraction of the MS/MS spectra generated by data-independent acquisition: A new concept for consistent and accurate proteome analysis. Molecular and Cellular Proteomics. 11 (6), 1-17 (2012).
- Liu, Y., Hüttenhain, R., Collins, B., Aebersold, R. Mass spectrometric protein maps for biomarker discovery and clinical research. Expert Review of Molecular Diagnostics. 13 (8), 811-825 (2013).
- Gallien, S., Duriez, E., Demeure, K., Domon, B. Selectivity of LC-MS/MS analysis: Implication for proteomics experiments. Journal of Proteomics. 81, 148-158 (2013).
- Muntel, J., et al. Advancing Urinary Protein Biomarker Discovery by Data-Independent Acquisition on a Quadrupole-Orbitrap Mass Spectrometer. Journal of Proteome Research. 14 (11), 4752-4762 (2015).
- Rappsilber, J., Mann, M., Ishihama, Y. Protocol for micro-purification, enrichment, pre-fractionation and storage of peptides for proteomics using StageTips. Nature Protocols. 2 (8), 1896-1906 (2007).
- Kim, Y., et al. Identification of Differentially Expressed Proteins in Direct Expressed Prostatic Secretions of Men with Organ-confined Versus Extracapsular Prostate Cancer. Molecular & Cellular Proteomics. 11 (12), 1870-1884 (2012).
- Decramer, S., et al. Urine in clinical proteomics. Molecular and Cellular Proteomics. 7 (10), 1850-1862 (2008).
- Thongboonkerd, V. Practical points in urinary proteomics. Journal of Proteome Research. 6 (10), 3881-3890 (2007).
- Konvalinka, A., Scholey, J. W., Diamandis, E. P. Searching for new biomarkers of renal diseases through proteomics. Clinical Chemistry. 58 (2), 353-365 (2012).
- Drake, R. R., et al. In-Depth Proteomic Analyses of Direct Expressed Prostatic Secretions. Journal of Proteome Research. 9 (5), 2109-2116 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved