A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياسات نقل الطاقة الرنين Förster في الخلايا النباتية الحية
In This Article
Summary
يتم توفير بروتوكول لإعداد مجهر مسح ليزر كونفوكوكال قياسي لقياسات نقل الطاقة بالرنين في الجسم الحي Förster ، يليه تقييم البيانات.
Abstract
تتم بسهولة تجارب نقل الطاقة بالرنين الرنيني (FRET) القائمة على الانبعاثات ولكن تعتمد على الإعداد المجهري. أصبحت مجاهر المسح بالليزر Confocal العمود الفقري لعلماء الأحياء. توفر الأنظمة التجارية مرونة عالية في ضبط طاقة الليزر وحساسية الكاشف وغالبا ما تجمع بين أجهزة الكشف المختلفة للحصول على الصورة المثالية. ومع ذلك، غالبا ما تكون مقارنة البيانات المستندة إلى الكثافة من التجارب والإعدادات المختلفة مستحيلة بسبب هذه المرونة. تعد الإجراءات الصديقة لعلماء الأحياء ذات فائدة وتسمح بتعديل بسيط وموثوق به لإعدادات الليزر والكاشف.
وعلاوة على ذلك، بما أن تجارب FRET في الخلايا الحية تتأثر بالتباين في التعبير عن البروتين ونسب قبول المانحين، يجب النظر في مستويات التعبير عن البروتين لتقييم البيانات. وصف هنا هو بروتوكول بسيط لقياسات FRET موثوق بها وقابلة للاستنساخ، بما في ذلك إجراءات لتقدير التعبير البروتين وتعديل كثافة الليزر وإعدادات كاشف. سيتم إجراء تقييم البيانات عن طريق المعايرة مع دمج الفلوروفور من كفاءة FRET المعروفة. لتحسين البساطة، تمت مقارنة عوامل التصحيح التي تم الحصول عليها في الخلايا وقياس البروتينات الفلورية المؤتلفة.
Introduction
عادة ما يلاحظ نقل الطاقة بالرنين Förster ((F)RET) عن طريق التحليل الطيفي الفلوري ، على الرغم من أن العملية نفسها لا تقتصر على الحدوث بين الفلوروفوريس. اقتران ثنائي القطب الكامنة ببساطة يتطلب جزيء المانحة الباعثة للضوء ومقبول امتصاص الضوء. وهذا مستمد من التداخل الطيفي المطلوب الذي لا يتجزأ من J من أطياف امتصاص الانبعاثات والمتقبلات العادية للمانحين1. ومع ذلك، ولأن تكنولوجيا الطاقة المتجددة تتنافس مع الفلورسينس، يصبح نقل الطاقة قابلا للقياس من خلال التعديلات في انبعاثات الفلورية: تحفز الطاقة المتجددة على إخماد المانحين وانبعاثات المقبولين الحساسة.
وقد أطلق على تكنولوجيا الطاقة المتجددة القائمة على الفلوروفور (RET) مصطلح نقل الطاقة بالرنين الفلوري (FRET) لفصله عن نقل الطاقة بالرنين الإضاءة الحيوية (BRET). تعتمد تكنولوجيا الطاقة المتجددة بقوة على المسافة بين المتبرع والمقبل، والتي تقع على نطاق واسع في نطاق 0.5-10 نانومتر مربع ، وبالتالي، في نفس نطاق أبعاد البروتينات ومجمعاتها. ثانيا، يعتمد RET على ثنائي القطب التوجه كابا التربيعية. جنبا إلى جنب مع حقيقة أن حرية الدوران من الفلوروفوريس المرتبطة بالبروتين يمكن إهمالها بسبب الوزن الجزيئي والاسترخاء الدوراني البطيء ، تسمح RET بتحليل التعديلات التوافقية3.
ويستند ما يسمى دائرة نصف قطرها فورستر على التداخل الطيفي لا يتجزأ ونطاق الطول الموجي للتداخل، بحيث الكروموفوريس امتصاص الضوء الأحمر يؤدي إلى أطول Förster radii من الأصباغ الزرقاء امتصاص الضوء. نظرا لأن النطاق الديناميكي لقياسات FRET محدود بنسبة 0.5 × R0 و 1.5 × R0 ، فإن زوج FRET ECFP-EYFP لديه نطاق ديناميكي يتراوح بين 2.5-7.3 نانومتر بسبب R0 من 4.9 نانومتر4.
يتم إعطاء سطوع الفلوروفور من خلال نتاج معامل انقراض الضرس وغلته الكمية. بالنسبة لقياسات FRET ، من المفيد اختيار الفلوروفورات ذات السطوع المماثل تقريبا. وهذا يعزز الكشف عن إخماد المانحين وتوعية الانبعاثات المقبولة. كما أنه يفضل معايرة نظام المجهر. بالنظر إلى أزواج FRET المستخدمة بشكل متكرر من البروتينات السماوي والفلورسنت ، يصبح السطوع السفلي للبروتينات الفلورية السماوي واضحا (الشكل 1A).
ومع ذلك، يجب أن يكون عمر المقبول أقل من عمر المتبرع، مما يضمن توافر المقبول لنقل الطاقة. إذا تجاوزت مدة حياة المقبول عمر المتبرع ، فقد يكون المقبول لا يزال في حالة متحمسة عندما يكون المتبرع متحمسا مرة أخرى. تظهر البروتينات الفلورية السيان المتقدمة مثل mTurquoise عمرا ممتدا وبالتالي تساهم في زيادة احتمالية FRET (Figure1B). يعتمد احتمال FRET أيضا على معامل انقراض الضرس للمقبول.
Protocol
ملاحظة: بالنسبة للبروتوكول التالي، تم تنفيذ عملية نقل عابرة للبلاستيدات الأولية، كما هو موضح سابقا12. ويرد أدناه وصف موجز.
1. عابر transfection من بروتوبلاستس
- قطع ~ 4 غرام من أوراق صحية من أربيدوبسيس تاليانا ecotype كولومبيا إلى شرائح 1 ملم ونقلها إلى 20 مل من محلول الانزيم (1.5٪ cellulase; 0.4٪ macerozyme؛ 0.1٪ ألبوم مصل البقري كسر الخامس؛ 0.4 M مانيتول؛ 20 mM KCl؛ 20 mM 2-(N-morpholino)حمض الإيثانسولفوني (MES)، درجة الحموضة 5.7؛ 10 mM CaCl2).
- فراغ التسلل شرائح ورقة تليها حضانة مع التحريض لمدة 2 ساعة في درجة حرارة الغرفة. حصاد الخلايا عن طريق الطرد المركزي لمدة 3 دقائق في 100 × غرام.
- غسل البروتوبلاستات مع W5-الحل (154 mM NaCl; 125 mM CaCl2; 5 mM KCl; 2 mM MES, pH 5.7) وإعادة إنفاقها في محلول MMG (0.4 M مانيتول; 15 mM MgCl2; 4 MM MES, pH 5.7).
- تنفيذ العدوى في شريحة 8-جيدا عن طريق صدمة التناضح في وجود البولي إيثيلينغليكول (PEG) 4000. مزيج 20 ميكرولتر من تعليق بروتوبلاست مع 5 ميكرولتر من الحمض النووي البلازميد (5 ميكروغرام / ميكرولتر) و 25 ميكرولتر من محلول PEG (0.2 M مانيتول، 0.1 M CaCl2، 40٪ PEG 4000).
- عكس الصدمة التناضحية عن طريق إعادة التكيف لطيف من الظروف التناضحية.
ملاحظة: إلى جانب عينة الاهتمام، يلزم التعبير عن المانح وحده والمقبل وحده لتحديد النزيف الطيفي للمتبرع والمقبل، على التوالي. يجب التعبير عن بروتين الانصهار للمتبرع والمقبل أيضا لأغراض المعايرة. كان تعبير البروتين الفلوري تحت سيطرة مروج فيروس فسيفساء القرنبيط 35S (pCaMV35S). وبالنسبة لجميع القياسات، استخدم مجاهر مسح بالليزر الكونفوج (LSM1 وLSM2). LSM1 نوعين من أجهزة الكشف: لقياسات FRET، تم الكشف عن إشارة المانحة من قبل كاشف GaAsP، في حين تم تسجيل FRET وانبعاثات المقبول مع فوتومولتيلير. LSM2 اثنين من photomultipliers، والتي استخدمت للكشف عن المانحة، FRET، وانبعاثات المقبول.
2. الليزر التكيف
ملاحظة: هنا، تم تطبيق 458 نانومتر و 514 نانومتر من ليزر الأرجون أيون لتحليل FRET بين بروتين فلوري سماوي معزز (ECFP) - وبروتينات فلورية صفراء محسنة (EYFP) تحمل علامة البروتينات. وبالنسبة لاكتساب البيانات القابلة للاستنساخ، تم تعديل الخطين على نحو مماثل. وقد تحقق ذلك إما عن طريق فوتوموليبلييه الإرسال أو وضع الانعكاس.
- تعديل الليزر باستخدام جهاز تحويل ضوئي ناقل الحركة
- استخدام بئر فارغة للتعديل.
- اختر وضع مسح الخط وعرض الرسم البياني.
- خفض كثافة الليزر إلى أدنى حد ممكن، وضبط كسب كاشف للضوضاء الخلفية للكشف.
- زيادة كثافة الليزر في خطوات 0.5٪ وتسجيل إشارة المقابلة.
- تطبيق الروتين لكلا خطوط الليزر.
- تعديل الليزر مع وضع الانعكاس
- استخدام بئر فارغة للتعديل.
- تطبيق عامل تصفية انعكاس، قم بتشغيل وضع الانعكاس، إذا كان متوفرا.
- تأكد من أن نطاق الطول الموجي للكاشف يغطي الطول الموجي لليزر.
- اختر وضع مسح الخط وعرض الرسم البياني.
- خفض كثافة الليزر إلى أدنى حد ممكن، وضبط كسب كاشف للضوضاء الخلفية للكشف.
- نقل الهدف إلى الموضع الأدنى.
- نقل الهدف لأعلى حتى انعكاس coverslip مرئيا.
- زيادة كثافة الليزر في خطوات 0.5٪ وتسجيل إشارة المقابلة.
- تطبيق الروتين لكلا خطوط الليزر.
- تقييم البيانات
- جدولة البيانات وفرز البيانات حسب كثافة الإشارة.
- رسم كثافة الإشارة ضد قوة الليزر النسبية.
- اختر كثافة الليزر التي تؤدي إلى كثافة إشارة مماثلة.
3. تعديل المولات الضوئية
ملاحظة: بعد تعديل الليزر، تم ضبط المولات الضوئية على المكاسب الفردية للحصول على حساسية مماثلة. وقد تم إجراء هذه المعايرة مع خط الليزر 514 نانومتر، الذي هو في وسط نطاق الطول الموجي للاهتمام.
- استخدام بئر فارغة للتعديل.
- تطبيق عامل تصفية انعكاس، والتبديل إلى وضع الانعكاس إذا كان متوفرا.
- تأكد من أن نطاق الطول الموجي للكاشف يغطي الطول الموجي لليزر (514 نانومتر).
- اختر وضع مسح الخط وعرض الرسم البياني.
- خفض كسب كاشف إلى نصف الحد الأقصى، وضبط كثافة الليزر للضوضاء الخلفية للكشف.
- نقل الهدف إلى الموضع الأدنى.
- نقل الهدف لأعلى حتى انعكاس coverslip مرئيا.
- زيادة كسب كاشف في خطوات من 50 إلى 100 V وتسجيل إشارة المقابلة.
- تطبيق الخطوات 3.1 إلى 3.8 لكلا الكاشفين.
- تقييم البيانات
- رسم كثافة ضد كسب كاشف لكل كاشف.
- اختيار مكاسب كاشف الفردية للحصول على حساسية مماثلة.
4. FRET اقتناء الصور
ملاحظة: ابدأ بعينة الاهتمام لإعداد الحصول على الصورة.
- اختر المرشحات المناسبة/ المرايا ال dichroic، على سبيل المثال، مرآة مزدوجة ثنائية الديكرويك MBS 458/514 لEFP/EYFP زوج FRET. استخدم نفس المرآة الديكهروبية لكافة القنوات لتمكين المسح الضوئي سطرا سطرا. حدد هدف الغمر بالماء لتصوير الخلايا الحية. اختر المسح الضوئي 12 بت أو 16 بت وسرعة المسح الضوئي المعتدلة.
- تحديد نطاق الكشف، ويفضل 470-510 نانومتر للكشف عن المانحين و 530-600 نانومتر للكشف عن المقبول / FRET في حالة ECFP / EYFP. عند استخدام ليزر ثنائي 445 نانومتر أو 440 نانومتر، استخدم 450 إلى 510 نانومتر كمد كشف. في حالة مقسم شعاع acousto-optic (AOBS)، حدد كشف المتبرع في نطاق 450 إلى 500 نانومتر لمنع الكشف عن المقبول غير المرغوب فيه.
- تطبيق إعداد كاشف وفقا ل3.10.2.
- تطبيق الإعداد الليزر وفقا ل2.3.2. راجع كثافة الليزر استنادا إلى جدول طاقة الليزر الذي تم الحصول عليه، إذا لزم الأمر. تأكد من أن نسبة الإشارة إلى الضوضاء تغطي النطاق الديناميكي الكامل للكاشفات (تتراوح الكثافة من 0 إلى 4095 للمسح الضوئي 12 بت).
- الحفاظ على كثافة الليزر والمكاسب كاشف ثابت. استخدام قطر الثقب لضبط.
ملاحظة: ضع في اعتبارك أن التغييرات في قطر الثقب تؤثر على الدقة المكانية. - إجراء القياسات (التقاط صور ل 20 خلية على الأقل).
5. تحديد التصحيحات عبر الحديث
ملاحظة: الخلايا التي تعبر فقط عن المتبرع أو المقبول مطلوبة لتحديد النزيف الطيفي المانح (DSBT) والنزيف الطيفي المقبول (ASBT) على التوالي. احتفظ بنفس الإعدادات الموضحة في القسم 4.
- إجراء قياسات FRET مع الخلايا التي تعبر عن الفلوروفور المانحة.
- إجراء قياسات FRET مع الخلايا التي تعبر عن الفلوروفور المقبول.
6. معايرة القياسات وفقا ل Beemiller وآخرون.13
ملاحظة: الخلايا التي تعبر عن اندماج المانحة المقبولة من كفاءة FRET المعروفة مطلوبة. هنا، تم استخدام ECFP-5 aa-EYFP-fusion بكفاءة FRET تبلغ 0.464. احتفظ بنفس الإعدادات الموضحة في القسم 4.
- إجراء قياسات FRET مع الخلايا التي تعبر عن اندماج المتبرع- المقبول
7. تقييم البيانات
- الحصول على التشكيلات الجانبية للخلايا، تأكد من أن كل ملف تعريف يحتوي على خلية واحدة لا يزيد عن. حفظ ملفات التعريف كملفات نصية.
- استيراد الملفات النصية إلى جدول بيانات باستخدام خيار استيراد الملف النصي في المقطع بيانات .
- قراءة القيم القصوى بتطبيق الدالة Max .
- قم بإدراج القيم التي تم الحصول عليها في جدول، وتحتوي على عمود لكل من معرف الانبعاثات الخاص بالمانحين، و FRET من الانبعاثات IF، و IA لانبعاثات المقبولين، وأربع مجموعات بيانات على الأقل: المانح فقط، والقبول فقط، وانصهار المانحين المقبولين، والقياس.
ملاحظة: الإثارة من المانح يؤدي أيضا إلى الإثارة المباشرة للمقبل ويسبب ASBT التي يتم وصفها من قبل القيمة α. - حساب قيم α ASBT مع مجموعة بيانات المقبول فقط باستخدام المعادلة (1).
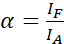 (1) الهيئة
(1) الهيئة
ملاحظة: استخدم الوسيط لكافة α-القيم في المعادلات التالية. ويظهر المانح طيفا واسعا من الانبعاثات يؤدي إلى التحدث المتبادل مع الانبعاثات الحساسة للمقبل. يتم إعطاء DSBT هذه بالقيمة β. - حساب قيم β النزف الطيفي للمانحين باستخدام مجموعة البيانات الخاصة بالمانحين فقط باستخدام المعادلة (2).
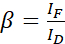 (2) الهيئة المعنية بالاتصالات
(2) الهيئة المعنية بالاتصالات
ملاحظة: استخدم الوسيط لكافة القيم β في المعادلات التالية. ويصف عامل المعايرة ξ العلاقة الخطية بين إخماد المانحين المشتق من FRET وانبعاث المقبول. استخدم الوسيطات 7.5 و 7.6 في المعادلات التالية. - احسب عوامل المعايرة ξ مع مجموعة بيانات الاندماج بين المانح والمقبل وكفاءة FRET E (0.46) باستخدام المعادلة (3).
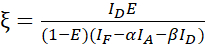 (3) الهيئة
(3) الهيئة
ملاحظة: استخدم الوسيط لكافة القيم ξ في المعادلات التالية. - حساب الكفاءة FRET من زوج البروتين من الفائدة باستخدام المعادلات (4) و (5).
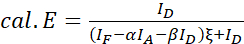 (4) الهيئة
(4) الهيئة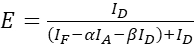 (5) 10- الأصوات التي تم 1
(5) 10- الأصوات التي تم 1 - تقدير تأثيرات قوة التعبير و/أو نسبة المانح إلى المقبول: رسم مجموع معرف، IF، و IA مقابل كفاءة FRET. تنفيذ انحدار خطي; لاحظ أنه كلما كان الرسم البياني أكثر حدة وكلما كان R2 أعلى ، كلما كان تأثير مستوى التعبير أو أكبر هو الفرق بين وفرة المانح والمقببول.
النتائج
تعديل المجهر الليزر المسح confocal
وكشف تعديل الليزر عن زيادة خطية في الانبعاثات مع زيادة كثافة الليزر (الشكل 2 والجدول 1). وكما هو متوقع بالنسبة لأشعة الليزر الآيونية الأرجونية، كان انبعاث خط 514 نانومتر أعلى بكثير من انبعاث خط 458 نانومتر، كما يتضح من منحدر أ?...
Discussion
ويتميز إخماد المانحين وانبعاثات المقبولين الحساسين بعلاقة خطية تسمح إما بحساب FRET القائم على المانح أو المقبول. وتسمى العوامل المقابلة للخطية إما عامل G (المانح للمقبل) أو الحادي عشر (المقبول للمتبرع)، وهما قيم متبادلة4. قياس FRET بين البروتينات الفلورية عن طريق المجهر الفلوري غ?...
Disclosures
نحن نضمن أن جميع المؤلفين قد كشفوا عن أي وجميع تضارب المصالح وليس لديهم مصالح مالية متنافسة.
Acknowledgements
أجريت التجارب في منصة تكنولوجيا المجهر الخفيف (LiMiTec) التابعة لكلية البيولوجيا، جامعة بيليفيلد. وقد مولت جامعة بيليفيلد هذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
References
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved