Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesures de transfert d’énergie par résonance de Förster dans des cellules végétales vivantes
Dans cet article
Résumé
Un protocole est prévu pour la mise en place d’un microscope confocal à balayage laser standard pour les mesures in vivo de transfert d’énergie par résonance de Förster, suivies d’une évaluation des données.
Résumé
Les expériences de transfert d’énergie de résonance de Förster (FRET) basées sur des émissions sensibilisées sont faciles à réaliser, mais dépendent de la configuration microscopique. Les microscopes confocaux à balayage laser sont devenus un cheval de bataille pour les biologistes. Les systèmes commerciaux offrent une grande flexibilité dans le réglage de la puissance laser et la sensibilité du détecteur et combinent souvent différents détecteurs pour obtenir l’image parfaite. Cependant, la comparaison des données basées sur l’intensité de différentes expériences et configurations est souvent impossible en raison de cette flexibilité. Les procédures conviviales pour les biologistes sont avantageuses et permettent un réglage simple et fiable des réglages du laser et du détecteur.
De plus, comme les expériences FRET dans des cellules vivantes sont affectées par la variabilité de l’expression des protéines et des rapports donneur-accepteur, les niveaux d’expression des protéines doivent être pris en compte pour l’évaluation des données. Décrit ici est un protocole simple pour des mesures FRET fiables et reproductibles, y compris des routines pour l’estimation de l’expression des protéines et l’ajustement de l’intensité laser et des paramètres du détecteur. L’évaluation des données sera effectuée par étalonnage avec une fusion de fluorophores de l’efficacité FRET connue. Pour améliorer la simplicité, des facteurs de correction ont été comparés qui ont été obtenus dans les cellules et en mesurant des protéines fluorescentes recombinantes.
Introduction
Le transfert d’énergie de résonance de Förster ((F)RET) est généralement observé par spectroscopie de fluorescence, bien que le processus lui-même ne se limite pas à se produire entre les fluorophores. Le couplage dipôle-dipôle sous-jacent nécessite simplement une molécule donneuse émettant de la lumière et un accepteur absorbant la lumière. Ceci est dérivé de l’intégrale de chevauchement spectral requise J des spectres normalisés d’émission du donneur et d’absorbance de l’accepteur1. Cependant, comme le RET est en concurrence avec la fluorescence, le transfert d’énergie devient mesurable par des altérations de l’émission de fluorescence : le RET induit la trempe du donneur et l’émission d’accepteur sensibilisé.
Le RET à base de fluorophore a été appelé transfert d’énergie de résonance de fluorescence (FRET) pour le séparer du transfert d’énergie de résonance de bioluminescence (BRET). Le RET dépend fortement de la distance entre le donneur et l’accepteur, qui est largement comprise entre 0,5 et 10 nm2 et donc dans la même gamme que les dimensions des protéines et de leurs complexes. Deuxièmement, RET dépend de l’orientation dipôle-dipôle kappa au carré. Combiné au fait que la liberté de rotation des fluorophores liés aux protéines peut être négligée en raison du poids moléculaire et de la relaxation rotationnelle lente, RET permet l’analyse des altérations conformationnelles3.
Le rayon de Förster est basé sur l’intégrale du chevauchement spectral et la gamme de longueurs d’onde du chevauchement, de sorte que les chromophores absorbant la lumière rouge entraînent des rayons de Förster plus longs que les colorants absorbant la lumière bleue. Comme la plage dynamique des mesures FRET est limitée de 0,5 × R0 et de 1,5 × R0, la paire FRET ECFP-EYFP a une plage dynamique de 2,5 à 7,3 nm en raison de son R0 de 4,9 nm4.
La luminosité d’un fluorophore est donnée par le produit de son coefficient d’extinction molaire et de son rendement quantique. Pour les mesures FRET, il est avantageux de choisir des fluorophores de luminosité presque similaire. Cela améliore la détection de la trempe du donneur et de l’émission d’accepteurs sensibilisés. Il favorise également l’étalonnage du système de microscopie. En regardant les paires FRET fréquemment utilisées de protéines cyan et fluorescentes, la luminosité plus faible des protéines fluorescentes cyan devient évidente (Figure 1A).
Cependant, la durée de vie de l’accepteur doit être inférieure à la durée de vie du donneur, ce qui garantit la disponibilité de l’accepteur pour le transfert d’énergie. Si la durée de vie de l’accepteur dépasse la durée de vie du donneur, l’accepteur peut encore être dans l’état excité lorsque le donneur est à nouveau excité. Les protéines fluorescentes cyan avancées telles que mTurquoise montrent une durée de vie prolongée et contribuent ainsi à une probabilité accrue de FRET (Figure1B). La probabilité de FRET dépend également du coefficient d’extinction molaire de l’accepteur.
Protocole
REMARQUE: Pour le protocole suivant, une transfection transitoire des protoplastes a été effectuée, comme décrit précédemment12. Une brève description est donnée ci-dessous.
1. Transfection transitoire des protoplastes
- Couper ~4 g de feuilles saines de l’écotype Columbia d’Arabidopsis thaliana en tranches de 1 mm et les transférer dans 20 mL de solution enzymatique (1,5 % de cellulase ; 0,4 % de macérozyme ; 0,1 % d’albumine sérique bovine Fraction V ; 0,4 M de mannitol ; 20 mM de KCl ; 20 mM d’acide 2-(N-morpholino)éthanesulfonique (MES), pH 5,7 ; 10 mM de CaCl2).
- Infiltrer sous vide les tranches de feuilles suivie d’une incubation avec agitation pendant 2 h à température ambiante. Récolter les cellules par centrifugation pendant 3 min à 100 × g.
- Laver les protoplastes avec une solution de W5 (154 mM naCl; 125 mM CaCl2; 5 mM KCl; 2 mM MES, pH 5,7) et les remettre en suspension dans une solution MMG (0,4 M mannitol; 15 mM MgCl2; 4 mM MES, pH 5,7).
- Effectuer la transfection dans une lame de 8 puits par choc osmotique en présence de polyéthylèneglycol (PEG) 4000. Mélanger 20 μL de la suspension de protoplaste avec 5 μL d’ADN plasmidique (5 μg/μL) et 25 μL de solution de PEG (0,2 M de mannitol, 0,1 M caCl2, 40 % de PEG 4000).
- Inverser le choc osmotique par un réajustement en douceur des conditions osmotiques.
REMARQUE: Outre l’échantillon d’intérêt, l’expression du donneur seul et de l’accepteur seul est nécessaire pour déterminer le saignement spectral du donneur et de l’accepteur, respectivement. Une protéine de fusion du donneur et de l’accepteur doit également être exprimée à des fins d’étalonnage. L’expression de la protéine fluorescente était sous le contrôle d’un promoteur 35S du virus de la mosaïque du chou-fleur (pCaMV35S). Pour toutes les mesures, deux microscopes confocaux à balayage laser (LSM1 et LSM2) ont été utilisés. LSM1 dispose de deux types de détecteurs : pour les mesures FRET, le signal donneur a été détecté par un détecteur GaAsP, tandis que FRET et l’émission d’accepteur ont été enregistrés avec un photomultiplicateur. LSM2 a deux photomultiplicateurs, qui ont été utilisés pour la détection du donneur, FRET, et l’émission de l’accepteur.
2. Réglage au laser
REMARQUE: Ici, des lignes de 458 nm et 514 nm d’un laser argon-ion ont été appliquées pour l’analyse FRET entre les protéines fluorescentes cyan améliorées (ECFP) et les protéines fluorescentes jaunes améliorées (EYFP). Pour l’acquisition de données reproductibles, les deux lignes ont été ajustées à une intensité similaire. Ceci a été réalisé soit par un photomultiplicateur de transmission, soit par le mode de réflexion.
- Réglage laser avec un photomultiplicateur de transmission
- Utilisez un puits vide pour l’ajustement.
- Choisissez le mode de balayage linéaire et la vue histogramme.
- Diminuez l’intensité du laser au minimum et ajustez le gain du détecteur au bruit de fond détectable.
- Augmentez l’intensité du laser par pas de 0,5% et enregistrez le signal correspondant.
- Appliquez la routine pour les deux lignes laser.
- Réglage laser avec mode réflexion
- Utilisez un puits vide pour l’ajustement.
- Appliquez un filtre de réflexion, activez le mode de réflexion, le cas échéant.
- Assurez-vous que la gamme de longueurs d’onde du détecteur couvre la longueur d’onde du laser.
- Choisissez le mode de balayage de ligne et la vue d’histogramme.
- Diminuez l’intensité du laser au minimum et ajustez le gain du détecteur au bruit de fond détectable.
- Déplacez l’objectif à la position la plus basse.
- Déplacez l’objectif vers le haut jusqu’à ce que le reflet du couvercle soit visible.
- Augmentez l’intensité du laser par pas de 0,5% et enregistrez le signal correspondant.
- Appliquez la routine pour les deux lignes laser.
- Évaluation des données
- Tabulez les données et triez les données par intensité de signal.
- Tracez les intensités du signal par rapport à la puissance laser relative.
- Choisissez des intensités laser qui se traduisent par une intensité de signal similaire.
3. Réglage des photomultiplicateurs
REMARQUE: Après ajustement laser, les photomultiplicateurs ont été ajustés aux gains individuels pour obtenir une sensibilité similaire. Cet étalonnage a été effectué avec la ligne laser 514 nm, qui se trouve au centre de la gamme de longueurs d’onde d’intérêt.
- Utilisez un puits vide pour l’ajustement.
- Appliquez un filtre de réflexion et passez en mode de réflexion si disponible.
- Assurez-vous que la gamme de longueurs d’onde du détecteur couvre la longueur d’onde du laser (514 nm).
- Choisissez le mode de balayage de ligne et la vue d’histogramme.
- Réduisez le gain du détecteur à la moitié du maximum et ajustez l’intensité du laser au bruit de fond détectable.
- Déplacez l’objectif à la position la plus basse.
- Déplacez l’objectif vers le haut jusqu’à ce que le reflet du couvercle soit visible.
- Augmentez le gain du détecteur par pas de 50 à 100 V et enregistrez le signal correspondant.
- Appliquez les étapes 3.1 à 3.8 pour les deux détecteurs.
- Évaluation des données
- Tracez l’intensité par rapport au gain du détecteur pour chaque détecteur.
- Choisissez les gains individuels du détecteur pour obtenir une sensibilité similaire.
4. Acquisition d’images FRET
REMARQUE: Commencez par l’échantillon d’intérêt pour la configuration de l’acquisition d’images.
- Choisissez les filtres/miroirs dichroïques appropriés, par exemple, un miroir double dichroïque MBS 458/514 pour la paire FRET ECFP/EYFP. Utilisez le même miroir dichroïque pour tous les canaux afin de permettre le balayage ligne par ligne. Sélectionnez un objectif d’immersion dans l’eau pour l’imagerie des cellules vivantes. Choisissez une analyse 12 bits ou 16 bits et une vitesse d’analyse modérée.
- Définir la plage de détection, de préférence 470-510 nm pour la détection du donneur et 530-600 nm pour la détection accepteur/FRET dans le cas de l’ECFP/EYFP. Lorsque vous utilisez un laser à diode de 445 nm ou 440 nm, utilisez 450 à 510 nm comme plage de détection. Dans le cas d’un séparateur de faisceau acousto-optique (AOBS), définissez la détection du donneur dans la plage de 450 à 500 nm pour éviter la détection d’accepteurs indésirables.
- Appliquer le réglage du détecteur conformément à la section 3.10.2.
- Appliquez le réglage laser conformément à la section 2.3.2. Révisez l’intensité du laser en fonction de la table de puissance laser obtenue, si nécessaire. Assurez-vous que le rapport signal/bruit couvre toute la plage dynamique des détecteurs (intensité allant de 0 à 4095 pour un balayage 12 bits).
- Maintenez les intensités laser et les gains du détecteur constants. Utilisez le diamètre du sténopé pour affiner le réglage.
REMARQUE: Gardez à l’esprit que les changements dans le diamètre du sténopé affectent la résolution spatiale. - Effectuez les mesures (prenez des images d’au moins 20 cellules).
5. Détermination des corrections de diaphonie
REMARQUE : Les cellules exprimant uniquement le donneur ou l’accepteur sont nécessaires pour déterminer le saignement spectral du donneur (DSBT) et le saignement spectral de l’accepteur (ASBT), respectivement. Conservez les mêmes paramètres que ceux décrits à la section 4.
- Effectuer des mesures FRET avec des cellules exprimant le fluorophore donneur.
- Effectuer des mesures FRET avec des cellules exprimant le fluorophore accepteur.
6. Étalonnage des mesures selon Beemiller et al.13
REMARQUE: Les cellules exprimant une fusion donneur-accepteur de l’efficacité FRET connue sont nécessaires. Ici, une fusion ECFP-5 aa-EYFP avec un rendement FRET de 0,46 a été utilisée4. Conservez les mêmes paramètres que ceux décrits à la section 4.
- Effectuer des mesures FRET avec des cellules exprimant la fusion donneur-accepteur
7. Évaluation des données
- Obtenez des profils de ligne des cellules, en vous assurant que chaque profil ne contient pas plus d’une cellule. Enregistrez les profils sous forme de fichiers texte.
- Importez les fichiers texte dans une feuille de calcul à l’aide de l’option d’importation de fichier texte de la section Données .
- Lisez les valeurs maximales en appliquant la fonction Max .
- Énumérez les valeurs obtenues dans un tableau, ayez chacune une colonne pour l’ID d’émission du donneur, l’IF d’émission FRET, l’IA d’émission de l’accepteur et au moins quatre ensembles de données : donneur seulement, accepteur uniquement, fusion donneur-accepteur et mesure.
REMARQUE: L’excitation du donneur entraîne également une excitation directe de l’accepteur et provoque une ASBT décrite par la valeur α. - Calculez les valeurs de α ASBT avec le jeu de données accepteur uniquement à l’aide de l’équation (1).
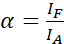 (1)
(1)
Remarque : Utilisez la médiane de toutes les valeurs α dans les équations suivantes. Le donneur présente un large spectre d’émission qui se traduit par une diaphonie d’émission avec l’émission sensibilisée de l’accepteur. Cette DSBT est donnée par la valeur β. - Calculez les valeurs de β de fond perdu spectral du donneur avec l’ensemble de données du donneur uniquement à l’aide de l’équation (2).
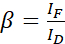 (2)
(2)
Remarque : Utilisez la médiane de toutes les valeurs β dans les équations suivantes. Le facteur d’étalonnage ξ décrit la relation linéaire entre la trempe du donneur dérivée de FRET et l’émission sensibilisée de l’accepteur. Utilisez les médianes de 7,5 et 7,6 dans les équations suivantes. - Calculer les facteurs d’étalonnage ξ avec l’ensemble de données de fusion donneur-accepteur et son efficacité FRET E (0,46) à l’aide de l’équation (3).
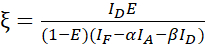 (3)
(3)
REMARQUE : Utilisez la médiane de toutes les valeurs ξ dans les équations suivantes. - Calculer les rendements FRET de la paire de protéines d’intérêt à l’aide des équations (4) et (5).
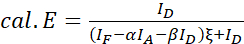 (4)
(4)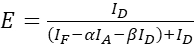 (5)
(5) - Estimer les effets de la force d’expression et/ou du rapport donneur-accepteur : tracer la somme des ID, IF et IA par rapport aux efficacités FRET. Effectuer une régression linéaire ; Notez que plus le graphique est raide et plus R2 est élevé, plus l’impact du niveau d’expression est élevé ou plus la différence d’abondance entre donneur et accepteur est grande.
Résultats
Réglage du microscope confocal à balayage laser
Le réglage laser a révélé une augmentation linéaire de l’émission avec une augmentation de l’intensité du laser (figure 2 et tableau 1). Comme prévu pour les lasers argon-ion, l’émission de la ligne de 514 nm était beaucoup plus élevée que l’émission de la ligne de 458 nm, comme en témoigne une pente plus raide. Pour les expériences ultérieures, une puissance laser de 4,5% et 6,5% a...
Discussion
La trempe du donneur et l’émission d’accepteur sensibilisée sont caractérisées par une relation linéaire qui permet le calcul du FRET basé sur le donneur ou l’accepteur. Les facteurs de linéarité correspondants sont appelés facteur G (donneur à accepteur) ou xi (accepteur à donneur), qui sont des valeurs réciproques4. La mesure de FRET entre les protéines fluorescentes par microscopie à fluorescence nécessite souvent des corrections pour le DSBT et l’ASBT en raison des large...
Déclarations de divulgation
Nous nous assurons que tous les auteurs ont divulgué tous les conflits d’intérêts et n’ont pas d’intérêts financiers concurrents.
Remerciements
Les expériences ont été réalisées à la plate-forme technologique de microscopie optique (LiMiTec) de la Faculté de biologie de l’Université de Bielefeld. Ce travail a été financé par l’Université de Bielefeld.
matériels
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
Références
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon