Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yaşayan Bitki Hücrelerinde Förster Rezonans Enerji Transferi Ölçümleri
Bu Makalede
Özet
In vivo Förster rezonans enerji transferi ölçümleri için standart bir konfokal lazer tarama mikroskobu kurmak ve ardından veri değerlendirmesi için bir protokol sağlanmıştır.
Özet
Hassaslaştırılmış emisyon bazlı Förster rezonans enerji transferi (FRET) deneyleri kolayca yapılır, ancak mikroskobik kuruluma bağlıdır. Konfokal lazer tarama mikroskopları biyologlar için bir çalışma atı haline gelmiştir. Ticari sistemler lazer güç ayarı ve dedektör hassasiyetinde yüksek esneklik sunar ve genellikle mükemmel görüntüyü elde etmek için farklı dedektörleri birleştirir. Ancak, farklı denemelerden ve kurulumlardan gelen yoğunluğa dayalı verilerin karşılaştırılması genellikle bu esneklik nedeniyle imkansızdır. Biyolog dostu prosedürler avantajlıdır ve lazer ve dedektör ayarlarının basit ve güvenilir bir şekilde ayarlanmasında izin verir.
Ayrıca canlı hücrelerde yapılan FRET deneyleri protein ekspresyosu ve donör-kabul edici oranlarındaki değişkenliklerden etkilendiği için veri değerlendirmesi için protein ekspresyon düzeylerinin göz önünde bulundurulmalıdır. Burada, protein ekspresyonunun tahmini ve lazer yoğunluğunun ve dedektör ayarlarının ayarlanması için rutinler de dahil olmak üzere güvenilir ve tekrarlanabilir FRET ölçümleri için basit bir protokol açıklanmıştır. Veri değerlendirmesi, bilinen FRET verimliliğinin florofor füzyonu ile kalibrasyon ile yapılacaktır. Basitliği artırmak için hücrelerde ve rekombinant floresan proteinlerin ölçülerek elde edilen düzeltme faktörleri karşılaştırılmıştır.
Giriş
Förster rezonans enerji transferi ((F)RET) tipik olarak floresan spektroskopisi ile gözlenir, ancak sürecin kendisi floroforlar arasında meydana gelmekle sınırlı değildir. Alttaki dipol-dipol bağlantısı sadece ışık yayan bir donör molekülü ve ışık emici bir alıcı gerektirir. Bu, normalleştirilmiş donör emisyonu ve alıcı emici absorbans spektrumunun gerekli spektral örtüşümü integral J'den türetilmiştir1. Bununla birlikte, RET floresan ile rekabet ettiği için, enerji transferi floresan emisyonundaki değişikliklerle ölçülebilir hale gelir: RET, donörlerin söndürülmesine ve duyarlı kabul edilebilir emisyona neden olur.
Florofor bazlı RET, biyolüminesans rezonans enerji transferinden (BRET) ayırmak için floresan rezonans enerji transferi (FRET) olarak adlandı. RET, donör ve alıcı arasındaki mesafeye bağlıdır, bu da yaygın olarak 0.5-10 nm2 aralığındadır ve böylece proteinlerin boyutları ve kompleksleri ile aynı aralıktadır. İkinci olarak, RET dipol-dipol oryantasyon kappa kare bağlıdır. Moleküler ağırlık ve yavaş dönme gevşemesi nedeniyle proteine bağlı floroforların dönme özgürlüğünün ihmal edilebildiği gerçeğiyle birleştiğinde, RET konformasyonel değişikliklerin analizine izin verir3.
Förster yarıçapı, spektral örtüşme integraline ve örtüşmenin dalga boyu aralığına dayanır, böylece kırmızı ışık emici kromoforlar mavi ışık emici boyalardan daha uzun Förster yarıçapı ile sonuçlanır. FRET ölçümlerinin dinamik aralığı R0 × 0,5 ve R0 × 1,5 ile sınırlı olduğundan, FRET çifti ECFP-EYFP 4,9 nm4 R0 nedeniyle 2,5-7,3 nm dinamik aralığına sahiptir.
Bir floroforun parlaklığı, azı dişi yok olma katsayısının ve kuantum veriminin ürünü ile verilir. FRET ölçümleri için, neredeyse benzer parlaklığa sahip floroforları seçmek avantajlıdır. Bu, donör söndürme ve duyarlı kabul eden emisyonun tespitini artırır. Ayrıca mikroskopi sisteminin kalibrasyonunu da tercih eder. Sık kullanılan FRET siyan ve floresan protein çiftlerine bakıldığında, siyan floresan proteinlerin daha düşük parlaklığı belirgin hale gelir (Şekil 1A).
Bununla birlikte, alıcının ömrü, bağışçının enerji transferi için kullanılabilirliğini sağlamak için donörün ömründen daha düşük olmalıdır. Kabul edenin ömrü donörün ömrünü aşarsa, bağışçı tekrar heyecanlandığında kabul eden kişi hala heyecanlı durumda olabilir. mTurquoise gibi gelişmiş siyan floresan proteinler uzun bir ömür gösterir ve böylece FRET olasılığının artmasına katkıda bulunur (Şekil1B). FRET olasılığı da kabul edenin azı dişi yok olma katsayısına bağlıdır.
Protokol
NOT: Aşağıdaki protokol için, daha önce açıklandığı gibi protoplastların geçici transfeksiyonı gerçekleştirildi12. Aşağıda kısa bir açıklama verilmiştir.
1. Protoplastların geçici transfeksiyon
- Arabidopsis thaliana ecotype Columbia'nın ~4 g sağlıklı yapraklarını 1 mm dilimler halinde kesin ve 20 mL enzim çözeltisine (%1,5 selüloz) aktarın; %0.4 macerozim; %0.1 sığır serum albümin Fraksiyonu V; 0.4 M mannitol; 20 mM KCl; 20 mM 2-(N-morpholino)etanesülfonic asit (MES), pH 5.7; 10 mM CaCl2).
- Yaprak dilimlerine vakumla sızın ve ardından oda sıcaklığında 2 saat boyunca ajitasyonlu bir inkübasyon. Hücreleri 100 × g'da 3 dakika santrifüjleme ile hasat edin.
- Protoplastları W5 çözeltisi (154 mM NaCl; 125 mM CaCl2; 5 mM KCl; 2 mM MES, pH 5.7) ile yıkayın ve MMG çözeltisinde (0.4 M mannitol; 15 mM MgCl2; 4 mM MES, pH 5.7) yeniden kullanın.
- Polietilenglikkol (PEG) 4000 varlığında osmotik şok ile 8 kuyu kaydırakta transfeksiyonu gerçekleştirin. Protoplast süspansiyonunun 20 μL'sini 5 μL plazmid DNA (5 μg/μL) ve 25 μL PEG çözeltisi (0,2 M mannitol, 0,1 M CaCl2, %40 PEG 4000) ile karıştırın.
- Ozmotik koşulların hafifçe yeniden düzenlenerek ozmotik şoku tersine çevirin.
NOT: İlgi örneğinin yanı sıra, donörün ve kabul edenin spektral kanamasını belirlemek için tek başına donör ve tek başına alıcı ifadesi gereklidir. Donörün ve alıcının bir füzyon proteini de kalibrasyon amacıyla ifade edilmelidir. Floresan protein ifadesi karnabahar mozaik virüs 35S promotörünün (pCaMV35S) kontrolü altındaydı. Tüm ölçümlerde iki konfokal lazer tarama mikroskobu (LSM1 ve LSM2) kullanılmıştır. LSM1'in iki tür dedektörü vardır: FRET ölçümleri için donör sinyali bir GaAsP dedektörü tarafından tespit edilirken, FRET ve alıcı emisyonu bir fotomultiplier ile kaydedildi. LSM2 donör, FRET ve kabul eden emisyonun tespiti için kullanılan iki fotomultipliere sahiptir.
2. Lazer ayarı
NOT: Burada gelişmiş camgöbeği floresan proteini (ECFP) ve gelişmiş sarı floresan protein (EYFP) etiketli proteinler arasında FRET analizi için 458 nm ve 514 nm çizgi argon-iyon lazer uygulanmıştır. Tekrarlanabilir veri toplama için her iki satır da benzer yoğunluğa göre ayarlandı. Bu, bir iletim fotomultiplier veya yansıma modu ile elde edildi.
- İletim fotomultiplier ile lazer ayarı
- Ayarlama için boş bir kuyu kullanın.
- Çizgi tarama modunu ve histogram görünümünü seçin.
- Lazer yoğunluğunu minimuma düşür ve dedektör kazancını tespit edilebilir arka plan gürültüsüne ayarlayın.
- Lazer yoğunluğunu % 0,5'lik adımlarla artırın ve ilgili sinyali kaydedin.
- Her iki lazer çizgisi için de rutini uygulayın.
- Yansıma modu ile lazer ayarı
- Ayarlama için boş bir kuyu kullanın.
- Yansıma filtresi uygulayın, varsa yansıma modunu kapatın.
- Dedektör dalga boyu aralığının lazerin dalga boylarını kapsadığından emin olun.
- Çizgi tarama modunu ve histogram görünümünü seçin.
- Lazer yoğunluğunu minimuma düşür ve dedektör kazancını tespit edilebilir arka plan gürültüsüne ayarlayın.
- Hedefi en düşük konuma getirin.
- Kapak parçasının yansıması görünene kadar hedefi yukarı taşıyın.
- Lazer yoğunluğunu % 0,5'lik adımlarla artırın ve ilgili sinyali kaydedin.
- Her iki lazer çizgisi için de rutini uygulayın.
- Veri değerlendirmesi
- Verileri tablolayın ve verileri sinyal yoğunluklarına göre sıralayın.
- Göreceli lazer gücüne karşı sinyal yoğunluklarını çizin.
- Benzer sinyal yoğunluğuna neden olan lazer yoğunluklarını seçin.
3. Fotomultipliers ayarı
NOT: Lazer ayarlamadan sonra fotomultiplierler benzer hassasiyet elde etmek için bireysel kazanımlara göre ayarlandı. Bu kalibrasyon, dalga boyu ilgi aralığının merkezinde yer alan 514 nm lazer hattı ile yapıldı.
- Ayarlama için boş bir kuyu kullanın.
- Yansıma filtresi uygulayın ve varsa yansıma moduna geçin.
- Dedektör dalga boyu aralığının lazerin dalga boylarını (514 nm) kapsadığından emin olun.
- Çizgi tarama modunu ve histogram görünümünü seçin.
- Dedektör kazancını maksimumun yarısına düşürün ve lazer yoğunluğunu algılanabilir arka plan gürültüsüne ayarlayın.
- Hedefi en düşük konuma getirin.
- Kapak parçasının yansıması görünene kadar hedefi yukarı taşıyın.
- 50 ila 100 V'lik adımlarla dedektör kazancını artırın ve ilgili sinyali kaydedin.
- Her iki dedektör için de 3.1 ile 3.8 arasında bir adım uygulayın.
- Veri değerlendirmesi
- Her dedektör için dedektör kazancına karşı yoğunluğu çizin.
- Benzer hassasiyet elde etmek için bireysel dedektör kazanımlarını seçin.
4. FRET görüntü alımı
NOT: Görüntü alımını ayarlamak için ilgi çekici örnekle başlayın.
- FRET çifti ECFP/EYFP için uygun filtreleri/dikroik aynaları seçin, örneğin çift dikroik ayna MBS 458/514. Satır satır taramayı etkinleştirmek için tüm kanallar için aynı dikroik aynayı kullanın. Canlı hücrelerin görüntülenmesi için bir su daldırma hedefi seçin. 12 bit veya 16 bit tarama ve orta tarama hızı seçin.
- Ecfp/EYFP durumunda tercihen donör tespiti için 470-510 nm ve kabul eden/FRET tespiti için 530-600 nm algılama aralığını tanımlayın. 445 nm veya 440 nm diyot lazer kullanırken, algılama aralığı olarak 450 ila 510 nm kullanın. Bir acousto-optik ışın ayırıcısı (AOBS) durumunda, istenmeyen alıcı tespitini önlemek için 450 ila 500 nm aralığında donör algılamasını tanımlayın.
- Dedektör ayarını 3.10.2'ye göre uygulayın.
- Lazer ayarını 2.3.2'ye göre uygulayın. Gerekirse, elde edilen lazer güç tablosuna göre lazer yoğunluğunu gözden geçirin. Sinyal-gürültü oranının dedektörlerin tüm dinamik aralığını (12 bit tarama için 0 ile 4095 arasında değişen yoğunluk) kapsadığından emin olun.
- Lazer yoğunluklarını ve dedektör kazanımlarını sabit tutun. İnce ayar için iğne deliği çapını kullanın.
NOT: İğne deliği çapındaki değişikliklerin uzamsal çözünürlüğü etkilediğini unutmayın. - Ölçümleri gerçekleştirin (en az 20 hücrenin görüntülerini alın).
5. Çapraz konuşma düzeltmelerinin belirlenmesi
NOT: Donör spektral kanamayı (DSBT) ve kabul eden spektral kanamayı (ASBT) sırasıyla belirlemek için sadece bağışçıyı veya kabul edeni ifade eden hücreler gereklidir. Bölüm 4'te açıklanan ayarları koruyun.
- Donör floroforu ifade eden hücrelerle FRET ölçümleri gerçekleştirin.
- Kabul eden floroforu ifade eden hücrelerle FRET ölçümleri gerçekleştirin.
6. Ölçümlerin Beemiller ve ark.13'e göre kalibrasyonu
NOT: Bilinen FRET verimliliğinin donör-alıcı füzyonunu ifade eden hücreler gereklidir. Burada 0,46 FRET verimli bir ECFP-5 aa-EYFP-füzyon kullanılmıştır4. Bölüm 4'te açıklanan ayarları koruyun.
- Donör-alıcı füzyonunu ifade eden hücrelerle FRET ölçümleri gerçekleştirin
7. Veri değerlendirmesi
- Her profilin birden fazla hücre içermemesini sağlayarak hücrelerin çizgi profillerini elde edin. Profilleri metin dosyaları olarak kaydedin.
- Veri bölümündeki metin dosyası içe aktarma seçeneğini kullanarak metin dosyalarını elektronik tabloya alın.
- Max işlevini uygulayarak en büyük değerleri okuyun.
- Elde edilen değerleri bir tabloda listeleyin, her biri donör emisyon kimliği, FRET emisyon IF, kabul eden emisyon IA ve en az dört veri kümesi için bir sütuna sahip olun: yalnızca donör, yalnızca kabul eden, bağışçı-alıcı füzyonu ve ölçüm.
NOT: Donörün çıkarılması da kabul edenin doğrudan çıkarılmasına neden olur ve α değeri ile tanımlanan ASBT'ye neden olur. - ASBT α değerlerini denklemi (1) kullanarak yalnızca alıcı veri kümesiyle hesaplayın.
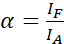 (1)
(1)
NOT: Aşağıdaki denklemlerde tüm α değerlerin ortancasını kullanın. Donör, kabul edenin duyarlı emisyonu ile emisyon çapraz sap ile sonuçlanan geniş bir emisyon spektrumu gösterir. Bu DSBT β değeri tarafından verilir. - Denklemi kullanarak donör spektral kanama β değerlerini yalnızca donör veri kümesiyle hesaplayın (2).
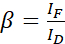 (2)
(2)
NOT: Aşağıdaki denklemlerde tüm β değerlerin ortancasını kullanın. Kalibrasyon faktörü ξ, FRET türevi donör söndürme ve alıcının duyarlı emisyonunun doğrusal ilişkisini açıklar. Aşağıdaki denklemlerde 7,5 ve 7,6 ortancalarını kullanın. - Donör-alıcı füzyon veri kümesi ve FRET verimliliği E (0,46) ile ξ kalibrasyon faktörlerini denklemi (3) kullanarak hesaplayın.
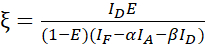 (3)
(3)
NOT: Aşağıdaki denklemlerde tüm ξ değerlerin ortancasını kullanın. - (4) ve (5) denklemlerini kullanarak protein faiz çiftinin FRET verimliliklerini hesaplayın.
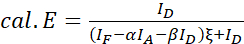 (4)
(4)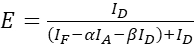 (5)
(5) - İfade gücünün ve/veya donör-alıcı oranının etkilerini tahmin edin: FRET verimliliklerine karşı kimlik, IF ve IA toplamını çizin. Doğrusal bir gerileme gerçekleştirin; grafik ne kadar dikse ve R2 ne kadar yüksekse, ifade seviyesinin etkisi o kadar yüksek veya donör ve alıcı bolluğu farkı o kadar büyüktür.
Sonuçlar
Konfokal lazer tarama mikroskopunun ayarlanmasında
Lazer ayarı, artan lazer yoğunluğu ile emisyonun doğrusal bir artışını ortaya koydu (Şekil 2 ve Tablo 1). Argon iyon lazerler için beklendiği gibi, 514 nm hattının emisyonu, daha dik bir eğimin kanıt ettiği gibi, 458 nm hattının emisyonunun çok daha yüksekti. Sonraki deneyler için sırasıyla 514 nm hattı ve 458 nm hattı için %4,5 ve %6,5 lazer gücü seçilmiştir. Bu, 1123 (514 ...
Tartışmalar
Donör söndürme ve duyarlı kabul eden emisyon, donör veya alıcı tabanlı FRET hesaplamasına izin veren doğrusal bir ilişki ile karakterize edilir. Karşılık gelen doğrusallık faktörlerine, karşılıklı değerler olan G faktörü (bağışçıdan alıcıya) veya xi (donöre kabul eden) denir4. Floresan proteinler arasındaki FRET'in floresan mikroskopi ile ölçülmesi, floresan proteinlerin geniş emilimi ve emisyon spektrumu nedeniyle genellikle DSBT ve ASBT için düzeltmeler ger...
Açıklamalar
Tüm yazarların herhangi bir çıkar çatışmasını ifşa etmelerinden ve rakip finansal çıkarları olmadığından emin olmak için.
Teşekkürler
Deneyler, Bielefeld Üniversitesi Biyoloji Fakültesi Işık Mikroskopi Teknolojisi Platformu'nda (LiMiTec) gerçekleştirildi. Bu çalışma Bielefeld Üniversitesi tarafından finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
Referanslar
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır