Method Article
التنظيف الانتقائي للنيماتودا Caenorhabditis البرية لإثراء لبكتيريا الميكروبيوم المعوية
In This Article
Summary
ترتبط الديدان الخيطية البرية بالتهاب Caenorhabditis بالعديد من الميكروبات ، غالبا في تجويف الأمعاء أو إصابة الأمعاء. هذا البروتوكول تفاصيل طريقة لإثراء الميكروبات غير قابلة للتخصيب استعمار الأمعاء، والاستفادة من مقاومة لطيف dauer.
Abstract
وقد ثبت Caenorhabditis elegans (C. elegans) ليكون نموذجا ممتازا لدراسة التفاعلات بين المضيف والميكروبيوم ، وخاصة في سياق الأمعاء. في الآونة الأخيرة ، اكتشفت العينات الإيكولوجية من الديدان الخيطية Caenorhabditis البرية مجموعة متنوعة من الميكروبات المرتبطة بها ، بما في ذلك البكتيريا والفيروسات والفطريات والميكروسبوريديا. العديد من هذه الميكروبات لديها استعمار مثير للاهتمام أو الأنماط الظاهرية العدوى التي تبرر المزيد من الدراسة، لكنها غالبا ما تكون غير قابلة للتشتيق. يقدم هذا البروتوكول طريقة لإثراء الميكروبات المعوية المطلوبة في C. elegans والديدان الخيطية ذات الصلة وتقليل وجود العديد من الميكروبات الملوثة التي تلتزم بقصل. يتضمن هذا البروتوكول إجبار الحيوانات على دخول مرحلة تطوير dauer واستخدام سلسلة من المضادات الحيوية والمنظفات لإزالة التلوث الخارجي. وبما أن الدور لديها تغيرات فسيولوجية تحمي الديدان الخيطية من الظروف البيئية القاسية، سيتم حماية أي ميكروبات معوية من هذه الظروف. ولكن لكي ينجح الإثراء، يجب الحفاظ على الميكروب الذي يهم عندما تتطور الحيوانات إلى الحيوانات. عندما تغادر الحيوانات مرحلة dauer ، يتم نشرها بشكل منفرد في خطوط فردية. ثم يتم اختيار مجموعات F1 للميكروبات المطلوبة أو الأنماط الظاهرية للعدوى وضد التلوث المرئي. ستسمح هذه الأساليب للباحثين بإثراء الميكروبات غير القابلة للتخصيب في التجويف المعوي ، والتي تشكل جزءا من الميكروبيوم الطبيعي ل C. elegans ومسببات الأمراض المعوية داخل الخلايا. ويمكن بعد ذلك دراسة هذه الميكروبات للاستعمار أو الأنماط الظاهرية للعدوى وآثارها على اللياقة البدنية المضيف.
Introduction
الكائن الحي النموذج الوراثي C. elegans هو ممتاز في نظام الجسم الحي لدراسة التفاعلات المضيفة والميكروب1،2. لديهم فسيولوجيا بسيطة نسبيا بالمقارنة مع الحيوانات الأخرى، ومع ذلك، فإن الكثير من بيولوجيا خلاياها تشبه بشكل أساسي الثدييات مما يجعلها نموذجا جيدا للبحوث البيولوجية1،3،4. بالإضافة إلى ذلك ، فهي مجهرية وسهلة الصيانة ، وتظل شفافة طوال عمرها القصير. هذه الخصائص تمكن من إجراء دراسات سريعة في الآليات التي تحكم التفاعلات بين المضيف والميكروب وتصور العدوى في الجسم الحي والاستعمار للمضيفين المرنين وراثيا5،6. وأخيرا، يستجيب C. elegans بسرعة للعدوى البكتيرية والفطرية والفيروسية، مما يجعلها نموذجا ممتازا لدراسة التفاعلات بين المضيف والميكروب وميكروبيوم الأمعاء7،8،9.
وقد سمحت زيادة في أخذ عينات من البرية C. elegans وغيرها من الديدان الخيطية للبحث في إيكولوجيا الديدان الخيطية الحية الحرة والتباين الجيني الطبيعي10،11. وفي الوقت نفسه، زادت العينات أيضا من اكتشاف مسببات الأمراض البيولوجية والميكروبات التي تحدث بشكل طبيعي والتي تتفاعل مع C. elegans12,13,14,15، مما أدى إلى إنشاء العديد من أنظمة نموذج الميكروبات المضيفة التي تدرس التفاعلات مع الفيروسات أو البكتيريا أو الميكروسبوريديا أو الأوميسيتات أو الفطريات16,17,18,19,200 . عادة، تم العثور على البرية C. elegans في ينبع المتعفنة والفواكه، وغالبا في المناخات الأكثر اعتدالا، ومعظمهم من استنساخ الذات21. عندما يتم جلب هذه العينات إلى المختبر ، يتم عزل الديدان الخيطية البرية إلى مجموعات من اللاستنساخ ، تحمل مجموعة من الميكروبات المرتبطة بها. عند اكتشاف ميكروبات جديدة ذات أهمية في الديدان الخيطية لالتهاب النيماتودا Caenorhabditis ، غالبا ما يتم فحص الحيوانات مباشرة للكشف عن العدوى أو الاستعمار عن طريق المجهر باستخدام الأنماط الظاهرية المرئية المرئية بسهولة. على سبيل المثال ، يمكن تصور العدوى الفيروسية على أنها تفكك للهياكل المعوية ، ويمكن رؤية المراحل الدقيقة داخل الخلايا المضيفة على أنها جراثيم أو meronts14،22. عندما يتم اكتشاف ميكروب مثير للاهتمام للتحقيق في المستقبل ، يجب فصله عن الميكروبات الملوثة الأخرى الموجودة في الديدان الخيطية البرية بحيث يمكن دراستها بمعزل عن غيرها. في كثير من الحالات ، لا يمكن استزراع الميكروب المثير للاهتمام في المختبر ، مما يجعل من الضروري إثراء الميكروب في النيماتودا المضيفة.
على سبيل المثال، يصف هذا البروتوكول عزل البرية من C. tropicalis تحتوي على البكتيريا التي تستعمر داخل التجويف المعوي من الديدان الخيطية، والتمسك الخلايا الظهارية المعوية بطريقة اتجاهية. فينوتيبيكيالي، تنمو البكتيريا عمودي على طول الجوانب الداخلية لللمن المعوي، مما يعطيها مظهرا يشبه الشعر الخشن، تصور على المجهر نورمارسكي القياسية في جميع مراحل الحيوان، بما في ذلك مرحلة dauer. تحتوي لوحة متوسطة نمو النيماتودا (NGM) التي نمت عليها سلالة C. tropicalis البرية على تلوث مرئي مع الميكروبات الأخرى. تم تطوير هذا البروتوكول للحد من نمو الميكروبات الملوثة إضافية على لوحات لدراسة هذه البكتيريا التمسك غير معروف. أجبرت الديدان الخيطية على دخول مرحلة الدوير لحماية البكتيريا في التجويف، ثم تم تنظيفها باستخدام سلسلة من الغسالات. بعد ذلك ، تم تحديد الأنواع البكتيرية غير المعروفة عن طريق تشريح الأمعاء وتضخيم PCR للحمض النووي الريبوسومي 16S للتسلسل.
وعموما، يمكن لهذا البروتوكول أن يثري أي ميكروب مهم مرتبط بالنيماتودا البرية التي يتم صيدها. بعد ذلك ، سيحدد الباحثون الميكروب المستهدف ، وتصور في عدوى الجسم الحي أو الظواهر الاستعمارية عن طريق المجهر ، ودراسة الآثار على اللياقة البدنية المضيف أو جوانب أخرى من التفاعلات بين المضيف والميكروب. يمكن لعزل والتحقيق في الأنواع الميكروبية الجديدة التي تتفاعل مع الديدان الخيطية Caenorhabditis الكشف عن الآليات الوراثية للمناعة المضيفة والنماذج الجديدة للتفاعلات بين المضيف والميكروب ذات الصلة بالدراسات الإمراضية الميكروبية والميكروبيوم.
Protocol
1. تحفيز تشكيل dauer للديدان الخيطية البرية على لوحات NGM
- تنمو سلالة Caenorhabditis البرية على لوحات NGM القياسية مع OP50-1 E. القولونية كمصدر للغذاء بعد الحصول على الديدان مع ميكروب غير قابل للزرع من الفائدة. احتضان الديدان الخيطية عند 20 درجة مئوية.
ملاحظة: درجة الحرارة القياسية لزراعة الديدان الخيطية Caenorhabditis بين 15-25 درجة مئوية، ولكن ينبغي تحديد تجريبيا لمنع فقدان ميكروب الفائدة. - تجويع لوحة من الحيوانات في 20 درجة مئوية لمدة 4-5 أيام حتى يتم استهلاك جميع OP50-1 والغالبية قد وصلت إلى مرحلة dauer.
ملاحظة: الدورز هي يرقات طويلة العمر تتطور بسبب غياب التغذية ولها البشرة الواقية.
2. غسل الديدان الخيطية
- إضافة 5 مل من M9 الحد الأدنى من وسائل الإعلام الأملاح (42 MM Na2HPO4، 22 MM KH2PO4، 8.6 mM NaCl، 19 mM NH4Cl) إلى لوحة 6 سم من الديدان الجائعة.
- باستخدام ماصة زجاجية معقمة ومصباح، ماصة تصل M9 والديدان من لوحة ونقلها إلى أنبوب الطرد المركزي 15 مل معقمة.
- باستخدام جهاز طرد مركزي سريري ، قم بتدفير الديدان في الأنبوب عند 1000 × ز لمدة 30 s في درجة حرارة الغرفة.
- باستخدام ماصة معقمة 15 مل، وإزالة والتخلص من الناطقة M9 فوق بيليه من الديدان. لا تزعج الديدان الحية في الجزء السفلي من الأنبوب عن طريق ترك ما يقرب من 50 ميكرولتر من M9 فوق الديدان.
- إضافة 10 مل من M9 + 0.05٪ من تريتون X-100 إلى نفس أنبوب الطرد المركزي وتشديد الغطاء أنبوب بشكل كاف.
- احتضان الأنبوب على نوتاتور لمدة 20 دقيقة في درجة حرارة الغرفة لإزالة الميكروبات الخارجية. إزالة أنبوب من نوتاتور وتدور أسفل الديدان في 1000 × ز لمدة 30 ق.
- باستخدام ماصة معقمة، وإزالة والتخلص من الناسخ M9 فوق بيليه من الديدان. لا تزعج الديدان الحية في الجزء السفلي من الأنبوب عن طريق ترك ما يقرب من 50 ميكرولتر من M9 فوق الديدان.
- اتبع وكرر الخطوات 2.5-2.8 ثلاث مرات أخرى.
3. تطهير الديدان الخيطية
- إعداد مضاد حيوي وحل SDS في 10 مل من المخزن المؤقت M9 بإضافة 0.25٪ SDS (250 ميكرولتر من 10٪ SDS)، 50 ميكروغرام/مل من كاربينسيلين، 25 ميكروغرام/مل من الكاناميسين، و12.5 ميكروغرام/مل من التتراسيكلين، و100 ميكروغرام/مل من جنتامايسين، و50 ميكروغرام/مل من الستريبتومايسين، و37.5 ميكروغرام/مل من الكلورامفينيكول، و200 ميكروغرام/مل من السيفوتاكسيم (انظر جدول المواد).
- احتضان الأنبوب الذي يحتوي على الديدان الخيطية في المضادات الحيوية ومحلول SDS على نوتاتور في درجة حرارة الغرفة بين عشية وضحاها.
ملاحظة: جميع الديدان غير dauer والأجنة سوف يموت، ولكن العديد من الديدان dauer البقاء على قيد الحياة هذه العملية التنظيف.
4. إزالة المضادات الحيوية وحل SDS
- تدور أسفل الديدان في أنبوب في 1000 × ز لمدة 1 دقيقة في درجة حرارة الغرفة. باستخدام ماصة معقمة، قم بإزالة الناطور من أنبوب الطرد المركزي دون إزعاج الديدان في الجزء السفلي من الأنبوب.
- إضافة 10 مل من M9 + 0.05٪ تريتون X-100 وتشديد الغطاء بشكل كاف من الأنبوب. احتضان الأنبوب على نوتاتور لمدة 20 دقيقة في درجة حرارة الغرفة.
- إزالة أنبوب من نوتاتور وتدور أسفل الديدان في 1000 × ز لمدة 1 دقيقة. اتبع وكرر الخطوات 4.2-4.3 ثلاث مرات.
- بعد الغسيل الأخير ، اترك بيليه الدودة دون إزعاج في الجزء السفلي في 100 ميكرولتر من المحلول وتجاهل الباقي.
5. نشر سلالة النيماتودا نظيفة
- باستخدام ماصة زجاجية معقمة، نقل 100 ميكرولتر من الناسخة والكريهة إلى مركز لوحة NGM 10 سم المصنفة مع OP50-1. السماح للوح لتجف دون إزعاج السائل في المركز.
- السماح للdauers الزحف للخروج من المركز ومن خلال الحديقة OP50-1 لمدة 5-10 دقيقة.
- التقط بعناية واحدة dauer ولوحة على لوحة NGM 6 سم المصنف. في المجموع، واختيار ما لا يقل عن 10 dauers ولوحة لهم في لوحات NGM 6 سم الفردية المصنفة مع OP50-1 (10 لوحات المجموع).
- احتضان لوحات لمدة 4-5 أيام في 20 درجة مئوية حتى نمت dauers والجيل التالي (F1) وصلت إلى مرحلة الكبار. التحقق بصريا من التلوث على جميع لوحات، ينظر إليها على أنها غير OP50-1 النمو الميكروبي.
- لكل صفيحة نظيفة، تحقق من انتشار الميكروب المثير للاهتمام عبر نورمارسكي أو المجهر الفلوري، مثل الفلورسنت في التهجين الموقعي (FISH)12، اعتمادا على النمط الظاهري للاهتمام.
6. تشريح الأمعاء وتحديد PCR من الأنواع الميكروبية
- زراعة الحيوانات عند 20 درجة مئوية لمدة 3-4 أيام للسماح لهم بتجويع وتقليل كمية البكتيريا OP50-1. إضافة 5 مل من وسائل الإعلام M9 إلى لوحة من الديدان الجائعة.
- باستخدام ماصة زجاجية معقمة ومصباح، ماصة تصل M9 + الديدان من لوحة ونقلها إلى أنبوب الطرد المركزي 15 مل معقمة.
- باستخدام جهاز طرد مركزي سريري ، قم بتدفير الديدان في الأنبوب عند 1000 × ز لمدة 30 s في درجة حرارة الغرفة.
- باستخدام ماصة معقمة 15 مل، قم بإزالة الناطور من أنبوب الطرد المركزي دون إزعاج الديدان الحية في الجزء السفلي من الأنبوب.
- إضافة 10 مل من M9 + 0.05٪ تريتون X-100 واحتضان الأنبوب على نوتاتور لمدة 20 دقيقة لإزالة الميكروبات الخارجية. كرر أربع مرات لغسل الديدان.
- بعد غسل الماضي، وذلك باستخدام طرف ماصة معقمة، وإزالة supernatant دون إزعاج بيليه في الجزء السفلي في 100 ميكرولتر من الحل.
- باستخدام طرف ماصة معقمة، نقل M9 والديدان إلى لوحة NGM غير المصنف والسماح للوح الجافة في حين أن الديدان الزحف حولها لمدة 20 دقيقة للمساعدة في إزالة OP50-1 من بشرة والأمعاء.
- إضافة 250 ميكرولتر من M9 إلى لوحة المجففة واستخدام ماصة زجاجية لنقل M9 + الديدان إلى لوحة جديدة غير المصنف NGM. مرة أخرى، دع تلك اللوحة تجف والسماح للديدان بالزحف لمدة 20 دقيقة.
- أضف 250 ميكرولتر من M9 إلى اللوحة ونقل 100 ميكرولتر من M9 + الديدان إلى زجاج ساعة نظيف.
- باستخدام اثنين من الإبر حقنة 26 G معقمة، وقطع رأس الديدان الخيطية عن طريق عقد الدودة إلى أسفل مع إبرة واحدة واستخدام إبرة أخرى لقطع الدودة. بعد قطع الرأس ، فإن الأمعاء (الحبيبية) والوند (شفاف) من الجسم تخرج بشكل طبيعي من الجسم.
- قطع قطعة من الأمعاء المكشوفة عن طريق الضغط على الأمعاء بإبرة واحدة وقطعها مع الأخرى.
ملاحظة: إذا كان ذلك ممكنا، تحقق من أن ميكروب الفائدة لا يزال موجودا في الأمعاء الأبدية باستخدام المجهر نورمارسكي، FISH، أو الكيمياء المناعية23. - نقل الأمعاء تشريح واحد في أنبوب PCR 0.5 مل تحتوي على 10 ميكرولتر من الماء العقيم. كرر ما مجموعه ما لا يقل عن 5 أنابيب PCR التي تحتوي على الأمعاء من مختلفة.
- تجميد أنابيب PCR في -80 درجة مئوية لمدة لا تقل عن 5 دقائق. إزالة أنابيب PCR من الثلاجة وتذوب العينات.
- ماصة السائل صعودا وهبوطا عدة مرات لفصل البكتيريا من الأمعاء.
- إجراء PCR باستخدام أزواج التمهيدي العالمي ضد تسلسل الحمض النووي للوحدات الفرعية الريبوسومية الصغيرة من البكتيريا والخميرة، أو microsporidia، اعتمادا على النوع المشتبه به من الميكروبات.
ملاحظة: على سبيل المثال، يتم تقديم بروتوكول عينة باستخدام التمهيديات 16S البكتيرية العالمية في الجدول 1. - تنقية amplicon باستخدام تنظيف الحمض النووي القائم على مرشح ومجموعة تركيز (انظر جدول المواد) وأداء تسلسل سانجر.
النتائج
تم عزل سلالة برية من نوع C. tropicalis (JU1848) من ثمار أشجار النخيل الفاسدة في غابة نوراج في غيانا الفرنسية (الشكل 1A)24. تم العثور على هذه السلالة لديها ميكروبات رقيقة تستعمر تجويف الأمعاء بطريقة اتجاهية (الشكل 1B). تم نقل هذا الميكروب بسهولة إلى سلالة C. elegans N2 عبر الثقافة المشتركة مع سلالة JU1848 ، حيث استعمر تجويف الأمعاء بالمثل.
أدى انتشار JU1848 على لوحات NGM القياسية المصنفة مع E. coli OP50-1 على مدى أجيال متعددة باستمرار إلى تلوث مرئي ، ينظر إليه على أنه مستعمرات مظلمة وموكويدية مختلفة داخل وخارج حديقة OP50-1 (الشكل 2A). تم تجويع طبق من JU1848 البرية لإجبار الحيوانات على الدخول إلى داور وتنظيفها كما هو موضح. كانت مطلية الحيوانات dauer واحد التي نجت من التنظيف على لوحات فردية NGM 6 سم بذر مع OP50-1 ويسمح للنمو لمدة 4 أيام في 20 درجة مئوية. ولوحظ وجود لوحات متعددة من ذرية F1 دون تلوث ميكروبي مرئي (الشكل 2B). تم التحقق من ذرية F1 لا تزال تحتوي على البكتيريا التمسك في تجويف الأمعاء (انظر أدناه).
تم غسل الحيوانات النظيفة JU1848 وقطع رؤوسها لعزل القطع المعوية كما هو موضح في البروتوكول (الخطوات 6.1-6.12). تم التحقق من البكتيريا التمسك في تجويف الأمعاء تشريح عن طريق المجهر نومارسكي (الشكل 3). كان يشتبه في أن الميكروب في تجويف JU1848 بكتيريا ، لذلك تم استخدام الأمعاء التشريحية كنموذج ل PCR باستخدام التمهيديات البكتيرية العالمية 16S و 27F و 1492R. من ما مجموعه ستة أمعاء تشريح الفردية، تم تسلسل منتجات PCR عبر سانجر، وأظهرت الكروماتوغراف نظيفة أن جميع التسلسلات الستة كانت متطابقة. واستنادا إلى هذه التسلسلات، تم تحديد هذه البكتيريا كنوع جديد في فئة Alphaproteobacteria ولكن لا يمكن تصنيفها في ترتيب أو جنس معروف (الملف التكميلي 1).

الشكل 1: التمسك البكتيريا استعمار التجويف من البرية C. tropicalis. (أ) صورة عينة حقل من الفاسد Euterpe sp. (الأسرة: Arecaceae) ثمار شجرة النخيل في غابة نوراج في غيانا الفرنسية. (ب) صورة نومارسكي لسلالة JU1848 ينظر مع الآلاف من البكتيريا الطويلة والرقيقة التي تشكل مظهر فرشاة مثل في التجويف (لو) من الأمعاء المضيفة (في). يشار إلى الطبقات البكتيرية (با) التي تغطي الأمعاء بأقواس ([). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
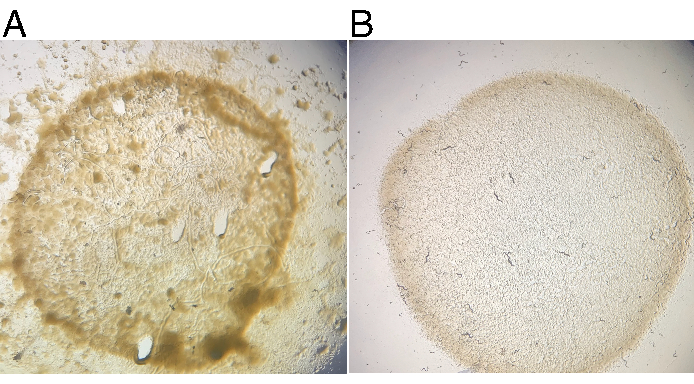
الشكل 2: يتم فقدان تلوث النمو الميكروبي بعد تنظيف النيماتودا. (أ) سلالة البرية JU1848 ينشر نمو الميكروبات ملحوظ على لوحات NGM 6 سم القياسية المصنفة مع البكتيريا E. coli OP50-1. (ب) بعد التنظيف، لوحة من ذرية F1 من dauer واحد يظهر أي تلوث الميكروبية مرئية بعد 4 أيام من الحضانة في 20 درجة مئوية .

الشكل 3: تظهر البكتيريا الملتصقة في تجويف الأمعاء المشرحة. صورة نومارسكي لحيوان JU1848 نظيف تم قطع رأسه بحيث تتسرب الأمعاء. يشار إلى البكتيريا المستعمرة (با) مع قوس ([) وينظر إليها في التجويف (لو) من قطعة من الأمعاء (في) التي هي خارج الجسم النيماتودا (NB). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكاشف | تركيز | مبلغ |
| 27F التمهيدي (5'-AGAGTTGATCMTGGCTCAG-3') | 20 مليون متر | 2.5 ميكرولتر |
| 1492R التمهيدي (5'-GGTTACCTTGTTACGACTT-3') | 20 مليون متر | 2.5 ميكرولتر |
| تشريح الأمعاء في الماء | N/A | 3 ميكرولتر |
| 10x PCR المخزن المؤقت | 10x | 5 ميكرولتر |
| dNTP | 10 مليون متر | 1 ميكرولتر |
| تاك بوليمراز | 5 يو/ميكرولتر | 0.5 ميكرولتر |
| الماء | N/A | 35.5 ميكرولتر |
الجدول 1: بروتوكول PCR العينة باستخدام التمهيديات البكتيرية العالمية والأمعاء تشريح.
الملف التكميلي 1: محاذاة MUSCLE لتسلسلات rDNA البكتيرية 16S المشتقة من PCR من ستة أمعاء JU1848 تشريح.
Discussion
يصف هذا البروتوكول عزل وتحديد الميكروبات من الديدان الخيطية Caenorhabditis المعزولة البرية باستخدام سلسلة من إجراءات التنظيف. ترتبط العديد من الميكروبات بالديدان الخيطية المعزولة البرية ، وبعضها يحتوي على أنماط ظاهرة مثيرة يمكن استخدامها للدراسات المستقبلية في التفاعلات بين المضيف والميكروب والمناعة الفطرية. وقد تم عزل العديد من البكتيريا الدقيقة والمسببة للأمراض من الديدان الخيطية Caenorhabditis البرية باستخدام التقنيات القياسية للنمو البكتيري في المختبر25,26. ومع ذلك ، لا يمكن زراعة جميع الميكروبات في المختبر ، ويصبح من الضروري إثراءها في الديدان الخيطية البرية. بعض الميكروبات لديها مرحلة بوغ مقاومة، مثل microsporidia، وتركيزات عالية من SDS يمكن استخدامها لقتل معظم البكتيريا والفطريات، مما يسمح لإثراء محدد من الجراثيم12. يقدم هذا البروتوكول طريقة لإثراء الميكروبات المعوية غير القابلة للتخصيب التي لا تقاوم SDS والعلاج بالمضادات الحيوية.
تستفيد التقنية المعروضة هنا من المقاومة البيئية التي شوهدت في الدور بسبب التغيرات الفسيولوجية مثل تقوية السفاح ، وقمع ضخ البلعوم ، وتغطية الفم بقابس بوكال27. خطوة حاسمة في هذا البروتوكول هو حضانة بين عشية وضحاها مع مختلف المضادات الحيوية و0.25٪ SDS. وتستخدم هذه الخطوة لقتل جميع الميكروبات الخارجية مع ترك الميكروبات الداخلية سليمة. في حين ثبت C. elegans dauers البقاء على قيد الحياة تركيزات SDS عالية في 10٪ لمدة 30 دقيقة27، يستخدم هذا البروتوكول حضانة معتدلة ولكن لفترات طويلة ليس فقط لقتل الميكروبات ولكن زيادة تعريض البكتيريا للمضادات الحيوية. وعلاوة على ذلك، يمكن أن يساعد التركيز المعتدل ل SDS في ضمان بقاء ال dauers من أنواع Caenorhabditis الأخرى على قيد الحياة، حيث أدى تعرض C. tropicalis إلى 1٪ SDS بين عشية وضحاها إلى موت جميع الدور. إذا كان كل من يموت dauers ، ثم تركيز SDS و / أو ينبغي خفض طول التعرض لSDS. وعلى العكس من ذلك، إذا كانت لوحات الجيل F1 لا تزال تحتوي على تلوث مرئي بعد التنظيف، فينبغي زيادة تركيز SDS ووقت الحضانة.
خطوة حاسمة أخرى هي عزل الحيوانات dauer واحد بعد التنظيف. هذه الخطوة حاسمة حيث لا تكون جميع الحيوانات نظيفة بعد SDS والعلاج بالمضادات الحيوية. لذلك ، يتم وضع الحيوانات في وسط لوحة NGM 10 سم مع OP50-1 ويسمح لها بالزحف إلى الخارج شعاعيا. في كثير من الأحيان من الأفضل اختيار المزيد من الحيوانات البعيدة ، حيث يبدو أن الزحف الممتد من خلال OP50-1 يساعد في إزالة أي ميكروبات محتملة على قيد الحياة متصلة بالكفاح. ومع ذلك ، فإن هذا يؤدي إلى الحد من البروتوكول ، لأنه سيكون أكثر تحديا لإثراء لميكروب من الاهتمام إذا لم يكن موجودا في السكان على وتيرة عالية. هنا، كان ألفابروتيكوباكتيريا التمسك موجودة في 90٪ -95٪ من السكان. لذلك ، كان معظم لوحات نظيفة البكتيريا الميكروبيوم. ومع ذلك ، إذا كان هناك ميكروب من الاهتمام في تردد أقل بكثير في السكان ، قد يكون من الضروري فحص العديد من لوحات F1 أكثر من ذلك بكثير.
من المحتمل أن يستخدم هذا البروتوكول لعزل أي عدد من الميكروبات غير القابلة للطائفة ذات الأهمية الموجودة في الديدان الخيطية البرية. ومع ذلك ، يجب أن يكون الميكروب في نسيج محمي بقص dauer ، قادر على البقاء على قيد الحياة في dauer ، ويكون له نمط افتراضي ملحوظ في المضيف. على هذا النحو ، يمكن استخدام هذه التقنية لإثراء البكتيريا الدقيقة الأخرى في التجويف المعوي إلى جانب أنواع Alphaproteobacteria الموصوفة هنا ، بما في ذلك البكتيريا التي لا تلتزم. أيضا، تم استخدام البروتوكول لإثراء لبكتيريا داخل الخلايا الكلية، بوردتيلا أتروبي، الذي يصيب النيماتودي أوشيوس tipulae28. بعد التخصيب، تم العثور على B. atropi لتشكيل المستعمرات على لوحات NGM، مما يدل على أنه قد يتم اكتشاف ميكروب من الفائدة لتكون قابلة للترجيل في المختبر بمجرد إزالة الملوثات الأسرع نموا. ومن المرجح أن تعمل هذه التقنية على الميكروبات والفيروسات، بما في ذلك فيروس أورساي، نظرا لهذه القدرة على إثراء البكتيريا داخل الخلايا. ومع ذلك ، يجب أن تكون هذه الميكروبات قادرة على البقاء على قيد الحياة الانتقال من وإلى dauer.
من المهم أن نتذكر أنه في حين يمكن تنفيذ هذا البروتوكول في مختبر السلامة البيولوجية المستوى 1، يجب الحفاظ على تقنية معقمة في جميع أنحاء لمنع المزيد من التلوث الميكروبي. يمكن تغيير البروتوكول وفقا لاحتياجات الباحث ، بما في ذلك أنواع / تركيزات المضادات الحيوية ، والنسبة المئوية ل SDS ، و / أو إضافة مضادات الفطريات مثل النيستاتين. في كثير من الأحيان ، يمكن أن يختلف عدد الميكروبات الملوثة الموجودة في النيماتودا المعزولة البرية بشكل كبير. هنا، تم استخدام الخسارة الواضحة لنمو الإشريكية القولونية غير OP50-1 على لوحات NGM كمقروء لسلالة النيماتودا النظيفة. ولكن، قد يكون هناك مجموعات غير قابلة للتكتل من الميكروبات الملوثة الموجودة، لذلك فمن الضروري إجراء طريقة ميتاجينوميك مثل تسلسل 16S rRNA amplicon لمعرفة مدى التلوث26. بمجرد تنظيف سلالة الدودة ، يمكن تجميدها وتخزينها بعيدا للدراسات المستقبلية. وبشكل عام، يسمح هذا البروتوكول للباحثين بإثراء الميكروبات غير القابلة للتخصيب في الديدان الخيطية البرية، مما يسمح لهم بدراسة الآثار على اللياقة البدنية للمضيف، وتوصيف الأنماط الظاهرية للاستعمار أو العدوى، والاستفادة من الأدوات الوراثية لفهم الآليات الكامنة وراء التفاعلات بين المضيف والميكروب.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود تضارب في المصالح.
Acknowledgements
شكرا للدكتور كريستيان براندل والمركز الوطني للبحوث في محطة نوراج الميدانية.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Fisher Scientific | BP1356 | |
| 10% SDS | Invitrogen | AM9822 | |
| BD PrecisionGlide Needle - 26 G | Fisher Scientific | 305115 | |
| Carbenicillin | Millipore-Sigma | C1389-1G | |
| Cefotaxime | Millipore-Sigma | C7039-500mg | |
| Chloramphenicol | Millipore-Sigma | C0378-25G | |
| DNA Clean and Concentrator Kit | Zymo Research | 11-303C | |
| DreamTaq Polymerase | Fisher Scientific | EP0711 | |
| Gentamycin | Millipore-Sigma | G1264-250mg | |
| Kanamycin | Millipore-Sigma | K1876-1G | |
| KH2PO4 | Fisher Scientific | P-286 | |
| NaCl | Fisher Scientific | S-671 | |
| NH4Cl | Fisher Scientific | A-661 | |
| Streptomycin | Millipore-Sigma | S6501-50G | |
| Tetracyclin | Millipore-Sigma | T7660-5G | |
| Triton X-100 | Fisher Scientific | BP-151 | |
| Watch glasses | VWR | 470144-850 |
References
- Balla, K. M., Troemel, E. R. Caenorhabditis elegans as a model for intracellular pathogen infection. Cellular Microbiology. 15, 1313-1322 (2013).
- Pukkila-Worley, R., Ausubel, F. M. Immune defense mechanisms in the Caenorhabditis elegans intestinal epithelium. Current Opinion in Immunology. 24, 3-9 (2012).
- Bossinger, O., Fukushige, T., Claeys, M., Borgonie, G., McGhee, J. D. The apical disposition of the Caenorhabditis elegans intestinal terminal web is maintained by LET-413. Developmental Biology. 268, 448-456 (2004).
- Dimov, I., Maduro, M. F. The C. elegans intestine: organogenesis, digestion, and physiology. Cell and Tissue Research. 377, 383-396 (2019).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485 (2017).
- Szumowski, S. C., Botts, M. R., Popovich, J. J., Smelkinson, M. G., Troemel, E. R. The small GTPase RAB-11 directs polarized exocytosis of the intracellular pathogen N. parisii for fecal-oral transmission from C. elegans. Proceedings of the National Academy of Sciences of the United States of America. 111, 8215-8220 (2014).
- Bakowski, M. A., et al. Ubiquitin-mediated response to microsporidia and virus infection in C. elegans. PLoS Pathogens. 10, 1004200 (2014).
- Sowa, J. N., et al. The Caenorhabditis elegans RIG-I Homolog DRH-1 Mediates the Intracellular Pathogen Response upon Viral Infection. Journal of Virology. 94, 01173 (2020).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15, 833-838 (2014).
- Félix, M. -. A., Duveau, F. Population dynamics and habitat sharing of natural populations of Caenorhabditis elegans and C. briggsae. BMC Biology. 10, 59 (2012).
- Lee, D., et al. Balancing selection maintains hyper-divergent haplotypes in Caenorhabditis elegans. Nature Ecology and Evolution. 5, 794-807 (2021).
- Luallen, R. J., et al. Discovery of a natural microsporidian pathogen with a broad tissue tropism in Caenorhabditis elegans. PLOS Pathogens. 12, 1005724 (2016).
- Osman, G. A., et al. Natural infection of C. elegans by an oomycete reveals a new pathogen-specific immune response. Current Biology. 28, 640-648 (2018).
- Felix, M. A., et al. Natural and experimental infection of Caenorhabditis nematodes by novel viruses related to nodaviruses. PLoS Biology. 9, 1000586 (2011).
- Zhang, G., et al. A large collection of novel nematode-infecting microsporidia and their diverse interactions with Caenorhabditis elegans and other related nematodes. PLoS Pathogens. 12, 1006093 (2016).
- Félix, M. -. A., Wang, D. Natural viruses of Caenorhabditis nematodes. Annual Review Genetics. 53, 313-326 (2019).
- Grover, M., Barkoulas, M. C. elegans as a new tractable host to study infections by animal pathogenic oomycetes. PLoS Pathogens. 17, 1009316 (2021).
- Bakowski, M. A., Luallen, R. J., Troemel, E. R. Microsporidia Infections in Caenorhabditis Elegans and Other Nematodes. Microsporidia: Pathogens of Opportunity: First Edition. , (2014).
- Taffoni, C., Pujol, N. Mechanisms of innate immunity in C. elegans epidermis. Tissue Barriers. 3, 1078432 (2015).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3: Genes, Genomes, Genetics. 10, 3025-3039 (2020).
- Frézal, L., Félix, M. -. A. C. elegans outside the Petri dish. eLife. 4, 05849 (2015).
- Troemel, E. R., Félix, M. -. A., Whiteman, N. K., Barrière, A., Ausubel, F. M. Microsporidia are natural intracellular parasites of the nematode Caenorhabditis elegans. PLoS Biology. 6, 2736-2752 (2008).
- Luallen, R. J., Bakowski, M. A., Troemel, E. R. Characterization of microsporidia-induced developmental arrest and a transmembrane leucine-rich repeat protein in Caenorhabditis elegans. PLoS One. 10, 0124065 (2015).
- Félix, M. -. A., et al. Species richness, distribution and genetic diversity of Caenorhabditis nematodes in a remote tropical rainforest. BMC Evolutionary Biology. 13, 10 (2013).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. -. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113, 3941-3949 (2016).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. ISME Journal. 10, 1998-2009 (2016).
- Androwski, R. J., Flatt, K. M., Schroeder, N. E. Phenotypic plasticity and remodeling in the stress-induced C. elegans dauer. Wiley Interdisciplinary Reviews: Developmental Biology. 6, 278 (2017).
- Tran, T. D., Ali, M. A., Lee, D., Félix, M. -. A., Luallen, R. J. Bacterial filamentation is an in vivo mechanism for cell-to-cell spreading. bioRxiv. , (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved