A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التعبير البكتيري وتنقية ميتالوبروتيناز المصفوفة البشرية -3 باستخدام كروماتوغرافيا التقارب
* These authors contributed equally
In This Article
Summary
يتم استخدام تنقية علامته وغسيل الكلى والتنشيط لزيادة غلة التعبير عن بروتين المجال الحفاز ميتالوبروتيناز-3 القابل للذوبان والنشط في البكتيريا. يتم تحليل كسور البروتين عبر المواد الهلامية SDS-PAGE.
Abstract
تنتمي المصفوفة الميتالوبروتيناز (MMPs) إلى عائلة بروتياز الميتزينسين مع أدوار مركزية في تحلل وإعادة تشكيل المصفوفة خارج الخلية (ECM) ، بالإضافة إلى التفاعلات مع العديد من عوامل النمو والسيتوكينات. الإفراط في التعبير عن MMPs محددة هو المسؤول في العديد من الأمراض مثل السرطان والأمراض العصبية التنكسية وأمراض القلب والأوعية الدموية. كانت MMPs مركز الاهتمام مؤخرا كأهداف لتطوير العلاجات التي يمكن أن تعالج الأمراض المرتبطة بالتعبير المفرط MMP.
لدراسة آلية MMP في المحلول ، هناك حاجة إلى طرق تنقية وتنقية أكثر سهولة وقوة للتعبير عن البروتين المؤتلف لإنتاج MMPs النشطة والقابلة للذوبان. ومع ذلك ، لا يمكن التعبير عن المجال الحفاز لمعظم MMPs في الإشريكية القولونية (E. coli) في شكل قابل للذوبان بسبب نقص آلات ما بعد الترجمة ، في حين أن أنظمة التعبير عن الثدييات عادة ما تكون مكلفة ولها عوائد أقل. يجب أن تخضع هيئات تضمين MMP لعملية شاقة وشاقة للتنقية وإعادة الطي على نطاق واسع ، مما يقلل بشكل كبير من غلة MMPs في المطابقة الأصلية. تقدم هذه الورقة بروتوكولا باستخدام خلايا Rosetta2(DE3)pLysS (المشار إليها فيما يلي باسم R2DP) لإنتاج المجال الحفاز ميتالوبروتيناز-3 مصفوفة (MMP-3cd) ، والذي يحتوي على علامة N-terminal His-tag متبوعة بالمجال المؤيد (Hisx6-pro-MMP-3cd) للاستخدام في تنقية التقارب. تعزز خلايا R2DP التعبير عن البروتينات حقيقية النواة من خلال بلازميد مقاوم للكلورامفينيكول يحتوي على كودونات نادرة عادة في أنظمة التعبير البكتيري. بالمقارنة مع خط الخلية التقليدي المفضل للتعبير عن البروتين المؤتلف ، BL21 (DE3) ، فإن التنقية باستخدام هذه السلالة الجديدة حسنت إنتاجية Hisx6-pro-MMP-3cd المنقى . عند التنشيط وإزالة الملح ، يتم شق المجال الاحترافي جنبا إلى جنب مع N-terminal His-tag ، مما يوفر MMP-3cd نشطا للاستخدام الفوري في عدد لا يحصى من التطبيقات في المختبر . لا تتطلب هذه الطريقة معدات باهظة الثمن أو بروتينات اندماج معقدة وتصف الإنتاج السريع ل MMPs البشرية المؤتلفة في البكتيريا.
Introduction
تخضع معظم البروتينات حقيقية النواة المعقدة لتعديلات متقنة بعد الترجمة بعد التعبير، مما يتطلب طي البروتين بمساعدة عالية والعوامل المساعدة لتكون وظيفية1. لا يزال إنتاج كميات كبيرة من البروتين البشري القابل للذوبان في مضيف بكتيري يمثل تحديا كبيرا بسبب ارتفاع التكاليف وعدم وجود طرق قوية للتعبير والتنقية، حتى بالنسبة للتجارب المعملية الأصغر حجما2،3. عادة ما يتم التعبير عن MMPs ، endopeptidases البشرية ذات الوزن الجزيئي الكبير ، كأجسام تضمين غير قابلة للذوبان عند التعبير عنها في E. coli. غالبا ما يؤدي استخراج MMPs البشرية القابلة للذوبان إلى عملية ذوبان وإعادة طي شاقة وتستغرق وقتا طويلا4.
MMPs لها أدوار حاسمة في كل من العمليات الفسيولوجية والمسببة للأمراض. MMPs البشرية هي عائلة من 23 إندوببتيداز الزنك ، مصنفة حسب بنية وخصوصية الركيزة ، ويتم التعبير عنها بشكل تفاضلي على الرغم من المجال الحفاز المحفوظ للغاية5,6. يتم إفراز MMPs كزيموجينات غير نشطة ، يتم تنظيمها عن طريق التنشيط بعد الترجمة ومثبطاتها الداخلية ، مثبطات الأنسجة من ميتالوبروتيناز (TIMPs) 7،8،9،10. على الرغم من الاعتراف بها في البداية لدورها في دوران ECM ، إلا أن MMPs متورطة أيضا في التطوير ، والتشكل ، وإصلاح الأنسجة ، وإعادة التشكيل8. تم ربط خلل تنظيم MMPs بشكل ملحوظ بالسرطان إلى جانب الأمراض العصبية التنكسية والقلب والأوعية الدموية والتليف ، من بين أمراض أخرى5,7.
يعد تطوير طرق إنتاج MMP قوية على نطاق واسع أمرا بالغ الأهمية لضمان نجاح الدراسات المستقبلية لآليات MMP من خلال الفحوصات الكيميائية الحيوية والقائمة على الخلايا. تم التعبير عن MMPs المختلفة سابقا في البكتيريا11 ، بما في ذلك MMPs الموسومة ب Hisx6 ، دون تغيير نشاط MMP12،13،14،15. ومع ذلك ، تتضمن هذه الطرق خطوات طويلة مملة قد يكون من الصعب تكرارها.
يمكن أيضا استخدام خلايا الثدييات للتعبير عن العديد من البروتينات البشرية المختلفة مع ضمان التعديلات المناسبة بعد الترجمة16. على الرغم من أن نظام التعبير عن الثدييات هو الخيار المثالي لإنتاج البروتينات البشرية المؤتلفة مع التعديلات المناسبة بعد الترجمة، فإن العيوب الرئيسية لهذه الطريقة هي الغلة المنخفضة الأولية، ووسائط النمو والكواشف المكلفة، والجداول الزمنية الطويلة للوصول إلى خطوط التعبير المستقرة، وخطر التلوث بأنواع أخرى مثل الفطريات أو البكتيريا2،11 . علاوة على ذلك ، ينتج إنتاج MMP في خطوط خلايا الثدييات شوائب من البروتينات الخلوية المرتبطة مثل TIMPs أو fibronectins11. على عكس نمو الخلايا البطيء الذي لوحظ في خلايا الثدييات ، يوفر نظام التعبير البكتيري إنتاج البروتين على نطاق واسع في فترة قصيرة إلى جانب متطلبات أبسط للوسائط والنمو. ومع ذلك ، نظرا لعدم وجود بروتينات خلوية أخرى مرتبطة (أي TIMPs) في أنظمة التعبير البكتيري ، فإن MMPs النشطة بتركيزات أعلى عرضة للتدهور من خلال التحلل الذاتي ، مما يؤدي إلى ضعف إنتاجية MMP 17.
تصف هذه الورقة طريقة مفصلة للتعبير البكتيري وتنقية وتنشيط المؤتلف Hisx6-pro-MMP-3cd باستخدام E. coli كمضيف تعبير بسبب قدرته على تحمل التكاليف وبساطته ونجاحه في إنتاج غلات أعلى من MMPs2,3,18. نظرا لأن الإشريكية القولونية تفتقر إلى آلات طي البروتين والمعالجة اللاحقة للترجمة اللازمة ل MMPs المؤتلف والبروتينات المعقدة الأخرى ، فقد تم تصميم العديد من سلالات E. coli للتغلب على هذه القيود ، مما يجعل E. coli مضيف أكثر ملاءمة للتعبير عن MMP-3cd البشري المؤتلف ،19،20 . على سبيل المثال ، تعزز سلالة R2DP المستخدمة في هذه الدراسة التعبير حقيقي النواة عن طريق توفير بلازميد مقاوم للكلورامفينيكول يحتوي على كودونات نادرا ما تستخدم في الإشريكية القولونية.
كما هو موضح في هذا البروتوكول ، بعد الإفراط في التعبير عن أجسام التضمين النقية نسبيا من متجه pET-3a (الشكل 1) في خلايا R2DP ، يتم استخراج بروتينات المجال الحفاز Hisx6-pro-MMP-3 (MMP-3cd) وتشويهها4. تم تنقية Hisx6-pro-MMP-3cd3,19 باستخدام كروماتوغرافيا علامة التقارب. عند إعادة الطي وغسيل الكلى ، تم تنشيط pro-MMP-3cd (zymogen) بواسطة خلات 4-aminophenylmercuric (APMA) ، ويستخدم تحليل SDS-PAGE لتقييم الغلة والحاجة إلى مزيد من التنقية 5,21. يصف هذا البروتوكول التعبير والتنقية والتنشيط MMP-3cd القابل للذوبان كمثال. ومع ذلك ، يمكن استخدامه أيضا كدليل للتعبير عن MMPs الأخرى والبروتياز البشري مع تعبير مماثل ، وآليات التنشيط (الشكل 2). بالنسبة للبروتينات الأخرى غير MMP-3cd ، ينصح القارئ بتحديد التراكيب والطرق العازلة المثلى للبروتين المستهدف قبل محاولة هذا البروتوكول.
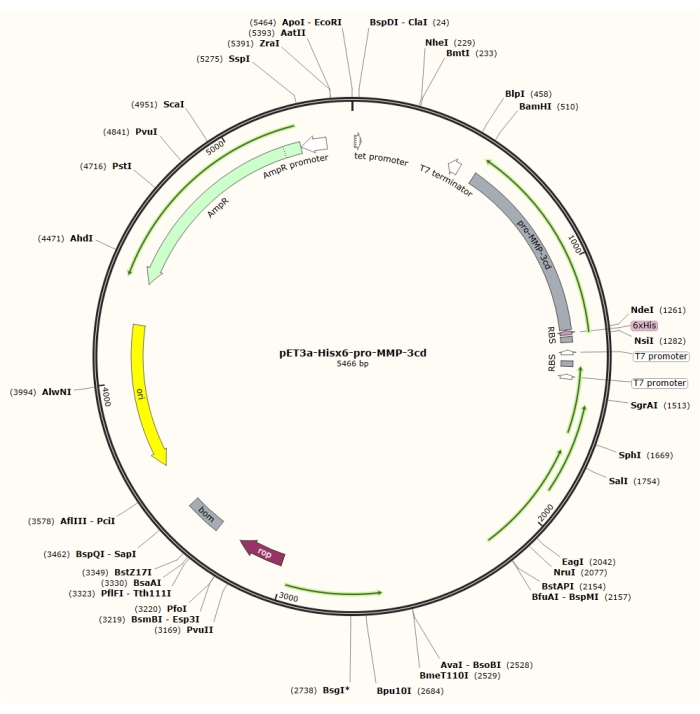
الشكل 1: خريطة البلازميد للبلازميد pET-3a-Hisx6-pro-MMP-3cd. يتضمن ناقل pET-3a جينا مقاوما للأمبيسلين. يتم استنساخ تسلسل علامة Hisx6 الطرفية N في المتجه المستند إلى pET-3a ، بما في ذلك pro-MMP-3cd ، لإنتاج بنية pET-3a-Hisx6-pro-MMP-3cd تحت سيطرة مروج T7 بين مواقع تقييد BamHI و NdeI. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التعبير البكتيري ل pro-MMP-3cd ، والتنقية ، وإعادة الطي ، والتنشيط. 1.1: تم تحويل بلازميد pET-3a-Hisx6-pro-MMP-3cd إلى خلايا BL21 (DE3) أو R2DP. 1.2: تم تحفيز التعبير عن البروتين Pro-MMP-3cd باستخدام IPTG. 1.3: يتم استخدام التحلل الكيميائي والصوتنة لاستخراج بروتينات Hisx6-pro-MMP-3cd التي هي أساسا غير قابلة للذوبان ووجدت في هيئات التضمين. تم استخدام اليوريا لتشويه وإذابة البروتين من أجسام التضمين. 2.1. تم تنقية بروتين Hisx6-pro-MMP-3cd المشوه عن طريق تنقية كروماتوغرافيا التقارب. 3. تم إعادة طي Hisx6-pro-MMP-3cd ببطء أثناء غسيل الكلى من خلال الإزالة التدريجية لليوريا من المخزن المؤقت. 4. أخيرا ، تم تنشيط بروتين MMP-3cd المعاد طيه باستخدام APMA عن طريق إزالة مجال N-terminal pro-peptide. تتم إزالة APMA لاحقا من المحلول من خلال تحلية المياه. تتوافق الأرقام مع أقسام البروتوكول التي تصف هذه الخطوات. الاختصارات: MMP-3cd = المجال الحفاز ميتالوبروتيناز-3 مصفوفة ؛ APMA = 4-أمينوفينيل أسيتات الزئبق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
1. تعبير MMP
- استنساخ وتحويل pET-3a-Hisx6-pro-MMP-3cd إلى خلايا R2DP
- هضم البلازميد pET-3a (انظر جدول المواد) مع إنزيمات تقييد NdeI و BamHI في Digest Buffer (انظر جدول المواد). في حجم تفاعل إجمالي قدره 40 ميكرولتر ، أضف 4 ميكرولتر من Digest Buffer ، و 33 ميكرولتر من 100 نانوغرام / ميكرولتر من البلازميد ، و 1.5 ميكرولتر من كل إنزيم تقييد واسمح للتفاعل بالمتابعة لمدة ~ 2 ساعة حتى الانتهاء عند 37 درجة مئوية.
- قم بإجراء تفاعل PCR على تسلسل MMP-3cd لإدراج علامة N-terminal الخاصة به. استخدم 25 ميكرولتر من مزيج تفاعل البوليميراز المتسلسل (انظر جدول المواد)، و2.5 ميكرولتر من 10 ميكرومتر من الاشعال (الشكل التكميلي S1)، و1.25 ميكرولتر من تسلسل إدراج 100 نانوغرام/ميكرولتر. أضف الماء المعقم إلى حجم التفاعل النهائي البالغ 50 ميكرولتر.
- قم بتشغيل منتج PCR وناقل مهضوم على هلام أغاروز 1٪. قم بتنقية أحزمة الجل باستخدام مجموعة استعادة الجل (انظر جدول المواد) وفقا لبروتوكول الشركة المصنعة.
- استنساخ منتج PCR المضخم في المتجه المهضوم بين مواقع تقييد NdeI و BamHI باستخدام مزيج تجميع الحمض النووي (انظر جدول المواد). استخدم الأدوات عبر الإنترنت لتحديد الحجم المطلوب لمتجه الإدراج والقطع لحجم تفاعل إجمالي قدره 15 ميكرولتر.
- قم بإذابة أليكوت 50 ميكرولتر من الخلايا عالية الكفاءة في التحول (انظر جدول المواد) على الجليد حتى يتم إذابتها. متوسط نمو SOC قبل التسخين (انظر جدول المواد) إلى 37 درجة مئوية وألواح LB-ampicillin (LB Amp) (انظر جدول المواد).
- أضف 1-2 ميكرولتر من تفاعل تجميع pET-3a-Hisx6-pro-MMP-3cd إلى أليكوت 50 ميكرولتر. احتضان على الجليد لمدة 30 دقيقة.
- صدمة حرارية للخلايا عن طريق الحضانة عند 42 درجة مئوية لمدة 30 ثانية. احتضان على الجليد لمدة 2 دقيقة.
- أضف 950 ميكرولتر من وسط نمو SOC إلى كل خليط تحويلي. رج العبوة لمدة 1 ساعة عند 250 دورة في الدقيقة و 37 درجة مئوية.
- لوحة 100 ميكرولتر من المحولات على لوحات أمبير LB وتحضن بين عشية وضحاها عند 37 درجة مئوية.
- قم بتلقيح كل مستعمرة معزولة في 10 مل من وسط LB Amp. رجه طوال الليل عند 250 دورة في الدقيقة و37 درجة مئوية.
- استخراج الحمض النووي البلازميد وفقا لبروتوكول الشركة المصنعة لمجموعة miniprep (انظر جدول المواد). تأكد من تسلسل البناء باستخدام التمهيدي الأمامي والخلفي T7 (الشكل التكميلي S1).
ملاحظة: يمكن تخزين الحمض النووي لبناء pET-3a-Hisx6-pro-MMP-3cd عند -20 درجة مئوية. عندما تكون جاهزا ، تابع التحول إلى خلايا R2DP. - قم بإذابة 20 ميكرولتر من خلايا R2DP (انظر جدول المواد) على الجليد لمدة 2-5 دقائق. قم بتسخين نمو SOC من المتوسط إلى درجة حرارة الغرفة وألواح LB Amp CamR إلى 37 درجة مئوية (انظر جدول المواد).
- أضف 1 ميكرولتر من 100 نانوغرام / ميكرولتر مؤكدة تسلسل pET-3a-Hisx6-pro-MMP-3cd إلى 50 ميكرولتر أليكوت. يحرك المزيج بلطف ويعاد الأنبوب إلى الثلج.
- احتضن الأنبوب على الثلج لمدة 5 دقائق.
- صدمة حرارية للخلايا عن طريق الحضانة عند 42 درجة مئوية لمدة 30 ثانية بالضبط. لا تهتز.
- ضع الخلايا على الجليد لمدة 2 دقيقة.
- أضف 80 ميكرولتر من وسط SOC في درجة حرارة الغرفة إلى الخليط المحول. رج العبوة لمدة 1 ساعة عند 250 دورة في الدقيقة و 37 درجة مئوية.
- قم بلوحة المحولات على ألواح LB Amp CamR واحتضنها بين عشية وضحاها عند 37 درجة مئوية.
- النمو والحث
- قم بتلقيح مستعمرة واحدة معزولة من محول R2DP pET-3a-Hisx6-pro-MMP-3cd من لوحة LB Amp CamR في 10 مل من وسائط LB Amp CamR عند 37 درجة مئوية. رج عند 250 دورة في الدقيقة بين عشية وضحاها (~ 16 ساعة). حفظ aliquots من كل ثقافة وإعداد 40٪ (v / v) الجلسرين (انظر جدول المواد) الأسهم إذا رغبت في ذلك.
- لكل ثقافة ليلية ، قم بتلقيح قارورة سعة 1 لتر تحتوي على 500 مل من وسط LB Amp CamR إلى كثافة بصرية عند 600 نانومتر (OD600) من 0.05-0.1.
ملاحظة: يجب أن يؤدي ذلك إلى إعادة الخلايا إلى النمو اللوغاريتمي. - قم بقياس OD600 في عدة نقاط زمنية ، عادة لمدة 3-4 ساعات ، حتى يقع بين 0.4 و 0.6.
- قبل الحث ، قم باقتباس جزء من الثقافة في أنبوب microfuge سعة 1.5 مل (انظر جدول المواد) وقم بتسميته جزءا غير مستحث. قم بتخزينه عند -80 درجة مئوية لتحليل الهلام. إذا لم تقم بتشغيل SDS-PAGE gel، تخطي هذه الخطوة والمتابعة إلى الخطوة 1.2.5.
- حث الثقافات على تركيز نهائي قدره 1 mM باستخدام مخزون 1 M isopropyl-ß-D-thiogalactopyranoside (IPTG) (انظر جدول المواد). استمر في الحضانة في شاكر 37 درجة مئوية لمدة 3-4 ساعات إضافية.
ملاحظة: أثناء التعبير، يجب على القارئ تحديد OD600 الأمثل في وقت الحث وتركيز IPTG. إذا انخفض العائد بشكل كبير بعد التنقية ، فقد يتطلب تركيز الإيميدازول في مخازن التنقية تعديلا ، أو قد تحتاج حبيبات الخلية إلى مزيد من الصوتنة. - قبل الطرد المركزي للثقافات ، قم بتحويل جزء صغير من الثقافة إلى أنبوب ميكروفوجي ثان سعة 1.5 مل وأطلق عليه اسم الكسر المستحث. قم بتخزينه عند -80 درجة مئوية لتحليل الهلام. إذا لم تقم بتشغيل هلام SDS-PAGE، تخطي هذه الخطوة والمتابعة إلى الخطوة 1.2.7.
- قم بالطرد المركزي لزراعة الخلايا في زجاجات مخروطية سعة 250 مل (انظر جدول المواد) بسرعة قصوى و 4 درجات مئوية لمدة 10 دقائق.
- كرر الخطوة 1.2.7 حتى يتم تكوير الثقافات بالكامل.
ملاحظة: وقفة: يمكن تجميد كريات الخلايا عند -80 درجة مئوية وإذابتها لاحقا لمزيد من المعالجة. وإلا، تخطي هذه الخطوة وانتقل إلى الخطوة 1.3.1.
- إدراج استخراج الجسم والذوبان
ملاحظة: قم بإعداد 10 م يوريا طازجة ، ويفضل أن يكون ذلك في موعد لا يتجاوز يوما واحدا مقدما ، مع التحريك جيدا حتى يذوب تماما. لا تسخن أو الأوتوكلاف اليوريا. تخزينها في درجة حرارة الغرفة.- أعد تعليق الكريات (من الخطوة 1.2.8) في المخزن المؤقت للتحلل (انظر جدول المواد). لكل غرام من الكريات ، أضف 3 مل من المخزن المؤقت للتحلل وأعد تعليقه عن طريق الدوامة أو السحب. رجه طوال الليل على حرارة 4 درجات مئوية.
- أضف 1.25 مل من 10٪ (ث / v) ديوكسيكولات الصوديوم (انظر جدول المواد) لكل 1 لتر من الثقافة. يرج في درجة حرارة الغرفة لمدة 30 دقيقة عند 150 دورة في الدقيقة.
- أضف 10 ميكرولتر من DNase I (انظر جدول المواد) لكل 1 لتر من الثقافة. يرج في درجة حرارة الغرفة لمدة 30 دقيقة عند 150 دورة في الدقيقة.
- جهاز طرد مركزي لمدة 10 دقائق عند 13000 × جم و 4 درجات مئوية.
- ضع جانبا جزءا صغيرا من MMP Lysed لتحليل الهلام. تخزينها في -80 درجة مئوية. إذا لم تقم بإجراء تحليل هلامي، فانتقل إلى الخطوة 1.3.6.
ملاحظة: بعد الطرد المركزي، قد تكون الكريات خيطية وغير معبأة بشكل مضغوط، مما يجعل من الخطر التخلص من المادة الخارقة. إذا كانت هذه هي الحالة، فانتقل إلى الخطوة 1.3.6 وانتقل إلى الخطوة 1.3.7. - تخلص من السوبرنات من عينات الطرد المركزي.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا عند هذه النقطة وتجميد كريات الخلايا عند -80 درجة مئوية وإذابتها لاحقا. وإلا، تخطي هذه الخطوة والمتابعة إلى الخطوة 1.3.7. - أعد تعليق الكريات في مزرعة 100 مل / لتر من المخزن المؤقت لجسم التضمين (انظر جدول المواد) عن طريق السحب لأعلى ولأسفل.
- أثناء الصوتنة ، احتفظ بالعينات على الجليد لمنع ارتفاع درجة الحرارة. سونيك كل عينة لمدة 6 دورات من 15 ثانية ، الناتج 5 ، ونبض 50٪. اسمح بفترات راحة لمدة 15 ثانية للتبريد بين الدورات.
ملاحظة: إذا لزم الأمر، انقل العينات إلى أنابيب مخروطية سعة 50 مل لمزيد من الطرد المركزي (انظر جدول المواد). جهاز طرد مركزي لمدة 10 دقائق عند 13000 × جم و 4 درجات مئوية. - ضع جانبا جزءا صغيرا من MMP المهدئ لتحليل الهلام. تخزينها في -80 درجة مئوية. إذا لم تقم بإجراء تحليل هلامي، فانتقل إلى الخطوة 1.3.11.
- تحقق من الكريات. إذا كان متصلا، كرر الخطوات 1.3.8-1.3.10. إذا كانت الكريات مضغوطة ، فتخلص من supernatant وانتقل إلى الخطوة 1.3.12.
ملاحظة: يمكن تكرار الصوت في المخزن المؤقت للجسم المستضمد لاستعادة المزيد من البروتين من حطام الخلايا المحللة. ومع ذلك ، فإن الكثير من الصوتنة يمكن أن يسبب القص ، مما يضر بعائد MMP. يمكن إيقاف البروتوكول مؤقتا في هذه المرحلة ، ويمكن تجميد كريات الخلايا عند -80 درجة مئوية وإذابتها لاحقا. - أعد تعليق كل حبيبة من مزرعة 1 لتر في 5 مل من المخزن المؤقت للذوبان (انظر جدول المواد) عن طريق السحب. احتضن لمدة 30 دقيقة على الأقل على الجليد للسماح للبروتينات بالذوبان.
- ضع جانبا جزءا صغيرا من MMP المذاب لتحليل الهلام. تخزينها في -80 درجة مئوية. إذا لم تقم بإجراء تحليل هلامي، فانتقل إلى الخطوة 1.3.14.
- الطرد المركزي للخلايا لمدة 10 دقائق في 13000 × غرام و 4 درجات مئوية.
- إذا تشكلت / بقيت الكريات بعد الطرد المركزي ، صب supernatant في أنبوب مخروطي منفصل 50 مل. أعد تعليق الكريات في 5 مل أخرى من المخزن المؤقت للذوبان (لكل 1 لتر من الثقافة) عن طريق السحب لأعلى ولأسفل.
- جهاز طرد مركزي لمدة 10 دقائق عند 13000 × جم و 4 درجات مئوية.
- كرر الخطوتين 1.3.13 و 1.3.14 حتى يتشكل القليل من الكريات أو لا تتشكل بعد الطرد المركزي أو يبقى فقط الراسب الرمادي. تجمع السوبرناتورز. تخلص من الكريات أو خزنها عند -80 درجة مئوية لمزيد من الصوتنة.
2. MMP تنقية وإعادة طي
- تنقية تقارب علامته (HT)
- وفقا لبروتوكول الشركة المصنعة ، املأ عمود تدفق الجاذبية (انظر جدول المواد) براتنج Ni-NTA المختلط جيدا (انظر جدول المواد). اسمح للراتنج بالاستقرار والانفصال عن المخزن المؤقت للتخزين بحيث يتشكل خط مميز بين الطبقتين.
ملاحظة: لا تسمح أبدا للراتنج بالجفاف ، لأن الهواء سوف يخترق الراتنج ويضر بإنتاج البروتين. بين الاستخدامات، قم بإجراء تجديد الراتنج الموضح في القسم 2.2. - اسمح للمخزن المؤقت للتخزين بالتصريف. املأ العمود بمجلدين من طبقة الراتنج من HT Equilibration Buffer.
- استنزاف المخزن المؤقت لتوازن HT والتخلص منه. أثناء تصريف العمود ، قم بالطرد المركزي لمستخلص البروتين عند 13000 × جم لمدة دقيقة واحدة وقم بتعقيم المرشح باستخدام مرشح 0.22 ميكرومتر (انظر جدول المواد).
- استبدل حاوية النفايات بأنبوب مخروطي سعة 50 مل يحمل علامة HT Flowthrough. أضف مستخلص البروتين المحضر إلى العمود.
- أعد تطبيق التدفق لزيادة الربط إلى أقصى حد.
- ضع جانبا جزءا صغيرا من Flowthrough Fraction لتحليل الهلام. تخزينها في -80 درجة مئوية. إذا لم تقم بإجراء تحليل هلامي، فانتقل إلى الخطوة 2.1.7.
- اغسل الراتنج على الفور ب 15 مل من مخزن HT Wash المؤقت (انظر جدول المواد). جمع التدفق من خلال أنابيب مخروطية 15 مل (انظر جدول المواد) المسمى HT غسل.
ملاحظة: تم الحصول على قيم الامتصاص عند 280 نانومتر (A280) عن طريق قياس الطيف الضوئي واستخدمت جنبا إلى جنب مع الوزن الجزيئي ومعامل الانقراض، ε، لتقدير تركيزات البروتين. بالنسبة ل Hisx6-pro-MMP-3cd المشوه ، يبلغ الوزن الجزيئي 29.86 kDa ، و ε 34.38 M-1 cm-1. - التفريغ ضد HT Wash Buffer ، قم بقياس وتسجيل A280. كرر الخطوتين 2.1.7 و2.1.8 مع كسور غسيل إضافية. بمجرد اقتراب A280 من خط الأساس وتقليل الشوائب إلى الحد الأدنى، انتقل إلى الخطوة 2.1.9.
- ضع جانبا جزءا صغيرا من جزء Wash Fraction لتحليل الجل. كرر ذلك لعدة أجزاء غسيل. تخزين الكسور في -80 درجة مئوية. إذا لم يتم إجراء تحليل هلام، فانتقل إلى الخطوة 2.1.10.
- قم على الفور بالتخلص من البروتينات ذات العلامات الخاصة به عن طريق إضافة 5 مل من HT Elution Buffer (انظر جدول المواد). جمع التدفق من خلال كسور 0.5-1 مل في أنابيب microfuge المسمى HT Elution.
- ضع جانبا جزءا صغيرا من جزء Elution لتحليل الهلام. كرر ذلك لعدة كسور استخراج. تخزين الكسور في -80 درجة مئوية. إذا لم تقم بإجراء تحليل هلامي، فانتقل إلى الخطوة 2.1.12.
- إذا كان A280 >0.3 ملغم / مل ، فقم بتخفيف الكسر باستخدام مخزن HT Equilibration Buffer (انظر جدول المواد).
ملاحظة: يجب تخفيف الجزء المخفف إلى A280 من 0.3 ملغ / مل أو أقل لمنع هطول الأمطار أثناء غسيل الكلى. يمكن إيقاف البروتوكول مؤقتا هنا وتجميد الكسور المجمعة عند -80 درجة مئوية وإذابتها لاحقا. وإلا، تخطي هذه الخطوة وانتقل إلى الخطوة 2.2.1.
- وفقا لبروتوكول الشركة المصنعة ، املأ عمود تدفق الجاذبية (انظر جدول المواد) براتنج Ni-NTA المختلط جيدا (انظر جدول المواد). اسمح للراتنج بالاستقرار والانفصال عن المخزن المؤقت للتخزين بحيث يتشكل خط مميز بين الطبقتين.
- تجديد الراتنج
- اغسل الراتنج بعشرة أحجام من طبقة الراتنج من HT Regeneration Buffer (انظر جدول المواد) وعشرة أحجام من طبقة الراتنج من الماء المعقم.
- تخزين الراتنج كملاط 50٪ في 20٪ (v / v) الإيثانول في الماء.
3. إعادة طي البروتين
ملاحظة: بالنسبة للأحجام الأصغر ، يمكن استخدام أشرطة غسيل الكلى في خطر أقل لفقدان العينة. مطلوب أنابيب غسيل الكلى إذا تم استخدام كميات أكبر (انظر جدول المواد).
- غسيل الكلي
ملاحظة: تركيز البروتين الأمثل لغسيل الكلى هو ~ 0.3 ملغ / مل. في حالة حدوث هطول كبير أثناء غسيل الكلى ، قم بتقليل تدرج تركيز اليوريا بين كل غسيل كلى باستخدام طريقة غسيل الكلى تدريجيا وإضافة المزيد من الخطوات المتوسطة (على سبيل المثال ، من 6 م إلى 5 م ، ثم 5 م إلى 4 م ، بدلا من تخطي مرحلة 5 م). نظرا لأن دورات التجميد والذوبان تلحق الضرر بالبنية الخلوية والبروتينية ، فمن الضروري تقليل فترات التوقف المؤقت في البروتوكول.- وفقا لبروتوكول الشركة المصنعة ، استخدم الكمية المناسبة من أنابيب غسيل الكلى وفقا لحجم عينات Elution Fraction .
- اغمر أجزاء MMP المنبعثة في أنابيب غسيل الكلى في 1 لتر من Dialysis Buffer 1 (انظر جدول المواد). حرك الأنبوب ومحتوياته على مقلي مغناطيسي لمدة لا تقل عن 8 ساعات عند 4 درجات مئوية.
- نقل إلى 1 لتر من غسيل الكلى المخزن المؤقت 2 (انظر جدول المواد). حرك الأنبوب ومحتوياته على مقلي مغناطيسي لمدة لا تقل عن 8 ساعات عند 4 درجات مئوية.
- نقل إلى 1 لتر من المخزن المؤقت لغسيل الكلى 3 (انظر جدول المواد). حرك الأنبوب ومحتوياته على مقلي مغناطيسي لمدة لا تقل عن 8 ساعات عند 4 درجات مئوية.
- انقل العينة إلى أنابيب مخروطية جديدة سعة 50 مل وقم بتسميتها على أنها MMP منزولة الدياليز.
- افحص الأنبوب بحثا عن أي راسب. إذا تشكل الراسب ، فقم بالطرد المركزي للعينة لمدة 1 دقيقة عند 13000 × جم و 4 درجات مئوية.
- انقل السوبرناتانت إلى أنابيب مخروطية جديدة سعة 15 مل وقم بتسميتها على أنها MMP مطوية.
- ضع جانبا جزءا صغيرا لتحليل الجل وقم بتسميته على أنه MMP مطوي. تخزينها في -80 درجة مئوية. إذا لم تقم بإجراء تحليل هلامي، فانتقل إلى الخطوة 3.1.9.
ملاحظة: إذا كانت الغلة منخفضة ، يمكن إذابة الراسب في مخزن HT Equilibration المؤقت والخطوات الواردة في القسم 3.1 المتكررة مع أنابيب غسيل الكلى. إذا لم يتم إجراء تحليل الجل أو إذا كان يجب إيقاف البروتوكول مؤقتا هنا ، فقم بتجميد العينات عند -80 درجة مئوية وإذابتها لاحقا. إذا كانت الإنتاجية في النطاق المطلوب، فانتقل إلى الخطوة 3.2.1.
- إعادة التركيز
ملاحظة: من المتوقع أن تكون معاملات الانقراض ل Hisx6-pro-MMP-3cd المعاد طيها والمشوهة هي نفسها؛ وبالتالي ، لا تتأثر حسابات A280.- أعد تركيز العينة حتى 0.5 ملغم/مل. استخدم خلية مقلوبة بسعة 400 مل (انظر جدول المواد) لتركيز العينة على 15 مل. لمنع الرغوة، استخدم أنبوب إعادة تركيز 50 مل للتركيز أكثر إذا لزم الأمر.
ملاحظة: إذا تشكل راسب ، فيمكن تكويره وإذابته في مخزن توازن HT. ثم كرر المقطعين 3.1 والخطوة 3.2.1. وإلا، فتابع إلى الخطوة 3.2.2. - ضع جانبا جزءا صغيرا لتحليل الجل وقم بتسميته على أنه MMP المركز.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا وتجميد العينات عند -80 درجة مئوية وإذابتها لاحقا.
- أعد تركيز العينة حتى 0.5 ملغم/مل. استخدم خلية مقلوبة بسعة 400 مل (انظر جدول المواد) لتركيز العينة على 15 مل. لمنع الرغوة، استخدم أنبوب إعادة تركيز 50 مل للتركيز أكثر إذا لزم الأمر.
4. التفعيل
- 4-تنشيط خلات أمينوفينيل الزئبق (APMA)
ملاحظة: APMA شديد السمية. قم بعمل حل مخزون جديد من 20 mM APMA قبل التنشيط ، واعمل دائما تحت غطاء دخان عند استخدام APMA. تخلص من نفايات APMA في حاويتها.- لكل 1 مل أليكوت من MMP (1 ملغ / مل) ، أضف 50 ميكرولتر من 20 مللي متر APMA (انظر جدول المواد) للوصول إلى تركيز APMA النهائي من 1 mM. احتضان بين عشية وضحاها في 37 درجة مئوية.
- إذا تشكل راسب ، فقم بطرده المركزي بسرعة قصوى لمدة 10 دقائق عند 4 درجات مئوية. قم بتخزين السوبرناتانت في أنبوب microfuge سعة 1.5 مل يحمل علامة MMP المنشط. تخلص من الراسب في حاوية تحمل علامة نفايات APMA.
- ضع جانبا جزءا صغيرا لتحليل الجل وقم بتسميته MMP المنشط.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا وتجميد العينات عند -80 درجة مئوية وإذابتها لاحقا. إذا لم تقم بإجراء تحليل هلامي، فانتقل إلى الخطوة 4.2.1. بعد التنشيط ، يكون الوزن الجزيئي ومعامل الانقراض ل MMP-3cd 19.40 kDa و 28.42 M-1 cm-1 ، على التوالي.
- تحلية المياه
- قم بإزالة APMA من عينة MMP-3cd المنشطة باستخدام عمود تحلية 2 مل (راجع جدول المواد)، باتباع بروتوكول الشركة المصنعة.
- ضع جانبا جزءا صغيرا لتحليل الجل وقم بتسميته MMP المملح. تخزينها في -80 درجة مئوية. إذا لم تقم بإجراء تحليل هلام ، فانتقل إلى القسم 4.3 مع العينات المتبقية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا وتجميد العينات عند -80 درجة مئوية وإذابتها لاحقا.
- تشغيل المواد الهلامية SDS-PAGE
- قم بتشغيل جميع كسور البروتين على المواد الهلامية SDS-PAGE: الكسر غير المستحث ، الكسر المستحث ، MMP المحلل ، MMP المصوتة ، MMP المذابة ، الكسر المتدفق ، كسر الغسيل ، كسر الإزالة ، MMP المعاد طيه ، MMP المركز ، MMP المنشط ، و MMP المملح.
- تخزين MMP-3 على المدى الطويل
- أضف 0.05٪ (v / v) من السطحي غير الأيوني (انظر جدول المواد) إلى عينات MMP-3cd المملحة وتخزينها عند -80 درجة مئوية.
النتائج
عند تشغيل العينات على SDS-PAGE ، نظرا لأن البروتين يتم التعبير عنه في شكل أجسام تضمين غير قابلة للذوبان ، يجب أن تحتوي الكسور المحللة والصوتية على القليل من مستخلص Hisx6-pro-MMP-3cd ، حيث لم يتم بعد إعادة إذابة البروتين في اليوريا. يقارن الشكل 3 أجزاء إزالة تنقية علامته من Hisx6-pro-MMP-3cd من ?...
Discussion
لا يزال الإنتاج الواسع النطاق ل MMPs القابلة للذوبان والبشرية والمؤتلفة مهمة صعبة. يمكن لخلايا الثدييات التعبير عن MMPs الوظيفية بتكاليف عالية وأوقات انتظار طويلة ، في حين أن E. coli تنتج بسرعة كميات كبيرة من أجسام تضمين MMP التي يجب تنقيتها وإعادة طيها11,16. تزي...
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما مصالح مالية منافسة.
Acknowledgements
يود المؤلفون أن يعربوا عن تقديرهم للدكتورة إيفيت راديسكي وألكسندرا هوكلا في Mayo Clinic في جاكسونفيل بولاية فلوريدا ، لتوفيرهما بلازميد pET-3a-pro-MMP-3cd كنموذج لاستنساخ جين Hisx6pro-MMP-3cd ، وتعليقاتهما ، إلى جانب الدكتور بول هارتلي من مركز نيفادا للجينوم في جامعة نيفادا ، رينو ، لتسلسل الحمض النووي. يود المؤلفون أيضا أن يشكروا كاساندرا هيرجنرادر على المساعدة في جزء من التعبير عن البروتين. م.ر.-س. أود أن أشكر منحة NIH-P20 GM103650-COBRE لعلم الأعصاب التكاملي وجائزة منحة UNR R & D mICRO SEED.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| Nonionic surfactant | Thermo Fisher Scientific | PI28316 | Storage detergent for preventing MMP aggregation. Minimizes interactions between hydrophobic residues on the MMP surface and water molecules, without disrupting catalytic activity. |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved