Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Бактериальная экспрессия и очистка металлопротеиназы-3 матрицы человека с помощью аффинной хроматографии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Его-меточная очистка, диализ и активация используются для повышения выхода растворимой, активной матриксной металлопротеиназы-3 каталитического домена экспрессии белка у бактерий. Белковые фракции анализируются с помощью гелей SDS-PAGE.
Аннотация
Матриксные металлопротеиназы (MMP) принадлежат к семейству протеаз метцинцина с центральной ролью в деградации и ремоделировании внеклеточного матрикса (ECM), а также взаимодействиях с несколькими факторами роста и цитокинами. Сверхэкспрессия специфических MMP ответственна за несколько заболеваний, таких как рак, нейродегенеративные заболевания и сердечно-сосудистые заболевания. В последнее время MMP находятся в центре внимания в качестве мишеней для разработки терапевтических средств, которые могут лечить заболевания, коррелирующие с гиперэкспрессией MMP.
Для изучения механизма MMP в растворе необходимы более легкие и надежные методы экспрессии и очистки рекомбинантного белка для производства активных, растворимых MMP. Однако каталитический домен большинства MMP не может быть выражен в Escherichia coli (E. coli) в растворимой форме из-за отсутствия посттрансляционного механизма, тогда как системы экспрессии млекопитающих обычно являются дорогостоящими и имеют более низкие выходы. Органы включения MMP должны пройти утомительный и трудоемкий процесс обширной очистки и переворачивания, значительно снижая выход MMP в нативной конформации. В данной работе представлен протокол с использованием клеток Rosetta2(DE3)pLysS (далее именуемых R2DP) для получения матричного металлопротеиназы-3 каталитического домена (MMP-3cd), который содержит N-концевую His-метку, за которой следует про-домен (Hisx6-pro-MMP-3cd) для использования в аффинной очистке. Клетки R2DP усиливают экспрессию эукариотических белков через резистентную к хлорамфениколу плазмиду, содержащую кодоны, обычно редкие в системах экспрессии бактерий. По сравнению с традиционной клеточной линией выбора для экспрессии рекомбинантного белка, BL21(DE3), очистка с использованием этого нового штамма улучшила выход очищенного Hisx6-pro-MMP-3cd. После активации и обессоливания домен pro расщепляется вместе с N-терминалом His-tag, обеспечивая активный MMP-3cd для немедленного использования в бесчисленных приложениях in vitro . Этот метод не требует дорогостоящего оборудования или сложного слияния белков и описывает быстрое производство рекомбинантных человеческих MMP в бактериях.
Введение
Большинство сложных эукариотических белков подвергаются сложным посттрансляционным модификациям после экспрессии, требуя высокоэффективного сворачивания белка и кофакторов, чтобы быть функциональными1. Производство большого количества растворимого человеческого белка в бактериальном хозяине остается серьезной проблемой из-за высоких затрат и отсутствия надежных методов экспрессии и очистки, даже для небольших лабораторных экспериментов2,3. MMP, эндопептидазы человека с большой молекулярной массой, обычно экспрессируются в виде нерастворимых тел включения при экспрессии в E. coli. Экстракция растворимых человеческих MMP часто приводит к трудоемкому, трудоемкому процессу солюбилизации и повторного складывания4.
MMP играют решающую роль как в физиологических, так и в патогенных процессах. Человеческие MMP представляют собой семейство из 23 эндопептидаз цинка, классифицированных по структуре и специфичности субстрата и дифференциально выраженных, несмотря на высокосохраняемый каталитический домен5,6. ММП секретируются в виде неактивных зимогенов, регулируемых посредством посттрансляционной активации и их эндогенных ингибиторов, тканевых ингибиторов металлопротеиназ (ТИМП)7,8,9,10. Хотя первоначально признана их роль в обороте ECM, MMP также были вовлечены в разработку, морфогенез, восстановление тканей и ремоделирование8. Дисрегуляция MMP была особенно связана с раком наряду с нейродегенеративными, сердечно-сосудистыми и фиброзными заболеваниями, среди других заболеваний5,7.
Разработка надежных крупномасштабных методов производства MMP имеет решающее значение для обеспечения успеха будущих исследований механизмов MMP с помощью биохимических и клеточных анализов. Различные MMP ранее экспрессировались в бактериях11, включая MMP с тегами Hisx6, без изменения активности MMP12,13,14,15. Однако эти методы включают утомительные, длительные шаги, которые может быть трудно воспроизвести.
Клетки млекопитающих также могут быть использованы для экспрессии многих различных человеческих белков, обеспечивая при этом надлежащие посттрансляционные модификации16. Хотя система экспрессии млекопитающих является идеальным выбором для получения рекомбинантных человеческих белков с надлежащими посттрансляционными модификациями, основными недостатками этого метода являются начальные низкие выходы, дорогостоящие питательные среды и реагенты, длительные сроки достижения стабильных линий экспрессии и риск заражения другими видами, такими как грибы или бактерии2,11 . Кроме того, производство MMP в клеточных линиях млекопитающих дает примеси из ассоциированных клеточных белков, таких как TIMPs или фибронектины11. В отличие от медленного роста клеток, наблюдаемого в клетках млекопитающих, система экспрессии бактерий предлагает крупномасштабное производство белка за короткий период времени наряду с более простыми средами и потребностями роста. Однако из-за отсутствия других ассоциированных клеточных белков (т.е. ТИМП) в системах экспрессии бактерий активные MMP в более высоких концентрациях подвергаются деградации в результате аутопротеолиза, что приводит к низкому выходу MMP17.
В данной работе описан подробный метод бактериальной экспрессии, очистки и активации рекомбинантного Hisx6-pro-MMP-3cd с использованием E. coli в качестве хозяина экспрессии благодаря его доступности, простоте и успеху в получении более высоких выходов MMP2,3,18. Поскольку E. coli не имеет механизма сворачивания белка и посттрансляционной обработки, необходимых для рекомбинантных MMP и других сложных белков, многие штаммы E. coli были разработаны для преодоления этих ограничений, что делает E. coli более подходящим хозяином для экспрессии рекомбинантного человеческого MMP-3cd,19,20 . Например, штамм R2DP, используемый в этом исследовании, усиливает эукариотическую экспрессию, поставляя резистентную к хлорамфениколу плазмиду, содержащую кодоны, редко используемые в E. coli.
Как описано в этом протоколе, после сверхэкспрессии относительно чистых тел включения из вектора pET-3a (рисунок 1) в клетках R2DP белки каталитического домена Hisx6-pro-MMP-3 (MMP-3cd) экстрагируются и денатурируются4. Hisx6-pro-MMP-3cd3,19 очищали с помощью аффинной метки хроматографии. При рефолдинге и диализе про-MMP-3cd (зимоген) активировали 4-аминофенилртумучевым ацетатом (APMA), а анализ SDS-PAGE используется для оценки выходов и необходимости дальнейшей очистки5,21. Этот протокол описывает экспрессию, очистку и активацию растворимого MMP-3cd в качестве примера. Тем не менее, он также может быть использован в качестве руководства для экспрессии других MMP и человеческих протеаз с аналогичной экспрессией и механизмами активации (рисунок 2). Для других белков, отличных от MMP-3cd, читателю рекомендуется определить оптимальные буферные композиции и методы для их целевого белка, прежде чем пытаться использовать этот протокол.
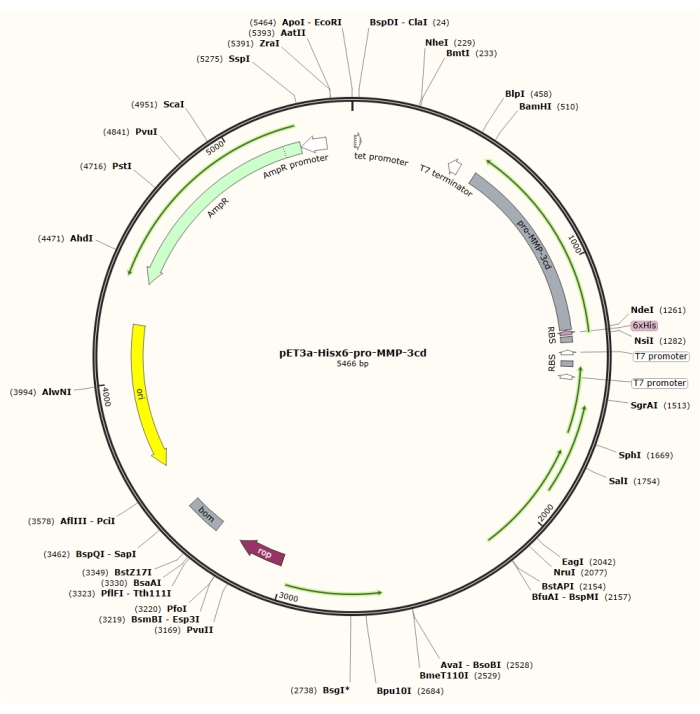
Рисунок 1: Плазмидная карта плазмиды pET-3a-Hisx6-pro-MMP-3cd. Вектор pET-3a включает ген устойчивости к ампициллину. N-концевая последовательность Hisx6-tag клонируется в вектор на основе pET-3a, включая pro-MMP-3cd, чтобы получить конструкцию pET-3a-Hisx6-pro-MMP-3cd под контролем промотора T7 между сайтами ограничения BamHI и NdeI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Бактериальная экспрессия про-MMP-3cd, очистка, рефолдация и активация. 1.1: плазмида pET-3a-Hisx6-pro-MMP-3cd трансформировалась в клетки BL21(DE3) или R2DP. 1.2: Экспрессия белка Pro-MMP-3cd была индуцирована с использованием IPTG. 1.3: Химический лизис и обработка ультразвуком используются для извлечения белков Hisx6-pro-MMP-3cd, которые в основном нерастворимы и обнаруживаются в телах включения. Мочевина использовалась для денатурации и солюбилизации белка из тел включения. 2.1. Денатурированный белок Hisx6-pro-MMP-3cd очищали с помощью аффинной хроматографической очистки. 3. Элюированный Hisx6-pro-MMP-3cd медленно переворачивался во время диализа путем постепенного удаления мочевины из буфера. 4. Наконец, восстановленный белок MMP-3cd был активирован с использованием APMA путем удаления N-концевого пропептидного домена. APMA позже удаляется из раствора путем обессоливания. Номера соответствуют разделам протокола, описывающим эти шаги. Сокращения: MMP-3cd = Матричный металлопротеиназы-3 каталитический домен; APMA = 4-аминофенилртутный ацетат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
1. Выражение MMP
- Клонирование и преобразование pET-3a-Hisx6-pro-MMP-3cd в ячейки R2DP
- Переваривайте плазмиду pET-3a (см. Таблицу материалов) ферментами рестрикции NdeI и BamHI в пищеварительном буфере (см. Таблицу материалов). В общем реакционном объеме 40 мкл добавьте 4 мкл пищеварительного буфера, 33 мкл плазмиды 100 нг/мкл и 1,5 мкл каждого фермента рестрикции и дайте реакции продолжаться в течение ~2 ч до завершения при 37 °C.
- Выполните реакцию ПЦР на последовательности MMP-3cd, чтобы вставить N-концевую His-метку. Используйте 25 мкл ПЦР-смеси (см. Таблицу материалов), 2,5 мкл праймеров 10 мкМ (дополнительный рисунок S1) и 1,25 мкл последовательности вставок 100 нг/мкл. Добавьте стерильную воду к конечному реакционному объему 50 мкл.
- Запускают препарат ПЦР и переваренный вектор на 1% агарозном геле. Очистите гелевые полосы с помощью набора для восстановления геля (см. Таблицу материалов) в соответствии с протоколом производителя.
- Клонируйте амплифицированный продукт ПЦР в переваренный вектор между участками ограничения NdeI и BamHI с помощью смеси сборки ДНК (см. Таблицу материалов). Используйте онлайн-инструменты для определения необходимого объема вставки и вектора разреза для общего объема реакции 15 мкл.
- Разморозьте 50-мкл аликвоту ячеек с высокой эффективностью трансформации (см. Таблицу материалов) на льду до оттаивания. Дожимная SOC питательная среда (см. Таблицу материалов) до пластин 37 °C и LB-ампициллина (LB Amp) (см. Таблицу материалов).
- Добавьте 1-2 мкл реакции сборки pET-3a-Hisx6-pro-MMP-3cd к аликвоте 50 мкл. Инкубировать на льду в течение 30 мин.
- Тепловой шок клеток путем инкубации при 42 °C в течение 30 с. Инкубировать на льду в течение 2 мин.
- Добавьте 950 мкл питательной среды SOC к каждой смеси трансформанта. Встряхивайте в течение 1 ч при 250 об/мин при 37 °C.
- Пластина 100 мкл трансформаторов на пластинах LB Amp и инкубируются в течение ночи при 37 °C.
- Инокулируют каждую изолированную колонию в 10 мл среды LB Amp. Встряхните в течение ночи при 250 об/мин при 37 °C.
- Извлечение плазмидной ДНК в соответствии с протоколом производителя для набора miniprep (см. Таблицу материалов). Подтвердите последовательность конструкции с помощью прямых и обратных праймеров T7 (дополнительный рисунок S1).
ПРИМЕЧАНИЕ: КОНСТРУКТИВНАЯ ДНК pET-3a-Hisx6-pro-MMP-3cd может храниться при -20 °C. Когда все будет готово, перейдите к преобразованию в ячейки R2DP. - Разморозить одну 20 мкл аликвоту клеток R2DP (см. Таблицу материалов) на льду в течение 2-5 мин. Дожимная SOC для роста среды до комнатной температуры и пластины LB Amp CamR до 37 °C (см. Таблицу материалов).
- Добавьте 1 мкл 100 нг/мкл подтвержденной последовательности pET-3a-Hisx6-pro-MMP-3cd к 50 мкл аликвоте. Осторожно перемешайте и верните тюбик ко льду.
- Высиживать трубку на льду в течение 5 мин.
- Тепловой шок клеток путем инкубации при 42 °C в течение ровно 30 с. Не трясти.
- Поместите ячейки на лед на 2 мин.
- Добавьте 80 мкл среды SOC комнатной температуры в трансформантную смесь. Встряхивайте в течение 1 ч при 250 об/мин при 37 °C.
- Нанесите трансформеры на пластины LB Amp CamR и инкубируйте в течение ночи при 37 °C.
- Рост и индукция
- Инокулировать одну изолированную колонию трансформанта R2DP pET-3a-Hisx6-pro-MMP-3cd из пластины LB Amp CamR в 10 мл среды LB Amp CamR при 37 °C. Встряхните при 250 об/мин в течение ночи (~16 ч). Сохраните аликвоты из каждой культуры и при необходимости подготовьте запасы 40% (v/v) глицерина (см. Таблицу материалов).
- На ночную культуру прививают колбу объемом 1 л, содержащую 500 мл среды LB Amp CamR , к оптической плотности при 600 нм (OD600) 0,05-0,1.
ПРИМЕЧАНИЕ: Это должно вернуть клетки к логарифмическому росту. - Измеряйте OD600 в нескольких временных точках, обычно в течение 3-4 ч, пока он не упадет между 0,4 и 0,6.
- Перед индудукцией аликвотируйте часть культуры в микрофьюжную трубку объемом 1,5 мл (см. Таблицу материалов) и маркируйте ее неиндуцированной фракцией. Храните при температуре -80 °C для анализа геля. Если гель SDS-PAGE не запущен, пропустите этот шаг и перейдите к шагу 1.2.5.
- Индуцировать культуры до конечной концентрации 1 мМ с использованием 1 М изопропил-ß-D-тиогалактопиранозида (IPTG) (см. Таблицу материалов). Продолжайте инкубировать в шейкере при температуре 37 °C в течение дополнительных 3-4 ч.
ПРИМЕЧАНИЕ: Во время экспрессии считыватель должен определить оптимальный OD600 в момент индукции и концентрацию IPTG. Если выход существенно падает после очистки, концентрация имидазола в буферах очистки может потребовать корректировки, или клеточную гранулу может потребоваться дальнейшая обработка ультразвуком. - Перед центрифугированием культур аликвотируют часть культуры во вторую микрофьюжную трубку объемом 1,5 мл и маркируют ее индуцированной фракцией. Храните при температуре -80 °C для анализа геля. Если гель SDS-PAGE не запущен, пропустите этот шаг и перейдите к шагу 1.2.7.
- Центрифугируют культуру клеток в конических флаконах по 250 мл (см. Таблицу материалов) с максимальной скоростью и 4 °C в течение 10 мин.
- Повторяйте шаг 1.2.7 до тех пор, пока культуры не будут полностью гранулированы.
ПРИМЕЧАНИЕ: ПАУЗА: Гранулы клеток могут быть заморожены при -80 °C и разморожены позже для дальнейшей обработки. В противном случае пропустите этот шаг и перейдите к шагу 1.3.1.
- Экстракция и солюбилизация тела включения
ПРИМЕЧАНИЕ: Приготовить свежий 10 М мочевины, желательно не ранее, чем за один день, тщательно перемешав до полного растворения. Не нагревать или автоклав мочевины; хранить его при комнатной температуре.- Повторное суспендирование гранулы (из стадии 1.2.8) в буфере лизиса (см. Таблицу материалов). На грамм гранулы добавляют 3 мл лизисного буфера и повторно суспендируют путем вихря или пипетирования. Встряхните на ночь при 4 °C.
- Добавить 1,25 мл 10% (мас./об.) дезоксихолата натрия (см. Таблицу материалов) на 1 л культуры. Встряхните при комнатной температуре в течение 30 мин при 150 об/мин.
- Добавьте 10 мкл ДНКазы I (см. Таблицу материалов) на 1 л культуры. Встряхните при комнатной температуре в течение 30 мин при 150 об/мин.
- Центрифуга в течение 10 мин при 13 000 × г и 4 °C.
- Отложите часть лизированного MMP для анализа геля. Хранить при -80 °C. Если анализ на гель не выполнен, перейдите к этапу 1.3.6.
ПРИМЕЧАНИЕ: После центрифугирования гранулы могут быть тягучими и не компактно упакованными, что делает рискованным выброс супернатанта. Если это так, то пропустите шаг 1.3.6 и перейдите к шагу 1.3.7. - Выбросьте супернатант из центрифугированных образцов.
ПРИМЕЧАНИЕ: Протокол может быть приостановлен в этот момент, а гранулы клеток заморожены при -80 °C и разморожены позже. В противном случае пропустите этот шаг и перейдите к шагу 1.3.7. - Повторное суспендирование гранулы в культуре 100 мл/л буфера тела включения (см. Таблицу материалов) путем пипетки вверх и вниз.
- Во время обработки ультразвуком держите образцы на льду, чтобы предотвратить перегрев. Обрабатывать ультразвуком каждый образец в течение 6 циклов по 15 с, выход 5 и 50% импульса. Оставьте 15 с периодов покоя для охлаждения между циклами.
ПРИМЕЧАНИЕ: При необходимости переложить образцы в конические трубки объемом 50 мл для дальнейшего центрифугирования (см. Таблицу материалов). Центрифуга в течение 10 мин при 13 000 × г и 4 °C. - Отложите часть ультразвукового MMP для анализа геля. Хранить при -80 °C. Если анализ геля не выполнен, перейдите к этапу 1.3.11.
- Проверьте гранулу. Если жесткое, повторите шаги 1.3.8-1.3.10. Если гранула компактная, откажитесь от супернатанта и перейдите к этапу 1.3.12.
ПРИМЕЧАНИЕ: Обработка ультразвуком в буфере тела включения может быть повторена для восстановления большего количества белка из лизированного клеточного мусора. Однако слишком много ультразвука может привести к сдвигу, что вредит выходу MMP. На этом этапе протокол может быть приостановлен, а гранулы клеток могут быть заморожены при -80 ° C и разморожены позже. - Повторно суспендировать каждую гранулу из культуры 1 л в 5 мл буфера солюбилизации (см. Таблицу материалов) путем пипетирования. Инкубируйте в течение не менее 30 минут на льду, чтобы позволить белкам солюбилизироваться.
- Отложите часть солюбилизированного MMP для анализа геля. Хранить при -80 °C. Если анализ геля не выполняется, перейдите к этапу 1.3.14.
- Центрифугируйте ячейки в течение 10 мин при 13 000 × г и 4 °C. НЕ ВЫБРАСЫВАЙТЕ СУПЕРНАТАНТ.
- Если гранула образуется/остается после центрифугирования, перелейте супернатант в отдельную коническую трубку объемом 50 мл. Повторно суспендировать гранулу еще в 5 мл буфера солюбилизации (на 1 л культуры) путем пипетки вверх и вниз.
- Центрифуга в течение 10 мин при 13 000 × г и 4 °C. НЕ ВЫБРАСЫВАЙТЕ СУПЕРНАТАНТ.
- Повторяйте этапы 1.3.13 и 1.3.14 до тех пор, пока после центрифугирования не образуется мало гранул или не образуется только серый осадок. Объединяйте супернатантов. Выбросьте или храните гранулы при -80 °C для дополнительной обработки ультразвуком.
2. MMP очистка и повторное складывание
- Его-тег (HT) аффинное очищение
- В соответствии с протоколом производителя заполните колонку гравитационного потока (см. Таблицу материалов) хорошо смешанной никель-НТА-смолой (см. Таблицу материалов). Позвольте смоле осесть и отделиться от буфера хранения таким образом, чтобы между двумя слоями образовалась четкая линия.
ПРИМЕЧАНИЕ: Никогда не позволяйте смоле высохнуть, так как воздух проникнет в смолу и повредит выходу белка. В перерывах между использованием выполните процедуру регенерации смолы, описанную в разделе 2.2. - Дайте буферу хранилища слиться. Заполните столбец двумя объемами буфера равновесия HT.
- Осушите буфер равновесия HT и выбросьте. Когда колонка дренируется, центрифугируют белковый экстракт при 13 000 × г в течение 1 мин и фильтруют-стерилизуют с помощью фильтра 0,22 мкм (см. Таблицу материалов).
- Замените контейнер для отходов на коническую трубку объемом 50 мл с маркировкой HT Flowthrough. Добавьте приготовленный белковый экстракт в колонку.
- Повторно примените сквозное прохождение, чтобы максимизировать связывание.
- Отложите часть фракции Flowthrough для анализа геля. Хранить при -80 °C. Если анализ геля не выполнен, перейдите к этапу 2.1.7.
- Немедленно промыть смолу 15 мл HT Wash Buffer (см. Таблицу материалов). Соберите проточное прохождение в конические трубки объемом 15 мл (см. Таблицу материалов) с маркировкой HT Wash.
ПРИМЕЧАНИЕ: Значения поглощения при 280 нм (A280) были получены с помощью спектрофотометрии и использовались вместе с молекулярной массой и коэффициентом вымирания, ε, для оценки концентраций белка. Для денатурированного Hisx6-pro-MMP-3cd молекулярная масса составляет 29,86 кДа, а ε составляет 34,38 М-1 см-1. - Заглушка против буфера стирки HT, измерение и запись A280. Повторите шаги 2.1.7 и 2.1.8 с дополнительными фракциями для промывки. Как только A280 приблизится к исходному уровню и примеси будут сведены к минимуму, перейдите к шагу 2.1.9.
- Отложите часть фракции Wash для анализа геля. Повторите для нескольких фракций стирки. Хранить фракции при температуре -80 °C. Если анализ геля не выполнен, перейдите к шагу 2.1.10.
- Немедленно элюируют помеченные Им белками, добавляя 5 мл буфера элюирования HT (см. Таблицу материалов). Соберите проточную фракцию в виде фракций 0,5-1 мл в микрофьюжных пробирках с маркировкой HT Elution.
- Отложите часть фракции элюирования для анализа геля. Повторите для нескольких фракций элюирования. Хранить фракции при температуре -80 °C. Если гель-анализ не выполнен, перейдите к шагу 2.1.12.
- Если A280 составляет >0,3 мг/мл, разбавьте фракцию буфером равновесия HT (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Элюированная фракция должна быть разбавлена до A280 0,3 мг/мл или менее для предотвращения осаждения во время диализа. Здесь протокол может быть приостановлен, а объединенные фракции заморожены при -80 °C и разморожены позже. В противном случае пропустите этот шаг и перейдите к шагу 2.2.1.
- В соответствии с протоколом производителя заполните колонку гравитационного потока (см. Таблицу материалов) хорошо смешанной никель-НТА-смолой (см. Таблицу материалов). Позвольте смоле осесть и отделиться от буфера хранения таким образом, чтобы между двумя слоями образовалась четкая линия.
- Регенерация смолы
- Промыть смолу десятью объемами смоляного слоя буфера регенерации HT (см. Таблицу материалов) и десятью объемами стерильной воды в смоляном слое.
- Храните смолу в виде 50% суспензии в 20% (v/v) этаноле в воде.
3. Рефолдирование белка
ПРИМЕЧАНИЕ: Для небольших объемов диализные кассеты могут использоваться с меньшим риском потери образца. Диализные трубки необходимы, если используются большие объемы (см. Таблицу материалов).
- Диализ
ПРИМЕЧАНИЕ: Оптимальная концентрация белка для диализа составляет ~0,3 мг/мл. Если во время диализа происходит значительное осаждение, уменьшите градиент концентрации мочевины между каждым диализом с помощью ступенчатого метода диализа и добавьте больше промежуточных этапов (например, от 6 М до 5 М, а затем от 5 М до 4 М, а не пропуская стадию 5 М). Поскольку циклы замораживания-оттаивания повреждают клеточную и белковую структуру, жизненно важно свести к минимуму паузы в протоколе.- В соответствии с протоколом производителя, используйте соответствующее количество диализных трубок в соответствии с объемом образцов Elution Fraction .
- Погружайте элюированные фракции MMP в диализные трубки в 1 л диализного буфера 1 (см. Таблицу материалов). Перемешивайте трубку и ее содержимое на магнитной мешалке не менее 8 ч при 4 °C.
- Перевести в 1 л диализного буфера 2 (см. Таблицу материалов). Перемешивайте трубку и ее содержимое на магнитной мешалке не менее 8 ч при 4 °C.
- Перевести в 1 л диализного буфера 3 (см. Таблицу материалов). Перемешивайте трубку и ее содержимое на магнитной мешалке не менее 8 ч при 4 °C.
- Перенесите образец в новые конические пробирки объемом 50 мл и пометьте их как диализированные MMP.
- Осмотрите трубку на наличие осадка. Если осадок образовался, центрифугируйте образец в течение 1 мин при 13 000 × г и 4 °C.
- Перенесите супернатант в новые конические трубки объемом 15 мл и пометьте их как Refolded MMP.
- Отложите фракцию для анализа геля и пометьте ее как Refolded MMP. Хранить при -80 °C. Если анализ геля не выполняется, перейдите к этапу 3.1.9.
ПРИМЕЧАНИЕ: Если выходы низкие, осадок может быть растворен в буфере равновесия HT и этапы в разделе 3.1 повторены с диализной трубкой. Если анализ на гель не проводится или если протокол должен быть приостановлен здесь, заморозьте образцы при -80 ° C и разморозьте их позже. Если доходность находится в желаемом диапазоне, перейдите к шагу 3.2.1.
- Реконцентрация
ПРИМЕЧАНИЕ: Ожидается, что коэффициенты вымирания для повторно свернутых и денатурированных Hisx6-pro-MMP-3cd будут одинаковыми; следовательно, расчеты A280 не затрагиваются.- Реконцентрировать образец до 0,5 мг/мл. Используйте перемешиваемую ячейку объемом 400 мл (см. Таблицу материалов), чтобы сконцентрировать образец до 15 мл. Чтобы предотвратить вспенивание, используйте реконцентрационную трубку объемом 50 мл для дальнейшей концентрации, если это необходимо.
ПРИМЕЧАНИЕ: Если образуется осадок, он может быть гранулирован и растворен в буфере равновесия HT. Затем повторите разделы 3.1 и 3.2.1. В противном случае перейдите к шагу 3.2.2. - Отложите фракцию для анализа геля и пометьте ее как концентрированный MMP.
ПРИМЕЧАНИЕ: Здесь протокол может быть приостановлен, а образцы заморожены при -80 °C и разморожены позже.
- Реконцентрировать образец до 0,5 мг/мл. Используйте перемешиваемую ячейку объемом 400 мл (см. Таблицу материалов), чтобы сконцентрировать образец до 15 мл. Чтобы предотвратить вспенивание, используйте реконцентрационную трубку объемом 50 мл для дальнейшей концентрации, если это необходимо.
4. Активация
- Активация 4-аминофенилртуартутного ацетата (APMA)
ПРИМЕЧАНИЕ: APMA очень токсична. Сделайте свежий стоковый раствор 20 мМ APMA перед активацией, и всегда работайте под вытяжным капотом при использовании APMA. Выбросьте отходы APMA в контейнер.- На 1 мл аликвоты ММП (1 мг/мл) добавляют 50 мкл 20 мМ APMA (см. Таблицу материалов) для достижения конечной концентрации APMA 1 мМ. Инкубировать в течение ночи при 37 °C.
- Если образуется осадок, центрифугируйте его с максимальной скоростью в течение 10 мин при 4 °C. Храните супернатант в микрофрагменной трубке объемом 1,5 мл с маркировкой Activated MMP. Выбросьте осадок в контейнер, маркированный для отходов APMA.
- Отложите фракцию для анализа геля и пометьте ее активированным MMP.
ПРИМЕЧАНИЕ: Здесь протокол может быть приостановлен, а образцы заморожены при -80 °C и разморожены позже. Если анализ геля не выполнен, перейдите к этапу 4.2.1. После активации молекулярная масса и коэффициент вымирания MMP-3cd составляют 19,40 кДа и 28,42 М-1 см-1 соответственно.
- Обессоливание
- Удалите APMA из активированного образца MMP-3cd с помощью колонки обессоливания 2 мл (см. Таблицу материалов) в соответствии с протоколом производителя.
- Отложите фракцию для анализа геля и пометьте ее обессоленным MMP. Хранить при -80 °C. Если анализ геля не выполняется, перейдите к разделу 4.3 с оставшимися образцами.
ПРИМЕЧАНИЕ: Здесь протокол может быть приостановлен, а образцы заморожены при -80 °C и разморожены позже.
- Запуск гелей SDS-PAGE
- Запустите все белковые фракции на гелях SDS-PAGE: неиндуцированная фракция, индуцированная фракция, лизированный MMP, ультразвуковой MMP, солюбилизированный MMP, проточная фракция, фракция wash, фракция элюирования, повторно свернутый MMP, концентрированный MMP, активированный MMP и обессоленный MMP.
- Длительное хранение ММП-3
- Добавьте 0,05% (v/v) неионное поверхностно-активное вещество (см. Таблицу материалов) к обессоленным образцам MMP-3cd и храните их при -80 °C.
Результаты
При запуске образцов на SDS-PAGE, поскольку белок экспрессируется в виде нерастворимых тел включения, лизированные и обработанные ультразвуком фракции должны практически не содержать экстракта Hisx6-pro-MMP-3cd, так как белок еще не был повторно растворен в мочевине. На рисунке 3 ?...
Обсуждение
Крупномасштабное производство растворимых, человеческих, рекомбинантных MMP остается сложной задачей. Клетки млекопитающих могут экспрессировать функциональные MMP при высоких затратах и длительном времени ожидания, тогда как E. coli быстро производит большое количество тел включен...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Авторы хотели бы поблагодарить доктора Эветт Радиски и Александру Хокла из клиники Майо в Джексонвилле, штат Флорида, за предоставление плазмиды pET-3a-pro-MMP-3cd в качестве шаблона для клонирования гена Hisx6pro-MMP-3cd, и их комментарии вместе с доктором Полом Хартли из Центра геномики Невады в Университете Невады, Рино, для секвенирования ДНК. Авторы также хотели бы поблагодарить Кассандру Хергенрайдер за помощь с частью экспрессии белка. М.Р.-С. хотели бы поблагодарить грант NIH-P20 GM103650-COBRE Integrative Neuroscience и грант UNR R&D mICRO SEED Grant Award.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| Nonionic surfactant | Thermo Fisher Scientific | PI28316 | Storage detergent for preventing MMP aggregation. Minimizes interactions between hydrophobic residues on the MMP surface and water molecules, without disrupting catalytic activity. |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
Ссылки
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены