Method Article
نقل الحبل الشوكي في الضفادع الصغيرة Xenopus laevis
In This Article
Summary
Xenopus laevis الشرغوف الحبل الشوكي هو طريقة إصابة ذات صلة لدراسة إصابة الحبل الشوكي وتجديده عن طريق إجراء قطع عرضي يقطع الحبل الشوكي تماما على المستوى الصدري.
Abstract
إصابة الحبل الشوكي (SCI) هي إصابة دائمة ، والتي تؤثر على الجهاز العصبي المركزي (CNS) الحركية والأعصاب الحسية ، مما يؤدي إلى شلل تحت موقع الإصابة. حتى الآن ، لا يوجد علاج وظيفي للتعافي ل SCI ، وهناك نقص في الوضوح فيما يتعلق بالعديد من المجمعات والأحداث الديناميكية التي تحدث بعد SCI. يمكن للعديد من الكائنات الحية غير الثديية أن تتجدد بعد SCI الشديد ، مثل أسماك teleost ، والبرمائيات urodele ، والمراحل اليرقية من البرمائيات anuran ، بما في ذلك الضفادع الصغيرة Xenopus laevis . هذه هي الكائنات الحية النموذجية حسنة النية لدراسة وفهم الاستجابة ل SCI والآليات الكامنة وراء عمليات التجدد الناجحة. يمكن أن يؤدي هذا النوع من الأبحاث إلى تحديد الأهداف المحتملة للتدخل العلاجي SCI. توضح هذه المقالة كيفية إجراء عملية نقل الحبل الشوكي Xenopus laevis الشرغوف ، بما في ذلك التربية والجراحة والرعاية بعد الجراحة وتقييم الاختبار الوظيفي. يمكن تطبيق طريقة الإصابة هذه لتوضيح الخطوات المختلفة لتجديد الحبل الشوكي من خلال دراسة الآليات الخلوية والجزيئية والجينية ، وكذلك التطور النسيجي والوظيفي بعد SCI وأثناء تجديد الحبل الشوكي.
Introduction
إصابة الحبل الشوكي (SCI) هي إصابة تؤثر على ما يقرب من 250,000-500,000 شخص في جميع أنحاء العالم كل عام1. بالإضافة إلى هذا الانتشار العالي ، يؤثر SCI على الأعصاب الحسية والحركية ، مما يولد شللا تحت موقع الإصابة وفصل بعض الأعضاء الداخلية عن التحكم في الجهاز العصبي المركزي. الحبل الشوكي ، وهو جزء من الجهاز العصبي المركزي ، لا يمكن أن يتجدد ، وبسبب تعقيد البلاء وعدم وجود فهم كامل لجميع العمليات المعنية ، لا توجد حتى الآن علاجات فعالة تسمح بالشفاء الوظيفي.
الكائنات الحية غير الثديية ، مثل أسماك teleost ، والبرمائيات urodele ، والمراحل اليرقية من البرمائيات anuran ، والتي يمكن أن تجدد الحبل الشوكي بعد SCI2,3,4 الشديد ، هي كائنات حية نموذجية ممتازة لدراسة العمليات التي تحكم حدثا تجديديا ناجحا وفهم فشل تجديد الثدييات. هذا الفهم ذو أهمية كبيرة لأنه يمكن أن يوفر رؤى أصلية لتطوير أهداف علاجية جديدة وعلاجات محتملة ل SCI.
الضفدع الأنوراني ، Xenopus laevis ، هو كائن حي نموذجي ممتاز لدراسة SCI. لديها قدرات تجديدية ممتازة خلال مراحل الشرغوف ، والتي يتم فقدانها تدريجيا أثناء التحول ، مما يسمح بالتجريب في المراحل التجديدية وغير التجديدية 3,5. تتكون طريقة الإصابة المعمول بها لدراسة SCI في الضفادع الصغيرة Xenopus laevis من بتر الذيل ، حيث تتم إزالة الذيل بالكامل ، بما في ذلك الأنسجة مثل العضلات و notochord والحبل الشوكي 6. كان لهذا النهج دور فعال في فهم الآليات العامة لعمليات التجديد4،7،8،9،10.
نظرا لأن بتر الذيل ينطوي على أنسجة متعددة بالإضافة إلى الحبل الشوكي ، وهو أمر مختلف عما يحدث بعد SCI البشري ، فهناك حاجة إلى نموذج إصابة أكثر صلة لدراسة SCI. لقد اعتمدنا على الدراسات المستخدمة في الماضي11 لتوليد أوصاف شاملة لنماذج الإصابة5،12،13،14 وطرق مختلفة لدراسة SCI12،13،14،15،16،17،18 . بعد نقل الحبل الشوكي ، يمكن عزل الجزء الذيلي من الحبل الشوكي للتعبير عن الحمض النووي الريبي والبروتين والتحليلات عالية الإنتاجية14،19،20،21. بالإضافة إلى ذلك ، تسمح الحقن داخل اللطخة للأدوية والجزيئات الصغيرة ، وكذلك كهربية الحمض النووي الريبي أو الحمض النووي الريبي أو المورفولينوس ، قبل أو بعد نقل الحبل الشوكي ، بدراسة آثار هذه الجزيئات في الوقاية أو العلاج من SCI أو الأحداث المحددة التي تحدث بعد SCI وتجديد الحبل الشوكي13,14 . علاوة على ذلك ، يمكن دراسة تطور الإصابة والعمليات التجديدية في أوقات مختلفة بعد الإصابة باستخدام الأساليب الكيميائية الحيوية والجزيئية والنسيجية والوظيفية12،13،14،17،19،20،21،22،23.
أخيرا ، يمكن استخدام جميع التقنيات المذكورة أعلاه في المراحل غير التجديدية ، مما يسلط الضوء على واحدة من أهم مزايا استخدام Xenopus laevis ككائن حي نموذجي لدراسة SCI ، والدراسات المقارنة للآليات التجديدية وغير التجديدية في نفس النوع13،19،20،21،22. تقدم هذه الورقة بروتوكولا لانتقال الحبل الشوكي Xenopus laevis الشرغوف ، بدءا من التدريج واختيار الضفادع الصغيرة الجديدة Nieuwkoop و Faber (NF) المرحلة 50. ويلي ذلك وصف إجراءات جراحة الحبل الشوكي لإنتاج صورية وعابرة ، والرعاية بعد الجراحة ، وأخيرا تحليل الانتعاش الوظيفي عن طريق قياس مسافة السباحة الحرة للشرغوف الصغير.
Protocol
يوفر هذا البروتوكول معلومات كافية لإجراء عملية نقل الحبل الشوكي بنجاح. تجدر الإشارة إلى أن هناك بروتوكولات مفصلة ممتازة لهذه التقنيات منشورة في مكان آخر14 ، والتي يمكن أن تكمل البروتوكولات المعروضة هنا. تمت الموافقة على جميع الإجراءات المتعلقة بالحيوانات من قبل لجنة أخلاقيات البيولوجيا والسلامة الأحيائية من كلية العلوم البيولوجية ، الجامعة البابوية الكاثوليكية في شيلي.
1. التزاوج الطبيعي للضفادع
- قبل ثلاثة إلى خمسة أيام من التزاوج ، قم بحقن الضفادع الذكور والإناث تحت الجلد مسبقا ب 50 وحدة من موجهة الغدد التناسلية المشيمية البشرية (hCG). استخدام تقنية "المخلب الحديدي" لتقييد الضفادع ؛ نظرا لأن الضفادع زلقة ، استخدم شبكة لإحاطة الضفدع إذا لزم الأمر. أدخل طرف إبرة 26 جم × 1/2 بوصة خلفية إلى الخط الجانبي ، وادفعها ظهريا إلى عمق 1 سم ، بين الجلد والعضلات.
- قبل التزاوج ، حقن الذكر مع 300 وحدة والأنثى مع 700 وحدة من قوات حرس السواحل الهايتية.
- لكي يحدث التزاوج ، ضع الذكر والأنثى في 2 لتر من محلول بارث 0.1x مباشرة بعد تبريد المحلول عند 4 درجات مئوية لمدة 15 دقيقة ليشبه ظروف الربيع واتركه بين عشية وضحاها عند 18 درجة مئوية.
- بعد ست عشرة ساعة ، اجمع الأجنة بعناية بمساعدة ماصة باستور البلاستيكية ، مع قطع الطرف ، وضعها في أطباق بتري قطرها 10 سم. قم بإزالة معطف الهلام الجنيني عن طريق احتضان الأجنة ب 25 مل من السيستين بنسبة 2٪ في الماء المقطر (درجة الحموضة 7.8 ؛ تأكد من أن المحلول يغطي الأجنة) لمدة 5 دقائق مع إثارة طفيفة. يغسل 3 مرات بالماء المقطر و 3 مرات بمحلول بارث 0.1x (8.9 mM NaCl ؛ 102 μM KCl ؛ 238.1 μM NaHCO3 ؛ 1 mM 4-(2- hydroxyethyl) -1-piperazine ethanesulfonic acid (HEPES) ؛ 81.14 μM MgSO4 ؛ 33.88 μM Ca(NO3)2 ؛ 40.81 μM CaCl2 ، الرقم الهيدروجيني 7.6).
- اختر الأجنة السليمة التي لها لون بني وتقسيم الأروميات بشكل متماثل. ضع الأجنة في أطباق بتري قطرها 10 سم مع 50 مل من محلول بارث 0.1x بكثافة لا تزيد عن 100 جنين لكل طبق.
2. التربية
- خلال الأسبوع الأول ، حافظ على الأجنة عند 18 درجة مئوية حتى تخرج من كيس الفيتيلين. خلال هذا الوقت ، قم بتغيير محلول Barth كل يوم ، وقم بإزالة الأجنة الميتة البيضاء والضفادع الصغيرة التي تقدم أي تغيير تشريحي مرئي أو الضفادع الصغيرة دون أي حركة سباحة.
- بعد الأسبوع الأول ، انقل الضفادع الصغيرة إلى مياه خالية من الكلور في خزانات بلاستيكية بكثافة 10 لكل لتر. تنمو الضفادع الصغيرة عند 20-21 درجة مئوية مع دورة مظلمة خفيفة لمدة 12 ساعة / 12 ساعة ، مع توفر أحجار الأكسجين في كل خزان لتهوية الماء وتغذيتها مرة واحدة في اليوم مع 0.5 ملغ لكل. استبدل الماء مرة واحدة في الأسبوع وتحقق من النفايات المتراكمة والحيوانات النافقة يوميا24.
3. التدريج
- بعد ثلاثة إلى أربعة أسابيع من الإخصاب ، ضع الحيوانات في طبق بتري ؛ ثم ، واحدا تلو الآخر ، تحقق من مورفولوجيا وظهور الأطراف الأمامية والخلفية. إذا لزم الأمر ، قم بتخدير الحيوانات عن طريق وضع الحيوانات في طبق بتري مع 50 مل من 0.02٪ من تريكاين ميسيلات في محلول بارث 0.1x للتلاعب بشكل أفضل. بعد ما لا يزيد عن دقيقتين ، ضع الحيوانات في محلول بارث 0.1x للتعافي من التخدير.
- ابحث عن الخصائص التشريحية التالية لحيوانات المرحلة 5025: الأطراف الأمامية التي تظهر للتو وهي كروية (الشكل 1) ؛ الأطراف الخلفية البارزة والكروية (الشكل 1).
ملاحظة: يمكن استخدام الحيوانات من المراحل 49 إلى 51 لهذا الإجراء (الشكل 1)؛ لمزيد من المعلومات حول المراحل ، راجع Nieuwkoop و Faber's Normal Table of Xenopus laevis25.
4. الجراحة: نقل الحبل الشوكي والحيوانات التي تعمل بشكل صوري
- تخدير المرحلة 50 من الضفادع الصغيرة عن طريق وضعها في طبق بتري مع 50 مل من 0.02٪ من تريكاين ميسيلات في محلول بارث 0.1x لمدة دقيقتين.
- بمساعدة ملعقة كبيرة وملقط ، ضع الشرغوف ، الجانب الظهري ، على قطعة مبللة من الشاش في النصف العلوي من طبق بتري الزجاجي.
- إجراء شق في الجلد والعضلات الظهرية على مستوى منتصف الصدر (الشكل 2A ، B) باستخدام مقص زنبركي للتشريح المجهري.
- بالنسبة للحيوانات الوهمية الضابطة ، تأكد من أن حجم الشق هو ~ 0.2 مم فقط (الشكل 2C) ؛ لا تتلف الحبل الشوكي (الشكل 2D ، D').
- بالنسبة للحيوانات العابرة ، قم بإجراء شق ثان يبلغ ~ 0.2 مم (الشكل 2C) لعبور الحبل الشوكي بالكامل (الشكل 2E ، E').
5. رعاية ما بعد الجراحة
- بعد الجراحة ، انقل الضفادع الصغيرة إلى خزان يحتوي على 0.5 لتر من محلول بارث 0.1x مع 1x البنسلين الستربتومايسين ، بكثافة 10-12 حيوانا لكل خزان. الحفاظ على الحيوانات العابرة والسيطرة عليها في خزانات منفصلة.
ملاحظة: سوف تتعافى الضفادع الصغيرة من التخدير في بضع دقائق. - الحفاظ على الضفادع الصغيرة مع تهوية عند درجة حرارة 20-21 درجة مئوية.
- تغيير محلول بارث بالمضادات الحيوية كل يومين حتى نهاية التجربة.
- ابدأ في إطعام الحيوانات بعد يوم واحد من الجراحة ، مرة واحدة في اليوم.
- القضاء على الحيوانات الميتة.
6. فحص السباحة
- احصل على صندوق به إضاءة LED من الداخل ، مغطى بورقة بوليسترين شفافة ، مما يسمح للضوء بالمرور.
- قم بتثبيت كاميرا فوق صندوق LED.
- ضع طبق بتري قطره 15 سم فوق الصندوق ، مملوءا ب 100 مل من محلول بارث 0.1x.
- بعد يوم واحد من التحويل ، ضع الشرغوف في طبق بتري واتركه لفترة تكيف مدتها 5 دقائق.
- بعد التكيف، ابدأ في تتبع سلوك السباحة الحرة بالفيديو باستخدام البرنامج المشار إليه (انظر جدول المواد) لمدة 5 دقائق.
- بعد اكتمال الفيديو ، انقل الشرغوف مرة أخرى إلى خزانه.
- كرر تتبع الفيديو بعد 5 و 10 و 15 و 20 يوما من التحويل (الشكل 3).
7. اعتبارات أخلاقيات البيولوجيا
ملاحظة: معدل نفوق الحيوانات بعد الجراحة الصورية والتحويل هو 13٪ و 30٪ على التوالي. بالإضافة إلى ذلك ، من الضروري وجود ما لا يقل عن 15-20 حيوانا لكل مجموعة للتحليل الإحصائي. لذلك ، ابدأ ب 23 حيوانا صوريا و 26 حيوانا عابرا.
- تخدير الحيوانات مع 0.02٪ تريكاين ميسيلات لمدة دقيقتين لضمان الحد من النشاط العصبي والحركي والألم قبل الجراحة.
- بعد الجراحة ، تحقق من الحيوانات للتعافي من التخدير. بالإضافة إلى ذلك ، قم بإطعام الحيوانات والتحقق منها يوميا.
- بعد الانتهاء من فحص السباحة ، ضح بالحيوانات بجرعة زائدة من تريكاين ميسيليت (1٪ تريكاين ميسيلات محضرة في محلول بيكربونات الصوديوم 30 ملليمتر).
النتائج
يسمح البروتوكول الموصوف هنا بدراسة تجديد الحبل الشوكي في Xenopus laevis. يمكن تقييم آثار العلاجات الدوائية المحددة ومساهمة التعبير الجيني المحدد في تجديد الحبل الشوكي من خلال قياس آثارها على التعافي من السباحة. يتم رسم مسافة السباحة الإجمالية مقابل الأيام التالية للإصابة لمقارنة الحيوانات الضابطة والمعالجة في نقطة زمنية محددة أو خلال فترة محددة. يتمثل الشكل 3 في استعادة الوظيفة الحركية عبر الزمن ، حيث يوضح مسافة السباحة عند 5 و 10 و 15 و 20 يوما بعد الانتقال. في 5 أيام بعد الانتقال ، سبحت الحيوانات بمعدل 0.7 متر في 5 دقائق ، مما يدل على انخفاض قدرة السباحة. وزادت هذه القدرة مع مرور الأيام، حيث لوحظ متوسط 2.1 و 3.1 م/5 دقائق بعد 10 و 15 يوما بعد الانتقال، على التوالي، ولوحظ الاسترداد الكامل لقدرات السباحة في 20 يوما بعد الانتقال، بمتوسط 5.7 م/5 دقائق.
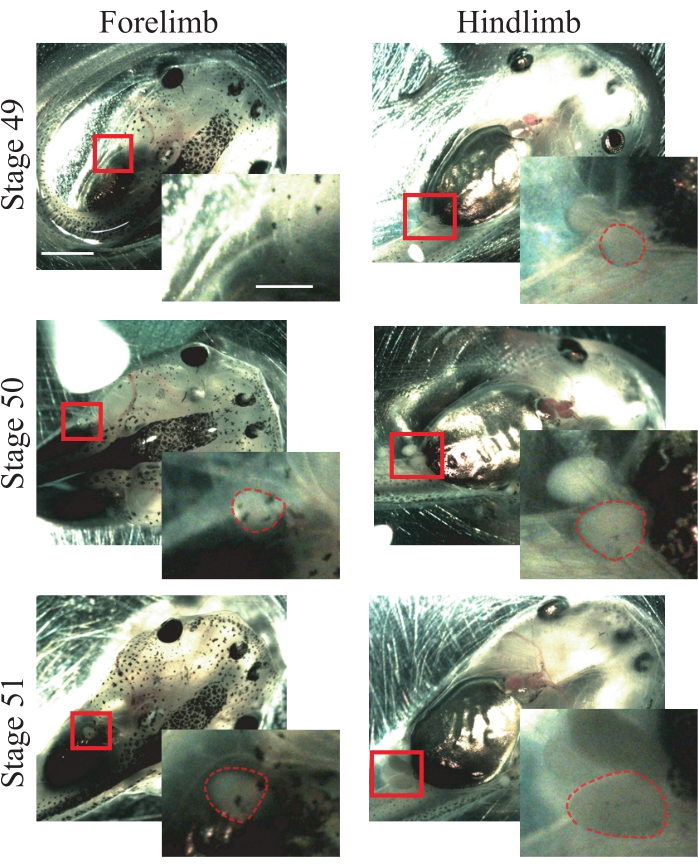
الشكل 1: تدريج الشرغوف زينوبوس. صور تمثيلية للمراحل 49-51 ، تظهر الأطراف الأمامية والخلفية للإشارة إلى التدريج الحيواني. قضبان المقياس = 2 مم. تظهر تكبيرات المنطقة المربعة في أسفل يسار كل صورة. قضبان المقياس = 1 مم. في المرحلة 49 ، لا يتم ملاحظة الأطراف الأمامية ، في حين أن الأطراف الخلفية تظهر فقط ، وتظهر شكلا كرويا. تقدم المرحلة 50 أطرافا أمامية تظهر للتو ، وتظهر شكلا كرويا وأطرافا خلفية بارزة بشكل كروي. في المرحلة 51 ، تقدم الأطراف الأمامية شكلا كرويا بارزا والأطراف الخلفية شكلا ممدودا بارزا. تظهر الخطوط العريضة المتقطعة أطرافا أمامية وخلفية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
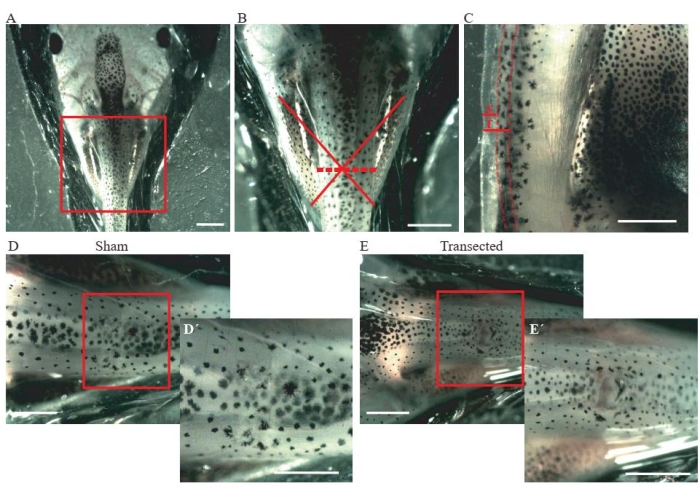
الشكل 2: نقل الحبل الشوكي . (أ) صورة تمثيلية توضح الموضع الصحيح للحيوان ، الجانب الظهري لأعلى ، لإجراء الجراحة. شريط المقياس = 2 مم. (B) يظهر تكبير A موقع الإصابة ومداها. يظهر الصليب الأحمر الموقع الدقيق لموقع الإصابة على المستوى الصدري للحبل الشوكي ، ويظهر الخط المتقطع مدى الإصابة. شريط المقياس = 1 مم (C) صورة تمثيلية تظهر منظرا جانبيا للمستوى الصدري للحبل الشوكي. يتم عرض امتداد شق وهمي ونقل. الخطوط المتقطعة تحدد حدود الحبل الشوكي. شريط المقياس = 1 مم (D) صورة تمثيلية تظهر حيوانا صوريا بحبل شوكي سليم. أشرطة المقياس = 1 مم (E) صورة تمثيلية تظهر حيوانا عابرا مع حبل شوكي متقطع. قضبان المقياس = 1 مم. تظهر تكبيرات المنطقة المربعة في أسفل يسار كل صورة (D' و E'). قضبان المقياس = 1 مم. الاختصارات: S = شق صوري. T = الانتقال. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
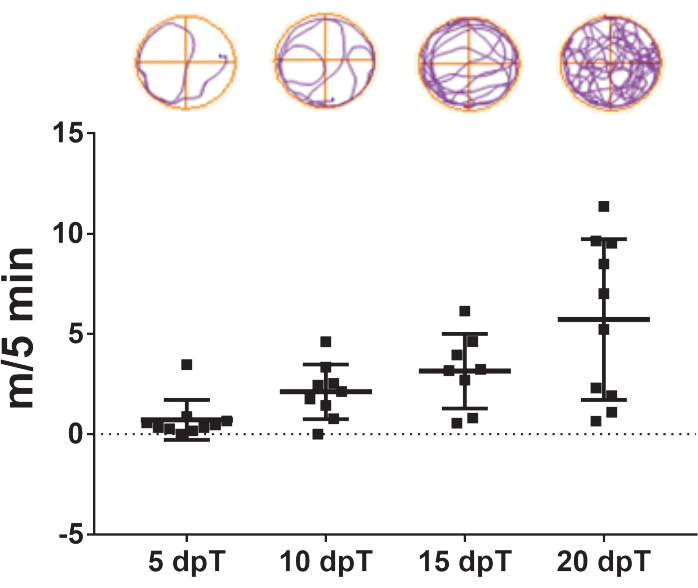
الشكل 3: استعادة وظيفة السباحة بمرور الوقت. مخطط نقطة تمثيلية لمسافة السباحة التي تغطيها الحيوانات العابرة في 5 دقائق في 5 و 10 و 15 و 20 يوما بعد الانتقال. تظهر عينات من مسارات السباحة في الأعلى. البيانات المقدمة كمتوسط ± SEM من 10 ضفادع صغيرة. الاختصارات: dpT = أيام ما بعد التحويل ؛ SEM = الخطأ المعياري للمتوسط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
البروتوكول الموضح هنا هو طريقة ممتازة لأداء SCI وتقييم الاسترداد الوظيفي. من أجل التكاثر ، من الضروري زراعة الضفادع الصغيرة الصحية واختيار الحيوانات المتشابهة في الحجم. ويؤدي الافتقار إلى التغذية السليمة إلى إجهاد المغذيات، مما يؤدي إلى ضعف القدرات التجديدية(26)؛ لذلك ، ينبغي إيلاء اهتمام خاص لتغذية الشرغوف الشرغوف. عندما تصل الضفادع الصغيرة إلى المرحلة 50 بعد 3-4 أسابيع ، يمكن تربيتها في درجات حرارة أعلى لتسريع عملية النمو ، 18-25 درجة مئوية هي الأمثل27. جودة المياه مهمة ، لأن الحيوانات حساسة لظروف المياه والمنتجات الكيميائية. وتشمل الظروف المثلى للمياه استخدام المياه المصفاة بالكربون والخالية من الكلور مع المعلمات التالية: الرقم الهيدروجيني (6.5-7.5)، والكلوريد (<0.02 ملغم/لتر)، وموصلية المياه (1.0 مللي ثانية/سم ± 0.1 وحدة)، والنحاس (<0.3 ملغم/لتر)؛ ودرجة الحموضة (0.02 ملغم/لتر)، ودرجة حرارة الماء (1.0 مللي ثانية/سم 0.1 وحدة)؛ ودرجة الحموضة (0.0 ملغم/لتر)؛ ودرجة حرارة الماء (0.0 ملليمتر/لتر ودرجة حرارتها)؛ ودرجة حرارة الماء (0.0 مللي ثانية/لتر ودرجة حرارتها)؛ ودرجة حرارة الماء (0.0 مللي ثانية/لتر ودرجة حرارتها)؛ ودرجة حرارة الماء (0.0 مللي سم/لتر صلابة الكربونات (KH: 5-10 dKH) ؛ صلابة عامة (GH: 6-16 dGH) ؛ النترات (NO3: <20 ملغ / لتر) ؛ والنتريت (NO2: <0.1 ملغ / لتر) 14،27،28. بالإضافة إلى ذلك ، لتجنب التلوث ، يجب تنظيف الخزانات البلاستيكية مرة واحدة في الأسبوع لتربية الحيوانات أو كل يومين بعد الجراحة عن طريق غسلها جيدا بالماء الخالي من الكلوريد والإسفنج ؛ يجب تجنب المنظفات.
للحصول على معدل بقاء أفضل بعد الجراحة ، يجب ألا تتعرض الضفادع الصغيرة للتخدير لفترات طويلة (لا تزيد عن 2 دقيقة). علاوة على ذلك ، يوصى بتخدير شرغوف واحد في كل مرة. نظرا لأن الحيوانات تحتاج إلى البقاء رطبة ، حافظ على الحيوانات مغمورة في المحلول طوال الوقت قبل الجراحة وبعدها ، وصب المحلول بملعقة فوق الشرغوف قبل بدء الجراحة. تأكد من أن الضرر واسع النطاق بما يكفي لتغطية الحبل الشوكي بأكمله ولكنه ليس واسعا جدا لأنه يمكن أن يؤدي إلى ضعف الانتعاش الوظيفي أو الوفاة. في حالة تلف notochord ، سيتم ثني الحيوان ، وسيتأثر الانتعاش الوظيفي. إذا امتد الضرر إلى ما هو أبعد من notochord ، فإن احتمال الوفاة يزداد14. أثناء فحص السباحة ، يعتبر التسجيل صحيحا إذا حدد البرنامج كل بظل أزرق ؛ خلاف ذلك ، يجب تكرار التسجيل. من المهم تجنب الحركة وتغيرات الهواء أو الضوء أثناء عملية التسجيل لمنع أخطاء التسجيل.
لا يزال هناك العديد من الأسئلة المفتوحة حول الآليات الخلوية والجزيئية الكامنة وراء تلف الحبل الشوكي وتجديده. يمكن استخدام البروتوكول الموصوف في هذا العمل لدراسة مساهمة الأحداث الخلوية المختلفة والتعبير الجيني والعلاجات في التعافي الوظيفي ، والتي يتم تحديدها من خلال قياس قدرات السباحة. بالإضافة إلى ذلك ، يمكن تطبيق العديد من التقنيات الأخرى على الحيوانات التي يتم تشغيلها. يمكن عزل الحبل الشوكي لإجراء استخراج البروتين و/أو الحمض النووي الريبوزي المرسال14 لدراسة ملامح البروتين والتعبير الجيني بعد التلف والعلاج19,20. كانت هذه الجراحة أيضا أساسا لدراسة الاستجابة الخلوية للحبل الشوكي22 وسلوك الخلايا السلفية الجذعية العصبية12،13،22 بعد إصابة الحبل الشوكي. كما تمت دراسة سلاسل الإشارات المشاركة في تجديد الحبل الشوكي باستخدام نموذج تلف الحبل الشوكي الموصوف هنا23. باختصار ، يعد البروتوكول الموصوف هنا نموذجا ممتازا لدراسة إصابة الحبل الشوكي وتجديده وقد تم استخدامه في العديد من الدراسات التي ساهمت في المعرفة الحالية حول هذا الموضوع.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان.
Acknowledgements
تم تمويل هذا العمل من خلال منح بحثية من: PG Slater: FONDECYT N° 3190820; J. Larraín: FONDECYT N° 1180429، CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
Materials
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
References
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved