Method Article
Transsection de la moelle épinière chez les têtards Xenopus laevis
Dans cet article
Résumé
Xenopus laevis tadpole la transection de la moelle épinière est une méthode de lésion pertinente pour étudier les lésions de la moelle épinière et la régénération en faisant une coupure transversale qui coupe complètement la moelle épinière au niveau thoracique.
Résumé
La lésion de la moelle épinière (LM) est une affection permanente qui affecte les nerfs moteurs et sensoriels du système nerveux central (SNC), entraînant une paralysie sous le site de la blessure. À ce jour, il n’existe pas de thérapie de récupération fonctionnelle pour le SCI, et il y a un manque de clarté concernant les nombreux complexes et événements dynamiques qui se produisent après le SCI. De nombreux organismes non mammifères peuvent se régénérer après une lésion médullaire sévère, tels que les poissons téléostéens, les amphibiens urodèles et les stades larvaires des amphibiens anuranes, y compris les têtards Xenopus laevis . Ce sont des organismes modèles de bonne foi pour étudier et comprendre la réponse au SCI et les mécanismes sous-jacents aux processus de régénération réussis. Ce type de recherche peut mener à l’identification de cibles potentielles pour l’intervention thérapeutique sci. Cet article explique comment effectuer la transsection de la moelle épinière de Xenopus laevis tadpole, y compris l’élevage, la chirurgie, les soins postopératoires et l’évaluation des tests fonctionnels. Cette méthode de lésion peut être appliquée pour élucider les différentes étapes de la régénération de la moelle épinière en étudiant les mécanismes cellulaires, moléculaires et génétiques, ainsi que l’évolution histologique et fonctionnelle après le SCI et pendant la régénération de la moelle épinière.
Introduction
La lésion de la moelle épinière (LM) est une affection qui touche environ 250 000 à 500 000 personnes dans le monde chaque année1. En plus de cette prévalence élevée, le SCI affecte les nerfs sensoriels et moteurs, générant une paralysie sous le site de la blessure et la déconnexion de certains organes internes du contrôle du SNC. La moelle épinière, une partie du SNC, ne peut pas se régénérer, et en raison de la complexité de l’affliction et du manque de compréhension complète de tous les processus impliqués, il n’existe toujours pas de thérapies efficaces permettant une récupération fonctionnelle.
Les organismes non mammifères, tels que les poissons téléostéens, les amphibiens urodèles et les stades larvaires des amphibiens anourans, qui peuvent régénérer la moelle épinière après une lésion médullaire sévère2,3,4, sont d’excellents organismes modèles pour étudier les processus qui régissent un événement régénératif réussi et comprendre l’échec de la régénération des mammifères. Cette compréhension est d’un grand intérêt car elle pourrait fournir des informations originales pour développer de nouvelles cibles thérapeutiques et des thérapies possibles pour le SCI.
La grenouille anurane, Xenopus laevis, est un excellent organisme modèle pour étudier la SCI. Il possède d’excellentes capacités de régénération pendant les stades têtards, qui se perdent progressivement lors de la métamorphose, permettant l’expérimentation dans les stades régénératif et non régénératif3,5. La méthode de blessure établie pour l’étude de la lésion médullaire chez les têtards Xenopus laevis consiste en une amputation de la queue, où toute la queue est enlevée, y compris les tissus tels que les muscles, la notochorde et la moelle épinière6. Cette approche a joué un rôle déterminant dans la compréhension des mécanismes généraux des processus de régénération4,7,8,9,10.
Comme l’amputation de la queue implique plusieurs tissus en plus de la moelle épinière, ce qui est différent de ce qui se passe après le SCI humain, un paradigme de blessure plus pertinent est nécessaire pour l’étude du SCI. Nous nous sommes appuyés sur des études utilisées dans le passé11 pour générer des descriptions complètes des paradigmes de blessure5,12,13,14 et différentes méthodes pour l’étude des lésions méridiennes12,13,14,15,16,17,18 . Après la transsection de la moelle épinière, la partie caudale de la moelle épinière peut être isolée pour l’expression de l’ARN et des protéines et des analyses à haut débit14,19,20,21. De plus, les injections intra-épilomiques de médicaments et de petites molécules, ainsi que l’électroporation de l’ADNc, de l’ARN ou des morpholinos, avant ou après la transsection de la moelle épinière, permettent d’étudier les effets de ces molécules dans la prévention ou le traitement du SCI ou d’événements spécifiques survenant après le SCI et la régénération de la moelle épinière13,14 . De plus, l’évolution des lésions et les processus de régénération peuvent être étudiés à différents moments après une blessure à l’aide d’approches biochimiques, moléculaires, histologiques et fonctionnelles12,13,14,17,19,20,21,22,23.
Enfin, toutes les techniques susmentionnées peuvent être utilisées à des stades non régénératifs, soulignant l’un des avantages les plus importants de l’utilisation de Xenopus laevis comme organisme modèle pour étudier les lésions médullaires, les études comparatives des mécanismes régénératifs et non régénératifs chez la même espèce13,19,20,21,22. Cet article présente un protocole pour la transsection de la moelle épinière du têtard Xenopus laevis, en commençant par la stadification et la sélection des têtards régénératifs de stade 50 Nieuwkoop et Faber (NF). Ceci est suivi par la description des procédures de chirurgie de la moelle épinière pour produire des animaux simulés et transectés, les soins postchirurgicaux, et enfin l’analyse de la récupération fonctionnelle par la mesure de la distance de nage du têtard libre.
Protocole
Ce protocole fournit suffisamment d’informations pour effectuer avec succès la transsection de la moelle épinière. Il est à noter qu’il existe d’excellents protocoles détaillés de ces techniques publiés ailleurs14, qui peuvent compléter celui présenté ici. Toutes les procédures animales ont été approuvées par le Comité de bioéthique et de biosécurité de la Faculté des sciences biologiques de la Pontificia Universidad Católica de Chile.
1. Accouplement naturel des grenouilles
- Trois à cinq jours avant l’accouplement, préinjecter par voie sous-cutanée les grenouilles mâles et femelles avec 50 unités de gonadotrophine chorionique humaine (hCG). Utilisez la technique de la « griffe de fer » pour retenir les grenouilles; comme les grenouilles sont glissantes, utilisez un filet pour entourer la grenouille si nécessaire. Insérez l’extrémité d’une aiguille de 26 G x 1/2 » postérieure à la ligne latérale, en la poussant dorsalement à une profondeur de 1 cm, entre la peau et le muscle.
- Avant l’accouplement, injectez au mâle 300 unités et à la femelle 700 unités d’hCG.
- Pour que l’accouplement ait lieu, placer le mâle et la femelle dans 2 L de solution de Barth 0,1x immédiatement après avoir refroidi la solution à 4 °C pendant 15 min pour ressembler aux conditions printanières et laisser reposer toute la nuit à 18 °C.
- Seize heures plus tard, collectez soigneusement les embryons à l’aide d’une pipette Pasteur en plastique, avec la pointe coupée, et placez-les dans des boîtes de Petri de 10 cm de diamètre. Retirer la couche de gelée embryonnaire en incubant les embryons avec 25 mL de cystéine à 2% dans de l’eau distillée (pH 7,8; assurer que la solution recouvre les embryons) pendant 5 min avec une légère agitation. Laver 3 fois avec de l’eau distillée et 3 fois avec 0,1x solution de Barth (8,9 mM de NaCl ; 102 μM KCl ; 238,1 μM de NaHCO3 ; 1 mM de 4-(2-hydroxyéthyl)-1-pipérazine d’acide éthanesulfonique (HEPES) ; 81,14 μM MgSO4 ; 33,88 μM Ca(NO3)2 ; 40,81 μM CaCl2, pH 7,6).
- Sélectionnez des embryons sains qui ont une couleur brunâtre et des blastomères à division symétrique. Placer les embryons dans des boîtes de Petri de 10 cm de diamètre avec 50 mL de solution de Barth 0,1x à une densité ne dépassant pas 100 embryons par plat.
2. Élevage
- Au cours de la première semaine, maintenez les embryons à 18 °C jusqu’à ce qu’ils sortent du sac vitelline. Pendant ce temps, changez la solution barth tous les jours et retirez les embryons et les têtards blanchâtres morts présentant une altération anatomique visible ou des têtards sans aucun mouvement de nage.
- Après la première semaine, transférer les têtards dans de l’eau sans chlore dans des réservoirs en plastique à une densité de 10 animaux par litre. Cultivez des têtards à 20-21 °C avec un cycle de lumière de 12 h / 12 h d’obscurité, avec des pierres d’oxygène disponibles dans chaque réservoir pour aérer l’eau et nourris une fois par jour avec 0,5 mg par animal. Remplacez l’eau une fois par semaine et vérifiez quotidiennement les déchets accumulés et les animaux morts24.
3. Mise en scène
- Trois à quatre semaines après la fécondation, placez les animaux dans une boîte de Pétri; puis, un par un, vérifiez la morphologie et l’apparence des membres antérieurs et des membres postérieurs. Si nécessaire, anesthésiez les animaux en les plaçant dans une boîte de Pétri avec 50 mL de mésylate de tricaïne à 0,02% dans une solution de Barth 0,1x pour une meilleure manipulation. Après pas plus de 2 min, placez les animaux dans 0,1x solution barth pour la récupération de l’anesthésie.
- Recherchez les caractéristiques anatomiques suivantes des animaux de stade 5025 : les membres antérieurs qui viennent d’apparaître et qui sont sphériques (figure 1); membres postérieurs saillants et sphériques (Figure 1).
REMARQUE: Les animaux des stades 49 à 51 peuvent être utilisés pour cette procédure (Figure 1); Pour plus d’informations sur les étapes, reportez-vous à Nieuwkoop et faber’s Normal Table of Xenopus laevis25.
4. Chirurgie : transsection de la moelle épinière et animaux opérés par simulacre
- Anesthésier les têtards de stade 50 en les plaçant dans une boîte de Petri avec 50 mL de mésylate de tricaïne à 0,02% dans une solution de Barth 0,1x pendant 2 min.
- À l’aide d’une cuillère à soupe et d’une pince, placez le têtard, côté dorsal vers le haut, sur un morceau de gaze humide dans la moitié supérieure d’une boîte de Petri en verre.
- Effectuer une incision de la peau et des muscles dorsaux au niveau mi-thoracique (Figure 2A, B) à l’aide de ciseaux à ressort à microdissection.
- Pour les animaux simulés de contrôle, assurez-vous que la taille de l’incision n’est que d’environ 0,2 mm (figure 2C); n’endommagent pas la moelle épinière (Figure 2D,D').
- Pour les animaux transectés, effectuer une deuxième incision d’environ 0,2 mm (Figure 2C) pour transecter complètement la moelle épinière (Figure 2E,E').
5. Soins postopératoires
- Après la chirurgie, transférer les têtards dans un réservoir contenant 0,5 L de 0,1x solution de Barth avec 1x pénicilline-streptomycine, à une densité de 10-12 animaux par réservoir. Entretenez les animaux transectés et contrôlez les animaux simulés dans des réservoirs séparés.
REMARQUE: Les têtards se rétabliront de l’anesthésie en quelques minutes. - Maintenir les têtards avec aération à une température de 20-21 °C.
- Changez la solution barth avec des antibiotiques tous les deux jours jusqu’à la fin de l’expérience.
- Commencez à nourrir les animaux un jour après la chirurgie, une fois par jour.
- Éliminez les animaux morts.
6. Essai de natation
- Procurez-vous une boîte avec éclairage LED de l’intérieur, recouverte d’une feuille de polystyrène transparent, qui permet à la lumière de passer.
- Installez une caméra sur le boîtier LED.
- Placez une boîte de Petri de 15 cm de diamètre sur le dessus de la boîte, remplie de 100 mL de solution de Barth 0,1x.
- Un jour après la transsection, placez un têtard dans la boîte de Pétri et laissez agir pendant une période d’adaptation de 5 minutes.
- Après adaptation, commencez à suivre en vidéo le comportement de nage libre à l’aide du logiciel référencé (voir la table des matériaux) pendant 5 min.
- Une fois la vidéo terminée, transférez le têtard dans son réservoir.
- Répétez le suivi vidéo 5, 10, 15 et 20 jours après la transsection (Figure 3).
7. Considérations bioéthiques
NOTE: La mortalité des animaux après une chirurgie simulée et une transsection est de 13% et 30%, respectivement. De plus, un minimum de 15 à 20 animaux par groupe est nécessaire pour l’analyse statistique. Par conséquent, commencez par 23 animaux simulés et 26 animaux transectés.
- Anesthésier les animaux avec 0,02% de mésylate de tricaïne pendant 2 min pour assurer une réduction de l’activité neuronale et motrice et de la douleur avant la chirurgie.
- Après la chirurgie, vérifiez les animaux pour la récupération de l’anesthésie. De plus, nourrissez et vérifiez les animaux quotidiennement.
- Après avoir terminé le test de natation, sacrifier les animaux avec une surdose de mésylate de tricaïne (mésylate de tricaïne à 1% préparé dans une solution de bicarbonate de sodium de 30 mM).
Résultats
Le protocole décrit ici permet l’étude de la régénération de la moelle épinière chez Xenopus laevis. Les effets de traitements pharmacologiques spécifiques et la contribution de l’expression de gènes spécifiques à la régénération de la moelle épinière peuvent être évalués en mesurant leurs effets sur la récupération de la natation. La distance totale de nage est tracée par rapport aux jours suivant la blessure afin de comparer les animaux témoins et traités à un moment précis ou sur une période spécifiée. La récupération de la fonction motrice au fil du temps est illustrée à la figure 3, qui montre la distance de nage à 5, 10, 15 et 20 jours après la transsection. 5 jours après la transsection, les animaux ont nagé en moyenne 0,7 m en 5 min, montrant une capacité de nage réduite. Cette capacité a augmenté avec les jours qui passaient, car une moyenne de 2,1 et 3,1 m/5 min a été observée après 10 et 15 jours après la transsection, respectivement, et une récupération complète des capacités de nage a été observée à 20 jours après la transsection, avec une moyenne de 5,7 m/5 min.
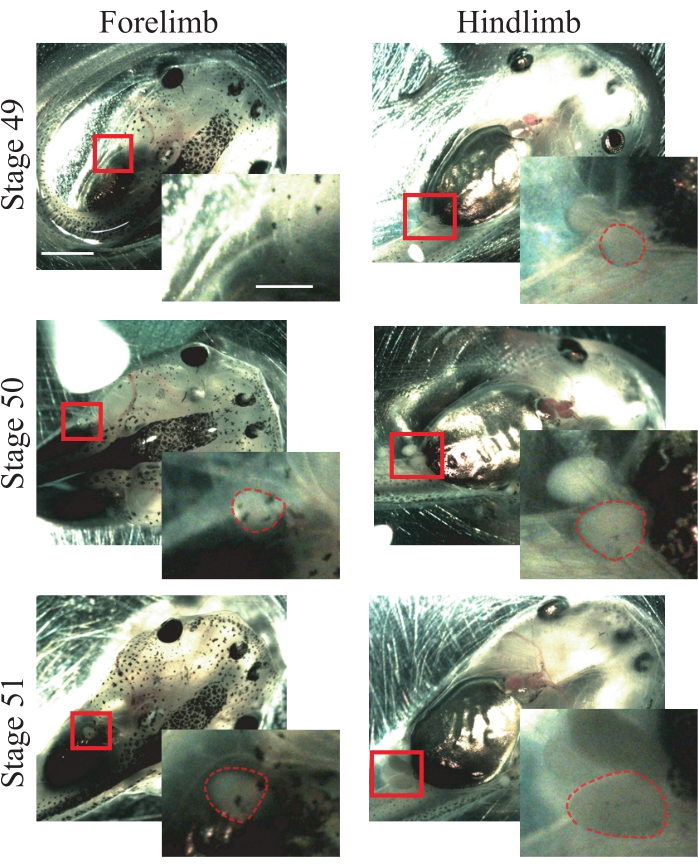
Figure 1 : Mise en scène du têtard Xenopus. Images représentatives des stades 49 à 51, montrant les membres antérieurs et postérieurs pour la référence de la stadification des animaux. Barres d’échelle = 2 mm. Les grossissements de la région encadrée sont affichés en bas à droite de chaque image. Barres d’échelle = 1 mm. Au stade 49, les membres antérieurs ne sont pas observés, tandis que les membres postérieurs apparaissent, montrant une forme sphérique. L’étape 50 présente des membres antérieurs qui viennent d’apparaître, montrant une forme sphérique et des membres postérieurs dépassant d’une forme sphérique. Au stade 51, les membres antérieurs présentent une forme sphérique saillante et les membres postérieurs une forme allongée saillante. Les contours en pointillés montrent les membres antérieurs et postérieurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
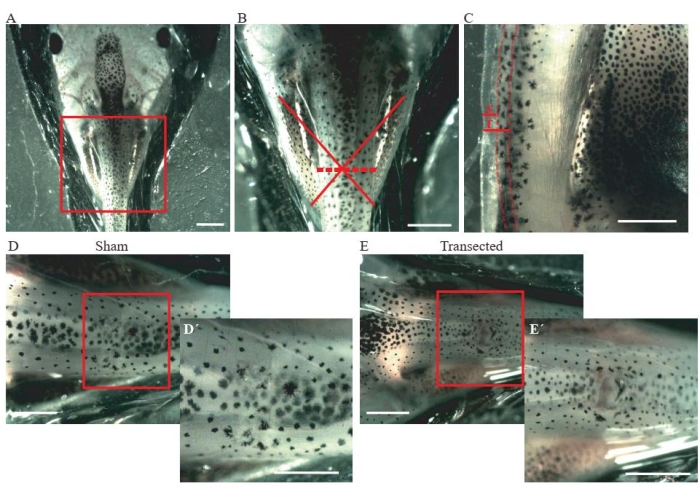
Figure 2 : Transsection de la moelle épinière. (A) Image représentative montrant le positionnement correct de l’animal, côté dorsal vers le haut, pour effectuer la chirurgie. Barre d’échelle = 2 mm. (B) Le grossissement de A indique l’emplacement et l’étendue de la blessure. La croix rouge indique l’emplacement exact du site de la blessure au niveau thoracique de la moelle épinière, et la ligne pointillée indique l’étendue de la blessure. Barre d’échelle = 1 mm. (C) Image représentative montrant une vue latérale du niveau thoracique de la moelle épinière. L’extension de l’incision simulée et la transsection sont montrées. Des lignes pointillées délimitent les limites de la moelle épinière. Barre d’échelle = 1 mm. (D) Image représentative montrant un animal factice avec une moelle épinière intacte. Barres d’échelle = 1 mm. (E) Image représentative montrant un animal transecté avec une moelle épinière interrompue. Barres d’échelle = 1 mm. Les grossissements de la région encadrée sont affichés en bas à droite de chaque image (D’et E'). Barres d’échelle = 1 mm. Abréviations: S = incision simulée; T = transsection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
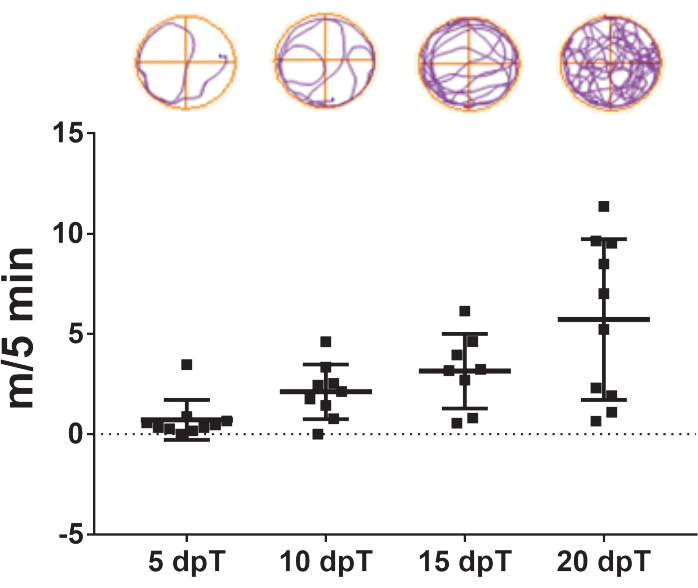
Figure 3 : Récupération de la fonction de natation au fil du temps. Diagramme à points représentatif de la distance de nage parcourue par les animaux transectés en 5 min à 5, 10, 15 et 20 jours après la transsection. Des échantillons de trajectoires de nage sont montrés en haut. Données présentées comme moyennes ± SEM de 10 têtards. Abréviations : dpT = jours après la transsection ; SEM = erreur-type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le protocole décrit ici est une excellente méthode pour effectuer une sci et évaluer la récupération fonctionnelle. Pour la reproductibilité, il est essentiel de cultiver des têtards en bonne santé et de choisir des animaux de taille similaire. Le manque d’alimentation adéquate génère un stress nutritif, ce qui entraîne de faibles capacités de régénération26; par conséquent, une attention particulière doit être accordée à l’alimentation des têtards. Lorsque les têtards atteignent le stade 50 après 3-4 semaines, ils peuvent être élevés à des températures plus élevées pour accélérer le processus de croissance, 18-25 °C étant optimal27. La qualité de l’eau est importante, car les animaux sont sensibles aux conditions de l’eau et aux produits chimiques. Les conditions optimales de l’eau comprennent l’utilisation d’eau filtrée au charbon sans chlore avec les paramètres suivants: pH (6,5-7,5), chlorure (<0,02 mg / L), conductivité de l’eau (1,0 mS / cm ± 0,1 unités), cuivre (<0,3 mg / L); dureté carbonatée (KH: 5-10 dKH); dureté générale (GH: 6-16 dGH); nitrate (NO3: <20 mg/L); et nitrite (NO2 : <0,1 mg/L)14,27,28. De plus, pour éviter toute contamination, les réservoirs en plastique doivent être nettoyés une fois par semaine pour l’élevage des animaux ou tous les deux jours après la chirurgie en les lavant soigneusement avec de l’eau sans chlorure et une éponge; le détergent doit être évité.
Pour un meilleur taux de survie après la chirurgie, les têtards ne doivent pas être exposés à l’anesthésie pendant de longues périodes (pas plus de 2 min). De plus, il est recommandé d’anesthésier un têtard à la fois. Comme les animaux ont besoin de rester hydratés, gardez les animaux immergés dans la solution tout le temps avant et après la chirurgie, et versez la solution avec une cuillère sur le têtard avant de commencer la chirurgie. Assurez-vous que les dommages sont suffisamment étendus pour couvrir toute la moelle épinière, mais pas trop, car ils peuvent induire une mauvaise récupération fonctionnelle ou la mort. Si la notochorde est endommagée, l’animal sera plié et la récupération fonctionnelle sera affectée. Si les dommages s’étendent au-delà de la notochorde, la probabilité de décès augmente14. Pendant le test de natation, l’enregistrement est considéré comme correct si le logiciel identifie chaque animal avec une ombre bleue; sinon, l’enregistrement doit être répété. Il est important d’éviter les mouvements et les changements d’air ou de lumière pendant le processus d’enregistrement pour éviter les erreurs d’enregistrement.
Il y a encore beaucoup de questions ouvertes sur les mécanismes cellulaires et moléculaires sous-jacents aux dommages et à la régénération de la moelle épinière. Le protocole décrit dans ce travail peut être utilisé pour étudier la contribution de différents événements cellulaires, de l’expression des gènes et des traitements sur la récupération fonctionnelle, déterminée en mesurant les capacités de nage. De plus, de nombreuses autres techniques peuvent être appliquées aux animaux opérés. La moelle épinière peut être isolée pour effectuer une extraction de protéines et/ou d’ARNm14 afin d’étudier les profils d’expression des protéines et des gènes après des dommages et un traitement19,20. Cette chirurgie a également servi de base à l’étude de la réponse cellulaire de la moelle épinière22 et du comportement des cellules progénitrices souches neurales12,13,22 après une lésion de la moelle épinière. Les cascades de signalisation impliquées dans la régénération de la moelle épinière ont également été étudiées à l’aide du paradigme des lésions de la moelle épinière décrit ici23. En résumé, le protocole décrit ici est un excellent modèle pour étudier les lésions de la moelle épinière et la régénération et a été utilisé pour de nombreuses études qui ont contribué aux connaissances existantes sur le sujet.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ces travaux ont été financés par des subventions de recherche de : PG Slater : FONDECYT N° 3190820 ; J. Larraín: FONDECYT N° 1180429, CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
matériels
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
Références
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon