Method Article
Rückenmarkstransektion bei Xenopus laevis Kaulquappen
In diesem Artikel
Zusammenfassung
Die Xenopus laevis Kaulquappen-Rückenmarkstransektion ist eine relevante Verletzungsmethode, um Rückenmarksverletzungen und -regeneration zu untersuchen, indem ein Querschnitt vorgenommen wird, der das Rückenmark auf Thoraxebene vollständig durchtrennt.
Zusammenfassung
Die Rückenmarksverletzung (SCI) ist ein dauerhaftes Leiden, das die motorischen und sensorischen Nerven des Zentralnervensystems (ZNS) betrifft und zu einer Lähmung unterhalb der Verletzungsstelle führt. Bis heute gibt es keine funktionelle Genesungstherapie für SCI, und es gibt einen Mangel an Klarheit über die vielen Komplexe und dynamischen Ereignisse, die nach der Rückenmarksverletzung auftreten. Viele Nicht-Säugetierorganismen können sich nach schwerer Rückenmarksverletzung regenerieren, wie Teleostfische, Urodele-Amphibien und Larvenstadien von Anuran-Amphibien, einschließlich Xenopus laevis Kaulquappen. Dies sind echte Modellorganismen, um die Reaktion auf SCI und die Mechanismen, die erfolgreichen regenerativen Prozessen zugrunde liegen, zu untersuchen und zu verstehen. Diese Art der Forschung kann zur Identifizierung potenzieller Ziele für die therapeutische Intervention von SCI führen. Dieser Artikel beschreibt, wie man Xenopus laevis Kaulquappen-Rückenmarkstransektion durchführt, einschließlich Haltung, Chirurgie, postoperative Pflege und funktionelle Testbewertung. Diese Verletzungsmethode kann zur Aufklärung der verschiedenen Schritte der Rückenmarksregeneration angewendet werden, indem die zellulären, molekularen und genetischen Mechanismen sowie die histologische und funktionelle Evolution nach SCI und während der Rückenmarksregeneration untersucht werden.
Einleitung
Rückenmarksverletzungen (SCI) sind ein Leiden, von dem jedes Jahr weltweit etwa 250.000 bis 500.000 Menschen betroffen sind1. Zusätzlich zu dieser hohen Prävalenz betrifft SCI sensorische und motorische Nerven, erzeugt Lähmungen unter der Verletzungsstelle und Trennung einiger innerer Organe von der Kontrolle des ZNS. Das Rückenmark, ein Teil des ZNS, kann sich nicht regenerieren, und aufgrund der Komplexität des Leidens und des fehlenden vollständigen Verständnisses aller beteiligten Prozesse gibt es immer noch keine effizienten Therapien, die eine funktionelle Genesung ermöglichen.
Nicht-Säugetierorganismen wie Teleostfische, Urodel-Amphibien und Larvenstadien von Anuran-Amphibien, die das Rückenmark nach schwerem SCI2,3,4 regenerieren können, sind ausgezeichnete Modellorganismen, um die Prozesse zu untersuchen, die ein erfolgreiches regeneratives Ereignis steuern und das Versagen der Regeneration von Säugetieren verstehen. Dieses Verständnis ist von großem Interesse, da es originelle Erkenntnisse liefern könnte, um neue therapeutische Ziele und mögliche Therapien für die Rückenmarksverletzung zu entwickeln.
Der Anuranfrosch, Xenopus laevis, ist ein ausgezeichneter Modellorganismus, um SCI zu studieren. Es verfügt über ausgezeichnete regenerative Fähigkeiten während der Kaulquappenstadien, die während der Metamorphose allmählich verloren gehen, was Experimente in den regenerativen und nichtregenerativen Stadien ermöglicht3,5. Die etablierte Verletzungsmethode zur Untersuchung der Rückenmarksverletzung bei Xenopus laevis-Kaulquappen besteht in der Schwanzamputation, bei der der gesamte Schwanz entfernt wird, einschließlich Gewebe wie Muskel, Notochord und Rückenmark6. Dieser Ansatz war maßgeblich am Verständnis der allgemeinen Mechanismen regenerativer Prozesse beteiligt4,7,8,9,10.
Da die Schwanzamputation neben dem Rückenmark mehrere Gewebe betrifft, was sich von dem unterscheidet, was nach menschlicher Rückenmarksverletzung geschieht, ist ein relevanteres Verletzungsparadigma für die Untersuchung von SCI erforderlich. Wir haben uns auf Studien gestützt, die in der Vergangenheit verwendet wurden11, um umfassende Beschreibungen von Verletzungsparadigmen zu erstellen5,12,13,14 und verschiedene Methoden für die Untersuchung von SCI12,13,14,15,16,17,18 . Nach der Rückenmarkstransektion kann der kaudale Teil des Rückenmarks für RNA- und Proteinexpression und Hochdurchsatzanalysen isoliert werden14,19,20,21. Darüber hinaus ermöglichen intrazerelomische Injektionen von Arzneimitteln und kleinen Molekülen sowie die Elektroporation von cDNA, RNA oder Morpholinos vor oder nach der Rückenmarkstransektion die Untersuchung der Auswirkungen dieser Moleküle bei der Prävention oder Behandlung von SCI oder von spezifischen Ereignissen, die nach SCI und Rückenmarksregeneration auftreten13,14 . Darüber hinaus können die Verletzungsentwicklung und die regenerativen Prozesse zu unterschiedlichen Zeitpunkten nach der Verletzung mit biochemischen, molekularen, histologischen und funktionellen Ansätzen untersucht werden12,13,14,17,19,20,21,22,23.
Schließlich können alle oben genannten Techniken in nicht-regenerativen Stadien verwendet werden, was einen der wichtigsten Vorteile der Verwendung von Xenopus laevis als Modellorganismus zur Untersuchung von SCI hervorhebt, die vergleichenden Studien von regenerativen und nicht-regenerativen Mechanismen bei derselben Spezies13,19,20,21,22. Dieser Artikel stellt ein Protokoll für die Xenopus laevis Kaulquappen-Rückenmarkstransektion vor, beginnend mit der Inszenierung und Auswahl von regenerativen Nieuwkoop- und Faber (NF) Stufe 50 Kaulquappen. Es folgt die Beschreibung der Verfahren für die Rückenmarkschirurgie zur Herstellung von Schein- und Transsekttieren, die postoperative Versorgung und schließlich die Analyse der funktionellen Erholung durch die Messung der freien Kaulquappenschwimmdistanz.
Protokoll
Dieses Protokoll liefert genügend Informationen, um eine Rückenmarkstransektion erfolgreich durchzuführen. Bemerkenswert ist, dass an anderer Stelle ausgezeichnete detaillierte Protokolle dieser Techniken veröffentlicht wurden14, die das hier vorgestellte ergänzen können. Alle Tierverfahren wurden vom Ausschuss für Bioethik und Biosicherheit der Fakultät für Biowissenschaften der Pontificia Universidad Católica de Chile genehmigt.
1. Natürliche Paarung der Frösche
- Drei bis fünf Tage vor der Paarung können männliche und weibliche Frösche subkutan mit 50 Einheiten humanem Choriongonadotropin (hCG) vorinjizieren. Verwenden Sie die "Eisenkralle" -Technik, um die Frösche zurückzuhalten; Da die Frösche rutschig sind, verwenden Sie bei Bedarf ein Netz, um den Frosch zu umgeben. Führen Sie die Spitze einer 26 G x 1/2" Nadel posterior in die seitliche Linie ein und drücken Sie sie dorsal bis zu einer Tiefe von 1 cm zwischen Haut und Muskel.
- Injizieren Sie vor der Paarung das Männchen mit 300 Einheiten und das Weibchen mit 700 Einheiten hCG.
- Damit die Paarung stattfinden kann, legen Sie das Männchen und das Weibchen unmittelbar nach dem Abkühlen der Lösung bei 4 ° C für 15 Minuten in 2 l 0,1x Barth-Lösung, um den Frühlingsbedingungen zu ähneln, und lassen Sie sie über Nacht bei 18 ° C liegen.
- Sechzehn Stunden später sammeln Sie die Embryonen vorsichtig mit Hilfe einer Pasteur-Pipette aus Kunststoff, wobei die Spitze abgeschnitten ist, und legen Sie sie in Petrischalen mit einem Durchmesser von 10 cm. Entfernen Sie den embryonalen Geleemantel, indem Sie die Embryonen mit 25 ml 2% Cystein in destilliertem Wasser (pH 7,8; stellen Sie sicher, dass die Lösung die Embryonen bedeckt) für 5 min mit leichter Erregung inkubieren. 3 mal mit destilliertem Wasser und 3 mal mit 0,1x Barthlösung (8,9 mM NaCl; 102 μM KCl; 238,1 μM NaHCO3; 1 mM 4-(2-hydroxyethyl)-1-piperazin ethansulfonsäure (HEPES); 81,14 μM MgSO4; 33,88 μM Ca(NO3)2; 40,81 μM CaCl2, pH 7,6).
- Wählen Sie gesunde Embryonen, die eine bräunliche Farbe haben und sich symmetrisch teilende Blastomere haben. Legen Sie die Embryonen in Petrischalen mit einem Durchmesser von 10 cm und 50 ml 0,1x Barthlösung bei einer Dichte von nicht mehr als 100 Embryonen pro Schale.
2. Haltung
- Während der ersten Woche halten Sie die Embryonen bei 18 ° C, bis sie aus dem Vitellinsack herauskommen. Wechseln Sie während dieser Zeit die Barth-Lösung jeden Tag und entfernen Sie weißliche tote Embryonen und Kaulquappen, die eine sichtbare anatomische Veränderung oder Kaulquappen ohne Schwimmbewegung aufweisen.
- Nach der ersten Woche Kaulquappen in chlorfreies Wasser in Kunststofftanks mit einer Dichte von 10 Tieren pro Liter überführen. Züchten Sie Kaulquappen bei 20-21 ° C mit einem 12-stündigen Hell- / 12-Stunden-Dunkelzyklus, wobei in jedem Tank Sauerstoffsteine vorhanden sind, um das Wasser zu belüften, und einmal täglich mit 0,5 mg pro Tier gefüttert werden. Ersetzen Sie einmal pro Woche Wasser und suchen Sie täglich nach angesammelten Abfällen und toten Tieren24.
3. Inszenierung
- Drei bis vier Wochen nach der Befruchtung die Tiere in eine Petrischale geben; Überprüfen Sie dann nacheinander die Morphologie und das Aussehen der Vorder- und Hinterbeine. Falls erforderlich, betäuben Sie die Tiere, indem Sie die Tiere in eine Petrischale mit 50 ml 0,02% Tricainmesylat in 0,1x Barthlösung zur besseren Manipulation geben. Nach nicht mehr als 2 min legen Sie die Tiere in 0,1x Barth-Lösung zur Erholung von der Narkose.
- Achten Sie auf die folgenden anatomischen Merkmale von Tieren im Stadium 5025: Vordergliedmaßen, die gerade erscheinen und kugelförmig sind (Abbildung 1); Hinterbeine, die hervorstehen und kugelförmig sind (Abbildung 1).
HINWEIS: Tiere der Stadien 49 bis 51 können für dieses Verfahren verwendet werden (Abbildung 1); Weitere Informationen zu den Etappen finden Sie in Nieuwkoop und Fabers Normaltabelle von Xenopus laevis25.
4. Chirurgie: Rückenmarkstransektion und scheinoperierte Tiere
- Anästhesieren Sie Kaulquappen im Stadium 50, indem Sie sie in eine Petrischale mit 50 ml 0,02% Tricainmesylat in 0,1x Barthlösung für 2 min geben.
- Legen Sie mit Hilfe eines Esslöffels und einer Pinzette die Kaulquappe, dorsale Seite nach oben, auf ein nasses Stück Gaze in der oberen Hälfte einer Glas-Petrischale.
- Führen Sie einen Schnitt der Haut und der Rückenmuskulatur im mittleren Thoraxbereich durch (Abbildung 2A, B) mit einer Mikrodissektionsfederschere.
- Stellen Sie bei Kontrollscheintieren sicher, dass die Schnittgröße nur ~ 0,2 mm beträgt (Abbildung 2C); das Rückenmark nicht schädigen (Abbildung 2D,D').
- Bei transsektierten Tieren führen Sie einen zweiten Schnitt von ~ 0,2 mm durch (Abbildung 2C), um das Rückenmark vollständig zu transektieren (Abbildung 2E, E').
5. Nachchirurgische Betreuung
- Nach der Operation die Kaulquappen in einen Tank mit 0,5 l 0,1x Barthlösung mit 1x Penicillin-Streptomycin mit einer Dichte von 10-12 Tieren pro Tank überführen. Pflegen Sie die transektierten und kontrollieren Sie Scheintiere in separaten Tanks.
HINWEIS: Kaulquappen erholen sich in ein paar Minuten von der Anästhesie. - Pflegen Sie die Kaulquappen mit Belüftung bei einer Temperatur von 20-21 ° C.
- Wechseln Sie die Barth-Lösung mit Antibiotika jeden zweiten Tag bis zum Ende des Experiments.
- Beginnen Sie mit der Fütterung der Tiere einen Tag nach der Operation, einmal täglich.
- Eliminiere tote Tiere.
6. Schwimm-Assay
- Erhalten Sie eine Box mit LED-Beleuchtung von innen, die mit einer transparenten Styroporplatte bedeckt ist, die das Licht durchlässt.
- Installieren Sie eine Kamera über der LED-Box.
- Legen Sie eine Petrischale mit einem Durchmesser von 15 cm auf die Schachtel, gefüllt mit 100 ml 0,1x Barth-Lösung.
- Legen Sie einen Tag nach der Transsektion eine Kaulquappe in die Petrischale und lassen Sie sie für eine 5-minütige Anpassungszeit gehen.
- Beginnen Sie nach der Anpassung 5 Minuten lang mit der Videoverfolgung des Freischwimmverhaltens mit der referenzierten Software (siehe Materialtabelle).
- Nachdem das Video abgeschlossen ist, übertragen Sie die Kaulquappe zurück in ihren Tank.
- Wiederholen Sie das Video-Tracking 5, 10, 15 und 20 Tage nach der Transsektion (Abbildung 3).
7. Bioethische Erwägungen
HINWEIS: Die Sterblichkeit von Tieren nach Scheinoperationen und Transsektion beträgt 13% bzw. 30%. Zusätzlich sind mindestens 15-20 Tiere pro Gruppe für die statistische Analyse erforderlich. Beginnen Sie daher mit 23 Schein- und 26 Transektieren.
- Anästhesieren Sie die Tiere mit 0,02% Tricainmesylat für 2 Minuten, um die Verringerung der neuronalen und motorischen Aktivität und der Schmerzen vor der Operation sicherzustellen.
- Überprüfen Sie nach der Operation die Tiere auf Erholung von der Anästhesie. Zusätzlich füttern und kontrollieren Sie die Tiere täglich.
- Nachdem Sie den Schwimmtest beendet haben, opfern Sie die Tiere mit einer Überdosis Tricainmesylat (1% Tricainmesylat, hergestellt in 30 mM Natriumbicarbonatlösung).
Ergebnisse
Das hierin beschriebene Protokoll ermöglicht die Untersuchung der Rückenmarksregeneration bei Xenopus laevis. Die Auswirkungen spezifischer pharmakologischer Behandlungen und der Beitrag der spezifischen Genexpression zur Regeneration des Rückenmarks können bewertet werden, indem ihre Auswirkungen auf die Erholung des Schwimmens gemessen werden. Die Gesamtschwimmstrecke wird gegen die Tage nach der Verletzung aufgetragen, um die Kontroll- und behandelten Tiere zu einem bestimmten Zeitpunkt oder über einen bestimmten Zeitraum zu vergleichen. Die Wiederherstellung der motorischen Funktion im Laufe der Zeit wird in Abbildung 3 veranschaulicht, die die Schwimmstrecke 5, 10, 15 und 20 Tage nach der Transsektion zeigt. 5 Tage nach der Transsektion schwammen die Tiere durchschnittlich 0,7 m in 5 min, was eine reduzierte Schwimmkapazität zeigte. Diese Kapazität nahm mit den vergangenen Tagen zu, da nach 10 bzw. 15 Tagen nach der Transsektion durchschnittlich 2,1 und 3,1 m/5 min beobachtet wurden und eine vollständige Erholung der Schwimmkapazitäten 20 Tage nach der Transsektion mit einem Durchschnitt von 5,7 m/5 min beobachtet wurde.
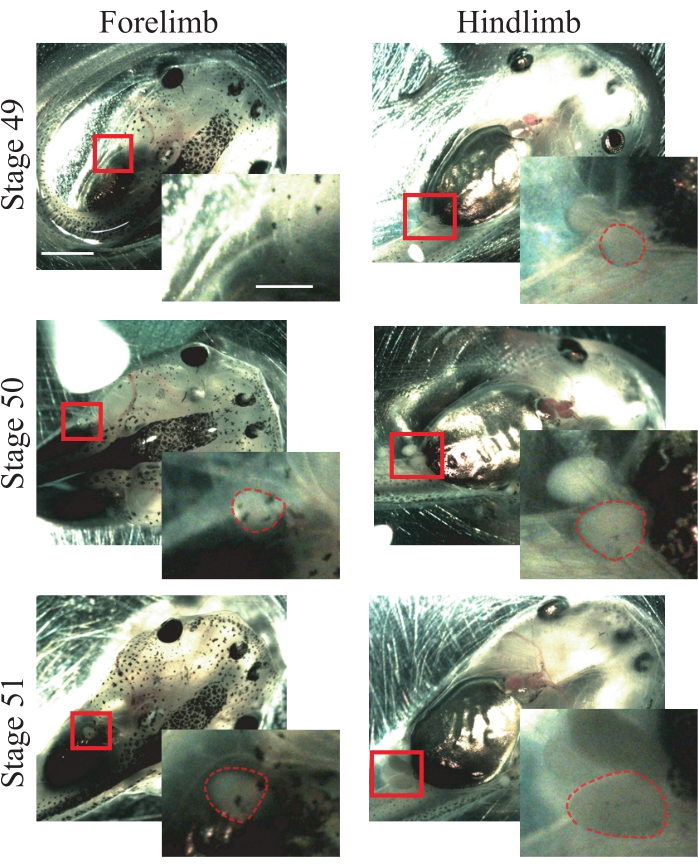
Abbildung 1: Xenopus-Kaulquappen-Inszenierung. Repräsentative Bilder der Stufen 49-51, die Vorder- und Hinterbeine als Tierinszenierung zeigen. Maßstabsstäbe = 2 mm. Vergrößerungen des Boxed-Bereichs werden unten rechts in jedem Bild angezeigt. Maßstabsstäbe = 1 mm. Im Stadium 49 werden die Vordergliedmaßen nicht beobachtet, während die Hinterbeine nur erscheinen und eine kugelförmige Form zeigen. Stufe 50 zeigt gerade erscheinende Vordergliedmaßen, die eine sphärische Form und Hinterbeine zeigen, die mit einer kugelförmigen Form hervorstehen. In Stufe 51 weisen die Vordergliedmaßen eine hervorstehende kugelförmige Form und die Hinterbeine eine hervorstehende längliche Form auf. Gestrichelte Umrisse zeigen Vorder- und Hinterbeine. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
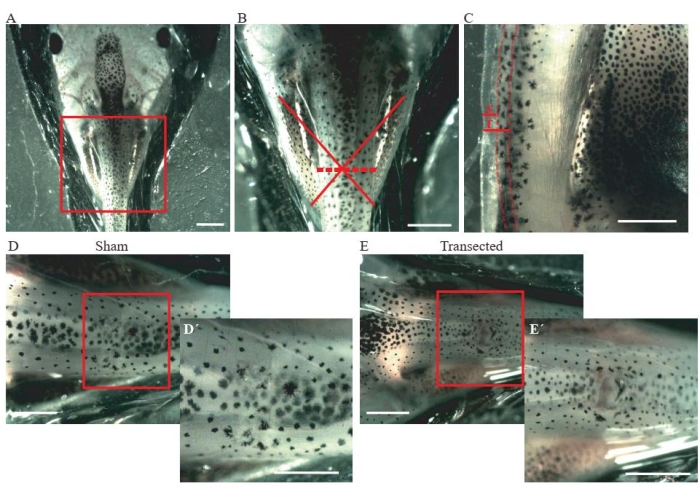
Abbildung 2: Querschnitt des Rückenmarks . (A) Repräsentatives Bild, das die korrekte Positionierung des Tieres, dorsale Seite nach oben, für die Durchführung der Operation zeigt. Maßstabsleiste = 2 mm. (B) Die Vergrößerung von A zeigt den Ort und das Ausmaß der Verletzung. Das rote Kreuz zeigt die genaue Lage der Verletzungsstelle auf der Brustebene des Rückenmarks, und die gestrichelte Linie zeigt das Ausmaß der Verletzung. Maßstabsleiste = 1 mm. (C) Repräsentatives Bild, das eine seitliche Ansicht der Thoraxebene des Rückenmarks zeigt. Die Ausdehnung der Scheininzision und der Transsektion werden gezeigt. Gestrichelte Linien beschreiben die Grenzen des Rückenmarks. Maßstabsleiste = 1 mm. (D) Repräsentatives Bild, das ein Scheintier mit einem intakten Rückenmark zeigt. Maßstabsstäbe = 1 mm. (E) Repräsentatives Bild, das ein transektiertes Tier mit einem unterbrochenen Rückenmark zeigt. Maßstabsstäbe = 1 mm. Vergrößerungen des geschachtelten Bereichs werden unten rechts in jedem Bild (D' und E') angezeigt. Maßstabsstäbe = 1 mm. Abkürzungen: S = Scheinschnitt; T = Transsektion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
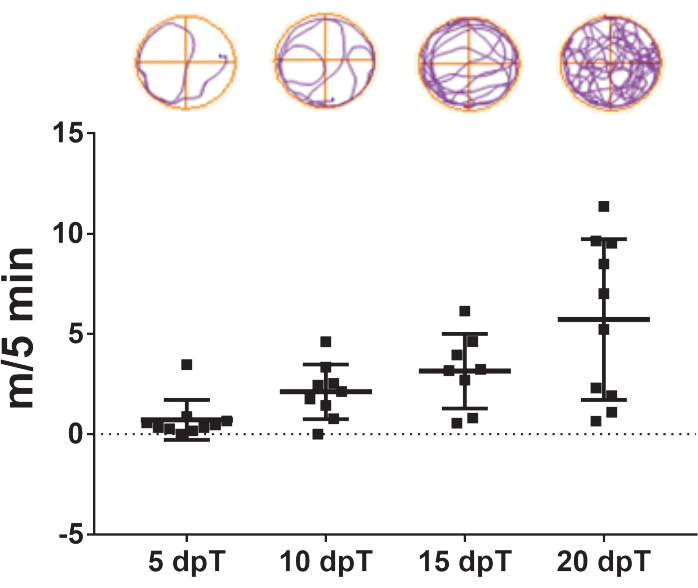
Abbildung 3: Erholung der Schwimmfunktion im Laufe der Zeit. Repräsentatives Punktdiagramm der von transsektierten Tieren zurückgelegten Schwimmstrecke in 5 Minuten bei 5, 10, 15 und 20 Tagen nach der Transsektion. Beispiele von Schwimmbahnen sind oben gezeigt. Daten, die als Mittelwert ± SEM von 10 Kaulquappen dargestellt werden. Abkürzungen: dpT = Tage nach der Transsektion; SEM = Standardfehler des Mittelwerts. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Das hierin beschriebene Protokoll ist eine ausgezeichnete Methode zur Durchführung von SCI und zur Bewertung der funktionellen Wiederherstellung. Für die Reproduzierbarkeit ist es wichtig, gesunde Kaulquappen zu züchten und Tiere zu wählen, die in ihrer Größe ähnlich groß sind. Der Mangel an richtiger Fütterung erzeugt Nährstoffstress, der zu schlechten Regenerationskapazitäten führt26; Daher sollte der Kaulquappenfütterung besondere Aufmerksamkeit geschenkt werden. Wenn Kaulquappen nach 3-4 Wochen Stadium 50 erreichen, können sie bei höheren Temperaturen aufgezogen werden, um den Wachstumsprozess zu beschleunigen, wobei 18-25 ° C optimal sind27. Die Wasserqualität ist wichtig, da Tiere empfindlich auf Wasserbedingungen und chemische Produkte reagieren. Zu den optimalen Wasserbedingungen gehört die Verwendung von kohlenstoffgefiltertem, chlorfreiem Wasser mit folgenden Parametern: pH-Wert (6,5-7,5), Chlorid (<0,02 mg / L), Leitfähigkeit von Wasser (1,0 mS / cm ± 0,1 Einheiten), Kupfer (<0,3 mg / L); Karbonathärte (KH: 5-10 dKH); allgemeine Härte (GH: 6-16 dGH); Nitrat (NO3: <20 mg/L); und Nitrit (NO2: <0,1 mg/L)14,27,28. Um eine Kontamination zu vermeiden, sollten Kunststofftanks einmal pro Woche für die Aufzucht von Tieren oder jeden zweiten Tag nach der Operation gereinigt werden, indem gründlich mit chloridfreiem Wasser und einem Schwamm gewaschen wird. Waschmittel müssen vermieden werden.
Für eine bessere Überlebensrate nach der Operation dürfen Kaulquappen nicht über einen längeren Zeitraum (nicht länger als 2 min) einer Anästhesie ausgesetzt werden. Darüber hinaus wird empfohlen, jeweils eine Kaulquappe zu betäuben. Da die Tiere hydratisiert bleiben müssen, halten Sie die Tiere vor und nach der Operation die ganze Zeit in Lösung und gießen Sie die Lösung mit einem Löffel auf die Kaulquappe, bevor Sie mit der Operation beginnen. Stellen Sie sicher, dass der Schaden umfangreich genug ist, um das gesamte Rückenmark zu bedecken, aber nicht zu umfangreich, da er zu einer schlechten funktionellen Genesung oder zum Tod führen kann. Wenn das Notochord beschädigt ist, wird das Tier gebogen und die funktionelle Genesung wird beeinträchtigt. Geht der Schaden über das Notochord hinaus, steigt die Wahrscheinlichkeit des Todes14. Während des Schwimmtests gilt die Aufzeichnung als korrekt, wenn die Software jedes Tier mit einem blauen Schatten identifiziert. Andernfalls sollte die Aufnahme wiederholt werden. Es ist wichtig, Bewegungen und Luft- oder Lichtveränderungen während des Aufnahmeprozesses zu vermeiden, um Aufnahmefehler zu vermeiden.
Es gibt immer noch viele offene Fragen zu den zellulären und molekularen Mechanismen, die der Schädigung und Regeneration des Rückenmarks zugrunde liegen. Das in dieser Arbeit beschriebene Protokoll kann verwendet werden, um den Beitrag verschiedener zellulärer Ereignisse, Genexpression und Behandlungen zur funktionellen Erholung zu untersuchen, die durch Messung der Schwimmkapazitäten bestimmt werden. Darüber hinaus können viele andere Techniken auf die operierten Tiere angewendet werden. Das Rückenmark kann isoliert werden, um eine Protein- und/oder mRNA-Extraktion14 durchzuführen, um Protein- und Genexpressionsprofile nach Schädigung und Behandlung zu untersuchen19,20. Diese Operation war auch die Grundlage für die Untersuchung der zellulären Reaktion des Rückenmarks22 und des Verhaltens von neuralen Stammvorläuferzellen12,13,22 nach einer Rückenmarksverletzung. Signalkaskaden, die an der Regeneration des Rückenmarks beteiligt sind, wurden ebenfalls unter Verwendung des hierin beschriebenen Paradigmas der Rückenmarksschädigung untersucht23. Zusammenfassend ist das hier beschriebene Protokoll ein hervorragendes Modell zur Untersuchung von Rückenmarksverletzungen und Regeneration und wurde für viele Studien verwendet, die zum vorhandenen Wissen über das Thema beigetragen haben.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Diese Arbeit wurde durch Forschungsstipendien finanziert von: PG Slater: FONDECYT N° 3190820; J. Larraín: FONDECYT N° 1180429, CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
Materialien
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
Referenzen
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten