Method Article
Xenopus laevis Kurbağa Yavruları'nda Omurilik Transeksiyonu
Bu Makalede
Özet
Xenopus laevis kurbağa yavrusu omurilik transeksiyonu, torasik seviyede omuriliği tamamen kesen enine bir kesim yaparak omurilik yaralanmasını ve rejenerasyonunu incelemek için ilgili bir yaralanma yöntemidir.
Özet
Omurilik yaralanması (SCI), merkezi sinir sistemi (CNS) motor ve duyusal sinirlerini etkileyen, yaralanma bölgesinin altında felce neden olan kalıcı bir hastalıktır. Bugüne kadar, SCI için fonksiyonel bir iyileşme tedavisi yoktur ve SCI sonrası meydana gelen birçok kompleks ve dinamik olay hakkında netlik eksikliği vardır. Memeli olmayan birçok organizma, teleost balıkları, ürodürol amfibileri ve Xenopus laevis kurbağa yavruları da dahil olmak üzere anuran amfibilerinin larva aşamaları gibi şiddetli SCI'den sonra yenilenebilir. Bunlar, SCI'ye verilen yanıtı ve başarılı rejeneratif süreçlerin altında yatan mekanizmaları incelemek ve anlamak için iyi niyetli model organizmalardır. Bu tür araştırmalar, SCI terapötik müdahalesi için potansiyel hedeflerin belirlenmesine yol açabilir. Bu makalede, hayvancılık, cerrahi, ameliyat sonrası bakım ve fonksiyonel test değerlendirmesi dahil olmak üzere Xenopus laevis kurbağa yavrusu omurilik transeksiyonunun nasıl yapılacağı açıklanmaktadır. Bu yaralanma yöntemi, hücresel, moleküler ve genetik mekanizmaların yanı sıra SCI sonrası ve omurilik rejenerasyonu sırasında histolojik ve fonksiyonel evrimin incelenmesiyle omurilik rejenerasyonunun farklı basamaklarını aydınlatmak için uygulanabilir.
Giriş
Omurilik yaralanması (SCI), her yıl dünya çapında yaklaşık 250.000-500.000 kişiyi etkileyen bir hastalıktır1. Bu yüksek prevalansa ek olarak, SCI duyusal ve motor sinirleri etkiler, yaralanma bölgesinin altında felç oluşturur ve bazı iç organların CNS'nin kontrolünden ayrılması. CNS'nin bir parçası olan omurilik yenilenemez ve rahatsızlığın karmaşıklığı ve ilgili tüm süreçlerin tam olarak anlaşılmaması nedeniyle, fonksiyonel iyileşmeye izin veren etkili tedaviler hala yoktur.
Teleost balıkları, ürol amfibileri ve şiddetli SCI2,3,4'ten sonra omuriliği yenileyebilen anuran amfibilerin larva aşamaları gibi memeli olmayan organizmalar, başarılı bir rejeneratif olayı yöneten süreçleri incelemek ve memeli rejenerasyonunun başarısızlığını anlamak için mükemmel model organizmalardır. Bu anlayış, SCI için yeni terapötik hedefler ve olası tedaviler geliştirmek için orijinal bilgiler sağlayabileceği için büyük ilgi çekicidir.
Anuran kurbağası, Xenopus laevis, SCI'yi incelemek için mükemmel bir model organizmadır. Metamorfoz sırasında aşamalı olarak kaybolan kurbağa yavrusu aşamalarında mükemmel rejeneratif kapasitelere sahiptir ve rejeneratif ve rejeneratif olmayan aşamalarda deneylere izin verir3,5. Xenopus laevis kurbağa yavrularında SCI'yi incelemek için kurulan yaralanma yöntemi, kas, notokord ve omurilik gibi dokular da dahil olmak üzere tüm kuyruğun çıkarıldığı kuyruk amputasyonundan oluşur6. Bu yaklaşım, rejeneratif süreçlerin genel mekanizmalarının anlaşılmasında etkili olmuştur4,7,8,9,10.
Kuyruk amputasyonu, insan SCI'sinden sonra olanlardan farklı olan omuriliğe ek olarak çoklu dokuları içerdiğinden, SCI çalışması için daha alakalı bir yaralanma paradigmasına ihtiyaç vardır. Geçmişte yaralanma paradigmalarının5,12,13,14 kapsamlı tanımlarını oluşturmak için kullanılan çalışmalara11 ve SCI12,13,14,15,16,17,18 çalışması için farklı yöntemlere güvendik. . Omurilik transeksiyonundan sonra, omuriliğin kaudal kısmı RNA ve protein ekspresyonu ve yüksek verimli analizler için izole edilebilir14,19,20,21. Ek olarak, ilaçların ve küçük moleküllerin intrasemik enjeksiyonlarının yanı sıra omurilik transeksiyonundan önce veya sonra cDNA, RNA veya morfolinoların elektroporasyonu, bu moleküllerin SCI'nin önlenmesinde veya tedavisinde veya SCI ve omurilik rejenerasyonundan sonra meydana gelen spesifik olayların etkilerinin incelenmesine izin verir13,14 . Ayrıca, yaralanma evrimi ve rejeneratif süreçler, biyokimyasal, moleküler, histolojik ve fonksiyonel yaklaşımlar kullanılarak yaralanma sonrası farklı zamanlamalarda incelenebilir12,13,14,17,19,20,21,22,23.
Son olarak, yukarıda belirtilen tüm teknikler rejeneratif olmayan aşamalarda kullanılabilir ve Xenopus laevis'i SCI'yi incelemek için model bir organizma olarak kullanmanın en önemli avantajlarından birini, aynı türdeki rejeneratif ve rejeneratif olmayan mekanizmaların karşılaştırmalı çalışmalarını13,19,20,21,22 vurgulamaktadır. Bu yazıda Xenopus laevis kurbağa yavrusu omurilik transeksiyonu için rejeneratif Nieuwkoop ve Faber (NF) evre 50 kurbağa yavrularının evrelemesi ve seçimi ile başlayan bir protokol sunulmaktadır. Bunu, sahte ve transekte hayvanlar üretmek için omurilik cerrahisi prosedürlerinin tanımı, ameliyat sonrası bakım ve son olarak serbest kurbağa yavrusu yüzme mesafesinin ölçülmesiyle fonksiyonel iyileşmenin analizi izler.
Protokol
Bu protokol, omurilik transeksiyonunu başarılı bir şekilde gerçekleştirmek için yeterli bilgi sağlar. Not olarak, bu tekniklerin başka bir yerde yayınlanmış mükemmel ayrıntılı protokolleri vardır14, bu da burada sunulanı tamamlayabilir. Tüm hayvan prosedürleri, Pontificia Universidad Católica de Chile, Biyolojik Bilimler Fakültesi'nden Biyoetik ve Biyogüvenlik Komitesi tarafından onaylanmıştır.
1. Kurbağaların doğal çiftleşmesi
- Çiftleşmeden üç ila beş gün önce, deri altından erkek ve dişi kurbağalara 50 ünite insan koryonik gonadotropin (hCG) enjekte edin. Kurbağaları kısıtlamak için "demir pençe" tekniğini kullanın; kurbağalar kaygan olduğundan, gerekirse kurbağayı çevrelemek için bir ağ kullanın. 26 G x 1/2" iğnenin ucunu lateral çizginin arkasına yerleştirin ve dorsal olarak cilt ve kas arasında 1 cm derinliğe itin.
- Çiftleşmeden önce, erkeğe 300 ünite ve dişi 700 birim hCG enjekte edin.
- Çiftleşmenin gerçekleşmesi için, erkek ve dişiyi, bahar koşullarına benzemek için çözeltiyi 4 ° C'de 15 dakika boyunca soğuttuktan hemen sonra 2 L 0.1x Barth çözeltisine yerleştirin ve gece boyunca 18 ° C'de bırakın.
- On altı saat sonra, embriyoları plastik bir Pasteur pipeti yardımıyla, ucu kesilmiş olarak dikkatlice toplayın ve 10 cm çapında Petri kaplarına yerleştirin. Embriyoları damıtılmış suda (pH 7.8; çözeltinin embriyoları kapsadığından emin olun) 25 mL% 2 sistein ile hafif ajitasyonla 5 dakika boyunca inkübe ederek embriyonik jöle kabuğunu çıkarın. 3 kez damıtılmış su ile ve 3 kez 0.1x Barth çözeltisi ile yıkayın (8.9 mM NaCl; 102 μM KCl; 238.1 μM NaHCO3; 1 mM 4-(2- hidroksietil)-1-piperazin etansülfonik asit (HEPES); 81.14 μM MgSO4; 33.88 μM Ca(NO3)2; 40.81 μM CaCl2, pH 7.6).
- Kahverengimsi bir renge sahip ve blastomerleri simetrik olarak bölen sağlıklı embriyoları seçin. Embriyoları, 10 cm çapında Petri kaplarına, 50 mL 0.1x Barth çözeltisi ile, çanak başına en fazla 100 embriyo yoğunluğunda yerleştirin.
2. Hayvancılık
- İlk hafta boyunca, embriyoları vitelin kesesinden çıkana kadar 18 ° C'de tutun. Bu süre zarfında, Barth çözeltisini her gün değiştirin ve görünür bir anatomik değişiklik gösteren beyazımsı ölü embriyoları ve kurbağa yavrularını veya herhangi bir yüzme hareketi olmadan kurbağa yavrularını çıkarın.
- İlk haftadan sonra, kurbağa yavrularını plastik tanklarda litre başına 10 hayvan yoğunluğunda klorsuz suya aktarın. Kurbağa yavrularını 20-21 ° C'de 12 saatlik ışık / 12 saatlik karanlık döngü ile büyütün, suyu havalandırmak için her tankta oksijen taşları bulunur ve hayvan başına 0,5 mg ile günde bir kez beslenir. Suyu haftada bir kez değiştirin ve biriken atık ve ölü hayvanları günlük olarak kontrol edin24.
3. Evreleme
- Döllenmeden üç ila dört hafta sonra, hayvanları bir Petri kabına yerleştirin; Daha sonra, tek tek, ön ayakların ve arka bacakların morfolojisini ve görünümünü kontrol edin. Gerekirse, daha iyi manipülasyon için hayvanları 0.1x Barth çözeltisinde 50 mL% 0.02 trikain mesilat içeren bir Petri kabına yerleştirerek hayvanları anestezi altına alın. En fazla 2 dakika sonra, anesteziden kurtulmak için hayvanları 0.1x Barth çözeltisine yerleştirin.
- Evre 50 hayvanlarının aşağıdaki anatomik özelliklerini arayın25: yeni ortaya çıkan ve küresel olan ön ayaklar (Şekil 1); çıkıntılı ve küresel olan arka bacaklar (Şekil 1).
NOT: Bu prosedür için 49 ila 51 aşamaları arasındaki hayvanlar kullanılabilir (Şekil 1); aşamalar hakkında daha fazla bilgi için Nieuwkoop ve Faber'in Xenopus laevis25'in Normal Tablosuna bakın.
4. Cerrahi: omurilik transeksiyonu ve sahte ameliyat edilen hayvanlar
- Aşama 50 kurbağa yavrularını, 2 dakika boyunca 0.1x Barth çözeltisinde 50 mL% 0.02 trikain mesilat içeren bir Petri kabına yerleştirerek anestezi yapın.
- Bir çorba kaşığı ve forseps yardımıyla, kurbağa yavrusunu, sırt tarafını, bir cam Petri kabının üst yarısında ıslak bir gazlı bez parçası üzerine yerleştirin.
- Mikrodiseksiyon yay makası kullanarak orta torasik seviyede cilt ve dorsal kasların bir kesisini yapın (Şekil 2A, B).
- Kontrol sahte hayvanları için, kesi boyutunun sadece ~ 0,2 mm olduğundan emin olun (Şekil 2C); omuriliğe zarar vermeyin (Şekil 2D,D').
- Transekte hayvanlar için, omuriliği tamamen transekte etmek için ~ 0.2 mm'lik ikinci bir kesi yapın (Şekil 2C) (Şekil 2E, E').
5. Ameliyat sonrası bakım
- Ameliyattan sonra, kurbağa yavrularını, tank başına 10-12 hayvan yoğunluğunda, 1x Penisilin-streptomisin içeren 0.5 L 0.1x Barth çözeltisi içeren bir tanka aktarın. Transekte edilmiş hayvanları ayrı tanklarda tutun ve kontrol edin.
NOT: Kurbağa yavruları anesteziden birkaç dakika içinde iyileşir. - Kurbağa yavrularını havalandırma ile 20-21 ° C sıcaklıkta tutun.
- Barth çözeltisini, deneyin sonuna kadar her gün antibiyotiklerle değiştirin.
- Hayvanları ameliyattan bir gün sonra, günde bir kez beslemeye başlayın.
- Ölü hayvanları ortadan kaldırın.
6. Yüzme testi
- Işığın geçmesine izin veren şeffaf bir polistiren levha ile kaplı, içeriden LED aydınlatmalı bir kutu elde edin.
- LED kutusunun üzerine bir kamera takın.
- Kutunun üzerine, 100 mL 0.1x Barth çözeltisi ile doldurulmuş 15 cm çapında bir Petri kabı yerleştirin.
- Transeksiyondan bir gün sonra, Petri kabına bir kurbağa yavrusu yerleştirin ve 5 dakikalık bir adaptasyon süresi için bırakın.
- Uyarlamadan sonra, referans verilen yazılımı kullanarak serbest yüzme davranışını video izlemeye başlayın ( Malzeme Tablosuna bakın) 5 dakika boyunca.
- Video tamamlandıktan sonra, kurbağa yavrusunu tankına geri aktarın.
- Video izlemeyi transeksiyondan 5, 10, 15 ve 20 gün sonra tekrarlayın (Şekil 3).
7. Biyoetik hususlar
NOT: Sahte cerrahi ve transeksiyon sonrası hayvanların mortalitesi sırasıyla% 13 ve% 30'dur. Ek olarak, istatistiksel analiz için grup başına en az 15-20 hayvan gereklidir. Bu nedenle, 23 sahte ve 26 transekte hayvanla başlayın.
- Ameliyat öncesi nöronal ve motor aktivitede ve ağrıda azalma sağlamak için hayvanları 2 dakika boyunca% 0.02 trikain mesilat ile anestezi yapın.
- Ameliyattan sonra, anesteziden kurtulmak için hayvanları kontrol edin. Ek olarak, hayvanları günlük olarak besleyin ve kontrol edin.
- Yüzme testini bitirdikten sonra, hayvanları aşırı dozda trikain mesilatı (30 mM sodyum bikarbonat çözeltisinde hazırlanan% 1 trikain mesilat) ile kurban edin.
Sonuçlar
Burada açıklanan protokol, Xenopus laevis'te omurilik rejenerasyonunun incelenmesine izin verir. Spesifik farmakolojik tedavilerin etkileri ve spesifik gen ekspresyonunun omurilik rejenerasyonuna katkısı, yüzme iyileşmesi üzerindeki etkileri ölçülerek değerlendirilebilir. Toplam yüzme mesafesi, belirli bir zaman noktasında veya belirli bir süre boyunca kontrol ve tedavi edilen hayvanları karşılaştırmak için yaralanmadan sonraki günlere göre çizilir. Motor fonksiyonun zaman içinde geri kazanılması, transeksiyondan sonraki 5, 10, 15 ve 20 günlük yüzme mesafesini gösteren Şekil 3'te örneklendirilmiştir. Transeksiyondan sonraki 5 günde, hayvanlar 5 dakikada ortalama 0,7 m yüzdüler ve bu da yüzme kapasitesinin azaldığını gösterdi. Bu kapasite geçen günlerle birlikte artmış, çünkü transeksiyondan sonraki 10 ve 15 gün sonra sırasıyla ortalama 2.1 ve 3.1 m/5 dk gözlenmiş, transeksiyondan sonraki 20 günde ortalama 5.7 m/5 dakika ile yüzme kapasitelerinin tamamen geri kazanımı gözlenmiştir.
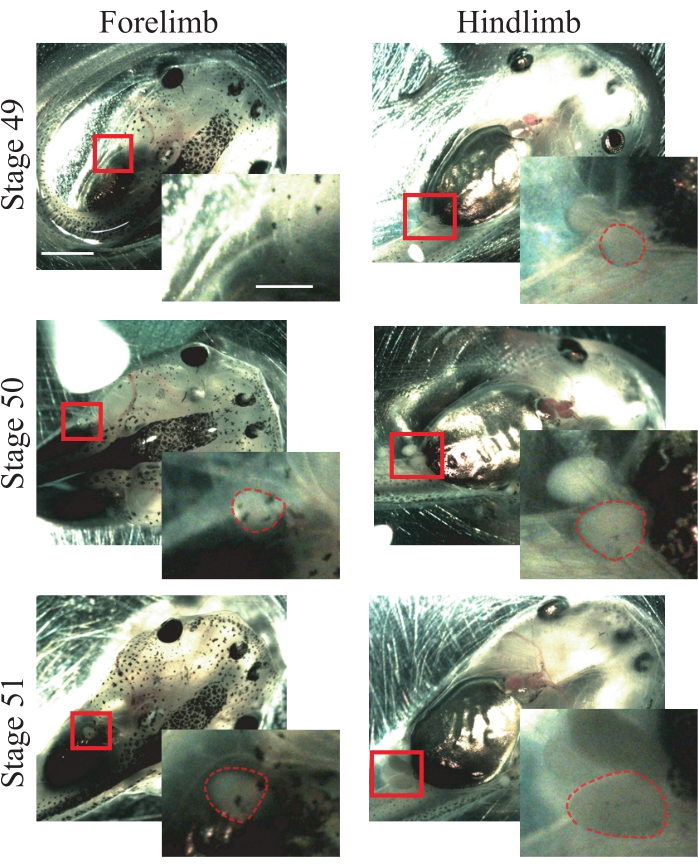
Resim 1: Xenopus kurbağa yavrusu evrelemesi. 49-51 aşamalarının temsili görüntüleri, hayvan evreleme referansı için ön ve arka bacakları gösterir. Ölçek çubukları = 2 mm. Kutulu bölgenin büyütmeleri her görüntünün sağ alt köşesinde gösterilir. Ölçek çubukları = 1 mm. 49. aşamada, ön ayaklar gözlenmezken, arka bacaklarda sadece küresel bir şekil göstererek ortaya çıkar. Aşama 50, yeni ortaya çıkan, küresel bir şekil gösteren ön ayakları ve küresel bir şekille çıkıntı yapan arka bacakları sunar. Aşama 51'de, ön ayaklar çıkıntılı bir küresel şekil sunar ve arka bacaklarda çıkıntılı uzun bir şekil bulunur. Kesikli anahatlar ön ve arka bacakları gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
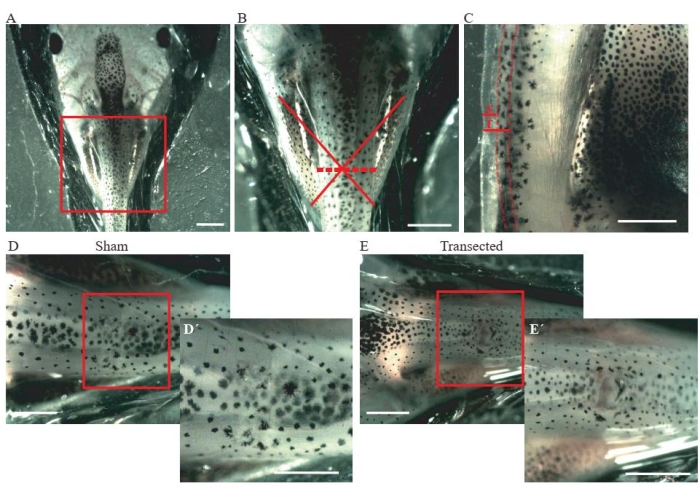
Şekil 2: Omurilik transeksiyonu . (A) Ameliyatı gerçekleştirmek için hayvanın dorsal tarafı yukarı doğru konumlandırıldığını gösteren temsili görüntü. Ölçek çubuğu = 2 mm. (B) A'nın büyütülmesi, yaralanmanın yerini ve derecesini gösterir. Kırmızı haç, omuriliğin torasik seviyesindeki yaralanma bölgesinin tam yerini gösterir ve kesikli çizgi yaralanmanın derecesini gösterir. Ölçek çubuğu = 1 mm. (C) Omuriliğin torasik seviyesinin yanal görünümünü gösteren temsili görüntü. Sahte insizyonun uzatılması ve transeksiyonu gösterilmiştir. Kesikli çizgiler omuriliğin sınırlarını belirler. Ölçek çubuğu = 1 mm. (D) Sağlam omuriliği olan sahte bir hayvanı gösteren temsili resim. Ölçek çubukları = 1 mm. (E) Omuriliği kesilmiş transekte bir hayvanı gösteren temsili görüntü. Ölçek çubukları = 1 mm. Kutulu bölgenin büyütmeleri her görüntünün sağ alt köşesinde gösterilir (D' ve E'). Ölçek çubukları = 1 mm. Kısaltmalar: S = sahte insizyon; T = transeksiyon. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
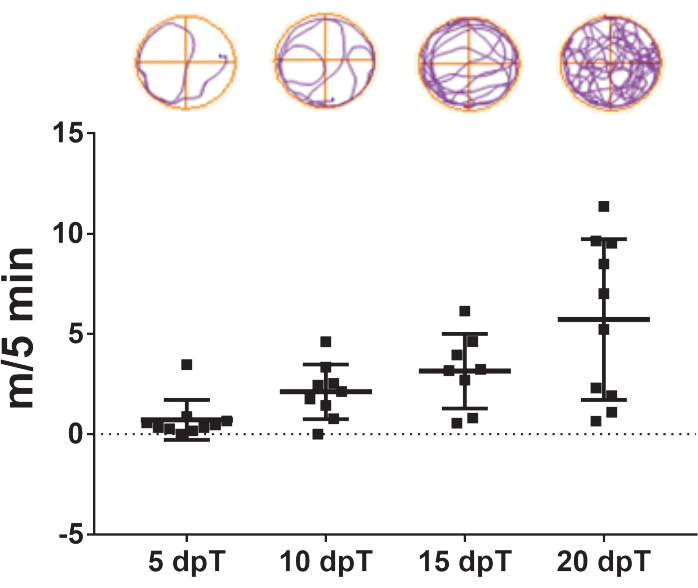
Şekil 3: Zamanla yüzme fonksiyonunun iyileşmesi. Transeksiyondan sonraki 5, 10, 15 ve 20 gün içinde transekte hayvanların kapladığı yüzme mesafesinin temsili nokta grafiği. Yüzme yörüngelerinin örnekleri üstte gösterilmiştir. Veriler, 10 kurbağa yavrusundan ortalama ± SEM olarak sunulmuştur. Kısaltmalar: dpT = transeksiyon sonrası gün; SEM = ortalamanın standart hatası. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan protokol, SCI gerçekleştirmek ve fonksiyonel iyileşmeyi değerlendirmek için mükemmel bir yöntemdir. Tekrarlanabilirlik için, sağlıklı kurbağa yavruları yetiştirmek ve benzer büyüklükteki hayvanları seçmek önemlidir. Doğru beslenme eksikliği, zayıf rejeneratif kapasitelere neden olan besin stresine neden olur26; bu nedenle, kurbağa yavrusu beslenmesine özel dikkat gösterilmelidir. Kurbağa yavruları 3-4 hafta sonra 50. aşamaya ulaştıkça, büyüme sürecini hızlandırmak için daha yüksek sıcaklıklarda yetiştirilebilirler, 18-25 ° C optimaldir27. Hayvanlar su koşullarına ve kimyasal ürünlere duyarlı oldukları için su kalitesi önemlidir. En uygun su koşulları, aşağıdaki parametrelerle karbon filtreli, klorsuz su kullanımını içerir: pH (6.5-7.5), klorür (<0.02 mg / L), suyun iletkenliği (1.0 mS / cm ± 0.1 ünite), bakır (<0.3 mg / L); karbonat sertliği (KH: 5-10 dKH); genel sertlik (GH: 6-16 dGH); nitrat (NO3: <20 mg/L); ve nitrit (NO2: <0.1 mg / L)14,27,28. Ek olarak, kontaminasyonu önlemek için, plastik tanklar hayvan yetiştirmek için haftada bir kez veya ameliyattan sonra her gün klorür içermeyen su ve süngerle iyice yıkanarak temizlenmelidir; deterjandan kaçınılmalıdır.
Ameliyattan sonra daha iyi bir hayatta kalma oranı için, kurbağa yavruları uzun süre anesteziye maruz bırakılmamalıdır (en fazla 2 dakika). Ayrıca, bir seferde bir kurbağa yavrusu anestezi yapılması önerilir. Hayvanların sulu kalması gerektiğinden, hayvanları ameliyattan önce ve sonra her zaman çözeltiye batırılmış halde tutun ve ameliyata başlamadan önce çözeltiyi kurbağa yavrusunun üzerine bir kaşıkla dökün. Hasarın tüm omuriliği kaplayacak kadar geniş olduğundan, ancak zayıf fonksiyonel iyileşmeye veya ölüme neden olabileceğinden çok geniş olmadığından emin olun. Notokord hasar görürse, hayvan bükülür ve fonksiyonel iyileşme etkilenir. Hasar notokordun ötesine uzanırsa, ölüm olasılığı artar14. Yüzme testi sırasında, yazılım her hayvanı mavi bir gölgeyle tanımlarsa kayıt doğru kabul edilir; aksi takdirde, kayıt tekrarlanmalıdır. Kayıt hatalarını önlemek için kayıt işlemi sırasında hareketten ve hava veya ışık değişimlerinden kaçınmak önemlidir.
Omurilik hasarı ve rejenerasyonunun altında yatan hücresel ve moleküler mekanizmalar hakkında hala birçok açık soru var. Bu çalışmada açıklanan protokol, farklı hücresel olayların, gen ekspresyonunun ve tedavilerin yüzme kapasitelerinin ölçülmesiyle belirlenen fonksiyonel iyileşme üzerindeki katkısını incelemek için kullanılabilir. Ek olarak, ameliyat edilen hayvanlara birçok başka teknik uygulanabilir. Omurilik, hasar ve tedaviden sonra protein ve gen ekspresyon profillerini incelemek için protein ve/veya mRNA ekstraksiyonu14 gerçekleştirmek üzere izole edilebilir19,20. Bu ameliyat aynı zamanda omurilik yaralanmasından sonra omurilik hücresel yanıtını22 ve nöral kök progenitör hücrelerinin12,13,22 davranışını incelemek için temel oluşturmuştur. Omurilik rejenerasyonunda rol oynayan sinyal kaskadları da burada açıklanan omurilik hasarı paradigması kullanılarak incelenmiştir23. Özetle, burada açıklanan protokol, omurilik yaralanması ve rejenerasyonunu incelemek için mükemmel bir modeldir ve konuyla ilgili mevcut bilgilere katkıda bulunan birçok çalışma için kullanılmıştır.
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma şu kaynaklardan araştırma hibeleri ile finanse edilmiştir: PG Slater: FONDECYT N° 3190820; J. Larraín: FONDECYT N° 1180429, CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
Referanslar
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır