A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أجهزة تعتمد على الزجاج لتوليد القطرات والمستحلبات
In This Article
Summary
هنا ، يتم تقديم بروتوكول لتصنيع أجهزة الموائع الدقيقة القائمة على الزجاج المستخدمة لتوليد مستحلبات أحادية التشتت عالية مع حجم قطرة يتم التحكم فيه.
Abstract
في هذه المخطوطة، يتم وصف ثلاثة بروتوكولات مختلفة خطوة بخطوة لتوليد قطرات مستحلب أحادية التشتت للغاية باستخدام الموائع الدقيقة القائمة على الزجاج. تم تصميم الجهاز الأول لتوليد قطرات بسيطة مدفوعة بالجاذبية. تم تصميم الجهاز الثاني لتوليد قطرات مستحلب في مخطط متدفق. الجهاز الثالث هو امتداد لجهاز التدفق المشترك مع إضافة سائل ثالث يعمل كأرضية كهربائية ، مما يسمح بتكوين قطرات مكهربة يتم تفريغها لاحقا. في هذا الإعداد ، يتمتع اثنان من السوائل الثلاثة بتوصيل كهربائي ملحوظ. السائل الثالث يتوسط بين هذين الاثنين وهو عازل كهربائي. يخلق فرق الجهد المطبق بين السائلين الموصلين مجالا كهربائيا يقترن بالإجهادات الهيدروديناميكية للسوائل المتدفقة ، مما يؤثر على عملية تكوين الطائرة والسقوط. توفر إضافة المجال الكهربائي مسارا لتوليد قطرات أصغر مما كانت عليه في أجهزة التدفق المشترك البسيطة ولتوليد الجسيمات والألياف مع مجموعة واسعة من الأحجام.
Introduction
يعد التوليد المتحكم فيه للقطرات في الميكرون ومقياس النانو مع توزيع ضيق الحجم مهمة صعبة. هذه القطرات ذات أهمية لهندسة المواد اللينة مع العديد من التطبيقات في العلوم والتكنولوجيا1،2،3،4،5،6.
الأجهزة الأكثر شيوعا لارتفاع معدل إنتاج القطرات هي الخلاطات7 ومستحلبات الموجات فوق الصوتية8. هذه الطرق بسيطة ومنخفضة التكلفة ، ولكنها عادة ما تؤدي إلى قطرات متعددة التشتت مع مجموعة واسعة من الأحجام. وبالتالي ، هناك حاجة إلى خطوات إضافية لإنتاج عينات أحادية التشتت. يمكن تصميم أجهزة الموائع الدقيقة بشكل مختلف لتوفير طريقة فعالة لإسقاط التكوين. بالإضافة إلى ذلك ، فإن معدلات التدفق المنخفضة عادة (أي انخفاض عدد رينولدز) تسمح بتحكم كبير في تدفق السوائل.
في حين أن أجهزة الموائع الدقيقة تصنع عادة باستخدام تقنيات الطباعة الحجرية مع سيلوكسان البولي (ثنائي ميثيل) (PDMS) ، تركز هذه المخطوطة على الأجهزة الشعرية القائمة على الزجاج. عادة ما يتم اختيار أجهزة PDMS لقدرتها على تصميم أنماط القنوات المعقدة وبسبب قابليتها للتوسع. على العكس من ذلك ، فإن الأجهزة الزجاجية صلبة ولديها مقاومة أكبر للمذيبات من نظيراتها PDMS. بالإضافة إلى ذلك ، يمكن تعديل الزجاج لتغيير قابليته للبلل ، مما يسمح بالتحكم في توليد المستحلبات المعقدة. إن القدرة على معالجة جدران الفوهة والقناة بشكل مستقل تمكن من تكوين قطرات بطريقة خاضعة للرقابة وقابلة للتكرار ، مع ضمان استقرار المستحلبات الناتجة إذا كانت القطرات ستلمس الجدران9 ؛ وإلا فإن القطرات قد تتجمع وتتراكم على الحائط. فرق آخر بين هذين النوعين من الأجهزة هو أنه في الأجهزة القائمة على الزجاج ، يكون التدفق ثلاثي الأبعاد ، بينما يكون مستويا في أجهزة PDMS التقليدية. هذه الحقيقة تقلل من ملامسة السقوط مع جدران القناة بحيث يمكن إهمال تأثير خطوط التلامس10 ، وبالتالي حماية استقرار قطرات المستحلب المتعددة.
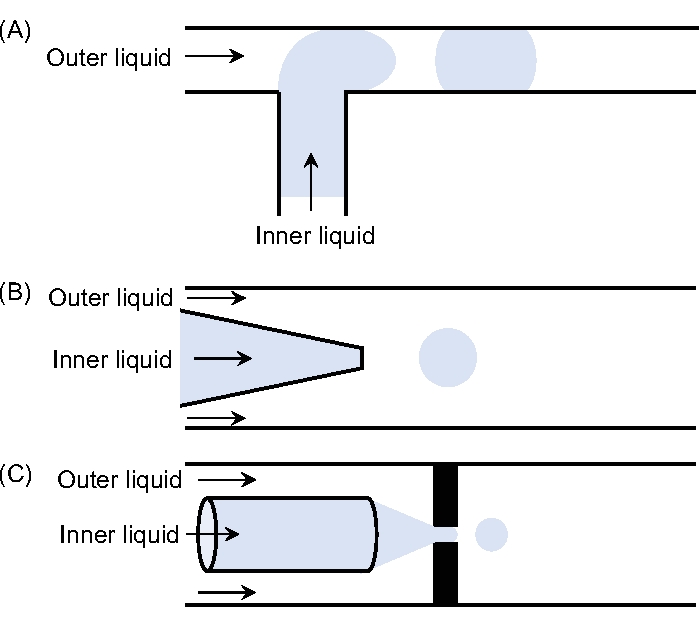
الشكل 1: تكوينات مختلفة لأجهزة الموائع الدقيقة. رسومات تخطيطية ل (A) تقاطع T ، (B) جهاز تدفق مشترك ، و (C) جهاز تركيز التدفق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
هناك ثلاث هندسات رئيسية مستخدمة ، وهي T-junction11 ، وتركيز التدفق 12,13 ، و coflow14. في هندسة تقاطع T ، تتقاطع المرحلة المشتتة الموجودة في القناة بشكل عمودي مع القناة الرئيسية التي تضم الطور المستمر. يكسر إجهاد القص الذي تمارسه المرحلة المستمرة السائل المشتت الوارد مما يؤدي إلى انخفاضات. القطرات المتولدة محدودة في حجم أقل بأبعاد القناة الرئيسية11. في هندسة التركيز على التدفق ، يتم إجبار السائلين من خلال فتحة صغيرة تقع أمام أنبوب الحقن. والنتيجة هي تشكيل طائرة ، وهي أصغر بكثير من أنبوب الحقن12,13. أخيرا ، تحتوي هندسة التدفق المشترك على تكوين يتميز بالتدفق المحوري لسائلين غير قابلين للامتزاج14. بشكل عام ، يمكن ملاحظة التنقيط والنفث اعتمادا على ظروف التشغيل. يحدث نظام التنقيط بمعدلات تدفق منخفضة والقطرات الناتجة أحادية التشتت للغاية وقطرها يتناسب مع حجم الطرف. العيب هو انخفاض وتيرة الإنتاج. يحدث نظام النفث بمعدلات تدفق أعلى مقارنة بنظام التنقيط. في هذه الحالة ، يتناسب قطر الإسقاط طرديا مع قطر الطائرة النفاثة التي يمكن أن تكون أصغر بكثير من قطر الطرف في ظل الظروف المناسبة.
يعتمد بديل لهذه النهج الهيدروديناميكية على الاستخدام الإضافي للقوى الكهربائية. Electrospray هي تقنية معروفة وتستخدم على نطاق واسع لتوليد القطرات. يعتمد على مبدأ أن السائل ذو الموصلية الكهربائية المحدودة سوف يتشوه في وجود مجال كهربائي قوي. سيعتمد السائل في النهاية شكلا مخروطيا ناتجا عن التوازن بين إجهاد التوتر الكهربائي والسطحي15. تبدأ العملية بالمجال الكهربائي الذي يحفز تيارا كهربائيا في السائل يتسبب في تراكم الشحنات على السطح. ينتج عن وجود المجال الكهربائي قوة كهربائية على هذه الشحنات ، والتي تسحب السائل على طول ، مما يطيل الغضروف المفصلي في اتجاه الحقل. في ظل ظروف مختلفة ، يمكن للغضروف المفصلي إما التخلص من القطرات المشحونة أو قد ينبعث منها واحد أو عدة نفاثات ثم تنقسم إلى قطرات15. على الرغم من أن طرق الموائع الدقيقة بمساعدة الكهرباء هذه تسمح بشكل طبيعي بتوليد قطرات صغيرة ، إلا أنها تعاني من عدم وجود عملية ثابتة الحالة التي تعرض للخطر التشتت الأحادي للمستحلب. تميل القطرات المشحونة الناتجة إلى التفريغ على الجدران المحصورة و / أو في أي مكان في الجهاز حيث يكون الجهد الكهربائي أقل من الجهد الخارجي المفروض. وبالتالي ، يصبح الغضروف المفصلي المكهرب غير مستقر ، مما يؤدي في النهاية إلى انبعاث قطرات بطريقة فوضوية ويسبب إنتاجها غير المنضبط وفقدان التشتت الأحادي.
في التدفق الكهربائي المشترك ، تقترن الإجهادات الكهربائية والهيدروديناميكية في جهاز الموائع الدقيقةcoflow 16 على غرار الجهاز المستخدم لتوليد مستحلبات مزدوجة12. هناك ميزتان رئيسيتان تسمحان للتدفق الكهربائي بالنجاح في الوصول إلى نظام انبعاثات ثابت الحالة: (i) يتم إخراج الطور المشتت إلى سائل لزج آخر يتدفق ، و (ii) استخدام قطب مضاد سائل أو أرضي. أثبت وجود سائل خارجي متدفق أنه يغير الخصائص الهندسية لعملية انبعاث السقوط17. يسمح القطب المضاد السائل بتفريغ واستخراج القطرات الناتجة ، مما يضمن توليد حالة ثابتة من القطرات. بالإضافة إلى ذلك ، من خلال استغلال توازن القوى الكهربائية والهيدروديناميكية ، يمكن أن تختلف أحجام السقوط الناتجة ضمن نطاق أوسع من الأحجام التي يمكن تغطيتها بأي من التقنيات المذكورة سابقا.
يهدف بروتوكول الفيديو المفصل هذا إلى مساعدة الممارسين الجدد في استخدام وتصنيع الموائع الدقيقة القائمة على الزجاج.
Protocol
1. جعل قطرات بسيطة
- لصنع قطرات بسيطة ، استخدم قاعدة زجاجية مصنوعة من شريحة مجهرية (76.2 مم × 25.4 مم) لبناء الجهاز. هذا يسمح بسهولة نقل وتصور السوائل من خلال الزجاج.
- استخدم شعيرات شعرية زجاجية مستديرة للطرف. بالنسبة لهذا البروتوكول ، استخدم الشعيرات الدموية المستديرة التي يبلغ قطرها 1 مم (متوفرة بسهولة في مجموعة واسعة من الأحجام).
- لصنع طرف بالقطر المطلوب ، اسحب الشعيرات الدموية باستخدام آلة سحب ماصة دقيقة حتى يتم الحصول على اثنين من الشعيرات الدموية النصفية بطرف صغير جدا (~ 1 ميكرومتر).
- استخدم microforge لقطع الطرف إلى القطر المطلوب (2-80 ميكرومتر). بالنسبة للأقطار الأكبر (> 80 ميكرومتر) ، استخدم بلاط السيراميك إذا لم يقطع microforge هذه الأحجام.
ملاحظة: اعتمادا على السائل المطلوب ، ستحتاج إلى معالجة الزجاج ، بحيث لا يتسلق السائل على طول الجزء الخارجي من الطرف.
- بالنسبة للسوائل القائمة على الماء ، اجعل الجزء الخارجي من الطرف كارها للماء. بالنسبة للسوائل القائمة على الزيت ، عندما يكون الجزء الخارجي من الطرف على اتصال بالماء ، اجعل الجزء الخارجي من الطرف محب للماء. انظر الخطوة 2.3 لمعالجة الزجاج.
- استخدم إبرة حقنة (20 جم) لتسهيل إدخال السائل في الشعيرات الدموية. نحت ثقب - بحجم القطر الخارجي للشعيرات الدموية - في قاعدة الإبرة باستخدام شفرة حلاقة أو مشرط.
- شطف الإبرة بالماء لإزالة أي غبار وألياف من القطع. جففها بالهواء.
- للتجميع ، قم بلصق الشعيرات الدموية المستديرة على شريحة المجهر باستخدام الإيبوكسي الجاف السريع. ضع طرف الشعيرات الدموية 1-2 سم خارج نهاية شريحة المجهر. استخدم فقط القليل من الإيبوكسي في وسط الشعيرات الدموية. وبهذه الطريقة ، لن تتداخل مع مجال الرؤية أو مع إبرة المحقنة.
- قم بلصق إبرة المحقنة بطريقة تجعل نهاية الشعيرات الدموية تجلس في وسط الإبرة. أولا ، ضع كمية صغيرة من الايبوكسي المتصلب تقريبا حول الحافة في الجزء السفلي من الإبرة. ضع الإبرة بحيث تكون نهاية الشعيرات الدموية في وسط قاعدتها.
- بعد بضع دقائق ، ضع طبقة ثانية من الإيبوكسي الطازج ، تغطي قاعدة الإبرة ، وتجنب الثقب. أخيرا ، قم بتغطية الثقب بالإيبوكسي المتصلب تقريبا لمنع الإيبوكسي من التدفق داخل الإبر. اتبع إرشادات الشركة المصنعة للإيبوكسي لأوقات التصلب والمعالجة.
- قم بتوصيل قطعة من الأنابيب (ID. × O.D. 0.86 مم × 1.32 مم) بالإبرة. نظف الأنبوب قبل إرفاقه. اغسل المياه منزوعة الأيونات يدويا باستخدام حقنة لإزالة أي بقايا تنتج عند قطع الأنابيب.
ملاحظة: يجب أن تكون مادة الأنابيب متوافقة مع السائل المستخدم في التجارب. يجب أن تكون الأنابيب طويلة بما يكفي لتكون قادرة على توصيل الجهاز ونظام الضخ. - لاختبار الجهاز ، قم بضخ المياه منزوعة الأيونات من خلال الإبرة ولاحظ ما إذا كان هناك أي تسربات. استخدم حقنة وإبرة المقابلة لها لضخ الماء يدويا. في حالة العثور على تسرب ، قم بتجفيف الجهاز جيدا. ضع الإيبوكسي وانتظر لمدة 1 ساعة على الأقل قبل الاختبار مرة أخرى.
- لتوليد قطرات ، باستخدام مشبك ، ضع الجهاز في وضع رأسي بحيث يكون الطرف متجها لأسفل كما هو الحال في صنبور المطبخ. استخدم مضخة حقنة أو إعدادا يعمل بالضغط لضخ السائل في الجهاز.
- جمع قطرات عن طريق وضع الطرف داخل كوب أو قارورة مع سائل مع كمية مناسبة من السطحي. على سبيل المثال ، بالنسبة لزيت السيليكون 10cSt كسائل داخلي ، استخدم مرحلة مستمرة من 16 mM كبريتات دوديسيل الصوديوم (SDS) في الماء.
- بالنسبة لقطرات الزيت في الماء ، من أجل زيادة استقرار القطرات ، أضف طبقة من الزيت اللزج أعلى حمام التجميع قبل صنع المستحلب. بالنسبة لقطرات الماء في الزيت ، استخدم خافضا للتوتر السطحي غير الأيوني في الزيت لتحقيق الاستقرار في القطرات.

الشكل 2: إبرة منحوتة. إبرة مع ثقب منحوت في قاعدتها لتناسب الشعيرات الدموية المستديرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: جهاز لتوليد قطرات بسيطة. مخطط لجهاز لتوليد قطرات بسيطة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: جمع قطرات بسيطة . (أ) رسم تخطيطي لكيفية جمع القطرات في دورق. (ب) منظر علوي لدورق حيث تم جمع قطرات زيت السيليكون 10cSt في 16 mM SDS في محلول مائي ، تم إنتاجه بطرف 580 ميكرومتر. حجم السقوط هو (3.29 ± 0.08) مم (C) المنظر العلوي لدورق حيث تم جمع قطرات زيت السيليكون 10cSt في 16 mM SDS في محلول مائي ، تم إنتاجه بطرف 86 ميكرومتر. حجم السقوط هو (1.75 ± 0.04) ملم يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
2. جعل قطرات مستحلب باستخدام مخطط التدفق المشترك
ملاحظة: تم تصميم الجهاز بشكل مشابه للجهاز الموضح في الخطوة 1.
- قم ببناء الجهاز على قاعدة زجاجية مصنوعة من شريحة مجهرية (76.2 مم × 25.4 مم). هذا يسمح بسهولة نقل وتصور السوائل من خلال الزجاج.
- استخدم شعيرة شعرية ذات مقطع مربع (شعيرات شعرية مربعة) للسائل الخارجي (الطور المستمر للمستحلب) بطول حوالي 5 سم. بالنسبة لهذا البروتوكول ، استخدم الشعيرات الدموية المستديرة التي يبلغ قطرها 1 مم (متوفرة بسهولة في مجموعة واسعة من الأحجام).
- لمعالجة الزجاج ، اعتمادا على السائل الداخلي المختار (المرحلة المشتتة) ، اجعل الجانب الداخلي من الشعيرات الدموية المربعة مسعورا أو محبة للماء. سيساعد العلاج على تجنب وجود قطرات عالقة في الزجاج والتدخل في تكوين قطرات جديدة.
- لجعل الزجاج مسعورا ، قم بتنظيف الشعيرات الدموية عن طريق وضعها في قارورة مع الأسيتون في حمام الموجات فوق الصوتية لمدة 10-15 دقيقة. شطفها مع الأسيتون أو الإيثانول (أبدا الماء). جففها.
- قم بإعداد قارورة نظيفة وجافة (جافة للعظام) تحتوي على تولوين 10 مل (أو هكسان) + 20 ميكرولتر من محلول تريميثوكسي (أوكتيل) سيلان. الحفاظ على الشعيرات الدموية في الحل لمدة 2 ساعة. شطف الشعيرات الدموية مع نفس المذيب المستخدم للمحلول.
- شطف مرة أخرى مع الأسيتون. يجف بالهواء. اخبزيها في الفرن لمدة 30 دقيقة على درجة حرارة 70 درجة مئوية.
ملاحظة: يصعب تنفيذ هذه العملية لنصائح الجهاز دون كسرها. - لعلاج نصائح الجهاز ، اغمسها في محلول التولوين ومحلول تريميثوكسي (أوكتيل) سيلان لبضع ثوان. إزالة أي حل زائد. اتركيه حتى يجف في الهواء.
- لجعل الزجاج محب للماء ، كرر نفس الخطوات (2.3.1-2.3.4) كما هو الحال في حالة مسعور ولكن بمحلول 10 مل من الأسيتون + 20 ميكرولتر من 2-[ميثوكسي (بولي إيثيلينوكسي) 6-9بروبيل] تريميثوكسيسيلان.
- استخدم شعيرات شعرية زجاجية مستديرة للطرف. قم بمطابقة القطر الخارجي للشعيرات الدموية مع الحجم الداخلي للشعيرات الدموية المربعة. وهذا يضمن محاذاة كل من الشعيرات الدموية بشكل محوري. تأكد من أن طول الشعيرات الدموية المستديرة أطول بعدة سنتيمترات من الشعيرات الدموية المربعة.
- اعتمادا على السائل المشتت ، عالج الزجاج ، بحيث لا يتسلق السائل على طول الجزء الخارجي من الطرف.
- تجميع عن طريق لصق الشعرية مربعة إلى شريحة المجهر باستخدام الايبوكسي الجاف السريع. ضع طرف الشعيرات الدموية 1-2 سم خارج نهاية شريحة المجهر (انظر الشكل 6A).
- استخدم رباطا من الإيبوكسي في وسط الشعيرات الدموية ، بحيث لا يتداخل في مجال الرؤية أو مع إبرة المحقنة. انتظر حتى يشفى تماما. لاحظ أنه حتى بالنسبة للإيبوكسي الجاف السريع ، توصي الشركة المصنعة ب 24 ساعة حتى تشفى المادة تماما.
- أدخل الشعيرات الدموية المستديرة في المربع الأول بحيث تبقى النهاية على بعد بضعة سنتيمترات خارج نهاية الشعيرات الدموية المربعة.
- ضع الطرف الآخر (خارج شريحة المجهر) داخل الشعيرات الدموية المربعة على مسافة تتزامن تقريبا مع نهاية الشعيرات الدموية المربعة (انظر الشكل 6 ب).
- الغراء الشعرية باستخدام داب من الايبوكسي على مسافة متوسطة بين نهاية الشعيرات الدموية وبداية المربع الأول. انتظر حتى يشفى تماما.
- قم بإجراء التعديلات التالية في الإبرتين المطلوبتين لإدخال السائل.
- لإيواء الشعيرات الدموية في قاعدة الإبرة ، قم بنحت ثقب في قاعدة الغطاء المستدير بحجم القطر الخارجي للشعيرات الدموية (انظر الشكل 2). لتناسب الإبرة الأخرى في نهاية الشعيرات الدموية المربعة ، قم بنحت ثقوب مستديرة ومربعة في قاعدة الإبرة لاستيعاب المفصل.
- تأكد من محاذاة كلا الثقبين بحيث يمكن تركيب الشعيرات الدموية المستديرة والمربعة داخل الإبرة. شطف الإبر بالماء لإزالة أي غبار وألياف من القطع. جففها بالهواء. قم بلصق الإبر واتبع البروتوكول الموصوف بالفعل في 1.5.2 (انظر الشكل 6C).
- قم بتوصيل الأنبوب (فحص القطر والمواد المتوافقة) بكل من الإبر. شطف الأنابيب بعد قطعها حتى تتم إزالة أي حطام والألياف. يدويا ، استخدم حقنة وإبرة لضخ الماء. اختبر الجهاز بحثا عن التسريبات كما هو موضح أدناه.
- أغلق إحدى الإبر عن طريق ثني قطعة من الأنابيب واستخدام مشبك الموثق لإغلاقها بفعالية من تدفق السوائل. ضخ المياه منزوعة الأيونات من خلال الإبرة الأخرى. إذا لم يلاحظ أي تسرب ، فقم بالضخ عبر الإبرة الأخرى.
- إذا تم العثور على تسرب ، جفف الجهاز جيدا ، وطبق الإيبوكسي ، وانتظر لمدة 1 ساعة على الأقل قبل الاختبار مرة أخرى.
- لتوليد قطرات ، كما هو موضح في الخطوة 1.8 ، استخدم إحدى الطريقتين لدفع السوائل: تثبيت معدلات تدفقها باستخدام مضخات المحاقن ، أو إصلاح ضغطها باستخدام عبوات مضغوطة.

الشكل 5: آثار العلاج الكارهة للماء . (أ) و (ج) الشعيرات الدموية دون أي سائل في الداخل. يشير الخط الأحمر إلى نهاية الشعيرات الدموية. (ب) الشعيرات الدموية غير المعالجة. السائل يبلل الشعيرات الدموية لأنه صعد فوق الخط الأحمر. (د) الشعيرات الدموية المعالجة بالماء. الماء لا يبلل الشعيرات الدموية في هذه الحالة. يبقى السائل تحت الخط الأحمر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
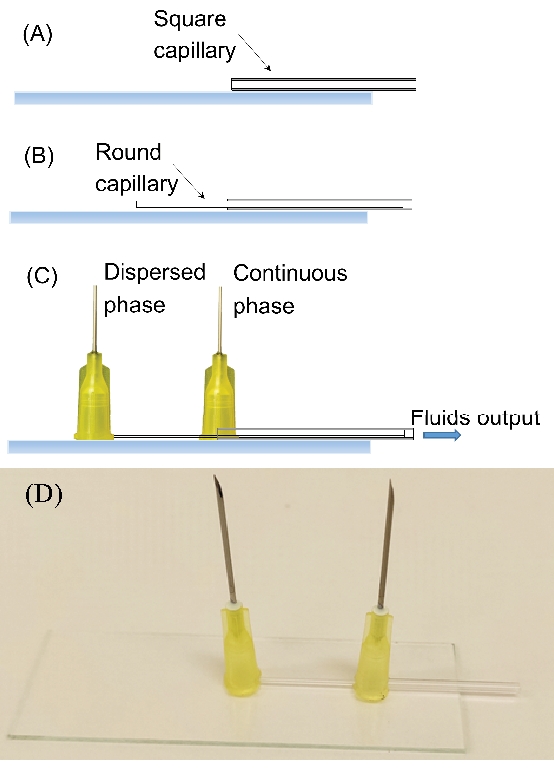
الشكل 6: جهاز التدفق المشترك . (أ) ضع الشعيرات الدموية المربعة على شريحة المجهر. (ب) ضع الشعيرات الدموية المستديرة داخل المربع الأول. (ج) الجهاز الكامل مع إبر حقنة. (د) صورة فوتوغرافية للجهاز بأكمله. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. صنع جهاز التدفق الكهربائي المشترك
- لبناء جهاز الموائع الدقيقة ، استخدم قاعدة زجاجية مصنوعة من شرائح المجهر (76.2 مم × 25.4 مم). نظرا لطولها ، وهي طويلة جدا بحيث لا يمكن وضعها على شريحة مجهر قياسية واحدة ، استخدم 1 1/2 أو اثنين من شرائح المجهر.
- قم بقص قطعتين صغيرتين من شريحة (حوالي 1 سم) للحفاظ على الشرائح معا كما هو موضح في الشكل 7A. استخدم الإيبوكسي للصق الزجاج. انتظر حتى يشفي.
- محاذاة اثنين من الشعيرات الدموية بشكل محوري. لتجنب التكلفة الإضافية لمحاذاة شعيرتين شعريتين مستديرتين بأقطار مختلفة ، استخدم شعيرة شعرية مربعة مع جانب داخلي يطابق القطر الخارجي للشعيرات الدموية المستديرة. بالنسبة لتجارب التدفق الكهربائي المشترك، استخدم شعيرة شعرية جانبية مقاس 2 مم.
ملاحظة: الشعيرات الدموية الجانبية مقاس 2 مم تجعل تجارب التدفق الكهربائي تعمل بشكل أفضل حيث أن مسافة الطرف إلى الأرض أصغر (أو مشابهة) من المسافة بين الطرف وجدار الشعيرات الدموية المربعة. عند استخدام الشعيرات الدموية الجانبية 1 مم ، يكون الجدار الشعري أقرب من الأرض وغالبا ما يميل السائل إلى التفريغ هناك ، مما يؤدي إلى نتائج غير قابلة للتكرار.- استخدم ناسخ الماس أو أي أداة أخرى متاحة لقطع الشعيرات الدموية المربعة إلى طول حوالي 4 سم. اشطفيه بالماء لإزالة أي جزيئات زجاجية. اتركيه حتى يجف في الهواء. اجعله كارها للماء إذا كانت المرحلة المشتتة سائلا قائما على الماء ، وإلا ، محبة للماء.
- اسحب شعيرات دموية مستديرة باستخدام آلة سحب ماصة حتى تحصل على نصفي شعيرتين شعريتين بطرف صغير.
- استخدم microforge لقطع طرف أحد الشعيرات الدموية النصفية إلى القطر المطلوب (20-80 ميكرومتر). بالنسبة للأقطار الأكبر ، يمكنك استخدام بلاط السيراميك. بالنسبة للماء في مستحلبات الزيت ، اجعل الجزء الخارجي من الطرف مسعورا.
- استخدم النصف الآخر من الشعيرات الدموية كجامع شعري. للقيام بذلك ، قم بقطع الطرف المسحوب حتى يتم استرداد النهايات المسطحة الأصلية.
- اقطع الشعيرات الدموية المستديرة لتكون بطول حوالي 4-5 سم (اجعلها أقصر من الشريحة). قم بتنظيفها لإزالة أي بقايا ناتجة أثناء عملية القطع. اغسلها بالماء منزوع الأيونات باستخدام حقنة. جففها بالهواء.
- قم بلصق الشعيرات الدموية المربعة على الشرائح (انظر الشكل 7B). لا تتوسيطه بالنسبة للشرائح ؛ يجب ألا يكون مفصل الشرائح في منطقة العرض. ضع رباطا (لمنع الانتشار) من الإيبوكسي المعالج تقريبا على النهايات.
- ضع الطرف والشعيرات الدموية المجمعة داخل الشعيرات الدموية المربعة. ضع كلا الطرفين - طرف وطرف واحد من المجمع - على نفس الشريحة ، لتجنب المفصل بين الشرائح (انظر الشكل 7C). المسافة بين الطرف والمجمع حوالي 2 ملم. استخدم المجهر لقياس هذه المسافة.
ملاحظة: تعتمد هذه المسافة على التقنية التي تستخدمها لضخ السوائل. الهدف النهائي هو أن تكون المسافة حوالي 1 مم بين الطرف والقطب المضاد السائل. - بمجرد أن تكون الشعيرات الدموية على المسافة الصحيحة ، قم بلصقها على الشريحة باستخدام القليل من الإيبوكسي. احرص على عدم تغطية المنطقة ذات الاهتمام بالإيبوكسي ، لأنه سيجعل التصور في المجهر صعبا.
- لتصنيع وصلات إلى الأطراف المفتوحة للشعيرات الدموية ، ضع الإبر التي تغطي هذه النهايات. مطلوب أربع إبر لكل جهاز.
- استخدم شفرة حلاقة أو مشرط لقطع قاعدة الإبر بحيث تتناسب مع الشعيرات الدموية. قم بعمل ثقب دائري في قاعدة الإبرة لتناسب إبرة في نهاية الشعيرات الدموية المستديرة.
- لتناسبها في نهاية الشعيرات الدموية المربعة ، قم بعمل ثقوب مستديرة ومربعة في قاعدة الإبرة لاستيعاب هذا المفصل. تأكد من محاذاة كلا الثقبين بحيث يمكن تركيب الشعيرات الدموية المستديرة والمربعة داخل الإبرة.
- شطف الإبر بالماء لإزالة أي غبار وألياف من القطع. جففها بالهواء.
- الغراء الإبر. اتبع الخطوات الواردة في 1.5.2. اسمح للإيبوكسي بالشفاء بين عشية وضحاها قبل اختبار الجهاز بحثا عن التسربات.
- لاختبار الجهاز بحثا عن التسريبات، اتبع الخطوات الموضحة أدناه.
- أغلق اثنين من الإبر باستخدام قطعة منحنية من الأنابيب التي يحملها مشبك الموثق. ضخ المياه منزوعة الأيونات من خلال واحدة من الإبر واستخدام آخر واحد كمخرج. استخدم حقنة وإبرة المقابلة لها لضخ المياه يدويا في الجهاز.
- إذا لم يلاحظ أي تسرب ، فقم بالضخ من خلال الإبرة التالية. كرر العملية حتى يمر الماء عبر الإبر الأربعة. في حالة العثور على تسرب ، جفف الجهاز جيدا ، وطبق الإيبوكسي ، وانتظر لمدة 1 ساعة على الأقل قبل الاختبار مرة أخرى.
- املأ الجهاز كما هو موضح أدناه وقم بإزالة فقاعات الهواء لأنها قد تحدث تذبذبات غير مرغوب فيها في النظام. لإزالة الفقاعات ، استخدم حقنتين نصف مملوءتين بالماء منزوع الأيونات. ادفع المحاقن واسحبها لتوجيه الهواء المحبوس داخل الإبر والشعيرات الدموية خارج الجهاز.
- تحضير المحاقن مع السوائل لاستخدامها في التجربة. قم بإزالة أي فقاعات من المحاقن كما هو موضح أعلاه. قم بتوصيل قطعة من الأنابيب بإبرة المحقنة واملأها بالسائل الذي يزيل كل الهواء.
- لتوصيل الأنبوب بالجهاز، قم بإزالة الأنبوب المستخدم للاختبار من إحدى إبر الجهاز وقم بضخ المياه باستخدام أحد محاقن المياه المتصلة، بحيث تقطر الإبرة الماء.
- في الوقت نفسه ، اجعل الأنابيب بالتنقيط بالسائل المطلوب. نظرا لأن كلا الطرفين يقطران ، عند الاتصال ، لا يتم إدخال أي هواء. كرر هذه العملية مع الحقنتين الأخريين ، وبالتالي فإن الإبرة الحرة الوحيدة في الجهاز هي المخرج.
- قم بتوصيل حقنة السائل الداخلي (المرحلة المشتتة) بالإبرة 1 ، والسائل الخارجي (الطور المستمر) بالإبرة 2 ، والسائل المجمع (القطب المضاد) بالإبرة 4. الإبرة 3 هي المخرج (انظر الشكل 8).
- قم بتوصيل مصدر الطاقة بالإبر التي تغذي السوائل الداخلية والمجمعة (الإبر 1 و 4 في الشكل 8) لتعيين فرق محتمل بين طرف السائل وسائل المجمع.
ملاحظة: نظرا لأن الإبرة معدنية، وعلى اتصال بهذه السوائل الموصلة، فإنها تعمل كأسلاك سائلة تحدد الفرق المحتمل بين الطرف والغضروف المفصلي المجمع. بالنسبة لأبعاد الجهاز المذكورة ، سيتراوح فرق الجهد بين 0 و 2.5 كيلو فولت. - ضخ السوائل باستخدام إحدى الطريقتين الممكنتين ، اعتمادا على المعدات المختبرية: استخدم مضخات المحاقن عالية الضغط التي ستحدد معدل تدفق السوائل أو استخدم علب الضغط التي ستعمل على إصلاح ضغط السوائل.
- بمجرد اختيار إحدى هذه الطرق ، قم بإصلاح معدلات التدفق الخارجي والداخلي إلى القيم المطلوبة وضبط معدل التدفق (أو الضغط) لمجمع السائل للحفاظ على المسافة ، L ، ثابتة (انظر الشكل 9).
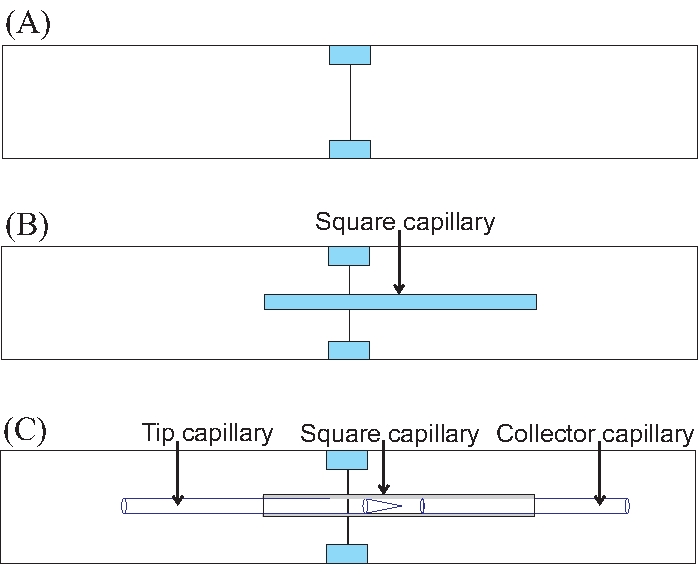
الشكل 7: كيفية وضع الشعيرات الدموية على جهاز التدفق الكهربائي خطوة بخطوة . (أ) بناء القاعدة الزجاجية للجهاز بضم شريحتين مجهريتين. الأجزاء الملونة هي قطع الزجاج المقطوعة التي بعد لصقها ، تمسك بشريحتي المجهر معا. (ب) الموضع الأمثل للشعيرات الدموية المربعة على شريحتين مجهريتين مجمعتين. (ج) تحديد موقع الشعيرات الدموية المستديرة لتجارب التدفق الكهربائي المشترك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
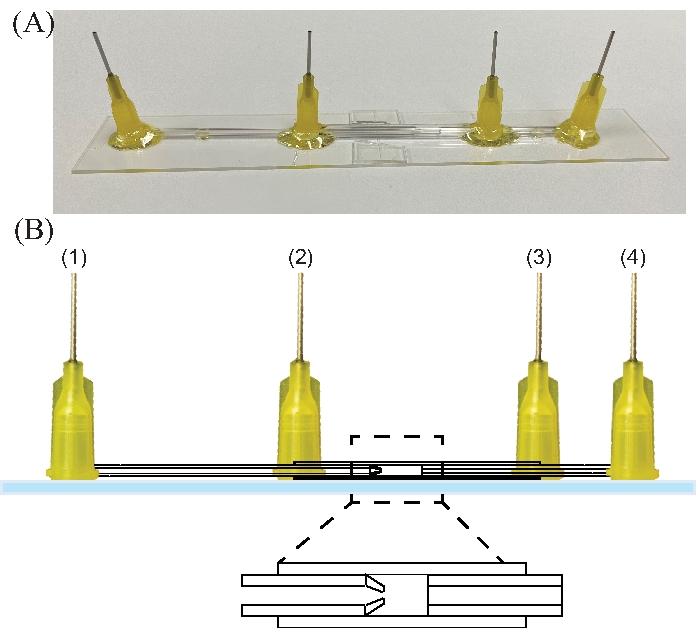
الشكل 8: جهاز التدفق الكهربائي. (أ) صورة فوتوغرافية لجهاز التدفق الكهربائي. (ب) رسم تخطيطي لجهاز التدفق الكهربائي المشترك. تشير الأرقام إلى إدخال (1) السائل الداخلي ، (2) السائل الخارجي ، (3) خروج الجهاز ، و (4) جامع / أرض السائل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
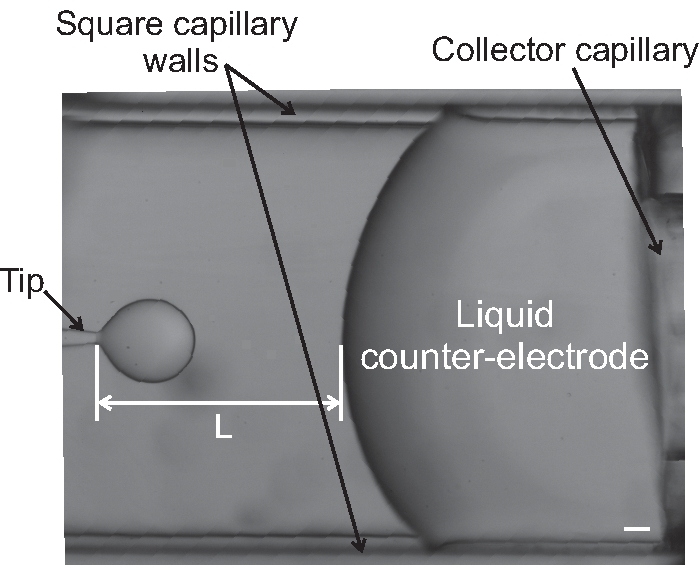
الشكل 9: صورة للطرف والقطب المضاد السائل أثناء تجربة التدفق الكهربائي. يتم وضع علامة على مسافة جامع التلميحات ، L. شريط المقياس يتوافق مع 100 ميكرومتر. تكبير المجهر هو 4x. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
4. إجراءات التنظيف
- حافظ على انزلاقات الشعيرات الدموية والمجهر في الأسيتون لإزالة جميع الغبار والزيت. أي جسيم زيت أو غبار يمكن أن يسد النصائح بحجم ميكرون. تحقق من النصائح الخاصة بالسدادات بعد كل خطوة أثناء التصنيع باستخدام مجهر تكبير 4x إلى 20x لأحجام الأطراف التي تتراوح بين 10 إلى 100 ميكرومتر.
- ضخ المياه منزوعة الأيونات من خلال الأنابيب قبل الاستخدام. استخدم حقنة وإبرة وقم بضخ الماء يدويا لمنع أي جسيم غير مرغوب فيه من الانتقال من داخل الأنبوب إلى الجهاز وانسداد الطرف.
النتائج
في هذه المخطوطة، تم تصميم ثلاثة أجهزة مختلفة لتوليد قطرات. لقد قمنا بتوليد قطرات بحجم (3.29 ± 0.08) مم (الشكل 4B) و (1.75 ± 0.04) مم (الشكل 4C) باستخدام الجهاز الموضح في الخطوة 1. يمكن توليد قطرات المستحلب باستخدام coflow وأجهزة coflow الكهربائية. بالنسبة للأخير ، نعرض التنقيط ف...
Discussion
تم وصف بروتوكول تصنيع ثلاثة أجهزة مختلفة تعتمد على الزجاج أعلاه. في حالة الجهاز لتوليد قطرات بسيطة ، فإن معدل التدفق وخصائص السائل أمران حاسمان لتوليد قطرات بطريقة خاضعة للرقابة. سوف تتشكل قطرات عند الطرف في نظام التنقيط ، أو في نهاية الطائرة في نظام النفث. يتم تحديد الانتقال من التنقيط إل...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نحن ممتنون ل ACS PRF (منحة 60302-UR9) ، Agrobio S.L. (العقد رقم 311325) ، و MCIN / AEI / 10.13039 / 501100011033 / FEDER ، UE (رقم المنحة. PID2021-122369NB-I00).
Materials
| Name | Company | Catalog Number | Comments |
| 2-[methoxy(polyethyleneoxy)6-9propyl] trimethoxysilane. | Gelest | SIM6492.7 | |
| Ceramic tile | Sutter | CTS | |
| Ethylene glycol | Fisher | BP230 | These can be found at other companies like Sigma-Aldrich |
| Hexane | Sigma- Aldrich | 34859 | Available in other vendors |
| ITW Polymers Adhesives Devcon 5 Minute Epoxy Adhesive 25 mL Dev-Tube | Ellsworth adhesives | 470740 | |
| Microforge | Narishige | MF 830 | |
| Micropipette puller | Sutter | P97 | |
| Microscope slides | Fisher | 12-544-1 | Available in other vendors |
| Needle 20 Gauge, .0255" ID, .0355" OD, 1/2" Long | McMaster | 75165A677 | |
| SDS | Sigma-aldrich | 428015 | Surfactant |
| Silicone oil | Clearco | PSF-10cSt | The catalog number correspond to the 10cSt viscosity oil. Different viscosity oils can be found at this company |
| Span 80 | Fisher | S0060500G | non-ionic surfactant |
| Square glass capillary 2mm ID (borosillicate 300 or 600 mm long) | VitroCom | S 102 | |
| Standard Glass Capillaries, 6 in., 2 / 1.12 OD/ID | World Precision instruments | 1B200-6 | These can be found at other companies like Sutter or Vitrocom |
| Syringe pump | Chemyx | FUSION 100-X | This model has a good quality/price ratio |
| Syringes (it will depend on the compatibility with the liquids) | Fisher | Catalog number will depend on the size | |
| Trimethoxy(octyl)silane | Sigma- Aldrich | 376221 | Available in other vendors |
| Tubing ( it will depend on the compatibility with the liquids) | Scientific commodities | BB3165-PE/5 | This reference is for polyethylene micro tubing. The size fits the needle size listed here |
References
- Basaran, O. A. Small-scale free surface flows with break-up: drop formation and emerging applications. American Institute of Chemical Engineers. 48 (9), 1842-1848 (2004).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Reviews of Modern Physics. 77 (3), 977-1026 (2005).
- Stone, H. A., Stroock, A. D., Adjari, A. Engineering Flows in Small Devices: Microfluidics Toward a Lab-on-a-Chip. Annual Review of Fluid Mechanics. 36 (1), 381-411 (2004).
- Gunther, A., Jensen, K. F. Multiphase microfluidics: from flow characteristics to chemical and materials synthesis. Lab on a Chip. 6, 1487-1503 (2006).
- Barrero, A., Loscertales, I. G. Micro- and Nanoparticles via Capillary Flows. Annual Review of Fluid Mechanics. 39, 89-106 (2007).
- Clift, R., Grace, J. R., Weber, M. E. . Bubbles, Drops, and Particles. , (2005).
- Othmer, K. . Encyclopedia of Chemical Technology. 4th edition. 9, (1994).
- Kentish, S., et al. The use of ultrasonics for nanoemulsion preparation. Innovative Food Science & Emerging Technologies. 9 (2), 170-175 (2008).
- Kumar, A., Li, S., Cheng, C. M., Lee, D. Flow-induced phase inversion of emulsions in tapered microchannels. Lab on a Chip. 16 (21), 4173-4180 (2016).
- Atencia, J., Beebe, D. J. Controlled microfluidic interfaces. Nature. 437, 648-655 (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junctions scaling and mechanism of break-up. Lab on a Chip. 6 (3), 437-446 (2006).
- Utada, A. S., et al. Monodisperse Double Emulsions Generated from a Microcapillary Device. Science. 308 (5721), 537-541 (2005).
- Gañan-Calvo, A. M. Generation of Steady Liquid Microthreads and Micron-Sized Monodisperse Sprays in Gas Streams. Physical Review Letters. 80 (2), 285-288 (1998).
- Shah, R. K., et al. Designer emulsions using microfluidics. Materials Today. 11 (4), 18-27 (2008).
- Taylor, G. I. Disintegration of water drops in an electric field. Proceedings of the Royal Society A, Mathematical, Physical and Engineering Sciences. 280 (1382), (1964).
- Gundabala, V. R., Vilanova, N., Fernández-Nieves, A. Current-voltage characteristic of electrospray processes in microfluidics. Physical Review Letters. 105 (15), 154503 (2010).
- Guerrero, J., Rivero, J., Gundabala, V. R., Perez-Saborid, M., Fernández-Nieves, A. Whipping of electrified liquid jets. Proceedings of the National Academy of Sciences of the United States of America. 111 (38), 13763-13767 (2014).
- Vilanova, N., Gundabala, V. R., Fernandez-Nieves, A. Drop size control in electro-coflow. Applied Physics Letters. 99 (2), 021910 (2011).
- Cloupeau, M., Prunet-Foch, B. Electrostatic spraying of liquids: Main functioning modes. Journal of Electrostatics. 25 (2), 165-184 (1990).
- Jaworek, A., Krupa, A. Main modes of electrohydrodynamic spraying of liquids. Third International Conference on Multiphase Flow ICMF. , (1998).
- Juraschek, R., Röllgen, F. W. Pulsation phenomena during electrospray ionization. International Journal of Mass Spectrometry. 177 (1), 1-15 (1998).
- Guerrero, J., et al. Emission modes in electro co-flow. Physics of Fluids. 31 (8), 082009 (2019).
- Utada, A. S., Fernández-Nieves, A., Stone, H. A., Weitz, D. A. Dripping to jetting transitions in coflowing liquid streams. Physical Review Letters. 99 (9), 094502 (2007).
- Castro-Hernández, E., Gundabala, V., Fernández-Nieves, A., Gordillo, J. M. Scaling the drop size in coflow experiments. New Journal of Physics. 11, 075021 (2009).
- Godfray, H. C. J., et al. Food Security: the challenge of feeding 9 billion people. Science. 327 (5967), 812-818 (2010).
- Labbé, R., Gagnier, D., Kostic, A., Shipp, L. The function of supplemental foods for improved crop establishment of generalist predators Orius insidiosus and Dicyphus hesperus. Scientific Reports. 8 (1), 17790 (2018).
- Pilkington, L. J., Messelink, G., van Lenteren, J. C., Le Mottee, K. 34;Protected Biological Control" - Biological pest management in the greenhouse industry. Biological Control. 52 (3), 216-220 (2010).
- Benson, C. M., Labbe, R. M. Exploring the Role of Supplemental Foods for Improved Greenhouse Biological Control. Annals of the Entomological Society of America. 114 (3), 302-321 (2021).
- Temiz, U., Öztürk, E. Encapsulation methods and use in animal nutrition. Selcuk Journal of Agricultural and Food Sciences. 32 (3), 624-631 (2018).
- Messelink, G. J., et al. Approaches to conserving natural enemy populations in greenhouse crops: current methods and future prospects. BioControl. 59, 377-393 (2014).
- Muñoz-Cárdenas, K., et al. Generalist red velvet mite predator (Balaustium sp.) performs better on a mixed diet. Experimental & Applied Acarology. 62 (1), 19-32 (2014).
- van Lenteren, J. C., Bolckmans, K., Köhl, J., Ravensberg, W. J., Urbaneja, A. Biological control using invertebrates and microorganisms: plenty of new opportunities. BioControl. 63, 39-59 (2018).
- Urbaneja-Bernat, P., Alonso, M., Tena, A., Bolckmans, K., Urbaneja, A. Sugar as nutritional supplement for the zoophytophagous predator Nesidiocoris tenuis. BioControl. 58 (1), 57-64 (2013).
- Vila, E., Cabello, T., Guevara-Gonzalez, R., Torres-Pacheco, I. Biosystems Engineering Applied to Greenhouse Pest Control. Biosystems Engineering: Biofactories for Food Production in the Century XXI. , (2014).
- Riudavets, J., Moerman, E., Vila, E., LodovicaGullino, M., Albajes, R. C., Nicot, P. Implementation of Integrated Pest and Disease Management in Greenhouses: From Research to the Consumer. Integrated Pest and Disease Management in Greenhouse Crops. Plant Pathology in the 21st Century. , (2020).
- Cohen, A. C. . Insect diets: Science and technology. Second edition. , (2015).
- Sullivan, M. T., Stone, H. A. The role of feedback in microfluidic flow-focusing devices. Philosophical Transactions of the Royal Society A: Mathematical, Physical, and Engineering Sciences. 366 (1873), 2131-2143 (2008).
- Shang, L., Cheng, Y., Zhao, Y. Emerging droplet microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- Christopher, G. F., Anna, S. L. Microfluidic methods for generating continuous droplet streams. Journal of Physics D: Applied Physics. 40 (19), 319 (2007).
- Nunes, J. K., Tsai, S. S., Wan, J., Stone, H. A. Dripping and jetting in microfluidic multiphase flows applied to particle and fiber synthesis. Journal of Physics D: Applied Physics. 46 (11), 114002 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved