Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Dispositivos a base de vidrio para generar gotas y emulsiones
En este artículo
Resumen
Aquí, se presenta un protocolo para fabricar dispositivos microfluídicos a base de vidrio utilizados para generar emulsiones altamente monodispersas con tamaño de gota controlado.
Resumen
En este manuscrito, se describen tres protocolos paso a paso diferentes para generar gotas de emulsión altamente monodispersas utilizando microfluídica a base de vidrio. El primer dispositivo está diseñado para la generación de gotas simples impulsadas por la gravedad. El segundo dispositivo está diseñado para generar gotas de emulsión en un esquema de coflujo. El tercer dispositivo es una extensión del dispositivo de coflujo con la adición de un tercer líquido que actúa como un suelo eléctrico, permitiendo la formación de gotas electrificadas que posteriormente se descargan. En esta configuración, dos de los tres líquidos tienen una conductividad eléctrica apreciable. El tercer líquido media entre estos dos y es un dieléctrico. Una diferencia de voltaje aplicada entre los dos líquidos conductores crea un campo eléctrico que se acopla con las tensiones hidrodinámicas de los líquidos que fluyen, afectando el proceso de formación de chorros y caídas. La adición del campo eléctrico proporciona un camino para generar gotas más pequeñas que en los dispositivos de coflujo simples y para generar partículas y fibras con una amplia gama de tamaños.
Introducción
La generación controlada de gotas en la micra y nanoescala con una distribución de tamaño estrecha es una tarea desafiante. Estas gotas son de interés para la ingeniería de materiales blandos con muchas aplicaciones en ciencia y tecnología 1,2,3,4,5,6.
Los dispositivos más comunes para la alta tasa de producción de gotas son los mezcladores7 y los emulsionadores de ultrasonido8. Estos métodos son simples y de bajo costo, pero generalmente resultan en gotas polidispersas con una amplia gama de tamaños. Por lo tanto, se requieren pasos adicionales para producir muestras monodispersas. Los dispositivos microfluídicos se pueden diseñar de manera diferente para proporcionar una forma eficiente de formación de caídas. Además, los caudales generalmente bajos involucrados (es decir, el bajo número de Reynolds) permiten un gran control sobre el flujo de fluido.
Mientras que los dispositivos microfluídicos se fabrican comúnmente utilizando técnicas litográficas con poli(dimetil) siloxano (PDMS), este manuscrito se centra en dispositivos capilares a base de vidrio. Los dispositivos PDMS generalmente se eligen por su capacidad para diseñar patrones de canal complejos y por su escalabilidad. Los dispositivos de vidrio, por el contrario, son rígidos y tienen una mayor resistencia a los solventes que sus contrapartes PDMS. Adicionalmente, el vidrio puede ser modificado para cambiar su humectabilidad, lo que permite controlar la generación de emulsiones complejas. Ser capaz de tratar de forma independiente las paredes de la boquilla y el canal permite la formación de gotas de manera controlada y reproducible, al tiempo que garantiza la estabilidad de las emulsiones resultantes si las gotas tocaran las paredes9; de lo contrario, las gotas pueden fusionarse y acumularse en la pared. Otra diferencia entre estos dos tipos de dispositivos es que en los dispositivos basados en vidrio, el flujo es tridimensional, mientras que es plano en los dispositivos PDMS convencionales. Este hecho minimiza el contacto de la gota con las paredes del canal para que la influencia de las líneas de contacto pueda descuidarse10, protegiendo así la estabilidad de múltiples gotas de emulsión.
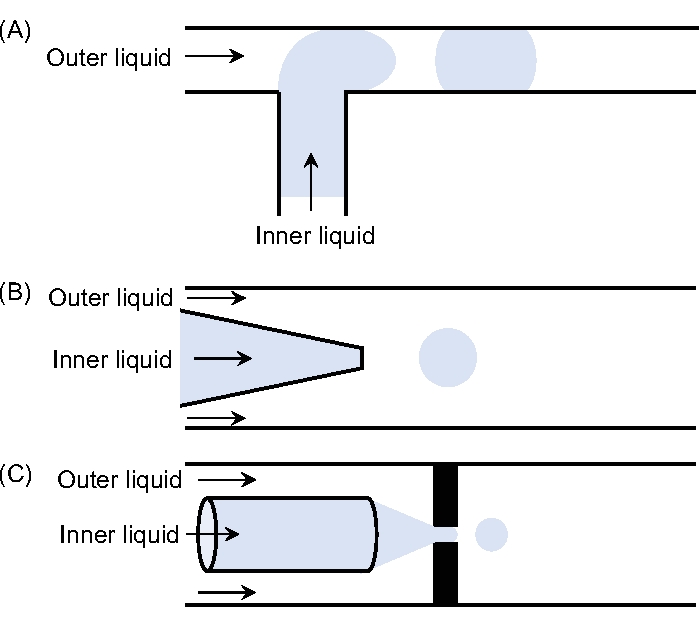
Figura 1: Diferentes configuraciones de dispositivos microfluídicos. Bocetos de (A) una unión en T, (B) un dispositivo de coflujo y (C) un dispositivo de enfoque de flujo. Haga clic aquí para ver una versión más grande de esta figura.
Hay tres geometrías principales utilizadas, a saber, la unión T11, el enfoque de flujo12,13 y el flujo de coflujo14. En la geometría de la unión T, la fase dispersa contenida en el canal intersecta perpendicularmente el canal principal que alberga la fase continua. La tensión de cizallamiento ejercida por la fase continua rompe el líquido disperso entrante dando lugar a caídas. Las gotas generadas están limitadas en menor tamaño por las dimensiones del canal principal11. En la geometría de enfoque de flujo, los dos fluidos son forzados a través de un pequeño orificio que se encuentra frente al tubo de inyección. El resultado es la formación de un chorro, que es mucho más pequeño que el tubo de inyección12,13. Finalmente, la geometría de coflujo tiene una configuración caracterizada por el flujo coaxial de dos fluidos inmiscibles14. En general, el goteo y el chorro se pueden observar dependiendo de las condiciones de operación. El régimen de goteo se produce a caudales bajos y las gotas resultantes son muy monodispersas y tienen un diámetro proporcional al tamaño de la punta. El inconveniente es su baja frecuencia de producción. El régimen de chorro ocurre a tasas de flujo más altas en comparación con el régimen de goteo. En este caso, el diámetro de la gota es directamente proporcional al diámetro del chorro, que puede ser mucho menor que el diámetro de la punta en las condiciones adecuadas.
Una alternativa a estos enfoques hidrodinámicos se basa en el uso adicional de fuerzas eléctricas. El electrospray es una técnica muy conocida y ampliamente utilizada para generar gotitas. Se basa en el principio de que un líquido con una conductividad eléctrica finita se deformará en presencia de un campo eléctrico fuerte. El líquido eventualmente adoptará una forma cónica resultante del equilibrio entre las tensiones eléctricas y de tensión superficial15. El proceso comienza con el campo eléctrico induciendo una corriente eléctrica en el líquido que hace que las cargas se acumulen en la superficie. La presencia del campo eléctrico da como resultado una fuerza eléctrica sobre estas cargas, que arrastra el líquido a lo largo, alargando el menisco en la dirección del campo. Bajo diferentes condiciones, el menisco puede arrojar las gotas cargadas o puede emitir uno o varios chorros que luego se rompen en gotas15. Aunque estos métodos microfluídicos asistidos eléctricamente permiten naturalmente la generación de pequeñas gotas, sufren de una falta de funcionamiento en estado estacionario que comprometa la monodispersidad de la emulsión. Las gotas cargadas resultantes tienden a descargarse en las paredes de confinamiento y / o en cualquier lugar del dispositivo donde el potencial eléctrico sea menor que el voltaje externo impuesto. Así, el menisco electrificado se vuelve inestable, emitiendo finalmente gotas de forma caótica y provocando su producción descontrolada y pérdida de monodispersidad.
En el electroflujo, las tensiones eléctricas e hidrodinámicas se acoplan en un dispositivo microfluídico de cofluido16 similar al utilizado para generar emulsiones dobles12. Dos características principales permiten que el electroflujo tenga éxito en alcanzar un régimen de emisión en estado estacionario: (i) la fase dispersa se expulsa a otro líquido viscoso de coflujo, y (ii) el uso de un contraelectrodo líquido o tierra. Tener un líquido exterior que fluye ha demostrado cambiar las propiedades geométricas del proceso de emisión degotas 17. El contraelectrodo líquido permite la descarga y extracción de las gotas resultantes, asegurando la generación de gotas en estado estacionario. Además, al explotar el equilibrio de las fuerzas eléctricas e hidrodinámicas, los tamaños de gota resultantes pueden variar potencialmente dentro de un rango más amplio que los tamaños que pueden ser cubiertos por cualquiera de las técnicas mencionadas anteriormente.
Este protocolo de video detallado está destinado a ayudar a los nuevos profesionales en el uso y fabricación de microfluídica a base de vidrio.
Protocolo
1. Hacer gotas simples
- Para hacer gotas simples, use una base de vidrio hecha con un portaobjetos de microscopio (76.2 mm x 25.4 mm) para construir el dispositivo. Esto permite un fácil transporte y visualización de los líquidos a través del vidrio.
- Use un capilar de vidrio redondo para la punta. Para este protocolo, utilice capilares redondos de 1 mm de diámetro (fácilmente disponibles en una amplia gama de tamaños).
- Para hacer una punta con el diámetro deseado, tire del capilar con una máquina de extracción de micropipetas hasta obtener dos medios capilares con una punta muy pequeña (~ 1 μm).
- Use una microtorra para cortar la punta al diámetro deseado (2-80 μm). Para diámetros más grandes (> 80 μm), use una baldosa de cerámica si la microtorra no corta esos tamaños.
NOTA: Dependiendo del líquido deseado, el vidrio deberá tratarse, para que el líquido no suba a lo largo del exterior de la punta.
- Para líquidos a base de agua, haga que el exterior de la punta sea hidrófobo. Para los líquidos a base de aceite, cuando el exterior de la punta está en contacto con el agua, haga que el exterior de la punta sea hidrófilo. Consulte el paso 2.3 para el tratamiento del vidrio.
- Use una aguja de jeringa (20 G) para facilitar la introducción del líquido en el capilar. Talle un agujero, del tamaño del diámetro exterior del capilar, en la base de la aguja con una cuchilla de afeitar o un bisturí.
- Enjuague la aguja con agua para eliminar el polvo y las fibras del corte. Sécalos al aire.
- Para ensamblar, pegue el capilar redondo al portaobjetos del microscopio con epoxi seco rápido. Coloque la punta del capilar 1-2 cm fuera del extremo del portaobjetos del microscopio. Use solo un poco de epoxi en el centro del capilar. De esta manera, no interferirá con el campo de visión ni con la aguja de la jeringa.
- Pegue la aguja de la jeringa de tal manera que el extremo del capilar se encuentre en el centro de la aguja. Primero, coloque una pequeña cantidad de epoxi casi endurecido alrededor del borde en la parte inferior de la aguja. Coloque la aguja de tal manera que el extremo del capilar esté en el centro de su base.
- Después de unos minutos, coloque una segunda capa de epoxi fresco, cubriendo la base de la aguja, evitando el agujero. Finalmente, cubra el orificio con epoxi casi endurecido para evitar que el epoxi fluya dentro de las agujas. Siga las pautas del fabricante de epoxi para los tiempos de endurecimiento y curado.
- Coloque un trozo de tubo (I.D. x O.D. 0,86 mm x 1,32 mm) a la aguja. Limpie el tubo antes de conectarlo. Enjuague el agua desionizada manualmente con una jeringa para eliminar los residuos producidos cuando se cortó el tubo.
NOTA: El material del tubo debe ser compatible con el líquido que se utiliza en los experimentos. El tubo debe ser lo suficientemente largo como para poder conectar el dispositivo y el sistema de bombeo. - Para probar el dispositivo, bombee agua desionizada a través de la aguja y observe si hay fugas. Utilice una jeringa y su aguja correspondiente para bombear manualmente el agua. En caso de que se encuentre una fuga, seque bien el dispositivo. Aplique epoxi y espere al menos 1 h antes de volver a probar.
- Para generar gotas, usando una abrazadera, coloque el dispositivo en posición vertical para que la punta esté hacia abajo como en un grifo de cocina. Use una bomba de jeringa o una configuración accionada por presión para bombear el líquido al dispositivo.
- Recoja las gotas colocando la punta dentro de un vaso de precipitados o un vial con un líquido con la cantidad adecuada de surfactante. Por ejemplo, para el aceite de silicona 10cSt como líquido interno, use una fase continua de 16 mM de dodecil sulfato de sodio (SDS) en agua.
- Para las gotas de aceite en agua, para aumentar la estabilidad de las gotas, agregue una capa de aceite viscoso en la parte superior del baño de recolección antes de hacer la emulsión. Para las gotas de agua en aceite, use un surfactante no iónico en el aceite para estabilizar las gotas.

Figura 2: Aguja tallada. Aguja con un agujero tallado en su base para encajar un capilar redondo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Dispositivo para generar gotas simples. Esquema de un dispositivo para generar gotas simples. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Recolección de gotas simples. (A) Boceto de cómo recolectar gotas en un vaso de precipitados. (B) Vista superior de un vaso de precipitados donde se recogieron gotas de aceite de silicona 10cSt en SDS de 16 mM en solución de agua, producida con una punta de 580 μm. El tamaño de la gota es (3.29 ± 0.08) mm. (C) Vista superior de un vaso de precipitados donde se recolectaron gotas de aceite de silicona 10cSt en SDS de 16 mM en solución de agua, producida con una punta de 86 μm. El tamaño de la gota es (1.75 ± 0.04) mm Haga clic aquí para ver una versión más grande de esta figura.
2. Hacer gotas de emulsión utilizando un esquema de coflujo
NOTA: El dispositivo está construido de forma similar al dispositivo descrito en el paso 1.
- Construya el dispositivo sobre una base de vidrio hecha con un portaobjetos de microscopio (76,2 mm x 25,4 mm). Esto permite un fácil transporte y visualización de los líquidos a través del vidrio.
- Utilice un capilar con sección cuadrada (capilar cuadrado) para el líquido externo (fase continua de la emulsión) con una longitud de unos 5 cm. Para este protocolo, utilice capilares redondos de 1 mm de diámetro (fácilmente disponibles en una amplia gama de tamaños).
- Para el tratamiento con vidrio, dependiendo del líquido interno elegido (fase dispersa), haga que el lado interno del capilar cuadrado sea hidrófobo o hidrófilo. El tratamiento ayudará a evitar que las gotas se peguen en el vidrio e interfieran con la formación de nuevas gotas.
- Para hacer vidrio hidrófobo, limpie los capilares poniéndolos en un vial con acetona en el baño de ultrasonido durante 10-15 min. Enjuáguelos con acetona o etanol (nunca agua). Sécalos.
- Prepare un vial limpio y seco (seco para los huesos) que contenga 10 ml de tolueno (o hexano) + 20 μL de solución de trimetoxi(octil)silano. Mantenga los capilares en la solución durante 2 h. Enjuague los capilares con el mismo disolvente utilizado para la solución.
- Enjuague de nuevo con acetona. Secar con aire. Hornéalos en el horno durante 30 min a unos 70 °C.
NOTA: Este proceso es difícil de implementar para las puntas del dispositivo sin romperlas. - Para tratar las puntas del dispositivo, sumérjalas en la solución de tolueno y solución de trimetoxi(octil)silano durante unos segundos. Retire cualquier exceso de solución. Dejar secar al aire.
- Para hacer vidrio hidrófilo, repita los mismos pasos (2.3.1-2.3.4) que en el caso hidrófobo pero con una solución de 10 ml de acetona + 20 μL de 2-[metoxi(polietilenoxi)6-9propil] trimetoxisilano.
- Use un capilar de vidrio redondo para la punta. Haga coincidir el diámetro exterior del capilar con el tamaño interno del capilar cuadrado. Esto asegura que ambos capilares estén alineados coaxialmente. Asegúrese de que la longitud del capilar redondo sea varios centímetros más larga que el capilar cuadrado.
- Dependiendo del líquido disperso, trate el vidrio, para que el líquido no suba a lo largo del exterior de la punta.
- Ensamble pegando el capilar cuadrado al portaobjetos del microscopio utilizando epoxi seco rápido. Coloque la punta del capilar 1-2 cm fuera del extremo del portaobjetos del microscopio (ver Figura 6A).
- Use un poco de epoxi en el centro del capilar, para que no interfiera en el campo de visión o con la aguja de la jeringa. Espere hasta que se cure por completo. Tenga en cuenta que incluso para el epoxi seco rápido, el fabricante recomienda 24 h para que el material se cure por completo.
- Introduce el capilar redondo en el cuadrado de tal manera que el extremo permanezca unos centímetros fuera del extremo del capilar cuadrado.
- Coloque el otro extremo (fuera del portaobjetos del microscopio) dentro del capilar cuadrado a una distancia que coincida aproximadamente con el extremo del capilar cuadrado (ver Figura 6B).
- Pega el capilar usando un poco de epoxi a media distancia entre el extremo del capilar y el comienzo del cuadrado. Espere hasta que se cure por completo.
- Realice las siguientes modificaciones en las dos agujas necesarias para introducir el líquido.
- Para alojar el capilar en la base de la aguja, talle un orificio en la base de la tapa redonda que sea del tamaño del diámetro exterior del capilar (ver Figura 2). Para ajustar la otra aguja al final del capilar cuadrado, talle agujeros redondos y cuadrados en la base de la aguja para acomodar la articulación.
- Asegúrese de que ambos orificios estén alineados para que los capilares redondos y cuadrados se puedan colocar dentro de la aguja. Enjuague las agujas con agua para eliminar el polvo y las fibras del corte. Sécalos al aire. Pegue las agujas y siga el protocolo ya descrito en 1.5.2 (ver Figura 6C).
- Conecte el tubo (compruebe el diámetro y el material compatible) a cada una de las agujas. Enjuague los tubos después de cortarlos para que se eliminen los desechos y las fibras. Manualmente, use una jeringa y una aguja para bombear el agua. Pruebe el dispositivo en busca de fugas como se describe a continuación.
- Cierre una de las agujas doblando un trozo de tubo y usando un clip aglutinante para cerrarlo efectivamente del flujo de fluido. Bombee agua desionizada a través de la otra aguja. Si no se observan fugas, bombee a través de la otra aguja.
- Si se encuentra una fuga, seque bien el dispositivo, aplique epoxi y espere al menos 1 h antes de volver a probar.
- Para generar gotas, como se describe en el paso 1.8, utilice una de las dos formas de conducir los líquidos: fijando sus caudales con bombas de jeringa o fijando su presión utilizando botes presurizados.

Figura 5: Efectos del tratamiento hidrófobo. (A) y (C) Capilar sin ningún líquido en su interior. La línea roja indica el extremo del capilar. (B) Capilar no tratado. El líquido está humedeciendo el capilar a medida que ha subido por encima de la línea roja. (D) Capilar tratado con agua. El agua no moja el capilar en este caso. El líquido se mantiene por debajo de la línea roja. Haga clic aquí para ver una versión más grande de esta figura.
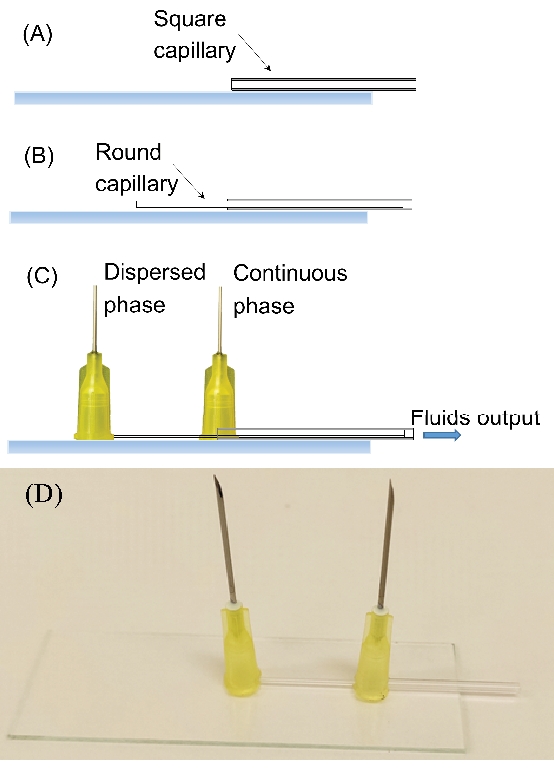
Figura 6: Dispositivo de coflujo. (A) Coloque el capilar cuadrado en el portaobjetos del microscopio. (B) Coloque el capilar redondo dentro del cuadrado. (C) El dispositivo completo con las agujas de la jeringa. (D) Fotografía del dispositivo completo. Haga clic aquí para ver una versión más grande de esta figura.
3. Fabricación de un dispositivo de electroflujo
- Para construir el dispositivo microfluídico, use una base de vidrio hecha con portaobjetos de microscopio (76.2 mm x 25.4 mm). Debido a su longitud, demasiado larga para caber en un solo portaobjetos de microscopio estándar, use 1 1/2 o dos portaobjetos de microscopio.
- Corte dos trozos pequeños de una diapositiva (aproximadamente 1 cm) para mantener las diapositivas juntas como se muestra en la Figura 7A. Use epoxi para pegar el vidrio. Espere hasta que se cure.
- Alinear dos capilares coaxialmente. Para evitar el costo adicional de alinear dos capilares redondos de diferentes diámetros, use un capilar cuadrado con un lado interno que coincida con el diámetro exterior del capilar redondo. Para experimentos de electroflujo, use un capilar lateral de 2 mm.
NOTA: El capilar lateral de 2 mm hace que los experimentos de electroflujo funcionen mejor ya que la distancia punta-suelo es menor (o similar) que la distancia entre la punta y la pared del capilar cuadrado. Cuando se usa el capilar lateral de 1 mm, la pared capilar está más cerca que el suelo y el líquido a menudo tiende a descargarse allí, lo que lleva a resultados no reproducibles.- Use un escriba de diamante u otra herramienta disponible para cortar el capilar cuadrado a una longitud de aproximadamente 4 cm. Enjuáguelo con agua para eliminar cualquier partícula de vidrio. Dejar secar al aire. Hazlo hidrófobo si la fase dispersa es un líquido a base de agua, de lo contrario, hidrófilo.
- Tire de un capilar redondo con una máquina de tirar de pipetas hasta obtener dos medios capilares con una punta pequeña.
- Use una microtorra para cortar la punta de uno de los medios capilares al diámetro deseado (20-80 μm). Para diámetros más grandes, puede usar una baldosa de cerámica. Para el agua en emulsiones de aceite, haga que el exterior de la punta sea hidrófobo.
- Use la otra mitad capilar como colector capilar. Para ello, corta la punta tirada para que se recuperen los extremos planos originales.
- Corte los dos capilares redondos para que tengan alrededor de 4-5 cm de largo (manténgalos más cortos que el portaobjetos). Límpielos para eliminar cualquier residuo generado durante el proceso de corte. Enjuáguelos con agua desionizada con una jeringa. Secarlos al aire.
- Pegue el capilar cuadrado a las diapositivas (ver Figura 7B). No lo centre en relación con las diapositivas; la articulación de las diapositivas no debe estar en la región de visualización. Ponga un dab (para evitar la propagación) de epoxi casi curado en los extremos.
- Coloque la punta y los capilares colectores dentro del capilar cuadrado. Coloque ambos extremos (punta y un extremo del colector) en la misma diapositiva, para evitar la unión entre diapositivas (ver Figura 7C). La distancia entre la punta y el colector es de alrededor de 2 mm. Use un microscopio para medir esta distancia.
NOTA: Esta distancia dependerá de la técnica que esté utilizando para bombear los líquidos. El objetivo final es tener una distancia de aproximadamente 1 mm entre la punta y el contraelectrodo líquido. - Una vez que los capilares estén a la distancia correcta, péguelos a la diapositiva con un poco de epoxi. Tenga cuidado de no cubrir la región de interés con epoxi, ya que dificultaría la visualización en el microscopio.
- Para fabricar conexiones a los extremos abiertos de los capilares, coloque agujas que cubran estos extremos. Se requieren cuatro agujas por dispositivo.
- Use una cuchilla de afeitar o un bisturí para cortar la base de las agujas para que quepan sobre los capilares. Haga un orificio redondo en la base de la aguja para que quepa una aguja en el extremo de los capilares redondos.
- Para ajustarlo al final del capilar cuadrado, haga agujeros redondos y cuadrados en la base de la aguja para acomodar esta articulación. Asegúrese de que ambos orificios estén alineados para que se puedan colocar capilares redondos y cuadrados dentro de la aguja.
- Enjuague las agujas con agua para eliminar el polvo y las fibras del corte. Secarlos al aire.
- Pega las agujas. Siga los pasos de la versión 1.5.2. Permita que el epoxi se cure durante la noche antes de probar el dispositivo en busca de fugas.
- Para probar el dispositivo en busca de fugas, siga los pasos que se detallan a continuación.
- Cierre dos de las agujas usando un trozo de tubo doblado sostenido por un clip de aglutinante. Bombee agua desionizada a través de una de las agujas y use la última como salida. Use una jeringa y su aguja correspondiente para bombear agua manualmente al dispositivo.
- Si no se observan fugas, bombee a través de la siguiente aguja. Repita el proceso hasta que el agua pase por las cuatro agujas. En caso de que se encuentre una fuga, seque bien el dispositivo, aplique epoxi y espere al menos 1 h antes de volver a probar.
- Llene el dispositivo como se describe a continuación y elimine las burbujas de aire, ya que pueden introducir oscilaciones indeseables en el sistema. Para eliminar las burbujas, use dos jeringas medio llenas con agua desionizada. Empuje y tire de las jeringas para guiar el aire atrapado dentro de las agujas y capilares fuera del dispositivo.
- Prepare las jeringas con los líquidos que se utilizarán en el experimento. Retire las burbujas de las jeringas como se describió anteriormente. Conecte un trozo de tubo a la aguja de la jeringa y llénelo con el líquido eliminando todo el aire.
- Para conectar el tubo al dispositivo, retire el tubo utilizado para las pruebas de una de las agujas del dispositivo y bombee agua con una de las jeringas de agua conectadas, de modo que la aguja gotee agua.
- Al mismo tiempo, haga que el tubo gotee con el líquido deseado. Debido a que ambos extremos están goteando, cuando están conectados, no se introduce aire. Repita este proceso con las otras dos jeringas, por lo que la única aguja libre en el dispositivo es la salida.
- Conecte la jeringa de líquido interno (fase dispersa) a la aguja 1, el líquido externo (fase continua) a la aguja 2 y el líquido colector (contraelectrodo) a la aguja 4. La aguja 3 es la salida (ver Figura 8).
- Conecte la fuente de alimentación a las agujas que alimentan los líquidos internos y colectores (agujas 1 y 4 en la Figura 8) para establecer una diferencia de potencial entre la punta y el líquido colector.
NOTA: Debido a que la aguja es metálica y está en contacto con estos líquidos conductores, actúan como cables líquidos que establecen la diferencia de potencial entre la punta y el menisco colector. Para las dimensiones del dispositivo mencionadas, la diferencia de potencial oscilará entre 0 y 2,5 kV. - Bombee los líquidos utilizando una de las dos formas posibles, dependiendo del equipo de laboratorio: use bombas de jeringa de alta presión que fijarán el caudal de los líquidos o use botes de presión que fijarán la presión de los líquidos.
- Una vez elegido uno de estos métodos, fije los caudales externos e internos a los valores deseados y ajuste el caudal (o presión) del colector de líquido para mantener la distancia, L, constante (ver Figura 9).
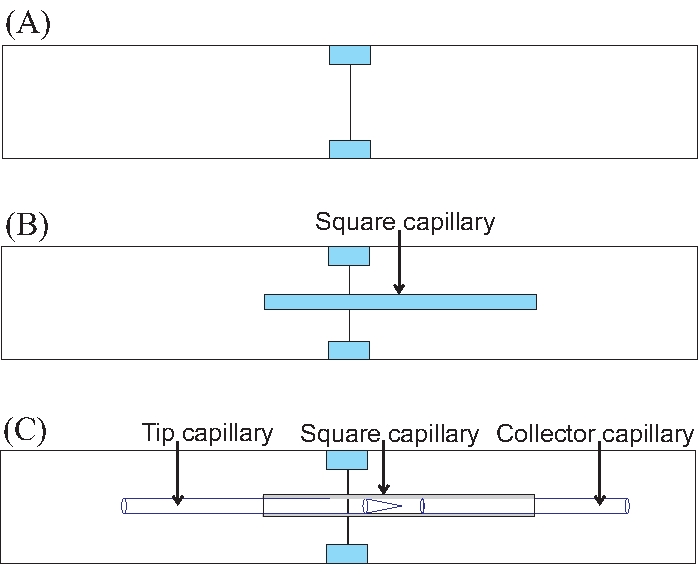
Figura 7: Cómo colocar los capilares en un dispositivo de electroflujo paso a paso. (A) Construir la base de vidrio para el dispositivo uniendo dos portaobjetos de microscopio. Las partes de colores son los trozos de vidrio cortados que después de ser pegados, mantienen unidos los dos portaobjetos del microscopio. (B) La posición óptima del capilar cuadrado en dos portaobjetos de microscopio ensamblados. (C) Posicionamiento de los capilares redondos para experimentos de electroflujo. Haga clic aquí para ver una versión más grande de esta figura.
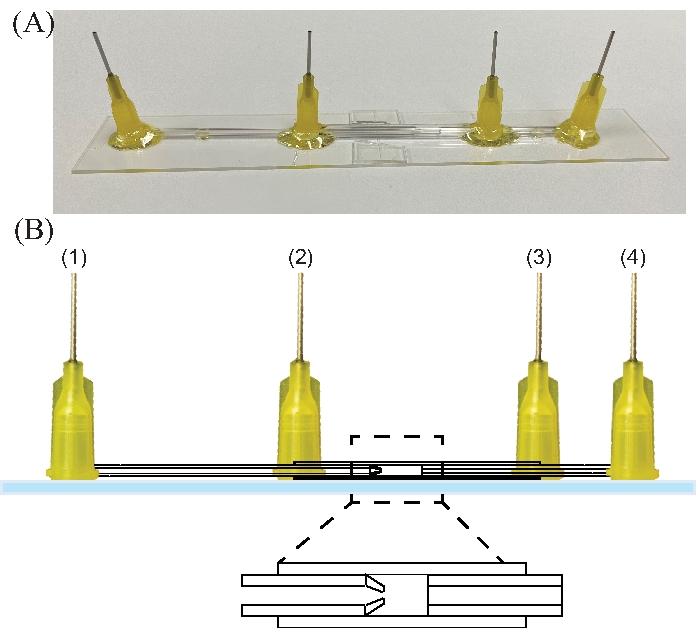
Figura 8: Dispositivo de electroflujo. (A) Fotografía de un dispositivo de electroflujo. (B) Boceto de un dispositivo de electroflujo. Los números indican la entrada para (1) el líquido interno, (2) el líquido externo, (3) la salida del dispositivo y (4) el colector / tierra de líquido. Haga clic aquí para ver una versión más grande de esta figura.
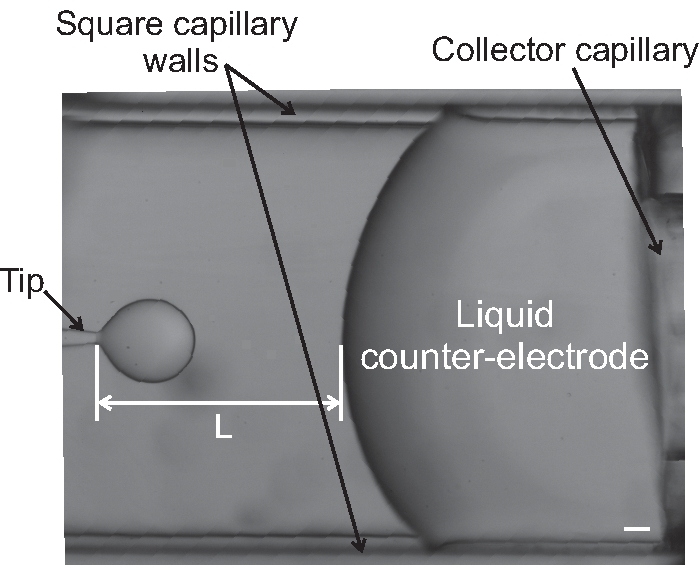
Figura 9: Imagen de la punta y el contraelectrodo líquido durante un experimento de electroflujo. La distancia punta-colector, L, está marcada. La barra de escala corresponde a 100 μm. La ampliación del microscopio es de 4x. Haga clic aquí para ver una versión más grande de esta figura.
4. Procedimientos de limpieza
- Mantenga los capilares y los portaobjetos del microscopio en acetona para eliminar todo el polvo y el aceite. Cualquier partícula de aceite o polvo podría obstruir las puntas del tamaño de una micra. Verifique las puntas para obstrucciones después de cada paso durante la fabricación con un microscopio de aumento de 4x a 20x para tamaños de punta entre 10 y 100 μm.
- Bombee agua desionizada a través del tubo antes de su uso. Use una jeringa y una aguja y bombee manualmente el agua para evitar que cualquier partícula indeseable viaje desde el interior del tubo hacia el dispositivo y obstruya la punta.
Resultados
En este manuscrito, se han diseñado tres dispositivos diferentes para generar gotas. Hemos generado gotas con un tamaño de (3.29 ± 0.08) mm (Figura 4B) y (1.75 ± 0.04) mm (Figura 4C) utilizando el dispositivo descrito en el paso 1. Las gotas de emulsión se pueden generar utilizando el coflujo y los dispositivos de electroflujo. Para este último, mostramos el goteo en la Figura 9, mientras que los modos de chorro de cono y azot...
Discusión
El protocolo para fabricar tres dispositivos diferentes basados en vidrio se ha descrito anteriormente. En el caso del dispositivo para generar gotas simples, el caudal y las propiedades del líquido son cruciales para generar gotas de manera controlada. Las gotas se formarán en la punta en el régimen de goteo, o al final del chorro en el régimen de chorro. La transición del goteo al chorro está parametrizada por el número de Weber adimensional, We23. Este número representa la relación ent...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la ACS PRF (subvención 60302-UR9), Agrobio S.L. (contrato #311325), y MCIN/AEI/10.13039/501100011033/FEDER, UE (subvención No. PID2021-122369NB-I00).
Materiales
| Name | Company | Catalog Number | Comments |
| 2-[methoxy(polyethyleneoxy)6-9propyl] trimethoxysilane. | Gelest | SIM6492.7 | |
| Ceramic tile | Sutter | CTS | |
| Ethylene glycol | Fisher | BP230 | These can be found at other companies like Sigma-Aldrich |
| Hexane | Sigma- Aldrich | 34859 | Available in other vendors |
| ITW Polymers Adhesives Devcon 5 Minute Epoxy Adhesive 25 mL Dev-Tube | Ellsworth adhesives | 470740 | |
| Microforge | Narishige | MF 830 | |
| Micropipette puller | Sutter | P97 | |
| Microscope slides | Fisher | 12-544-1 | Available in other vendors |
| Needle 20 Gauge, .0255" ID, .0355" OD, 1/2" Long | McMaster | 75165A677 | |
| SDS | Sigma-aldrich | 428015 | Surfactant |
| Silicone oil | Clearco | PSF-10cSt | The catalog number correspond to the 10cSt viscosity oil. Different viscosity oils can be found at this company |
| Span 80 | Fisher | S0060500G | non-ionic surfactant |
| Square glass capillary 2mm ID (borosillicate 300 or 600 mm long) | VitroCom | S 102 | |
| Standard Glass Capillaries, 6 in., 2 / 1.12 OD/ID | World Precision instruments | 1B200-6 | These can be found at other companies like Sutter or Vitrocom |
| Syringe pump | Chemyx | FUSION 100-X | This model has a good quality/price ratio |
| Syringes (it will depend on the compatibility with the liquids) | Fisher | Catalog number will depend on the size | |
| Trimethoxy(octyl)silane | Sigma- Aldrich | 376221 | Available in other vendors |
| Tubing ( it will depend on the compatibility with the liquids) | Scientific commodities | BB3165-PE/5 | This reference is for polyethylene micro tubing. The size fits the needle size listed here |
Referencias
- Basaran, O. A. Small-scale free surface flows with break-up: drop formation and emerging applications. American Institute of Chemical Engineers. 48 (9), 1842-1848 (2004).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Reviews of Modern Physics. 77 (3), 977-1026 (2005).
- Stone, H. A., Stroock, A. D., Adjari, A. Engineering Flows in Small Devices: Microfluidics Toward a Lab-on-a-Chip. Annual Review of Fluid Mechanics. 36 (1), 381-411 (2004).
- Gunther, A., Jensen, K. F. Multiphase microfluidics: from flow characteristics to chemical and materials synthesis. Lab on a Chip. 6, 1487-1503 (2006).
- Barrero, A., Loscertales, I. G. Micro- and Nanoparticles via Capillary Flows. Annual Review of Fluid Mechanics. 39, 89-106 (2007).
- Clift, R., Grace, J. R., Weber, M. E. . Bubbles, Drops, and Particles. , (2005).
- Othmer, K. . Encyclopedia of Chemical Technology. 4th edition. 9, (1994).
- Kentish, S., et al. The use of ultrasonics for nanoemulsion preparation. Innovative Food Science & Emerging Technologies. 9 (2), 170-175 (2008).
- Kumar, A., Li, S., Cheng, C. M., Lee, D. Flow-induced phase inversion of emulsions in tapered microchannels. Lab on a Chip. 16 (21), 4173-4180 (2016).
- Atencia, J., Beebe, D. J. Controlled microfluidic interfaces. Nature. 437, 648-655 (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junctions scaling and mechanism of break-up. Lab on a Chip. 6 (3), 437-446 (2006).
- Utada, A. S., et al. Monodisperse Double Emulsions Generated from a Microcapillary Device. Science. 308 (5721), 537-541 (2005).
- Gañan-Calvo, A. M. Generation of Steady Liquid Microthreads and Micron-Sized Monodisperse Sprays in Gas Streams. Physical Review Letters. 80 (2), 285-288 (1998).
- Shah, R. K., et al. Designer emulsions using microfluidics. Materials Today. 11 (4), 18-27 (2008).
- Taylor, G. I. Disintegration of water drops in an electric field. Proceedings of the Royal Society A, Mathematical, Physical and Engineering Sciences. 280 (1382), (1964).
- Gundabala, V. R., Vilanova, N., Fernández-Nieves, A. Current-voltage characteristic of electrospray processes in microfluidics. Physical Review Letters. 105 (15), 154503 (2010).
- Guerrero, J., Rivero, J., Gundabala, V. R., Perez-Saborid, M., Fernández-Nieves, A. Whipping of electrified liquid jets. Proceedings of the National Academy of Sciences of the United States of America. 111 (38), 13763-13767 (2014).
- Vilanova, N., Gundabala, V. R., Fernandez-Nieves, A. Drop size control in electro-coflow. Applied Physics Letters. 99 (2), 021910 (2011).
- Cloupeau, M., Prunet-Foch, B. Electrostatic spraying of liquids: Main functioning modes. Journal of Electrostatics. 25 (2), 165-184 (1990).
- Jaworek, A., Krupa, A. Main modes of electrohydrodynamic spraying of liquids. Third International Conference on Multiphase Flow ICMF. , (1998).
- Juraschek, R., Röllgen, F. W. Pulsation phenomena during electrospray ionization. International Journal of Mass Spectrometry. 177 (1), 1-15 (1998).
- Guerrero, J., et al. Emission modes in electro co-flow. Physics of Fluids. 31 (8), 082009 (2019).
- Utada, A. S., Fernández-Nieves, A., Stone, H. A., Weitz, D. A. Dripping to jetting transitions in coflowing liquid streams. Physical Review Letters. 99 (9), 094502 (2007).
- Castro-Hernández, E., Gundabala, V., Fernández-Nieves, A., Gordillo, J. M. Scaling the drop size in coflow experiments. New Journal of Physics. 11, 075021 (2009).
- Godfray, H. C. J., et al. Food Security: the challenge of feeding 9 billion people. Science. 327 (5967), 812-818 (2010).
- Labbé, R., Gagnier, D., Kostic, A., Shipp, L. The function of supplemental foods for improved crop establishment of generalist predators Orius insidiosus and Dicyphus hesperus. Scientific Reports. 8 (1), 17790 (2018).
- Pilkington, L. J., Messelink, G., van Lenteren, J. C., Le Mottee, K. 34;Protected Biological Control" - Biological pest management in the greenhouse industry. Biological Control. 52 (3), 216-220 (2010).
- Benson, C. M., Labbe, R. M. Exploring the Role of Supplemental Foods for Improved Greenhouse Biological Control. Annals of the Entomological Society of America. 114 (3), 302-321 (2021).
- Temiz, U., Öztürk, E. Encapsulation methods and use in animal nutrition. Selcuk Journal of Agricultural and Food Sciences. 32 (3), 624-631 (2018).
- Messelink, G. J., et al. Approaches to conserving natural enemy populations in greenhouse crops: current methods and future prospects. BioControl. 59, 377-393 (2014).
- Muñoz-Cárdenas, K., et al. Generalist red velvet mite predator (Balaustium sp.) performs better on a mixed diet. Experimental & Applied Acarology. 62 (1), 19-32 (2014).
- van Lenteren, J. C., Bolckmans, K., Köhl, J., Ravensberg, W. J., Urbaneja, A. Biological control using invertebrates and microorganisms: plenty of new opportunities. BioControl. 63, 39-59 (2018).
- Urbaneja-Bernat, P., Alonso, M., Tena, A., Bolckmans, K., Urbaneja, A. Sugar as nutritional supplement for the zoophytophagous predator Nesidiocoris tenuis. BioControl. 58 (1), 57-64 (2013).
- Vila, E., Cabello, T., Guevara-Gonzalez, R., Torres-Pacheco, I. Biosystems Engineering Applied to Greenhouse Pest Control. Biosystems Engineering: Biofactories for Food Production in the Century XXI. , (2014).
- Riudavets, J., Moerman, E., Vila, E., LodovicaGullino, M., Albajes, R. C., Nicot, P. Implementation of Integrated Pest and Disease Management in Greenhouses: From Research to the Consumer. Integrated Pest and Disease Management in Greenhouse Crops. Plant Pathology in the 21st Century. , (2020).
- Cohen, A. C. . Insect diets: Science and technology. Second edition. , (2015).
- Sullivan, M. T., Stone, H. A. The role of feedback in microfluidic flow-focusing devices. Philosophical Transactions of the Royal Society A: Mathematical, Physical, and Engineering Sciences. 366 (1873), 2131-2143 (2008).
- Shang, L., Cheng, Y., Zhao, Y. Emerging droplet microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- Christopher, G. F., Anna, S. L. Microfluidic methods for generating continuous droplet streams. Journal of Physics D: Applied Physics. 40 (19), 319 (2007).
- Nunes, J. K., Tsai, S. S., Wan, J., Stone, H. A. Dripping and jetting in microfluidic multiphase flows applied to particle and fiber synthesis. Journal of Physics D: Applied Physics. 46 (11), 114002 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados