Method Article
أجهزة إلكترونية عضوية مرنة للعلاج الميداني الكهربائي النبضي للورم الأرومي الدبقي
In This Article
Summary
يصف هذا العمل تطوير أقطاب كهربائية مرنة متداخلة للتنفيذ في نماذج أورام المخ 3D ، أي في الثقافة المختبرية ، في نموذج البويضة ، وفي نموذج الفئران في الجسم الحي . يمكن استخدام الطريقة المقترحة لتقييم آثار المجالات الكهربائية النبضية على الأورام بمستويات مختلفة من التعقيد.
Abstract
يصعب القضاء على الورم الأرومي الدبقي بعلاجات الأورام القياسية بسبب درجة غزوه العالية. تعتبر العلاجات الكهربائية الحيوية القائمة على المجالات الكهربائية النبضية (PEFs) واعدة لتحسين كفاءة العلاج. ومع ذلك ، فإنها تعتمد على أقطاب صلبة تسبب أضرارا حادة ومزمنة ، خاصة في الأنسجة الرخوة مثل الدماغ. في هذا العمل ، تم استخدام الإلكترونيات المرنة لتوصيل PEFs إلى الأورام وتم تقييم الاستجابة البيولوجية باستخدام المجهر الفلوري. تم طلاء أقطاب الذهب المتداخلة على ركيزة رقيقة وشفافة من الباريلين-C بالبوليمر الموصل PEDOT: PSS ، مما أدى إلى جهاز متوافق ومتوافق حيويا. تم فحص آثار PEFs على الأورام وبيئتها المكروية باستخدام نماذج بيولوجية مختلفة. أولا ، تم استزراع أحاديات الطبقة من خلايا الورم الأرومي الدبقي فوق الأقطاب الكهربائية للتحقيق في الظواهر في المختبر. كخطوة وسيطة ، تم تطوير نموذج في البويضات حيث تم تطعيم كرويات الورم المهندسة في الغشاء الجنيني للسمان. بسبب عدم وجود جهاز مناعي ، أدى ذلك إلى أورام شديدة الأوعية الدموية. في هذه المرحلة المبكرة من التطور ، ليس للأجنة جهاز مناعي ، ولا يتم التعرف على الأورام كأجسام غريبة. وبالتالي ، يمكن أن تتطور بسرعة أثناء تطوير الأوعية الخاصة بهم من نظام الأوعية الدموية الجنيني الحالي ، والذي يمثل نموذجا ثمينا للسرطان 3D. أخيرا ، تم تقييم توصيل القطب المرن ل PEFs في كائن حي كامل مع نظام مناعي وظيفي ، باستخدام نموذج فأر اصطناعي ، orthograft (داخل الجمجمة). تم تطعيم كرويات الورم في دماغ الفئران الفلورية متعددة الجينات قبل زرع أجهزة القطب العضوي المرنة. مكنت نافذة الجمجمة المغلقة من التصوير متعدد الفوتونات للورم وبيئته المكروية أثناء العلاج ب PEFs على مدى عدة أسابيع.
Introduction
الورم الأرومي الدبقي متعدد الأشكال (GBM) هو ورم شديد التوغل وبالتالي يصعب القضاء عليه بالعلاجات القياسية مثل الاستئصال والعلاج الإشعاعي والعلاج الكيميائي. على الرغم من العلاجات متعددة الوسائط ، لا يزال التشخيص سيئا للغاية ويعاني معظم المرضى من تطور المرض في غضون عام واحد من التشخيص 1,2. في الآونة الأخيرة ، أظهر تطوير العلاجات الكهربائية الحيوية إمكانات كبيرة لتحسين العلاجات الحالية. تستخدم هذه العلاجات توصيل المجالات الكهربائية النبضية (PEF) ، عادة في جلسة علاج واحدة ، لتعطيل سلامة الغشاء الخلوي والبيئة المكروية للأورام. يمكن أن يكون اضطراب غشاء الخلية هذا ، المعروف أيضا باسم التثقيب الكهربائي ، قابلا للعكس أو لا رجعة فيه اعتمادا على شدة المجال الكهربائي وعدد النبضات. يتم تطبيق التثقيب الكهربائي الذي لا رجعة فيه (IRE) كتقنية استئصال الأنسجة غير الحرارية التي تسبب فيها النبضات الكهربائية أضرارا قاتلة للأغشية الخلوية مما يؤدي إلى موت الخلايا3. يتم تطبيق التثقيب الكهربائي العكسي في العلاج الكيميائي الكهربائي (ECT) ، وهي تقنية راسخة تتكون من توصيل PEFs بالاشتراك مع أدوية العلاج الكيميائي لتعزيز امتصاص الدواء في الخلايا السرطانية4. علاوة على ذلك ، أظهرت الدراسات الحديثة التثقيب الكهربائي للكالسيوم كبديل للعلاج بالصدمات الكهربائية بكفاءة عالية لعلاج السرطان ، وهو أيضا غير مكلف ويؤدي إلى آثار جانبية أقل5. على الرغم من هذه التطورات الواعدة ، يتم تطبيق PEFs بشكل عام باستخدام أقطاب كهربائية معدنية صلبة من المعروف أنها تسبب أضرارا للأنسجةالرخوة 6. الدماغ حساس بشكل خاص لمثل هذه الأجهزة الغازية حيث يؤدي عدم التطابق الميكانيكي إلى حدوث التهاب وتندب نجمي7.
في هذا السياق ، يتم تقديم نظام توصيل PEF مرن بالاشتراك مع نماذج 3D لأورام الورم الأرومي الدبقي ، من التصنيع الدقيق إلى نموذج الفئران. تصنع الأقطاب الكهربائية المطابقة بعمليات تصنيع دقيقة قياسية للأغشية الرقيقة ، بما في ذلك استخدام مواد ناعمة ومتوافقة حيويا مثل parylene-C والذهب و PEDOT: PSS 8,9. يتم استخدام تصميم القطب المقسم لتغطية مساحة سطح كبيرة مع الحفاظ على الشفافية الكافية للتصوير بين أصابع القطب10. بالنسبة لنموذج الورم ، يتم إنتاج كرويات ثلاثية الأبعاد لخلايا الورم الأرومي الدبقي التي تعبر عن مراسل مضان مشفر وراثيا باستخدام تباين في طريقة لوحة 96 بئرا المتراكبةالسائلة 11. يتم تطعيم الكرات في الغشاء المشيمي لجنين السمان ، مما ينتج عنه نموذج في البويضة تم استخدامه على نطاق واسع لدراسة تكوين الأوعية أو علم السموم الدوائية12،13. يمكن تطعيم الأورام والأوعية الدموية بواسطة الأوعية الدموية للجنين في غياب جهاز المناعة في هذه المرحلة من التطور الجنيني12. ثم يتم وضع أقطاب كهربائية مرنة فوق الورم الوعائي لدراسة تأثير توصيل PEF على الكرة الأرضية والأوعية الدموية. أخيرا ، يتم التحقيق في هذه التأثيرات على كائن حي كامل ، بما في ذلك البيئة المكروية للورم والجهاز المناعي ، عن طريق زرع كرويات مهندسة في حمة الدماغ لنماذجالفئران 14. يتم وضع أقطاب كهربائية مرنة أعلى موقع الإدخال ويتم إغلاق حج القحف بنافذة زجاجية ، مما يسمح بالتصوير المتكرر ثنائي الفوتون على مدار عدة أسابيع.
ستكون هذه الطرق مفيدة للأشخاص المهتمين بمجالات مختلفة تتراوح من هندسة الإلكترونيات الدقيقة إلى تطبيقات الأورام. يمكن استخدام بروتوكول التصنيع الدقيق وتكييفه لأي تطبيق يتطلب أقطاب معدنية رقيقة مغلفة ب PEDOT: PSS. علاوة على ذلك ، فإن النماذج البيولوجية التي تم تطويرها لتقييم العلاجات الكهربائية المضادة للأورام ستكون ذات أهمية عامة للتحقيق في تمايز الاستجابة الخلوية والأوعية الدموية والمناعية للمواد المزروعة.
Protocol
تم تنفيذ جميع الإجراءات التجريبية وفقا للتشريع الفرنسي ووفقا لتوجيه مجلس الجماعة الأوروبية المؤرخ 24 نوفمبر 1986 (86/609 / EEC) لرعاية واستخدام المختبر. تم ترخيص البحث على الحيوانات من قبل إدارة الخدمات Vétérinaires des Bouches-du-Rhône وتمت الموافقة عليه من قبل اللجنة الأخلاقية في بروفانس كوت دازور (Apafis # 22689-2019100414103054).
1. التصنيع الدقيق للجهاز المرن (الشكل 1)
- تنظيف الشرائح الزجاجية
- ينزلق زجاج Sonicate في محلول صابون 2٪ لمدة 15 دقيقة. شطفها بالماء.
- Sonicate مرة أخرى في مزيج من 80 ٪ من الأسيتون النقي و 20 ٪ من الأيزوبروبانول النقي لمدة 15 دقيقة.
تنبيه: هذه المذيبات ضارة وقابلة للاشتعال. ارتد معدات الحماية الشخصية (PPE) وتعامل معها تحت غطاء الدخان. - شطف الشرائح مع الأيزوبروبانول وجفف بمسدس الهواء.
ملاحظة: تأكد من أن الأسيتون لا يجف على الركائز أثناء العملية برمتها.
- نقش قطب كهربائي ذهبي (الشكل 1 أ)
- قم بإيداع طبقة 3 ميكرومتر من الباريلين-C (PaC) بنظام ترسيب الباريلين (الشكل 1Aa).
- ضع الشرائح الزجاجية النظيفة في غرفة الترسيب. رش الصابون على المبرد ، واتركه يجف ، وأدخله في المصيدة الباردة المخصصة لنظام الترسيب. يسهل هذا المضاد للالتصاق سهولة إزالة PaC من المبرد بعد الترسيب.
تنبيه: PaC مهيج ويشكل خطرا على الصحة. ارتداء القفازات أثناء التعامل معها. - تزن 6 جم من PaC في قارب من الألومنيوم ووضعه في الفرن. قم بإخلاء الماكينة (P = 10 mTorr) وابدأ الترسيب بالمعلمات التالية: TChiller = -100 °C ، TFurnace = 690 °C ،T Vaporizer = 175 °C ، و TChamber = 135 °C.
- عند الانتهاء من الترسيب ودرجة حرارة المرذاذ أقل من 40 درجة مئوية ، قم بإيقاف تشغيل المبرد والمبخر والفرن. تنفيس الجهاز وجمع العينات.
- ضع الشرائح الزجاجية النظيفة في غرفة الترسيب. رش الصابون على المبرد ، واتركه يجف ، وأدخله في المصيدة الباردة المخصصة لنظام الترسيب. يسهل هذا المضاد للالتصاق سهولة إزالة PaC من المبرد بعد الترسيب.
- تنشيط سطح العينات عن طريق معالجة بلازما الأكسجين لمدة 30 ثانية (100 واط ، 50 سم مكعب).
- قم بتغطية العينات المعالجة بالبلازما بمقاومة ضوئية سلبية عند 1000 × جم لمدة 40 ثانية. ضع العينات على طبق ساخن عند 110 درجة مئوية لمدة 2 دقيقة (الشكل 1Ab).
تنبيه: المحلول المقاوم للضوء قابل للاشتعال ويسبب تهيجا. ارتداء معدات الوقاية الشخصية والتعامل معها تحت غطاء الدخان. - ضع مرشح i-line في خط شعاع مصفف الاتصال واسع النطاق للأشعة فوق البنفسجية وفضح مقاومة الضوء من خلال قناع يتميز بتصميم القطب المتقاطع (الشكل 1Ac).
ملاحظة: تم تصميم أقطاب كهربائية متداخلة بفجوة 50 أو 250 ميكرومتر باستخدام محرر تخطيط وتم طلب أقنعة ضوئية من شركة تنتج أقنعة ضوئية من البوليستر عن طريق التصوير الضوئي بالليزر. - تخبز العينات المذكورة أعلاه على حرارة 110 درجة مئوية على طبق ساخن لمدة 3 دقائق وتترك لتبرد إلى درجة حرارة الغرفة لمدة 5 دقائق. اغمر العينات في مطور خال من الأيونات المعدنية لمدة 3 دقائق لإزالة مقاومة الضوء غير المكشوفة. شطف العينات بالماء وتجفيفها بمسدس هوائي (الشكل 1Ad).
تنبيه: حل المطور هو مصدر إزعاج. ارتداء معدات الوقاية الشخصية ومقبض تحت غطاء الدخان. - تنشيط سطح العينات عن طريق معالجة بلازما الأكسجين لمدة 60 ثانية (100 واط ، 50 sccm).
- قم بإيداع طبقة التصاق 20 نانومتر من الكروم وطبقة 300 نانومتر من الذهب مع مبخر حراري على النحو التالي (الشكل 1Ae).
- قم بتنفيس آلة المبخر وقم بقص العينات (متجهة لأسفل) على اللوحة المستديرة العلوية بمسامير معدنية. املأ البوتقات المخصصة ، على التوالي ، بالكروم والذهب. قم بإغلاق وإخلاء الماكينة للوصول إلى ضغط أقل من 5 · 10-6 Torr. ابدأ دوران حامل العينة.
- حدد البوتقة التي تحتوي على الكروم وقم بزيادة التيار الذي يمر عبرها ببطء حتى يتم الوصول إلى معدل ترسيب 0.2 Å · s-1 . افتح الغالق وانتظر حتى يتم ترسيب 20 نانومتر من الكروم. أغلق الغالق وقم بخفض التيار ببطء حتى 0 مللي أمبير.
- حدد البوتقة التي تحتوي على الذهب وقم بزيادة التيار الذي يمر بها ببطء حتى يتم الوصول إلى معدل ترسب 0.2 Å · s-1 . افتح الغالق لتبخير الذهب ، وانتظر حتى يتم ترسيب 10 نانومتر من الذهب ، ثم قم بزيادة معدل الترسيب إلى 1.5 Å · s-1 حتى يتم ترسيب 300 نانومتر تقريبا. أغلق الغالق وقم بخفض التيار ببطء إلى 0 مللي أمبير.
- دع العينات تبرد إلى درجة حرارة الغرفة لمدة 15 دقيقة بعد الترسب. أوقف دوران حامل العينة ، وقم بتهوية الجهاز ، واجمع العينات.
- اغمر العينات في دورق مع الأسيتون. ضع الدورق على صفيحة اهتزاز مضبوطة عند 110 دورة في الدقيقة لمدة 15 دقيقة لرفع المقاومة للضوء. شطف العينات مع الأيزوبروبانول وتجفيفها بمسدس الهواء (الشكل 1Af).
- تنشيط سطح العينات عن طريق معالجة بلازما الأكسجين لمدة 30 ثانية (100 واط ، 50 سم مكعب).
- قم بإيداع طبقة عازلة 3 ميكرومتر من PaC بنظام ترسيب الباريلين (انظر الخطوة 1.2.1) (الشكل 1Ag).
- قم بإيداع طبقة 3 ميكرومتر من الباريلين-C (PaC) بنظام ترسيب الباريلين (الشكل 1Aa).
- افتتاح المخطط التفصيلي (الشكل 1 ب)
- قم بتغطية العينات بمقاومة ضوئية موجبة عند 600 × جم لمدة 35 ثانية. ضعه على طبق ساخن على حرارة 110 درجة مئوية لمدة 2 دقيقة (الشكل 1 ب).
تنبيه: المحلول المقاوم للضوء قابل للاشتعال ويسبب تهيجا. ارتداء معدات الوقاية الشخصية ومقبض تحت غطاء الدخان. - تأكد من عدم وجود مرشح i-line في خط الشعاع الخاص بمحاذاة الاتصال ذات النطاق العريض للأشعة فوق البنفسجية وفضح المقاومة للضوء من خلال قناع يتميز بمخطط الجهاز باستخدام مصفف اتصال واسع النطاق للأشعة فوق البنفسجية (الشكل 1Bb).
- اغمر العينات في مطور خال من الأيونات المعدنية لمدة 4 دقائق لإزالة مقاومة الضوء المكشوفة. شطف العينات بالماء وتجفيفها بمسدس هوائي (الشكل 1 قبل الميلاد).
- احفر المخطط التفصيلي عبر طبقتين من PaC باستخدام محفور أيوني تفاعلي (160 واط ، 22 دقيقة ، O2: 50 sccm ، CF4: 10 sccm) (الشكل 1Bd).
- قم بإزالة مقاومة الضوء المتبقية باستخدام الأسيتون ، واشطفها باستخدام الأيزوبروبانول ، وجفف العينات بمسدس هوائي.
- قم بتغطية العينات بمقاومة ضوئية موجبة عند 600 × جم لمدة 35 ثانية. ضعه على طبق ساخن على حرارة 110 درجة مئوية لمدة 2 دقيقة (الشكل 1 ب).
- PEDOT: طلاء PSS (الشكل 1C)
- قم بتغطية محلول صابون بنسبة 2٪ عند 70 × جم لمدة 35 ثانية (الشكل 1 ج).
- قم بإيداع طبقة قربانية 3 ميكرومتر من PaC بنظام ترسيب الباريلين (انظر الخطوة 1.2.1) (الشكل 1Cb).
- مقاومة للضوء إيجابية بطبقة دوارة عند 600 × جم لمدة 35 ثانية. ضع العينات على طبق ساخن عند 110 درجة مئوية لمدة 2 دقيقة (الشكل 1 سم مكعب).
- تأكد من عدم وجود مرشح i-line في خط شعاع مصفف الاتصال واسع النطاق للأشعة فوق البنفسجية وفضح مقاومة الضوء من خلال قناع يتميز بالسطح النشط للأقطاب الكهربائية (الشكل 1Cd).
- اغمر العينات في مطور خال من الأيونات المعدنية لمدة 4 دقائق لإزالة مقاومة الضوء المكشوفة. شطف العينات بالماء وتجفيفها بمسدس هوائي (الشكل 1Ce).
- احفر PaC باستخدام محفور أيون تفاعلي لفتح السطح النشط للأقطاب الكهربائية (160 واط ، 24 دقيقة ، O2: 50 sccm ، CF4: 10 sccm). تحقق باستخدام المجهر من عدم وجود PaC متبقي على السطح النشط (الشكل 1Cf).
- إزالة photoresist المتبقية مع الأسيتون ، شطف مع الأيزوبروبانول وتجفيف العينات مع بندقية الهواء.
- تنشيط سطح العينات باستخدام معالجة بلازما الأكسجين لمدة 90 ثانية (100 واط ، 50 sccm).
- امزج التشتت التجاري ل PEDOT: PSS المبلمر كيميائيا مع 5٪ من جلايكول الإيثيلين (EG) ، و 0.1٪ من حمض دوديسيل بنزين السلفونيك (DBSA). سونيكات لمدة 15 دقيقة. أضف 1٪ بالوزن من (3-غليسيديل أوكسي بروبيل) ثلاثي ميثيل سيلوكسان (GOPS) وسونيكات لمدة 5 دقائق. قم بتصفية المحلول من خلال مرشح 1.2 ميكرومتر.
تنبيه: EG مهيج ويشكل خطرا على الصحة. DBSA هو مهيج وتآكل. GOPS هو تآكل. ارتد معدات الوقاية الشخصية المناسبة وتعامل مع هذه المواد الكيميائية تحت غطاء الدخان.
ملاحظة: يعتمد الحجم الإجمالي على عدد العينات. بالنسبة إلى 10 شرائح زجاجية قياسية ، قم بإعداد 20 مل على الأقل تتوافق مع الكميات التالية: 18.78 مل من PEDOT: PSS ، 1 مل من EG ، 20 ميكرولتر من DBSA ، و 200 ميكرولتر من GOPS. - قم بتغطية أربع طبقات من PEDOT: محلول PSS عند 150 × جم لمدة 35 ثانية. بعد ترسب كل طبقة ، اخبز العينات على حرارة 110 درجة مئوية لمدة 60 ثانية على طبق ساخن وقم بتبريدها إلى درجة حرارة الغرفة لمدة 5 دقائق قبل تدوير الطبقة التالية (الشكل 1Cg).
- قم بإزالة طبقة PaC القربانية عن طريق غمر العينات في الماء (الشكل 1Ch).
- اخبز العينات على حرارة 140 درجة مئوية لمدة 1 ساعة.
- اغمر العينات في ماء منزوع الأيونات لمدة 30 دقيقة لإزالة الصابون المتبقي والمركبات منخفضة الوزن الجزيئي في فيلم PEDOT: PSS وفصل العينات عن الركيزة الزجاجية (الشكل 1Ci).
- التوصيلات والتعبئة والتغليف (الشكل 1 د)
- قم بإيداع طبقة رقيقة من طلاء الأكريليك على فيلم بوليميد مطلي بالنحاس (الشكل 1 دا). استخدم الهباء الجوي للحصول على طبقة متجانسة من الطلاء (الشكل 1 ديسيبل).
- قم بنقش طلاء الأكريليك بالليزر (75 كيلو هرتز ، 7 واط ، 1 تمريرة ليزر ، 400 مم · ثانية -1) للحصول على وسادتي تلامس مستطيلتين (5 مم × 15 مم ؛ فجوة 1.5 مم) (الشكل 1 تيار مستمر).
- احفر النحاس الرطب بكلوريد الحديديك المشبع بنسبة 30٪ (وزن / حجم) (FeCl3) في الماء لمدة 15 دقيقة عند 40 درجة مئوية (الشكل 1Dd).
تنبيه: FeCl3 مهيج ومسبب للتآكل. تعامل معها بالقفازات تحت غطاء الدخان. - قم بتجريد طلاء الأكريليك بالأسيتون عن طريق فركه قليلا بقطعة قماش (الشكل 1De).
- قم بقص فيلم البوليميد المزخرف إلى أشكال مستطيلة (15 مم × 30 مم) باستخدام الليزر (15 كيلو هرتز ، 10 واط ، 30 تمريرة ليزر ، 130 مم · ثانية -1) (الشكل 1Df).
- قم بتوزيع معجون الفضة بآلة توزيع ثلاثية المحاور عند ضغط ثلاثة قضبان بإبرة قطرها 330 ميكرومتر (5 م · دقيقة -1) (الشكل 1Dg).
تنبيه: معجون الفضة مهيج. التعامل مع القفازات. - قم بمحاذاة وإرفاق مسبار PaC مع فيلم polyimide تحت مجهر مجهر باستخدام ملاقط (الشكل 1Dh).
ملاحظة: يمكن نقش علامات المحاذاة في الخطوة 1.5.2 لتسهيل وضع المسبار على وسادات التماس. - تخبز على حرارة 140 درجة مئوية لمدة 2 ساعة في الفرن.
- ضع شريط حماية بوليميد 1 سم2 على وسادات التلامس (الشكل 1Di).
- اغمس الواجهة حيث يتم توصيل مسبار PaC وفيلم polyimide في PDMS (الشكل 1Dj).
- اخبزيها لمدة 2 ساعة على حرارة 50 درجة مئوية.
- قم بإزالة شريط الحماية لفتح وسادات التلامس (الشكل 1Dk).
ملاحظة: التصنيع الدقيق للأجهزة في المختبر مشابه ولكن يجب تخطي الخطوات 1.2.1 و 1.3 و 1.5.
2. توليد خط الخلية المستقرة GCaMP6f الورم الأرومي الدبقي
- إنتاج فيروس لينتي
- في دورق 75 سم² ، قم بزراعة خط خلية مشتق من HEK 293T محسن لإنتاج فيروس العدس في 10 مل من وسط النسر المعدل من Dulbecco (DMEM) يحتوي على 4.5 جم · L-1 من الجلوكوز ، L- الجلوتامين ، بيروفات الصوديوم ، وبيكربونات الصوديوم ومكمل مع 10٪ مصل بقري جنيني خال من التتراسيكلين (FBS) ، 100 وحدة · mL-1 من البنسلين و 100 ميكروغرام · mL-1 من الستربتومايسين لمدة 3 أيام على الأقل حتى التقاء 80٪.
- قم بإزالة الوسط من القارورة. اشطف الخلايا برفق ب 10 مل من محلول ملحي مخزن بالفوسفات (PBS).
- أضف 1 مل من محلول التربسين / EDTA 0.25٪ واحتضان القارورة لمدة 5 دقائق عند 37 درجة مئوية.
تنبيه: يشكل محلول التربسين / EDTA خطرا على الصحة. ارتداء معدات الوقاية الشخصية ومقبض تحت غطاء الدخان. - أضف 8 مل من وسط الاستزراع. اغسل تعليق الخلية برفق.
- عد الخلايا واللوحة 4 × 106 خلايا في طبق بتري في 8 مل من وسط الاستزراع.
- في اليوم التالي ، قم بتخفيف 25 ميكروغرام من البلازميد الذي يحتوي على الجين GCaMP6f وعلامة اختيار تمنح مقاومة للبوروميسين في حجم إجمالي قدره 600 ميكرولتر من الماء. إضافته إلى أنبوب كاشف النقل. دوامة لمدة 10 ثوان عند 3000 دورة في الدقيقة واحتضان الأنبوب في درجة حرارة الغرفة لمدة 10 دقائق للسماح بإنتاج الجسيمات النانوية.
- أضف محتويات الأنبوب بالتنقيط على ثقافة خلايا HEK 293 T واهزها برفق باليد. احتضان الخلايا عند 37 درجة مئوية لمدة 4 ساعات على الأقل.
- استبدل الوسائط التي تحتوي على معقدات الجسيمات النانوية بوسائط جديدة وأعد الخلايا عند 37 درجة مئوية.
- بعد ثلاثة أيام ، اجمع المادة الطافية وأجهزة الطرد المركزي عند 500 × جم لمدة 10 دقائق لإزالة الحطام الخلوي. جمع المرحلة السائلة التي تحتوي على جزيئات فيروسية.
ملاحظة: يمكن تأكيد إنتاج الفيروس في المادة الطافية باستخدام اختبار عيار عدسي فيروسي كمي ويمكن تخزينه عند -80 درجة مئوية لمدة 2 سنوات على الأقل.
- نقل خلايا الورم الأرومي الدبقي
- في دورق 75 سم² ، خلايا الورم الأرومي الدبقي المزروعة في 10 مل من DMEM تحتوي على 1 جم · L-1 من الجلوكوز ، L-الجلوتامين ، بيروفات الصوديوم ، وبيكربونات الصوديوم ومكمل مع 10٪ FBS خالية من التتراسيكلين ، 100 وحدة · mL-1 من البنسلين ، و 100 μg · mL-1 من الستربتومايسين لمدة 4 أيام على الأقل.
- تخلص من الوسط وأضف المادة الطافية التي تم الحصول عليها في الخطوة 2.1.9 على الخلايا المستهدفة.
- أضف 5 ميكروغرام · مل -1 من بروميد هيكساداميثرين في الوسط لتحسين التنبيغ. احتضان لمدة 6 ساعات عند 37 درجة مئوية. استبدل الوسط ب 10 مل من الوسط الطازج.
تنبيه: بروميد هيكساداميثرين مهيج. تعامل معها بالقفازات.
- توليد خط خلية مستقر
- بعد يومين إلى ثلاثة أيام من التنبيغ ، أضف 10 مل من DMEM تحتوي على 1 جم · L-1 من الجلوكوز ، L- الجلوتامين ، بيروفات الصوديوم ، وبيكربونات الصوديوم ، 10 ٪ FBS ، 100 وحدة · مل -1 من البنسلين ، 100 ميكروغرام · مل -1 من الستربتومايسين وتستكمل مع بوروميسين لقتل الخلايا غير المحولة. خلايا الثقافة في هذه الوسائط لمدة 3 أيام على الأقل.
تنبيه: بورومايسين مهيج. التعامل معها بالقفازات.
ملاحظة: يجب اختبار حساسية الخلايا للبوروميسين قبل النقل عن طريق زراعة الخلايا في وسطها الموصى به الذي يحتوي على تركيزات مختلفة من البوروميسين. بعد يوم واحد ، تحقق من الخلايا باستخدام المجهر. اختر التركيز الكافي الذي تكون فيه غالبية الخلايا ميتة ولكن القليل منها لا يزال على قيد الحياة ، للتأكد من أن المضاد الحيوي ليس ساما للغاية وقد يقتل الخلايا المنقولة أيضا. - إزالة الوسط وشطف الخلايا مع 10 مل من برنامج تلفزيوني.
- أضف 1 مل من 0.25٪ من محلول التربسين / EDTA واحتضان القارورة لمدة 5 دقائق عند 37 درجة مئوية.
- أضف 8 مل من وسط الاستزراع. اغسل تعليق الخلية برفق.
- اجمع 100 ميكرولتر من معلق الخلية وقم بقياس تركيز الخلية باستخدام عداد الخلية. نضح 50 ميكرولتر من تعليق الخلية في عداد خلايا آلي محمول باليد مع مستشعر 60 ميكرومتر.
- بذرة 1 خلية / بئر في لوحة 96 بئر. على سبيل المثال ، لتركيز 1 × 10 3 خلايا لكل مل ، أضف 1 / (1 × 103) ، أي 0.001 مل من تعليق الخلية لكل بئر. بذر كل بئر لزيادة فرص النجاح. كاملة مع وسط الاستزراع للوصول إلى حجم إجمالي قدره 200 ميكرولتر لكل بئر.
- بعد يوم واحد ، ابحث عن كل بئر يحتوي على خلية واحدة وتحقق من مضانها (λexc = 490 نانومتر و λem = 530 نانومتر). ضع علامة على الآبار التي تحتوي على خلية واحدة فقط منقولة. استمر في النمو لبضعة أيام حتى يقترب البئر من التقاء.
- تخلص من الوسط وشطف الخلايا ب 200 ميكرولتر من برنامج تلفزيوني. أضف 100 ميكرولتر من محلول التربسين / EDTA 0.25٪ واحتضان الصفيحة المكونة من 96 بئرا لمدة 5 دقائق عند 37 درجة مئوية.
- أضف 100 ميكرولتر من الوسط واغسل تعليق الخلية برفق. نقل تعليق الخلية في طبق بتري. أضف 5 مل من الوسط واترك الخلايا تنمو لبضعة أيام حتى يصبح طبق بتري متداخلا تقريبا.
- تخلص من الوسط وشطف الخلايا ب 5 مل من برنامج تلفزيوني. أضف 1 مل من محلول التربسين / EDTA 0.25٪ واحتضن طبق بتري لمدة 5 دقائق عند 37 درجة مئوية.
- أضف 6 مل من المتوسط واغسل تعليق الخلية برفق. انقل تعليق الخلية إلى قارورة T25. استمر في النمو لبضعة أيام حتى تكاد القارورة متقاربة.
- تخلص من الوسط وشطف الخلايا ب 5 مل من برنامج تلفزيوني. أضف 1 مل من محلول التربسين / EDTA بنسبة 0.25٪ واحتضن دورق T25 لمدة 5 دقائق عند 37 درجة مئوية. أضف 7 مل من DMEM تحتوي على 1 جم · L-1 من الجلوكوز ، L- الجلوتامين ، بيروفات الصوديوم ، وبيكربونات الصوديوم ، وتستكمل مع 10 ٪ FBS ، 100 وحدة · مل-1 من البنسلين ، و 100 ميكروغرام · مل -1 من الستربتومايسين. اغسل تعليق الخلية برفق.
- قسم معلق الخلية إلى أربع قوارير T25 (2 مل لكل دورق) وأضف 5 مل من الوسط إلى كل دورق. دع الخلايا تنمو لبضعة أيام حتى تكاد تكون القوارير متقاربة.
- كرر الخطوة 2.3.12 لثلاث قوارير واحتفظ بالدورق الأخير للخطوة 3.1.3. انقل تعليق الخلية في أنبوب مخروطي سعة 15 مل وجهاز طرد مركزي عند 150 × جم لمدة 5 دقائق. تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 900 ميكرولتر. امزج الخلايا برفق للحفاظ على تعليق خلية متجانس.
- نقل تعليق الخلية إلى قوارير التخزين المبردة. أضف 100 ميكرولتر من ثنائي ميثيل سلفوكسيد. ضع المبردات على حرارة -80 درجة مئوية طوال الليل. نقل الخلايا المجمدة إلى النيتروجين السائل لمزيد من التجارب.
ملاحظة: يمكن تقييم كفاءة النقل عن طريق إضافة 5 ميكرومتر من ملح الكالسيوم الأيونوميسين في الوسط والتحقق من الزيادة المستحثة للتألق تحت مجهر مضان (λexc = 490 نانومتر و λem = 530 نانومتر).
- بعد يومين إلى ثلاثة أيام من التنبيغ ، أضف 10 مل من DMEM تحتوي على 1 جم · L-1 من الجلوكوز ، L- الجلوتامين ، بيروفات الصوديوم ، وبيكربونات الصوديوم ، 10 ٪ FBS ، 100 وحدة · مل -1 من البنسلين ، 100 ميكروغرام · مل -1 من الستربتومايسين وتستكمل مع بوروميسين لقتل الخلايا غير المحولة. خلايا الثقافة في هذه الوسائط لمدة 3 أيام على الأقل.
نماذج 3.3D
- ثقافة كروية
- تحضير محلول من 1٪ (وزن / حجم) أغاروز في الماء منزوع الأيونات (DI).
- أضف 100 غرام من مسحوق الأغاروز في 100 مل من ماء DI وقم بتسخين المحلول في فرن الميكروويف حتى يذوب كل المسحوق. حرك المحلول بانتظام لتجنب التكتلات. الأوتوكلاف الحل لمدة 20 دقيقة عند 120 درجة مئوية.
- بمجرد استرجاعها من الأوتوكلاف ، أضف 75 ميكرولتر من محلول الأغاروز لكل بئر في لوحة 96 بئر بعناية. قم بإيداعه على جانب البئر لتشكيل الغضروف المفصلي ، مما ينتج عنه قاع دائري غير ملتصق. اتركه يتجمد لمدة 15 دقيقة في درجة حرارة الغرفة.
- افصل الخلايا (الخطوة 2.3.12) عن القارورة التي تم الحصول عليها في الخطوة 2.3.14.
- أضف 10000 خلية لكل بئر من خلايا الورم الأرومي الدبقي واستكملها للوصول إلى حجم إجمالي قدره 150 ميكرولتر لكل بئر مع DMEM يحتوي على 1 جم · L-1 من الجلوكوز ، L- الجلوتامين ، بيروفات الصوديوم ، وبيكربونات الصوديوم ، وتستكمل مع 10 ٪ مصل البقر الجنيني (FBS) ، 100 وحدة · مل -1 من البنسلين و 100 ميكروغرام · مل -1 من الستربتومايسين.
- احتضان الخلايا عند 37 درجة مئوية دون تحريك اللوحة لمدة 3 أيام. ثم استبدل نصف الوسائط بوسائط جديدة كل 2 أيام مع ماصة متعددة القنوات حتى مزيد من التجارب. احتفظ بطرف الماصة في الجزء العلوي من البئر لتجنب تلف الأغاروز أو الكروي نفسه.
ملاحظة: يعتمد حجم الحلقات الكروية على عدد الخلايا المصنفة وخط الخلية ، لذلك يجب تكييفها اعتمادا على التجارب.
- تحضير محلول من 1٪ (وزن / حجم) أغاروز في الماء منزوع الأيونات (DI).
- نموذج في البيض
- ضع البيض المخصب من السمان الياباني (C. japonica) في حاضنة (37 درجة مئوية ورطوبة 57٪) على صواني ذات دوار أوتوماتيكي يقلب البيض كل 2 ساعة. يعتبر هذا اليوم يوما جنينيا (ED) 0.
- اغسل قوارب الوزن البلاستيكية بوضعها في 70٪ (وزن / حجم) من الإيثانول. أخرج قوارب الوزن وجففها تحت غطاء الدخان.
ملاحظة: من هذه النقطة ، لا يتم إجراء التجارب في ظروف معقمة. ومع ذلك ، هناك حاجة إلى ظروف نظيفة لتجنب تطور العفن على الأجنة. - في ED3 ، افتح البيض برفق باستخدام ملقط بأطراف رفيعة مغسولة مسبقا بنسبة 70٪ (وزن / حجم). صب الجنين في وعاء وزن بلاستيكي ، وقم بتغطيته بقارب وزن آخر وضعه في حاضنة مرطبة قياسية عند 37 درجة مئوية لمدة 3 أيام.
- في ED6 ، قم بعمل شق صغير في الغشاء المشيمي الولعي (CAM) بإبرة 23 جرام.
- باستخدام ماصة ، ضع كرويا لمدة 7 أيام على الشق ، وأعد الجنين إلى الحاضنة لمدة 3 أيام ، حتى يتم إجراء مزيد من التجارب.
ملاحظة: يمكن حقن صبغة فلورية في عين الجنين لتصور الأوعية الدموية. - في يوم التجربة ، ضع المسبار المرن فوق الورم الوعائي باستخدام مناور دقيق.
- ال in vivo نموذج
ملاحظة: هذا الجزء من البروتوكول مقتبس من الجزء المنشور سابقا كمرجع.14. تم استخدام الفئران الفلورية البالغة متعددة الألوان AMU-Neuroinflam (B6.Cg-Tg (Thy1-CFP) 23Jrs (Ly6a-EGFP) G5Dzk (Itgax-EYFP) 1Mnz / FD) ؛ تقدم هذه الفئران علامات على مجموعة فرعية من Thy1+ الخلايا العصبية عن طريق التعبير الوراثي ل ECFP ، ووضع العلامات على LyzM المحيطية+ الخلايا الالتهابية عن طريق التعبير المعدل وراثيا ل EGFP ووضع العلامات على نوع فرعي من الخلايا الدبقية الصغيرة التي تعبر عن EYFP تحت سيطرة Cd11c+. باختصار ، يتم تخدير الحيوانات قليلا مع 1.5 ٪ إيزوفلوران لمدة 2 دقيقة قبل أي علاج أو حقن. قبل الجراحة ، يتم تخدير الحيوانات بالكيتامين (120 ملغم / كغم ؛ IP) و Xylazine (12 مغ/كغ؛ IP). ثم ، يتم تطبيق 3 ٪ ليدوكائين هلام محليا لتخفيف أي ألم في الأذنين المرتبطة بتثبيت الدعم التجسيمي. ثم ، يتم إعطاء محلول Bupivacaine بنسبة 0.25٪ إلى موقع الجراحة لتخفيف أي ألم بسبب حج القحف. بمجرد إعداد الفأر للجراحة ، تم إجراء حج القحف بقطر 4 مم وفقا للمرجع14. باستخدام إبرة 26 G ، تم عمل ثقب في الأم الجافية في منتصف حج القحف وتم حقن كروي الورم بنظام الحقن الموصوف في المرجع14. بالإضافة إلى ذلك ، كما هو موضح هنا ، تم وضع قطب كهربائي مرن على GCamp6 أو DsRed للتعبير عن كروي الورم قبل إغلاق حج القحف بنافذة زجاجية.- ضع قطرة من محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS) بحيث يغطي حج القحف. ضع القطب المرن على قطرة DPBS ، وضع الجزء الخلفي من المسبار برفق مع وسادات التلامس على ظهر الماوس (الشكل 4B).
ملاحظة: استخدم قفازات معقمة وتقنية "الطرف فقط". قم بتغيير القفازات إذا تم ملامسة سطح غير معقم. توفير الدعم الحراري أثناء هذا الإجراء. - المس قطرة DPBS بقطعة صغيرة من الورق لامتصاص DPBS حتى يتمكن المسبار من الاستلقاء على الجافية ومتابعة انحناء الدماغ. تأكد من بقاء طبقة صغيرة من DPBS أسفل الأقطاب الكهربائية دون الهروب من جانب القطب. هذا يضمن حاجزا ضد تسرب الغراء خلال الخطوات التالية.
ملاحظة: تعقيم جميع المعدات قبل الاستخدام. - ضع قطرة صغيرة من لاصق السيليكون على المسبار وقم بتغطيته بغطاء زجاجي دائري 5 مم. ادفع زجاج الغطاء لأسفل حتى يتم توزيع السيليكون بالتساوي وتكون المسافة بين زجاج الغطاء والمسبار ضئيلة. ادفع زجاج الغطاء لأسفل لمدة 30 ثانية أخرى حتى يتجمد السيليكون.
- لتأمين زجاج الغطاء ، ضع الغراء الفائق بسرعة على جوانبه وادفعه لأسفل حتى يشفى الغراء إلى صلب.
- باستخدام عود أسنان ، ضع الغراء الفائق على عنق المسبار مع الحرص على سحب الغراء الفائق أسفل الرقبة لتوفير دعم ثابت له.
- قم بتغطية الجمجمة بأسمنت الأسنان لبناء غطاء مزمن. احرص بشكل خاص على تغطية حواف زجاج الغطاء فقط.
- ارفع الجزء الخلفي من المسبار وضع الأسمنت أسفل عنق المسبار. ضع المسبار على الأسمنت قبل أن يعالج. ادفع عنق المسبار برفق باستخدام ملقط غير حاد بحيث يكون سطحه في نفس مستوى سطح زجاج الغطاء وليس في طريق هدف المجهر أثناء التجربة.
- قم بتغطية الجزء العلوي من عنق المسبار بما لا يزيد عن 1.5 مم من طبقة الأسمنت السنية لتحقيق قبضة قوية على المسبار. قم ببناء بئر أسمنت يقدم سلسلة من التلال بطول 1.5 مم على مسافة 1-2 مم حول زجاج الغطاء لإنشاء حوض لسائل الغمر للتصوير ثنائي الفوتون (الشكل 4C).
- بعد علاج الأسمنت ، ضع مسكنات البوبرينورفين بعد الجراحة (0.05 مجم / كجم ، 0.1 مل لكل 10 جم من وزن الجسم تحت الجلد) وحافظ على الحيوان في جو دافئ حتى يستيقظ. وهذا يشمل القرب من لمبة الأشعة تحت الحمراء وكذلك لف الحيوان في منشفة ورقية.
ملاحظة: ضع مقياس حرارة على مستوى الماوس لمراقبة درجة الحرارة. - تميز المعاوقة في نطاق 1-10 كيلو هرتز باستخدام الجهد.
- دع الحيوان يتعافى من الجراحة لمدة 10 أيام على الأقل. إدارة الأدوية المضادة للالتهابات مباشرة بعد الجراحة ومواصلة مراقبة حالة الحيوان لتوفير تسكين مناسب بعد الجراحة.
- ضع قطرة من محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS) بحيث يغطي حج القحف. ضع القطب المرن على قطرة DPBS ، وضع الجزء الخلفي من المسبار برفق مع وسادات التلامس على ظهر الماوس (الشكل 4B).
4. توصيل وتصوير المجال الكهربائي النبضي (PEF)
- ضع العينات تحت المجهر الفلوري. في حالة نماذج 3D ، لا يمكن ملاحظة الأورام إلا من الأعلى.
ملاحظة: بالنسبة لنموذج البويضات ، تم إجراء التجارب تحت مجهر التألق (ولكن ممكن أيضا باستخدام مجهر ثنائي الفوتون) ، بينما أجريت التجارب على النموذج في الجسم الحي تحت مجهر ثنائي الفوتون (الشكل 6). - قم بتوصيل مولد النبض بمنصات الاتصال الخاصة بالأجهزة ، باستخدام موصلات دبوس pogo (في المختبر) أو مقاطع التمساح (في البيض وفي الجسم الحي) (الشكل 4 أ). اضبط المعلمات المطلوبة (عدد النبضات ، الجهد ، مدة النبضة ، التردد) وقم بتطبيق PEFs عن طريق تشغيل المولد (الشكل 4 أ). قم بقياس التألق في وقت واحد لمراقبة تأثيرات PEFs في الوقت الفعلي.
النتائج
يسمح هذا البروتوكول بالتطبيق على نموذجين من الورم الأرومي الدبقي يتم فيهما دمج نظام توصيل PEF مرن. بعد خطوات التصنيع الدقيق والتعبئة ، يتم تمييز الأقطاب الكهربائية المرنة في محلول ملحي بواسطة التحليل الطيفي للمعاوقة الكهروكيميائية (EIS) لتقييم أدائها والتحقق من صحته. تظهر الأقطاب الكهربائية المطلية ب PEDOT: PSS المناطق النموذجية التي تهيمن عليها السعة والمقاومة مفصولة بتردد قطع ، بينما تعرض الأقطاب الكهربائية غير المطلية سلوكا سعويا فقط (الشكل 2).
يتم استخدام تباين في طريقة لوحة 96 بئر تراكب السائل لزراعة أورام 3D مصنوعة من خلايا الورم الأرومي الدبقي المنقولة بثبات معبرة عن مراسل الكالسيوم داخل الخلايا الفلورية. يمكن ملاحظة نمو الأجسام الكروية باستخدام مجهر المجال الساطع (الشكل 3 ؛ إد 0). هناك حاجة إلى ما لا يقل عن 2 أو 3 أيام للحصول على كروية كروية وكثيفة ، وهذا يتوقف على خط الخلية وعدد الخلايا المصنفة.
في نموذج البويضة ، يتم تطعيم الأجسام الكروية في الغشاء المشيمي الألانتوي لجنين السمان (الشكل 3 ؛ الشكل 3 ؛ إد 6). يمكن تقييم نجاح الكسب غير المشروع بواسطة الفحص المجهري الفلوري بعد بضعة أيام ، حيث تحتوي الخلايا الحية على الكالسيوم داخل الخلايا ، وبالتالي فهي فلورية (الشكل 3 ؛ إد 9). يمكن ملاحظة الأوعية الدموية للورم تحت المجهر الفلوري عن طريق حقن صبغة فلورية في الأوعية الدموية (الشكل 3 ؛ ED9). ومع ذلك ، قد لا يكون من الممكن دائما تصور الأوعية الدموية داخل الورم لأن الكرة الكروية كثيفة للغاية. يتم وضع الأقطاب الكهربائية المرنة المتداخلة فوق الورم الوعائي (الشكل 3; ED 9) ومتصلة بمولد النبض. يجب وضع المسبار برفق لتجنب نزيف الجنين ؛ خلاف ذلك ، يمكن أن تنتشر صبغة الفلورسنت ، مما يعيق أي ملاحظة عن طريق التصوير. يمكن التحقق من التوصيل الصحيح للنبضة إلى البيئة البيولوجية عن طريق قياس التيار الذي يمر عبر الدائرة. يسمح تصوير هذه النماذج في البويضات بالمراقبة في الوقت الفعلي لتأثير PEFs على الكالسيوم داخل الخلايا في ورم الورم الأرومي الدبقي 3D ، بالإضافة إلى تضيق الأوعية الناجم عن الأوعية الدموية للورم ، وتجنب أي تأثير لأنواع الخلايا الأخرى بما في ذلك الجهاز المناعي15.
يمكن أيضا إجراء دراسة تأثير PEF على الورم الأرومي الدبقي في نموذج أكثر اكتمالا وتنبؤا. في الواقع ، يتكون النموذج في الجسم الحي الموصوف أعلاه14 من تطعيم ورم أرومي دبقي ثلاثي الأبعاد في حمة الدماغ للفأر (الشكل 4). يتم توصيل موقع حقن الورم بواسطة حبة هيمي جل ديكستران متقاطعة ، لتلخيص القيود الفيزيائية الحيوية الفسيولوجية أثناء نمو الورم. على الرغم من وصفها في المرجع14 ، يجدر إعادة التأكيد على أنه من الأهمية بمكان أن يتم لصق حبة هيمي ديكستران بدقة على الأم الجافية. خلاف ذلك ، يمكن للورم الهروب من خلال الجافية المفتوحة وتغطية الدماغ بالكامل ، مما يجعل التصوير مستحيلا. بالنسبة لأي تصوير مزمن ، يشكل نمو الأنسجة الذي يحدث أثناء شفاء نافذة الجمجمة حاجزا خطيرا ، حيث أن الأنسجة الجديدة غير شفافة وتجعل الصور ضبابية أو غير قابلة للاستخدام. لذلك ، بعد إدخال حبة hemi ولصقها ، يجب إغلاق الجدران الجانبية لنافذة الجمجمة المفتوحة بطبقة رقيقة من superglue موضوعة بدقة في جميع أنحاء جدار التجويف ، دون ترك الغراء الفائق ينزلق أو يتدفق على الجافية. عندما يتم وضع المسبار المرن أعلى موقع حقن الورم ، لا يمكن أن تبقى أي فقاعات تحت المسبار ، لسببين. أولا ، لا يمكن أن يستمر التصوير عند وجود فقاعات. ثانيا ، تعمل الفقاعات كعوازل ، وبالتالي تغيير خصائص التحفيز الكهربائي. بعد اتخاذ الاحتياطات الموضحة أعلاه ، يتم إغلاق حج القحف بنافذة زجاجية مثبتة على الجمجمة للسماح بالتصوير المزمن على مدار أسابيع. نظرا لأن الورم يتكون من خلايا تعبير GCaMP أو DsRed ، يمكن تأكيد الحقن باستخدام مجهر مضان. يجب قياس المعاوقة الكهروكيميائية للأقطاب الكهربائية للتحقق من صحة الأداء بعد الزرع. بالمقارنة مع المعاوقة في المحلول الملحي ، من المتوقع زيادة المعاوقة في الجسم الحي عند ترددات أعلى من 100 هرتز بسبب وجود بيئة بيولوجية (الشكل 5). يمكن ملاحظة الحمة العصبية الوعائية وتسلل الورم وتمييزها من خلال الركيزة الشفافة على مدار أسابيع بواسطة المجهر ثنائي الفوتون (الشكل 6). يمكن أن يسمح استخدام الحيوانات المعدلة وراثيا التي تعبر عن البروتينات الفلورية في الخلايا ذات الأهمية (الخلايا المناعية والخلايا العصبية) ، على سبيل المثال ، بإظهار الحد الأدنى من العملية الالتهابية التي يسببها زرع القطب وحده (الشكل 6 أ) أو إظهار وجود الخلايا الدبقية الصغيرة والوحيدات بعد 26 يوما من زرع قطب كهربائي محفز PEF مزروع فوق ورم GBM المتنامي (الشكل 6B1 ). في الحالة الأخيرة ، تم العثور على كل من الخلايا المشتقة من الخلايا الطرفية والخلايا الدبقية الصغيرة المقيمة في الدماغ حول الورم وداخله (الشكل 6B2). في يوم تسليم PEF ، يمكن توصيل وسادات الاتصال للأقطاب الكهربائية المرنة بمولد النبض ، مباشرة تحت المجهر ثنائي الفوتون. بشكل عام ، يمكن استخدام هذا النموذج للتحقيق في تأثير العلاجات الكهربائية الحيوية بمرور الوقت باستخدام أنواع مختلفة من الخلايا المشاركة في تطور ورم المخ ، حتى عمق حوالي 500 ميكرومتر.
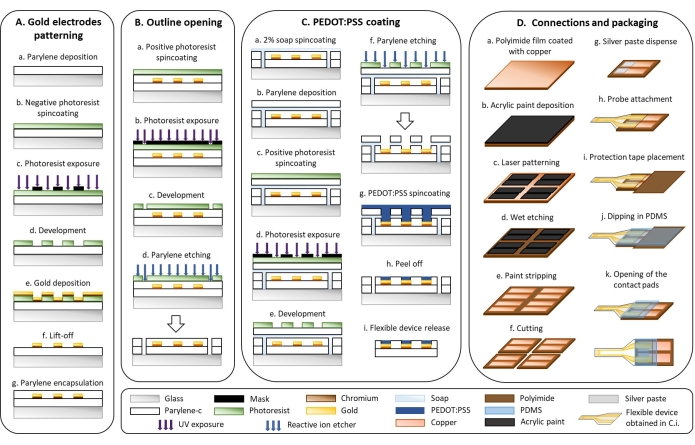
الشكل 1: التصنيع الدقيق للأقطاب الكهربائية المرنة . (أ) نقش قطب الذهب وركيزة الباريلين C. (ب) افتتاح المخطط التفصيلي. (ج) PEDOT: طلاء PSS. (د) التوصيلات والتعبئة والتغليف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
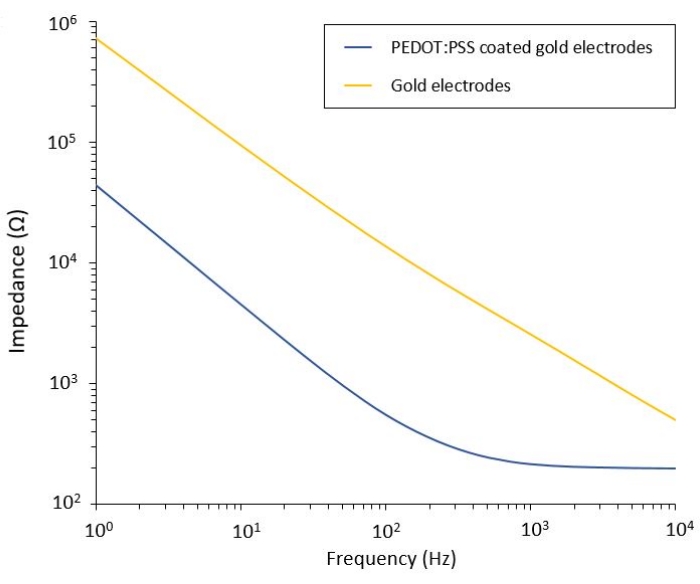
الشكل 2: التحليل الطيفي للمعاوقة الكهروكيميائية لأقطاب الذهب المرنة و PEDOT: أقطاب كهربائية باردة مغلفة ب PSS في محلول ملحي. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
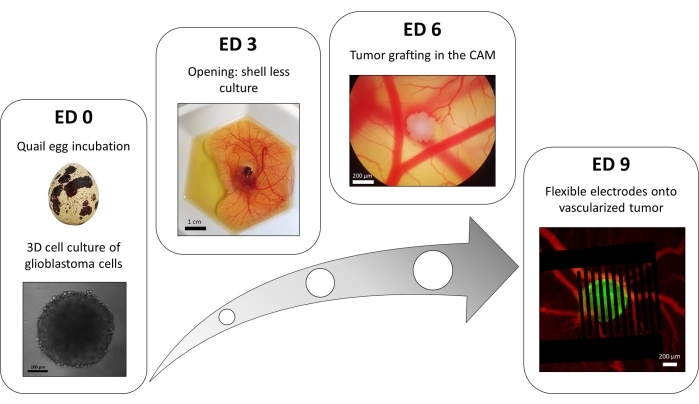
الشكل 3: نموذج البويضات للورم الأرومي الدبقي. ED 0: كروي لوحظ بمجهر المجال الساطع. ED 3: قذيفة أقل ثقافة جنين السمان بعد 3 أيام من الفتح. ED 6: الورم المزروع في الطب التكميلي والبديل لوحظ باستخدام مجهر المجال الساطع. ED 9: جهاز مرن يوضع على الورم الوعائي (ورم باللون الأخضر والأوعية الدموية باللون الأحمر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
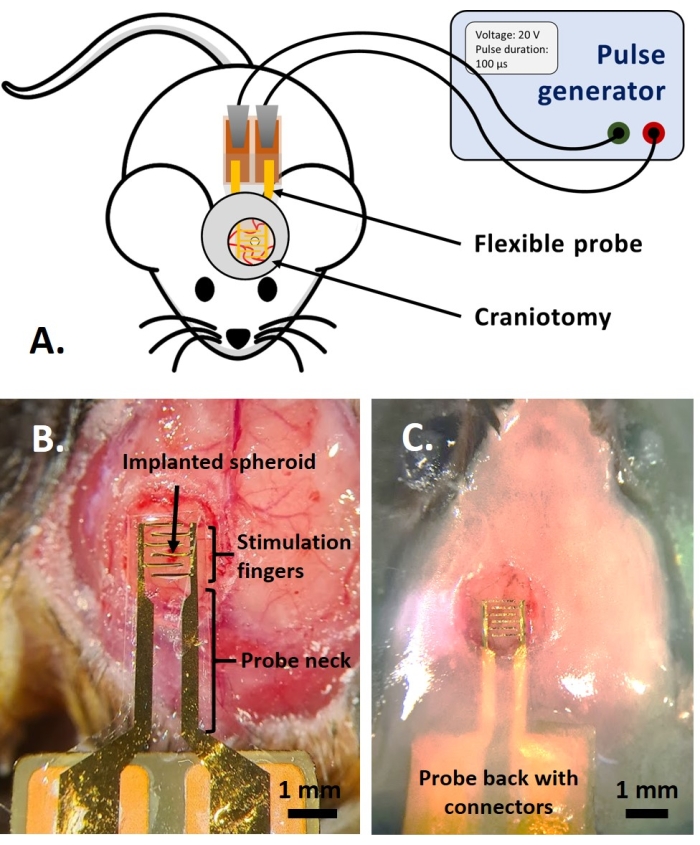
الشكل 4: التطبيق في الجسم الحي. أ: مخطط التجارب في الجسم الحي. (ب) وضع المسبار قبل وضع غطاء زجاجي وراتنج أكريليك. (ج) زرع مسبار مكتمل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
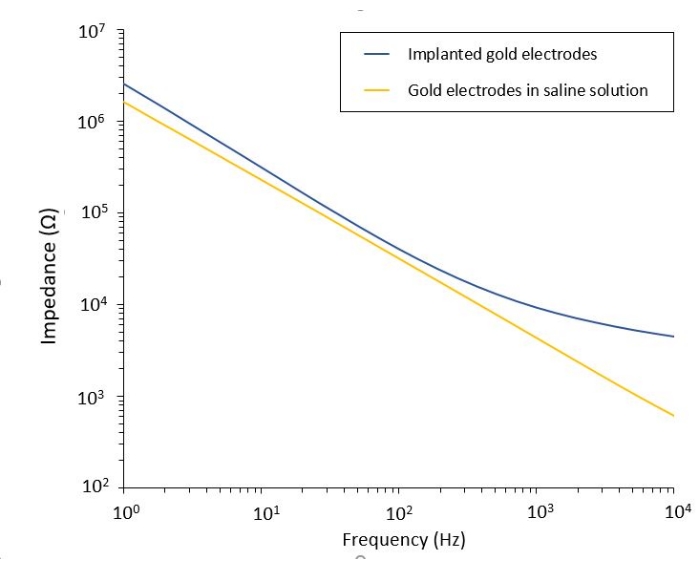
الشكل 5: التحليل الطيفي للمعاوقة الكهروكيميائية لأقطاب الذهب المرنة في محلول ملحي مقارنة بمسبار مزروع. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
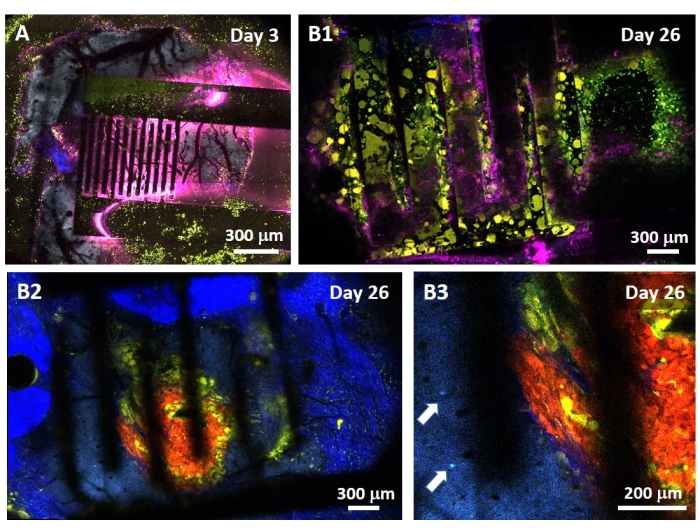
الشكل 6: التصوير ثنائي الفوتون متعدد الأطياف داخل الجسم من خلال أقطاب كهربائية . (أ) صورة مبلطة لسطح الدماغ السليم في فأر تحكم متعدد الفلورسنت AMU-Neuroinflam بعد 3 أيام من زرع القطب الكهربائي. يظهر السماوي التشجير الشجيري للخلايا العصبية الهرمية من الطبقة 5 ، ويظهر اللون الأخضر الخلايا المحببة والوحيدات المجندة ، ويظهر اللون الأصفر الخلايا الدبقية الصغيرة المنشطة والخلايا المتغصنة. يظهر اللون الوردي انتشار الأشعة تحت الحمراء بسبب تراكم الحرارة. (ب1) صورة مماثلة كما في A ولكن بعد 26 يوما من زرع الورم الكروي 200 ميكرومتر عميق داخل القشرة تليها مباشرة زرع القطب الكهربائي. لاحظ تراكم الخلايا المناعية الخضراء والصفراء. (ب2) صورة مماثلة كما في B1 ولكن 100 ميكرومتر تحت سطح الأقطاب الكهربائية. لاحظ وجود التشجير الشجيري العصبي الأزرق في محيط كتلة الورم الأحمر نفسها التي تسللت إليها الخلايا الدبقية الصفراء والخلايا المتغصنة. يظهر اللون الأزرق الغامق إشارة توافقية ثانية من الكولاجين حول الورم. (ب 3) عرض مكبر ل B2 يظهر وجود ورم بين الخلايا العصبية (يشار إليه بالأسهم) بالقرب من الورم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يتيح النهج الموصوف في هذا العمل لنماذج أورام المخ مع نظام توصيل PEF متكامل دراسة تأثير PEFs على مستويات مختلفة من التنظيم البيولوجي. يتكون بروتوكول التصنيع الدقيق من عمليات الأغشية الرقيقة القياسية ، والتي توفر درجة كبيرة من الحرية في تصميم القطب الكهربائي الذي يمكن تكييفه مع التطبيق المحدد. في بعض الأحيان ، يمكن أن تكون خطوة التلدين الحراري الإضافية مفيدة في نهاية التصنيع ، لتقليل انحناء الأقطاب الكهربائية التي حدثت أثناء التصنيع.
إن استخدام خط خلايا الورم الأرومي الدبقي المستقر الذي يعبر عن مؤشر الكالسيوم الفلوري يتجنب جميع المضاعفات المرتبطة بتوصيل الصبغة والاحتفاظ بها ، خاصة في الأورام ثلاثية الأبعاد الكثيفةجدا 16. في الواقع ، لوحظ مستوى تعبير مرتفع على مدى فترة طويلة مقارنة بمؤشرات الكالسيوم الفلورية الكيميائيةالقياسية 17. يمكن تطبيق هذا البروتوكول على خطوط الخلايا المختلفة ، حيث يستخدم عادة لتصوير النشاط العصبي11. هنا ، تم استخدام خطوط الخلايا البشرية والفئران (U87 و Gl261 للزرع في الفئران التي تعاني من نقص المناعة أو المناعة ، على التوالي). في الواقع ، أظهرت الدراسات الحديثة أن خط خلية U87 يختلف عن خط الخلايا الأصلية حيث تم اكتساب العديد من الطفرات على مدار سنوات من زراعة الخلايا ، مما أثر على التكاثر التجريبي18. الطريقة المستخدمة لإعداد أورام 3D عالية الإنتاجية ، قابلة للتكرار ، وتسمح بتوليد كرويات بحجم معين اعتمادا على خط الخلية ، وعدد الخلايا عند البذر ، ووقت النمو19. ومع ذلك ، فإن هذه الأجسام الكروية كثيفة ، مما يمثل عيبا عند التصوير في قلب الورم.
نموذج في البويضة مفيد كنهج أول لدراسة تأثير PEF على أورام 3D والأوعية الدموية ، دون تفاعلات مع أنواع الخلايا الأخرى الموجودة في الدماغ. هذا النموذج غير مكلف وسريع وعالي الإنتاجية ويثير قضايا أخلاقية أقل من النماذج الحيوانية. من المهم الحفاظ على سلامة الجنين طوال التجربة بأكملها ، حيث يمكن أن يؤثر ذلك على بقائه وجودة التصوير. يجب توخي الحذر بشكل خاص أثناء فتح بيضة السمان ، لتجنب الأضرار التي لحقت الغشاء الجنيني. يجب أيضا إجراء الكسب غير المشروع ووضع الأقطاب الكهربائية المرنة بعناية ، لتجنب النزيف الذي يمكن أن يقتل الجنين. يسمح حقن صبغة الفلورسنت في الأوعية الدموية بالتصور المتزامن للخلايا السرطانية والأوعية الدموية باستخدام الفحص المجهري الفلوري. يجب إجراء الحقن داخل العين بعناية لتجنب تسرب الصبغة إلى السائل الجنيني ، مما قد يتسبب في حدوث مضان متبقي في الخلفية يؤدي إلى تدهور جودة التصوير. يمكن أيضا استخدام هذا النموذج لمتابعة امتصاص الدواء ، لأنه يسمح بالوصول إلى الدورة الدموية. ومع ذلك ، فإن التجارب محدودة بوقت بقاء الجنين لمدة 12 يوما ، مما يسمح ب 7 أيام من المراقبة ، وهو أقصر بكثير من النموذج21 في الجسم الحي.
يمكن مراقبة نموذج ورم الدماغ في الجسم الحي لمدة 4 إلى 5 أسابيع قبل أن تصل الحيوانات إلى نقطة نهاية تجريبية أخلاقية يحددها فقدان الوزن المفاجئ بنسبة 20٪. إنه جيد التحمل ويظل في مكانه إذا لم يكن ذيل توصيل القطب طويلا جدا. خلاف ذلك ، تميل الحيوانات إلى خدش موصل التقليب ، والذي قد يتمزق في النهاية ، وبالتالي يمنع الاتصال اللاحق بالمحفز. ومع ذلك ، فإن فترة 4 أسابيع هذه ذات قيمة لتغطية المراحل المختلفة لتطور الورم الأرومي الدبقي. عند مقارنة كثافة الخلايا السرطانية في نفس حجم الاهتمام على فترات زمنية مختلفة ، يمكن ملاحظة تطور حركية نمو الورم. على وجه الخصوص ، لوحظ نمو الورم المعزز في وقت التبديل المناعي22. دراسة مماثلة في وجود قطب كهربائي محفز من شأنه أن يفيد في تأثير PEF على معدل انتشار الورم وحساسية الورم للقضاء المناعي. بالمقارنة مع نموذج البويضات ، يمكن اعتبار النموذج في الجسم الحي نموذجا قيما قبل السريري لدراسة تأثير الخلايا المناعية على تطور الورم ومساهمتها في التأثير العلاجي ل PEF. تم تكييف هذا البروتوكول من مقال سابق مع إضافة جهاز قطب كهربائي مرن على الورم قبل وضع نافذة الجمجمة14. يمكن وصف كل من العلاجات الكهربائية الحيوية الحادة والمزمنة للأورام بالملاحظات المباشرة واللاحقة باستخدام الفحص المجهري ثنائي الفوتون نظرا لأنه من المتوقع أن يؤدي التحفيز الأولي إلى موت الخلايا ويؤدي إلى خلل دائم في الاستجابة المناعية.
يمكن الوصول بسهولة إلى وصلات المسبار المرن تحت المجهر ثنائي الفوتون. وبالتالي يمكن تعديل معلمات التحفيز الكهربائي في الوقت الفعلي بناء على التأثير الملحوظ على الأنسجة العصبية و / أو الخلايا المستهدفة ، على غرار الطريقة التي يقوم بها الطبيب بإجراء الإجراءات التدخلية أثناء مراقبة صور التصوير بالرنين المغناطيسي أو التصوير المقطعي المحوسب لمريضه. الاعتبار الأخير هو أهمية الختم الدقيق للقطب الكهربائي على الدماغ باستخدام الغراء الفائق وغراء السيليكون لمنع إعادة نمو الأنسجة.
في الختام ، يمثل البروتوكول الموصوف هنا نموذجا مبتكرا لدراسة تأثير علاج PEF مع أقطاب البوليمر العضوية المرنة لنماذج ورم الورم الأرومي الدبقي. يظهر النموذجان مستويات مختلفة من التعقيد بحيث يمكن فصل التأثيرات الخلوية أو الوعائية أو المناعية لفهم آليات العمل بشكل أفضل. تقلل الأقطاب الكهربائية السطحية المطابقة من الضرر علاجي المنشأ مع تمكين تعطيل البيئة المكروية للورم ، مما يؤدي إلى تضيق الأوعية أو عدم تنظيم الكالسيوم داخل الخلايا15.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لهما مصالح مالية متنافسة.
Acknowledgements
تم دعم العمل المبلغ عنه هنا من قبل الوكالة الوطنية الفرنسية للبحوث (ANR-18-CE19-0029). يشكر المؤلفون بحرارة S.M. Bardet لمساهمتها في توليد خط خلية GCaMP6f مستقر و D. O'Connor لمساعدتها في نموذج البيض .
Materials
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
References
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved