Method Article
Dispositifs électroniques organiques flexibles pour la thérapie par champs électriques pulsés du glioblastome
Dans cet article
Résumé
Ce travail décrit le développement d’électrodes interdigitées flexibles pour la mise en œuvre dans des modèles 3D de tumeurs cérébrales, à savoir la culture in vitro , le modèle in ovo et le modèle murin in vivo . La méthode proposée peut être utilisée pour évaluer les effets des champs électriques pulsés sur les tumeurs à différents niveaux de complexité.
Résumé
Le glioblastome est difficile à éradiquer avec les thérapies oncologiques standard en raison de son degré élevé d’invasivité. Les traitements bioélectriques basés sur les champs électriques pulsés (PEF) sont prometteurs pour l’amélioration de l’efficacité du traitement. Cependant, ils reposent sur des électrodes rigides qui causent des dommages aigus et chroniques, en particulier dans les tissus mous tels que le cerveau. Dans ce travail, l’électronique flexible a été utilisée pour délivrer des PEF aux tumeurs et la réponse biologique a été évaluée par microscopie fluorescente. Des électrodes en or interdigitées sur un substrat mince et transparent de parylène-C ont été recouvertes du polymère conducteur PEDOT:PSS, résultant en un dispositif conformable et biocompatible. Les effets des PEF sur les tumeurs et leur microenvironnement ont été examinés à l’aide de divers modèles biologiques. Tout d’abord, des monocouches de cellules de glioblastome ont été cultivées au-dessus des électrodes pour étudier les phénomènes in vitro. Comme étape intermédiaire, un modèle in ovo a été développé où des sphéroïdes tumoraux modifiés ont été greffés dans la membrane embryonnaire d’une caille. En raison de l’absence d’un système immunitaire, cela a conduit à des tumeurs hautement vascularisées. À ce stade précoce de développement, les embryons n’ont pas de système immunitaire et les tumeurs ne sont pas reconnues comme des corps étrangers. Ainsi, ils peuvent se développer rapidement tout en développant leurs propres vaisseaux à partir du système vasculaire embryonnaire existant, ce qui représente un modèle de cancer 3D précieux. Enfin, l’administration d’électrodes flexibles de PEF a été évaluée dans un organisme complet doté d’un système immunitaire fonctionnel, à l’aide d’un modèle murin syngénique d’orthogreffe (intracrânienne). Des sphéroïdes tumoraux ont été greffés dans le cerveau de souris multi-fluorescentes transgéniques avant l’implantation de dispositifs d’électrodes organiques flexibles. Une fenêtre crânienne scellée a permis l’imagerie multiphotonique de la tumeur et de son microenvironnement pendant le traitement par PEF sur une période de plusieurs semaines.
Introduction
Le glioblastome multiforme (GBM) est une tumeur très invasive et donc difficile à éradiquer avec des traitements standard tels que la résection, la radiothérapie et la chimiothérapie. Malgré les traitements multimodaux, le pronostic reste très sombre et la plupart des patients connaissent une progression de la maladie dans l’année 1 suivant le diagnostic 1,2. Récemment, le développement de traitements bioélectriques a montré un grand potentiel pour améliorer les thérapies existantes. Ces thérapies utilisent l’administration de champs électriques pulsés (PEF), généralement en une seule séance de traitement, pour perturber l’intégrité de la membrane cellulaire et le microenvironnement des tumeurs. Cette perturbation de la membrane cellulaire, également appelée électroporation, peut être réversible ou irréversible en fonction de l’intensité du champ électrique et du nombre d’impulsions. L’électroporation irréversible (IRE) est appliquée comme une technique d’ablation tissulaire non thermique dans laquelle les impulsions électriques causent des dommages mortels aux membranes cellulaires conduisant à la mort cellulaire3. L’électroporation réversible est appliquée à l’électrochimiothérapie (ECT), une technique établie qui consiste à administrer des PEF en combinaison avec des médicaments de chimiothérapie pour améliorer l’absorption du médicament dans les cellules cancéreuses4. De plus, des études récentes ont démontré que l’électroporation du calcium était une alternative à l’ECT avec une efficacité élevée pour le traitement du cancer, qui est également peu coûteuse et induit moins d’effets secondaires5. Malgré ces avancées prometteuses, les EEP sont généralement appliqués à l’aide d’électrodes métalliques rigides connues pour endommager les tissus mous6. Le cerveau est particulièrement sensible à ces dispositifs invasifs où le décalage mécanique induit une inflammation et des cicatrices astrogliales7.
Dans ce contexte, un système flexible d’administration de PEF en combinaison avec des modèles 3D de tumeurs de glioblastome est présenté, de la microfabrication à un modèle murin. Les électrodes conformes sont fabriquées avec des procédés de microfabrication à couche mince standard, y compris l’utilisation de matériaux souples et biocompatibles tels que le parylène-C, l’or et le PEDOT:PSS 8,9. Une conception d’électrode interdigitée est utilisée pour couvrir une grande surface tout en maintenant une transparence adéquate pour l’imagerie entre les doigts de l’électrode10. Pour le modèle tumoral, des sphéroïdes 3D de cellules de glioblastome exprimant un rapporteur de fluorescence génétiquement codé sont produits en utilisant une variante de la méthode de plaque de 96 puits à recouvrement de liquide11. Les sphéroïdes sont greffés dans la membrane chorio-allantoïdienne d’un embryon de caille, ce qui donne un modèle in ovo qui a été largement utilisé pour étudier l’angiogenèse ou la toxicologie médicamenteuse12,13. Les tumeurs peuvent être greffées et vascularisées par le système vasculaire de l’embryon en l’absence de système immunitaire à ce stade du développement embryonnaire12. Des électrodes flexibles sont ensuite placées sur le dessus de la tumeur vascularisée pour étudier l’effet de l’administration de PEF sur le sphéroïde et son système vasculaire. Enfin, ces effets sont étudiés sur un organisme vivant complet, y compris le microenvironnement tumoral et le système immunitaire, en implantant des sphéroïdes modifiés dans le parenchyme cérébral de modèles murins14. Des électrodes flexibles sont placées sur le site d’insertion et la craniotomie est scellée avec une fenêtre en verre, permettant une imagerie répétée à deux photons sur plusieurs semaines.
Ces méthodes seront utiles pour les personnes intéressées par divers domaines allant de l’ingénierie microélectronique aux applications en oncologie. Le protocole de microfabrication peut être utilisé et adapté pour toute application nécessitant des électrodes métalliques à couche mince revêtues de PEDOT:PSS. De plus, les modèles biologiques développés pour l’évaluation des traitements électriques antitumoraux seront d’intérêt général pour l’étude de la différenciation de la réponse cellulaire, vasculaire et immunitaire aux matériaux implantés.
Protocole
Toutes les procédures expérimentales ont été réalisées conformément à la législation française et à la directive du Conseil de la Communauté européenne du 24 novembre 1986 (86/609/CEE) pour le soin et l’utilisation des animaux de laboratoire. La recherche sur les animaux a été autorisée par la Direction Départementale des Services Vétérinaires des Bouches-du-Rhône et approuvée par le comité d’éthique de Provence Côte d’Azur (Apafis # 22689-2019100414103054).
1. Microfabrication de dispositifs souples (figure 1)
- Nettoyage des lames de verre
- Sonicate de verre glisse dans une solution de savon à 2% pendant 15 min. Rincez-les à l’eau.
- Soniquer à nouveau dans un mélange de 80% d’acétone pure et 20% d’isopropanol pur pendant 15 min.
ATTENTION : Ces solvants sont nocifs et inflammables. Portez un équipement de protection individuelle (EPI) et manipulez-le sous une hotte. - Rincer les lames avec de l’isopropanol et sécher avec un pistolet à air.
REMARQUE: Assurez-vous que l’acétone ne sèche pas sur les substrats pendant tout le processus.
- Motifs d’électrodes en or (Graphique 1A)
- Déposer une couche de 3 μm de parylène-C (PaC) avec un système de dépôt de parylène (Figure 1Aa).
- Placez les lames de verre nettoyées dans la chambre de dépôt. Vaporisez du savon sur le refroidisseur, laissez-le sécher et insérez-le dans le piège à froid désigné du système de dépôt. Cet anti-adhésif facilite l’élimination du PaC du refroidisseur après le dépôt.
MISE EN GARDE : Le PaC est irritant et présente un danger pour la santé. Portez des gants lorsque vous le manipulez. - Pesez 6 g de PaC dans un bateau en aluminium et placez-le dans le four. Évacuer la machine (P = 10 mTorr) et commencer le dépôt avec les paramètres suivants :Refroidisseur T = -100 °C, Four T = 690 °C,Vaporisateur T = 175 °Cet Chambre T = 135 °C.
- Lorsque le dépôt est terminé et que la température du vaporisateur est inférieure à 40 °C, éteignez le refroidisseur, le vaporisateur et le four. Ventilez la machine et prélevez les échantillons.
- Placez les lames de verre nettoyées dans la chambre de dépôt. Vaporisez du savon sur le refroidisseur, laissez-le sécher et insérez-le dans le piège à froid désigné du système de dépôt. Cet anti-adhésif facilite l’élimination du PaC du refroidisseur après le dépôt.
- Activer la surface des échantillons par traitement plasma à l’oxygène pendant 30 s (100 W, 50 sccm).
- Enduire les échantillons traités au plasma avec une résine photosensible négative à 1 000 x g pendant 40 s. Placer les échantillons sur une plaque chauffante à 110 °C pendant 2 min (figure 1Ab).
ATTENTION : La solution de résine photosensible est inflammable et provoque une irritation ; porter l’EPI et le manipuler sous une hotte. - Placez un filtre i-line dans la ligne de faisceau de l’aligneur de contact UV à large bande et exposez la résine photosensible à travers un masque présentant la conception de l’électrode interdigitée (Figure 1Ac).
REMARQUE: Les électrodes interdigitées avec un espace de 50 ou 250 μm ont été conçues à l’aide d’un éditeur de mise en page et les photomasques ont été commandés à une entreprise qui produit des photomasques en polyester par phototraçage laser. - Cuire les échantillons ci-dessus à 110 °C sur une plaque chauffante pendant 3 min et les laisser refroidir à température ambiante pendant 5 min. Immergez les échantillons dans un révélateur sans ions métalliques pendant 3 minutes pour retirer la résine photosensible non exposée. Rincer les échantillons à l’eau et les sécher à l’aide d’un pistolet à air comprimé (figure 1Ad).
ATTENTION : La solution du développeur est un irritant ; porter l’EPI et manipuler sous une hotte. - Activer la surface des échantillons par traitement plasma à l’oxygène pendant 60 s (100 W, 50 sccm).
- Déposer une couche d’adhérence de 20 nm de chrome et une couche d’or de 300 nm avec un évaporateur thermique comme suit (Figure 1Ae).
- Éventez l’évaporateur et clipsez les échantillons (vers le bas) sur la plaque ronde supérieure à l’aide de vis métalliques. Remplissez les creusets dédiés, respectivement, avec du chrome et de l’or. Sceller et évacuer la machine pour atteindre une pression inférieure à 5.10-6 Torr. Lancez la rotation du porte-échantillon.
- Sélectionnez le creuset contenant du chrome et augmentez lentement le courant qui le traverse jusqu’à ce qu’un taux de dépôt de 0,2 Å·s-1 soit atteint. Ouvrez l’obturateur et attendez que 20 nm de chrome soient déposés. Fermez l’obturateur et diminuez lentement le courant jusqu’à 0 mA.
- Sélectionnez le creuset contenant de l’or et augmentez lentement le courant qui le traverse jusqu’à ce qu’un taux de dépôt de 0,2 Å·s-1 soit atteint. Ouvrez l’obturateur pour évaporer l’or, attendez que 10 nm d’or soient déposés, puis augmentez le taux de dépôt à 1,5 Å·s-1 jusqu’à ce qu’environ 300 nm soient déposés. Fermez l’obturateur et abaissez lentement le courant à 0 mA.
- Laisser les échantillons refroidir à température ambiante pendant 15 minutes après le dépôt. Arrêtez la rotation du porte-échantillon, aérez la machine et prélevez les échantillons.
- Plongez les échantillons dans un bécher avec de l’acétone. Placer le bécher sur une plaque à secouer réglée à 110 tr/min pendant 15 min pour soulever la résine photosensible. Rincer les échantillons avec de l’isopropanol et les sécher avec un pistolet à air comprimé (figure 1Af).
- Activer la surface des échantillons par traitement plasma à l’oxygène pendant 30 s (100 W, 50 sccm).
- Déposer une couche isolante de 3 μm de PaC avec un système de dépôt de parylène (voir étape 1.2.1) (Figure 1Ag).
- Déposer une couche de 3 μm de parylène-C (PaC) avec un système de dépôt de parylène (Figure 1Aa).
- Ouverture du contour (figure 1B)
- Enduire les échantillons d’une résine photosensible positive à 600 x g pendant 35 s. Placez-le sur une plaque chauffante à 110 °C pendant 2 min (figure 1Ba).
ATTENTION : La solution de résine photosensible est inflammable et provoque une irritation ; porter l’EPI et manipuler sous une hotte. - Assurez-vous qu’il n’y a pas de filtre i-line dans la ligne de faisceau de l’aligneur de contact UV large bande et exposez la résine photosensible à travers un masque qui présente le contour de l’appareil avec un aligneur de contact large bande UV (Figure 1Bb).
- Immergez les échantillons dans un révélateur sans ions métalliques pendant 4 minutes pour retirer la résine photosensible exposée. Rincez les échantillons à l’eau et séchez-les à l’aide d’un pistolet à air comprimé (figure 1Bc).
- Graver le contour à travers les deux couches de PaC avec une gravure ionique réactive (160 W, 22 min, O2: 50 sccm, CF4: 10 sccm) (Figure 1Bd).
- Retirer la résine photosensible restante avec de l’acétone, rincer avec de l’isopropanol et sécher les échantillons avec un pistolet à air comprimé.
- Enduire les échantillons d’une résine photosensible positive à 600 x g pendant 35 s. Placez-le sur une plaque chauffante à 110 °C pendant 2 min (figure 1Ba).
- PEDOT:revêtement PSS (Figure 1C)
- Enduire une solution de savon à 2 % à 70 x g pendant 35 s (Figure 1Ca).
- Déposer une couche sacrificielle de PaC de 3 μm avec un système de dépôt de parylène (voir étape 1.2.1) (Figure 1Cb).
- Résine photosensible positive spin-coat à 600 x g pendant 35 s. Placer les échantillons sur une plaque chauffante à 110 °C pendant 2 min (figure 1Cc).
- Assurez-vous qu’il n’y a pas de filtre i-line dans la ligne de faisceau de l’aligneur de contact UV à large bande et exposez la résine photosensible à travers un masque qui présente la surface active des électrodes (Figure 1Cd).
- Immergez les échantillons dans un révélateur sans ions métalliques pendant 4 minutes pour retirer la résine photosensible exposée. Rincez les échantillons à l’eau et séchez-les à l’aide d’un pistolet à air comprimé (figure 1Ce).
- Graver le PaC avec une gravure ionique réactive pour ouvrir la surface active des électrodes (160 W, 24 min, O2: 50 sccm, CF4: 10 sccm). Vérifiez au microscope qu’il n’y a pas de PaC résiduel sur la surface active (Figure 1Cf).
- Retirer la résine photosensible restante avec de l’acétone, rincer avec de l’isopropanol et sécher les échantillons avec un pistolet à air comprimé.
- Activer la surface des échantillons à l’aide d’un traitement plasma à l’oxygène pendant 90 s (100 W, 50 sccm).
- Mélanger une dispersion commerciale de PEDOT:PSS chimiquement polymérisé avec 5 % en volume d’éthylène glycol (EG) et 0,1 % en volume d’acide dodécylbenzène sulfonique (DBSA). Sonifier pendant 15 min. Ajouter 1 % en poids de (3-glycydyloxypropyl)triméthylsiloxane (GOPS) et soniquer pendant 5 min. Filtrer la solution à travers un filtre de 1,2 μm.
ATTENTION : L’EG est irritant et présente un danger pour la santé. DBSA est irritant et corrosif. GOPS est corrosif. Portez l’EPI approprié et manipulez ces produits chimiques sous une hotte.
REMARQUE : Le volume total dépend du nombre d’échantillons. Pour 10 lames de verre standard, préparez au moins 20 mL qui correspondraient aux quantités suivantes : 18,78 mL de PEDOT:PSS, 1 mL d’EG, 20 μL de DBSA et 200 μL de GOPS. - Enduit de spin-coat quatre couches de solution PEDOT:PSS à 150 x g pendant 35 s. Après dépôt de chaque couche, cuire les échantillons à 110 °C pendant 60 s sur une plaque chauffante et les refroidir à température ambiante pendant 5 min avant de faire tourner la couche suivante (figure 1Cg).
- Retirez la couche de PaC sacrificielle en immergeant les échantillons dans l’eau (Figure 1Ch).
- Cuire les échantillons à 140 °C pendant 1 h.
- Plonger les échantillons dans de l’eau désionisée pendant 30 minutes pour éliminer le savon restant et les composés de faible poids moléculaire dans le film PEDOT:PSS et détacher les échantillons du substrat de verre (Figure 1Ci).
- Raccords et emballage (Figure 1D)
- Déposer une fine couche de peinture acrylique sur un film de polyimide recouvert de cuivre (figure 1Da). Utiliser un aérosol pour obtenir une couche homogène de peinture (figure 1Db).
- Modeler la peinture acrylique avec un laser (75 kHz, 7 W, 1 passe laser, 400 mm·s-1) pour obtenir deux tampons de contact rectangulaires (5 mm x 15 mm; espace de 1,5 mm) (Figure 1Dc).
- Graver le cuivre avec du chlorure ferrique saturé à 30 % (p/v) (FeCl3) dans de l’eau pendant 15 min à 40 °C (figure 1Dd).
ATTENTION : Le FeCl3 est irritant et corrosif; Manipulez-le avec des gants sous une hotte. - Décaper la peinture acrylique avec de l’acétone en la frottant légèrement avec un chiffon (Figure 1De).
- Découpez le film de polyimide à motifs en formes rectangulaires (15 mm x 30 mm) à l’aide d’un laser (15 kHz, 10 W, 30 passes laser, 130 mm·s-1) (Figure 1Df).
- Distribuer la pâte d’argent avec une machine de distribution à trois axes à une pression de trois bars avec une aiguille de 330 μm de diamètre (5 m·min-1) (figure 1Dg).
ATTENTION : La pâte d’argent est un irritant; manipuler avec des gants. - Aligner et fixer la sonde PaC avec le film polyimide au microscope binoculaire à l’aide d’une pince à épiler (Figure 1Dh).
REMARQUE : Les marques d’alignement peuvent être rectifiées à l’étape 1.5.2 pour faciliter le positionnement de la sonde sur les plaquettes de contact. - Cuire au four à 140 °C pendant 2 h.
- Placez un ruban de protection en polyimide de 1 cm2 sur les plaquettes de contact (figure 1Di).
- Plongez l’interface où la sonde PaC et le film polyimide sont connectés dans PDMS (Figure 1Dj).
- Cuire au four pendant 2 h à 50 °C.
- Retirez le ruban de protection pour ouvrir les plaquettes de contact (Figure 1Dk).
REMARQUE : La microfabrication des instruments in vitro est similaire, mais les étapes 1.2.1, 1.3 et 1.5 doivent être ignorées.
2. Génération de la lignée cellulaire stable Glioblastoma GCaMP6f
- Production de lentivirus
- Dans une fiole de 75 cm², cultiver une lignée cellulaire dérivée de HEK 293T optimisée pour la production de lentivirus dans 10 mL de milieu d’aigle modifié (DMEM) de Dulbecco contenant 4,5 g· L-1 de glucose, de L-glutamine, de pyruvate de sodium et de bicarbonate de sodium et complété par 10% de sérum fœtal bovin (FBS) sans tétracycline, 100 unités·mL-1 de pénicilline et 100 μg·mL-1 de streptomycine pendant au moins 3 jours jusqu’à 80% de confluence.
- Retirer le milieu de la fiole. Rincer doucement les cellules avec 10 ml de solution saline tamponnée au phosphate (PBS).
- Ajouter 1 mL de solution de trypsine/EDTA à 0,25 % et incuber la fiole pendant 5 min à 37 °C.
ATTENTION : La solution trypsine/EDTA présente un danger pour la santé; porter l’EPI et manipuler sous une hotte. - Ajouter 8 ml de milieu de culture. Rincer doucement la suspension cellulaire.
- Compter les cellules et plaquer 4 x 106 cellules dans une boîte de Petri dans 8 ml de milieu de culture.
- Le lendemain, diluer 25 μg du plasmide contenant le gène GCaMP6f et un marqueur de sélection conférant une résistance à la puromycine dans un volume total de 600 μL d’eau. Ajoutez-le à un tube de réactif de transfection. Vortex pendant 10 s à 3 000 tr/min et incuber le tube à température ambiante pendant 10 min pour permettre la production de nanoparticules.
- Ajouter le contenu du tube goutte à goutte sur la culture de cellules T HEK 293 et balancer doucement à la main. Incuber les cellules à 37 °C pendant au moins 4 h.
- Remplacez les milieux contenant des complexes de nanoparticules par des milieux frais et remettez les cellules à 37 °C.
- Trois jours plus tard, recueillir le surnageant et centrifuger à 500 x g pendant 10 minutes pour éliminer les débris cellulaires. Recueillir la phase liquide contenant les particules virales.
NOTE: La production de virus dans le surnageant peut être confirmée à l’aide d’un test quantitatif de titre lentiviral et peut être conservée à -80 °C pendant au moins 2 ans.
- Transduction des cellules du glioblastome
- Dans une fiole de 75 cm², cultiver des cellules de glioblastome dans 10 mL de DMEM contenant 1 g· L-1 de glucose, de L-glutamine, de pyruvate de sodium et de bicarbonate de sodium et complété par 10% de FBS sans tétracycline, 100 unités · mL-1 de pénicilline et 100 μg · mL-1 de streptomycine pendant au moins 4 jours.
- Jeter le milieu et ajouter le surnageant obtenu à l’étape 2.1.9 sur les cellules cibles.
- Ajouter 5 μg·mL-1 de bromure d’hexadiméthrine dans le milieu pour améliorer la transduction. Incuber pendant 6 h à 37 °C. Remplacer le milieu par 10 ml de milieu frais.
ATTENTION : Le bromure d’hexadiméthrine est un irritant. Manipulez-le avec des gants.
- Génération d’une lignée cellulaire stable
- Deux à trois jours après la transduction, ajouter 10 mL de DMEM contenant 1 g· L-1 de glucose, L-glutamine, pyruvate de sodium et bicarbonate de sodium, 10% FBS, 100 unités ·mL-1 de pénicilline, 100 μg·mL-1 de streptomycine et complété par de la puromycine pour tuer les cellules non transduites. Cellules de culture dans ce milieu pendant au moins 3 jours.
ATTENTION : La puromycine est un irritant; Manipulez-le avec des gants.
NOTE: La sensibilité des cellules à la puromycine doit être testée avant la transduction en cultivant des cellules dans leur milieu recommandé contenant différentes concentrations de puromycine. Un jour plus tard, vérifiez les cellules avec un microscope. Choisissez la concentration adéquate à laquelle la majorité des cellules sont mortes mais peu sont encore vivantes, pour s’assurer que l’antibiotique n’est pas trop toxique et pourrait également tuer les cellules transfectées. - Retirer le milieu et rincer les cellules avec 10 ml de PBS.
- Ajouter 1 mL de 0,25 % d’une solution de trypsine/EDTA et incuber la fiole pendant 5 min à 37 °C.
- Ajouter 8 ml de milieu de culture. Rincer doucement la suspension cellulaire.
- Recueillir 100 μL de suspension cellulaire et mesurer la concentration cellulaire à l’aide d’un compteur de cellules. Aspirer 50 μL de suspension cellulaire dans un compteur de cellules automatisé portatif avec un capteur de 60 μm.
- Ensemencer 1 cellule/puits dans une assiette de 96 puits. Par exemple, pour une concentration de 1 x 10 3 cellules par mL, ajouter 1/(1 x 103), soit 0,001 mL de suspension cellulaire par puits. Semer chaque puits pour augmenter les chances de succès. Complet avec milieu de culture pour atteindre un volume total de 200 μL par puits.
- Un jour plus tard, trouvez chaque puits contenant une cellule et vérifiez sa fluorescence (λexc = 490 nm et λem = 530 nm). Marquez les puits contenant une seule cellule transfectée. Continuez la croissance pendant quelques jours jusqu’à ce que le puits soit presque confluent.
- Jeter le milieu et rincer les cellules avec 200 μL de PBS. Ajouter 100 μL de solution de trypsine/EDTA à 0,25 % et incuber la plaque à 96 puits pendant 5 min à 37 °C.
- Ajouter 100 μL de milieu et rincer doucement la suspension cellulaire. Transférer la suspension cellulaire dans une boîte de Pétri. Ajouter 5 mL de milieu et laisser les cellules se développer pendant quelques jours jusqu’à ce que la boîte de Petri soit presque confluente.
- Jeter le milieu et rincer les cellules avec 5 ml de PBS. Ajouter 1 mL de solution de trypsine/EDTA à 0,25 % et incuber la boîte de Petri pendant 5 min à 37 °C.
- Ajouter 6 mL de milieu et rincer doucement la suspension cellulaire. Transvaser la suspension cellulaire dans une fiole T25. Poursuivre la croissance pendant quelques jours jusqu’à ce que la fiole soit presque confluente.
- Jeter le milieu et rincer les cellules avec 5 ml de PBS. Ajouter 1 mL de solution de trypsine/EDTA à 0,25 % et incuber la fiole T25 pendant 5 min à 37 °C. Ajouter 7 mL de DMEM contenant 1 g· L-1 de glucose, de L-glutamine, de pyruvate de sodium et de bicarbonate de sodium, et complété par 10% FBS, 100 unités·mL-1 de pénicilline et 100 μg·mL-1 de streptomycine. Rincer doucement la suspension cellulaire.
- Diviser la suspension cellulaire en quatre fioles T25 (2 mL par fiole) et ajouter 5 mL de milieu dans chaque fiole. Laissez les cellules se développer pendant quelques jours jusqu’à ce que les flacons soient presque confluents.
- Répéter l’étape 2.3.12 pour trois flacons et conserver la dernière fiole pour l’étape 3.1.3. Transférer la suspension cellulaire dans un tube conique de 15 mL et centrifuger à 150 x g pendant 5 min. Jeter le surnageant et remettre en suspension la pastille cellulaire dans 900 μL. Mélanger délicatement les cellules pour maintenir une suspension cellulaire homogène.
- Transférer la suspension cellulaire dans des flacons de stockage cryogéniques. Ajouter 100 μL de diméthylsulfoxyde. Placer les cryoflacons à -80 °C pendant la nuit. Transférer les cellules congelées à l’azote liquide pour d’autres expériences.
NOTE: L’efficacité de la transfection peut être évaluée en ajoutant 5 μM de sel de calcium ionomycine dans le milieu et en vérifiant l’augmentation induite de la fluorescence au microscope à fluorescence (λexc = 490 nm et λem = 530 nm).
- Deux à trois jours après la transduction, ajouter 10 mL de DMEM contenant 1 g· L-1 de glucose, L-glutamine, pyruvate de sodium et bicarbonate de sodium, 10% FBS, 100 unités ·mL-1 de pénicilline, 100 μg·mL-1 de streptomycine et complété par de la puromycine pour tuer les cellules non transduites. Cellules de culture dans ce milieu pendant au moins 3 jours.
3.3D modèles
- Culture sphéroïde
- Préparer une solution d’agarose à 1 % (p/v) dans de l’eau désionisée (DI).
- Ajouter 100 g de poudre d’agarose dans 100 mL d’eau DI et chauffer la solution dans un four à micro-ondes jusqu’à ce que toute la poudre soit dissoute. Remuez la solution régulièrement pour éviter les grumeaux. Autoclaver la solution pendant 20 min à 120 °C.
- Une fois récupéré de l’autoclave, ajouter soigneusement 75 μL de solution d’agarose par puits dans une plaque de 96 puits. Déposez-le sur le côté du puits pour former un ménisque, ce qui donne un fond rond non adhérent. Laisser solidifier pendant 15 min à température ambiante.
- Détacher les cellules (étape 2.3.12) de la fiole obtenue à l’étape 2.3.14.
- Ajouter 10 000 cellules par puits de cellules de glioblastome et compléter pour atteindre un volume total de 150 μL par puits avec DMEM contenant 1 g· L-1 de glucose, de L-glutamine, de pyruvate de sodium et de bicarbonate de sodium, et complété par 10% de sérum bovin fœtal (FBS), 100 unités·mL-1 de pénicilline et 100 μg·mL-1 de streptomycine.
- Incuber les cellules à 37 °C sans bouger la plaque pendant 3 jours. Ensuite, remplacez la moitié du média par un média frais tous les 2 jours avec une pipette multicanal jusqu’à ce que d’autres expériences soient effectuées. Gardez l’embout de la pipette dans la partie supérieure du puits pour éviter d’endommager l’agarose ou le sphéroïde lui-même.
NOTE: La taille des sphéroïdes dépend du nombre de cellules ensemencées et de la lignée cellulaire, elle doit donc être adaptée en fonction des expériences.
- Préparer une solution d’agarose à 1 % (p/v) dans de l’eau désionisée (DI).
- Le modèle in ovo
- Placez les œufs fécondés de caille japonaise (C. japonica) dans un incubateur (37 °C et 57% d’humidité) sur des plateaux munis d’un rotateur automatique qui retourne les œufs toutes les 2 h. Ce jour est considéré comme le jour embryonnaire (ED) 0.
- Lavez les bateaux de pesage en plastique en les plaçant dans de l’éthanol à 70 % (p/v). Sortez les bateaux de pesage et séchez-les sous une hotte.
REMARQUE: À partir de ce point, les expériences ne sont pas effectuées dans des conditions stériles. Cependant, des conditions propres sont nécessaires pour éviter le développement de moisissures sur les embryons. - Sur ED3, ouvrir doucement les œufs à l’aide d’une pince à épiler à pointes minces prélavées avec de l’éthanol à 70 % (p/v). Versez l’embryon dans un bateau de pesage en plastique, recouvrez-le d’un autre bateau de pesage et placez-le dans un incubateur humidifié standard à 37 °C pendant 3 jours.
- Sur ED6, faites une petite incision dans la membrane chorio-allantoïdienne (CAM) avec une aiguille de 23 G.
- À l’aide d’une pipette, placez un sphéroïde de 7 jours sur l’incision et remettez l’embryon dans l’incubateur pendant 3 jours, jusqu’à d’autres expériences.
REMARQUE: Un colorant fluorescent peut être injecté dans l’œil de l’embryon pour visualiser les vaisseaux sanguins. - Le jour de l’expérience, placez la sonde flexible sur la tumeur vascularisée à l’aide d’un micromanipulateur.
- Le in vivo modèle
NOTE: Cette partie du protocole est adaptée de celle précédemment publiée en référence14. Des souris fluorescentes multicolores adultes AMU-Neuroinflam (B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD) ont été utilisées; ces souris présentent le marquage d’une sous-population de Thy1+ neurones par expression transgénique de l’ECFP, marquage de LyzM périphérique+ cellules inflammatoires par expression transgénique de l’EGFP et marquage d’un sous-type de microglie exprimant l’EYFP sous le contrôle de Cd11c+. En bref, les animaux sont légèrement sous sédation avec 1,5% d’isoflurane pendant 2 minutes avant tout traitement ou injection. Avant la chirurgie, les animaux sont anesthésiés avec de la kétamine (120 mg / kg; IP) et la xylazine (12 mg/kg; IP). Ensuite, le gel de lidocaïne à 3% est appliqué localement pour soulager toute douleur dans les oreilles associée à la fixation du support stéréotaxique. Ensuite, une solution de bupivacaïne à 0,25% est administrée au site chirurgical pour soulager toute douleur due à la craniotomie. Une fois la souris préparée pour la chirurgie, une craniotomie de 4 mm de diamètre a été réalisée selon la référence14. Avec une aiguille de 26 G, un trou a été fait dans la dure-mère au milieu de la craniotomie et le sphéroïde tumoral a été injecté avec le système d’injection décrit dans la référence14. De plus, comme décrit ici, une électrode flexible a été placée sur le GCamp6 ou le DsRed exprimant le sphéroïde tumoral avant de sceller la craniotomie avec une fenêtre en verre.- Placez une goutte de solution saline tamponnée au phosphate (DPBS) de Dulbecco afin qu’elle recouvre la craniotomie. Placez l’électrode flexible sur la goutte de DPBS et placez doucement l’arrière de la sonde avec des pastilles de contact sur le dos de la souris (Figure 4B).
REMARQUE: Utilisez des gants stériles et une technique « pointe seulement ». Changez les gants si une surface non stérile est en contact. Fournir un support thermique pendant cette procédure. - Touchez la goutte DPBS avec un petit morceau de papier pour absorber la DPBS jusqu’à ce que la sonde puisse reposer à plat sur la dure-mère et suivre la courbure du cerveau. Assurez-vous qu’une petite couche de DPBS reste sous les électrodes sans s’échapper du côté de l’électrode. Cela garantit une barrière contre les débordements de colle lors des étapes suivantes.
REMARQUE : Stérilisez tout l’équipement avant utilisation. - Placez une petite goutte d’adhésif silicone sur la sonde et recouvrez-la d’un verre à couverture ronde de 5 mm. Poussez le verre de couverture vers le bas jusqu’à ce que le silicone soit réparti uniformément et que la distance entre le verre de couverture et la sonde soit minimale. Poussez le verre de couvercle vers le bas pendant encore 30 s pour que le silicone puisse se solidifier.
- Pour fixer le verre de couverture, appliquez rapidement de la superglue sur ses côtés et poussez-la vers le bas jusqu’à ce que la colle durcisse pour devenir solide.
- À l’aide d’un cure-dent, appliquez de la superglue au niveau du cou de la sonde en veillant à ce que la superglue soit aspirée sous le cou pour lui fournir un soutien stable.
- Couvrez le crâne avec du ciment dentaire pour construire un capuchon chronique. Prenez soin de ne couvrir que les bords du verre de couverture.
- Soulevez l’arrière de la sonde et appliquez du ciment sous le col de la sonde. Posez la sonde sur le ciment avant qu’elle ne durcisse. Poussez doucement le col de la sonde avec des pinces émoussées afin que sa surface soit au même niveau que celle du verre de couverture et non sur le chemin de l’objectif du microscope pendant l’expérience.
- Couvrir le haut du col de la sonde avec pas plus de 1,5 mm de couche de ciment dentaire pour obtenir une prise ferme sur la sonde. Construire un puits de ciment présentant une crête de 1,5 mm à une distance de 1 à 2 mm autour du verre de couverture pour créer un bassin pour le fluide d’immersion pour l’imagerie à deux photons (Figure 4C).
- Une fois le ciment durci, appliquez des analgésiques post-chirurgicaux à la buprénorphine (0,05 mg/kg, 0,1 mL par 10 g de poids corporel par voie sous-cutanée) et maintenez l’animal dans une atmosphère chaude jusqu’à son réveil. Cela inclut la proximité d’une ampoule infrarouge ainsi que l’emballage de l’animal dans une serviette en papier.
REMARQUE: Placez un thermomètre au niveau de la souris pour surveiller la température. - Caractériser l’impédance dans la gamme 1-10 kHz à l’aide d’un potentiostat.
- Laissez l’animal se remettre de la chirurgie pendant au moins 10 jours. Administrer des anti-inflammatoires immédiatement après la chirurgie et continuer à surveiller l’état de l’animal pour fournir une analgésie postopératoire appropriée.
- Placez une goutte de solution saline tamponnée au phosphate (DPBS) de Dulbecco afin qu’elle recouvre la craniotomie. Placez l’électrode flexible sur la goutte de DPBS et placez doucement l’arrière de la sonde avec des pastilles de contact sur le dos de la souris (Figure 4B).
4. Livraison et imagerie par champ électrique pulsé (EEP)
- Placer les échantillons sous un microscope à fluorescence. Dans le cas des modèles 3D, les tumeurs ne peuvent être observées que par le haut.
REMARQUE : Pour le modèle in ovo, les expériences ont été réalisées au microscope à épifluorescence (mais c’est également possible avec un microscope à deux photons), tandis que les expériences sur le modèle in vivo ont été réalisées au microscope à deux photons (figure 6). - Connectez un générateur d’impulsions aux tablettes de contact des appareils à l’aide de connecteurs à broche pogo (in vitro) ou de pinces crocodiles (in ovo et in vivo) (Figure 4A). Réglez les paramètres souhaités (nombre d’impulsions, tension, durée des impulsions, fréquence) et appliquez des EEP en faisant fonctionner le générateur (Figure 4A). Mesurez la fluorescence simultanément pour observer les effets des EEP en temps réel.
Résultats
Ce protocole permet l’application à deux modèles de glioblastome dans lesquels un système d’administration de PEF flexible est intégré. Après les étapes de microfabrication et d’emballage, les électrodes flexibles sont caractérisées en solution saline par spectroscopie d’impédance électrochimique (EIS) afin d’évaluer et de valider leurs performances. Les électrodes revêtues de PEDOT:PSS montrent les régions dominées capacitives et résistives typiques séparées par une fréquence de coupure, tandis que les électrodes non revêtues n’affichent qu’un comportement capacitif (Figure 2).
Une variante de la méthode de la plaque de 96 puits en recouvrement de liquide est utilisée pour développer des tumeurs 3D constituées de cellules de glioblastome transfectées exprimant de manière stable un rapporteur de calcium intracellulaire fluorescent. La croissance des sphéroïdes peut être observée avec un microscope à fond clair (Figure 3; ED 0). Au moins 2 ou 3 jours sont nécessaires pour obtenir des sphéroïdes sphériques et denses, en fonction de la lignée cellulaire et du nombre de cellules ensemencées.
Dans le modèle in ovo , des sphéroïdes sont greffés dans la membrane chorio-allantoïdienne d’un embryon de caille (Figure 3 ; ED 6). Le succès de la greffe peut être évalué par microscopie à fluorescence quelques jours plus tard, car les cellules vivantes ont du calcium intracellulaire et sont donc fluorescentes (Figure 3; ED 9). La vascularisation de la tumeur peut être observée au microscope à fluorescence en injectant un colorant fluorescent dans les vaisseaux sanguins (Figure 3 ; ED9). Cependant, il n’est pas toujours possible de visualiser les vaisseaux sanguins à l’intérieur de la tumeur car le sphéroïde est très dense. Les électrodes interdigitées flexibles sont placées au-dessus de la tumeur vascularisée (Figure 3 ; ED 9) et connecté à un générateur d’impulsions. La sonde doit être placée doucement pour éviter le saignement de l’embryon; Sinon, le colorant fluorescent peut se propager, ce qui obstrue toute observation par imagerie. La livraison correcte de l’impulsion à l’environnement biologique peut être vérifiée en mesurant le courant traversant le circuit. L’imagerie de ces modèles in ovo permet de suivre en temps réel l’effet des PEF sur le calcium intracellulaire dans une tumeur de glioblastome 3D, ainsi que la vasoconstriction induite sur le système vasculaire de la tumeur, en évitant toute influence d’autres types cellulaires dont le système immunitaire15.
L’étude de l’effet PEF sur le glioblastome peut également être réalisée dans un modèle plus complet et prédictif. En effet, le modèle in vivo décrit ci-dessus14 consiste à greffer une tumeur de glioblastome 3D dans le parenchyme cérébral d’une souris (Figure 4). Le site d’injection de la tumeur est bouché par un hémi-bille de gel de dextrane réticulé, pour récapituler les contraintes biophysiques physiologiques lors de la croissance de la tumeur. Bien que décrit dans la référence14, il convient de souligner à nouveau qu’il est extrêmement important que l’hémiperle de dextran soit précisément supercollée à la dure-mère; Sinon, la tumeur peut s’échapper par la dure-mère ouverte et couvrir complètement le cerveau, rendant l’imagerie impossible. Pour toute imagerie chronique, la croissance tissulaire qui a lieu lorsque la fenêtre crânienne guérit pose un obstacle sérieux, car le nouveau tissu n’est pas transparent et rend les images brumeuses ou inutilisables. Par conséquent, après avoir inséré et collé l’hémi-bille, les parois latérales de la fenêtre crânienne ouverte doivent être scellées avec une fine couche de superglue méticuleusement placée tout autour de la paroi de la cavité, sans laisser la superglue glisser ou couler sur la dure-mère. Lorsque la sonde flexible est placée au-dessus du site d’injection de la tumeur, aucune bulle ne peut rester sous la sonde, pour deux raisons. Tout d’abord, l’imagerie ne peut pas se poursuivre lorsque des bulles sont présentes. Deuxièmement, les bulles servent d’isolants, modifiant ainsi les propriétés de stimulation électrique. Après avoir pris les précautions décrites ci-dessus, la craniotomie est scellée avec une fenêtre en verre cimentée au crâne pour permettre une imagerie chronique sur plusieurs semaines. Comme la tumeur est constituée de cellules exprimant GCaMP ou DsRed, l’injection peut être confirmée avec un microscope à fluorescence. L’impédance électrochimique des électrodes doit être mesurée pour valider la performance après l’implantation. Par rapport à l’impédance en solution saline, une augmentation de l’impédance est attendue in vivo à des fréquences supérieures à 100 Hz en raison de la présence d’un environnement biologique (Figure 5). Le parenchyme neural vascularisé et l’infiltration tumorale peuvent être observés et caractérisés à travers le substrat transparent pendant des semaines par microscopie à deux photons (Figure 6). L’utilisation d’animaux transgéniques exprimant des protéines fluorescentes dans des cellules d’intérêt (cellules immunitaires et neurones) peut, par exemple, permettre la mise en évidence du processus inflammatoire minimal induit par l’implantation d’électrodes seules (Figure 6A) ou montrer la présence de microglies et de monocytes 26 jours après l’implantation d’une électrode stimulée par PEF implantée au-dessus d’une tumeur GBM en croissance (Figure 6B1 ). Dans ce dernier cas, des cellules dérivées de monocytes périphériques et des cellules microgliales résidant dans le cerveau ont été trouvées autour et à l’intérieur de la tumeur (Figure 6B2). Le jour de la livraison du PEF, les pastilles de contact des électrodes flexibles peuvent être connectées au générateur d’impulsions, directement sous le microscope à deux photons. Dans l’ensemble, ce modèle peut être utilisé pour étudier l’effet des traitements bioélectriques au fil du temps en utilisant différents types de cellules impliquées dans le développement des tumeurs cérébrales, jusqu’à une profondeur d’environ 500 μm.
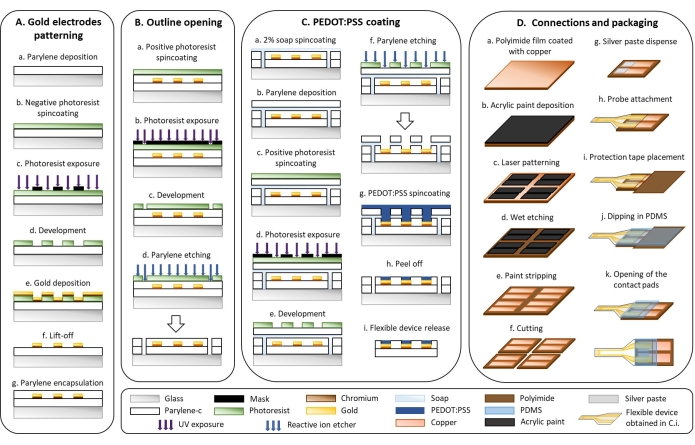
Figure 1 : Microfabrication d’électrodes flexibles. (A) Motif d’électrode en or et substrat de parylène C. B) Ouverture des grandes lignes. (C) PEDOT:revêtement PSS. (D) Connexions et emballage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
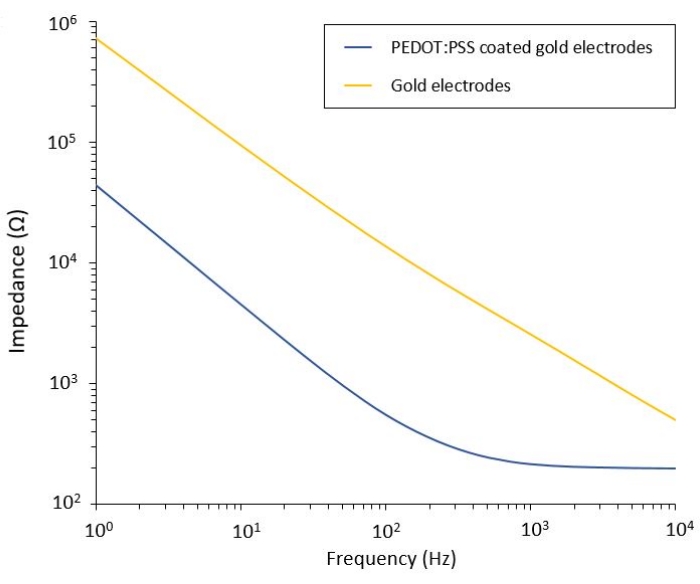
Figure 2 : Spectroscopie d’impédance électrochimique d’électrodes en or flexible et électrodes froides revêtues de PEDOT:PSS dans une solution saline. Veuillez cliquer ici pour voir une version agrandie de cette figure.
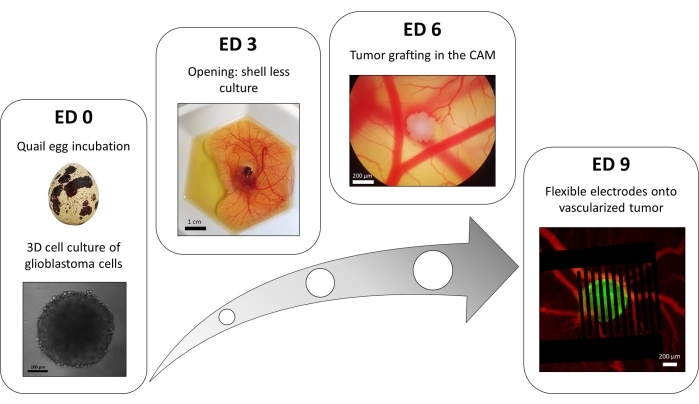
Figure 3 : Le modèle in ovo du glioblastome. ED 0: Sphéroïde observé avec un microscope à fond clair. ED 3: Culture sans coquille d’un embryon de caille 3 jours après ouverture. ED 6: Tumeur implantée dans le CAM observée avec un microscope à fond clair. ED 9 : Dispositif souple placé sur la tumeur vascularisée (tumeur en vert et vaisseaux sanguins en rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.
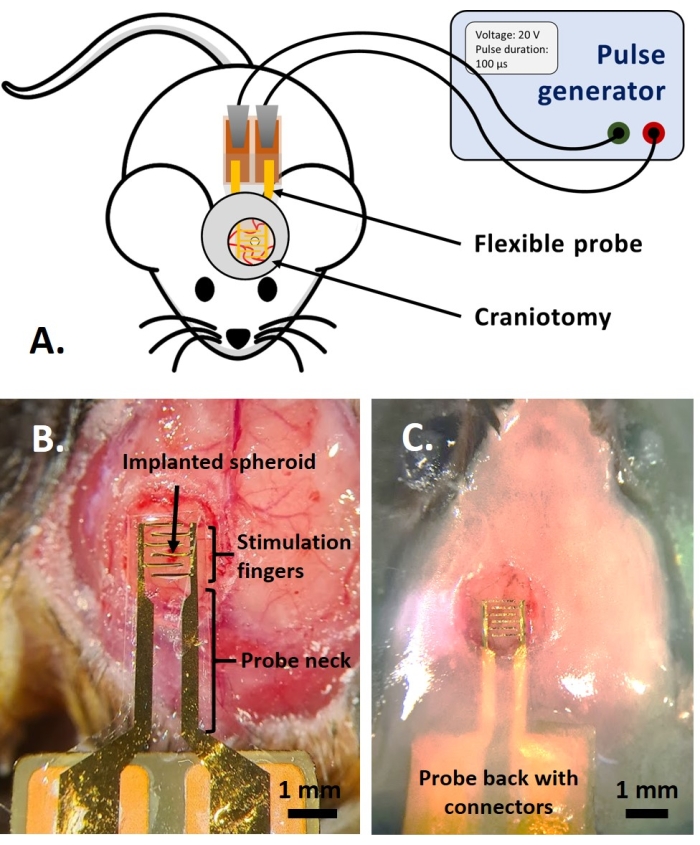
Figure 4: Application in vivo. (A) Schéma pour les expériences in vivo. (B) Mise en place de la sonde avant l’application du verre de couverture et de la résine acrylique. (C) Implantation de la sonde terminée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
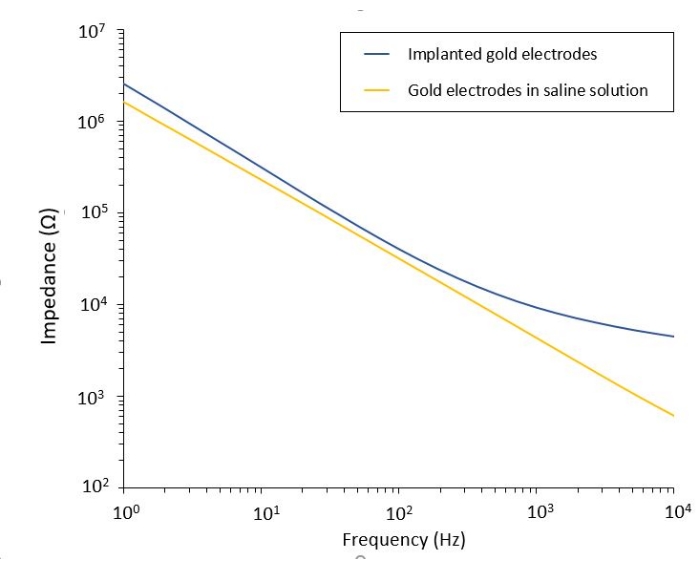
Figure 5 : Spectroscopie d’impédance électrochimique d’électrodes d’or flexibles dans une solution saline par rapport à une sonde implantée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
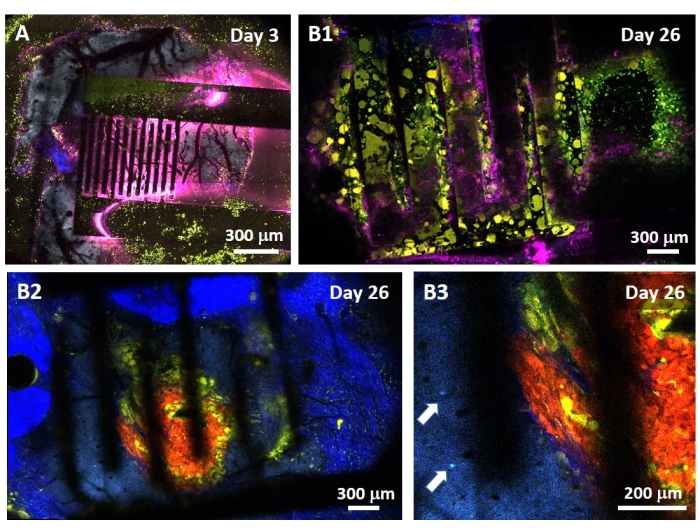
Figure 6 : Imagerie multispectrale intravitale à deux photons à travers des électrodes. (A) Image en mosaïque de la surface saine du cerveau chez une souris témoin multifluorescente AMU-Neuroinflam 3 jours après l’implantation de l’électrode. Le cyan montre l’arborisation dendritique des neurones pyramidaux de la couche 5, le vert montre les granulocytes et les monocytes recrutés, et le jaune montre la microglie activée et les cellules dendritiques. Le rose montre la diffusion infrarouge due à l’accumulation de chaleur. (B1) Image similaire à celle de A mais 26 jours après l’implantation du sphéroïde tumoral à 200 μm de profondeur dans le cortex immédiatement suivie de l’implantation de l’électrode. Notez l’accumulation de cellules immunitaires vertes et jaunes. (B2) Image similaire à celle de B1 mais à 100 μm sous la surface des électrodes. Notons la présence d’arborisation dendritique neuronale bleue à la périphérie de la masse tumorale rouge elle-même infiltrée par la microglie jaune et les cellules dendritiques. Le bleu profond montre un deuxième signal harmonique du collagène péritumoral. (B3) Vue agrandie de B2 montrant la présence de somas interneuronaux (indiqués par des flèches) à proximité de la tumeur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’approche décrite dans ce travail permet aux modèles de tumeurs cérébrales avec un système intégré d’administration de PEF d’étudier l’effet des PEF à différents niveaux de l’organisation biologique. Le protocole de microfabrication se compose de procédés standard à couche mince, qui offrent un grand degré de liberté dans la conception des électrodes qui peut être adapté à l’application spécifique. Parfois, une étape supplémentaire de recuit thermique peut être utile à la fin de la fabrication, pour réduire la flexion des électrodes qui s’est produite pendant la fabrication.
L’utilisation d’une lignée cellulaire de glioblastome stable exprimant un indicateur de calcium fluorescent évite toutes les complications liées à l’administration et à la rétention du colorant, en particulier dans les tumeurs 3D très denses16. En effet, un niveau d’expression élevé est observé sur une longue période par rapport aux indicateurs chimiques fluorescents standardde calcium 17. Ce protocole peut être appliqué à diverses lignées cellulaires, car il est couramment utilisé pour l’imagerie de l’activité neuronale11. Ici, des lignées cellulaires humaines et murines ont été utilisées (U87 et Gl261 pour l’implantation chez des souris immunodéficientes ou immunocompétentes, respectivement). En effet, des études récentes ont montré que la lignée cellulaire U87 est différente de celle des cellules d’origine car de nombreuses mutations ont été acquises au cours d’années de culture cellulaire, affectant la reproductibilité expérimentale18. La méthode utilisée pour la préparation des tumeurs 3D est à haut débit, reproductible, et permet la génération de sphéroïdes d’une taille spécifique en fonction de la lignée cellulaire, du nombre de cellules à l’ensemencement et du temps de croissance19. Cependant, ces sphéroïdes sont denses, ce qui présente un inconvénient lors de l’imagerie au cœur de la tumeur.
Le modèle in ovo est utile comme première approche pour étudier l’effet du PEF sur les tumeurs 3D et leur système vasculaire, sans interactions avec d’autres types de cellules présentes dans le cerveau. Ce modèle est peu coûteux, rapide, à haut débit et soulève moins de questions éthiques que les modèles animaux. Il est important de maintenir l’intégrité de l’embryon tout au long de l’expérience, car cela pourrait affecter sa survie et la qualité de l’imagerie. Des précautions particulières doivent être prises lors de l’ouverture de l’œuf de caille, pour éviter d’endommager la membrane embryonnaire. La greffe et la mise en place des électrodes flexibles doivent également être effectuées avec soin, afin d’éviter les saignements qui pourraient tuer l’embryon. L’injection de colorant fluorescent dans les vaisseaux sanguins permet la visualisation simultanée des cellules tumorales et la vascularisation par microscopie à fluorescence. L’injection intraoculaire doit être effectuée avec précaution pour éviter que le colorant ne s’échappe dans le liquide embryonnaire, ce qui pourrait provoquer une fluorescence résiduelle en arrière-plan qui dégrade la qualité de l’imagerie. Ce modèle peut également être utilisé pour suivre l’absorption du médicament, car il permet l’accès au système circulatoire. Cependant, les expériences sont limitées par le temps de survie de 12 jours de l’embryon, permettant ainsi 7 jours d’observation, ce qui est nettement plus court que le modèle in vivo 21.
Le modèle de tumeur cérébrale in vivo peut être surveillé pendant 4 à 5 semaines avant que les animaux n’atteignent un critère expérimental éthique déterminé par une perte de poids soudaine de 20%. Il est bien toléré et reste en place si la queue de connexion de l’électrode n’est pas trop longue. Sinon, les animaux ont tendance à rayer le connecteur retournant, qui pourrait finalement être déchiré, empêchant ainsi la connexion ultérieure au stimulateur. Cette période de 4 semaines est néanmoins précieuse pour couvrir les différentes étapes du développement du glioblastome. En comparant les densités de cellules tumorales dans le même volume d’intérêt à différents intervalles de temps, l’évolution de la cinétique de croissance tumorale peut être observée. En particulier, une croissance tumorale accrue a été observée au moment de l’interrupteur immunitaire22. Une étude similaire en présence d’une électrode stimulante informerait sur l’effet du PEF sur le taux de prolifération tumorale et la sensibilité tumorale à l’élimination immunitaire. Par rapport au modèle in ovo , le modèle in vivo peut être considéré comme un modèle préclinique précieux pour étudier l’impact des cellules immunitaires sur la progression tumorale et leur contribution à l’effet thérapeutique du PEF. Ce protocole est adapté d’un précédent article avec l’ajout d’un dispositif d’électrode flexible sur la tumeur avant de placer une fenêtre crânienne14. Les traitements bioélectriques aigus et chroniques des tumeurs peuvent être caractérisés par des observations directes et ultérieures avec la microscopie à deux photons, étant donné que la stimulation initiale devrait induire la mort cellulaire et déclencher une dérégulation durable de la réponse immunitaire.
Les connexions de la sonde flexible sont facilement accessibles au microscope à deux photons. Les paramètres de stimulation électrique peuvent ainsi être ajustés en temps réel en fonction de l’effet observé sur le tissu neural et/ou les cellules ciblées, de la même manière qu’un médecin effectuerait des procédures interventionnelles tout en observant des images IRM ou CT de son patient. Une dernière considération est l’importance de sceller soigneusement l’électrode sur le cerveau avec de la superglue et de la colle de silicone pour empêcher la repousse des tissus.
En conclusion, le protocole décrit ici représente un modèle innovant pour étudier l’effet de la thérapie PEF avec des électrodes en polymère organique flexible pour les modèles tumoraux de glioblastome. Les deux modèles présentent différents niveaux de complexité, de sorte que les effets cellulaires, vasculaires ou immunitaires peuvent être séparés pour une meilleure compréhension des mécanismes d’action. Les électrodes superficielles et conformes réduisent les dommages iatrogènes tout en permettant de perturber le microenvironnement tumoral, déclenchant une vasoconstriction ou un dérèglement du calcium intracellulaire15.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Les travaux rapportés ici ont été soutenus par l’Agence Nationale de la Recherche (ANR-18-CE19-0029). Les auteurs remercient chaleureusement S.M. Bardet pour sa contribution à la génération d’une lignée cellulaire GCaMP6f stable et D. O’Connor pour son aide avec le modèle in ovo .
matériels
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
Références
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon