Method Article
Dispositivos eletrônicos orgânicos flexíveis para terapia de campo elétrico pulsado de glioblastoma
Neste Artigo
Resumo
Este trabalho descreve o desenvolvimento de eletrodos interdigitalizados flexíveis para implementação em modelos de tumores cerebrais 3D, a saber, cultura in vitro , modelo in ovo e modelo murino in vivo. O método proposto pode ser utilizado para avaliar os efeitos de campos elétricos pulsados em tumores em diferentes níveis de complexidade.
Resumo
O glioblastoma é difícil de erradicar com terapias oncológicas padrão devido ao seu alto grau de invasividade. Os tratamentos bioelétricos baseados em campos elétricos pulsados (PFE) são promissores para a melhoria da eficiência do tratamento. No entanto, eles dependem de eletrodos rígidos que causam danos agudos e crônicos, especialmente em tecidos moles, como o cérebro. Neste trabalho, eletrônica flexível foi utilizada para entregar PEFs aos tumores e a resposta biológica foi avaliada com microscopia fluorescente. Eletrodos de ouro interdigitalizados em um substrato fino e transparente de parileno-C foram revestidos com o polímero condutor PEDOT:PSS, resultando em um dispositivo conformável e biocompatível. Os efeitos dos PEFs sobre os tumores e seu microambiente foram examinados usando vários modelos biológicos. Primeiro, monocamadas de células de glioblastoma foram cultivadas em cima dos eletrodos para investigar fenômenos in vitro. Como etapa intermediária, um modelo in ovo foi desenvolvido onde esferoides tumorais modificados foram enxertados na membrana embrionária de uma codorna. Devido à ausência de um sistema imunológico, isso levou a tumores altamente vascularizados. Neste estágio inicial de desenvolvimento, os embriões não têm sistema imunológico e os tumores não são reconhecidos como corpos estranhos. Assim, eles podem se desenvolver rapidamente enquanto desenvolvem seus próprios vasos a partir do sistema vascular embrionário existente, o que representa um valioso modelo de câncer 3D. Finalmente, a entrega flexível de eletrodos de PFE foi avaliada em um organismo completo com um sistema imunológico funcional, usando um modelo singênico de camundongo ortoenxerto (intracraniano). Esferoides tumorais foram enxertados no cérebro de camundongos transgênicos multifluorescentes antes da implantação de dispositivos de eletrodos orgânicos flexíveis. Uma janela craniana selada permitiu a imagem multifóton do tumor e seu microambiente durante o tratamento com PFE durante um período de várias semanas.
Introdução
O glioblastoma multiforme (GBM) é um tumor altamente invasivo e, portanto, difícil de erradicar com tratamentos padrão, como ressecção, radioterapia e quimioterapia. Apesar dos tratamentos multimodais, o prognóstico permanece muito ruim e a maioria dos pacientes apresenta progressão da doença em até 1 ano após o diagnóstico 1,2. Recentemente, o desenvolvimento de tratamentos bioelétricos tem mostrado grande potencial para melhorar as terapias existentes. Essas terapias usam a entrega de campos elétricos pulsados (PFE), tipicamente em uma única sessão de tratamento, para interromper a integridade da membrana celular e o microambiente dos tumores. Essa ruptura da membrana celular, também conhecida como eletroporação, pode ser reversível ou irreversível, dependendo da intensidade do campo elétrico e do número de pulsos. A eletroporação irreversível (IRE) é aplicada como uma técnica de ablação tecidual não térmica na qual pulsos elétricos causam danos fatais às membranas celulares, levando à morte celular3. A eletroporação reversível é aplicada na eletroquimioterapia (ECT), uma técnica estabelecida que consiste na administração de PFE em combinação com drogas quimioterápicas para aumentar a captação de drogas em células cancerígenas4. Além disso, estudos recentes demonstraram a eletroporação do cálcio como uma alternativa à ECT com alta eficiência para o tratamento do câncer, que também é barata e induz menos efeitos colaterais5. Apesar desses avanços promissores, os PEFs são geralmente aplicados usando eletrodos rígidos e metálicos que são conhecidos por causar danos aos tecidos moles6. O cérebro é particularmente sensível a tais dispositivos invasivos, onde a incompatibilidade mecânica induz inflamação e cicatrizes astrogliais7.
Nesse contexto, um sistema flexível de administração de PFE em combinação com modelos 3D de tumores de glioblastoma é apresentado, desde a microfabricação até um modelo murino. Os eletrodos conformais são feitos com processos padrão de microfabricação de filme fino, incluindo o uso de materiais macios e biocompatíveis, como parileno-C, ouro e PEDOT: PSS 8,9. Um projeto de eletrodo interdigitado é usado para cobrir uma grande área de superfície, mantendo a transparência adequada para imagens entre os dedos do eletrodo10. Para o modelo tumoral, esferoides 3D de células de glioblastoma expressando um repórter de fluorescência geneticamente codificado são produzidos usando uma variação do método de placa de 96 poços de sobreposição líquida11. Os esferoides são enxertados na membrana corioalantóica de um embrião de codorna, resultando em um modelo in ovo que tem sido amplamente utilizado para estudar angiogênese ou toxicologia medicamentosa12,13. Os tumores podem ser enxertados e vascularizados pela vasculatura do embrião na ausência de um sistema imunológico nessa fase do desenvolvimento embrionário12. Eletrodos flexíveis são então colocados em cima do tumor vascularizado para estudar o efeito da entrega de PFE no esferoide e sua vasculatura. Finalmente, esses efeitos são investigados em um organismo vivo completo, incluindo o microambiente tumoral e o sistema imunológico, implantando esferoides modificados no parênquima cerebral de modelos murinos14. Eletrodos flexíveis são colocados no topo do local de inserção e a craniotomia é selada com uma janela de vidro, permitindo imagens repetidas de dois fótons ao longo de várias semanas.
Esses métodos serão úteis para pessoas interessadas em vários domínios, desde engenharia microeletrônica até aplicações oncológicas. O protocolo de microfabricação pode ser usado e adaptado para qualquer aplicação que exija eletrodos metálicos de filme fino revestidos com PEDOT:PSS. Além disso, os modelos biológicos desenvolvidos para a avaliação de tratamentos elétricos antitumorais serão de interesse geral para a investigação da diferenciação da resposta celular, vascular e imune aos materiais implantados.
Protocolo
Todos os procedimentos experimentais foram realizados de acordo com a legislação francesa e em conformidade com a Diretiva do Conselho da Comunidade Europeia de 24 de novembro de 1986 (86/609/CEE) para o cuidado e uso de animais de laboratório. A pesquisa em animais foi autorizada pela Direction Départementale des Services Vétérinaires des Bouches-du-Rhône e aprovada pelo comitê de ética da Provence Cote D'Azur (Apafis # 22689-2019100414103054).
1. Microfabricação flexível do dispositivo (Figura 1)
- Limpeza das lâminas de vidro
- Lâminas de vidro Sonicate em solução de sabão a 2% por 15 min. Enxágue-os com água.
- Sonicate novamente em uma mistura de 80% de acetona pura e 20% de isopropanol puro por 15 min.
CUIDADO: Estes solventes são nocivos e inflamáveis. Use equipamentos de proteção individual (EPI) e manuseie-os sob um exaustor. - Lave as lâminas com isopropanol e seque com uma pistola de ar.
NOTA: Certifique-se de que a acetona não seque nos substratos durante todo o processo.
- Padronização de eletrodos de ouro (Figura 1A)
- Depositar uma camada de 3 μm de parileno-C (PaC) com um sistema de deposição de parileno (Figura 1Aa).
- Coloque as lâminas de vidro limpas na câmara de deposição. Pulverize sabão no chiller, deixe secar e insira-o na armadilha fria designada do sistema de deposição. Este antiadesivo facilita a fácil remoção da PaC do chiller após a deposição.
CUIDADO: A PaC é irritante e representa um perigo para a saúde. Use luvas ao manuseá-lo. - Pesar 6 g de PaC em um barco de alumínio e colocá-lo no forno. Evacuar a máquina (P = 10 mTorr) e iniciar a deposição com os seguintes parâmetros: TChiller = -100 °C, TFurnace = 690 °C,T Vaporizer = 175 °C e TChamber = 135 °C.
- Quando a deposição estiver concluída e a temperatura do vaporizador estiver abaixo de 40 °C, desligue o resfriador, o vaporizador e o forno. Ventile a máquina e colete as amostras.
- Coloque as lâminas de vidro limpas na câmara de deposição. Pulverize sabão no chiller, deixe secar e insira-o na armadilha fria designada do sistema de deposição. Este antiadesivo facilita a fácil remoção da PaC do chiller após a deposição.
- Ativar a superfície das amostras por tratamento com plasma de oxigênio por 30 s (100 W, 50 sccm).
- Spin-coate as amostras tratadas com plasma com um fotorresistente negativo a 1.000 x g por 40 s. Colocar as amostras numa placa quente a 110 °C durante 2 min (figura 1Ab).
CUIDADO: A solução fotorresistente é inflamável e causa irritação; use EPIs e manuseie-os sob um exaustor. - Coloque um filtro i-line na linha de luz do alinhador de contato de banda larga UV e exponha o fotorresistente através de uma máscara que caracterize o design do eletrodo interdigitado (Figura 1Ac).
NOTA: Eletrodos interdigitalizados com um espaço de 50 ou 250 μm foram projetados usando um editor de layout e fotomáscaras foram encomendadas de uma empresa que produz fotomáscaras de poliéster por fotoplotagem a laser. - Asse as amostras acima a 110 °C numa placa quente durante 3 minutos e deixe-as arrefecer até à temperatura ambiente durante 5 minutos. Mergulhe as amostras em um revelador sem íons metálicos por 3 minutos para remover o fotorresistente não exposto. Enxaguar as amostras com água e secá-las com uma pistola de ar (Figura 1Ad).
CUIDADO: A solução do desenvolvedor é irritante; usar EPI e manusear sob um exaustor. - Ativar a superfície das amostras por tratamento com plasma de oxigênio por 60 s (100 W, 50 sccm).
- Depositar uma camada de adesão de 20 nm de cromo e uma camada de ouro de 300 nm com um evaporador térmico da seguinte forma (Figura 1Ae).
- Ventile a máquina evaporadora e prenda as amostras (viradas para baixo) na placa redonda superior com parafusos metálicos. Encha os cadinhos dedicados, respectivamente, com cromo e ouro. Sele e evacue a máquina para atingir uma pressão abaixo de 5·10-6 Torr. Inicie a rotação do suporte da amostra.
- Selecione o cadinho que contém cromo e aumente lentamente a corrente que passa por ele até que uma taxa de deposição de 0,2 Å·s-1 seja atingida. Abra o obturador e aguarde até que 20 nm de cromo sejam depositados. Feche o obturador e reduza lentamente a corrente até 0 mA.
- Selecione o cadinho que contém ouro e aumente lentamente a corrente que passa por ele até que uma taxa de deposição de 0,2 Å·s-1 seja atingida. Abra o obturador para evaporar o ouro, espere até que 10 nm de ouro seja depositado e, em seguida, aumente a taxa de deposição para 1,5 Å·s-1 até que aproximadamente 300 nm sejam depositados. Feche o obturador e reduza lentamente a corrente para 0 mA.
- Deixe as amostras arrefecerem até à temperatura ambiente durante 15 minutos após a deposição. Pare a rotação do suporte da amostra, ventile a máquina e colete as amostras.
- Mergulhe as amostras em um copo com acetona. Coloque o copo em uma placa de agitação ajustada a 110 rpm por 15 min para levantar o fotorresistente. Enxaguar as amostras com isopropanol e secá-las com pistola de ar (Figura 1Af).
- Ativar a superfície das amostras por tratamento com plasma de oxigênio por 30 s (100 W, 50 sccm).
- Depositar uma camada de isolamento de 3 μm de PaC com um sistema de deposição de parileno (ver passo 1.2.1) (Figura 1Ag).
- Depositar uma camada de 3 μm de parileno-C (PaC) com um sistema de deposição de parileno (Figura 1Aa).
- Abertura do contorno (Figura 1B)
- Girar as amostras com fotorresistência positiva a 600 x g por 35 s. Colocá-lo sobre uma placa quente a 110 °C durante 2 min (Figura 1Ba).
CUIDADO: A solução fotorresistente é inflamável e causa irritação; usar EPI e manusear sob um exaustor. - Certifique-se de que não há filtro i-line na linha de luz do alinhador de contato de banda larga UV e exponha o fotorresistente através de uma máscara que caracterize o contorno do dispositivo com um alinhador de contato de banda larga UV (Figura 1Bb).
- Mergulhe as amostras em um revelador livre de íons metálicos por 4 minutos para remover o fotorresistente exposto. Enxaguar as amostras com água e secá-las com uma pistola de ar (Figura 1Bc).
- Gravar o contorno através das duas camadas de PaC com um gravador de íons reativo (160 W, 22 min, O2: 50 sccm, CF4: 10 sccm) (Figura 1Bd).
- Remova o fotorresistente restante com acetona, enxágue com isopropanol e seque as amostras com uma pistola de ar.
- Girar as amostras com fotorresistência positiva a 600 x g por 35 s. Colocá-lo sobre uma placa quente a 110 °C durante 2 min (Figura 1Ba).
- PEDOT: Revestimento do PSS (Figura 1C)
- Spin-coat uma solução de sabão a 2% a 70 x g por 35 s (Figura 1Ca).
- Depositar uma camada sacrificial de PaC de 3 μm com um sistema de deposição de parileno (ver passo 1.2.1) (Figura 1Cb).
- Fotorresistência positiva de spin-coat a 600 x g por 35 s. Colocar as amostras numa placa quente a 110 °C durante 2 minutos (figura 1Cc).
- Certifique-se de que não há filtro i-line na linha de luz do alinhador de contato de banda larga UV e exponha o fotorresistente através de uma máscara que apresente a superfície ativa dos eletrodos (Figura 1Cd).
- Mergulhe as amostras em um revelador livre de íons metálicos por 4 minutos para remover o fotorresistente exposto. Enxaguar as amostras com água e secá-las com uma pistola de ar (Figura 1Ce).
- Gravar a PaC com uma colcha iónica reactiva para abrir a superfície activa dos eléctrodos (160 W, 24 min, O2: 50 sccm, CF4: 10 sccm). Verifique com um microscópio se não há PaC residual na superfície ativa (Figura 1Cf).
- Remova o fotorresistente restante com acetona, enxágue com isopropanol e seque as amostras com uma pistola de ar.
- Ativar a superfície das amostras usando o tratamento com plasma de oxigênio por 90 s (100 W, 50 sccm).
- Misture uma dispersão comercial de PEDOT:PSS quimicamente polimerizado com 5 vol% de etilenoglicol (EG) e 0,1 vol% de ácido dodecilbenzeno sulfônico (DBSA). Sonicate por 15 min. Adicione 1 % em peso de (3-gliciloxipropil) trimetilsiloxano (GOPS) e sonicate por 5 min. Filtrar a solução através de um filtro de 1,2 μm.
CUIDADO: EG é um irritante e representa um perigo para a saúde. DBSA é um irritante e corrosivo. O GOPS é corrosivo. Use EPIs apropriados e manuseie esses produtos químicos sob um exaustor.
Observação : O volume total depende do número de amostras. Para 10 lâminas de vidro padrão, prepare pelo menos 20 mL que correspondam às seguintes quantidades: 18,78 mL de PEDOT:PSS, 1 mL de EG, 20 μL de DBSA e 200 μL de GOPS. - Spin-coat quatro camadas de solução PEDOT:PSS a 150 x g por 35 s. Após a deposição de cada camada, cozer as amostras a 110 °C durante 60 s sobre uma placa quente e arrefecê-las até à temperatura ambiente durante 5 minutos antes de fiar a camada seguinte (Figura 1Cg).
- Retirar a camada de PaC sacrificial imergindo as amostras em água (Figura 1Ch).
- Assar as amostras a 140 °C durante 1 h.
- Imergir as amostras em água deionizada por 30 min para remover o sabão restante e os compostos de baixo peso molecular no filme PEDOT:PSS e para separar as amostras do substrato de vidro (Figura 1Ci).
- Conexões e empacotamento (Figura 1D)
- Deposite uma fina camada de tinta acrílica sobre um filme de poliimida revestido com cobre (Figura 1Da). Use um aerossol para obter uma camada homogênea de tinta (Figura 1Db).
- Padronizar a tinta acrílica com um laser (75 kHz, 7 W, 1 passagem a laser, 400 mm·s-1) para obter duas almofadas de contato retangulares (5 mm x 15 mm; 1,5 mm de folga) (Figura 1Dc).
- Enterre o cobre em água a 30% (p/v) de cloreto férrico saturado (FeCl3) em água durante 15 minutos a 40 °C (Figura 1Dd).
CUIDADO: FeCl3 é um irritante e corrosivo; manuseie-o com luvas sob um exaustor. - Retire a tinta acrílica com acetona, esfregando-a ligeiramente com um pano (Figura 1De).
- Corte o filme de poliimida padronizado em formas retangulares (15 mm x 30 mm) com um laser (15 kHz, 10 W, 30 passes de laser, 130 mm·s-1) (Figura 1Df).
- Dispensar pasta de prata com uma máquina distribuidora de três eixos a uma pressão de três bar com uma agulha de 330 μm de diâmetro (5 m·min-1) (Figura 1Dg).
CUIDADO: A pasta de prata é um irritante; alça com luvas. - Alinhar e fixar a sonda de PaC com o filme de poliimida sob um microscópio binocular usando pinças (Figura 1Dh).
NOTA: As marcas de alinhamento podem ser padronizadas na etapa 1.5.2 para facilitar o posicionamento da sonda nas almofadas de contato. - Asse a 140 °C durante 2 h no forno.
- Coloque uma fita de proteção de poliimida de 1 cm2 nas almofadas de contato (Figura 1Di).
- Mergulhe a interface onde a sonda PaC e o filme de poliimida estão conectados no PDMS (Figura 1Dj).
- Asse durante 2 h a 50 °C.
- Remova a fita de proteção para abrir as almofadas de contato (Figura 1Dk).
NOTA: A microfabricação de dispositivos in vitro é semelhante, mas as etapas 1.2.1, 1.3 e 1.5 devem ser ignoradas.
2. Geração de glioblastoma GCaMP6f linhagem celular estável
- Produção de lentivírus
- Em um frasco de 75 cm², cultura de uma linhagem celular derivada de HEK 293T otimizada para a produção de lentivírus em 10 mL de Meio de Águia Modificado (DMEM) da Dulbecco contendo 4,5 g· L-1 de glicose, L-glutamina, piruvato de sódio e bicarbonato de sódio e suplementado com 10% de soro fetal bovino livre de tetraciclina (FBS), 100 unidades·mL-1 de penicilina e 100 μg·mL-1 de estreptomicina por pelo menos 3 dias até 80% de confluência.
- Retirar o meio do balão. Lave suavemente as células com 10 mL de solução salina tamponada com fosfato (PBS).
- Adicionar 1 ml de solução de tripsina/EDTA a 0,25% e incubar o balão durante 5 minutos a 37 °C.
CUIDADO: A solução de tripsina/EDTA representa um perigo para a saúde; usar EPI e manusear sob um exaustor. - Adicionar 8 mL de meio de cultura. Lave suavemente a suspensão celular.
- Contar as células e a placa 4 x 106 células em uma placa de Petri em 8 mL de meio de cultura.
- No dia seguinte, diluir 25 μg do plasmídeo contendo o gene GCaMP6f e um marcador de seleção conferindo resistência à puromicina em um volume total de 600 μL de água. Adicione-o a um tubo de reagente de transfecção. Vórtice por 10 s a 3.000 rpm e incube o tubo à temperatura ambiente por 10 min para permitir a produção de nanopartículas.
- Adicione o conteúdo do tubo gota a gota na cultura de células T HEK 293 e agite suavemente à mão. Incubar células a 37 °C durante, pelo menos, 4 h.
- Substitua os meios que contêm complexos de nanopartículas por meios frescos e devolva as células a 37 °C.
- Três dias depois, coletar o sobrenadante e centrifugar a 500 x g por 10 min para remover os detritos celulares. Recolher a fase líquida contendo partículas virais.
NOTA: A produção do vírus no sobrenadante pode ser confirmada usando um teste quantitativo de título de lentivirais e pode ser armazenada a -80 °C por pelo menos 2 anos.
- Transdução de células de glioblastoma
- Num balão de 75 cm², cultura de células de glioblastoma em 10 ml de DMEM contendo 1 g· L-1 de glicose, L-glutamina, piruvato de sódio e bicarbonato de sódio e suplementado com FBS 10% livre de tetraciclina, 100 unidades·mL-1 de penicilina e 100 μg·mL-1 de estreptomicina por pelo menos 4 dias.
- Rejeitar o meio e adicionar o sobrenadante obtido na etapa 2.1.9 nas células-alvo.
- Adicione 5 μg·mL-1 de brometo de hexadimetrina no meio para melhorar a transdução. Incubar durante 6 h a 37 °C. Substitua o meio por 10 mL de meio fresco.
CUIDADO: O brometo de hexadimetrina é um irritante. Manusei-o com luvas.
- Geração de uma linhagem celular estável
- Dois a três dias após a transdução, adicionar 10 mL de DMEM contendo 1 g· L-1 de glicose, L-glutamina, piruvato de sódio e bicarbonato de sódio, 10% FBS, 100 unidades·mL-1 de penicilina, 100 μg·mL-1 de estreptomicina e suplementado com puromicina para matar as células não transduzidas. Células de cultura neste meio por pelo menos 3 dias.
CUIDADO: A puromicina é um irritante; manuseá-lo com luvas.
NOTA: A sensibilidade das células à puromicina deve ser testada antes da transdução por células de cultura no seu meio recomendado contendo diferentes concentrações de puromicina. Um dia depois, verifique as células com um microscópio. Escolha a concentração adequada em que a maioria das células está morta, mas poucas ainda estão vivas, para garantir que o antibiótico não seja muito tóxico e possa matar as células transfectadas também. - Retire o meio e enxágue as células com 10 mL de PBS.
- Adicionar 1 ml de 0,25% de uma solução de tripsina/EDTA e incubar o balão durante 5 minutos a 37 °C.
- Adicionar 8 mL de meio de cultura. Lave suavemente a suspensão celular.
- Recolher 100 μL de suspensão celular e medir a concentração celular com um contador de células. Aspirar 50 μL de suspensão celular em um contador de células automatizado portátil com um sensor de 60 μm.
- Semeie 1 célula/poço em uma placa de 96 poços. Por exemplo, para uma concentração de 1 x 10 3 células por mL, adicione 1 / (1 x 103), ou seja, 0,001 mL de suspensão celular por poço. Semeie cada poço para aumentar as chances de sucesso. Complete com meio de cultura para atingir um volume total de 200 μL por poço.
- Um dia depois, encontre cada poço contendo uma célula e verifique sua fluorescência (λexc = 490 nm e λem = 530 nm). Marque os poços que contêm apenas uma célula transfectada. Continue o crescimento por alguns dias até que o poço esteja quase confluente.
- Descarte o meio e enxágue as células com 200 μL de PBS. Adicionar 100 μL de solução de tripsina/EDTA a 0,25% e incubar a placa de 96 poços durante 5 min a 37 °C.
- Adicionar 100 μL de meio e lavar suavemente a suspensão celular. Transfira a suspensão celular em uma placa de Petri. Adicione 5 mL de meio e deixe as células crescerem por alguns dias até que a placa de Petri esteja quase confluente.
- Descarte o meio e enxágue as células com 5 mL de PBS. Adicionar 1 ml de solução de tripsina/EDTA a 0,25% e incubar a placa de Petri durante 5 min a 37 °C.
- Adicionar 6 ml de meio e lavar suavemente a suspensão celular. Transferir a suspensão celular para um balão T25. Continue o crescimento por alguns dias até que o balão esteja quase confluente.
- Descarte o meio e enxágue as células com 5 mL de PBS. Adicionar 1 ml de solução de tripsina/EDTA a 0,25% e incubar o balão T25 durante 5 min a 37 °C. Adicionar 7 ml de DMEM contendo 1 g· L-1 de glicose, L-glutamina, piruvato de sódio e bicarbonato de sódio, e suplementado com 10% de FBS, 100 unidades·mL-1 de penicilina e 100 μg·mL-1 de estreptomicina. Lave suavemente a suspensão celular.
- Dividir a suspensão celular em quatro frascos de T25 (2 ml por balão) e adicionar 5 ml de meio a cada balão. Deixe as células crescerem por alguns dias até que os frascos estejam quase confluentes.
- Repetir o passo 2.3.12 para três balões e manter o último balão para o passo 3.1.3. Transferir a suspensão celular para um tubo cônico de 15 mL e centrífuga a 150 x g por 5 min. Descarte o sobrenadante e ressuspenda o pellet celular em 900 μL. Misture suavemente as células para manter uma suspensão celular homogênea.
- Transfira a suspensão celular para frascos de armazenamento criogênico. Adicionar 100 μL de sulfóxido de dimetilo. Colocar os criovios a -80 °C durante a noite. Transfira células congeladas para nitrogênio líquido para novos experimentos.
NOTA: A eficiência da transfecção pode ser avaliada pela adição de 5 μM de sal de cálcio de ionomicina no meio e verificando o aumento induzido da fluorescência sob um microscópio de fluorescência (λexc = 490 nm e λem = 530 nm).
- Dois a três dias após a transdução, adicionar 10 mL de DMEM contendo 1 g· L-1 de glicose, L-glutamina, piruvato de sódio e bicarbonato de sódio, 10% FBS, 100 unidades·mL-1 de penicilina, 100 μg·mL-1 de estreptomicina e suplementado com puromicina para matar as células não transduzidas. Células de cultura neste meio por pelo menos 3 dias.
3.3D modelos
- Cultura esferoide
- Preparar uma solução de agarose a 1% (p/v) em água deionizada (DI).
- Adicione 100 g de pó de agarose em 100 mL de água DI e aqueça a solução em um forno de micro-ondas até que todo o pó esteja dissolvido. Mexa a solução regularmente para evitar aglomerados. Autoclave a solução durante 20 min a 120 °C.
- Uma vez recuperado da autoclave, adicione 75 μL de solução de agarose por poço em uma placa de 96 poços com cuidado. Deposite-o no lado do poço para formar um menisco, resultando em um fundo redondo não aderente. Deixe solidificar por 15 min à temperatura ambiente.
- Retirar as células (etapa 2.3.12) do balão obtido na fase 2.3.14.
- Adicionar 10.000 células por poço de células de glioblastoma e completar para atingir um volume total de 150 μL por poço com DMEM contendo 1 g· L-1 de glicose, L-glutamina, piruvato de sódio e bicarbonato de sódio, e suplementado com 10% de soro fetal bovino (FBS), 100 unidades·mL-1 de penicilina e 100 μg·mL-1 de estreptomicina.
- Incubar as células a 37 °C sem mover a placa durante 3 dias. Em seguida, substitua metade da mídia por mídia nova a cada 2 dias por uma pipeta multicanal até novos experimentos. Mantenha a ponta da pipeta na parte superior do poço para evitar danos à agarose ou ao próprio esferoide.
NOTA: O tamanho dos esferoides depende do número de células semeadas e da linhagem celular, por isso deve ser adaptado dependendo dos experimentos.
- Preparar uma solução de agarose a 1% (p/v) em água deionizada (DI).
- O modelo in ovo
- Coloque ovos fertilizados de codorna japonesa (C. japonica) em uma incubadora (37 °C e 57% de umidade) em bandejas com um rotador automático que gira os ovos a cada 2 h. Este dia é considerado Dia Embrionário (ED) 0.
- Lave os barcos de pesagem de plástico, colocando-os em etanol a 70% (p/v). Retire os barcos de pesagem e seque-os sob um exaustor.
NOTA: A partir deste ponto, os experimentos não são realizados em condições estéreis. No entanto, condições limpas são necessárias para evitar o desenvolvimento de mofo nos embriões. - No ED3, abra suavemente os ovos usando uma pinça com pontas finas pré-lavadas com etanol a 70% (p/v). Deite o embrião num barco de pesagem de plástico, cubra-o com outro barco de pesagem e coloque-o numa incubadora humidificada padrão a 37 °C durante 3 dias.
- No ED6, faça uma pequena incisão na membrana corioalantóica (CAM) com uma agulha de 23 G.
- Usando uma pipeta, coloque um esferoide de 7 dias na incisão e devolva o embrião à incubadora por 3 dias, até novos experimentos.
NOTA: Um corante fluorescente pode ser injetado no olho do embrião para visualizar os vasos sanguíneos. - No dia do experimento, coloque a sonda flexível em cima do tumor vascularizado usando um micromanipulador.
- O in vivo modelo
NOTA: Esta parte do protocolo é adaptada da anteriormente publicada em referência14. Foram utilizados camundongos adultos fluorescentes multicoloridos AMU-Neuroinflam (B6.Cg-Tg(Thy1-CFP)23Jrs(Ly6a-EGFP)G5Dzk(Itgax-EYFP)1Mnz/FD); esses camundongos apresentam marcação de uma subpopulação de Thy1+ neurônios por expressão transgênica de ECFP, marcação de LyzM periférico+ células inflamatórias por expressão transgênica de EGFP e marcação de um subtipo de micróglia expressando EYFP sob o controle de Cd11c+. Em resumo, os animais são levemente sedados com isoflurano a 1,5% por 2 minutos antes de qualquer tratamento ou injeção. Antes da cirurgia, os animais são anestesiados com cetamina (120 mg/kg; IP) e Xilazina (12 mg/kg; IP). Em seguida, o gel de lidocaína a 3% é aplicado localmente para aliviar qualquer dor nos ouvidos associada à fixação do suporte estereotáxico. Em seguida, a solução de bupivacaína a 0,25% é administrada no local cirúrgico para aliviar qualquer dor devido à craniotomia. Uma vez preparado o camundongo para a cirurgia, uma craniotomia de 4 mm de diâmetro foi realizada de acordo com a referência14. Com uma agulha de 26 G, foi feito um orifício na dura-máter no meio da craniotomia e o esferoide tumoral foi injetado com o sistema de injeção descrito na referência14. Além disso, como descrito aqui, um eletrodo flexível foi colocado no GCamp6 ou DsRed expressando esferoide tumoral antes de selar a craniotomia com uma janela de vidro.- Coloque uma gota de Dulbecco's Phosphate-Buffered Saline (DPBS) para que cubra a craniotomia. Coloque o eletrodo flexível na gota de DPBS e coloque suavemente a parte de trás da sonda com almofadas de contato na parte de trás do mouse (Figura 4B).
NOTA: Use luvas estéreis e uma técnica de "apenas ponta". Troque as luvas se uma superfície não estéril for contatada. Forneça suporte térmico durante este procedimento. - Toque na gota de DPBS com um pequeno pedaço de papel para absorver o DPBS até que a sonda possa ficar plana na dura-máter e seguir a curvatura do cérebro. Certifique-se de que uma pequena camada de DPBS permaneça abaixo dos eletrodos sem escapar do lado do eletrodo. Isso garante uma barreira contra o transbordamento de cola durante as próximas etapas.
NOTA: Esterilize todos os equipamentos antes de usar. - Coloque uma pequena gota de adesivo de silicone na sonda e cubra-a com um vidro de cobertura redonda de 5 mm. Empurre o vidro da tampa para baixo até que o silicone esteja uniformemente distribuído e a distância entre o vidro da tampa e a sonda seja mínima. Empurre o vidro da tampa para baixo por mais 30 s para que o silicone possa se solidificar.
- Para fixar o vidro da tampa, aplique rapidamente a supercola em seus lados e empurre-a para baixo até que a cola se torne sólida.
- Usando um palito de dente, aplique supercola no pescoço da sonda, tomando cuidado para que a supercola seja desenhada sob o pescoço para fornecer suporte estável para ela.
- Cubra o crânio com cimento dental para construir uma tampa crônica. Tome especial cuidado para cobrir apenas as bordas do vidro da tampa.
- Levante a parte de trás da sonda e aplique cimento sob o pescoço da sonda. Coloque a sonda no cimento antes que ele cure. Empurre o pescoço da sonda suavemente com pinça contundente para que sua superfície esteja no mesmo nível que a do vidro da tampa e não no caminho da objetiva do microscópio durante o experimento.
- Cubra a parte superior do pescoço da sonda com não mais de 1,5 mm de camada de cimento dentário para obter uma fixação firme na sonda. Construir um poço de cimento apresentando uma crista de 1,5 mm a uma distância de 1-2 mm ao redor do vidro de cobertura para criar uma bacia para o fluido de imersão para a imagem de dois fótons (Figura 4C).
- Após a cura do cimento, aplicar analgésicos pós-cirúrgicos de buprenorfina (0,05 mg/kg, 0,1 mL por 10 g de peso corporal por via subcutânea) e manter o animal em ambiente quente até que ele acorde. Isso inclui a proximidade de uma lâmpada infravermelha, bem como embrulhar o animal em uma toalha de papel.
NOTA: Coloque um termômetro no nível do mouse para monitorar a temperatura. - Caracterizar a impedância na faixa de 1-10 kHz usando um potenciostato.
- Deixe o animal se recuperar da cirurgia por pelo menos 10 dias. Administrar anti-inflamatórios imediatamente após a cirurgia e continuar monitorando o estado do animal para fornecer analgesia pós-operatória apropriada.
- Coloque uma gota de Dulbecco's Phosphate-Buffered Saline (DPBS) para que cubra a craniotomia. Coloque o eletrodo flexível na gota de DPBS e coloque suavemente a parte de trás da sonda com almofadas de contato na parte de trás do mouse (Figura 4B).
4. Entrega e imagem do Campo Elétrico Pulsado (PEF)
- Coloque os espécimes sob um microscópio de fluorescência. No caso dos modelos 3D, os tumores só podem ser observados a partir do topo.
NOTA: Para o modelo in ovo , os experimentos foram realizados em microscópio de epifluorescência (mas também é possível com microscópio de dois fótons), enquanto os experimentos no modelo in vivo foram realizados sob microscópio de dois fótons (Figura 6). - Conecte um gerador de pulso às almofadas de contato dos dispositivos, usando conectores de pino pogo (in vitro) ou clipes de crocodilo (in ovo e in vivo) (Figura 4A). Defina os parâmetros desejados (número de pulsos, tensão, duração do pulso, frequência) e aplique os PEFs executando o gerador (Figura 4A). Meça a fluorescência simultaneamente para observar os efeitos dos PEFs em tempo real.
Resultados
Este protocolo permite a aplicação a dois modelos de glioblastoma nos quais um sistema flexível de entrega de PFE é integrado. Seguindo as etapas de microfabricação e embalagem, eletrodos flexíveis são caracterizados em solução salina por espectroscopia de impedância eletroquímica (EIS) para avaliar e validar seu desempenho. Os eletrodos revestidos com PEDOT:PSS mostram as regiões tipicamente dominadas por capacitivo e resistivo separadas por uma frequência de corte, enquanto os eletrodos não revestidos apresentam apenas comportamento capacitivo (Figura 2).
Uma variação do método de placa de 96 poços de sobreposição líquida é usada para cultivar tumores 3D feitos de células de glioblastoma transfectadas expressando de forma estável um repórter de cálcio intracelular fluorescente. O crescimento dos esferoides pode ser observado com um microscópio de campo brilhante (Figura 3; ED 0). Pelo menos 2 ou 3 dias são necessários para obter esferoides esféricos e densos, dependendo da linhagem celular e do número de células semeadas.
No modelo in ovo , os esferoides são enxertados na membrana corioalantóica de um embrião de codorna (Figura 3; ED 6). O sucesso do enxerto pode ser avaliado por microscopia de fluorescência alguns dias depois, uma vez que as células vivas possuem cálcio intracelular, sendo, portanto, fluorescentes (Figura 3; ED 9). A vascularização do tumor pode ser observada em microscópio de fluorescência por injeção de corante fluorescente nos vasos sanguíneos (Figura 3; ED9). No entanto, nem sempre pode ser possível visualizar os vasos sanguíneos dentro do tumor, pois o esferoide é muito denso. Os eletrodos interdigitados flexíveis são colocados sobre o tumor vascularizado (Figura 3; ED 9) e conectado a um gerador de pulso. A sonda deve ser colocada suavemente para evitar sangramento do embrião; caso contrário, o corante fluorescente pode se espalhar, o que obstrui qualquer observação por imagem. A entrega correta do pulso ao ambiente biológico pode ser verificada medindo a corrente que passa pelo circuito. A imagem destes em modelos ovolitros permite o monitoramento em tempo real do efeito das PFE sobre o cálcio intracelular em um tumor de glioblastoma 3D, bem como da vasoconstrição induzida na vasculatura do tumor, evitando qualquer influência de outros tipos celulares, incluindo o sistema imunológico15.
O estudo do efeito do PFE sobre o glioblastoma também pode ser realizado em um modelo mais completo e preditivo. De fato, o modelo in vivo descrito acima14 consiste em enxertar um tumor de glioblastoma 3D no parênquima cerebral de um camundongo (Figura 4). O local de injeção do tumor é entupido por um hemi-grânulo de gel de dextrano reticulado, para recapitular as restrições biofísicas fisiológicas durante o crescimento do tumor. Embora descrito na referência14, vale ressaltar novamente que é criticamente importante que o hemi-cordão de dextrano seja precisamente supercolado à dura-máter; caso contrário, o tumor pode escapar através da dura-máter aberta e cobrir completamente o cérebro, tornando a imagem impossível. Para qualquer imagem crônica, o crescimento do tecido que ocorre à medida que a janela craniana cicatriza representa uma séria barreira, pois o novo tecido não é transparente e torna as imagens nebulosas ou inutilizáveis. Portanto, depois de inserir e colar o hemi-talão, as paredes laterais da janela craniana aberta precisam ser seladas com uma fina camada de supercola meticulosamente colocada ao redor da parede da cavidade, sem deixar a supercola escorregar ou fluir para a dura-máter. Quando a sonda flexível é colocada no topo do local de injeção do tumor, nenhuma bolha pode ficar sob a sonda, por duas razões. Em primeiro lugar, a imagem não pode prosseguir quando as bolhas estão presentes. Em segundo lugar, as bolhas servem como isolantes, alterando assim as propriedades de estimulação elétrica. Depois de tomar as precauções descritas acima, a craniotomia é selada com uma janela de vidro cimentada ao crânio para permitir imagens crônicas ao longo de semanas. Como o tumor consiste em células expressivas GCaMP ou DsRed, a injeção pode ser confirmada com um microscópio de fluorescência. A impedância eletroquímica dos eletrodos deve ser medida para validar o desempenho após a implantação. Em comparação com a impedância em solução salina, espera-se um aumento da impedância in vivo em frequências acima de 100 Hz devido à presença de um ambiente biológico (Figura 5). Parênquima neural vascularizado e infiltração tumoral podem ser observados e caracterizados através do substrato transparente ao longo de semanas por microscopia de dois fótons (Figura 6). O uso de animais transgênicos expressando proteínas fluorescentes em células de interesse (células imunes e neurônios) pode, por exemplo, permitir a demonstração do processo inflamatório mínimo induzido apenas pelo implante de eletrodos (Figura 6A) ou mostrar a presença de micróglia e monócitos 26 dias após o implante de um eletrodo estimulado por PFE implantado em cima de um tumor GBM em crescimento (Figura 6B1 ). Neste último caso, tanto células derivadas de monócitos periféricos quanto células microgliais residentes no cérebro foram encontradas ao redor e dentro do tumor (Figura 6B2). No dia da entrega do FPE, as almofadas de contato dos eletrodos flexíveis podem ser conectadas ao gerador de pulso, diretamente sob o microscópio de dois fótons. No geral, este modelo pode ser usado para investigar o efeito de tratamentos bioelétricos ao longo do tempo usando vários tipos de células envolvidas no desenvolvimento de tumores cerebrais, até uma profundidade de cerca de 500 μm.
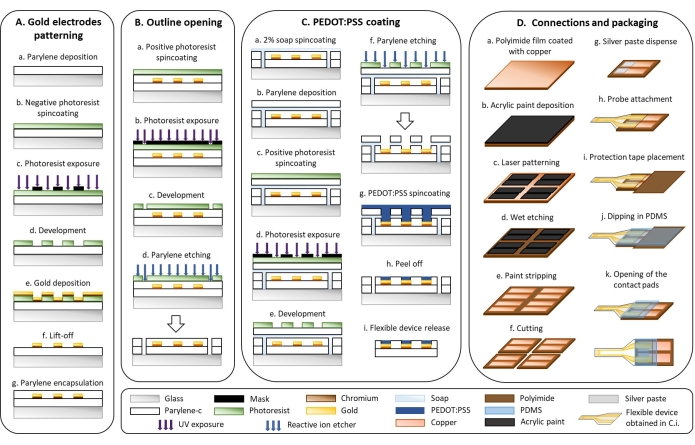
Figura 1: Microfabricação de eletrodos flexíveis. (A) Padronização de eletrodos de ouro e substrato de Parileno C. (B) Abertura do esboço. (C) PEDOT: revestimento PSS. (D) Conexões e embalagens. Por favor, clique aqui para ver uma versão maior desta figura.
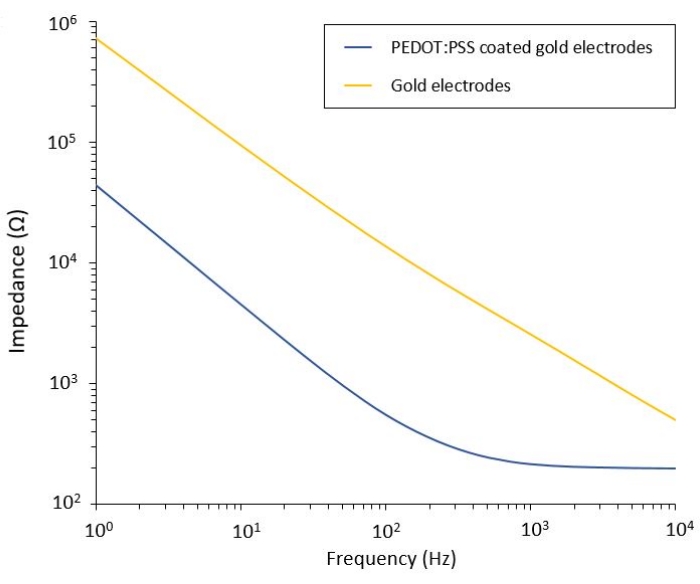
Figura 2: Espectroscopia de impedância eletroquímica de eletrodos de ouro flexíveis e eletrodos frios revestidos com PEDOT:PSS em uma solução salina. Clique aqui para ver uma versão maior desta figura.
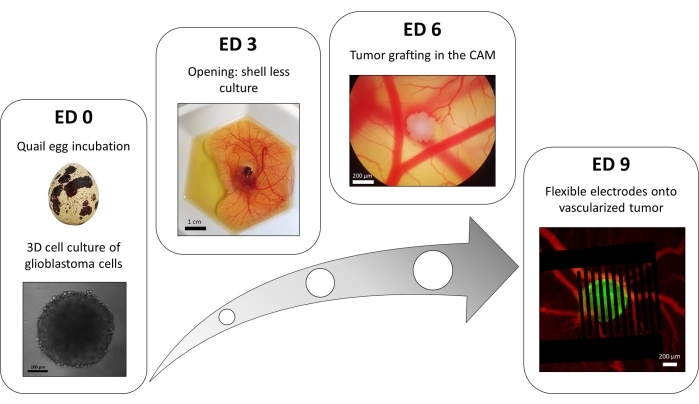
Figura 3: O modelo in ovo do glioblastoma. ED 0: Esferoide observado com um microscópio de campo brilhante. ED 3: Shell less culture de um embrião de codorna 3 dias após a abertura. ED 6: Tumor implantado na CAM observado com microscópio de campo brilhante. ED 9: Dispositivo flexível colocado no tumor vascularizado (tumor em verde e vasos sanguíneos em vermelho). Por favor, clique aqui para ver uma versão maior desta figura.
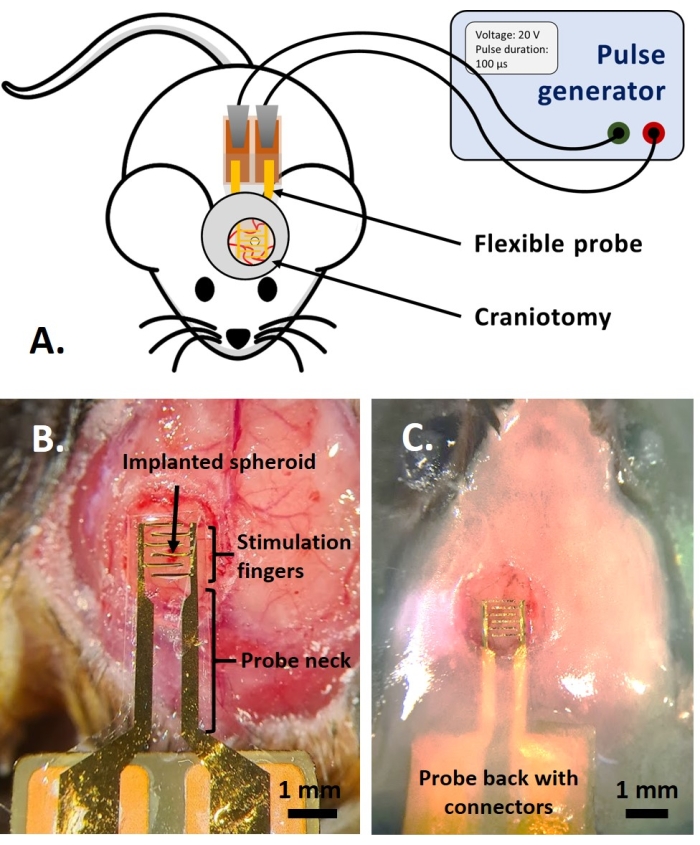
Figura 4: A aplicação in vivo . (A) Esquema para experimentos in vivo. (B) Colocação da sonda antes da aplicação do vidro de cobertura e da resina acrílica. (C) Implantação da sonda concluída. Por favor, clique aqui para ver uma versão maior desta figura.
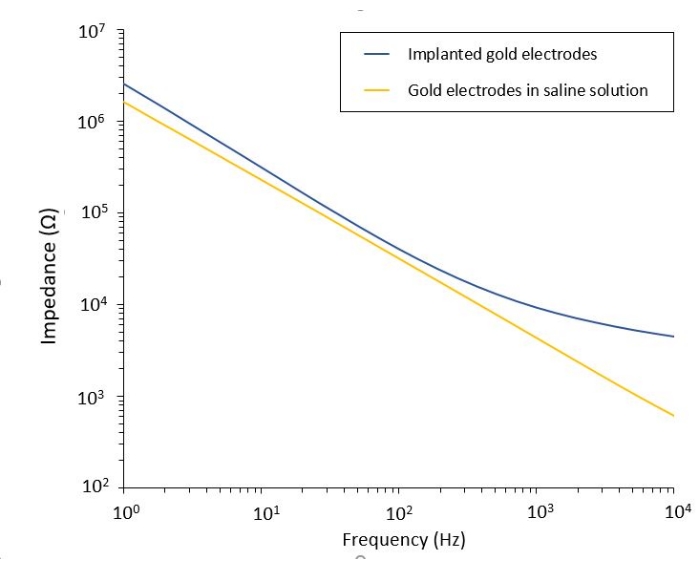
Figura 5: Espectroscopia de impedância eletroquímica de eletrodos de ouro flexíveis em uma solução salina em comparação com uma sonda implantada. Clique aqui para ver uma versão maior desta figura.
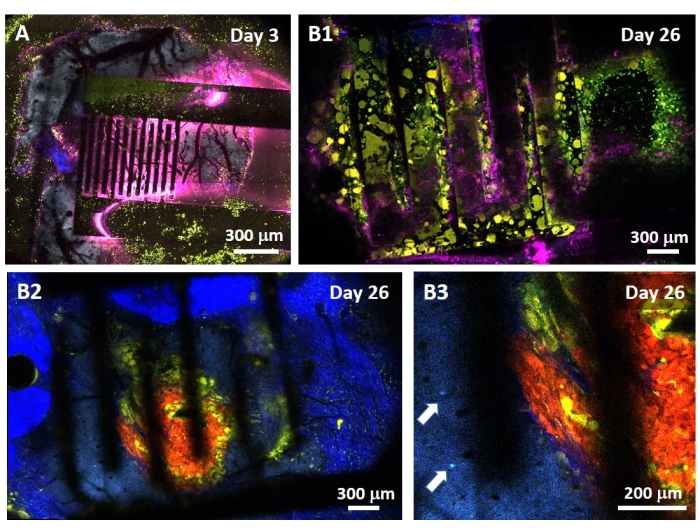
Figura 6: Imagem multiespectral intravital de dois fótons através de eletrodos . (A) Imagem em mosaico da superfície cerebral saudável em um camundongo AMU-Neuroinflam multifluorescente controle 3 dias após o implante do eletrodo. O ciano mostra a arborização dendrítica dos neurônios piramidais da camada 5, o verde mostra granulócitos e monócitos recrutados e o amarelo mostra a micróglia ativada e as células dendríticas. O rosa mostra a difusão infravermelha devido ao acúmulo de calor. (B1) Imagem semelhante à de A, mas 26 dias após o implante esferoide do tumor 200 μm de profundidade dentro do córtex imediatamente seguido de implantação de eletrodo. Observe o acúmulo de células imunes verdes e amarelas. (B2) Imagem semelhante à da B1 , mas 100 μm abaixo da superfície dos eléctrodos. Observe a presença de arborização dendrítica neuronal azul na periferia da própria massa tumoral vermelha infiltrada por micróglia amarela e células dendríticas. O azul profundo mostra um segundo sinal harmônico do colágeno peritumoral. (B3) Vista ampliada de B2 mostrando a presença de somas de interneurônios (indicados por setas) nas proximidades do tumor. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
A abordagem descrita neste trabalho permite que modelos de tumores cerebrais com um sistema integrado de entrega de PFE estudem o efeito de PFE em diferentes níveis de organização biológica. O protocolo de microfabricação consiste em processos padrão de filme fino, que proporcionam um grande grau de liberdade no projeto de eletrodos que podem ser adaptados à aplicação específica. Às vezes, uma etapa adicional de recozimento térmico pode ser útil no final da fabricação, para reduzir a flexão dos eletrodos que ocorreu durante a fabricação.
O uso de uma linhagem celular de glioblastoma estável expressando um indicador fluorescente de cálcio evita todas as complicações ligadas à entrega e retenção de corantes, especialmente em tumores 3D muito densos16. De fato, um alto nível de expressão é observado durante um longo período em comparação com os indicadores químicos padrão de cálcio fluorescente17. Esse protocolo pode ser aplicado a várias linhagens celulares, pois é comumente utilizado para a atividade neural de imagem11. Aqui, foram utilizadas linhagens celulares humanas e murinas (U87 e Gl261 para implantação em camundongos imunodeficientes ou imunocompetentes, respectivamente). De fato, estudos recentes mostraram que a linhagem celular U87 é diferente da das células originais, pois muitas mutações foram adquiridas ao longo de anos de cultura celular, afetando a reprodutibilidade experimental18. O método utilizado para a preparação de tumores 3D é de alto rendimento, reprodutível e permite a geração de esferoides de tamanho específico, dependendo da linhagem celular, do número de células na semeadura e do tempo de crescimento19. No entanto, esses esferoides são densos, o que apresenta uma desvantagem ao visualizar o núcleo do tumor.
O modelo in ovo é útil como uma primeira abordagem para estudar o efeito do PFE em tumores 3D e sua vasculatura, sem interações com outros tipos de células que estão presentes no cérebro. Esse modelo é barato, rápido, de alto rendimento e levanta menos questões éticas do que os modelos animais. É importante manter a integridade do embrião durante todo o experimento, pois isso pode afetar sua sobrevivência e a qualidade da imagem. Cuidados especiais devem ser tomados ao abrir o ovo de codorna, para evitar danos à membrana embrionária. O enxerto e a colocação dos eletrodos flexíveis também devem ser realizados com cuidado, para evitar sangramento que possa matar o embrião. A injeção de corante fluorescente nos vasos sanguíneos permite a visualização simultânea das células tumorais e a vascularização com microscopia de fluorescência. A injeção intraocular deve ser realizada com cuidado para evitar que o corante vaze para o líquido embrionário, o que poderia causar uma fluorescência residual no fundo que degrada a qualidade da imagem. Esse modelo também pode ser utilizado para acompanhar a captação de medicamentos, pois permite o acesso ao sistema circulatório. No entanto, os experimentos são limitados pelo tempo de sobrevivência de 12 dias do embrião, permitindo assim 7 dias de observação, o que é significativamente menor do que o modelo in vivo 21.
O modelo de tumor cerebral in vivo pode ser monitorado por 4 a 5 semanas antes que os animais atinjam um desfecho experimental ético determinado por uma súbita perda de peso de 20%. É bem tolerado e permanece no lugar se a cauda de conexão do eletrodo não for muito longa. Caso contrário, os animais tendem a arranhar o conector de viragem, que pode ser rasgado, impedindo assim a conexão subsequente com o estimulador. Este período de 4 semanas é, no entanto, valioso para cobrir os diferentes estágios do desenvolvimento do glioblastoma. Ao comparar as densidades de células tumorais no mesmo volume de interesse em diferentes intervalos de tempo, a evolução da cinética de crescimento tumoral pode ser observada. Em particular, observou-se aumento do crescimento tumoral no momento da troca imune22. Um estudo semelhante na presença de um eletrodo estimulante informaria sobre o efeito do PFE na taxa de proliferação tumoral e na sensibilidade do tumor à eliminação imunológica. Em comparação com o modelo in ovo , o modelo in vivo pode ser visto como um valioso modelo pré-clínico para estudar o impacto das células imunes na progressão do tumor e sua contribuição para o efeito terapêutico do PFE. Este protocolo é adaptado de um artigo anterior com a adição de um dispositivo de eletrodo flexível no tumor antes da colocação de uma janela craniana14. Tanto o tratamento bioelétrico agudo quanto o crônico de tumores podem ser caracterizados por observações diretas e subsequentes com microscopia de dois fótons, uma vez que a estimulação inicial deve induzir a morte celular e desencadear uma desregulação duradoura da resposta imune.
As conexões da sonda flexível são facilmente acessíveis sob o microscópio de dois fótons. Os parâmetros de estimulação elétrica podem, portanto, ser ajustados em tempo real com base no efeito observado no tecido neural e / ou nas células-alvo, semelhante à forma como um médico realizaria procedimentos intervencionistas ao observar imagens de ressonância magnética ou tomografia computadorizada de seu paciente. Uma consideração final é a importância da vedação cuidadosa do eletrodo no cérebro com supercola e cola de silicone para evitar o crescimento do tecido.
Em conclusão, o protocolo aqui descrito representa um modelo inovador para estudar o efeito da terapia com PFE com eletrodos de polímero orgânico flexíveis para modelos tumorais de glioblastoma. Os dois modelos exibem diferentes níveis de complexidade, de modo que os efeitos celulares, vasculares ou imunológicos podem ser separados para uma melhor compreensão dos mecanismos de ação. Eletrodos conformais e superficiais reduzem o dano iatrogênico ao mesmo tempo em que possibilitam a ruptura do microambiente tumoral, desencadeando vasoconstrição ou desregulação do cálcio intracelular15.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
O trabalho aqui relatado foi apoiado pela Agência Nacional de Pesquisa da França (ANR-18-CE19-0029). Os autores agradecem calorosamente a S.M. Bardet por sua contribuição para a geração de uma linhagem celular GCaMP6f estável e a D. O'Connor por sua ajuda com o modelo in ovo .
Materiais
| Name | Company | Catalog Number | Comments |
| (3-Glycidyloxypropyl)trimethoxysilane | Sigma | 440167 | GOPS |
| 0.25% Trypsin-EDTA (1X) | Gibco | 25200-056 | |
| 4-Dodecylbenzenesulfonic acid | Sigma | 44198 | DBSA |
| 96-well plate | Falcon | 353075 | |
| Acetone | Technic | 530 | |
| Acrylic resin | Fischer scientific | NC1455685 | |
| agarose | Sigma | A9539 | |
| autoclave | Tuttnauer | 3150 EL | |
| AZ 10XT | Microchemicals | Positive photoresist | |
| AZ 826 MIF Developer | Merck | 10056124960 | Metal-ion-free developer for the negative photoresist |
| AZ Developer | Merck | 10054224960 | Metal-ion-free developer for the positive photoresist |
| AZ nLof 2070 | Microchemicals | Negative photoresist | |
| Buprenorphine | Axience | ||
| Carprofen | Rimadyl | ||
| Centrifuge Sorvall Legend X1R | Thermo Scientific | 75004260 | |
| CMOS camera Prime 95B | Photometrics | ||
| CO2 incubator HERAcell 150i | Thermo scientific | ||
| DAC board | National Instruments | USB 6259 | |
| Déco spray Pébéo | Cultura | 3167860937307 | Black acrylic paint |
| Dextran Texas Red 70.000 | Thermofisher | D1830 | |
| Die bonding paste "Epinal" | Hitachi | EN-4900GC | Silver paste |
| Dimethyl sulfoxide | Sigma | D2438 | |
| Dispensing machine | Tianhao | TH-2004C | |
| Dulbecco’s Modified Eagle’s Medium + GlutaMAX™-I | Gibco | 10567-014 | |
| Dulbecco's Modified Eagle's Medium | Sigma | D6429 | |
| Egg incubator COUVAD'OR 160 | lafermedemanon.com | ||
| Ethylene glycol | Carl Roth | 6881.1 | |
| Fertilized eggs of Japanese quail | Japocaille | ||
| Fetal Bovine Serum | VWR | S181BH | |
| Flask | Greiner | 658170 | |
| Fluorescence macroscope | Leica MZFLIII | ||
| Gl261 | DSMZ | ACC 802 | |
| Gold pellets - Dia 3 mm x 6 mm th | Neyco | ||
| Handheld automated cell counter | Millipore | PHCC00000 | |
| Heating and drying oven | Memmert | UF110 | |
| Hexadimethrine Bromide Sequa-brene | Sigma | S2667 | |
| hot plate Delta 6 HP 350 | Süss Microtec | ||
| Illumination system pE-4000 | CoolLed | ||
| Infrared tunable femtosecond laser (Maï-Taï) | Spectra Physics (USA) | ||
| Ionomycin calcium salt | Sigma | I3909 | |
| Kapton tape SCOTCH 92 33x19 | 3M | Polyimide protection tape | |
| Lab made pulse generator | |||
| Labcoter 2 Parylene Deposition system PDS 2010 | SCS | ||
| Lenti-X 293 T cell line | Takara Bio | 63218 | HEK 293T-derived cell line optimized for lentivirus production |
| Lenti-X GoStix Plus | Takara Bio | 631280 | Quantitative lentiviral titer test |
| Mask aligner MJB4 | Süss Microtec | ||
| Micro-90 Concentrated cleaning solution | International Products | M9050-12 | |
| Microscope slides 76 x 52 x 1 mm | Marienfeld | 1100420 | |
| Needles 30G | BD Microlance 3 | 304000 | |
| PalmSens4 potentiostat | PalmSens | ||
| parylene-c : dichloro-p-cyclophane | SCS | 300073 | |
| PCB Processing Tanks | Mega Electronics | PA104 | |
| PEDOT:PSS Clevios PH 1000 | Heraeus | ||
| penicillin / streptomycin | Gibco | 15140-122 | |
| Petri dish | Falcon | 351029 | |
| pGP-CMV-GCaMP6f | Addgene | 40755 | plasmid |
| Phosphate Buffer Saline solution | Thermofisher | D8537 | |
| Plasma treatment system PE-100 | Plasma Etch | ||
| PlasmaLab 80 Reactive Ion Etcher | Oxford Instruments | ||
| Plastic mask | Selba | ||
| Plastic weigh boat 64 x 51 x 19 mm | VWR | 10770-454 | |
| Poly-dimethylsiloxane: SYLGARD 184 Silicone Elastomer Kit | Dow chemicals | 1673921 | |
| Polyimide copper film 60 µm (Kapton) | Goodfellow | IM301522 | |
| Propan-2-ol | Technic | 574 | |
| Protolaser S | LPKF | ||
| puromycin | Gibco | A11103 | |
| Round cover glass 5 mm diameter | Fischer scientific | 50-949-439 | |
| Scepter Sensors - 60 µm | Millipore | PHCC60050 | |
| Silicone adhesive Kwik-Sil | World Precision Instruments | ||
| spin coater | Süss Microtec | ||
| Spin Coater | Laurell | WS-650 | |
| Super glue | Office depot | ||
| tetracycline-free fœtal bovine Serum | Takara Bio | 631105 | |
| Thermal evaporator Auto 500 | Boc Edwards | ||
| Two-photon microscope | Zeiss LSM 7MP | ||
| U87-MG | ATCC | HTB-14 | Human glioblastoma cells |
| Ultrasonic cleaner | VWR | ||
| Vortex VTX-3000L | LMS | VTX100323410 | |
| Xfect single shots reagent | Takara Bio | 631447 | Transfection reagent |
Referências
- Koshy, M., et al. Improved survival time trends for glioblastoma using the SEER 17 population-based registries. Journal of Neuro-Oncology. 107 (1), 207-212 (2012).
- Davis, M. E. Glioblastoma: Overview of disease and treatment. Clinical Journal of Oncology Nursing. 20, 2-8 (2016).
- Edd, J. F., Horowitz, L., Davalos, R. V., Mir, L. M., Rubinsky, B. In vivo results of a new focal tissue ablation technique: irreversible electroporation. IEEE transactions on Bio-Medical Engineering. 53 (7), 1409-1415 (2006).
- Breton, M., Mir, L. M. Microsecond and nanosecond electric pulses in cancer treatments. Bioelectromagnetics. 33 (2), 106-123 (2012).
- Frandsen, S. K., et al. Direct therapeutic applications of calcium electroporation to effectively induce tumor necrosis. Cancer Research. 72 (6), 1336-1341 (2012).
- Lee, J. H., Kim, H., Kim, J. H., Lee, S. -. H. Soft implantable microelectrodes for future medicine: prosthetics, neural signal recording and neuromodulation. Lab on a Chip. 16 (6), 959-976 (2016).
- Lee, H., Bellamkonda, R. V., Sun, W., Levenston, M. E. Biomechanical analysis of silicon microelectrode-induced strain in the brain. Journal of Neural Engineering. 2 (4), 81-89 (2005).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A review of organic and inorganic biomaterials for neural interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Lecomte, A., Degache, A., Descamps, E., Dahan, L., Bergaud, C. In vitro and in vivo biostability assessment of chronically-implanted Parylene C neural sensors. Sensors and Actuators B: Chemical. 251, 1001-1008 (2017).
- Dijk, G., Ruigrok, H. J., O'Connor, R. P. PEDOT:PSS-coated stimulation electrodes attenuate irreversible electrochemical events and reduce cell electropermeabilization. Advanced Materials Interfaces. 8 (19), 2100214 (2021).
- Chen, T. -. W., et al. Ultra-sensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ribatti, D. Chapter 5 Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International Review of Cell and Molecular Biology. 270, 181-224 (2008).
- Valdes, T. I., Kreutzer, D., Moussy, F. The chick chorioallantoic membrane as a novel in vivo model for the testing of biomaterials. Journal of Biomedical Materials Research. 62 (2), 273-282 (2002).
- Ricard, C., Stanchi, F., Rougon, G., Debarbieux, F. An orthotopic glioblastoma mouse model maintaining brain parenchymal physical constraints and suitable for intravital two-photon microscopy. Journal of Visualized Experiments: JoVE. (86), e51108 (2014).
- Lefevre, M. C. Integrating flexible electronics for pulsed electric field delivery in a vascularized 3D glioblastoma model. npj Flexible Electronics. 5, 19 (2021).
- Perry, J. L., Ramachandran, N. K., Utama, B., Hyser, J. M. Use of genetically-encoded calcium indicators for live cell calcium imaging and localization in virus-infected cells. Methods. 90, 28-38 (2015).
- Blömer, U., et al. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. Journal of Virology. 71 (9), 6641-6649 (1997).
- Lenting, K., Verhaak, R., ter Laan, M., Wesseling, P., Leenders, W. Glioma: experimental models and reality. Acta Neuropathologica. 133 (2), 263-282 (2017).
- Hickman, J. A., et al. Three-dimensional models of cancer for pharmacology and cancer cell biology: Capturing tumor complexity in vitro/ex vivo. Biotechnology Journal. 9 (9), 1115-1128 (2014).
- Tay, S. L. M., Heng, P. W. S., Chan, L. W. The CAM-LDPI method: a novel platform for the assessment of drug absorption. Journal of Pharmacy and Pharmacology. 64 (4), 517-529 (2012).
- Kundeková, B., Máčajová, M., Meta, M., Čavarga, I., Bilčík, B. Chorioallantoic Membrane Models of Various Avian Species: Differences and Applications. Biology. 10 (4), 301 (2021).
- Ricard, C., et al. Phenotypic dynamics of microglial and monocyte-derived cells in glioblastoma-bearing mice. Scientific Reports. 6 (1), 26381 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados