A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقارنة مباشرة بين تشتت رامان المحفز فوق الطيف ومجهر تشتت رامان المضاد للستوكس للتصوير الكيميائي
In This Article
Summary
تقارن هذه الورقة بشكل مباشر بين الدقة والحساسية وتباين التصوير لتشتت رامان المحفز (SRS) وتشتت رامان المضاد لستوكس (CARS) المتكامل في نفس منصة المجهر. تظهر النتائج أن CARS لديها دقة مكانية أفضل ، و SRS يعطي تباينات أفضل ودقة طيفية ، وكلتا الطريقتين لهما حساسية مماثلة.
Abstract
يعد تشتت رامان المحفز (SRS) والفحص المجهري المتماسك لتشتت رامان المضاد لستوكس (CARS) أكثر تقنيات التصوير تشتتا رامان تماسكا استخداما. يوفر التصوير الفائق الطيف SRS و CARS معلومات رامان الطيفية في كل بكسل ، مما يتيح فصلا أفضل للتركيبات الكيميائية المختلفة. على الرغم من أن كلتا التقنيتين تتطلبان اثنين من ليزر الإثارة ، إلا أن مخططات الكشف عن الإشارات والخصائص الطيفية مختلفة تماما. الهدف من هذا البروتوكول هو إجراء كل من التصوير فوق الطيفي SRS و CARS على منصة واحدة ومقارنة تقنيتي الفحص المجهري لتصوير عينات بيولوجية مختلفة. تستخدم طريقة التركيز الطيفي للحصول على المعلومات الطيفية باستخدام ليزر الفيمتو ثانية. باستخدام العينات الكيميائية القياسية ، تتم مقارنة الحساسية والدقة المكانية والدقة الطيفية ل SRS و CARS في نفس ظروف الإثارة (أي الطاقة في العينة ، ووقت سكن البكسل ، والعدسة الموضوعية ، وطاقة النبض). يتم تجاور التناقضات التصويرية ل CARS و SRS للعينات البيولوجية ومقارنتها. ومن شأن المقارنة المباشرة بين أداء CARS وSRS أن تسمح بالاختيار الأمثل لطريقة التصوير الكيميائي.
Introduction
لوحظت ظاهرة تشتت رامان لأول مرة في عام 1928 من قبل C. V. Raman1. عندما يتفاعل فوتون حادث مع عينة ، يمكن أن يحدث حدث تشتت غير مرن تلقائيا ، حيث يتطابق تغير طاقة الفوتون مع انتقال اهتزازي للأنواع الكيميائية التي تم تحليلها. لا تتطلب هذه العملية استخدام علامة كيميائية ، مما يجعلها أداة متعددة الاستخدامات وخالية من الملصقات للتحليل الكيميائي مع تقليل اضطراب العينات. على الرغم من مزاياه ، يعاني تشتت رامان التلقائي من مقطع عرضي منخفض التشتت (عادة 1011 أقل من المقطع العرضي لامتصاص الأشعة تحت الحمراء [IR]) ، مما يتطلب أوقات اكتساب طويلة للتحليل2. وبالتالي ، فإن السعي لزيادة حساسية عملية تشتت رامان أمر ضروري في دفع تقنيات رامان للتصوير في الوقت الفعلي.
إحدى الطرق الفعالة لتعزيز حساسية تشتت رامان بشكل كبير هي من خلال عمليات تشتت رامان المتماسكة (CRS) ، والتي تستخدم عادة نبضتان ليزر لإثارة التحولات الاهتزازية الجزيئية 3,4. عندما يتطابق فرق طاقة الفوتون بين الليزرين مع الأوضاع الاهتزازية لجزيئات العينة ، سيتم توليد إشارات رامان قوية. عمليتا CRS الأكثر استخداما للتصوير هما تشتت رامان المضاد لستوكس (CARS) وتشتت رامان المحفز (SRS)5. على مدى العقدين الماضيين ، طورت التطورات التكنولوجية تقنيات الفحص المجهري CARS و SRS لتصبح أدوات قوية للقياس الكمي الخالي من الملصقات وتوضيح التغيرات الكيميائية في العينات البيولوجية.
يمكن تأريخ التصوير الكيميائي بواسطة الفحص المجهري CARS إلى عام 1982 عندما تم تطبيق المسح الضوئي بالليزر لأول مرة للحصول على صور CARS ، والتي أظهرها Duncan et al6. تم تسريع تحديث المجهر CARS بشكل كبير بعد التطبيقات الواسعة للمسح الضوئي بالليزر متعدد الفوتونات المجهريةالفلورية 7. أدى العمل المبكر من مجموعة Xie باستخدام ليزر عالي معدل التكرار إلى تحويل CARS إلى منصة تصوير كيميائية عالية السرعة وخالية من الملصقات لتوصيف الجزيئات في العينات البيولوجية 8,9,10. واحدة من القضايا الرئيسية لتصوير CARS هي وجود خلفية غير رنانة ، مما يقلل من تباين الصورة ويشوه طيف رامان. تم بذل العديد من الجهود إما لتقليل الخلفية غير الرنانة 11،12،13،14،15 أو لاستخراج إشارات رامان الرنانة من أطياف CARS16،17. التقدم الآخر الذي تقدم بشكل كبير في هذا المجال هو التصوير الفائق الطيف CARS ، والذي يسمح برسم الخرائط الطيفية في كل بكسل صورة مع تحسين الانتقائية الكيميائية18،19،20،21.
تشتت رامان المحفز (SRS) هي تقنية تصوير أصغر سنا من CARS ، على الرغم من أنه تم اكتشافها في وقت سابقمن 22. في عام 2007 ، تم الإبلاغ عن الفحص المجهري SRS باستخدام مصدر ليزر منخفض معدل التكرار23. سرعان ما أظهرت عدة مجموعات تصوير SRS عالي السرعة باستخدام ليزر عالي معدل التكرار24،25،26. واحدة من المزايا الرئيسية للفحص المجهري SRS على CARS هي عدم وجود خلفية غير رنانة27 ، على الرغم من أن الخلفيات الأخرى مثل التشكيل عبر الطور (XPM) ، والامتصاص العابر (TA) ، والامتصاص ثنائي الفوتون (TPA) ، وتأثير الحرارة الضوئية (PT) ، قد تحدث مع SRS28. بالإضافة إلى ذلك ، فإن إشارة SRS وتركيز العينة لهما علاقات خطية ، على عكس CARS ، التي تعتمد على تركيز الإشارة التربيعية29. وهذا يبسط القياس الكمي الكيميائي وفك الخلط الطيفي. تطورت SRS متعددة الألوان وفائقة الطيف في أشكال مختلفة 30،31،32،33،34،35،36 ، مع التركيز الطيفي كونها واحدة من أكثر الأساليب شعبية للتصوير الكيميائي37،38.
يتطلب كل من CARS و SRS تركيز المضخة وأشعة ليزر ستوكس على العينة لتتناسب مع الانتقال الاهتزازي للجزيئات لإثارة الإشارة. تشترك مجاهر CARS و SRS أيضا في الكثير من القواسم المشتركة. ومع ذلك ، فإن الفيزياء الكامنة وراء هاتين العمليتين ، واكتشافات الإشارات المشاركة في تقنيات الفحص المجهري هذه لها تفاوتات 3,39. CARS هي عملية بارامترية لا تحتوي على اقتران طاقة صافي لجزيء الفوتون3. ومع ذلك ، فإن SRS هي عملية غير بارامترية ، وتساهم في نقل الطاقة بين الفوتونات والأنظمة الجزيئية27. في CARS ، يتم إنشاء إشارة جديدة بتردد مضاد ل Stokes ، بينما يظهر SRS على أنه نقل الطاقة بين المضخة وأشعة ليزر Stokes.
إشارة CARS ترضي Eq (1)28.
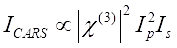 (1)
(1)
وفي الوقت نفسه ، يمكن كتابة إشارة SRS ك Eq (2) 28.
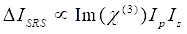 (2)
(2)
هنا ، I P و I S و I CARS و ΔISRS هي شدة شعاع المضخة ، وشعاع ستوكس ، وإشارة CARS ، وإشارات SRS ، على التوالي. χ(3) هي القابلية البصرية غير الخطية من الدرجة الثالثة للعينة ، وهي قيمة معقدة تتكون من أجزاء حقيقية ووهمية.
تعبر هذه المعادلات عن الملامح الطيفية واعتماد تركيز الإشارة ل CARS و SRS. تؤدي الاختلافات في الفيزياء إلى مخططات كشف متباينة لهاتين التقنيتين المجهريتين. عادة ما ينطوي الكشف عن الإشارة في CARS على الفصل الطيفي للفوتونات التي تم إنشاؤها حديثا والكشف عنها باستخدام أنبوب مضاعف ضوئي (PMT) أو جهاز مقترن بالشحنة (CCD) ؛ بالنسبة ل SRS ، عادة ما يتم قياس تبادل الطاقة بين المضخة وحزم Stokes عن طريق تعديل عالي السرعة باستخدام مغير بصري وإزالة الصبغة باستخدام صمام ثنائي ضوئي (PD) مقترن بمضخم صوت قفل.
على الرغم من نشر العديد من التطورات والتطبيقات التكنولوجية في السنوات الأخيرة في كل من مجالات CARS و SRS ، لم يتم إجراء مقارنات منهجية بين تقنيتي CRS على نفس النظام الأساسي ، خاصة بالنسبة ل CARS فائقة الطيف و SRS المجهرية. ومن شأن المقارنات المباشرة في الحساسية والدقة المكانية والدقة الطيفية وقدرات الفصل الكيميائي أن تسمح لعلماء الأحياء باختيار أفضل طريقة للقياس الكمي الكيميائي. في هذا البروتوكول ، يتم توفير خطوات مفصلة لبناء منصة تصوير متعددة الوسائط مع كل من طرائق CARS و SRS فائقة الطيف على أساس نظام ليزر الفيمتو ثانية والتركيز الطيفي. تمت مقارنة التقنيتين في الاتجاه الأمامي للدقة الطيفية ، وحساسية الكشف ، والدقة المكانية ، وتباينات التصوير للخلايا.
Protocol
1. الإعداد الفعال لتصوير CRS فوق الطيفي
ملاحظة: يتطلب توليد إشارة CRS استخدام ليزر عالي الطاقة (أي الفئة 3B أو الفئة 4). يجب معالجة بروتوكولات السلامة ويجب ارتداء معدات الحماية الشخصية المناسبة (PPE) في جميع الأوقات عند العمل في مثل هذه القوى الذروة العالية. استشر الوثائق المناسبة قبل التجريب. يركز هذا البروتوكول على تصميم مسار الشعاع ، ونقيق نبضات الفيمتو ثانية ، وتحسين ظروف التصوير. يوضح الشكل 1 تخطيطا بصريا عاما لهذا المجهر CRS الفائق الطيف. التكوين الموضح هنا هو واحد من العديد من التكوينات الموجودة للفحص المجهري CRS. تم بناء نظام الفحص المجهري CRS المستخدم في هذا البروتوكول على مصدر ليزر فيمتو ثانية مزدوج الإخراج ومجهر مسح بالليزر.
- تأكد من أن مصدر الليزر يوفر اثنين من قطارات نبض الفيمتو ثانية (عرض 120 fs) بمعدل تكرار يبلغ 80 ميجاهرتز ، بما في ذلك طول موجي ثابت عند 1045 نانومتر يستخدم كشعاع ستوكس ، وطول موجي قابل للضبط من 680 إلى 1300 نانومتر يستخدم كشعاع مضخة. مزامنة نبضات الإخراج مع فرق تأخير بصري. استخدم إطار المجهر لبناء منصة التصوير.
- تصميم مسار الشعاع
- للتحكم في طاقة الليزر في العينة، استخدم لوحة نصف موجة ومجموعة مقسم شعاع الاستقطاب (PBS) لكل شعاع ليزر.
- قم بتثبيت مغير صوتي بصري (AOM) في مسار شعاع ليزر ستوكس. ركز الشعاع باستخدام عدسة ذات بعد بؤري 150 مم في AOM وأعد ترتيبإخراج الترتيب 0 باستخدام عدسة ذات بعد بؤري 400 مم.
- استخدم نفس زوج العدسات (الأطوال البؤرية 150 مم و 400 مم) لتوسيع شعاع المضخة لمطابقة حجم شعاع الليزر مع Stokes.
- ضع عدسات البعد البؤري مقاس 400 مم في كل من مساري المضخة وشعاع Stokes على مراحل ترجمة منفصلة أحادية البعد لضبط تباعد الحزمة وتحسين حجم الحزمة قبل دخول المجهر.
- قم بتوجيه شعاع المضخة باستخدام مرآة عاكسة قائمة الزاوية مثبتة على مرحلة ترجمة آلية لضبط التأخير البصري. إذا احتاج شعاع ستوكس إلى تأخير بصري ، فضع هذه المكونات بدلا من ذلك في مسار الشعاع الخاص به.
- اسمح بدمج كلا الحزمتين في مرآة ثنائية اللون مع طول موجي قاطع عند ~ 1000 نانومتر (بين المضخة والأطوال الموجية ستوكس) ، بحيث ينتقل شعاع ستوكس عبر المرآة ثنائية اللون بينما ينعكس شعاع المضخة بواسطة المرآة ثنائية اللون. أرسل أشعة الليزر المدمجة إلى المجهر.
- لتغريد المضخة وعوارض ستوكس ، ضع قضبان زجاجية في مسارات الحزم الخاصة بها. راجع الخطوة 1.5 للحصول على التفاصيل.
- لتأكيد المحاذاة المناسبة وحجم الشعاع ، استخدم أغشية القزحية بعد المرآة ثنائية اللون وقبل المجهر. على وجه التحديد ، قم بتثبيت أحدهما في موضع قريب من والآخر على مسافة من المرآة ثنائية اللون لتأكيد المحاذاة الجيدة وتداخل الحزمة. استخدم بطاقة عرض الأشعة تحت الحمراء أو عارض الأشعة تحت الحمراء لتصور الشعاع أثناء المحاذاة.
- استخدم PD سريع ومذبذب لقياس التأخير البصري تقريبا بين المضخة ونبضات ستوكس. قم بتشغيل منظار الذبذبات عن طريق أخذ عينات من قطار نبض الليزر.
- قم بحظر شعاع المضخة وقم بأخذ عينة من شعاع ستوكس. قم بتكبير إحدى النبضات ووضع مؤشر رأسي عليها لتحديد موقعها الزمني على الذبذبات.
- قم بإلغاء حظر شعاع المضخة ومنع شعاع ستوكس. ترجم مرحلة التأخير حتى تتماشى نبضات مضخة العينة مؤقتا مع الموضع المحدد.
- المجهر الماسح الضوئي بالليزر
- لتكوين المجهر المستقيم ، أرسل أشعة الليزر المدمجة من خلال المنظار للصعود إلى مستوى مناسب قبل الوصول إلى مرايا المسح الضوئي 2D galvo.
- قم بقياس حجم شعاع الليزر قبل المجهر ، وقم بإعداد زوج العدسات المناسب بعد مرايا galvo لتوسيع شعاع الليزر ليتناسب بشكل أفضل مع حجم بؤبؤ مدخل العدسة الموضوعية.
- قم ببناء نظام 4-f باستخدام العدستين ، مع الفتحة الخلفية للعدسة الموضوعية ومركز مرآتي galvo كونهما طائرتين مترافقتين. بدلا من ذلك ، استخدم مرآتين منفصلتين 1D galvo مع نظامي عدسة 4-f للمسح الضوئي بالليزر.
- بعد المكثف ، قم بتصميم مرآة قابلة للطي 2 بوصة لتعكس أشعة الليزر لجمع الإشارات. ضع عدسة قطرها 2 في مسار الشعاع المرسل لجمع إشارات الإرسال وتركيزها بالكامل على أجهزة الكشف.
- قم بتوجيه إشارات CARS إلى PMT باستخدام مرآة ثنائية اللون لها انقطاع عند 776 نانومتر ، واسمح باكتشاف إشارات SRS المرسلة بواسطة PD. استخدم مرشح تمرير النطاق الترددي (655/30 نانومتر) قبل PMT لرفض نبضات ليزر الإثارة المتبقية. استخدم مرشح تمرير قصير (تمريرة قصيرة 980 نانومتر) قبل PD لمنع شعاع ستوكس من دخول الكاشف.
- للكشف عن إشارة CARS ، قم بتوصيل مضخم صوت مسبق ومحول جهد تيار بعد PMT وقبل إرسال الإشارة إلى نظام الحصول على البيانات. اضبط جهد PMT لتحسين تباين الإشارة والصورة.
- استخدم مولد دالة لتعديل AOM عند MHz 10-1 ، واستخدم نفس التردد كمرجع لإلغاء التشويش المقفل. استخدم مكبر صوت قفل لاستخراج إشارات SRS قبل الحصول على البيانات.
- الحصول على البيانات وعرضها
- قم بإجراء الحصول على البيانات باستخدام بطاقة الحصول على البيانات الرقمية (DAQ) بالاقتران مع كتلة طرفية.
- استخدم المخرجات التناظرية من DAQ للتحكم في مرايا galvo والمدخلات التناظرية للحصول على الإشارة.
- استخدم البرامج المكتوبة من Lab استنادا إلى LabVIEW الذي يحتوي على شاشة عرض متعددة القنوات متزامنة لعرض الصور وحفظها في الوقت الفعلي (راجع الملف التكميلي).
- نقيق مصدر الفيمتو ثانية وقياس الاستبانة الطيفية
ملاحظة: لتحقيق دقة طيفية جيدة باستخدام التركيز الطيفي ، يتم استخدام قضبان زجاجية لإدخال التشتت ونبضات الليزر النقيق من الفيمتو ثانية إلى بيكو ثانية. لتحقيق أفضل دقة طيفية ، يجب أن يساوي معدل النقيق لشعاع المضخة معدل شعاع ستوكس. بالنسبة لنظام الليزر هذا ، يمكن تحقيق أفضل دقة طيفية عن طريق النقيق ~ 120 fs إخراج نبضات الليزر إلى 3.4 ps للمضخة و 1.8 ps ل Stokes. يتم تحقيق هذا النقيق باستخدام مجموعة 4 + 1 (أربعة في الحزمة المدمجة ، واحدة فقط في شعاع ستوكس) من مزيج قضيب زجاجي 150 مم (SF-57) ، كما هو موضح أدناه ، ويجب أن يحقق دقة طيفية 15 سم - 1 . يمكن قياس مدة النبض باستخدام جهاز ربط ذاتي.- أدخل قضيبا زجاجيا واحدا مقاس 150 مم في مسار شعاع ستوكس فقط.
- أدخل قضيبين زجاجيين مقاس 150 مم في مسار شعاع المضخة/ستوكس المشترك بعد مقسم الشعاع ثنائي اللون. لزيادة النقيق ، دع أشعة الليزر المدمجة تمرر مرتين قضيبين زجاجيين عن طريق وضع مرآة عازلة في أحد طرفي القضبان.
- لقياس الاستبانة الطيفية، قم بإعداد مادة كيميائية قياسية (على سبيل المثال، ثنائي ميثيل سلفوكسيد [DMSO]) عينة مضغوطة بين غطاءين زجاجيين، ومسح مرحلة التأخير حتى يتم تحقيق أقصى إشارة.
- حرك التأخير البصري 1000 ميكرومتر في اتجاه الانزياح الأحمر. ثم قم بتشغيل 200 إطار بسرعة 10 ميكرومتر / خطوة نحو اتجاه الانزياح الأزرق لجمع مكدس الصور الطيفي الفائق.
- لتحويل أرقام الإطارات إلى أرقام موجية، قم بإجراء انحدار خطي باستخدام C-H المتماثل (2,913 سم-1) وغير المتماثل (2,994 سم-1) الممتد من DMSO وأرقام الإطارات المقابلة40.
- استخدم إشارة XPM لقياس ملف تعريف كثافة التركيز الطيفي. أغلق الحجاب الحاجز على المكثف نصف إغلاق وانقل التركيز البؤري إلى غطاء فارغ. اجمع نفس عدد الخطوات كما هو الحال بالنسبة ل SRS فائق الطيف. لقياس خلفية CARS غير الرنانة ، ركز على الغطاء الزجاجي واجمع نفس العدد من الخطوات لقياسات CARS فائقة الطيف.
- تحسين نسبة الإشارة إلى التشويش (SNR) للصور
- قم بإعداد عينة كيميائية لمحاذاة النظام. اتبع الإجراء الموضح في الخطوة 3.1 لإعداد العينة.
ملاحظة: DMSO هو خيار جيد لأنه مادة كيميائية مختبرية شائعة مع إشارات رامان قوية وقمم C-H متماثلة وغير متماثلة مفصولة جيدا. - ضع العينة على مرحلة المجهر ، وأضف الماء أو زيت الغمر إذا لزم الأمر للعدسة الموضوعية أو المكثف. حرك حافة قطرة DMSO بشكل صحيح في مجال الرؤية واضبط العدسة الموضوعية للحصول على أفضل تركيز بؤري. توسيط المكثف باستخدام طريقة إضاءة كوهلر41. افتح الحجاب الحاجز بالكامل على المكثف.
- اضبط الطول الموجي لشعاع المضخة إلى 800 نانومتر (1,045 نانومتر ستوكس) لاستهداف ذروة 2,913 سم-1 CH3 . اضبط قوة كل من المضخة وشعاع ستوكس على ~ 30 ميجاوات قبل المجهر عن طريق ضبط لوحة نصف الموجة (~ 10 ميجاوات في مستوى العينة).
- بالنسبة إلى SRS ، اضبط كسب مضخم القفل على ~ 10 مع ثابت زمني قدره 7 ميكروثانية (عند استخدام وقت سكن 10 ميكروثانية بكسل). تأكد من أن ثابت الوقت أصغر من وقت سكن البكسل. استخدم Demod R لإخراج AUX لإشارات SRS.
- بالنسبة إلى CARS، أرسل مخرج PMT إلى مضخم الصوت المسبق ومحول الجهد الحالي. استخدم DAQ للحصول على الإخراج من المحول.
- قم بتعيين معلمات الحصول على الصور في برنامج الاستحواذ. استخدم رقم بكسل 200 × 200 بحجم مسح ضوئي يبلغ ~ 100 × 100 ميكرومتر2. تأكد من أن الصورة تحتوي على كل من قطرة DMSO ومنطقة فارغة.
- امسح العينة ضوئيا وتحقق من الصورة على شاشة الكمبيوتر. امسح مرحلة التأخير الآلية في شعاع Stokes/pump أثناء مراقبة الصور في الوقت الفعلي. امسح التأخير ضوئيا حتى يتم تكبير الإشارة.
- حرك قطرة DMSO لتغطية مجال الرؤية بالكامل وتحقق مما إذا كان الحد الأقصى لإشارة التيار المستمر متمركزا في الصورة (تعتمد الإشارة على شعاع المضخة). اضبط إما موضع شعاع المضخة عبر مرآة أو إزاحة الجهد في برنامج التصوير.
- بعد تحسين التيار المستمر ، اضبط مرايا شعاع Stokes حتى يتم تكبير إشارة التيار المتردد عن طريق ضبط قيمة العتبة لعرض تشبع ~ 50٪. تحقق مما إذا كان التشبع متمركزا في الصورة. إذا لم يكن الأمر كذلك ، فقم بضبط المرايا فقط في شعاع ستوكس. راقب الإشارة أثناء المحاذاة كملاحظات في الوقت الفعلي حول جودة المحاذاة.
- لتحديد SNR، حدد منطقة صغيرة من صورة DMSO وقم بقياس القيمة المتوسطة. بالنسبة للتشويش، حدد مساحة صغيرة في المنطقة الفارغة من الصورة وحدد كل من متوسط القيمة المتوسطة والانحراف المعياري. اطرح قيمة متوسط الضوضاء من قيمة متوسط الإشارة واقسم النتائج على الانحراف المعياري للمنطقة الفارغة.
- إذا لم يكن SNR المحسوب مرتفعا بما فيه الكفاية (عادة 800-1000 ل SRS و >10000 ل CARS عند جهد PMT من 0.4 V مع مزيج الطاقة هذا) ، تحقق من تداخل الشعاع وإعادة تحسينه ، وأحجام الحزم ، وتأخير موضع المرحلة ، وضبط AOM ، وتغيير تردد تعديل مولد الوظيفة حتى يتم الحصول على SNR المتوقع.
- قم بإعداد عينة كيميائية لمحاذاة النظام. اتبع الإجراء الموضح في الخطوة 3.1 لإعداد العينة.
2. تحليل الصور ومعالجة البيانات
- تحليل SNR
- افتح برنامج ImageJ. لاستيراد نموذج ملف DMSO .txt المحفوظ، انقر فوق ملف | | الاستيراد | صورة النص فتح.
- بمجرد استيراد الصورة، اضغط على CTRL+shift+C لإظهار وظيفة السطوع والتباين (B&C). للعثور على الحد الأقصى لإشارة العينة، اضغط على الزر تلقائي في B&C حتى تظهر منطقة من عينة DMSO مشبعة.
- انقر فوق أداة التحديد البيضاوي على واجهة ImageJ وقم بتمييز مساحة صغيرة من منطقة DMSO المشبعة. بمجرد تمييزه، اضغط على M لقياس المتوسط والانحراف المعياري للمنطقة المحددة.
- لقياس الخلفية، اضبط الأشرطة في وظيفة B&C حتى يمكن ملاحظة إشارة المنطقة الفارغة. انقر فوق التحديد البيضاوي وقم بتمييز منطقة من الخلفية بنفس حجم الخطوة 2.1.3. تأكد من أن المنطقة المحددة لا تحتوي على DMSO. اضغط على M لقياس إحصائيات المنطقة المحددة.
- حساب SNR وفقا للخطوة 1.6.10.
- معالجة صور CRS فائقة الطيف
- استيراد ملف .txt وفقا للخطوة 2.1.1. بمجرد استيرادها ، انقر فوق صورة | مكدسات | أدوات | المونتاج إلى المكدس... لتحويل الملف إلى مكدس صور.
- قم بالتمرير عبر المونتاج حتى تظهر ذروة DMSO الأولى. حدد منطقة على DMSO وانقر على صورة | | المكدس رسم ملف تعريف المحور Z لرسم طيف الكثافة مقابل رقم الإطار. لاستخراج البيانات الطيفية الخام ، انقر فوق القائمة وانسخ بيانات ملف التعريف.
- لتحويل الطيف المسترد إلى وحدات عدد موجي، قم بإجراء انحدار خطي كما هو موضح في الخطوة 1.5.5.
- مناسب لقياس الاستبانة الطيفية
ملاحظة: تستخدم دالات لورنتزيان لتناسب أطياف SRS و CARS28.- افتح برنامج التركيب، ثم انسخ بيانات الانحدار الخطي والصقها في البرنامج. لتركيب بيانات SRS ، قم بتمييز البيانات ثم ارسم البيانات كمخطط مبعثر.
- اسحب المؤامرة المبعثرة. انقر على تحليل | القمم | الأساسية | متعددة الذروة تناسب افتح مربع الحوار لإظهار محلل الذروة. عند سحبه ، تحقق من أن الإدخال هو المخطط الحالي وقم بتغيير وظيفة الذروة إلى Lorentzian (Lorentz).
- انقر نقرا مزدوجا فوق كل من قمتي DMSO على الرسم البياني لتسليط الضوء على المناطق المراد تركيبها. بعد ذلك ، انقر فوق فتح NLfit لإظهار نافذة التركيب . انقر فوق الزر احتواء حتى تقارب ، ثم موافق، لرؤية ملخص مجدول لمعاملات التركيب (انظر Eq (3)).
ملاحظة: توضح المعادلة أدناه تنسيق دالة لورنتزيان في البرنامج. A 1/2 هي سعات القمم المناسبة ، و w1/2 هي عروض القمم المجهزة ، وقيم x 01/02 هي مراكز القمم المجهزة. المتغير المستقل هو x والمتغير التابع هو y.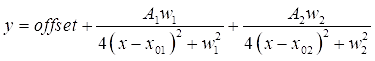 (3)
(3) - للتركيب الطيفي CARS ، انقر فوق تحليل | | التركيب | تناسب المنحنى غير الخطي افتح مربع الحوار. حدد الفئة: جديدة لتحديد وظيفة جديدة ل CARS. استخدم دالة تركيب CARS ذات قبوتين المحددة أدناه (انظر Eq (4)) للتركيب الطيفي ل CARS.
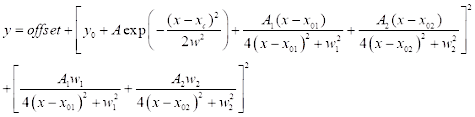 (4)
(4)
- تحديد الدقة المكانية
ملاحظة: قبل هذه الخطوة، من المهم معرفة التحويل بين حجم البكسل عند تكبير معين ورقم بكسل وحجم الخطوة بالميكرومتر. يمكن إجراء ذلك باستخدام عينة من قطر معروف أكبر من دقة التصوير المتوقعة ، وقياس ملف تعريف الخط الخاص به ، وتركيب دالة Gaussian لتحديد العرض الكامل عند نصف القيمة القصوى (FWHM). يمكن استخدام أهداف الدقة أو العينات الموحدة مثل الخرز البوليمري.- احصل على صورة للخلايا أو جزيئات البوليمر التي يقل قطرها عن 200 نانومتر.
- استخدم ImageJ لرسم خط عبر أصغر جسيم في الصورة.
- اضغط على K لرسم ملف تعريف الكثافة.
- انقر فوق قائمة من النافذة المنبثقة وانسخ المعلومات إلى برنامج التركيب.
- ارسم الملف الشخصي في برنامج التركيب واستخدم تركيب Gaussian (انقر فوق تحليل | | التركيب | تناسب المنحنى غير الخطي فتح | الحوار الفئة: الوظائف الأساسية; الوظيفة: غاوس).
- اقرأ عرض الذروة بعد التركيب. استخدم تحويل حجم البكسل للحصول على الدقة الفعلية للمجهر.
3. إعداد عينات لتصوير CRS فوق الطيف
- إعداد شرائح التصوير والعينات الكيميائية
- ضع قطعة من الشريط على الوجهين على غطاء ، وقم بقص شكل مستطيل صغير من الشريط من منتصف الشريط الموضوع لإنشاء منطقة مفتوحة لوضع العينة.
- ماصة 1-2 ميكرولتر من DMSO النقي وتوزيع القطرة في وسط الشاغر.
- ضع الغطاء العلوي بعناية واضغط برفق على حواف الأغطية لإغلاق الغرفة مع التأكد من أن عينة DMSO لا تلامس حواف الشريط.
- بالنسبة لتجارب الحساسية ، قم بإعداد تخفيفات تسلسلية ل DMSO في أكسيد الديوتيريوم (D2O) لإعطاء نطاق تركيز يتراوح بين 50٪ و 0٪. خذ 1-2 ميكرولتر من كل محلول وقم بإعداد عينات مضغوطة كما هو موضح أعلاه.
- إعداد الخلايا
- زرع الخلايا في طبق زجاجي سفلي 35 مم (أو أكبر) في وسط النسر المعدل من دولبيكو (DMEM) مع 10٪ مصل بقري جنيني (FBS) و 1٪ بنسلين / ستربتومايسين.
- احتضان الخلايا في غرفة حضانة عند 37 درجة مئوية مع جو 5٪ CO2 بين عشية وضحاها أو أكثر حتى يتم تحقيق التقاء ~ 50٪ -80٪.
- قم بتصوير الخلايا الحية مباشرة أو قم بإصلاح الخلايا بمحلول فورمالين بنسبة 10٪ للتصوير.
النتائج
مقارنات الاستبانة الطيفية
يقارن الشكل 2 الاستبانة الطيفية للفحص المجهري SRS فائق الطيف (الشكل 2A) و CARS (الشكل 2B) باستخدام عينة DMSO. بالنسبة لطيف SRS ، تم تطبيق وظيفتين لورنتزيان (انظر خطوة البروتوكول 2.3) لتناسب الطيف ، وتم الحصول على دقة ...
Discussion
يصف البروتوكول المعروض هنا بناء مجهر CRS متعدد الوسائط والمقارنة المباشرة بين تصوير CARS و SRS. بالنسبة لبناء المجهر ، فإن الخطوات الحاسمة هي تداخل الحزم المكانية والزمانية وتحسين حجم الحزمة. يوصى باستخدام عينة قياسية مثل DMSO قبل التصوير البيولوجي لتحسين SNR ومعايرة نوبات رامان. تكشف المقارنة ا?...
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا البحث من قبل صندوق بدء التشغيل التابع لقسم الكيمياء بجامعة بوردو.
Materials
| Name | Company | Catalog Number | Comments |
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25x36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
References
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved