Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Direkter Vergleich der hyperspektralen stimulierten Raman-Streuung und der kohärenten Anti-Stokes-Raman-Streumikroskopie für die chemische Bildgebung
In diesem Artikel
Zusammenfassung
Dieses Papier vergleicht direkt die Auflösung, Empfindlichkeit und Bildkontraste der stimulierten Raman-Streuung (SRS) und der kohärenten Anti-Stokes-Raman-Streuung (CARS), die in dieselbe Mikroskopplattform integriert sind. Die Ergebnisse zeigen, dass CARS eine bessere räumliche Auflösung hat, SRS bessere Kontraste und spektrale Auflösung liefert und beide Methoden eine ähnliche Empfindlichkeit aufweisen.
Zusammenfassung
Die stimulierte Raman-Streuung (SRS) und die kohärente Anti-Stokes-Raman-Streuung (CARS) sind die am weitesten verbreiteten kohärenten Raman-Streubildgebungstechnologien. Hyperspektrale SRS- und CARS-Bildgebung bieten Raman-Spektralinformationen an jedem Pixel, was eine bessere Trennung verschiedener chemischer Zusammensetzungen ermöglicht. Obwohl beide Techniken zwei Anregungslaser erfordern, sind ihre Signaldetektionsschemata und spektralen Eigenschaften sehr unterschiedlich. Das Ziel dieses Protokolls ist es, sowohl hyperspektrale SRS- als auch CARS-Bildgebung auf einer einzigen Plattform durchzuführen und die beiden Mikroskopietechniken zur Abbildung verschiedener biologischer Proben zu vergleichen. Die Spektralfokussierungsmethode wird verwendet, um Spektralinformationen mit Femtosekundenlasern zu erfassen. Durch die Verwendung chemischer Standardproben werden die Empfindlichkeit, die räumliche Auflösung und die spektrale Auflösung von SRS und CARS unter den gleichen Anregungsbedingungen (d. h. Leistung an der Probe, Pixelverweilzeit, Objektivlinse, Pulsenergie) verglichen. Die bildgebenden Kontraste von CARS und SRS für biologische Proben werden gegenübergestellt und verglichen. Der direkte Vergleich von CARS- und SRS-Leistungen würde eine optimale Auswahl der Modalität für die chemische Bildgebung ermöglichen.
Einleitung
Das Raman-Streuungsphänomen wurde erstmals 1928 von C. V. Raman1 beobachtet. Wenn ein einfallendes Photon mit einer Probe interagiert, kann spontan ein inelastisches Streuereignis auftreten, bei dem die Energieänderung des Photons mit einem Schwingungsübergang der analysierten chemischen Spezies übereinstimmt. Dieser Prozess erfordert nicht die Verwendung eines chemischen Tags und ist somit ein vielseitiges, etikettenfreies Werkzeug für die chemische Analyse bei gleichzeitiger Minimierung der Probenstörung. Trotz ihrer Vorteile leidet die spontane Raman-Streuung unter einem geringen Streuquerschnitt (typischerweise 1011 niedriger als der Infrarot-Absorptionsquerschnitt [IR]), was lange Erfassungszeiten für die Analyseerforderlich macht 2. Daher ist das Bestreben, die Empfindlichkeit des Raman-Streuprozesses zu erhöhen, unerlässlich, um Raman-Technologien für die Echtzeit-Bildgebung voranzutreiben.
Eine effektive Möglichkeit, die Empfindlichkeit der Raman-Streuung erheblich zu erhöhen, sind kohärente Raman-Streuprozesse (CRS), für die typischerweise zwei Laserpulse verwendet werden, um molekulare Schwingungsübergängeanzuregen 3,4. Wenn die Photonen-Energiedifferenz zwischen den beiden Lasern mit den Schwingungsmoden von Probenmolekülen übereinstimmt, werden starke Raman-Signale erzeugt. Die beiden am häufigsten verwendeten CRS-Verfahren für die Bildgebung sind kohärente Anti-Stokes-Raman-Streuung (CARS) und stimulierte Raman-Streuung (SRS)5. In den letzten zwei Jahrzehnten haben technologische Entwicklungen CARS- und SRS-Mikroskopietechniken zu leistungsfähigen Werkzeugen für die markierungsfreie Quantifizierung und Aufklärung chemischer Veränderungen in biologischen Proben gemacht.
Die chemische Bildgebung durch CARS-Mikroskopie kann auf das Jahr 1982 datiert werden, als Laserscanning zum ersten Mal angewendet wurde, um CARS-Bilder zu erfassen, demonstriert von Duncan et al6. Die Modernisierung der CARS-Mikroskopie wurde nach den breiten Anwendungen der Laser-Scanning-Multiphotonen-Fluoreszenzmikroskopiestark beschleunigt 7. Frühe Arbeiten der Xie-Gruppe, die Laser mit hoher Wiederholungsrate verwenden, haben CARS zu einer schnellen, markierungsfreien, chemischen Bildgebungsplattform für die Charakterisierung von Molekülen in biologischen Probenentwickelt 8,9,10. Eines der Hauptprobleme für die CARS-Bildgebung ist das Vorhandensein eines nicht resonanten Hintergrunds, der den Bildkontrast reduziert und das Raman-Spektrum verzerrt. Es wurden viele Anstrengungen unternommen, um entweder den nicht resonanten Hintergrund 11,12,13,14,15 zu reduzieren oder resonante Raman-Signale aus den CARS-Spektren 16,17 zu extrahieren. Ein weiterer Fortschritt, der das Feld stark vorangebracht hat, ist die hyperspektrale CARS-Bildgebung, die eine spektrale Kartierung an jedem Bildpixel mit verbesserter chemischer Selektivität 18,19,20,21 ermöglicht.
Die stimulierte Raman-Streuung (SRS) ist eine jüngere Bildgebungstechnologie als CARS, obwohl sie früher entdeckt wurde22. Im Jahr2007 wurde berichtet, dass die SRS-Mikroskopie eine Laserquelle mit niedriger Wiederholungsrate 23 verwendete. Bald demonstrierten mehrere Gruppen eine Hochgeschwindigkeits-SRS-Bildgebung mit Lasern mit hoher Wiederholungsrate24,25,26. Einer der Hauptvorteile der SRS-Mikroskopie gegenüber CARS ist das Fehlen des nicht-resonanten Hintergrunds27, obwohl andere Hintergründe wie Kreuzphasenmodulation (XPM), transiente Absorption (TA), Zwei-Photonen-Absorption (TPA) und photothermischer (PT) -Effekt bei SRS28 auftreten können. Darüber hinaus haben das SRS-Signal und die Probenkonzentration lineare Beziehungen, im Gegensatz zu CARS, das eine quadratische Signalkonzentrationsabhängigkeitaufweist 29. Dies vereinfacht die chemische Quantifizierung und spektrale Entmischung. Mehrfarbiges und hyperspektrales SRS hat sich in verschiedenen Formenentwickelt 30,31,32,33,34,35,36, wobei die spektrale Fokussierung einer der beliebtesten Ansätze für die chemische Bildgebung ist 37,38.
Sowohl CARS als auch SRS erfordern die Fokussierung der Pumpe und der Stokes-Laserstrahlen auf die Probe, um den Schwingungsübergang der Moleküle für die Signalanregung anzupassen. Auch CARS und SRS-Mikroskope haben viel gemeinsam. Die Physik, die diesen beiden Prozessen zugrunde liegt, und die Signaldetektionen, die an diesen Mikroskopietechnologien beteiligt sind, weisen jedoch Disparitätenauf 3,39. CARS ist ein parametrischer Prozess, der keine Netto-Photonen-Molekül-Energiekopplunghat 3. SRS ist jedoch ein nichtparametrischer Prozess und trägt zum Energietransfer zwischen Photonen und molekularen Systemen bei27. In CARS wird ein neues Signal bei Anti-Stokes-Frequenz erzeugt, während sich SRS als Energieübertragung zwischen der Pumpe und den Stokes-Laserstrahlen manifestiert.
CARS Signal erfüllt Eq (1)28.
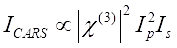 (1)
(1)
In der Zwischenzeit kann das SRS-Signal als Eq (2) 28 geschrieben werden.
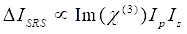 (2)
(2)
Hier sind I p, I s, I CARS und ΔISRS die Intensitäten des Pumpenstrahls, des Stokes-Strahls, des CARS-Signals bzw. der SRS-Signale. χ(3) ist die nichtlineare optische Suszeptibilität der Probe dritter Ordnung und ist ein komplexer Wert, der sich aus realen und imaginären Teilen zusammensetzt.
Diese Gleichungen drücken die Spektralprofile und die Signalkonzentrationsabhängigkeit von CARS und SRS aus. Unterschiede in der Physik führen zu unterschiedlichen Nachweisschemata für diese beiden Mikroskopietechnologien. Die Signaldetektion in CARS beinhaltet in der Regel die spektrale Trennung neu erzeugter Photonen und die Detektion mit einer Photomultiplierröhre (PMT) oder einem ladungsgekoppelten Gerät (CCD); Für SRS wird der Energieaustausch zwischen der Pumpe und Stokes-Strahlen normalerweise durch Hochgeschwindigkeitsintensitätsmodulation mit einem optischen Modulator und Demodulation mit einer Photodiode (PD) in Verbindung mit einem Lock-in-Verstärker gemessen.
Obwohl in den letzten Jahren viele technologische Entwicklungen und Anwendungen sowohl im CARS- als auch im SRS-Bereich veröffentlicht wurden, wurden keine systematischen Vergleiche der beiden CRS-Techniken auf derselben Plattform durchgeführt, insbesondere für die hyperspektrale CARS- und SRS-Mikroskopie. Direkte Vergleiche in Bezug auf Empfindlichkeit, räumliche Auflösung, spektrale Auflösung und chemische Trennfähigkeiten würden es Biologen ermöglichen, die beste Modalität für die chemische Quantifizierung auszuwählen. In diesem Protokoll werden detaillierte Schritte zum Aufbau einer multimodalen Bildgebungsplattform mit hyperspektralen CARS- und SRS-Modalitäten auf der Grundlage eines Femtosekundenlasersystems und einer spektralen Fokussierung bereitgestellt. Die beiden Techniken wurden in Vorwärtsrichtung für spektrale Auflösung, Detektionsempfindlichkeit, räumliche Auflösung und bildgebende Kontraste von Zellen verglichen.
Protokoll
1. Instrumenteller Aufbau für die hyperspektrale CRS-Bildgebung
HINWEIS: Die Erzeugung von CRS-Signalen erfordert die Verwendung von Hochleistungslasern (d. h. Klasse 3B oder Klasse 4). Sicherheitsprotokolle müssen beachtet werden, und bei Arbeiten mit solch hohen Spitzenleistungen muss jederzeit eine geeignete persönliche Schutzausrüstung (PSA) getragen werden. Konsultieren Sie die ordnungsgemäße Dokumentation, bevor Sie experimentieren. Dieses Protokoll konzentriert sich auf das Entwerfen des Strahlwegs, das Zwitschern der Femtosekundenpulse und die Optimierung der Bildgebungsbedingungen. Ein allgemeines optisches Layout dieses hyperspektralen CRS-Mikroskops ist in Abbildung 1 dargestellt. Die hier gezeigte Konfiguration ist eine von vielen vorhandenen Konfigurationen für die CRS-Mikroskopie. Das in diesem Protokoll verwendete CRS-Mikroskopiesystem basiert auf einer Femtosekunden-Laserquelle mit zwei Ausgängen und einem Laser-Scanning-Mikroskop.
- Stellen Sie sicher, dass die Laserquelle zwei Femtosekunden-Pulszüge (120 fs Breite) mit einer Wiederholrate von 80 MHz liefert, einschließlich einer festen Wellenlänge bei 1.045 nm, die als Stokes-Strahl verwendet wird, und einer abstimmbaren Wellenlänge von 680 bis 1.300 nm, die als Pumpstrahl verwendet wird. Synchronisieren Sie die Ausgangsimpulse mit einer optischen Verzögerungsdifferenz. Verwenden Sie einen Mikroskoprahmen, um die Bildgebungsplattform zu erstellen.
- Entwerfen des Balkenpfads
- Um die Laserleistung an der Probe zu steuern, verwenden Sie für jeden Laserstrahl eine Halbwellenplatte und eine Kombination aus Polarisationsstrahlteiler (PBS).
- Installieren Sie einen akusto-optischen Modulator (AOM) im Stokes-Laserstrahlpfad. Fokussieren Sie den Strahl mit einem 150-mm-Brennweitenobjektiv in das AOM und resolierenSie den Ausgang 0. Ordnung mit einem 400-mm-Brennweitenobjektiv.
- Verwenden Sie das gleiche Objektivpaar (150 mm und 400 mm Brennweiten), um den Pumpenstrahl so zu erweitern, dass die Laserstrahlgröße mit dem Stokes übereinstimmt.
- Platzieren Sie die 400-mm-Brennweitenobjektive sowohl im Pump- als auch im Stokes-Strahlpfad auf separaten eindimensionalen Translationsstufen, um die Strahldivergenz zu optimieren und die Strahlgröße vor dem Eintritt in das Mikroskop zu optimieren.
- Steuern Sie den Pumpenstrahl mit einem rechtwinklig reflektierenden Spiegel, der auf einem motorisierten Übersetzungstisch montiert ist, um die optische Verzögerungsabstimmung zu ermöglichen. Wenn der Stokes-Strahl eine optische Verzögerung benötigt, platzieren Sie diese Komponenten stattdessen in seinem Strahlweg.
- Lassen Sie beide Strahlen an einem dichroitischen Spiegel mit einer Grenzwellenlänge bei ~ 1.000 nm (zwischen der Pumpe und den Stokes-Wellenlängen) kombinieren, so dass der Stokes-Strahl durch den dichroitischen Spiegel übertragen wird, während der Pumpstrahl vom dichroitischen Spiegel reflektiert wird. Senden Sie die linear kombinierten Laserstrahlen zum Mikroskop.
- Um die Pumpe und die Stokes-Balken zu zwitschern, platzieren Sie Glasstäbe in ihren Balkenbahnen. Weitere Informationen finden Sie in Schritt 1.5.
- Um die richtige Ausrichtung und Strahlgröße zu bestätigen, verwenden Sie Irismembranen nach dem dichroitischen Spiegel und vor dem Mikroskop. Installieren Sie insbesondere eine Position in der Nähe und die andere in einem Abstand vom dichroitischen Spiegel, um eine gute Ausrichtung und Strahlüberlappung zu bestätigen. Verwenden Sie eine IR-Anzeigekarte oder einen IR-Viewer, um den Strahl während der Ausrichtung zu visualisieren.
- Verwenden Sie ein schnelles PD und ein Oszilloskop, um die optische Verzögerung zwischen der Pumpe und den Stokes-Impulsen ungefähr zu messen. Lösen Sie das Oszilloskop aus, indem Sie den Laserpulszug abtasten.
- Blockieren Sie den Pumpenstrahl und nehmen Sie Proben am Stokes-Strahl. Zoomen Sie auf einen der Impulse und platzieren Sie einen vertikalen Cursor darauf, um seine zeitliche Position auf dem Oszilloskop zu markieren.
- Entsperren Sie den Pumpenstrahl und blockieren Sie den Stokes-Strahl. Übersetzen Sie die Verzögerungsstufe, bis die Impulse der Probenpumpe zeitlich an der markierten Position ausgerichtet sind.
- Das Laserscanning-Mikroskop
- Für eine aufrechte Mikroskopkonfiguration senden Sie die kombinierten Laserstrahlen durch ein Periskop, um auf eine geeignete Ebene zu klettern, bevor Sie die 2D-Galvo-Scanning-Spiegel erreichen.
- Messen Sie die Laserstrahlgröße vor dem Mikroskop und richten Sie das richtige Linsenpaar nach den Galvospiegeln ein, um den Laserstrahl so zu erweitern, dass er der Größe der Eintrittspupille der Objektivlinse am besten entspricht.
- Konstruieren Sie ein 4-f-System mit den beiden Linsen, wobei die hintere Blende der Objektivlinse und die Mitte der beiden Galvospiegel konjugierte Ebenen sind. Alternativ können Sie zwei separate 1D-Galvospiegel mit zwei 4-F-Linsensystemen für das Laserscannen verwenden.
- Entwerfen Sie nach dem Kondensator einen 2-Zoll-Klappspiegel, um die Laserstrahlen für die Signalerfassung zu reflektieren. Positionieren Sie eine Linse mit einem Durchmesser von 2 im übertragenen Strahlengang, um Übertragungssignale zu den Detektoren vollständig zu sammeln und zu fokussieren.
- Leiten Sie die CARS-Signale mit einem dichroitischen Spiegel mit einem Grenzwert bei 776 nm an den PMT und lassen Sie die übertragenen SRS-Signale vom PD erkennen. Verwenden Sie einen Bandpassfilter (655/30 nm) vor dem PMT, um Restanregungslaserpulse abzulehnen. Verwenden Sie einen Kurzpassfilter (980 nm Kurzpass) vor dem PD, um das Eindringen des Stokes-Strahls in den Detektor zu blockieren.
- Für die CARS-Signalerkennung schließen Sie nach dem PMT und vor dem Senden des Signals an das Datenerfassungssystem einen Vorverstärker und einen Strom-Spannungs-Wandler an. Stellen Sie die PMT-Spannung ein, um den Signal- und Bildkontrast zu optimieren.
- Verwenden Sie einen Funktionsgenerator, um das AOM bei 1-10 MHz zu modulieren, und verwenden Sie die gleiche Frequenz wie die Referenz für die Lock-in-Demodulation. Verwenden Sie einen Lock-in-Verstärker, um SRS-Signale vor der Datenerfassung zu extrahieren.
- Datenerfassung und -anzeige
- Führen Sie die Datenerfassung mit einer digitalen Datenerfassungskarte (DAQ) in Verbindung mit einer Klemmleiste durch.
- Verwenden Sie die analogen Ausgänge des Datenerfassungsgeräts, um die Galvospiegel und die analogen Eingänge für die Signalerfassung zu steuern.
- Verwenden Sie im Labor geschriebene Software, die auf LabVIEW basiert und über eine simultane Mehrkanalanzeige verfügt, um Bilder in Echtzeit anzuzeigen und zu speichern (siehe Ergänzende Datei).
- Chirping der Femtosekundenquelle und Messung der spektralen Auflösung
HINWEIS: Um eine gute spektrale Auflösung durch spektrale Fokussierung zu erreichen, werden Glasstäbe verwendet, um Dispersionen einzuführen und Laserpulse von Femtosekunde bis Pikosekunde zu chirpen. Um die beste spektrale Auflösung zu erreichen, muss die Chirprate des Pumpstrahls der des Stokes-Strahls entsprechen. Für dieses Lasersystem kann die beste spektrale Auflösung erreicht werden, indem die ~120 fs Ausgangslaserpulse auf 3,4 ps für die Pumpe und 1,8 ps für den Stokes gezwitschert werden. Dieses Zwitschern wird durch die Verwendung einer 4 + 1-Kombination (vier im kombinierten Strahl, einer nur im Stokes-Strahl) von 150 mm Glasstab (SF-57) -Kombination, wie unten beschrieben, erreicht und sollte eine spektrale Auflösung von 15 cm-1 erreichen. Die Pulsdauer kann mit einem Autokorrelator gemessen werden.- Stecken Sie einen 150-mm-Glasstab nur in den Stokes-Balkenweg.
- Setzen Sie zwei 150-mm-Glasstäbe in den kombinierten Pump-/Stokes-Balkenpfad nach dem dichroitischen Balkensplitter ein. Um das Zwitschern zu erhöhen, lassen Sie die kombinierten Laserstrahlen die beiden Glasstäbe doppelt passieren, indem Sie einen dielektrischen Spiegel an einem Ende der Stäbe platzieren.
- Um die spektrale Auflösung zu messen, bereiten Sie eine chemische Standardprobe (z. B. Dimethylsulfoxid [DMSO]) vor, die zwischen zwei Glasabdeckungen gepresst wird, und scannen Sie die Verzögerungsstufe ab, bis das maximale Signal erreicht ist.
- Bewegen Sie die optische Verzögerung um 1.000 μm in Rotverschiebungsrichtung. Führen Sie dann 200 Bilder mit 10 μm / Schritt in Richtung Blueshift-Richtung aus, um den hyperspektralen Bildstapel zu sammeln.
- Um die Framezahlen in Wellenzahlen umzuwandeln, führen Sie eine lineare Regression mit der symmetrischen (2.913 cm-1) und asymmetrischen (2.994 cm-1) C-H-Dehnung von DMSO und den entsprechenden Framenummern40 durch.
- Verwenden Sie das XPM-Signal zur Messung des spektralen Fokussierungsintensitätsprofils. Schließen Sie die Membran am Kondensator halb und verschieben Sie den Fokus auf ein leeres Deckglas. Sammeln Sie die gleiche Anzahl von Schritten wie bei hyperspektralem SRS. Um den nicht resonanten CARS-Hintergrund zu messen, konzentrieren Sie sich auf den Glasbelag und sammeln Sie die gleiche Anzahl von Schritten für die hyperspektralen CARS-Messungen.
- Optimierung des Signal-Rausch-Verhältnisses (SNR) von Bildern
- Bereiten Sie eine chemische Probe für die Systemausrichtung vor. Befolgen Sie das in Schritt 3.1 beschriebene Verfahren für die Probenvorbereitung.
HINWEIS: DMSO ist eine gute Wahl, da es sich um eine gängige Laborchemikalie mit starken Raman-Signalen und gut getrennten symmetrischen und asymmetrischen C-H-Peaks handelt. - Legen Sie die Probe auf den Mikroskoptisch und fügen Sie bei Bedarf Wasser oder Tauchöl für die Objektivlinse oder den Kondensator hinzu. Bewegen Sie den Rand des DMSO-Tröpfchens ordnungsgemäß im Sichtfeld und stellen Sie das Objektiv für den besten Fokus ein. Zentrieren Sie den Kondensator mit der Köhler Beleuchtungsmethode41. Öffnen Sie die Membran am Kondensator vollständig.
- Stimmen Sie die Wellenlänge des Pumpstrahls auf 800 nm (1.045 nmStokes) ab, um die Spitze von 2.913 cm-1 CH 3 anzuvisieren. Stellen Sie die Leistung sowohl der Pumpe als auch des Stokes-Strahls auf ~ 30 mW vor dem Mikroskop ein, indem Sie die Halbwellenplatte einstellen (~ 10 mW Leistung in der Probenebene).
- Stellen Sie für SRS die Lock-in-Verstärkerverstärkung auf ~10 mit einer Zeitkonstante von 7 μs ein (bei Verwendung einer Verweilzeit von 10 μs Pixel). Stellen Sie sicher, dass die Zeitkonstante kleiner ist als die Pixelverweildauer. Verwenden Sie Demod R für den AUX-Ausgang für SRS-Signale.
- Senden Sie bei CARS den PMT-Ausgang an den Vorverstärker und den Strom-Spannungs-Wandler. Verwenden Sie die Datenerfassung, um die Ausgabe vom Wandler zu erfassen.
- Stellen Sie die Bildaufnahmeparameter in der Aufnahmesoftware ein. Verwenden Sie eine Pixelzahl von 200 x 200 mit einer Scangröße von ~100 x 100 μm2. Stellen Sie sicher, dass das Bild sowohl das DMSO-Droplet als auch einen leeren Bereich enthält.
- Scannen Sie das Beispiel und überprüfen Sie das Bild auf dem Computerbildschirm. Scannen Sie die motorisierte Verzögerungsstufe im Stokes/Pumpenstrahl und überwachen Sie die Echtzeitbilder. Scannen Sie über die Verzögerung, bis das Signal maximiert ist.
- Bewegen Sie den DMSO-Tropfen, um das gesamte Sichtfeld abzudecken, und prüfen Sie, ob das DC-Signalmaximum im Bild zentriert ist (das Signal ist pumpenstrahlabhängig). Stellen Sie entweder die Position des Pumpenstrahls über einen Spiegel oder den Spannungsversatz in der Bildgebungssoftware ein.
- Stellen Sie nach der DC-Optimierung die Stokes-Strahlspiegel so lange ein, bis das AC-Signal maximiert ist, indem Sie den Schwellenwert so einstellen, dass eine Sättigung von ~ 50% angezeigt wird. Überprüfen Sie, ob die Sättigung im Bild zentriert ist. Wenn nicht, stimmen Sie die Spiegel nur im Stokes-Strahl ab. Überwachen Sie das Signal während der Ausrichtung als Echtzeit-Feedback über die Qualität der Ausrichtung.
- Um den SNR zu bestimmen, wählen Sie einen kleinen Bereich des DMSO-Bildes aus und messen Sie den Mittelwert. Wählen Sie für das Rauschen einen kleinen Bereich im leeren Bereich des Bildes aus und ermitteln Sie sowohl den Mittelwert als auch die Standardabweichung. Subtrahieren Sie den Rauschmittelwert vom Signalmittelwert und dividieren Sie die Ergebnisse durch die Standardabweichung des leeren Bereichs.
- Wenn der berechnete SNR nicht hoch genug ist (typischerweise 800-1.000 für SRS und >10.000 für CARS bei einer PMT-Spannung von 0,4 V mit dieser Leistungskombination), überprüfen und optimieren Sie die Strahlüberlappung, die Strahlgrößen und die Verzögerungsstufenposition, passen Sie das AUM an und ändern Sie die Modulationsfrequenz des Funktionsgenerators, bis die erwartete SNR erreicht ist.
- Bereiten Sie eine chemische Probe für die Systemausrichtung vor. Befolgen Sie das in Schritt 3.1 beschriebene Verfahren für die Probenvorbereitung.
2. Bildanalyse und Datenverarbeitung
- SNR-Analyse
- Öffnen Sie die ImageJ-Software. Um die gespeicherte DMSO-Beispieldatei .txt zu importieren, klicken Sie auf Datei | | importieren Textbild-| Offen.
- Sobald das Bild importiert wurde, drücken Sie STRG+UMSCHALT+C , um die Helligkeits- und Kontrastfunktion (B&C) aufzurufen. Um das maximale Sample-Signal zu finden, drücken Sie die Auto-Taste im B&C, bis ein Bereich der DMSO-Probe gesättigt erscheint.
- Klicken Sie auf der ImageJ-Benutzeroberfläche auf das ovale Auswahlwerkzeug und markieren Sie einen kleinen Bereich des gesättigten DMSO-Bereichs. Drücken Sie nach der Markierung M , um den Mittelwert und die Standardabweichung des ausgewählten Bereichs zu messen.
- Um den Hintergrund zu messen, passen Sie die Balken in der B&C-Funktion an, bis das Signal des leeren Bereichs beobachtet werden kann. Klicken Sie auf die ovale Auswahl und markieren Sie einen Bereich des Hintergrunds, der die gleiche Größe wie in Schritt 2.1.3 hat. Stellen Sie sicher, dass die ausgewählte Region kein DMSO enthält. Drücken Sie M , um die Statistiken des ausgewählten Bereichs zu messen.
- Berechnen Sie den SNR gemäß Schritt 1.6.10.
- Verarbeitung von hyperspektralen CRS-Bildern
- Importieren Sie die .txt Datei gemäß Schritt 2.1.1. Klicken Sie nach dem Import auf Bild | Stapel | Tools | Montage zu Stack... , um die Datei in einen Image-Stack zu konvertieren.
- Scrollen Sie durch die Montage, bis der erste DMSO-Peak sichtbar ist. Wählen Sie eine Region auf dem DMSO aus und klicken Sie auf Image | | stapeln Zeichnen Sie das Profil der Z-Achse , um das Spektrum der Intensität im Vergleich zum Frame-Zahlenspektrum darzustellen. Um die spektralen Rohdaten zu extrahieren, klicken Sie auf Liste und kopieren Sie die Profildaten.
- Um das wiederhergestellte Spektrum in Wellenzahleinheiten umzuwandeln, führen Sie eine lineare Regression durch, wie in Schritt 1.5.5 beschrieben.
- Passform zur Messung der spektralen Auflösung
HINWEIS: Lorentzianische Funktionen werden verwendet, um die SRS- und CARS-Spektren28 anzupassen.- Öffnen Sie die Anpassungssoftware, kopieren Sie die linearen Regressionsdaten und fügen Sie sie in das Programm ein. Um die SRS-Daten anzupassen, markieren Sie die Daten und zeichnen Sie sie dann als Streudiagramm.
- Ziehen Sie das Streudiagramm nach oben. Klicken Sie auf Analyse | Peaks und Baseline-| Mehrere Peak-Fit-| Öffnen Sie den Dialog, um den Peak-Analysator aufzurufen. Wenn Sie nach oben gezogen werden, überprüfen Sie, ob die Eingabe das aktuelle Diagramm ist, und ändern Sie die Spitzenfunktion in Lorentzian (Lorentz).
- Doppelklicken Sie auf jeden der beiden DMSO-Spitzen im Diagramm, um die anzupassenden Regionen hervorzuheben. Klicken Sie anschließend auf NLfit öffnen , um das passende Fenster aufzurufen. Klicken Sie auf die Schaltfläche Bis zur Konvergenz anpassen (Fit until converged ) und dann auf OK, um eine tabellarische Zusammenfassung der Anpassungskoeffizienten anzuzeigen (siehe Eq (3)).
HINWEIS: Die folgende Gleichung zeigt das Lorentzsche Funktionsformat in der Software. A 1/2 sind die Amplituden der passenden Peaks, w1/2 sind die Breiten der angepassten Peaks und die x01/02-Werte sind die Center der angepassten Peaks. Die unabhängige Variable ist x und die abhängige Variable ist y.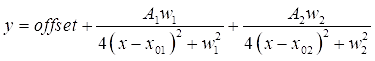 (3)
(3) - Für die CARS-Spektralanpassung klicken Sie auf Analyse | Anpassung | Nichtlineare Kurvenanpassung | Öffnen Sie den Dialog. Wählen Sie die Kategorie: Neu, um eine neue Funktion für CARS zu definieren. Verwenden Sie eine unten definierte Zwei-Peak-CARS-Fitting-Funktion (siehe Eq (4)) für die CARS-Spektralanpassung.
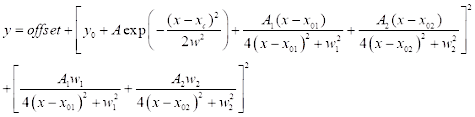 (4)
(4)
- Bestimmen der räumlichen Auflösung
HINWEIS: Vor diesem Schritt ist es wichtig, die Konvertierung zwischen der Pixelgröße bei einer bestimmten Vergrößerung, Pixelanzahl und der Schrittgröße in μm zu kennen. Dies kann durchgeführt werden, indem eine Probe mit einem bekannten Durchmesser, der größer als die erwartete Bildauflösung ist, verwendet wird, ihr Linienprofil gemessen und eine Gaußsche Funktion angepasst wird, um die volle Breite bei halbem Maximalwert (FWHM) zu bestimmen. Es können Auflösungstargets oder einheitliche Proben wie polymere Perlen verwendet werden.- Erfassen Sie ein Bild von Zellen oder Polymerpartikeln mit einem Durchmesser von weniger als 200 nm.
- Verwenden Sie ImageJ, um eine Linie über das kleinste Partikel im Bild zu zeichnen.
- Drücken Sie K , um das Intensitätsprofil darzustellen.
- Klicken Sie im Popup-Fenster auf Liste und kopieren Sie die Informationen in die passende Software.
- Zeichnen Sie das Profil in der Beschlagsoftware auf und verwenden Sie Gaußsches Fitting (klicken Sie auf Analyse | Anpassung | Nichtlineare Kurvenanpassung | Dialog öffnen | Kategorie: Grundfunktionen; Funktion: Gauss).
- Lesen Sie die Spitzenbreite nach dem Anpassen ab. Verwenden Sie die Pixel-zu-Größe-Konvertierung, um die tatsächliche Auflösung des Mikroskops zu erhalten.
3. Vorbereitung der Proben für die hyperspektrale CRS-Bildgebung
- Vorbereitung von bildgebenden Objektträgern und chemischen Proben
- Legen Sie ein Stück doppelseitiges Klebeband auf ein Deckglas und schneiden Sie eine kleine rechteckige Form des Bandes von der Mitte des platzierten Bandes aus, um einen offenen Bereich für die zu platzierende Probe zu schaffen.
- Pipette 1-2 μL reines DMSO und dosieren Sie das Tröpfchen in der Mitte des Leerstands.
- Legen Sie das obere Deckglas vorsichtig auf und drücken Sie vorsichtig auf die Kanten der Deckgläser, um die Kammer zu versiegeln, während Sie sicherstellen, dass die DMSO-Probe nicht mit den Rändern des Bandes in Berührung kommt.
- Für Sensitivitätsexperimente sind serielle Verdünnungen von DMSO in Deuteriumoxid (D2O) herzustellen, um einen Konzentrationsbereich von 50%-0% zu erhalten. Nehmen Sie 1-2 μL jeder Lösung und bereiten Sie gepresste Proben wie oben beschrieben vor.
- Zellpräparation
- Säen Sie die Zellen in einer 35 mm großen Glasbodenschale (oder größer) in Dulbeccos Modified Eagle Medium (DMEM) mit 10% fetalem Rinderserum (FBS) und 1% Penicillin / Streptomycin.
- Inkubieren Sie die Zellen in einer Inkubationskammer bei 37 °C mit einer 5% CO2-Atmosphäre über Nacht oder länger, bis ~ 50% -80% Konfluenz erreicht ist.
- Stellen Sie die lebenden Zellen direkt dar oder fixieren Sie die Zellen mit einer 10% igen Formalinlösung für die Bildgebung.
Ergebnisse
Vergleiche der spektralen Auflösung
Abbildung 2 vergleicht die spektrale Auflösung der hyperspektralen SRS- (Abbildung 2A) und CARS- (Abbildung 2B) Mikroskopie unter Verwendung einer DMSO-Probe. Für das SRS-Spektrum wurden zwei Lorentzsche Funktionen (siehe Protokollschritt 2.3) angewendet, um in das Spektrum zu passen, und eine Auflösung von 14,6 cm-1 wurde unter Verwendung des 2.913 cm-1-Pea...
Diskussion
Das hier vorgestellte Protokoll beschreibt den Aufbau eines multimodalen CRS-Mikroskops und den direkten Vergleich zwischen CARS- und SRS-Bildgebung. Für die Mikroskopkonstruktion sind die kritischen Schritte räumliche und zeitliche Strahlüberlappung und Strahlgrößenoptimierung. Es wird empfohlen, vor der biologischen Bildgebung eine Standardprobe wie DMSO zur Optimierung von SNR und Kalibrierung von Raman-Verschiebungen zu verwenden. Der direkte Vergleich zwischen CARS- und SRS-Bildern zeigt, dass CARS eine bessere...
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Forschung wurde vom Startup-Fonds des Purdue University Department of Chemistry unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25x36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
Referenzen
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten