È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Confronto diretto tra lo scattering Raman stimolato iperspettrale e la microscopia a dispersione raman coerente anti-Stokes per l'imaging chimico
In questo articolo
Riepilogo
Questo documento confronta direttamente la risoluzione, la sensibilità e i contrasti di imaging dello scattering Raman stimolato (SRS) e dello scattering Raman anti-Stokes coerente (CARS) integrati nella stessa piattaforma del microscopio. I risultati mostrano che CARS ha una migliore risoluzione spaziale, SRS offre migliori contrasti e risoluzione spettrale ed entrambi i metodi hanno una sensibilità simile.
Abstract
Lo scattering Raman stimolato (SRS) e la microscopia a dispersione Raman (CARS) coerente anti-Stokes sono le tecnologie di imaging a dispersione Raman coerente più utilizzate. L'imaging iperspettrale SRS e CARS offre informazioni spettrali Raman su ogni pixel, che consente una migliore separazione di diverse composizioni chimiche. Sebbene entrambe le tecniche richiedano due laser di eccitazione, i loro schemi di rilevamento del segnale e le proprietà spettrali sono molto diversi. L'obiettivo di questo protocollo è quello di eseguire sia l'imaging iperspettrale SRS che CARS su un'unica piattaforma e confrontare le due tecniche di microscopia per l'imaging di diversi campioni biologici. Il metodo di messa a fuoco spettrale viene impiegato per acquisire informazioni spettrali utilizzando laser a femtosecondi. Utilizzando campioni chimici standard, vengono confrontate la sensibilità, la risoluzione spaziale e la risoluzione spettrale di SRS e CARS nelle stesse condizioni di eccitazione (ad esempio, potenza al campione, tempo di permanenza dei pixel, obiettivo, energia dell'impulso). I contrasti di imaging di CARS e SRS per campioni biologici sono giustapposti e confrontati. Il confronto diretto delle prestazioni di CARS e SRS consentirebbe una selezione ottimale della modalità per l'imaging chimico.
Introduzione
Il fenomeno dello scattering Raman fu osservato per la prima volta nel 1928 da C. V. Raman1. Quando un fotone incidente interagisce con un campione, può verificarsi spontaneamente un evento di scattering anelastico, in cui il cambiamento di energia del fotone corrisponde a una transizione vibrazionale delle specie chimiche analizzate. Questo processo non richiede l'uso di un tag chimico, rendendolo uno strumento versatile e privo di etichette per l'analisi chimica riducendo al minimo le perturbazioni del campione. Nonostante i suoi vantaggi, lo scattering Raman spontaneo soffre di una bassa sezione trasversale di scattering (tipicamente 1011 inferiore alla sezione trasversale di assorbimento a infrarossi [IR]), che richiede lunghi tempi di acquisizione per l'analisi2. Pertanto, la ricerca di aumentare la sensibilità del processo di scattering Raman è essenziale per spingere le tecnologie Raman per l'imaging in tempo reale.
Un modo efficace per migliorare notevolmente la sensibilità dello scattering Raman è attraverso processi di scattering Raman coerenti (CRS), per i quali due impulsi laser sono tipicamente utilizzati per eccitare le transizioni vibrazionali molecolari 3,4. Quando la differenza di energia fotonica tra i due laser corrisponde alle modalità vibrazionali delle molecole campione, verranno generati forti segnali Raman. I due processi CRS più comunemente usati per l'imaging sono lo scattering raman anti-Stokes coerente (CARS) e lo scattering Raman stimolato (SRS)5. Negli ultimi due decenni, gli sviluppi tecnologici hanno avanzato le tecniche di microscopia CARS e SRS per diventare potenti strumenti per la quantificazione senza etichette e la delucidazione dei cambiamenti chimici nei campioni biologici.
L'imaging chimico mediante microscopia CARS può essere datato al 1982, quando la scansione laser è stata applicata per la prima volta per acquisire immagini CARS, dimostrata da Duncan et al6. La modernizzazione della microscopia CARS è stata notevolmente accelerata dopo le ampie applicazioni della microscopia a fluorescenza multifotone a scansione laser7. I primi lavori del gruppo Xie che utilizzano laser ad alto tasso di ripetizione hanno trasformato CARS in una piattaforma di imaging chimico ad alta velocità, priva di etichette, per la caratterizzazione di molecole in campioni biologici 8,9,10. Uno dei principali problemi per l'imaging CARS è la presenza di uno sfondo non consonante, che riduce il contrasto dell'immagine e distorce lo spettro Raman. Sono stati fatti molti sforzi per ridurre lo sfondo non consonante 11,12,13,14,15 o per estrarre segnali Raman risonanti dagli spettri CARS 16,17. Un altro progresso che ha notevolmente migliorato il campo è l'imaging CARS iperspettrale, che consente la mappatura spettrale di ogni pixel dell'immagine con una migliore selettività chimica 18,19,20,21.
Lo scattering Raman stimolato (SRS) è una tecnologia di imaging più giovane di CARS, sebbene sia stata scoperta prima del22. Nel 2007, la microscopia SRS è stata segnalata utilizzando una sorgente laser a basso tasso di ripetizione23. Ben presto, diversi gruppi hanno dimostrato l'imaging SRS ad alta velocità utilizzando laser ad alto tasso di ripetizione 24,25,26. Uno dei principali vantaggi della microscopia SRS rispetto a CARS è l'assenza dello sfondo non consonante27, sebbene altri sfondi come la modulazione multifase (XPM), l'assorbimento transitorio (TA), l'assorbimento a due fotoni (TPA) e l'effetto fototermico (PT), possano verificarsi con SRS28. Inoltre, il segnale SRS e la concentrazione del campione hanno relazioni lineari, a differenza di CARS, che ha una dipendenza quadratica segnale-concentrazione29. Ciò semplifica la quantificazione chimica e l'unmixing spettrale. L'SRS multicolore e iperspettrale si è evoluto in diverse forme 30,31,32,33,34,35,36, con la messa a fuoco spettrale che è uno degli approcci più popolari per l'imaging chimico 37,38.
Sia CARS che SRS richiedono la messa a fuoco della pompa e dei raggi laser Stokes sul campione per abbinare la transizione vibrazionale delle molecole per l'eccitazione del segnale. Anche i microscopi CARS e SRS hanno molto in comune. Tuttavia, la fisica alla base di questi due processi e le rilevazioni di segnali coinvolte in queste tecnologie di microscopia hanno disparità 3,39. CARS è un processo parametrico che non ha un accoppiamento netto di energia fotone-molecola3. SRS, tuttavia, è un processo non parametrico e contribuisce al trasferimento di energia tra fotoni e sistemi molecolari27. In CARS, viene generato un nuovo segnale alla frequenza anti-Stokes, mentre SRS si manifesta come il trasferimento di energia tra la pompa e i raggi laser Stokes.
Il segnale CARS soddisfa Eq (1)28.
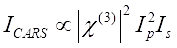 (1)
(1)
Nel frattempo, il segnale SRS può essere scritto come Eq (2)28.
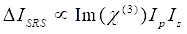 (2)
(2)
Qui, Ip, Is, ICARS e ΔISRS sono rispettivamente le intensità del fascio della pompa, del fascio di Stokes, del segnale CARS e dei segnali SRS. χ(3) è la suscettibilità ottica non lineare del terzo ordine del campione ed è un valore complesso composto da parti reali e immaginarie.
Queste equazioni esprimono i profili spettrali e la dipendenza dalla concentrazione del segnale di CARS e SRS. Le differenze nella fisica si traducono in schemi di rilevamento disparati per queste due tecnologie di microscopia. Il rilevamento del segnale in CARS di solito comporta la separazione spettrale di fotoni di nuova generazione e il rilevamento utilizzando un tubo fotomoltiplicatore (PMT) o un dispositivo ad accoppiamento di carica (CCD); per SRS, lo scambio di energia tra la pompa e i fasci di Stokes viene solitamente misurato mediante modulazione di intensità ad alta velocità utilizzando un modulatore ottico e demodulazione utilizzando un fotodiodo (PD) abbinato a un amplificatore lock-in.
Sebbene molti sviluppi tecnologici e applicazioni siano stati pubblicati negli ultimi anni sia in ambito CARS che SRS, non sono stati eseguiti confronti sistematici delle due tecniche CRS sulla stessa piattaforma, in particolare per la microscopia iperspettrale CARS e SRS. Confronti diretti in sensibilità, risoluzione spaziale, risoluzione spettrale e capacità di separazione chimica consentirebbero ai biologi di selezionare la migliore modalità per la quantificazione chimica. In questo protocollo, vengono forniti passaggi dettagliati per costruire una piattaforma di imaging multimodale con entrambe le modalità CARS iperspettrale e SRS basate su un sistema laser a femtosecondi e messa a fuoco spettrale. Le due tecniche sono state confrontate in avanti per la risoluzione spettrale, la sensibilità di rilevamento, la risoluzione spaziale e i contrasti di imaging delle cellule.
Protocollo
1. Configurazione strumentale per l'imaging CRS iperspettrale
NOTA: La generazione del segnale CRS richiede l'uso di laser ad alta potenza (ad esempio, classe 3B o classe 4). I protocolli di sicurezza devono essere affrontati e devono essere indossati in ogni momento adeguati dispositivi di protezione individuale (DPI) quando si lavora a potenze di picco così elevate. Consultare la documentazione appropriata prima della sperimentazione. Questo protocollo si concentra sulla progettazione del percorso del fascio, sul cinguettio degli impulsi a femtosecondi e sull'ottimizzazione delle condizioni di imaging. Un layout ottico generale di questo microscopio CRS iperspettrale è mostrato nella Figura 1. La configurazione mostrata qui è una delle tante configurazioni esistenti per la microscopia CRS. Il sistema di microscopia CRS utilizzato in questo protocollo è costruito su una sorgente laser a femtosecondi a doppia uscita e un microscopio a scansione laser.
- Assicurarsi che la sorgente laser fornisca due treni di impulsi a femtosecondi (larghezza 120 fs) con una frequenza di ripetizione di 80 MHz, tra cui una lunghezza d'onda fissa a 1.045 nm utilizzata come raggio di Stokes e una lunghezza d'onda sintonizzabile da 680 a 1.300 nm utilizzata come raggio della pompa. Sincronizzare gli impulsi di uscita con una differenza di ritardo ottico. Utilizzare un telaio per microscopio per costruire la piattaforma di imaging.
- Progettazione del percorso del fascio
- Per controllare la potenza del laser sul campione, utilizzare una piastra a mezza onda e una combinazione pbS (Polarization Beam Splitter) per ciascun raggio laser.
- Installare un modulatore acusto-ottico (AOM) nel percorso del raggio laser Stokes. Focalizza il fascio con un obiettivo di lunghezza focale di 150 mm nell'AOM e ricorda l'uscita diordine 0 con un obiettivo di lunghezza focale di 400 mm.
- Utilizzare la stessa coppia di obiettivi (lunghezze focali di 150 mm e 400 mm) per espandere il raggio della pompa in modo che corrisponda alle dimensioni del raggio laser con lo Stokes.
- Posizionare gli obiettivi di lunghezza focale di 400 mm sia nei percorsi della pompa che in quelli del fascio stokes su stadi di traslazione unidimensionali separati per mettere a punto la divergenza del fascio e ottimizzare le dimensioni del fascio prima di entrare nel microscopio.
- Dirigere il fascio della pompa con uno specchio riflettente ad angolo retto montato su uno stadio di traslazione motorizzato per la regolazione del ritardo ottico. Se il raggio di Stokes ha bisogno di ritardo ottico, posizionare invece questi componenti nel suo percorso del fascio.
- Consentire la combinazione di entrambi i fasci a uno specchio dicroico con una lunghezza d'onda di taglio a ~ 1.000 nm (tra la pompa e le lunghezze d'onda di Stokes), in modo che il fascio di Stokes trasmetta attraverso lo specchio dicroico mentre il fascio della pompa viene riflesso dallo specchio dicroico. Inviare i raggi laser combinati in modo collineare al microscopio.
- Per cinguettare la pompa e le travi di Stokes, posiziona le aste di vetro nei loro percorsi delle travi. Vedere il passaggio 1.5 per i dettagli.
- Per confermare il corretto allineamento e la dimensione del fascio, utilizzare i diaframmi dell'iride dopo lo specchio dicroico e prima del microscopio. In particolare, installarne uno in una posizione vicina e l'altro a una distanza dallo specchio dicroico per confermare un buon allineamento e la sovrapposizione del fascio. Utilizzare una scheda di visualizzazione IR o un visualizzatore IR per visualizzare il raggio durante l'allineamento.
- Utilizzare un PD veloce e un oscilloscopio per misurare approssimativamente il ritardo ottico tra la pompa e gli impulsi di Stokes. Attivare l'oscilloscopio campionando il treno di impulsi laser.
- Bloccare il fascio della pompa e campionare il raggio di Stokes. Ingrandisci uno degli impulsi e posiziona un cursore verticale su di esso per contrassegnarne la posizione temporale sull'oscilloscopio.
- Sblocca il raggio della pompa e blocca il raggio di Stokes. Traslare lo stadio di ritardo fino a quando la pompa campione non si allinea temporalmente con la posizione contrassegnata.
- Il microscopio a scansione laser
- Per una configurazione al microscopio verticale, inviare i raggi laser combinati attraverso un periscopio per salire a un livello appropriato prima di raggiungere gli specchi di scansione galvo 2D.
- Misurare la dimensione del raggio laser prima del microscopio e impostare la coppia di lenti corretta dopo gli specchi galvo per espandere il raggio laser per adattarsi al meglio alle dimensioni della pupilla d'ingresso della lente dell'obiettivo.
- Costruisci un sistema 4-f usando i due obiettivi, con l'apertura posteriore dell'obiettivo e il centro dei due specchi galvo che sono piani coniugati. In alternativa, utilizzare due specchi galvo 1D separati con due sistemi di lenti 4-f per la scansione laser.
- Dopo il condensatore, progettare uno specchio flip da 2 pollici per riflettere i raggi laser per la raccolta del segnale. Posizionare una lente con un diametro di 2 nel percorso del fascio trasmesso per raccogliere e focalizzare completamente i segnali di trasmissione ai rilevatori.
- Dirigere i segnali CARS al PMT con uno specchio dicroico con un cutoff a 776 nm e consentire il rilevamento dei segnali SRS trasmessi dal PD. Utilizzare un filtro passa-banda (655/30 nm) prima del PMT per respingere gli impulsi laser di eccitazione residua. Utilizzare un filtro a passaggio corto (passaggio corto di 980 nm) prima del PD per impedire al raggio di Stokes di entrare nel rilevatore.
- Per il rilevamento del segnale CARS, collegare un preamplificatore e un convertitore di corrente-tensione dopo il PMT e prima di inviare il segnale al sistema di acquisizione dati. Regolare la tensione PMT per ottimizzare il contrasto del segnale e dell'immagine.
- Utilizzare un generatore di funzioni per modulare l'AOM a 1-10 MHz e utilizzare la stessa frequenza del riferimento per la demodulazione lock-in. Utilizzare un amplificatore lock-in per estrarre i segnali SRS prima dell'acquisizione dei dati.
- Acquisizione e visualizzazione dei dati
- Eseguire l'acquisizione dei dati utilizzando una scheda di acquisizione dati digitale (DAQ) in combinazione con una morsettiera.
- Utilizzare le uscite analogiche del DAQ per controllare gli specchi galvo e gli ingressi analogici per l'acquisizione del segnale.
- Utilizzare un software scritto in laboratorio basato su LabVIEW con un display multicanale simultaneo per la visualizzazione e il salvataggio delle immagini in tempo reale (vedere File supplementare).
- Cinguettio della sorgente di femtosecondi e misurazione della risoluzione spettrale
NOTA: per ottenere una buona risoluzione spettrale utilizzando la messa a fuoco spettrale, le aste di vetro vengono utilizzate per introdurre dispersioni e impulsi laser chirp da femtosecondo a picosecondo. Per ottenere la migliore risoluzione spettrale, la velocità di cinguettio del fascio della pompa deve essere uguale a quella del raggio di Stokes. Per questo sistema laser, la migliore risoluzione spettrale può essere ottenuta cinguettando gli impulsi laser di uscita ~ 120 fs a 3,4 ps per la pompa e 1,8 ps per lo Stokes. Questo cinguettio si ottiene utilizzando una combinazione 4 + 1 (quattro nel raggio combinato, uno solo nel raggio stokes) di 150 mm di asta di vetro (SF-57), come descritto di seguito, e dovrebbe raggiungere una risoluzione spettrale di 15 cm-1 . La durata dell'impulso può essere misurata utilizzando un autocorrelatore.- Inserire un'asta di vetro da 150 mm solo nel percorso della trave stokes.
- Inserire due aste di vetro da 150 mm nel percorso combinato pompa/fascio Stokes dopo lo splitter a fascio dicroico. Per aumentare il cinguettio, lasciare che i raggi laser combinati passino due volte le due aste di vetro posizionando uno specchio dielettrico a un'estremità delle aste.
- Per misurare la risoluzione spettrale, preparare un campione chimico standard (ad esempio, dimetilsolfossido [DMSO]) premuto tra due coperchi di vetro e scansionare lo stadio di ritardo fino a raggiungere il segnale massimo.
- Spostare il ritardo ottico di 1.000 μm nella direzione di spostamento verso il rosso. Quindi, esegui 200 fotogrammi a 10 μm / passo verso la direzione blueshift per raccogliere lo stack di immagini iperspettrali.
- Per convertire i numeri di fotogramma in numeri d'onda, eseguire una regressione lineare utilizzando il C-H simmetrico (2.913 cm-1) e asimmetrico (2.994 cm-1) che si estende da DMSO e i corrispondenti numeri di fotogramma40.
- Utilizzare il segnale XPM per misurare il profilo di intensità di messa a fuoco spettrale. Chiudere a metà il diaframma sul condensatore e spostare lo stato attivo su una coverlip vuota. Raccogliere lo stesso numero di passaggi dell'SRS iperspettrale. Per misurare lo sfondo non risonante di CARS, concentrati sul coperchio di vetro e raccogli lo stesso numero di passaggi per le misurazioni iperspettrali di CARS.
- Ottimizzazione del rapporto segnale-rumore (SNR) delle immagini
- Preparare un campione chimico per l'allineamento del sistema. Seguire la procedura descritta nel passaggio 3.1 per la preparazione del campione.
NOTA: DMSO è una buona scelta perché è una sostanza chimica di laboratorio comune con forti segnali Raman e picchi simmetrici e asimmetrici C-H ben separati. - Posizionare il campione sul palco del microscopio e aggiungere acqua o olio per immersione, se necessario, per la lente dell'obiettivo o il condensatore. Spostare correttamente il bordo della goccia DMSO nel campo visivo e regolare l'obiettivo per la migliore messa a fuoco. Centrare il condensatore utilizzando il metodo di illuminazione Köhler41. Aprire completamente il diaframma sul condensatore.
- Regolare la lunghezza d'onda del fascio della pompa a 800 nm (1.045 nm Stokes) per indirizzare il picco CH 3 di 2.913 cm-1. Impostare la potenza sia della pompa che del fascio di Stokes a ~ 30 mW prima del microscopio regolando la piastra a mezza onda (~ 10 mW di potenza sul piano del campione).
- Per SRS, impostare il guadagno dell'amplificatore lock-in su ~10 con una costante di tempo di 7 μs (quando si utilizza un tempo di permanenza di pixel di 10 μs). Assicurati che la costante di tempo sia inferiore al tempo di permanenza dei pixel. Utilizzare Demod R per l'uscita AUX per i segnali SRS.
- Per CARS, inviare l'uscita PMT al preamplificatore e al convertitore di corrente-tensione. Utilizzare il DAQ per acquisire l'output dal convertitore.
- Impostare i parametri di acquisizione delle immagini nel software di acquisizione. Utilizzare un numero di pixel di 200 x 200 con una dimensione di scansione di ~100 x 100 μm2. Assicurati che l'immagine contenga sia il droplet DMSO che un'area vuota.
- Scansiona il campione e controlla l'immagine sullo schermo del computer. Scansiona lo stadio di ritardo motorizzato nel fascio Stokes/pump mentre monitori le immagini in tempo reale. Scansiona il ritardo fino a quando il segnale non viene massimizzato.
- Spostare la goccia DMSO per coprire l'intero campo visivo e verificare se il massimo del segnale CC è centrato nell'immagine (il segnale dipende dal fascio della pompa). Regolare la posizione del fascio della pompa tramite uno specchio o l'offset di tensione nel software di imaging.
- Dopo l'ottimizzazione DC, regolare gli specchi del fascio Stokes fino a quando il segnale CA non viene massimizzato regolando il valore di soglia per visualizzare una saturazione di ~ 50%. Controllare se la saturazione è centrata nell'immagine. In caso contrario, mettere a punto gli specchi solo nel raggio di Stokes. Monitorare il segnale durante l'allineamento come feedback in tempo reale sulla qualità dell'allineamento.
- Per determinare l'SNR, selezionare una piccola regione dell'immagine DMSO e misurare il valore medio. Per il rumore, selezionate una piccola area nella regione vuota dell'immagine e determinate sia il valore medio medio che la deviazione standard. Sottrarre il valore medio del rumore dal valore medio del segnale e dividere i risultati per la deviazione standard della regione vuota.
- Se l'SNR calcolato non è abbastanza alto (in genere 800-1.000 per SRS e >10.000 per CARS con una tensione PMT di 0,4 V con questa combinazione di potenza), controllare e riottimizzare la sovrapposizione del fascio, le dimensioni del fascio e la posizione dello stadio di ritardo, mettere a punto l'AOM e modificare la frequenza di modulazione del generatore di funzioni fino a ottenere l'SNR previsto.
- Preparare un campione chimico per l'allineamento del sistema. Seguire la procedura descritta nel passaggio 3.1 per la preparazione del campione.
2. Analisi delle immagini ed elaborazione dei dati
- Analisi SNR
- Aprire il software ImageJ. Per importare il file di .txt di esempio DMSO salvato, fare clic su File | Importare | | immagine di testo Apri.
- Una volta importata l'immagine, premere CTRL+MAIUSC+C per visualizzare la funzione luminosità e contrasto (B&C). Per trovare il segnale di campionamento massimo, premere il pulsante automatico nel B&C fino a quando una regione del campione DMSO appare satura.
- Fare clic sullo strumento di selezione ovale sull'interfaccia ImageJ ed evidenziare una piccola area della regione DMSO satura. Una volta evidenziato, premere M per misurare la deviazione media e standard dell'area selezionata.
- Per misurare lo sfondo, regolare le barre nella funzione B&C fino a quando non è possibile osservare il segnale della regione vuota. Fare clic sulla selezione ovale ed evidenziare un'area dello sfondo delle stesse dimensioni del passaggio 2.1.3. Assicurarsi che l'area selezionata non contenga DMSO. Premere M per misurare le statistiche dell'area selezionata.
- Calcolare l'SNR in base al passaggio 1.6.10.
- Elaborazione di immagini CRS iperspettrali
- Importare il file .txt in base al passaggio 2.1.1. Una volta importato, fai clic su Immagine | Stack | Strumenti | Montaggio a Stack... per convertire il file in uno stack di immagini.
- Scorrere il montaggio fino a visualizzare il primo picco DMSO. Seleziona una regione sul DMSO e fai clic su Immagine | | stack Traccia il profilo dell'asse Z per tracciare l'intensità rispetto allo spettro del numero di fotogrammi. Per estrarre i dati spettrali grezzi, fare clic sull'elenco e copiare i dati del profilo.
- Per convertire lo spettro recuperato in unità di numero d'onda, eseguire una regressione lineare come descritto nel passaggio 1.5.5.
- Raccordo per la misurazione della risoluzione spettrale
NOTA: le funzioni lorentziane vengono utilizzate per adattarsi agli spettri SRS e CARS28.- Aprire il software di fitting, quindi copiare e incollare i dati di regressione lineare nel programma. Per adattare i dati SRS, evidenziare i dati e quindi tracciare i dati come grafico a dispersione.
- Tirare su il grafico a dispersione. Fare clic su Analisi | Picchi e | di base | Multiple Peak Fit Apri finestra di dialogo per visualizzare l'analizzatore di picco. Quando si tira su, controllare che l'input sia il grafico corrente e modificare la funzione di picco in Lorentzzian (Lorentz).
- Fare doppio clic su ciascuno dei due picchi DMSO sul grafico per evidenziare le regioni da montare. Quindi, fare clic su Apri NLfit per visualizzare la finestra di raccordo . Fare clic sul pulsante Adatta fino a convergenza , quindi su OK per visualizzare un riepilogo tabulato dei coefficienti di raccordo (vedere Eq (3)).
NOTA: l'equazione seguente mostra il formato della funzione lorentziana nel software. A1/2 sono le ampiezze dei picchi di raccordo, w1/2 sono le larghezze dei picchi montati e i valori x01/02 sono i centri dei picchi montati. La variabile indipendente è x e la variabile dipendente è y.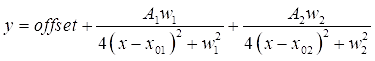 (3)
(3) - Per il raccordo spettrale CARS, fare clic su Analisi | Raccordo | Curva non lineare adatta | Apri finestra di dialogo. Selezionare categoria: nuovo per definire una nuova funzione per CARS. Utilizzare una funzione di raccordo CARS a due picchi definita di seguito (vedere Eq (4)) per il montaggio spettrale CARS.
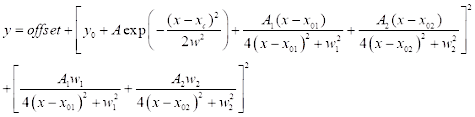 (4)
(4)
- Determinazione della risoluzione spaziale
NOTA: prima di questo passaggio, è importante conoscere la conversione tra la dimensione dei pixel a un ingrandimento specifico, il numero di pixel e la dimensione del passo in μm. Questo può essere eseguito utilizzando un campione di un diametro noto che è più grande della risoluzione di imaging prevista, misurando il suo profilo di linea e adattando una funzione gaussiana per determinare l'intera larghezza al valore FWHM (Half Maximum). È possibile utilizzare obiettivi di risoluzione o campioni uniformi come perline polimeriche.- Acquisire un'immagine di cellule o particelle polimeriche di diametro inferiore a 200 nm.
- Usa ImageJ per disegnare una linea attraverso la particella più piccola dell'immagine.
- Premere K per tracciare il profilo di intensità.
- Fare clic sull'elenco dalla finestra pop-up e copiare le informazioni nel software di adattamento.
- Tracciare il profilo nel software di raccordo e utilizzare il raccordo gaussiano (fare clic su Analisi | Raccordo | Curva non lineare adatta | Apri finestra di dialogo | Categoria: Funzioni di base; Funzione: Gauss).
- Leggere la larghezza di picco dopo il montaggio. Utilizzare la conversione da pixel a dimensione per ottenere la risoluzione effettiva del microscopio.
3. Preparazione di campioni per l'imaging CRS iperspettrale
- Preparazione di vetrini di imaging e campioni chimici
- Posizionare un pezzo di nastro biadesivo su una copertina e ritagliare una piccola forma rettangolare del nastro dal centro del nastro posizionato per creare un'area aperta per il posizionamento del campione.
- Pipettare 1-2 μL di DMSO puro ed erogare la goccia al centro del posto vacante.
- Posizionare con attenzione il coperchio superiore e premere delicatamente i bordi dei coperchi per sigillare la camera, assicurandosi che il campione DMSO non contatti i bordi del nastro.
- Per gli esperimenti di sensibilità, preparare diluizioni seriali di DMSO in ossido di deuterio (D2O) per dare un intervallo di concentrazione del 50% -0%. Prelevare 1-2 μL di ogni soluzione e preparare i campioni pressati come descritto sopra.
- Preparazione cellulare
- Semina le cellule in un piatto di fondo di vetro da 35 mm (o più grande) nel Modified Eagle Medium (DMEM) di Dulbecco con il 10% di siero bovino fetale (FBS) e l'1% di penicillina / streptomicina.
- Incubare le cellule in una camera di incubazione a 37 °C con un'atmosfera di CO2 del 5% durante la notte o più a lungo fino a raggiungere una confluenza del ~50%-80%.
- Immagina direttamente le cellule vive o fissa le cellule con una soluzione di formalina al 10% per l'imaging.
Risultati
Confronti della risoluzione spettrale
La Figura 2 confronta la risoluzione spettrale della microscopia iperspettrale SRS (Figura 2A) e CARS (Figura 2B) utilizzando un campione DMSO. Per lo spettro SRS, sono state applicate due funzioni lorentziane (vedi fase di protocollo 2.3) per adattarsi allo spettro e una risoluzione di 14,6 cm-1 è stata ottenuta utilizzando il picco di 2.913 cm-1 . Per...
Discussione
Il protocollo qui presentato descrive la costruzione di un microscopio CRS multimodale e il confronto diretto tra CARS e SRS imaging. Per la costruzione del microscopio, i passaggi critici sono la sovrapposizione del fascio spaziale e temporale e l'ottimizzazione delle dimensioni del fascio. Si consiglia di utilizzare un campione standard come DMSO prima dell'imaging biologico per ottimizzare l'SNR e calibrare gli spostamenti Raman. Il confronto diretto tra le immagini CARS e SRS rivela che CARS ha una migliore risoluzio...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questa ricerca è stata supportata dal fondo di avvio del Dipartimento di Chimica della Purdue University.
Materiali
| Name | Company | Catalog Number | Comments |
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25x36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
Riferimenti
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619 (1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515 (2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807 (2005).
- Cheng, J. -. X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905 (2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -. o. Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026 (2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -. X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -. X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -. K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -. S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265 (2015).
- Liao, C. -. S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738 (2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W., Gill, G. W. . Cytopreparation: Principles & Practice. , 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -. X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66 (2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847 (2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon