A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توصيف التهاب الصفاق الإنتاني الناجم عن السالمونيلا التيفيموريوم في الفئران
In This Article
Summary
يصف هذا البروتوكول تحريض الإنتان أحادي البكتيريا سالب الجرام في نظام نموذج الماوس. النموذج مفيد في التحقيق في استجابات المضيف الالتهابية والمميتة أثناء الإنتان.
Abstract
الإنتان هو استجابة مناعية للمضيف غير منظم للغزو الميكروبي أو تلف الأنسجة ، مما يؤدي إلى إصابة الأعضاء في موقع بعيد عن موقع العدوى أو الضرر. حاليا، تشمل نماذج الفئران المستخدمة على نطاق واسع من الإنتان تسمم الدم الداخلي الناجم عن عديد السكاريد الشحمي (LPS)، والربط والثقب الدماغي (CLP)، وأنظمة نماذج العدوى أحادية البكتيريا. يصف هذا البروتوكول طريقة لدراسة استجابات المضيف أثناء التهاب الصفاق الإنتاني الناجم عن عدوى السالمونيلا التيفيموريوم في الفئران. س. التيفيموريوم، وهو عامل ممرض داخل الخلايا سالب الجرام، يسبب مرضا شبيها بالتيفوئيد في الفئران.
يوضح هذا البروتوكول إعداد الثقافة ، وتحريض التهاب الصفاق الإنتاني في الفئران من خلال الحقن داخل الصفاق ، وطرق دراسة استجابات المضيف الجهازية. علاوة على ذلك ، يتم تقديم تقييم العبء البكتيري في الأعضاء المختلفة وتحليل التدفق الخلوي لزيادة أعداد العدلات في الغسيل البريتوني. السالمونيلا يؤدي الإنتان الناجم عن التيفيموريوم في الفئران إلى زيادة في السيتوكينات الالتهابية والتسلل السريع للعدلات في التجويف البريتوني ، مما يؤدي إلى انخفاض البقاء على قيد الحياة.
تم تحسين كل خطوة في هذا البروتوكول ، مما أدى إلى قابلية عالية للتكرار من التسبب في التهاب الصفاق الإنتاني . هذا النموذج مفيد لدراسة الاستجابات المناعية أثناء الإنتان البكتيري ، وأدوار الجينات المختلفة في تطور المرض ، وآثار الأدوية لتخفيف الإنتان.
Introduction
يعرف الإنتان بأنه استجابة التهابية ومناعية جهازية غير منظمة للغزو الميكروبي أو تلف الأنسجة ، مما يؤدي إلى إصابة الأعضاء بعيدا عن موقع العدوى أو الضرر. الصدمة الإنتانية هي مجموعة فرعية من الإنتان تتميز بانخفاض ضغط الدم المستمر أثناء إنعاش الحجم ، مع زيادة كبيرة في خطر الوفاة1. أصبح عامة الناس أكثر وعيا بهذا الاضطراب خلال جائحة COVID-19. وعلى الرغم من ارتفاع معدل الوفيات المرتبطة به، فإن البيانات الوبائية الشاملة عن العبء العالمي للإنتان غير متوفرة بسبب تعقيد تشخيصه. في عام 2017 ، كان هناك 48.9 مليون حالة إنتان و 11 مليون حالة وفاة في جميع أنحاء العالم ، وهو ما يمثل 19.7 ٪ من جميع الوفيات العالمية2. علاوة على ذلك ، وجدت دراسة حول الانتشار المطول للعدوى والإنتان المرتبط بها في مرضى وحدة العناية المركزة أن 62٪ من العزلات الإيجابية من المرضى كانت كائنات سالبة الجرام3.
في البداية ، ركزت التحقيقات حول الإنتان على تحديد الإمراض الميكروبية. ومع ذلك ، فإن فهم "فرضية الخطر" ، التي تملي كيفية تمييز المضيف بين الذات وغير الذات ، أدى إلى إمالة توازن أبحاث الإنتان نحو فهم استجابة المضيف لمسببات الأمراض الغازية. تشمل نماذج الفئران المستخدمة على نطاق واسع من الإنتان نموذج تسمم الدم الداخلي الناجم عن عديد السكاريد الشحمي (LPS) ، ونماذج الإنتان متعدد الميكروبات ، والربط والثقب الرأسي (CLP) والتهاب الصفاق العمودي الصاعد للقولون (CASP) ، ونماذج العدوى الأحادية البكتيرية4.
لقد قمنا بتوحيد نظام نموذج الماوس عن طريق تحفيز الإنتان البريتوني باستخدام السالمونيلا التيفيموريوم. هذا النموذج مفيد على غيره لأن السالمونيلا التيفيموريوم هي مسببات الأمراض داخل الخلايا التي تحاكي الحالة ذات الصلة سريريا من الإنتان سالب الجرام. نتيجة تعفن الدم في التهاب الصفاق في هذا النموذج نظامية ، مع وفيات 100 ٪ في غضون 96 ساعة بعد الإصابة. لذلك ، هذا النموذج مفيد في دراسة استجابات المضيف الالتهابية والمميتة. في هذا النموذج، يحدث الإنتان عن طريق حقن 0.5 مليون وحدة تشكيل مستعمرة (CFU) من السالمونيلا التيفيموريوم داخل الصفاق في فأر C57BL/6 عمره 8-10 أسابيع. يمكن تأكيد العدوى الجهازية عن طريق تقييم العبء البكتيري للعضو ~ 16 ساعة بعد الإصابة. توضح هذه المقالة تعفن الدم الناجم عن التهاب الصفاق الناجم عن السالمونيلا التيفيموريوم في الفئران ، وتميز التغيرات الناتجة في تكوين الخلايا البريتونية ، وتحدد العبء البكتيري في الأعضاء المختلفة.
Protocol
أجريت جميع التجارب باستخدام السالمونيلا التيفيموريوم في مرافق مستوى السلامة البيولوجية 2 (BSL-2). يجب توخي الحذر لاستخدام معدات الحماية الشخصية المناسبة (PPE) ، وضمان السلامة ، واتباع طرق التخلص من المخاطر البيولوجية BSL-2 القياسية. أجريت جميع تجارب الفئران وفقا للمبادئ التوجيهية التي ذكرتها لجنة أخلاقيات الحيوان المؤسسية ، IISc. وتم تربية الفئران وصيانتها في المرفق الحيواني المركزي التابع للمعهد (رقم التسجيل: 48/1999/CPCSEA، المؤرخ 1/3/1999)، الذي وافقت عليه وزارة البيئة والغابات في حكومة الهند. تمت الموافقة على البروتوكولات التجريبية من قبل لجنة الأغراض والرقابة والإشراف على التجارب على الحيوانات برقم التصريح المعتمد CAF/Ethics/797/2020.
تعريف BSL2: يمثل تصنيف BSL2 أن العوامل الخطرة بيولوجيا تشكل تهديدا معتدلا للبيئة وموظفي المختبر5.
1. إعداد ثقافة السالمونيلا التيفيموريوم
- أضف 100 ميكرولتر من السالمونيلا التيفيموريوم NCTC 12023 من مخزون الجلسرين إلى 3 مل من مرق لوريا بيرتاني (LB). احتضن الثقافة عند 160 دورة في الدقيقة عند 37 درجة مئوية بين عشية وضحاها.
- خط 50 ميكرولتر من الثقافة المزروعة بين عشية وضحاها في مرق LB على صفيحة أجار السالمونيلا شيغيلا (SS) ويحضن عند 37 درجة مئوية لمدة ~ 12 ساعة. قم بتخزين صفيحة SS agar مع المستعمرات البكتيرية عند 4 درجات مئوية لعدة أيام قبل تجربة العدوى في الجسم الحي .
- اختر مستعمرة واحدة من لوحة SS agar المخططة باستخدام طرف صغير. قم بإخراج الطرف الصغير إلى 3 مل من مرق LB والاستزراع عند 160 دورة في الدقيقة عند 37 درجة مئوية بين عشية وضحاها.
- أضف 0.1 مل من الثقافة البكتيرية إلى 50 مل من مرق LB واحتضنها عند 37 درجة مئوية في حاضنة شاكر عند 160 دورة في الدقيقة لمدة 3-4 ساعات للوصول إلى المرحلة اللوغاريتمية للنمو. تمييع الثقافة بعامل 2 باستخدام مرق LB.
ملاحظة: خلال المرحلة اللوغاريتمية، تكون الخلايا البكتيرية في أفضل حالاتها الصحية وتنقسم بنشاط. - قم بقياس الكثافة البصرية (OD) للمزرعة عند الطول الموجي للضوء 600 نانومتر في مقياس الطيف الضوئي أو قارئ الصفائح الدقيقة. بمجرد أن يصل OD إلى 1.0 ، قم بعمل اثنين من الأليكوت من 1 مل من الثقافة في أنابيب microfuge 1.5 mL.
- قم بطرد الأنابيب مركزيا بسرعة 7,750 × جم لمدة 15 دقيقة. تخلص من السوبرناتانت واغسل الكريات ب 1 مل من 1x PBS 2x. جهاز طرد مركزي للأنابيب بسرعة 7,750 × جم لمدة 15 دقيقة.
- أعد تعليق الكريات في 0.5 مل من 1x PBS في أنبوبين مختلفين 1.5 مل microfuge. اجمع المعلقات من كلا الأنبوبين في أنبوب واحد سعة 1.5 مل يحتوي الآن على ~ 2 × 108 وحدات تشكيل مستعمرة (CFU) / مل.
- تحضير تعليق الخلايا البكتيرية من 1 × 106 CFU / مل عن طريق تخفيف هذا المحلول المخزون.
تنبيه: قم بتحسين CFU المقابل ل OD في ظل ظروف مختبرية محددة لتحديد CFU ل OD 1.0 قبل بدء التجارب.
2. الفئران والالتهابات
- منزل الفئران الذكور C57BL / 6 8-10 أسابيع التي تزن ~ 20 غرام في غرفة الهواء النظيف في منشأة الحيوانات لعدة أيام للتأقلم.
- في يوم العدوى ، أمسك الفأر بيد واحدة ، وامسح جلد البطن بنسبة 70٪ من الإيثانول ، وانشر الساقين الخلفيتين لتحسين الوصول إلى جدار البطن.
- حقن 0.5 مل من 1 × 106 CFU / مل تعليق بكتيري داخل الصفاق بمساعدة حقنة 1 مل. لذلك ، يتلقى كل ماوس 5 × 105 CFU. السيطرة ، تتلقى الفئران غير المصابة 0.5 مل من PBS وحدها. بعد الإصابة ، قم بلوحة الثقافة للتحقق من حقن CFU الفعلي ، والذي قد يختلف من 0.2-0.8 مليون CFU / 0.5 مل.
- ضع الفئران مرة أخرى في الأقفاص كما هو معين.
- التضحية بالفئران باستخدام الاختناق CO2 ~ 12-18 ساعة بعد الإصابة للحصول على أفضل استجابة. عادة ، تموت جميع الفئران المصابة في غضون 96 ساعة. في ظل بعض التدخلات التجريبية ، قد تنجو بعض الفئران. القتل الرحيم لهذه الفئران بعد 96 ساعة. أيضا ، القتل الرحيم لأي فأر مع درجة حرارة الجسم أقل من 33.2 درجة مئوية والضيق الحاد في 96 ساعة كنقطة نهاية إنسانية.
ملاحظة: في هذا النموذج، قد تبدأ بعض الفئران في الموت بعد 12 ساعة من حقن السالمونيلا . لذلك ، خطط للتجارب بشكل صحيح والتي تتضمن نقاطا زمنية متعددة.
3. تقييم CFU للأعضاء
- التضحية بالفأر المصاب عن طريق اختناق CO2 ، ومسح البطن بقطعة من القطن مغموسة في 70 ٪ من الإيثانول. قطع فتح الجلد البطني. ارجع إلى مقالة Ray و Dittel للحصول على بروتوكول فيديو حول كيفية جمع سائل غسل الصفاق6. قطع فتح تجويف الصفاق وجمع الأعضاء ذات الأهمية في أنابيب microfuge. بالإضافة إلى ذلك ، نظرا لأن الدم في الفئران المصابة بالإنتان يتخثر بسرعة وتكون الكميات منخفضة ، فقم بجمعه بسرعة بعد التضحية.
ملاحظة: يوضح هذا الفيديو تعداد CFU العضو من الكبد حيث يخضع الكبد لتلف نسيجي مرضي واسع النطاق في هذا النموذج من الإنتان. - قطع قطعة صغيرة من الكبد ووضعها في أنبوب microfuge.
ملاحظة: يمكن تخزين هذا على الجليد لمدة أقصاها 2-3 ساعات قبل المتابعة إلى الخطوة التالية. - وزن ونقل القطع إلى أنابيب الطرد المركزي الدقيقة. يفضل قطع قطع تزن ~ 10-15 ملغ للتجانس السليم. استخدم أعضاء كاملة في حالة الأعضاء الأصغر مثل الغدد الليمفاوية المساريقية (MLNs) أو الغدة الصعترية.
- أضف 0.5 مل من 1x PBS إلى الأنبوب وقم بتجانس الأعضاء باستخدام مجانس يدوي. تأكد من أن الأعضاء متجانسة تماما. اجعل الحجم يصل إلى 1 مل عن طريق إضافة 0.5 مل من 1x PBS.
- جهاز الطرد المركزي للأنابيب عند 200 × غرام لمدة 5 دقائق عند 4 درجات مئوية.
- اجمع السوبرناتانت في أنابيب microfuge طازجة وقم بإعداد تخفيفات من 1 × 10−1 و 10−2 في صفيحة من 96 بئرا.
- انشر 50 ميكرولتر من المخفف على ألواح SS agar الطازجة واحتضن الألواح عند 37 درجة مئوية لمدة 12 ساعة.
- احسب عدد المستعمرات التي تظهر في كل شرط وقم بتطبيع البيانات مع وزن العضو باستخدام المعادلة (1):
CFU/mg =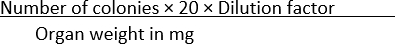 (1)
(1)
ملاحظة: يستخدم الرقم 20 في الصيغة لتحويل المستعمرات لكل لوحة إلى CFU/mL. يتم التوصل إلى هذا الرقم بقسمة 1 مل على مقدار حجم معين من المستنبتة المطلية - في هذه الحالة ، 50 ميكرولتر.
على سبيل المثال ، إذا تم العثور على 100 مستعمرة في صفيحة SS agar ، حيث ينتشر 50 ميكرولتر من 1 × 10-1 تخفيف عضو متجانس يزن 10 ملغ ، ثم
CFU/mg =
4. تحليل التدفق الخلوي لمختلف مجموعات الخلايا المناعية في الإفرازات البريتونية
- جمع الخلايا البريتونية كما هو موضح سابقا من قبل راي وديتل6.
- أعد تعليق بيليه الخلية من سائل الغسل البريتوني في 1 مل من RPMI مع استكمال مصل البقر الجنيني بنسبة 10٪ (FBS). تعداد إجمالي أعداد الخلايا في الغسيل البريتوني باستخدام مقياس الدم. اضبط رقم الخلية بحيث يتلقى كل أنبوب 0.2-0.5 مليون خلية.
ملاحظة: قد يحتوي الغسل البريتوني في الفئران المصابة بالإنتان على كرات الدم الحمراء ، والتي ربما تظهر بسبب النزيف. كن حريصا على استبعاد كرات الدم الحمراء أثناء حساب الخلايا البريتونية. في المجهر الساطع ، تظهر كرات الدم الحمراء أصغر بكثير من الخلايا المناعية. تظهر هذه على شكل أقراص مسطحة أو دونات ، مستديرة ، مع مسافة بادئة في الوسط ، ولكنها ليست جوفاء. يمكن إضافة خطوة لتحليل كرات الدم الحمراء7. - قم بتدوير الخلايا لأسفل عند 200 × جم عند 4 درجات مئوية لمدة 10 دقائق ، وتخلص من supernatant ، واغسل الخلايا 1x باستخدام 1x PBS بارد. الطرد المركزي للخلايا في 200 × غرام عند 4 درجات مئوية لمدة 10 دقائق.
- قم بحظر مستقبلات Fc على PECs باستخدام مانع FcR (تخفيف 1: 400) ، تم إعداده في مخزن مؤقت للحجب يتكون من 5٪ FBS و 0.02٪ أزيد الصوديوم في PBS. احتضان على الثلج لمدة 15 دقيقة.
- الطرد المركزي للخلايا في 200 × غرام عند 4 درجات مئوية لمدة 10 دقائق. تخلص من السوبرناتانت. تمييع الأجسام المضادة المقترنة بالفلوروكروم ذات الأهمية في منع المخزن المؤقت. استخدم تخفيفا بنسبة 1:500 من LY6G المضاد للفأر لتلطيخ العدلات.
ملاحظة: يمكن أيضا الكشف عن مجموعات الخلايا المناعية الأخرى باستخدام ، على سبيل المثال ، مضاد الفأر B220 للخلايا البائية ، ومضاد للفأر CD3 للخلايا التائية ، ومضاد للفأر F4/80 للبلاعم. - احتضان ~ 0.2 مليون خلية في 200 ميكرولتر من المحاليل المخففة للأجسام المضادة في أنابيب منفصلة. كعنصر تحكم سلبي ، ضع جانبا أنبوبا واحدا في كل نوع من أنواع الفلوروكروم للتحكم غير الملطخ لاحتضان الخلايا ب 200 ميكرولتر من المخزن المؤقت المانع بدون جسم مضاد.
- احتضن العينات على الجليد لمدة 45 دقيقة مع النقر المتقطع كل 15 دقيقة.
- الطرد المركزي للخلايا في 200 × غرام لمدة 10 دقائق عند 4 درجات مئوية. تخلص من السوبرناتانت. إصلاح الخلايا مع 4 ٪ بارافورمالديهايد لمدة ~ 15 دقيقة في درجة حرارة الغرفة إذا كانت هناك حاجة لتخزينها لعدة أيام. ومع ذلك ، من الأفضل الحصول على بيانات من عينات ملطخة حديثا في مقياس التدفق الخلوي.
- أعد تعليق الخلايا في 200 ميكرولتر من المخزن المؤقت لتلطيخ FACS (2٪ FBS في PBS). الحصول على البيانات في مقياس التدفق الخلوي.
النتائج
يظهر توصيف مفصل للاستجابة المناعية للمضيف باستخدام هذا النموذج المعين في المنشورات السابقة 8,9. ويرد في هذا القسم عدد قليل من النتائج التمثيلية للبروتوكول الموصوف. يهدف هذا النموذج إلى تحفيز العدوى الجهازية ل S. التيفيموريوم عن طريق الحقن داخل الصفاق ل?...
Discussion
توضح هذه المقالة طريقة لتحفيز شكل حاد من الإنتان البكتيري عن طريق الحقن داخل الصفاق من السالمونيلا التيفيموريوم. هذا النموذج مفيد على غيره لأن السالمونيلا التيفيموريوم هي مسببات الأمراض داخل الخلايا ، وبالتالي ، شديدة الإمراض ، تحاكي الحالة ذات الصلة سريريا من الإنتان سالب الج...
Disclosures
وليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر مرفق الحيوانات المركزي ، IISc على تزويدنا بالفئران للبحث. تم تمويل هذه الدراسة من خلال منح مقدمة إلى DpN من قسم التكنولوجيا الحيوية ومجلس أبحاث العلوم والهندسة ، حكومة الهند. يتم الاعتراف بشكل كبير بدعم البنية التحتية من برنامج DBT-IISc ومنح DST-FIST. نشكر جميع الأعضاء السابقين والحاليين في مختبر DpN على دعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| Consumables | |||
| 1 mL Sterile Syringe with 26 G needle | Beckton Dickinson, Singapore | 303060 | |
| 1.5 mL Microcentrifuge Tube | Tarsons, USA | 500010 | |
| 10 mL Sterile Syringe with 21 G needle | Beckton Dickinson, Spain | 307758 | |
| 50 mL Conical Flask | Tarsons, USA | 441150 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546041 | |
| 50 mL Graduated Centrifuge Tube | Tarsons, USA | 546021 | |
| Cell spreader | VWR, USA | VWRU60828-680 | |
| Dulbecco’s Phosphate Buffered Saline | HiMedia, Mumbai, India | TS1006 | |
| Ethanol | Merck | 100983 | |
| FcR blocker | BD Biosciences | 553142 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC Rat anti-mouse Ly6G (Clone 1A8) | BD Pharmingen | 551460 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Hand based Homogenizer | - | - | |
| Hemocytometer (Neubauer counting chamber) | Rohem, India | I.S. 10269 | |
| Luria Bertani Broth | HiMedia, Mumbai, India | M1245 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Petriplates | Tarsons, USA | 460091 | |
| RPMI | Himedia, Mumbai, India | AT060-10X1L | |
| Salmonella-Shigella Agar | HiMedia, Mumbai, India | M108 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Equipments | |||
| Centrifuge | Kubota | ||
| Flow cytometer | BD FACSverse | ||
| Incubator | N-biotek | ||
| Spectrophotometer | Shimadzu | ||
| Weighing machine | Sartorius |
References
- Hotchkiss, R. S., et al. Sepsis and septic shock. Nature Reviews Disease Primers. 2 (1), 1-21 (2016).
- Rudd, K. E., et al. regional, and national sepsis incidence and mortality, 1990-2017: Analysis for the Global Burden of Disease Study. The Lancet. 395 (10219), 200-211 (2020).
- Vincent, J. L., et al. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 302 (21), 2323-2329 (2009).
- Lewis, A. J., Seymour, C. W., Rosengart, M. R. Current murine models of sepsis. Surgical Infections. 17 (4), 385-393 (2016).
- Ta, L., Gosa, L., Nathanson, D. A. Biosafety and biohazards: Understanding biosafety levels and meeting safety requirements of a biobank. Biobanking. 1897, 213-225 (2019).
- Ray, A., Dittel, D. N. Isolation of Mouse Peritoneal Cavity Cells. Journal of Visualized Experiments: JoVE. (35), e1488 (2010).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-protocol. 5 (20), 1631 (2015).
- Yadav, S., et al. Nitric oxide synthase 2 enhances the survival of mice during Salmonella Typhimurium infection-induced sepsis by increasing reactive oxygen species, inflammatory cytokines and recruitment of neutrophils to the peritoneal cavity. Free Radical Biology & Medicine. 116, 73-87 (2018).
- Verma, T., et al. Cell-free hemoglobin is a marker of systemic inflammation in mouse models of sepsis: A Raman spectroscopic study. Analyst. 146 (12), 4022-4032 (2021).
- Cassado, A. D. A., Lima, M. R. D., Bortoluci, K. R. Revisiting mouse peritoneal macrophages: Heterogeneity, development, and function. Frontiers in Immunology. 6, 225 (2015).
- Yadav, S., Verma, T., Chattopadhyay, A., Nandi, D. Factors affecting the pathophysiology of sepsis, an inflammatory disorder: Key roles of oxidative and nitrosative stress. Indian Journal of Inflammation Research. 3 (1), 2 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved