Method Article
التهجين الفلوري للحمض النووي الريبي في الموقع (FISH) لتصور الاستعمار الميكروبي والعدوى في أمعاء Caenorhabditis elegans
In This Article
Summary
غالبا ما ترتبط الميكروبات المعوية ، بما في ذلك البكتيريا خارج الخلية ومسببات الأمراض داخل الخلايا مثل فيروس أورساي والميكروسبوريديا (الفطريات) ، بالديدان الخيطية الخيطية البرية Caenorhabditis . تقدم هذه المقالة بروتوكولا للكشف عن الميكروبات التي تستعمر و / أو تصيب الديدان الخيطية C. elegans وقياسها ، ولقياس حمل مسببات الأمراض بعد العدوى الخاضعة للرقابة في المختبر.
Abstract
تسكن أمعاء نيماتودا Caenorhabditis البرية مجموعة متنوعة من الكائنات الحية الدقيقة ، بما في ذلك بكتيريا ميكروبيوم الأمعاء ومسببات الأمراض ، مثل microsporidia والفيروسات. بسبب أوجه التشابه بين Caenorhabditis elegans والخلايا المعوية للثدييات ، بالإضافة إلى قوة نظام C. elegans ، ظهر هذا المضيف كنظام نموذجي لدراسة تفاعلات الأمعاء والميكروب المضيف في الجسم الحي. في حين أنه من الممكن ملاحظة بعض جوانب هذه التفاعلات باستخدام الفحص المجهري للمجال الساطع ، فمن الصعب تصنيف الميكروبات بدقة وتوصيف مدى الاستعمار أو العدوى دون أدوات أكثر دقة. يمكن استخدام التهجين الفلوري في الموقع (FISH) كأداة لتحديد وتصور الميكروبات في الديدان الخيطية من البرية أو لتوصيف العدوى وقياسها تجريبيا في الديدان الخيطية المصابة بالميكروبات في المختبر. مجسات FISH ، التي تضع علامات على الحمض النووي الريبوزي الريبوسومي الصغير الوفير للغاية ، تنتج إشارة ساطعة للبكتيريا والخلايا المجهرية. يمكن للمجسات المصممة لاستهداف المناطق المحفوظة من الحمض النووي الريبي الريبوسومي الشائعة في العديد من الأنواع اكتشاف مجموعة واسعة من الميكروبات ، في حين أن استهداف المناطق المتباينة من الحمض النووي الريبوسومي مفيد للكشف الأضيق. وبالمثل ، يمكن تصميم المجسات لتسمية الحمض النووي الريبي الفيروسي. يتم تقديم بروتوكول لتلطيخ RNA FISH إما مع بارافورمالدهيد (PFA) أو تثبيت الأسيتون. يعد تثبيت PFA مثاليا للديدان الخيطية المرتبطة بالبكتيريا والميكروسبوريديا والفيروسات ، في حين أن تثبيت الأسيتون ضروري لتصور جراثيم microsporida. تم غسل الحيوانات أولا وتثبيتها في بارافورمالدهيد أو الأسيتون. بعد التثبيت ، تم تحضين مجسات FISH بعينات للسماح بتهجين المجسات إلى الهدف المطلوب. تم غسل الحيوانات مرة أخرى ثم فحصها على شرائح المجهر أو باستخدام الأساليب الآلية. بشكل عام ، يتيح بروتوكول FISH هذا الكشف عن الميكروبات التي تعيش في أمعاء C. elegans وتحديدها وتحديدها ، بما في ذلك الميكروبات التي لا توجد أدوات وراثية متاحة لها.
Introduction
برز Caenorhabditis elegans كنظام نموذجي قوي لدراسة المناعة الفطرية وتفاعلات ميكروب المضيف في الخلايا الظهارية المعوية 1,2. نظرا لوجود جسم شفاف و 20 خلية معوية فقط ، تمثل C. elegans نظاما مناسبا لمراقبة عمليات الاستعمار المعوي الميكروبي والعدوى في سياق كائن حي سليم. تشترك الخلايا المعوية الخيطية في أوجه تشابه مورفولوجية ووظيفية متعددة مع الخلايا الظهارية المعوية للثدييات ، مما يجعلها نموذجا قابلا للتتبع في الجسم الحي لتشريح العمليات التي تحكم استعمار الميكروبيوم وعدوى مسببات الأمراض3،4،5،6.
تتغذى Wild C. elegans على مجموعة متنوعة من الميكروبات التي تستعمر الأمعاء وتصيبها ، وقد أدى أخذ عينات من هذه الديدان الخيطية إلى اكتشاف الفيروسات وحقيقيات النوى (الفطريات والفطريات البيضية) والبكتيريا التي ترتبط بشكل طبيعي بهذا المضيف7،8،9،10. تم العثور على فيروس Orsay يصيب الأمعاء وهو حاليا الفيروس الطبيعي الوحيد المعروف ل C. elegans9. Microsporidia هي مسببات الأمراض داخل الخلايا المرتبطة بالفطريات والتي تعد العدوى الأكثر شيوعا في التهاب Caenorhabditis الذي يتم صيده في البرية ، حيث تم اكتشاف العديد من الأنواع التي تصيب C. elegans والديدان الخيطية ذات الصلة 8,11. توجد العديد من البكتيريا بشكل شائع في تجويف الأمعاء ل C. elegans التي يتم صيدها في البرية وقد تم إنشاء العديد من الأنواع كنموذج طبيعي لميكروبيوم C. elegans (CeMbio)6،12،13،14. يعد اكتشاف وتوصيف الميكروبات التي تستعمر و / أو تصيب C. elegans بشكل طبيعي أمرا ضروريا لفهم الآليات الجينية التي تحكم هذه التفاعلات بين الميكروبات المضيفة ، بالإضافة إلى تصور العمليات الميكروبية الجديدة التي تحدث فقط في سياق مضيف سليم.
بعد أخذ العينات ، يتم فحص الديدان الخيطية البرية عن طريق الفحص المجهري لتباين التداخل التفاضلي (DIC) للبحث عن الأنماط الظاهرية التي تشير إلى العدوى أو الاستعمار. على سبيل المثال ، يمكن أن ترتبط التغييرات في المظهر الحبيبي النمطي للخلايا المعوية بوجود عدوى طفيلية داخل الخلايا8. على وجه التحديد ، يعد فقدان حبيبات الأمعاء وانخفاض اللزوجة الخلوية علامات على العدوى الفيروسية ، في حين أن إعادة تنظيم حبيبات الأمعاء إلى "أخاديد" قد تشير إلى الإصابة بالميكروسبوريديا في جنس Nematocida 8,9. نظرا لوجود مجموعة متنوعة من الميكروبات الموجودة في عينات C. elegans البرية ، فقد يكون من الصعب التمييز بين الميكروبات من خلال الفحص المجهري لمدينة دبي للإنترنت. قد يكون من الصعب أيضا اكتشاف المعلومات المتعلقة بالتوزيع المكاني للميكروبات داخل المضيف بسبب صغر حجم العديد من الميكروبات15. بالإضافة إلى ذلك ، فإن زراعة أي ميكروبات معينة ذات أهمية في المختبر ليست ممكنة دائما ، مما يؤدي إلى صعوبات في الكشف و / أو القياس الكمي.
يوفر التهجين الفلوري للحمض النووي الريبي في الموقع (FISH) طريقة لتسمية الميكروبات بالفلورسنت من خلال استخدام مجسات الفلورسنت التي ترتبط بالحمض النووي الريبي للوحدة الفرعية الريبوسومية الصغيرة (SSU) في الخلايا الثابتة. إذا كان تحليل الخصائص المورفولوجية يشير إلى فئة معينة من الميكروبات ، فيمكن استخدام مجسات FISH التي تستهدف فئات محددة أو واسعة من هذه الميكروبات. على سبيل المثال ، يعتبر EUB338 مسبارا عالميا ل SSU البكتيري ويستخدم بشكل شائع للكشف عن مجموعة واسعة من البكتيريا16. يستخدم البروتوكول الموصوف هنا مجسات الحمض النووي أحادية الشريط التي يتم تصنيفها في النهاية باستخدام فلوروفور ومصممة خصيصا لتكون مكملة ل SSU المستهدف للميكروب محل الاهتمام ، على الرغم من وجود مجسات مصممة مسبقا متاحة16. الميزة الرئيسية لاستهداف SSU من الميكروبات هي الوفرة الكبيرة نسبيا لهذا الحمض النووي الريبي ، والتي تضم عادة 80٪ -90٪ من جميع الحمض النووي الريبي في الخلية ، مما يؤدي إلى تلطيخ بنسبة إشارة إلى ضوضاءعالية جدا 17. يمكن أيضا تصميم المجسات لاستهداف الحمض النووي الريبي للكشف عن الفيروسات ، مثل فيروس Orsay 9,18 ، والتي غالبا ما تكون موجودة في نسخ عالية جدا في الخلايا المصابة إذا كان الفيروس يتكاثر بنشاط.
اعتمادا على النتائج مع المجسات المعروفة ، قد يكون من الضروري الحصول على مزيد من معلومات التسلسل لتصميم مجسات أكثر تحديدا لتأكيد الأنواع في الموقع. النهج الشائع هو استخدام البادئات العالمية ضد المناطق المحفوظة من SSU (16S للبكتيريا و 18S لحقيقيات النوى) لتضخيم (عبر PCR) المناطق الأكثر تباينا8. باستخدام معلومات التسلسل هذه ، يمكن تصميم مجسات ذات خصوصية أكبر للأنواع. يمكن لمجسات FISH هذه بعد ذلك تمكين تحديد الميكروبات بطريقة مستقلة عن الثقافة8. بالإضافة إلى ذلك ، يمكن أن يعطي RNA FISH نظرة ثاقبة للاستعمار المورفولوجي الفريد وخصائص العدوى ، بما في ذلك أنماط الخيوط أو توطين الأنسجة19،20. يمكن استخدام مجسات FISH الملونة المختلفة في وقت واحد ، مما يسمح بالتمييز البصري بين الميكروبات في عينات الديدان الخيطية البرية ، بالإضافة إلى مراقبة ديناميكيات الميكروب والميكروب داخل مضيف15,20. علاوة على ذلك ، يمكن تطبيق تلطيخ RNA FISH على دراسات التفاعل بين المضيف والممرض حيث يمكن بسهولة قياس العدوى واستعمار الأنواع المعروفة يدويا أو من خلال الأساليب الآلية لتقديم رؤى حول حمل مسببات الأمراض ، على سبيل المثال ، في مقارنة طفرات C. elegans التي زادت أو قللت من مقاومة العدوى21.
Protocol
ملاحظة: يمكن تثبيت الديدان الخيطية إما بمحلول بارافورمالدهيد (PFA) أو الأسيتون. يسمح PFA بتصور أفضل للتشكل من الأسيتون ويمكنه الحفاظ على الإشارات من البروتين الفلوري الأخضر المعدل وراثيا (GFP) ، والذي يتم تدميره بواسطة الأسيتون. ومع ذلك ، فإن تثبيت الأسيتون ضروري لاختراق جراثيم microsporidian لتمكين وضع العلامات على هذه المرحلة من الحياة. علاوة على ذلك ، يمكن أن يكون الأسيتون أكثر ملاءمة من PFA لأنه أقل سمية ، ويمكن تخزين العينات لعدة أيام في الأسيتون في مجمد -20 درجة مئوية دون الحاجة إلى إزالة المثبت. فيما يلي بروتوكولان منفصلان ، باستخدام محلول PFA أو الأسيتون كمثبت. للحصول على تصور لخطوات البروتوكول ، انظر الشكل 1.
1. تلطيخ الأسماك مع تثبيت PFA
- تحضير الديدان الخيطية مع الميكروبات المرتبطة بها
- تنمو الديدان الخيطية مع الميكروب المطلوب من الاهتمام على لوحات وسائط نمو الديدان الخيطية القياسية (NGM) المصنفة بمصدر الغذاء المناسب. احتضان الديدان الخيطية عند 20 درجة مئوية حتى يتم الوصول إلى مرحلة الحياة المطلوبة.
- أضف 2 مل من وسائط الأملاح الدنيا M9 (42 mM Na 2 HPO4 ، 22 mM KH2PO 4 ، 8.6 mM NaCl ، 19 mM NH 4 Cl) + 0.1٪ Tween 20 إلى NGM لوحات تحتوي على سلالة Caenorhabditis المصابة أو المستعمرة مع الميكروب المطلوب ليتم تصوره.
ملاحظة: إضافة المنظفات هي لمنع الديدان الخيطية من الالتصاق بالماصات وأنابيب microfuge ، ولمساعدة نيماتودا مرحلة الحبيبات L1-L2. 0.1٪ يمكن استخدام Triton-X بدلا من Tween 20. - ماصة حتى الديدان الخيطية من لوحات باستخدام ماصة باستور الزجاج واللمبة، ونقلها إلى أنابيب microfuge ملحوظ 1.5 مل.
ملاحظة: يفضل استخدام الماصات الزجاجية لأن الديدان الخيطية يمكن أن تلتصق بالماصات البلاستيكية ، لكن إضافة المنظفات (Tween 20 أو Triton-X) يمكن أن تقلل من هذه المشكلة. - باستخدام جهاز طرد مركزي دقيق ، قم بتدوير العينات التي تحتوي على الديدان الخيطية المستعمرة أو المصابة عند 2000 × جم لمدة 60 ثانية للحيوانات L1 ، أو 500 × جم لمدة 60 ثانية للحيوانات L4 أو الحيوانات البالغة. سيتم تنفيذ جميع خطوات الطرد المركزي اللاحقة بالسرعة المحددة.
- قم بإزالة المادة الطافية من أنابيب microfuge باستخدام ماصة. تجنب إزعاج حبيبات الديدان الخيطية عن طريق إزالة المادة الطافية بعناية حتى 100 ميكرولتر فوق الحبيبات. يمكن تقدير ذلك باستخدام أنابيب microfuge 1.5 مل.
- غسل الديدان الخيطية للقضاء على التلوث الخارجي
- أضف 1 مل من 1x PBS (137 mM NaCl ، 2.7 mM KCl ، 10 mM Na 2 HPO 4 ، 1.8 mM KH2PO4) + 0.1٪ Tween 20 (PBS-T) إلى أنابيب microfuge.
- قم بتدوير العينات في جهاز طرد مركزي دقيق بالسرعة المناسبة (انظر الخطوة 1.1.4). باستخدام ماصة ، قم بإزالة كل ما عدا 100 ميكرولتر من المادة الطافية. يمكن تقدير ذلك باستخدام أنابيب microfuge 1.5 مل.
- كرر الخطوتين أعلاه 2-3x.
ملاحظة: عادة ما تكون ثلاث غسلات إجمالية كافية ؛ ومع ذلك ، يمكن إجراء غسلات إضافية لإزالة أي تلوث خارجي زائد.
- إصلاح الديدان الخيطية مع PFA
- في غطاء الدخان ، أضف 33 ميكرولتر من 16٪ PFA إلى أنبوب microfuge الذي يحتوي على 100 ميكرولتر من المادة الطافية فوق حبيبات الديدان الخيطية التي تم الحصول عليها من الخطوة 1.2.3 للحصول على تركيز نهائي بنسبة 4٪ PFA.
تنبيه: PFA مادة مسرطنة. قد يؤدي ملامسة PFA إلى حساسية الجلد وتهيجه وتلف العين. يطلق PFA أبخرة سامة قد تؤدي إلى تهيج الجهاز التنفسي أو التحسس. عند استخدام PFA ، اعمل في غطاء دخان مع معدات الحماية الشخصية المناسبة وارجع إلى أوراق بيانات السلامة المناسبة قبل الاستخدام. - احتضان العينات التي تحتوي على الديدان الخيطية المستعمرة أو المصابة بالميكروب محل الاهتمام لمدة 30-45 دقيقة في درجة حرارة الغرفة. بعد الحضانة ، قم بتخزين العينات في 70٪ من الإيثانول عند 4 درجات مئوية حتى يصبح البروتوكول جاهزا للمتابعة.
ملاحظة: فترة الحضانة الأقصر أفضل للحفاظ على إشارة GFP في السلالات المعدلة وراثيا بسبب تدهور GFP بواسطة PFA بمرور الوقت. تسمح أوقات الحضانة الأطول للمثبت بالاختراق بشكل أفضل في العينات. من الأفضل تحديد وقت الحضانة تجريبيا اعتمادا على العينة.
- في غطاء الدخان ، أضف 33 ميكرولتر من 16٪ PFA إلى أنبوب microfuge الذي يحتوي على 100 ميكرولتر من المادة الطافية فوق حبيبات الديدان الخيطية التي تم الحصول عليها من الخطوة 1.2.3 للحصول على تركيز نهائي بنسبة 4٪ PFA.
- قم بإزالة محلول PFA
- قم بتدوير العينات في جهاز طرد مركزي دقيق بالسرعة المناسبة (انظر الخطوة 1.1.4). باستخدام ماصة ، قم بإزالة أكبر قدر ممكن من المادة الطافية دون إزعاج الحبيبات.
تنبيه: يحتوي الطافي على PFA ، وهو سام. تخلص من المادة الطافية وغسلتين على الأقل كنفايات سامة في غطاء الدخان. - أضف 0.5 مل من PBS-T إلى العينات الموجودة في أنابيب microfuge.
- اتبع وكرر الخطوات 1.4.1 و 1.4.2 2-3x مع PBS-T.
ملاحظة: سيساعد إجراء المزيد من عمليات الغسيل في تقليل إشارة الخلفية. يوصى بأربع غسلات على الأقل في المجموع. - بعد الغسيل الأخير ، قم بتدوير العينات وإزالة المادة الطافية ، تاركا الحبيبات دون إزعاج.
- قم بتدوير العينات في جهاز طرد مركزي دقيق بالسرعة المناسبة (انظر الخطوة 1.1.4). باستخدام ماصة ، قم بإزالة أكبر قدر ممكن من المادة الطافية دون إزعاج الحبيبات.
- تحضير المخزن المؤقت للتهجين (HB) وغسل الديدان الخيطية
- تحضير 1 مل من HB (900 mM NaCl ، 20 mM Tris pH 7.5 ، 0.01٪ SDS) لكل عينة.
ملاحظة: يجب تحضير HB طازجا قبل كل استخدام لتجنب هطول الأمطار. ومع ذلك ، يمكن عمل مخزن مؤقت عام (900 mM NaCl ، 20 mM Tris pH 7.5) مسبقا وتخزينه في درجة حرارة الغرفة حتى تكون هناك حاجة إلى HB. قبل الاستخدام ، قم بإعداد 1 مل لكل عينة من المخزن المؤقت العام وأضف SDS إلى تركيز نهائي بنسبة 0.01٪. - أضف 800 ميكرولتر من HB إلى أنابيب microfuge التي تحتوي على حبيبات الديدان الخيطية. قم بتكوير العينات في جهاز الطرد المركزي الدقيق (انظر الخطوة 1.1.4). قم بإزالة المادة الطافية دون إزعاج الحبيبات.
- تحضير 1 مل من HB (900 mM NaCl ، 20 mM Tris pH 7.5 ، 0.01٪ SDS) لكل عينة.
- تهجين مسبار FISH إلى التسلسل المستهدف المطلوب
- امزج 100 ميكرولتر لكل عينة من HB المحضر مع مسبار FISH المطلوب إلى تركيز نهائي من مسبار 5-10 نانوغرام / ميكرولتر.
ملاحظة: مجسات FISH هي 15-23 -mer oligos ، مضادة للحساسية ل SSU للميكروب محل الاهتمام ، وموسومة بفلوروفور ملون متصل بنهاية 5 'أو 3' (انظر الجدول 1 للمجسات المستخدمة هنا). بشكل عام ، يتم تخزين مجسات FISH المخزنة عند 1 مجم / مل. - أضف 100 ميكرولتر من HB الذي يحتوي على مسبار FISH لكل عينة. تخلط عن طريق تحريك الأنابيب برفق أو قلبها.
ملاحظة: يمكن إضافة مجسات FISH ملونة مختلفة في وقت واحد لتصور إشارات فلورية متعددة في نفس العينة (انظر الشكل 1B). - احتضان العينات طوال الليل (6-24 ساعة) في حمام جاف عند 46-54 درجة مئوية أو خلاط حراري عند 46-54 درجة مئوية عند 1200 دورة في الدقيقة.
ملاحظة: عادة ما تستخدم الحضانة عند 46-48 درجة مئوية للتهجين. ومع ذلك ، قد تحتاج درجة الحرارة هذه إلى التعديل اعتمادا على درجة حرارة انصهار مسبار FISH. بشكل عام ، تكون درجة حرارة التهجين 4 درجات مئوية أقل من درجة حرارة الانصهار.
- امزج 100 ميكرولتر لكل عينة من HB المحضر مع مسبار FISH المطلوب إلى تركيز نهائي من مسبار 5-10 نانوغرام / ميكرولتر.
- قم بإزالة مسبار FISH واغسل الديدان الخيطية
- قم بإعداد 3 مل من محلول الغسيل المؤقت (WB) (900 مللي متر كلوريد الصوديوم ، 20 مللي متر من Tris pH 7.5 ، 5 مللي متر EDTA ، 0.01٪ SDS) لكل عينة.
ملاحظة: يجب تحضير البنك الدولي طازجا قبل كل استخدام لتجنب هطول الأمطار. ومع ذلك ، يمكن عمل مخزن مؤقت عام (900 mM NaCl ، 20 mM Tris pH 7.5) مسبقا وتخزينه في درجة حرارة الغرفة حتى تكون هناك حاجة إلى مخزن الغسيل المؤقت. قبل الاستخدام ، قم بإعداد 3 مل لكل عينة من المخزن المؤقت العام وأضف EDTA إلى التركيز النهائي البالغ 5 مللي مول و SDS إلى التركيز النهائي بنسبة 0.01٪. - أجهزة الطرد المركزي للعينات بالسرعة المناسبة (انظر الخطوة 1.1.4). قم بإزالة HB باستخدام ماصة ، مع الحرص على ترك حبيبات الديدان الخيطية دون إزعاج.
- أضف 1 مل من WB المحضر لكل عينة.
- أجهزة الطرد المركزي للعينات بالسرعة المناسبة (انظر الخطوة 1.1.4). قم بإزالة WB باستخدام ماصة ، مع الحرص على ترك الحبيبات دون إزعاج.
- أضف 1 مل من WB المحضر لكل عينة.
- احتضان العينات لمدة 1 ساعة عند 48-56 درجة مئوية في حمام جاف (أو خلاط حراري عند 48-56 درجة مئوية عند 1200 دورة في الدقيقة). في حالة الحضانة في حمام جاف ، اقلب الأنابيب برفق كل 15-20 دقيقة.
ملاحظة: بشكل عام ، يتم استخدام 48 درجة مئوية كدرجة حرارة الغسيل القياسية ؛ ومع ذلك ، قد تحتاج درجة الحرارة هذه إلى التعديل إذا كانت هناك إشارة خلفية عالية. غالبا ما تكون درجة حرارة الغسيل أعلى بمقدار 2 درجة مئوية من درجة حرارة التهجين. يمكن تقصير وقت الحضانة في البنك الدولي إلى 30 دقيقة لتقليل الخلفية بشكل أكبر ، وبعد ذلك ، يجب تكرار الخطوتين 1.7.4 و 1.7.5. يجب أن يتبع ذلك فترة حضانة واحدة (للبكتيريا) أو اثنتين (للبلازما البوغية الدقيقة) فترات حضانة مدتها 30 دقيقة عند 48 درجة مئوية. - أجهزة الطرد المركزي للعينات بالسرعة المناسبة (انظر الخطوة 1.1.4). باستخدام ماصة ، قم بإزالة المخزن المؤقت للغسيل ، مع الحرص على ترك الحبيبات دون إزعاج.
- أضف 100-500 ميكرولتر من PBS-T إلى كل عينة. في هذه المرحلة ، يمكن تخزين العينات في PBS-T عند 4 درجات مئوية لمدة تصل إلى أسبوع حتى يصبح البروتوكول جاهزا للمتابعة.
- قم بإعداد 3 مل من محلول الغسيل المؤقت (WB) (900 مللي متر كلوريد الصوديوم ، 20 مللي متر من Tris pH 7.5 ، 5 مللي متر EDTA ، 0.01٪ SDS) لكل عينة.
- جبل الديدان الخيطية
- أجهزة الطرد المركزي للعينات بالسرعة المناسبة (انظر الخطوة 1.1.4). قم بإزالة أكبر قدر ممكن من PBS-T دون إزعاج حبيبات الديدان الخيطية.
- (اختياري) أضف 20 ميكرولتر من وسيط التركيب المضاد للتلاشي مع DAPI (جدول المواد) إلى العينات.
- قم بتحميل ماصة 20 ميكرولتر بطرف ماصة 200 ميكرولتر واستخدم المقص لقطع طرف الماصة للسماح بسحب الديدان الخيطية الكبيرة.
- باستخدام طرف الماصة المقطوع ، انقل 5-10 ميكرولتر من الحبيبات إلى شريحة مجهر. قم بتغطيتها بغطاء 22 × 22. لتخزين الشرائح ، أغلق حواف الغطاء بطلاء الأظافر واحتفظ بها في صندوق مظلم عند 4 درجات مئوية حتى تصبح جاهزة للاستخدام مرة أخرى.
2. تلطيخ الأسماك مع تثبيت الأسيتون
- تحضير الديدان الخيطية مع الميكروبات المرتبطة بها كما هو موضح في الخطوة 1.1.
- اغسل الديدان الخيطية للتخلص من التلوث الخارجي كما هو موضح في الخطوة 1.2.
- إصلاح الديدان الخيطية مع الأسيتون
- قم بإزالة المادة الطافية دون إزعاج الحبيبات وأضف 1 مل من الأسيتون من الدرجة المعملية إلى العينة.
تنبيه: الأسيتون سائل وبخار شديد الاشتعال. على الرغم من أنه يمكن شراؤه بدون وصفة طبية كمزيل لطلاء الأظافر ، فمن المهم أن تتذكر أن الأسيتون يسبب تهيجا خطيرا للعين ، وقد يسبب النعاس أو الدوخة. - احتضان العينات التي تحتوي على الديدان الخيطية المستعمرة أو المصابة بالميكروب محل الاهتمام لمدة 15 دقيقة في درجة حرارة الغرفة. بعد الحضانة ، يمكن تخزين العينات في الأسيتون عند -20 درجة مئوية لمدة تصل إلى أسبوعين حتى يصبح البروتوكول جاهزا للمتابعة.
ملاحظة: لا تستخدم هذا البروتوكول مع سلالات C. elegans المعدلة وراثيا التي تعبر عن GFP (أو أشكاله المتحولة الأيلية) إذا كان من المرغوب فيه الحفاظ على التألق ، لأن الأسيتون يدمر هذه الإشارة.
- قم بإزالة المادة الطافية دون إزعاج الحبيبات وأضف 1 مل من الأسيتون من الدرجة المعملية إلى العينة.
- إزالة الأسيتون
- قم بتدوير العينات في جهاز طرد مركزي دقيق بالسرعة المناسبة (انظر الخطوة 1.1.4). باستخدام ماصة ، قم بإزالة المادة الطافية دون إزعاج الحبيبات.
تنبيه: يحتوي المادة الطافية على الأسيتون. تخلص من المادة الطافية وغسلتين على الأقل كنفايات سامة في غطاء الدخان. - أضف 0.5 مل من PBS-T إلى العينات الموجودة في أنابيب microfuge.
- اتبع وكرر الخطوات 2.4.1 و 2.4.2 2-4x مع PBS-T.
ملاحظة: سيساعد إجراء المزيد من عمليات الغسيل في تقليل إشارة الخلفية. يوصى بإجراء أربع غسلات في المجموع. - بعد الغسيل الأخير ، قم بتدوير العينات وإزالة المادة الطافية ، مما يضمن عدم إزعاج الحبيبات.
- قم بتدوير العينات في جهاز طرد مركزي دقيق بالسرعة المناسبة (انظر الخطوة 1.1.4). باستخدام ماصة ، قم بإزالة المادة الطافية دون إزعاج الحبيبات.
- تحضير المخزن المؤقت للتهجين (HB) وغسل الديدان الخيطية كما هو موضح في الخطوة 1.5.
- تهجين مسبار FISH إلى التسلسل المستهدف المطلوب كما هو موضح في الخطوة 1.6.
- إزالة مسبار FISH وغسل الديدان الخيطية
- تحضير 1.1 مل من محلول الغسيل المؤقت (WB) (900 مللي متر كلوريد الصوديوم ، 20 مللي متر تريس درجة الحموضة 7.5 ، 5 مللي متر EDTA ، 0.01٪ SDS) لكل عينة.
ملاحظة: يجب تحضير البنك الدولي طازجا قبل كل استخدام لتجنب هطول الأمطار. ومع ذلك ، يمكن عمل مخزن مؤقت عام (900 mM NaCl ، 20 mM Tris pH 7.5) مسبقا وتخزينه في درجة حرارة الغرفة حتى تكون هناك حاجة إلى مخزن مؤقت للغسيل. قبل الاستخدام ، قم بإعداد 1.1 مل لكل عينة من المخزن المؤقت العام وأضف EDTA إلى التركيز النهائي البالغ 5 مللي مول و SDS إلى التركيز النهائي بنسبة 0.01٪. - أجهزة الطرد المركزي للعينات بالسرعة المناسبة (انظر 1.1.4). قم بإزالة HB باستخدام ماصة ، مع الحرص على ترك حبيبات الديدان الخيطية دون إزعاج.
- أضف 100 ميكرولتر من WB المحضر إلى كل عينة.
- أجهزة الطرد المركزي للعينات بالسرعة المناسبة (انظر 1.1.4). قم بإزالة WB باستخدام ماصة ، مع الحرص على ترك الحبيبات دون إزعاج.
- أضف 1 مل من WB المحضر لكل عينة.
- احتضان العينات لمدة 1 ساعة عند 48-56 درجة مئوية في حمام جاف (أو خلاط حراري عند 48-56 درجة مئوية عند 1200 دورة في الدقيقة). في حالة الحضانة في حمام جاف ، اقلب الأنابيب برفق كل 15-20 دقيقة.
ملاحظة: بشكل عام ، يتم استخدام 48 درجة مئوية كدرجة حرارة الغسيل القياسية ؛ ومع ذلك ، قد تحتاج درجة الحرارة هذه إلى التعديل إذا كانت هناك إشارة خلفية عالية. غالبا ما تكون درجة حرارة الغسيل أعلى بمقدار 2 درجة مئوية من درجة حرارة التهجين. - أجهزة الطرد المركزي للعينات بالسرعة المناسبة (انظر الخطوة 1.1.4). باستخدام ماصة ، قم بإزالة المخزن المؤقت للغسيل ، مع الحرص على ترك الحبيبات دون إزعاج.
- أضف 100-500 ميكرولتر من PBS-T إلى كل عينة. في هذه المرحلة ، يمكن تخزين العينات في PBS-T عند 4 درجات مئوية لمدة تصل إلى أسبوع حتى يصبح البروتوكول جاهزا للمتابعة.
- تحضير 1.1 مل من محلول الغسيل المؤقت (WB) (900 مللي متر كلوريد الصوديوم ، 20 مللي متر تريس درجة الحموضة 7.5 ، 5 مللي متر EDTA ، 0.01٪ SDS) لكل عينة.
- قم بتركيب الديدان الخيطية كما هو موضح في الخطوة 1.8.
النتائج
لتحليل بكتيريا الميكروبيوم ، تم استخدام مجسات FISH محددة وعالمية للبكتيريا 16S على الحيوانات المعزولة في البرية. تم أخذ عينات من سلالة Caenorhabditis tropicalis البرية (JU1848) من غابة Nouragues بالقرب من نهر صغير في غيانا الفرنسية من ثمار شجرة النخيل المتعفنة22. تحت مجهر تباين التداخل التفاضلي (DIC) ، تم العثور على سلالة الديدان الخيطية هذه مستعمرة ببكتيريا يبدو أنها تلتصق بشكل اتجاهي بظهارة الأمعاء (الشكل 2 أ). ثم تم تنظيف JU1848 بشكل انتقائي للقضاء على الملوثات الميكروبية الأخرى وإثراء البكتيريا الملتصقة المرغوبة23. باستخدام طريقة تفاعل البوليميراز المتسلسل العالمية ، تم تحديد البكتيريا كنوع جديد في فئة Alphaproteobacteria. ثم تم تصميم مسبار FISH المسمى Cal Fluor Red 610 خصيصا لتسلسل 16S rRNA لهذه البكتيريا للسماح بالتصور الفلوري للاستعمار داخل C. tropicalis (الشكل 2B). تم وضع علامة على مسبار 16S rRNA FISH العالمي القادر على ربط العديد من أنواع البكتيريا (EUB338) ب 6-carboxyfluorescin (FAM) وتمت إضافته أيضا إلى هذه العينة. تتداخل إشارات الفلورسنت الخضراء والحمراء تماما ، مما يشير إلى أن معظم البكتيريا التي تستعمر الأمعاء هي بكتيريا ألفا بروتيوبكتيريا الملتصقة. تم إصلاح هذه الحيوانات في PFA قبل تلطيخها.
لتحليل العدوى التجريبية في المختبر مع مسببات الأمراض داخل الخلايا ذات الهوية المعروفة ، تم استخدام فيروس Orsay ومجسات FISH الخاصة بالميكروسبوريديان على C. elegans ذات الخلفية البرية. فيروس أورساي هو فيروس RNA إيجابي الشريط من عائلة Nodaviridae ، والممرض الفيروسي الطبيعي الوحيد الموجود في C. elegans. يتكون جينوم الحمض النووي الريبي ثنائي الأجزاء لفيروس أورساي من شرائح RNA1 و RNA2 ، وقد تم تطوير مجسات FISH التي تستهدف كلا الجزأين (الشكل 3A ، B) 9،18. في الأمعاء ، يتم استشعار الحمض النووي الريبي الفيروسي بواسطة RIG-I homolog DRH-124 ، وهو مطلوب لتنشيط برنامج الدفاع النسخي المسمى استجابة مسببات الأمراض داخل الخلايا (IPR)25،26،27. يتم التحكم في نسخ جينات IPR المضادة للفيروسات جزئيا على الأقل بواسطة عامل النسخZIP-1 21. هنا ، يظهر تعبير ZIP-1::GFP موضعيا في النوى المعوية للخلايا التي تظهر تلطيخ فيروس أورساي الإيجابي في السيتوبلازم (الشكل 3 أ)21. تظهر العديد من الحيوانات الملطخة ب FISH الخاصة بأورساي للإشارة إلى قوة هذه الإشارة لسهولة القياس الكمي (الشكل 3 ب). تم تثبيت الحيوانات الموضحة في الشكل 3 أ ، ب في PFA.
الطفيلي المجهري المسمى Nematocida parisii ، والذي يعني قاتل الديدان الخيطية من باريس ، هو أحد مسببات الأمراض داخل الخلايا في الأمعاء. تم استخدام العديد من مجسات FISH التي تحمل علامة 18S rRNA من N. parisii ، بما في ذلك مجسات MicroA و MicroB الموسومة بالفلورسنت. تظهر العديد من الحيوانات الملطخة ب MicroB FISH للإشارة إلى قوة هذه الإشارة لسهولة القياس الكمي (الشكل 3C). بالإضافة إلى ذلك ، يصاب C. elegans بواسطة microsporidia أخرى وثيقة الصلة. يمكن تمييز العدوى المشتركة ل N2 ب N. parisii و N. ausubeli ذات الصلة باستخدام بروتوكول FISH هذا من خلال تصميم مجسات FISH الخاصة بالأنواع التي تتنافس ضد بعضها البعض للارتباط بمنطقة متباينة على 18S rRNA (الشكل 3D)28. في هذا المثال ، يحتوي مسبار N. parisii FISH على اقتران مثالي بالقاعدة مع N. parisii 18S rRNA ، ولكن عدم تطابق 7 نقاط أساس مع N. ausubeli 18S rRNA. والعكس صحيح بالنسبة لمسبار N. ausubeli. على هذا النحو ، سوف يتفوق كل مسبار FISH خاص بالأنواع على الارتباط بالأنواع المشابهة 18S على الأنواع غير المتشابهة. بالإضافة إلى ذلك ، فإن استخدام DAPI لتلطيخ النوى يسمح بتوطين أفضل للعدوى في سياق الحيوان بأكمله ، خاصة بالنسبة للأمعاء التي تحتوي على نوى كبيرة يسهل التعرف عليها. يحتوي الشكل 3C ، D على الحيوانات التي تم تثبيتها في PFA. تؤدي العدوى اللاحقة ب N. parisii إلى تطور meronts إلى جراثيم. لتصور جراثيم N. parisii ، يجب تثبيت الحيوانات في الأسيتون لأنها تخترق جدار البوغ بشكل أفضل من PFA (الشكل 3E ، F) 8. يوضح تلطيخ FISH الناتج الهياكل الصغيرة والكبيرة على شكل قضيب ، والتي من المحتمل أن تتوافق مع جراثيم N. parisii ، الملطخة بمجسات خاصة ب N. parisii باللون الأحمر.
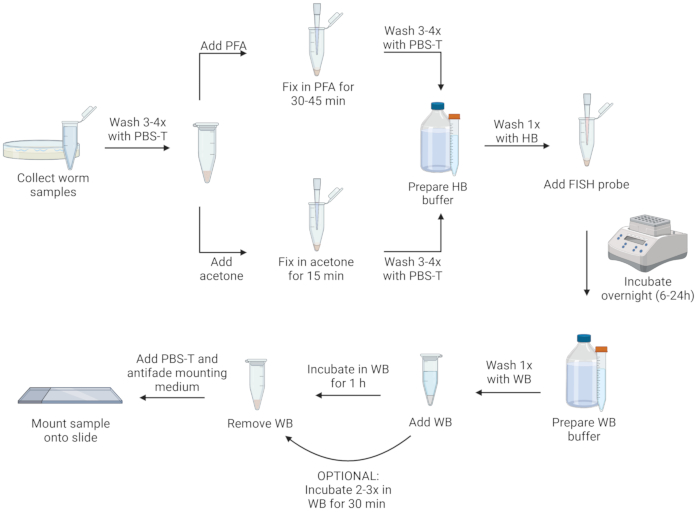
الشكل 1: التمثيل المرئي لبروتوكول FISH. تم إنشاؤها باستخدام Biorender.com. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
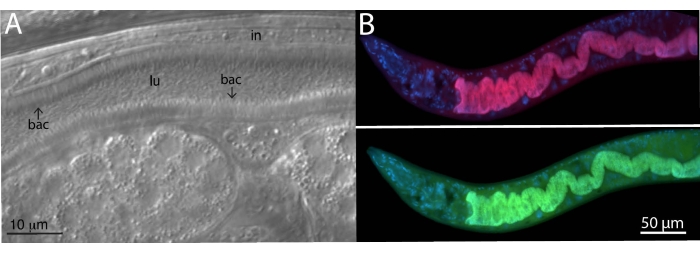
الشكل 2: تلطيخ الأسماك من سلالة C. tropicalis البرية JU1848 المستعمرة مع البكتيريا الملتصقة في الأمعاء. (أ) صورة نومارسكي تصور الآلاف من بكتيريا العصيات الرقيقة (bac) المرتبطة اتجاهيا بالأمعاء (في) JU1848 ، مما يخلق نمطا ظاهريا يشبه الشعر داخل التجويف (lu). لوحة الشكل هذه مقتبسة من Morgan، E. et al. (2021)23. (ب) تلطيخ FISH ل JU1848 ، مثبت في PFA ، باستخدام مسبار أحمر (b002_16S_A-CF610) مصمم لاستهداف تسلسل 16S rRNA للبكتيريا الملتصقة (أعلى) ومسبار FISH عالمي ذو علامة خضراء (EUB338-FAM) مصمم لاستهداف 16S من البكتيريا (أسفل). يظهر تلطيخ DAPI لنوى المضيف باللون الأزرق. انظر الجدول 1 لمعرفة تسلسل المسبار. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
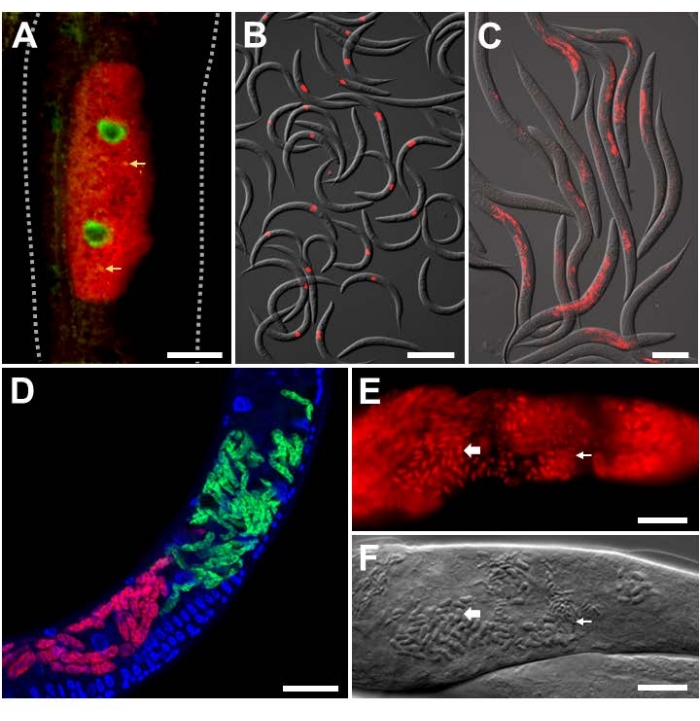
الشكل 3: تلطيخ الأسماك من C. elegans المصابة بمسببات الأمراض داخل الخلايا. (أ ، ب) تلطيخ الأسماك من C. elegans معبرا عن ZIP-1::GFP ومصابا بفيروس Orsay ، والذي تم إصلاحه باستخدام PFA قبل تلطيخه للحفاظ على إشارة GFP. تم استخدام مجسات Orsay 1 Red و Orsay 2 Red لتلطيخ مسببات الأمراض. (أ) تتكون الصورة المركبة من قنوات فلورية مدمجة حمراء وخضراء. يتم تحفيز تعبير ZIP-1 النووي::GFP عند الإصابة بفيروس Orsay ويظهر باللون الأخضر. يظهر التألق الذاتي من حبيبات الأمعاء باللون الأصفر ويشار إليه بأسهم صفراء. الخطوط المنقطة تحدد جسم الديدان الخيطية. شريط المقياس = 25 ميكرومتر. (B) تتكون الصورة المركبة من قنوات الفلورسنت الحمراء المدمجة وقنوات DIC. شريط المقياس = 200 ميكرومتر. (C ، D) تلطيخ الأسماك من النوع البري C. elegans المصابة بالميكروسبوريديا التي تم تثبيتها في PFA. (ج) تلطيخ الأسماك من النوع البري C. elegans المصابة ب N. parisii والثابتة في PFA. تم استخدام مسبار MicroB-CF610 لتلطيخ مسببات الأمراض. تتكون الصورة المركبة من قنوات الفلورسنت الحمراء المدمجة وقنوات DIC. شريط المقياس = 100 ميكرومتر. (د) تلطيخ الأسماك من النوع البري C. elegans المصابة ب N. parisii و N. ausubeli في الأمعاء. تم تلطيخ اثنين من مسببات الأمراض باستخدام زوج من مجسات FISH المحددة التي تتنافس على الارتباط بنفس المنطقة من 18S rRNA. تم تلطيخ N. parisii باستخدام MicroF-CF610 (أحمر) وتم تلوين N. ausubeli باستخدام MicroSp1A-FAM (أخضر). يظهر تلطيخ DAPI لنوى المضيف باللون الأزرق. شريط المقياس = 25 ميكرومتر. (E) تلطيخ الأسماك ببكتيريا C. elegans من النوع البري الثابت بالأسيتون المصابة بجراثيم N. parisii. تم استخدام MicroA-CF610 (أحمر) للتلطيخ (أحمر). شريط المقياس = 15 ميكرومتر. (F) صورة نومارسكي تصور جراثيم N. parisii التي تظهر في (E). شريط المقياس = 15 ميكرومتر. في الخيارين (ه) و(و)، يشار إلى التراكيب الصغيرة والكبيرة على شكل قضيب بأسهم صغيرة وكبيرة، على الترتيب، تقابل جراثيم N. parisii. انظر الجدول 1 لمعرفة تسلسل المسبار. الصورة الموضحة في (A) مقتبسة من Lažetić، V. et al. (2022)21. الصور المعروضة في (B) و (C) مقتبسة من Reddy، K. C. et al. (2019) 26. الصور الموضحة في (E) و (F) مقتبسة من Troemel، E. R. et al. (2008) 8. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| اسم المسبار | خصوصية التحقيق | دقق في الفلوروفور | تسلسل التحقيق |
| EUB338-FAM | البكتيرية 16S (عالمي) | 5' 6-فلوريسئين (FAM) | GCTGCCCCCCGTAGGAGT |
| b002_16S_A-CF610 | ألفا بروتيوباكتيريا 16S | كال فلور ريد 610 (CF610) | TGTACCGACCCTTAACGTTC |
| أورساي1 أحمر | فيروس أورساي RNA1 | كال فلور ريد 610 (CF610) | GACATATGTGATGCCGAGAC |
| أورساي2 أحمر | فيروس أورساي RNA2 | كال فلور ريد 610 (CF610) | GTAGTGTCATTGTAGGCAGC |
| مايكرو أ-CF610 | الديدان الخيطية باريسي 18S | كال فلور ريد 610 (CF610) | CTCTGTCCATCCTCGGCAA |
| ميكروب-CF610 | الديدان الخيطية باريسي 18S | كال فلور ريد 610 (CF610) | CTCTCGGCACTCCTCTCTG |
| ميكروف-سي إف 610 | الديدان الخيطية باريسي 18S | كال فلور ريد 610 (CF610) | AGACAAATCAGTCCACGAATT |
| مايكروس1A-فام | الديدان الخيطية أوسوبيلي 18S | 5' 6-فلوريسئين (FAM) | CAGGTCACCCCACGTGCT |
الجدول 1: قائمة تسلسل مسبار FISH. تم شراء جميع مجسات FISH تجاريا مع الفلوروفور المرفق بنهاية 5 '(عن طريق تخليق قليل النوكليوتيد المخصص ؛ انظر جدول المواد) وتم تنقية oligonucleotides بواسطة HPLC في المرحلة العكسية.
Discussion
ترتبط Wild C. elegans بشكل طبيعي بمجموعة متنوعة من الميكروبات. يمكن للباحثين استخدام RNA FISH للكشف عن هذه الميكروبات وتحديدها بالإضافة إلى اكتساب نظرة ثاقبة حول توطينها في سياق كامل. يمكن تحديد الميكروبات ذات الأنماط الظاهرية المرغوبة أو المثيرة للاهتمام من خلال هذه الطريقة ثم عزلها لمزيد من التوصيف والتسلسل. يمكن أيضا قياس وفرة العديد من العزلات البكتيرية من C. elegans البرية عبر RNA FISH29. باستخدام البروتوكول الموضح هنا ، من الممكن أيضا مراقبة الكائنات الحية الدقيقة المعروفة داخل مضيفيها ومعرفة المزيد عن تفاعلاتها. الأهم من ذلك ، أن فيروس Orsay و microsporidia هما طفيليان ملزمان ولا يمكن استزراعهما بشكل مستقل عن المضيف ، لذا فإن FISH هي أداة التصور القياسية. يمكن أيضا قياس الاستعمار أو العدوى من خلال RNA FISH باستخدام الديدان الخيطية المزروعة على ألواح مزروعة ببكتيريا مرغوبة قابلة للزراعة. بالإضافة إلى تلطيخ الكائنات الحية الدقيقة في أمعاء C. elegans ، يمكن استخدام هذا البروتوكول لسلالات الديدان الخيطية الأخرى مثل C. tropicalis أو Oscheius tipulae19,23.
الميزة الرئيسية لبروتوكول FISH هي أنه يوفر طريقة بسيطة وسريعة وقوية لتلطيخ الميكروبات المرتبطة ب C. elegans. تحتوي الصور الناتجة عن تلطيخ FISH على نسبة إشارة إلى ضوضاء عالية ، والتي يتم تحقيقها من خلال استخدام مجسات FISH التي تستهدف الحمض النووي الريبي الوفير ل SSU داخل العينة. نظرا لوجود مستويات 30x أو أعلى من rRNA من rDNA ، فإن معظم الإشارات من تلطيخ FISH مع مجسات أن rRNA المستهدف يرجع إلى rRNA بدلا من rDNA30. علاوة على ذلك ، فإن RNA FISH يجعل من الممكن رؤية العدوى أو الاستعمار في سياق الحيوان بأكمله. يتم تسهيل هذا التصور من خلال التلوين المشترك لنوى المضيف مع DAPI و / أو استخدام سلالات تحمل علامة الفلورسنت من C. elegans لتسليط الضوء بشكل أفضل على توطين العدوى أو الاستعمار داخل العينة. على سبيل المثال ، تم استخدام FISH الخاص بالميكروسبوريد لتحديد انتحاء الأنسجة للديدان الخيطية displodere باستخدام لوحة من سلالات C. elegans مع تعبير GFP في أنسجة مختلفة20. بالإضافة إلى ذلك ، فإن هذا البروتوكول قابل للتغييرات التي تسمح للباحثين بتحديد الظروف المثالية المناسبة لاحتياجاتهم الخاصة (على سبيل المثال ، ضبط فترة التثبيت ، وزيادة درجة حرارة التهجين).
إحدى الخطوات الحاسمة في بروتوكول FISH هي إصلاح العينات. فترة الحضانة بعد إضافة المثبت ضرورية لإتاحة الوقت للعامل لاختراق العينة. أوقات الحضانة الأطول ليست مثالية للعينات التي تحتوي على بروتينات الفلورسنت المعدلة وراثيا بسبب تدهور البروتين بواسطة PFA بمرور الوقت. بالنسبة للعينات التي تحتوي على GFP ، من الضروري تحديد وقت التثبيت الأمثل للسماح بالنفاذية ، مع الحفاظ على إشارة GFP.
يمكن استخدام FISH لتلطيخ البكتيريا أو الفيروسات أو microsporidia في C. elegans. ومع ذلك ، فإن أفضل نوع من العوامل المثبتة المستخدمة في FISH يعتمد على متطلبات العينة والمصب. يقدم هذا البروتوكول حل PFA كعامل مثبت أساسي لتلطيخ البكتيريا والفيروسات. ومع ذلك ، فإن PFA ليست كافية لتصور جراثيم microsporidian لأنها لا تستطيع اختراق جدار البوغ. لتصور الجراثيم ، يجب استخدام الأسيتون بدلا من ذلك. على الرغم من أن تثبيت PFA فعال لوضع العلامات على FISH لمراحل الحياة الأخرى من microsporidia ، بما في ذلك sporoplasms ، meronts ، و sporonts. ويلاحظ وجود اختلافات رئيسية أخرى بين تثبيت الأسيتون وتثبيت PFA. الأسيتون أكثر ملاءمة لأنه يمكن تخزين العينات بسرعة في الثلاجة بعد إضافتها ، دون الحاجة إلى الغسيل. ومع ذلك ، فإن الأسيتون يقتل بسرعة أي GFP موجود في مضيف معدل وراثيا. PFA هو المثبت المفضل إذا كان من المهم الحفاظ على بعض الهياكل الفسيولوجية في المضيف ، حيث يبدو أن الحيوانات الثابتة بالأسيتون أكثر تدهورا ، مما يجعل تحديد بعض الأنسجة أكثر صعوبة. نظرا لأن العينات ثابتة ، لا يسمح بروتوكول FISH هذا بالتصوير المباشر لتفاعلات المضيف والميكروب في الجسم الحي. ومع ذلك ، فإن الدورة الزمنية لعدوى مطاردة النبض متبوعة بتلطيخ FISH للعينات في نقاط زمنية مختلفة يمكن أن تسمح للمرء برؤية بعض ديناميكيات العدوى الميكروبية19،20،31.
خطوة أخرى حاسمة في جميع أنحاء البروتوكول هي الغسيل الشامل للعينات قبل وبعد التهجين. قبل التهجين ، عند جمع الديدان في أنابيب microfuge ، يمكن حمل البكتيريا الزائدة أو الميكروبات الأخرى من ألواح NGM مع عينة الدودة. ثلاث غسلات مع PBS-T قياسية ؛ ومع ذلك ، قد يكون من الضروري إجراء المزيد من عمليات الغسيل للتخلص بشكل كاف من الكائنات الحية الدقيقة الخارجية ، خاصة عند استخدام C. elegans الملوثة بشدة والمعزولة في البرية. عند عرض العينات المركبة بعد FISH ، قد يكون هناك بعض مسبار FISH المتبقي الذي ينتج كميات كبيرة من الإشارة في خلفية العينة. تعتبر درجة حرارة الغسيل وعدد مرات الغسيل مهمة لإزالة المسبار الزائد وغير المرتبط على وجه التحديد. لتقليل مضان الخلفية ، من الممكن إجراء غسلتين أو ثلاث غسلات مع 1 مل من WB كل 30 دقيقة ، بدلا من غسل واحد مع 1 مل من WB لمدة ساعة. قد تتطلب مجسات FISH المختلفة درجات حرارة غسيل مختلفة. عادة ما تكون درجة حرارة الغسيل 2 درجة مئوية فوق درجة حرارة التهجين ، ولكن يمكن زيادة ذلك إذا كان هناك الكثير من مضان الخلفية (ضوضاء عالية).
يستخدم بروتوكول FISH مجسات فلورية مصممة لاستهداف الحمض النووي الريبي الميكروبي الخاص بالأنواع ، ولكن يمكن تصميم مجسات FISH لنسخ أخرى عالية النسخ. قد يكون لمجسات FISH الأخرى درجات حرارة انصهار مختلفة ، لذلك قد يلزم تنفيذ خطوات الحضانة عند درجة حرارة أعلى أو أقل مما هو موصوف. يمكن أن يحدد تلطيخ FISH التوزيع المكاني للاستعمار الميكروبي أو العدوى داخل المضيف ، مما يسمح بتوصيف تفاعلات الميكروب المضيف والميكروب والميكروب. أحد القيود هو أنه لا يمكن استخدام سوى عدد قليل من الفلوروفورات التقليدية في وقت واحد ، مما يقلل من عدد الكائنات الحية الدقيقة المختلفة التي يمكن اكتشافها عبر FISH في نفس الوقت. هذا يحد من استخدامه لدراسات الميكروبيوم المعقدة في C. elegans. ومع ذلك ، فإن FISH متعدد الألوان الذي يستهدف rRNA يستخدم مجسات موسومة بفلوروفورات غير قانونية يمكن أن تزيد من عدد ملصقات المجموعة الميكروبية المميزة15. هناك قيد آخر وهو أنه من الصعب التمييز بين الأنواع ذات الصلة الوثيقة ، وخاصة البكتيريا ، التي لها تسلسلات SSU متشابهة للغاية. ومع ذلك ، فإن الاختلاف الشديد في التسلسل بين أنواع microsporidia يساعد على تسهيل تمايزها مع هذا البروتوكول (الشكل 3) 32،33.
بشكل عام ، يصف بروتوكول FISH هذا تقنية للكشف عن الكائنات الحية الدقيقة داخل C. elegans. يسمح للباحثين باستخدام نظام نموذجي شفاف وقابل للتتبع وراثيا للكشف عن الاستعمار والعدوى وقياسهما في سياق سليم ، بالإضافة إلى تحديد السلوك الميكروبي الفريد أو التشكل داخل المضيف. تم نشر نسخة ما قبل الطباعة من هذه المخطوطة أثناء المراجعة34.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
شكرا للدكتورة ماري آن فيليكس لتزويدنا بسلالات الديدان الخيطية البرية. تم دعم هذا العمل من قبل NSF في إطار CAREER Grant 2143718 وجامعة ولاية كاليفورنيا بموجب جائزة CSUPERB New Investigator Award إلى RJL ، والمعاهد الوطنية للصحة تحت R01 AG052622 و R01 GM114139 إلى ERT ، وزمالة جمعية القلب الأمريكية إلى VL.
Materials
| Name | Company | Catalog Number | Comments |
| 10% SDS | Invitrogen | AM9822 | |
| Acetone | Fisher Scientific | A-11-1 | |
| Antifade mounting serum with DAPI (Vectashield) | Vectalab | NC9524612 | |
| EDTA | Fisher Scientific | S311-500 | |
| FISH probes (see Table 1) | LGC Biosearch Technologies | FISH probes were commercially purchased via custom oligonucleotide synthesis | |
| KCl | Fisher Scientific | P217 | |
| KH2PO4 | Fisher Scientific | P-286 | |
| Na2HPO4 | Fisher Scientific | S375-500 | |
| NaCl | Fisher Scientific | S-671 | |
| NH4Cl | Fisher Scientific | A-661 | |
| Paraformaldehyde | Electron Microscopy Science | 50-980-487 | CAUTION: PFA is a carcinogen. Handle appropriately |
| Thermal mixer | Eppendorf | 5384000020 | |
| Tris base | Fisher Scientific | BP152 | |
| Triton X-100 | Fisher Scientific | BP-151 | |
| Tween-20 | Fisher Scientific | BP337-500 |
References
- Pukkila-Worley, R., Ausubel, F. M. Immune defense mechanisms in the Caenorhabditis elegans intestinal epithelium. Current Opinion in Immunology. 24 (1), 3-9 (2012).
- Balla, K. M., Troemel, E. R. Caenorhabditis elegans as a model for intracellular pathogen infection. Cellular Microbiology. 15 (8), 1313-1322 (2013).
- Dimov, I., Maduro, M. F. The C. elegans intestine: organogenesis, digestion, and physiology. Cell and Tissue Research. 377 (3), 383-396 (2019).
- Bossinger, O., Fukushige, T., Claeys, M., Borgonie, G., McGhee, J. D. The apical disposition of the Caenorhabditis elegans intestinal terminal web is maintained by LET-413. Developmental Biology. 268 (2), 448-456 (2004).
- Szumowski, S. C., Botts, M. R., Popovich, J. J., Smelkinson, M. G., Troemel, E. R. The small GTPase RAB-11 directs polarized exocytosis of the intracellular pathogen N. parisii for fecal-oral transmission from C. elegans. Proceedings of the National Academy of Sciences. 111 (22), 8215-8220 (2014).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences. 113 (27), 3941-3949 (2016).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485 (2017).
- Troemel, E. R., Félix, M. -. A., Whiteman, N. K., Barrière, A., Ausubel, F. M. Microsporidia are natural intracellular parasites of the nematode Caenorhabditis elegans. PLoS Biology. 6 (12), 2736-2752 (2008).
- Felix, M. A., et al. Natural and experimental infection of Caenorhabditis nematodes by novel viruses related to nodaviruses. PLoS Biology. 9 (1), 1000586 (2011).
- Osman, G. A., et al. Natural infection of C. elegans by an oomycete reveals a new pathogen-specific immune response. Current Biology. 28 (4), 640-648 (2018).
- Zhang, G. A large collection of novel nematode-infecting microsporidia and their diverse interactions with Caenorhabditis elegans and other related nematodes. PLOS Pathogens. 12 (12), 1006093 (2016).
- Clark, L. C., Hodgkin, J. Commensals, probiotics and pathogens in the Caenorhabditis elegans model. Cell Microbiology. 16 (1), 27-38 (2014).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans microbiome resource. G3. Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Michael, L., Markus, S., Petra, P., Holger, D. A multicolor fluorescence in situ hybridization approach using an extended set of fluorophores to visualize microorganisms. Frontiers in Microbiology. 10, 1383 (2019).
- Fuchs, B. M., et al. Flow cytometric analysis of the in situ accessibility of Escherichia coli 16S rRNA for fluorescently labeled oligonucleotide probes. Applied and Environmental Microbiology. 64 (12), 4973-4982 (1998).
- O'Neil, D., Glowatz, H., Schlumpberger, M. Ribosomal RNA depletion for efficient use of RNA-seq capacity. Current Protocols in Molecular Biology. 103 (1), 4-19 (2013).
- Franz, C. J., et al. Santeuil and Le Blanc viruses primarily infect intestinal cells in Caenorhabditis nematodes. Virology. 448, 255-264 (2014).
- Tran, T. D., Ali, M. A., Lee, D., Luallen, R. J. Bacterial filamentation as a mechanism for cell-to-cell spread within an animal host. Nature Communications. 13 (1), 1-11 (2022).
- Luallen, R. J., et al. Discovery of a natural microsporidian pathogen with broad tissue tropism in Caenorhabditis elegans. PLOS Pathogens. 12 (6), 1005724 (2016).
- Lažetić, V., et al. et al The transcription factor ZIP-1 promotes resistance to intracellular infection in Caenorhabditis elegans. Nature Communications. 13 (1), 1-16 (2022).
- Félix, M. -. A., et al. Species richness, distribution and genetic diversity of Caenorhabditis nematodes in a remote tropical rainforest. BMC Evolutionary Biology. 13 (1), 10 (2013).
- Morgan, E., Longares, J. F., Félix, M. A., Luallen, R. J. Selective cleaning of wild Caenorhabditis nematodes to enrich for intestinal microbiome bacteria. Journal of Visualized Experiments. (174), e62937 (2021).
- Sowa, J. N., et al. The Caenorhabditis elegans RIGI homolog DRH-1 mediates the intracellular pathogen response upon viral infection. Journal of Virology. 94 (2), 01173 (2020).
- Bakowski, M. A., et al. Ubiquitin-mediated response to microsporidia and virus infection in C. elegans. PLOS Pathogens. 10 (6), 1004200 (2014).
- Reddy, K. C., et al. Antagonistic paralogs control a switch between growth and pathogen resistance in C. elegans. PLoS Pathogens. 15 (1), 1007528 (2019).
- Reddy, K. C., et al. An intracellular pathogen response pathway promotes proteostasis in C. elegans. Current Biology. 27 (22), 3544-3553 (2017).
- Balla, K. M., Lažetić, V., Troemel, E. R. Natural variation in the roles of C. elegans autophagy components during microsporidia infection. PloS One. 14 (4), 0216011 (2019).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14 (1), 38 (2016).
- Fu, R., Gong, J. Single cell analysis linking ribosomal (r)DNA and rRNA copy numbers to cell size and growth rate provides insights into molecular protistan ecology. The Journal of Eukaryotic Microbiology. 64 (6), 885-896 (2017).
- Willis, A. R., et al. A parental transcriptional response to microsporidia infection induces inherited immunity in offspring. Science Advances. 7 (19), (2021).
- Cuomo, C. A., et al. Microsporidian genome analysis reveals evolutionary strategies for obligate intracellular growth. Genome Research. 22 (12), 2478-2488 (2012).
- Reinke, A. W., Balla, K. M., Bennett, E. J., Troemel, E. R. Identification of microsporidia host-exposed proteins reveals a repertoire of rapidly evolving proteins. Nature Communications. 8 (1), 14023 (2017).
- Rivera, D. E., Lažetić, V., Troemel, E. R., Luallen, R. J. RNA fluorescence in situ hybridization (FISH) to visualize microbial colonization and infection in the Caenorhabditis elegans intestines. bioRxiv. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved