A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصور الديناميكيات التوافقية لمستقبلات الغشاء باستخدام FRET أحادي الجزيء
In This Article
Summary
تقدم هذه الدراسة إجراء مفصلا لإجراء تجارب نقل طاقة الرنين الفلوري أحادي الجزيء (smFRET) على مستقبلات G المقترنة بالبروتين (GPCRs) باستخدام وضع العلامات الخاصة بالموقع عن طريق دمج الأحماض الأمينية غير الطبيعية (UAA). يوفر البروتوكول دليلا خطوة بخطوة لإعداد عينة smFRET والتجارب وتحليل البيانات.
Abstract
تعد قدرة الخلايا على الاستجابة للإشارات الخارجية ضرورية لتطوير الخلايا ونموها وبقائها. للاستجابة لإشارة من البيئة ، يجب أن تكون الخلية قادرة على التعرف عليها ومعالجتها. تعتمد هذه المهمة بشكل أساسي على وظيفة مستقبلات الغشاء ، التي يتمثل دورها في تحويل الإشارات إلى اللغة الكيميائية الحيوية للخلية. تشكل المستقبلات المقترنة بالبروتين G (GPCRs) أكبر عائلة من بروتينات مستقبلات الغشاء في البشر. من بين GPCRs ، مستقبلات الغلوتامات الأيضية (mGluRs) هي فئة فرعية فريدة تعمل كدايمرات ملزمة وتمتلك مجالا كبيرا خارج الخلية يحتوي على موقع ربط الليغاند. أدت التطورات الحديثة في الدراسات الهيكلية ل mGluRs إلى تحسين فهم عملية تنشيطها. ومع ذلك ، فإن انتشار التغيرات التوافقية واسعة النطاق من خلال mGluRs أثناء التنشيط والتشكيل غير مفهوم بشكل جيد. يعد نقل طاقة الرنين الفلوري أحادي الجزيء (smFRET) تقنية قوية لتصور وقياس الديناميكيات الهيكلية للجزيئات الحيوية على مستوى البروتين الواحد. لتصور العملية الديناميكية لتنشيط mGluR2 ، تم تطوير أجهزة استشعار مطابقة فلورية تعتمد على دمج الأحماض الأمينية غير الطبيعية (UAA) التي سمحت بوضع علامات على البروتين الخاص بالموقع دون إزعاج البنية الأصلية للمستقبلات. يشرح البروتوكول الموصوف هنا كيفية إجراء هذه التجارب ، بما في ذلك نهج وضع العلامات UAA الجديد ، وإعداد العينات ، والحصول على بيانات smFRET وتحليلها. هذه الاستراتيجيات قابلة للتعميم ويمكن توسيعها للتحقيق في الديناميكيات التوافقية لمجموعة متنوعة من بروتينات الغشاء.
Introduction
يعتمد نقل المعلومات عبر غشاء البلازما بشكل كبير على وظيفة مستقبلات الغشاء1. يؤدي ارتباط الرباط بالمستقبل إلى تغيير مطابق وتنشيط المستقبلات. غالبا ما تكون هذه العملية ألوستيريك في طبيعتها2. مع أكثر من 800 عضو ، تعد المستقبلات المرتبطة بالبروتين G (GPCRs) أكبر عائلة من مستقبلات الغشاء في البشر3. نظرا لدورها في جميع العمليات الخلوية تقريبا ، أصبحت GPCRs أهدافا مهمة للتطوير العلاجي. في النموذج الأساسي لإشارات GPCR ، يؤدي تنشيط ناهض إلى تغييرات تطابقية للمستقبل الذي ينشط لاحقا مركب بروتين G غير المتجانس عن طريق تبادل الناتج المحلي الإجمالي مقابل GTP في جيب ربط النيوكليوتيدات في Gα. ثم تتحكم الوحدات الفرعية G α-GTP و Gβγ المنشطة في نشاط البروتينات المستجيبة في اتجاه المصب وتنشر سلسلة الإشارات 4,5. تعتمد عملية الإشارة هذه بشكل أساسي على قدرة الأربطة على تغيير الشكل ثلاثي الأبعاد للمستقبل. إن الفهم الميكانيكي لكيفية تحقيق الليغاند لذلك أمر بالغ الأهمية لتطوير علاجات جديدة وتصميم مستقبلات وأجهزة استشعار اصطناعية.
مستقبلات الغلوتامات الأيضية (mGluRs) هي أعضاء في عائلة GPCR من الفئة C وهي مهمة للتأثيرات العصبية البطيئة للغلوتامات وضبط استثارة الخلايا العصبية 6,7. من بين جميع GPCRs ، تعد GPCRs من الفئة C فريدة من نوعها من الناحية الهيكلية من حيث أنها تعمل كدايمرات ملزمة. يحتوي mGluRs على ثلاثة مجالات هيكلية: مجال مصيدة ذبابة الزهرة (VFT) ، والمجال الغني بالسيستين (CRD) ، والمجال عبر الغشاء (TMD)8. التغييرات التوافقية أثناء عملية التنشيط معقدة وتشمل اقتران التشكيل المحلي والعالمي الذي ينتشر على مسافة 12 نانومتر ، فضلا عن التعاون الخافت. التشكيلات الوسيطة ، والترتيب الزمني للدول ، ومعدل الانتقال بين الدول غير معروفة. من خلال اتباع تشكيل المستقبلات الفردية في الوقت الفعلي ، من الممكن تحديد الحالات الوسيطة العابرة وتسلسل التغيرات التوافقية أثناء التنشيط. يمكن تحقيق ذلك من خلال تطبيق نقل طاقة الرنين الفلوري أحادي الجزيء 9,10 (smFRET) ، كما تم تطبيقه مؤخرا لتصور انتشار التغيرات التوافقية أثناء تنشيط mGluR2 11. تتمثل إحدى الخطوات الرئيسية في تجارب FRET في توليد مستشعرات FRET عن طريق الإدخال الخاص بالموقع للفلوروفورات المانحة والمتقبلة في البروتين محل الاهتمام. تم اعتماد استراتيجية دمج الأحماض الأمينية غير الطبيعية (UAA) 12،13،14،15 للتغلب على قيود تقنيات وضع العلامات الفلورية النموذجية الخاصة بالموقع والتي تتطلب إنشاء طفرات أقل من السيستين أو إدخال علامة كبيرة مشفرة وراثيا. وقد سمح ذلك بإعادة الترتيب التوافقي للوصلة الألوستيرية المدمجة الأساسية ، والتي انضمت إلى مجالات ربط الليغاند والإشارات في mGluR2. في هذا البروتوكول ، يتم تقديم دليل خطوة بخطوة لإجراء تجارب smFRET على mGluR2 ، بما في ذلك نهج وضع العلامات الخاصة بالموقع على mGluR2 مع UAA لربط الفلوروفورات باستخدام تفاعل تسيكل الأزيد المحفز بالنحاس. علاوة على ذلك ، يصف هذا البروتوكول منهجية الالتقاط المباشر لبروتينات الغشاء وتحليل البيانات. البروتوكول الموضح هنا ينطبق أيضا على دراسة الديناميكيات التوافقية لبروتينات الغشاء الأخرى.
Protocol
ويرد وصف لسير العمل العام للبروتوكول في الشكل 1.
1. إعداد غرفة العينة
- تنظيف الانزلاق والغطاء
ملاحظة: تهدف هذه الخطوات إلى تنظيف أسطح الشرائح وكذلك الأغطية وإعدادها للأمينوسيلان. أحد المتطلبات الحاسمة لإجراء تجارب التألق أحادية الجزيء على جزيئات مربوطة بالسطح هو السطح المخمل. تتضمن تقنية التخميل الأكثر موثوقية والقابلة للتكرار ربط سلاسل البوليمر الخاملة تساهميا بالسطح الزجاجي كطبقة كثيفة. البولي إيثيلين جلايكول (PEG) هو البوليمر الأكثر كفاءة المستخدم في تخميل السطح16. تفاصيل إجراء التخميل باستخدام PEG (PEGylation) موصوفة أدناه:- ضع علامة على الثقوب المراد حفرها على الشرائح بعلامة (~ 6 مم بعيدا عن الحافة). استخدم Dremel لحفر ثقوب صغيرة (قطرها 1 مم) على الشريحة الزجاجية. اغمر الشرائح في الماء أثناء عملية الحفر.
- اغسل الشرائح بالأسيتون لإزالة الحبر المتبقي من العلامة.
- أخرجيها من الأسيتون واشطفي الشرائح بالماء، ثم ضعيها في الميكروويف لمدة 5 دقائق في الماء بقوة عالية (700 واط).
- نظف الشرائح بالماء قبل وضعها في وعاء تلطيخ زجاجي ليتم صوتيتها. ضع الأغطية في جرة تلطيخ مختلفة.
- قم بإلغاء صوت الشرائح والأغطية في الأسيتون لمدة 30 دقيقة في سونيكتور الحمام عند 23 درجة مئوية.
- في غضون ذلك ، قم بتنظيف قارورة زجاجية لإعداد محلول aminosilanization المستخدم خلال الخطوة التالية. املأ القارورة ب 1 M KOH ، وقم بسونيك القارورة لمدة 30 دقيقة ، واشطف KOH جيدا بالماء ، ثم قم بسونيك لمدة 30 دقيقة إضافية في الميثانول. اترك القارورة في الميثانول حتى وقت خطوة الأمينوسيلان.
- في غضون ذلك ، قم بإزالة aminosilane و mPEG و biotin-PEG من الفريزر (-20 درجة مئوية) واسمح لهم بالوصول إلى درجة حرارة الغرفة (RT) في الظلام.
- تخلص من الأسيتون من الشريحة وأغطية الجرار في حاوية النفايات الكيميائية المناسبة ، وشطفها جيدا بالماء ، ثم قم بصوتنة الشرائح في 5 M KOH لمدة 30 دقيقة.
- شطف الشرائح وأغطية بالماء ، ثم سونيك في الميثانول لمدة 2 دقيقة (كرر مرتين). اترك الجرار مليئة بالميثانول حتى خطوة الأمينوسيلان.
ملاحظة: في هذه الدراسة ، يتم استخدام المياه منزوعة الأيونات ما لم يذكر خلاف ذلك. يتم استخدام سونيكتور حمام يعمل عند 23 درجة مئوية.
- أمينوسيلانية
ملاحظة: تهدف هذه الخطوة إلى ربط الأمينوسيلان تساهميا بسطح الشريحة والغطاء النظيف. سوف يرتبط mPEG والبيوتين-PEG الوظيفيان تساهميا بهذا السطح في الخطوة التالية.- تحضير خليط أمينوسيلانات في قارورة نظيفة (الخطوة 1.6). تحضير الحل عن طريق خلط الميثانول (150 مل) ، وحمض الخليك (7.5 مل ، واستخدام ماصة زجاجية) ، والأمينوسيلان (2.5 مل).
- امزج المحلول بلطف في غطاء الدخان الكيميائي ، ثم صبه في الشريحة والجرار المغطاة . استخدم 50 مل للأغطية و 100 مل للشرائح. تأكد من أن الشرائح وقسائم الغطاء مغمورة بالكامل في المحلول.
- احتضن لمدة 10 دقائق ، ثم سونيك الجرار لمدة 1 دقيقة (الصوتنة تزيل الشوائب من السطح) ، وتحضن لمدة 10 دقائق أخرى.
- تخلص من محلول أمينوسيلان في حاوية جمع النفايات. أضف الميثانول إلى الجرار ، وأغلق الجرار بأغطية ، ورجها بلطف باليد. تخلص من الميثانول ، واملأ الجرار بالماء.
- أعد زجاجة الأمينوسيلان إلى الفريزر (-20 درجة مئوية).
- بيجالاتيون
ملاحظة: تصف هذه الخطوات إجراء PEGylation.- أثناء أمينوسيلان، قم بإعداد المخزن المؤقت pegylation. يزن 84 ملغ من بيكربونات الصوديوم (NaHCO3) وإضافته إلى 10 مل من الماء (10 ملليمتر). بالإضافة إلى ذلك ، قم بوزن mPEG والبيوتين-PEG ووضعها جانبا. بالنسبة لست شرائح وأغطية ، استخدم 96 ملغ من mPEG و 1.2-2.4 ملغ من البيوتين-PEG.
ملاحظة: من المهم عدم إضافة الكثير من البيوتين-PEG لأنه يمكن أن يزيد من عدد بقع الخلفية. لا تذوب خليط PEG حتى قبل التطبيق مباشرة على الشرائح. - شطف الشرائح بالماء ، وجففها بضربة هواء لطيفة ، ثم ضعها في صناديق التجميع المرطبة.
ملاحظة: من الضروري استخدام شركة طيران نظيفة. تجنب استخدام الهواء المعلب المضغوط ، والذي يمكن أن يترك بقايا على الزجاج. - أضف المخزن المؤقت pegylation إلى خليط مسحوق PEG وماصة لأعلى ولأسفل بلطف عدة مرات حتى تذوب. أضف 55 ميكرولتر من المخزن المؤقت pegylation لكل شريحة (بالنسبة لست شرائح ، أضف 330 ميكرولتر من المخزن المؤقت pegylation).
- جهاز طرد مركزي عند 9600 × جم لمدة 1 دقيقة عند 23 درجة مئوية لترسيب الجسيمات غير الذائبة. جمع supernatant لاستخدامها في الخطوة التالية.
ملاحظة: يتحلل البيوتين-PEG بسرعة بسبب وجود مجموعة NHS. من المهم القيام بخطوات الخلط والطرد المركزي بسرعة. - ضع 60 ميكرولتر من محلول PEGylation على كل شريحة ثم ضع الغطاء في الأعلى بحيث يكون محلول PEGylation محصورا بين الشريحة والغطاء الانزلاقي.
ملاحظة: تجنب إدخال فقاعات بين الشريحة والغطاء ، لأن هذا سيقلل من كفاءة التخميل. قم بإزالة أي فقاعات عن طريق ضبط الغطاء والشريحة بطرف ماصة. - ضع الشرائح في درج مسطح ومظلم. يمكن تخزين الشرائح بين عشية وضحاها. ومع ذلك ، فإن الحضانة لمدة 4-6 ساعات تؤدي إلى التخميل الأمثل.
ملاحظة: من الضروري أن نتذكر أي جانب هو pegylated. - ضع علامة على الجانب غير المغطى قبل التخزين. بعد الحضانة ، قم بتفكيك وشطف الشرائح والأغطية بلطف بالماء
- جفف الشرائح والأغطية عن طريق نفخ الهواء. احتفظ بالشرائح والأغطية في أنبوب معقم (50 مل)، بحيث يكون السطح PEGylated مواجها بعيدا عن بعضها البعض. يخزن في درجة حرارة -20 درجة مئوية حتى يوم التجربة.
ملاحظة: من الأفضل استخدام الشرائح وأغطية الغطاء في غضون 4 أسابيع من التحضير. يجب أن تواجه الأسطح PEGylated بعيدا عن بعضها البعض. يمكن أن يؤدي تخزين شرائح وأغطية PEGylated في أكياس محكمة الغلق بالتفريغ إلى زيادة مدة صلاحيتها.
- أثناء أمينوسيلان، قم بإعداد المخزن المؤقت pegylation. يزن 84 ملغ من بيكربونات الصوديوم (NaHCO3) وإضافته إلى 10 مل من الماء (10 ملليمتر). بالإضافة إلى ذلك ، قم بوزن mPEG والبيوتين-PEG ووضعها جانبا. بالنسبة لست شرائح وأغطية ، استخدم 96 ملغ من mPEG و 1.2-2.4 ملغ من البيوتين-PEG.
2. تعبير mGluR2 مع الأحماض الأمينية غير الطبيعية المدمجة ، ووضع العلامات الفلورية ، والاستخراج
ملاحظة: يحدد هذا البروتوكول إعداد الخلايا وكواشفها ومعالجتها للتعبير عن mGluR2 التي تحتوي على UAA 4-azido-L-phenylalanine (AZP). الإجراء هو لخلايا HEK293T المزروعة على أغطية زجاجية 18 مم. يمكن توسيع نطاق الإجراء حسب الضرورة.
- بذر
ملاحظة: حافظ على خلايا HEK293T في DMEM مكملة بمصل بقري جنيني بنسبة 10٪ (v / v) ، و 100 وحدة · mL−1 البنسلين الستربتومايسين ، و 15 mM HEPES المخزن المؤقت (الملف التكميلي 1) (الرقم الهيدروجيني 7.4) عند 37 درجة مئوية تحت 5٪ CO2.- تمرير الخلايا مع 0.05 ٪ التربسين-EDTA. خلايا HEK293T البذرية على أغطية زجاجية بولي لتر / دي ليسين (PLL / PDL) بحيث تصل إلى ≥80٪ من الالتقاء خلال وقت النقل.
- النقل
- قم بإعداد محلول مخزون 40 mM من AZP في 0.1 M NaOH.
- قم بإعداد وسائط مكملة ب AZP لنمو الخلايا وتعبير mGluR2. تكملة الوسائط القياسية (+ FBS، القلم/البكتيريا العقدية، 15 mM HEPES) باستخدام حل مخزون AZP سعة 40 ملليمتر. اجعل تركيز AZP النهائي إلى 0.6 ملليمتر. أضف حل 1 M HEPES (تمت إضافة نصف حجم حل مخزون AZP البالغ 40 mM). على سبيل المثال ، لإعداد 10 مل من الوسائط التكميلية AZP ، اجمع بين 9.775 مل من الوسائط القياسية ، و 150 ميكرولتر من محلول مخزون AZP 40 mM ، و 75 ميكرولتر من محلول 1 M HEPES.
- تصفية (تعقيم) الوسائط باستخدام مرشح حقنة (0.2 ميكرومتر ، PES).
- استبدل الوسائط القياسية بوسائط تحتوي على وسائط مكملة ب AZP قبل النقل.
ملاحظة: احرص على عدم تجفيف الخلايا أثناء استبدال الوسائط. - قم بنقل الخلايا باستخدام كاشف النقل (جدول المواد) باتباع دليل الشركة المصنعة. نقل خلايا HEK293T على غطاء 18 مم باستخدام ما مجموعه 2 ميكروغرام من الحمض النووي (1000 نانوغرام من tRNA / synthetase + 1000 نانوغرام من بلازميد البروتين المحتوي على الكودون الكهرماني). ارجع إلى الجدول 1 لمعرفة تركيز وحجم المكونات المستخدمة.
- قم بتغيير الوسائط لمدة 24 ساعة بعد النقل إلى وسائط جديدة مكملة ب AZP واسمح للخلايا بالنمو لمدة 24 ساعة إضافية.
- وضع العلامات مع أصباغ السيانين الألكين
- قبل 20 دقيقة من وضع العلامات، اغسل أغطية الأغطية بمخزن تسجيل مؤقت دافئ (37 درجة مئوية) (RB) (ملف تكميلي 1) مرتين، وانقلها إلى وسائط قياسية دافئة (37 درجة مئوية) بدون AZP (+ FBS، Pen/Strep، 15 mM HEPES).
- قم بإعداد محلول وضع العلامات الذي يحتوي على Cy3-alkyne و Cy5-alkyne و BTTES وكبريتات النحاس (II) (CuSO4) و (+) الصوديوم L-ascorbate و aminoguanidine.
- اتبع ترتيب صنع الحلول وإضافتها (الجدول 2):
- إعداد 50 mM BTTES.
- تحضير 100 مللي متر أمينوجوانيدين.
- تحضير 100 mM Na-ascorbate.
- تحضير 655.5 ميكرولتر من RB.
- أضف صبغة الألكين Cy3 / Cy5 (10 mM في مخزون DMSO) إلى RB.
ملاحظة: إضافة أمينوجوانيدين إلى RB. - تحضير 20 mM CuSO4.
- امزج CuSO4 و BTTES في أنبوب جديد (سيتحول المحلول إلى اللون الأزرق).
- أضف خليط CuSO4 و BTTES إلى RB (2.3.3.6.)
- أضف Na-Ascorbate.
- اتبع الحجم الوارد في الجدول 2 أدناه للحصول على غطاء مقاس 18 مم.
- اخلطي المحلول جيدا واحتضنيه على الثلج وفي الظلام لمدة 10 دقائق قبل وضع العلامات على الخلايا.
- قبل إضافة حل وضع العلامات إلى الأغطية ، قم بإزالة الوسائط واغسلها باستخدام RB. أضف محلول وضع العلامات واحتضنه لمدة 15 دقيقة عند 37 درجة مئوية في الظروف المظلمة.
- ملاحظة: لتحسين وضع العلامات، أضف الغلوتامات (التركيز النهائي ~ 0.5 ملليمتر) بعد 10 دقائق واحتضنها لمدة 5 دقائق إضافية. النحاس سام جدا للخلايا ، ويجب ألا يستمر تفاعل وضع العلامات لأكثر من 15 دقيقة في الجسم الحي. تحضير جميع المكونات الطازجة. أضف Na-Ascorbate أخيرا. حافظ على التفاعل عند 4 درجات مئوية أثناء التحضير. ومع ذلك ، عند إضافة محلول وضع العلامات ، يجب تخزين الخلايا عند 37 درجة مئوية داخل الحاضنة.
- حصاد الخلايا واستخراج البروتينات (تحلل الخلايا)
- قم بإزالة محلول وضع العلامات واغسل الغطاء (18 مم) الذي يحتوي على الخلايا المنقولة mGluR2 مرتين باستخدام RB.
- باستخدام ماصة ، اغسل الخلايا من الغطاء وأعد تعليقها في RB (1 مل).
ملاحظة: قلل من تعرض العينة للضوء قدر الإمكان بعد هذه النقطة. - قم بتكوير الخلايا عن طريق الدوران عند 1000 × جم عند 4 درجات مئوية لمدة 5 دقائق وإزالة السوبرناتانت. أعد تعليق بيليه الخلية في 80-130 ميكرولتر من محلول التحلل.
ملاحظة: يجب أن تكون حبيبة الخلية مرئية بالعين. يعتمد حجم التحلل على كمية العينة المفقودة أثناء عملية وضع العلامات والغسيل. - تخلط بلطف عن طريق السحب لتفتيت الكريات. التفاف في احباط ووضعها على الروك في 4 درجة مئوية لمدة 0.5-1 ساعة لتحليل الخلايا.
- حبيبات الكسر غير القابل للذوبان عن طريق الطرد المركزي عند 20000 × جم و 4 درجات مئوية لمدة 20 دقيقة. انقل المادة الفائقة إلى أنبوب بارد طازج (البروتين المحلل الذي يحتوي على البروتين الموسوم بالفلورسنت محل الاهتمام) وقم بتخزينه على الجليد لإجراء التجارب.
3. تجميع غرفة تدفق جزيء واحد ووظائفها
- قم بإزالة الشريحة والغطاء من الفريزر واتركيهما يسخنان في RT في الظلام (~ 30 دقيقة).
- قم بتجميع الغرفة باستخدام شريط على الوجهين عن طريق وضع شرائح من الشريط على الوجهين بين الشريحة والغطاء . تأكد من أن الأسطح PEGylated تشكل الجزء الداخلي من غرفة التدفق.
- باستخدام طرف ماصة ، اضغط على الغطاء للتأكد من أن الشريط يتلامس تماما مع كل من الغطاء والشريحة ؛ احرص على عدم كسر الغطاء. تطبيق الايبوكسي على حواف الشرائح.
ملاحظة: لا تضيف الكثير بحيث يملأ الإيبوكسي الثقوب المحفورة. - ضع غرفة التدفق مع توجيه جانب الغطاء لأسفل في صندوق مظلم رطب للسماح للإيبوكسي بالجفاف (~ 30 دقيقة).
ملاحظة: أضف المخزن المؤقت T50 (الملف التكميلي 1) من خلال الثقوب المحفورة لمنع الايبوكسي من تغطية الثقوب (10-15 ميكرولتر) خلال فترة التجفيف. - احتضان كل حارة غرفة مع 500 نانومتر نيوترافيدين (مخفف في T50) عن طريق تطبيق ببطء ~ 40 ميكرولتر على كل حارة.
- احتضان في RT لمدة 2 دقيقة داخل صندوق مظلم رطب. يغسل مع ~ 100 ميكرولتر من T50 المخزن المؤقت لكل حارة.
- احتضان كل ممر غرفة مع 20 نانومتر من الأجسام المضادة البيوتينيل11. يعتمد اختيار الأجسام المضادة على العلامة الموجودة على البروتين.
ملاحظة: إذا لم يكن الجسم المضاد الأساسي حيويا ، فقم أولا باحتضان الجسم المضاد الثانوي البيوتينيل لمدة 30 دقيقة ثم احتضنه بالجسم المضاد الأساسي. - احتضن في RT لمدة 30 دقيقة داخل صندوق مظلم رطب. يغسل مع ~ 200 ميكرولتر من T50 لكل حارة.
ملاحظة: تأكد من أن الممرات لن تجف أبدا أثناء عملية التحضير.
4. المخازن المؤقتة أحادية الجزيء
- المخزن المؤقت Trolox
ملاحظة: المخزن المؤقت Trolox هو المخزن المؤقت لبدء عمل المخزن المؤقت للتصوير. تعتمد مكونات المخزن المؤقت على التجربة وقد تختلف اعتمادا على البروتين محل الاهتمام. يتضمن المخزن المؤقت المستخدم في البروتوكول الموصوف هنا الأملاح (كلوريد الصوديوم ، KCl ، CaCl 2 ، MgCl2) ، عامل التخزين المؤقت (HEPES) ، و Trolox (الرقم الهيدروجيني ~ 7.35).- قم بإذابة 9-10 ملغ من Trolox في 10 مل من المخزن المؤقت لتسجيل جزيء واحد (SRB ، الملف التكميلي 1)
ملاحظة: Trolox يجعل المخزن المؤقت حمضيا قليلا. اضبط الرقم الهيدروجيني في هذه المرحلة باستخدام محلول هيدروكسيد الصوديوم (NaOH) ، 10 M (الرقم الهيدروجيني 7.35). سيتم إجراء تعديل درجة الحموضة الدقيقة بعد حل Trolox بالكامل ؛ ومع ذلك ، فإن زيادة الرقم الهيدروجيني في هذه المرحلة يزيد من قابلية ذوبان Trolox. - امزج المحلول في RT باستخدام آلة الروك على الطاولة لمدة 4-8 ساعات (ملفوفة بورق الألومنيوم) لإذابة Trolox بالكامل.
- تحقق من الرقم الهيدروجيني واضبطه إذا لزم الأمر.
- تأكد من حل Trolox بالكامل. تعقيم الحل مع مرشح حقنة وتخزينها في 4 درجة مئوية.
ملاحظة: يجب استخدام المخزن المؤقت بعد 2-10 أيام من الشيخوخة. يساعد Trolox على قمع الوميض ويستخدم عادة في دراسات الجزيء الواحد17. تأتي الخصائص المضادة للوميض من مشتق مؤكسد من Trolox18. وبالتالي ، يوصى بالاحتفاظ بها في RT لبضع ساعات على الأقل حتى تنضج. بالإضافة إلى ذلك ، تعمل الأشعة فوق البنفسجية لمحلول Trolox الطازج على تسريع عملية الأكسدة ويمكن استخدامها لتسريع "شيخوخة" Trolox buffer18.
- قم بإذابة 9-10 ملغ من Trolox في 10 مل من المخزن المؤقت لتسجيل جزيء واحد (SRB ، الملف التكميلي 1)
- وصفة المخزن المؤقت للتصوير: مزيج Trolox المخزن المؤقت + المنظفات (~ 2 أضعاف قيمة CMC للمنظف) + 4 mM protocatechuic acid (PCA).
ملاحظة: يتم الاحتفاظ بتركيز المنظفات بالقرب من CMC لأن تركيزات المنظفات العالية قد تؤدي إلى زيادة تمسخ البروتين. على سبيل المثال ، يمكن استخدام الخليط التالي 955 ميكرولتر ترولوكس + 5 ميكرولتر 10٪ DDM + الكوليسترول (W٪ ، 10: 1) + 40 ميكرولتر من محلول مخزون PCA 100 mM. هنا ، يعمل PCA كعامل مضاد للأكسدة وكان يستخدم سابقا في دراسات smFRET19. DDM غير أيوني ، ويستخدم عادة لإذابة بروتينات الغشاء20,21 ، وقد استخدم في دراسات جزيء واحد. DDM هو منظف جيد الخيار الأول. ومع ذلك ، نوصي باختبار منظفات متعددة وضمان اتساق النتائج.
5. إعداد المجهر والحصول على بيانات smFRET
- قم بتشغيل الكمبيوتر والمجهر. قم بتشغيل الليزر للإحماء (532 نانومتر لإثارة Cy3 و 640 نانومتر لإثارة Cy5).
ملاحظة: هنا ، تم استخدام مجهر مقلوب مجهز بهدف TIRF 100x (N.A. 1.49) ، ومقسم الصور ، وكاميرا EMCCD. تم تجهيز الإعداد بجهاز دمج ليزر من أربعة أسطر ، ومرآة ثنائية اللون ، ومرشح انبعاث طويل المرور ، ومرشح ثنائي اللون للانبعاثات ، ومرشح من الشق. - قم بتشغيل كاميرا EMCCD وافتح برنامج الكاميرا. انتظر 20 دقيقة حتى تصل الكاميرا إلى -69 درجة مئوية وتستقر فيها.
- قم بتركيب غرفة العينة على مرحلة المجهر. أضف عينة البروتين تدريجيا لتحقيق ~ 400 جزيء لكل مجال رؤية (الخطوة 2.4.5). اغسل الغرفة ب 100 ميكرولتر من مخزن التصوير المؤقت.
- اضبط الكسب ومعدل الاكتساب وقوى الليزر بحيث يتم اكتشاف إشارات التألق أحادية الجزيء في كل من القنوات المانحة والمتقبلة. اضبط تركيز البروتينات داخل غرفة العينة إذا لزم الأمر.
ملاحظة: مع وجود أكثر من 400 جزيء في مجال الرؤية ، يصبح التمييز بين الجزيئات الفردية أكثر صعوبة ، وستكون ضوضاء الخلفية أعلى. - إثارة المتبرع والحصول على آثار زمنية حتى يتم تبييض ما لا يقل عن 80٪ من جزيئات المتبرع في مجال الرؤية ضوئيا.
- في نهاية الفيلم ، قم بتشغيل ليزر 640 نانومتر لإثارة المتقبل مباشرة حتى تقوم بعض جزيئات المستقبل بالتبييض الضوئي ، مما يسهل جزيء واحد من التمييز متعدد المراحيض.
- انتقل إلى مجال رؤية مختلف وكرر الخطوات المذكورة أعلاه لجمع ثلاثة أفلام على الأقل (نسخ طبق الأصل تقني) لكل شرط.
ملاحظة: استخدم أقل طاقة ليزر ممكنة أثناء تحديد منطقة اهتمام جديدة (ROI) والتركيز لتقليل التبييض الضوئي. انتبه إلى انحراف المرحلة أثناء الاستحواذ. إذا لوحظ انحراف ملحوظ بعد الانتقال إلى عائد استثمار جديد ، فانتظر لمدة 3 دقائق قبل البدء في الاستحواذ.
6. تحليل البيانات
- محاذاة قناة المتبرع والمتلقي (رسم خرائط الأفلام)
- تسجيل صور حبة الفلورسنت في قنوات المتبرع والمتقبل.
- قم بإنشاء ملف رسم الخرائط باستخدام بيانات الخرزة لربط التألق المانح والمتلقي من كل جزيء22,23.
ملاحظة: تنقسم إشارة الانبعاث من جزيء واحد إلى إشارات مانحة وإشارات متقبلة بواسطة مرشح ثنائي اللون للانبعاثات داخل مقسم الصورة. يتم عرض صور المتبرع والمتقبل على الكاميرا جنبا إلى جنب. لربط كثافة المتبرع والمتلقي بدقة لجزيء واحد بين المنطقتين ، غالبا ما يتم إنشاء ملف رسم خرائط باستخدام عينات من حبة الفلورسنت. باستخدام ملف رسم الخرائط هذا ، يتم تعيين جميع الجزيئات التي يتم اكتشافها في قنوات المتبرع والمتقبل على بعضها البعض. ثم يولد التحليل آثار الوقت ، والتي هي كثافة المتبرع والمتلقي بمرور الوقت ، لكل جزيء.
- اختيار آثار FRET أحادية الجزيء (انتقاء الجسيمات)
ملاحظة: يتم فحص آثار الجسيمات الفردية واختيارها للتحليل النهائي باستخدام MATLAB. تعتمد معايير الاختيار الدقيقة على النظام. يتم توضيح المبادئ التوجيهية العامة حول ما يشكل جسيما عالي الجودة هنا. تتوفر جميع الرموز المعدلة حسب الطلب على GitHub (https://github.com/vafabakhsh-lab).- حدد الآثار التي تكون فيها الكثافة الكلية للآثار (المتبرع + المتقبل) مستقرة بمرور الوقت. حدد الآثار ذات التغيرات المضادة للارتباط في كثافة المتبرع والمتقبل.
- حدد الجزيئات المانحة والمتقبلة التي تظهر التبييض الضوئي بخطوة واحدة. حدد الآثار التي يبلغ طولها >5 ثانية.
ملاحظة: يجب أن تنتقل الخلفية في كل قناة بعد التبييض إلى الصفر. لا ينبغي أن يكون للآثار العديد من الأحداث الوامضة. هذا سيزيد من صعوبة التحليل. - احسب كفاءة FRET باستخدام المعادلة E = (I A− 0.088 × I D)/(I D + [I A− 0.088 × I D])24,25,26، حيث I D وI A هما كثافة المتبرع الخام والمتقبل، على التوالي.
ملاحظة: يتم تحديد تسرب انبعاث المتبرع إلى قناة المتقبل باستخدام عينة تحمل علامة المتبرع فقط متحمسة باستخدام ليزر 532 نانومتر26. قد يختلف عامل تصحيح التسرب، 0.088، باختلاف الإعدادات وفقا لمجموعات الفلتر المستخدمة. ومن المهم ملاحظة أن التحويل الكمي والقوي لكفاءات FRET إلى مسافات مطلقة يتطلب تصحيح كثافة المانحين والمتقبلين لعوامل متعددة وقد نوقش على نطاق واسع قبل27.
- تحديد الحالة التوافقية بواسطة نمذجة ماركوف المخفية (HMM)
- قم بتنفيذ برنامج vbFRET28 في MATLAB واستورد الآثار المحددة لحالة معينة. تعيين القيود المفروضة على عدد الحالات والتكرارات المحتملة التي سيتم تنفيذها.
ملاحظة: استنادا إلى البيانات الأولية المستمدة من النتائج التمثيلية، افترض أن هناك ما يصل إلى أربع حالات منفصلة من حالات FRET يشغلها المستشعر المطابق؛ وهكذا ، تم تعيين مجموعة من دولة واحدة إلى أربع دول. تم تحديد التحسينات في التركيب سابقا على أنها زيادة طفيفة مع تكرار >25 ؛ وهكذا ، تم استخدام 25 تكرارا لملاءمة البيانات التمثيلية. - تحليل آثار smFRET وتصدير الآثار المثالية وجلسة التحليل. احفظ الآثار المثالية في مجلد منفصل للتحليل النهائي.
ملاحظة: تم توفير البرامج المستخدمة لاستخراج بيانات انتقال الحالة ووقت الإقامة من الآثار المثالية في العملالمنشور سابقا 29. - باستخدام برامج MATLAB ، قم باستخراج انتقالات الحالة ورسمها كخريطة حرارية مع إحداثيات X التي تشير إلى تشكيل البداية وإحداثيات Y التي تشير إلى التوافق النهائي.
ملاحظة: يتم تعريف الانتقالات على أنها تغييرات في قيمة FRET >0.1 في النتائج التمثيلية التي تمت مناقشتها هنا. تعتمد عتبة الانتقالات على الحالات التوافقية المفترضة التي يشغلها بروتين الاهتمام (تعيين عتبة الانتقال لتكون أقل من الفرق بين أقرب حالات FRET) ، بالإضافة إلى الدقة التي يسمح بها الإعداد التجريبي. يتيح فحص الخرائط الحرارية لظروف متعددة تحديد الحالات التوافقية الأكثر شيوعا التي ينتقل منها المستشعر ، وبالتالي يشغلها. تم تحديد أربع حالات FRET للنتائج التمثيلية (FRET = 0.31 و 0.51 و 0.71 و 0.89). - باستخدام برامج MATLAB ، قم باستخراج أوقات الإقامة لكل حالة توافقية محددة. قم بتعيين مجموعة من قيم FRET التي تحدد كل حالة ودقة زمنية أثناء الحصول على البيانات. يتم تقسيم نطاقات FRET بالتساوي على حالات FRET المجاورة. تصدير أوقات الإقامة لظروف العلاج المحددة.
ملاحظة: في معظم الحالات، يمكن تقدير بيانات وقت الإقامة بشكل جيد بواسطة دالة اضمحلال أسي واحدة. يمكن إجراء هذا التحليل في برنامج تحليل البيانات والرسوم البيانية.
- قم بتنفيذ برنامج vbFRET28 في MATLAB واستورد الآثار المحددة لحالة معينة. تعيين القيود المفروضة على عدد الحالات والتكرارات المحتملة التي سيتم تنفيذها.
- تركيب غاوسي للرسوم البيانية للسكان smFRET لتحديد حجم إشغال الدولة
- استيراد المدرج التكراري ل FRET للسكان للظروف ذات الأهمية في تحليل البيانات وبرامج الرسوم البيانية لتحليل الذروة المتعددة.
- حدد عدد القمم الموجودة (أربع قمم أو حالات استنادا إلى تحليل HMM). تم إجراء التركيب باستخدام توزيعات غاوسية متعددة30 تم تعريفها على أنها
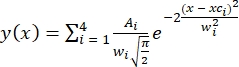 ، حيث A هي منطقة الذروة ، xc هي مركز الذروة ، و w هي عرض الذروة لكل ذروة.
، حيث A هي منطقة الذروة ، xc هي مركز الذروة ، و w هي عرض الذروة لكل ذروة. - تقييد معلمات التركيب ك A > 0 و xc = FRET ± 0.02 و 0.1 ≤w≤ 0.24. كانت أربع قمم FRET لفرادى السكان FRET مناسبة في وقت واحد. تطبيق القيود المحددة لتركيبات جميع الظروف.
- احسب حالة الإشغال (النسبة المئوية) كمنطقة ذروة الاهتمام مقسومة على المساحة الإجمالية، والتي تعرف بأنها مجموع جميع القمم.
النتائج
التعبير ووضع العلامات الفلورية لمستشعر FRET القائم على UAA
هنا ، تتم مناقشة النتائج النموذجية لإدراج ووضع العلامات الفلورية على UAA (AZP) داخل CRD من mGluR2 (548UAA)11. كما ذكرنا سابقا ، لإدراج AZP في mGluR2 ، من الضروري التعبير المشترك عن الآلات الانتقالية الهندسية ، والتي تتضمن تركيب ...
Discussion
GPCRs هي بروتينات تعمل على غشاء الخلية لبدء نقل الإشارة. ويتألف العديد من المحافل العالمية للإبلاغ من مجالات متعددة، وتعتمد الإشارات على التفاعل التعاوني بين المجالات. لتعديل خصائص مستقبلات الغشاء هذه ، من الضروري فهم السلوك الديناميكي للمجالات المتعددة. نقل طاقة الرنين الفلوري أحادي الجز...
Disclosures
ويعلن صاحبا البلاغ عدم وجود مصالح متنافسة.
Acknowledgements
نشكر أعضاء مختبر رضا فابابخش على المناقشات. تم دعم هذا العمل من خلال منحة المعاهد الوطنية للصحة R01GM140272 (إلى R.V.) ، وصندوق سيرل للقيادة لعلوم الحياة في جامعة نورث وسترن ، ومن قبل اتحاد شيكاغو الطبي الحيوي بدعم من صناديق سيرل في صندوق شيكاغو المجتمعي (إلى R.V). تم دعم B.W.L. من قبل منحة التدريب T32GM-008061 من المعهد الوطني للعلوم الطبية العامة (NIGMS).
Materials
| Name | Company | Catalog Number | Comments |
| (+)-Sodium L-Ascorbate | Sigma Aldrich | Cat # 11140-250G | |
| 4-azido-L-phenylalanine | Chem-Impex International | Cat # 06162 | |
| 548UAA | Liauw et al. 2021 | Transfected construct | |
| Acetic Acid | Fisher Chemical | 64-19-7 | |
| Acetone | Fisher Chemical | 67-64-1 | |
| Adobe Illustrator (2022) | https://www.adobe.com/ | RRID:SCR_010279 | Software, algorithm |
| Aminoguanidine (hydrochloride) | Cayman Chemical | 81530 | |
| Aminosilane | Aldrich | 919-30-2 | |
| Bath Sonicator 2.8 L | Fisher Scientific | Ultrasonic Bath 2.8 L | |
| Biotin-PEG | Laysan Bio Inc | Item# Biotin-PEG-SVA-5000-100mg | |
| BTTES | Click Chemistry Tools | 1237-500 | |
| Copper (II) sulfate | Sigma Aldrich | Cat # 451657-10G | |
| Cover slip | VWR | 16004-306 | Sample chamber |
| Cy3 Alkyne | Click Chemistry Tools | TA117-5 | |
| Cy5 Alkyne | Click Chemistry Tools | TA116-5 | |
| DDM | Anatrace | Part# D310 1 GM | Detergent |
| DDM-CHS (10:1) | Anatrace | Part# D310-CH210 1 ML | Detergent with cholecterol |
| Defined Fetal Bovine Serum | Thermo Fisher Scientific | SH30070.03 | |
| Di01-R405/488/561/635 | Semrock | Notch filter | |
| DMEM | Corning | 10-013-CV | |
| EMCCD | Andor | DU-897U | Camera |
| ET542lp | Chroma | Long pass emission filter | |
| FF640-FDi01 | Semrock | Emission dichroic filter | |
| FLAG-tag antibody | Genscript | A01429 | |
| Fluorescent bead | Invitrogen T7279 | TetraSpeck microspheres | Spherical bead |
| Glass slides | Fisherfinest | 12-544-4 | sample chamber |
| Glutamate | Sigma Aldrich | Cat # 6106-04-3 | |
| HEK 293T | Sigma Aldrich | Cat # 12022001 | Cell line |
| HEPES | FisherBioReagents | 7365-45-9 | |
| Image splitter | OptoSplit II | ||
| KOH | Fluka | 1310-58-3 | |
| Laser | Oxxius | 4-line laser combiner | |
| Lipofectamine 3000 Transfection Reagent | Thermo Fisher Scientific | L3000015 | Transfection Reagent |
| Methanol | Fisher Chemical | 67-56-1 | |
| Microscope | Olympus | Olympus IX83 | |
| Milli-Q water | Barnstead | Water Deionizer | |
| m-PEG | Laysan Bio Inc | Item# MPEG-SIL-5000-1g | |
| NF03-405/488/532/635 | Semrock | Dichroic mirror | |
| OptiMEM | Thermo Fisher Scientific | 51985091 | Reduced Serum Medium |
| OptiMEM/Reduced serum medium | Thermo Fisher Scientific | ||
| OriginPro (2020b) | https://www.originlab.com/ | RRID:SCR_014212 | Data analysis and graphing software |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| pIRE4-Azi | Addgene | Plasmid # 105829 | Transfected construct |
| Poly-L-lysine hydrobromide | Sigma Aldrich | Cat # P2636 | |
| Protocatechuic acid (PCA) | HWI group | 99-50-3 | |
| smCamera (Version 1.0) | http://ha.med.jhmi.edu/resources/ | Camera software | |
| Sodium bicarbonate | FisherBioReagents | 144-55-8 | |
| Sodium hydroxide (NaOH) | Sigma | 1310-73-2 | |
| Syringe filter | Whatman UNIFLO | Cat#9914-2502 | Liquid filtration |
| Trolox | Sigma | 53188-07 |
References
- Smock, R. G., Gierasch, L. M. Sending signals dynamically. Science. 324 (5924), 198-203 (2009).
- Changeux, J. P., Christopoulos, A. Allosteric modulation as a unifying mechanism for receptor function and regulation. Cell. 166 (5), 1084-1102 (2016).
- Tang, X. -. l., Wang, Y., Li, D. -. l., Luo, J., Liu, M. -. Y. Orphan G protein-coupled receptors (GPCRs): biological functions and potential drug targets. Acta Pharmacologica Sinica. 33 (3), 363-371 (2012).
- Chung, K. Y., et al. Conformational changes in the G protein Gs induced by the β2 adrenergic receptor. Nature. 477 (7366), 611-615 (2011).
- Vafabakhsh, R., Levitz, J., Isacoff, E. Y. Conformational dynamics of a class C G-protein-coupled receptor. Nature. 524 (7566), 497-501 (2015).
- Niswender, C. M., Conn, P. J. Metabotropic glutamate receptors: Physiology, pharmacology, and disease. Annual Review of Pharmacology and Toxicology. 50, 295-322 (2010).
- Pin, J. P., Bettler, B. Organization and functions of mGlu and GABA(B) receptor complexes. Nature. 540 (7631), 60-68 (2016).
- Kniazeff, J., et al. Closed state of both binding domains of homodimeric mGlu receptors is required for full activity. Nature Structural & Molecular Biology. 11 (8), 706-713 (2004).
- Ha, T. Single-molecule fluorescence resonance energy transfer. Methods. 25 (1), 78-86 (2001).
- Schuler, B., Eaton, W. A. Protein folding studied by single-molecule FRET. Current Opinion in Structural Biology. 18 (1), 16-26 (2008).
- Liauw, B. W. -. H., Afsari, H. S., Vafabakhsh, R. Conformational rearrangement during activation of a metabotropic glutamate receptor. Nature Chemical Biology. 17 (3), 291-297 (2021).
- Noren, C. J., Anthonycahill, S. J., Griffith, M. C., Schultz, P. G. A general method for site-specific incorporation of unnatural amino acids into proteins. Science. 244 (4901), 182-188 (1989).
- Presolski, S. I., Hong, V. P., Finn, M. Copper-catalyzed azide-alkyne click chemistry for bioconjugation. Current Protocols in Chemical Biology. 3 (4), 153-162 (2011).
- Huber, T., Naganathan, S., Tian, H., Ye, S. X., Sakmar, T. P. Unnatural amino acid mutagenesis of GPCRs using amber codon suppression and bioorthogonal labeling. G Protein Coupled Receptors: Structure. 520, 281-305 (2013).
- Serfling, R., Coin, I., Pecoraro, V. Chapter Four - Incorporation of Unnatural Amino Acids into Proteins Expressed in Mammalian Cells. Methods in Enzymology. 580, 89-107 (2016).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments. (86), e50549 (2014).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Cordes, T., Vogelsang, J., Tinnefeld, P. On the mechanism of Trolox as antiblinking and antibleaching reagent. Journal of the American Chemical Society. 131 (14), 5018-5019 (2009).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Lee, S., et al. How do short chain nonionic detergents destabilize G-protein-coupled receptors. Journal of the American Chemical Society. 138 (47), 15425-15433 (2016).
- Cao, A. -. M., et al. Allosteric modulators enhance agonist efficacy by increasing the residence time of a GPCR in the active state. Nature Communications. 12 (1), 1-13 (2021).
- Mancebo, A., Mehra, D., Banerjee, C., Kim, D. -. H., Puchner, E. M. Efficient cross-correlation filtering of one-and two-color single molecule localization microscopy data. Frontiers in Bioinformatics. 1, 739769 (2021).
- Mehra, D., Adhikari, S., Banerjee, C., Puchner, E. M. Characterizing locus specific chromatin structure and dynamics with correlative conventional and super-resolution imaging in living cells. Nucleic Acids Research. , (2022).
- Chen, H., Puhl, H. L., Koushik, S. V., Vogel, S. S., Ikeda, S. R. Measurement of FRET efficiency and ratio of donor to acceptor concentration in living cells. Biophysical Journal. 91 (5), 39-41 (2006).
- Gopich, I. V., Szabo, A. FRET efficiency distributions of multistate single molecules. The Journal of Physical Chemistry B. 114 (46), 15221-15226 (2010).
- Roy, R., Hohng, S., Ha, T. A practical guide to single-molecule FRET. Nature Methods. 5 (6), 507-516 (2008).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-A multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Bronson, J. E., Fei, J., Hofman, J. M., Gonzalez, R. L., Wiggins, C. H. Learning rates and states from biophysical time series: A Bayesian approach to model selection and single-molecule FRET data. Biophysical Journal. 97 (12), 3196-3205 (2009).
- Zhang, J., et al. Specific structural elements of the T-box riboswitch drive the two-step binding of the tRNA ligand. Elife. 7, 39518 (2018).
- Goodman, N. R. Statistical analysis based on a certain multivariate complex Gaussian distribution (an introduction). The Annals of Mathematical Statistics. 34 (1), 152-177 (1963).
- Brown, R. B., Audet, J. Current techniques for single-cell lysis. Journal of the Royal Society Interface. 5, 131-138 (2008).
- Schamber, M. R., Vafabakhsh, R. Mechanism of sensitivity modulation in the calcium-sensing receptor via electrostatic tuning. Nature Communications. 13 (1), 2194 (2022).
- Jain, A., Liu, R., Xiang, Y. K., Ha, T. Single-molecule pull-down for studying protein interactions. Nature Protocols. 7 (3), 445-452 (2012).
- Huang, S. K., et al. Delineating the conformational landscape of the adenosine A(2A) receptor during G protein coupling. Cell. 184 (7), 1884-1894 (2021).
- Wingler, L. M., et al. Angiotensin analogs with divergent bias stabilize distinct receptor conformations. Cell. 176 (3), 468-478 (2019).
- Gordon, C. G., et al. Reactivity of biarylazacyclooctynones in copper-free click chemistry. Journal of the American Chemical Society. 134 (22), 9199-9208 (2012).
- Kim, E., Koo, H. Biomedical applications of copper-free click chemistry: In vitro, in vivo, and ex vivo. Chemical Science. 10 (34), 7835-7851 (2019).
- Pickens, C. J., Johnson, S. N., Pressnall, M. M., Leon, M. A., Berkland, C. J. Practical considerations, challenges, and limitations of bioconjugation via azide-alkyne cycloaddition. Bioconjugate Chemistry. 29 (3), 686-701 (2018).
- Geng, Y., et al. Structural mechanism of ligand activation in human calcium-sensing receptor. Elife. 5, 13662 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved