Method Article
التحرير الجيني لخلايا المكاك البائية الريسوس الأولية
In This Article
Summary
نقدم طريقة لزراعة وتحرير الجينات لخلايا المكاك البائية الريسوس الأولية باستخدام CRISPR / Cas9 والنمط المصلي 6 للفيروس المرتبط بالغدي المؤتلف لدراسة علاجات الخلايا البائية.
Abstract
الخلايا البائية وذريتها هي مصادر الأجسام المضادة عالية التعبير. إن قدراتها العالية على التعبير عن البروتين جنبا إلى جنب مع وفرتها ، وسهولة الوصول إليها عن طريق الدم المحيطي ، وقابليتها للنقل بالتبني البسيط جعلتها هدفا جذابا لنهج تحرير الجينات للتعبير عن الأجسام المضادة المؤتلفة أو البروتينات العلاجية الأخرى. إن التحرير الجيني للفأر والخلايا البائية الأولية البشرية فعال ، وقد أظهرت نماذج الفئران للدراسات في الجسم الحي نتائج واعدة ، ولكن لم يتم إثبات الجدوى وقابلية التوسع للنماذج الحيوانية الأكبر حتى الآن. لذلك ، قمنا بتطوير بروتوكول لتحرير الخلايا البائية الأولية لقرود المكاك الريسوس في المختبر لتمكين مثل هذه الدراسات. نبلغ عن حالات الزراعة في المختبر وتحرير الجينات لخلايا المكاك البائية الريسوس الأولية من خلايا الدم أحادية النواة المحيطية أو الخلايا الطحالية باستخدام CRISPR / Cas9. لتحقيق التكامل المستهدف للأشرطة الكبيرة (<4.5 كيلوبايت) ، تم تضمين بروتوكول سريع وفعال لإعداد النمط المصلي 6 للفيروس المرتبط بالغدي المؤتلف كقالب إصلاح موجه بالتماثل باستخدام ناقل مساعد للفيروسات الغدية ذاتي الإسكات يدعم التتراسيكلين. تمكن هذه البروتوكولات من دراسة علاجات الخلايا البائية المحتملة في المكاك الريسوس.
Introduction
الخلايا البائية هي أساس المناعة الخلطية. عند التنشيط بواسطة مستضد مشابه وإشارات ثانوية ، تؤدي الخلايا البائية الساذجة إلى ظهور خلايا المركز الجرثومي B وخلايا الذاكرة البائية وخلايا البلازما1. هذا الأخير هو مصدر الأجسام المضادة المفرزة التي تتوسط في الوظائف الوقائية لمعظم اللقاحات المتاحة حاليا2. تم وصف خلايا البلازما بأنها مصانع للأجسام المضادة لأنها تفرز كميات هائلة من الأجسام المضادة في المصل - حوالي 2 نانوغرام / يوم / خلية3 ، تصل إلى 7-16 جم / لتر مصل ، مما يجعل الأجسام المضادة واحدة من البروتينات الثلاثة الأكثر وفرة في المصل4. الخلايا البائية وفيرة في الدم، ومن ثم يمكن الحصول عليها بسهولة وحقنها مرة أخرى في الفرد.
جعلت هذه السمات الخلايا البائية هدفا لجهود العلاج الخلوي لتحرير مستقبلات الخلايا البائية (BCR) والتعبير عن الأجسام المضادة المعادلة على نطاق واسع (bNAbs) لفيروس نقص المناعة البشرية (HIV)5،6،7،8،9،10،11،12،13،14،15 والبروتينات الأخرى 16 ، 17،18،19،20،21. وقد أظهرت هذه الأساليب إمكانات في العديد من دراسات الفئران في الجسم الحي7،8،10،11،16،22. ومع ذلك ، لا يزال يتعين التغلب على العديد من العقبات للترجمة السريرية9،15،23 ، من بينها السلامة والمدة وحجم الفعالية العلاجية ، بالإضافة إلى التوسع إلى الحيوانات الأكبر مثل الرئيسيات غير البشرية (NHPs). في الواقع ، NHPs ، وخاصة المكاك ريسوس ، التي لها تاريخ طويل في أبحاث الأجسام المضادة وفيروس نقص المناعة البشرية24,25 ، هي النموذج الأنسب لاختبار هذه المعلمات.
هنا ، قمنا بتطوير بروتوكولات تمكن من معالجة هذه المشكلات. حتى الآن ، حاولت دراسات قليلة زراعة خلايا المكاك البائية الريسوس خارج الجسم الحي ، وتم الإبلاغ عن الانتقاء الإيجابي فقط باستخدام CD20 لتنقية خلايا المكاك البائيةالمكاك الريسوس 26،27،28. لقد أنشأنا بروتوكولا لعزل خلايا المكاك البائية التي لم تمسها عن طريق النضوب السلبي لأنواع الخلايا الأخرى. علاوة على ذلك ، يتم تحديد ظروف الاستزراع للتحرير الجيني المستهدف لخلايا المكاك البائية الريسوس. يحدد هذا البروتوكول استخدام البروتينات النووية الريبية كريسبر / كاس9 (RNPs) والنمط المصلي للفيروس المرتبط بالغدي المؤتلف 6 (rAAV6) كقالب إصلاح موجه بالتماثل (HDRT) لتحرير الجينات خلايا المكاك البائية المستزرعة. باستخدام هذا البروتوكول ، تم تحقيق كفاءات تحرير تصل إلى 40٪ مع إدخالات كبيرة (~ 1.5 كيلو بايت). نقدم أيضا طريقة سريعة وفعالة من حيث التكلفة لإنتاج rAAV6 باستخدام مساعد فيروسي غديدي ذاتي الإسكات29 ممكن للتتراسيكلين لتمكين الاختبار السريع ل HDRTs بهذا التنسيق. تصف هذه البروتوكولات مجتمعة سير عمل فعال لتحرير الجينات لخلايا المكاك البائية الريسوس (الشكل 1) ، مما يتيح تقييم علاجات الخلايا البائية في نموذج NHP.
لبدء التجارب ، يمكن طلب المواد المانحة من مصادر تجارية أو الحصول عليها عن طريق الفصد أو استئصال الطحال. في هذه الدراسة ، تم إجراء الفصد وجمع الدم كما هو موضح سابقا30 باستخدام مضادات التخثر EDTA. للحصول على الطحال ، تم إجراء خلايا المكاك البائية الريسوس الأولية ، استئصال الطحال الجزئي (25٪ -50٪) أو الكلي باستخدام التقنيات التي تم الإبلاغ عنها سابقا31. تم صيام الحيوانات بين عشية وضحاها قبل الجراحة. لفترة وجيزة ، أثناء الجراحة ، تم قص البطن وإعداده بدعك متناوبة من الكلورهيكسيدين و 70٪ كحول الأيزوبروبيل ثلاث مرات. تم إجراء شق (5-10 سم) في البطن لتحديد وعزل الطحال. تم ربط الأوعية الدموية في الطحال إما بالغرز أو المشابك الوعائية. تم إغلاق الشق في طبقتين مع 4-0 خيوط بوليديوكسانون PDS. تم إجراء استئصال الطحال مرة واحدة لحيوان فردي. تم تحضير معلقات أحادية الخلية من طحال المكاك عن طريق النقع من خلال مصافي الخلايا. تم تحضير الخلايا أحادية النواة من الدم ومعلقات الخلايا الطحالية باستخدام الطرد المركزي المتدرج الكثافة وتخزينها في النيتروجين السائل.
Protocol
تم إجراء جميع الإجراءات والتجارب على الحيوانات وفقا للبروتوكولات المعتمدة من قبل لجنة رعاية واستخدام الحيوان المؤسسية التابعة للمعهد الوطني للحساسية والأمراض المعدية ، المعاهد الوطنية للصحة. ويرد في الشكل 1 ملخص للبروتوكولات التالية. تم إيواء ذكور وإناث المكاك الريسوس (Macaca mulatta) من أصل جيني هندي تتراوح أعمارهم بين 2-8 سنوات ورعايتهم وفقا للمبادئ التوجيهية للجنة المعنية برعاية واستخدام المختبر في مرفق للسلامة الأحيائية من المستوى 2.
تنبيه: أجريت جميع التجارب وفقا للاحتياطات العالمية لمسببات الأمراض المنقولة بالدم ، مع تقنيات معقمة / معقمة ومعدات السلامة البيولوجية المناسبة من المستوى 2 في أغطية التدفق الصفحي.
1. إنتاج rAAV6
- تحضير الكواشف لإنتاج rAAV6.
- تصميم واستنساخ قالب الإصلاح الموجه بالتماثل بين التكرارات الطرفية المقلوبة (ITR) ل AAV2 في المتجه pAAV باستخدام التقنيات القياسية. تأكد من أن أذرع التماثل لا تقل عن ~ 250 نقطة أساس على كلا الجانبين ، ولكن قد يكفي أقل من 60 نقطة أساس ، على الرغم من تفضيل أذرع التماثل الأطول إذا كان تصميم البناء يسمح بذلك. إذا كانت التسلسلات المستهدفة لأي من sgRNAs المستخدمة موجودة في HDRT ، فقم بإزالتها باستخدام طفرات صامتة ، والتي تكون أكثر فاعلية في الشكل المجاور للفضاء الأولي أو منطقة البذور في الموقع المستهدف.
ملاحظة: يمكن إجراء تخليق الجينات جنبا إلى جنب مع تجميع جيبسون للاستنساخالفعال 32. إعداد Maxiprep من استنساخ الصحيح للنقل. بالنسبة لتصميم sgRNA ، يوصى باستخدام CHOPCHOP33 ، ويمكن العثور على قائمة بالمزيد من الأدوات في https://zlab.bio/guide-design-resources. وتبلغ سعة التغليف القصوى لمركبات AAV بما في ذلك لوائح الاتصالات الدولية ~ 4,7 كيلو بايت. AAV6 هو النمط المصلي الأكثر استخداما لتحرير الخلايا المكونة للدم ، وخاصة الخلايا البائية9. لم يتم اختبار الأنماط المصلية الأخرى ل AAV لتحرير الجينات لخلايا المكاك B الريسوس ، ولكن تم استخدام AAV28 و AAV-DJ10,11 في دراسات الفئران. - إعداد وسط استزراع 293AAV ووسط إنتاج طبقا للجدول 1 والجدول 2. مرشح معقم من خلال وحدة مرشح غشاء بولي إيثر سلفون (PES) 0.2 ميكرومتر. يحفظ في درجة حرارة 4 درجة مئوية.
- تحضير 1x بولي إيثيلينيمين (PEI) محلول (1 مجم / مل ، 100 مل).
- في دورق زجاجي سعة 250 مل ، سخني ~ 70 مل من H2O في الميكروويف لمدة ~ 30 ثانية ، ثم أضف 100 مجم من PEI. أضف محرك مغناطيسي ، وحركه حتى يذوب PEI في الغالب.
- اضبط الرقم الهيدروجيني على 7 مع 1 M HCl ، ثم قم بتعبئة ما يصل إلى 100 مل باستخدام H2O ، وانتظر 10 دقائق ، وتحقق من الرقم الهيدروجيني مرة أخرى ، واضبطه إذا لزم الأمر.
- قم بتصفية محلول PEI المعقم من خلال وحدة مرشح غشاء PES 0.2 ميكرومتر ، والقسمة ، وتخزينها -20 درجة مئوية. بعد الذوبان ، يمكن تخزين المحلول عند 4 درجات مئوية لمدة تصل إلى 2 أشهر.
- تحضير محلول البولي إيثيلين جلايكول (PEG) / كلوريد الصوديوم 5x.
- تزن 400 غرام من PEG 8000 و 24 غرام من كلوريد الصوديوم.
- أضف محرك مغناطيسي إلى دورق زجاجي سعة 2 لتر ، وأضف وزن PEG 8,000 وكلوريد الصوديوم ، واشطفه ب ~ 550 مل من الماء منزوع الأيونات.
- يقلب مع التسخين ويغلى المزيج أو 80-90 درجة مئوية حتى يذوب تماما.
- اضبط الرقم الهيدروجيني على ~ 7.4 باستخدام 1 M NaOH ، ثم اضبط مستوى الصوت على 1 لتر باستخدام أسطوانة قياس ، وانقله إلى زجاجة زجاجية سعة 2 لتر مع المحرك المغناطيسي.
- الأوتوكلاف الزجاجة والمحرك المغناطيسي والمحلول في حمام مائي لمدة 30 دقيقة عند 121 درجة مئوية.
- بعد التعقيم ، قم بتبريد المحلول في غرفة باردة مع التحريك باستخدام المحرك المغناطيسي لمنع الانفصال إلى مراحل مختلفة. القسمة إذا لزم الأمر ، وتخزينها في درجة حرارة 4 درجة مئوية.
- تحضير المخزن المؤقت للصياغة.
- امزج 500 مل من DPBS مع 50 ميكرولتر من 10٪ Pluronic F-68. مرشح معقم من خلال وحدة مرشح غشاء PES 0.2 ميكرومتر ، وتخزينها في درجة حرارة الغرفة (RT).
- تصميم واستنساخ قالب الإصلاح الموجه بالتماثل بين التكرارات الطرفية المقلوبة (ITR) ل AAV2 في المتجه pAAV باستخدام التقنيات القياسية. تأكد من أن أذرع التماثل لا تقل عن ~ 250 نقطة أساس على كلا الجانبين ، ولكن قد يكفي أقل من 60 نقطة أساس ، على الرغم من تفضيل أذرع التماثل الأطول إذا كان تصميم البناء يسمح بذلك. إذا كانت التسلسلات المستهدفة لأي من sgRNAs المستخدمة موجودة في HDRT ، فقم بإزالتها باستخدام طفرات صامتة ، والتي تكون أكثر فاعلية في الشكل المجاور للفضاء الأولي أو منطقة البذور في الموقع المستهدف.
- زراعة الخلايا ونقلها ونقلها لإنتاج rAAV6
- إذابة وزراعة وتجميد خلايا 293AAV كما هو موضح من قبل الشركة المصنعة باستخدام وسط الاستزراع 293AAV أعلاه و Trypsin-EDTA للتقسيم. يوصى بتجميد بعض الممرات المبكرة واستخدام الخلايا لإنتاج AAV قبل أن تصل إلى الممر 40.
- لإنتاج rAAV6 ، قم بزرع أربعة أطباق لزراعة الخلايا مقاس 15 سم مع 5 × 106 خلايا في 30 مل لكل منها. تكون الخلايا جاهزة للنقل عادة بعد 1-2 أيام من البذر عندما تصل إلى التقاء 80٪ -90٪.
- قم بإذابة Maxiprep من بلازميد pAAV الذي يحتوي على HDRT ليتم تعبئته في AAV6. أعد تعليق 85.6 ميكروغرام من بلازميد pAAV في 3 مل من وسط DMEM النقي.
- قم بإذابة 342 ميكرولتر من محلول PEI 1 مجم / مل في 3 مل من وسط DMEM النقي. احتضان كلا الحلين لمدة 10 دقائق في RT.
- امزج كلا من أنابيب 3 مل في أنبوب واحد من ~ 6.4 مل من مزيج النقل ، واحتضانه لمدة 20 دقيقة في RT.
- وفي الوقت نفسه ، قم بإذابة ناقل RepCap6 المساعد الذي يدعم التتراسيكلين وذاتي الإسكات من الفريزر -80 درجة مئوية في حمام مائي بدرجة حرارة 37 درجة مئوية. لتحويل خلايا 293AAV ، أضف الناقل المساعد عند تعدد العدوى (MOI) من 25 باستخدام الجرعة المعدية لثقافة الأنسجة المتوسطة (TCID 50) وبافتراض 1.15 ×10 7 خلايا / طبق ؛ عادة ، يتم استخدام 2-10 ميكرولتر لكل طبق 15 سم. صخرة وتدوير الأطباق بلطف لتوزيعها.
- بعد احتضان مزيج النقل ، أضف 1.6 مل منه بالتنقيط عبر كل طبق من الأطباق الأربعة مقاس 15 سم. احتضان في 37 درجة مئوية و 5 ٪ CO2 بين عشية وضحاها.
ملاحظة: بدلا من ذلك ، إذا كانت ناقلات rAAV6 ذات الأهمية متاحة بالفعل ، فيمكن استخدام هذه النواقل لتوفير الجينوم الفيروسي المراد تعبئته ، مما يلغي الحاجة إلى أي بلازميدات مع هذا النظام وينتج عيارات rAAV6 مماثلة. لهذا النهج ، يتم تحويل خلايا 293AAV مع rAAV6 المطلوب عند MOI من 50 (بناء على نسخ جينوم rAAV6 [GC] / mL) جنبا إلى جنب مع المتجه المساعد. - في اليوم التالي ، قم بشفط وسط الاستزراع وتجاهله بعناية ، واستبدله ب 30 مل من وسط الإنتاج المسخن مسبقا. احتضان لمدة 96 ساعة أخرى قبل الحصاد. لا يوصى بإجراء مزيد من التغيير المتوسط لزيادة الغلة.
- حصاد وتنقية AAV6 المؤتلف من الوسط
- بدون إزاحة الخلايا من الطبق ، اجمع كل طافت الخلية في وحدة مرشح بغشاء PES 0.2 ميكرومتر أكبر بنسبة 50٪ على الأقل من حجم الوسط المراد تصفيته. ثم قم بتصفية المادة الطافية.
ملاحظة: إذا كانت هناك رغبة في الحصول على غلات أعلى من rAAV6 ، فيمكن حصاد الخلايا واستخراج rAAV من حبيبات الخلية باستخدام مجموعات تجارية أو بروتوكولات راسخة34,35. نظرا لأن AAV6 يفرز في الغالب في الوسط36 ، فقد تم استخدام المادة الطافية فقط ، مما قلل من العمالة والتكلفة والوقت. - أضف محلول 5x PEG / NaCl إلى المادة الطافية المفلترة بنسبة 25٪ من الحجم الذي تم جمعه ؛ هذا عادة ما يكون 30 مل إذا تم استخدام أربعة أطباق 15 سم من 30 مل.
- تخلط جيدا عن طريق التقليب ، ثم تحتضن طوال الليل عند 4 درجات مئوية لترسيب الجسيمات الفيروسية.
ملاحظة: جزيئات AAV مستقرة لمدة تصل إلى 2 أيام في هذا الحل. - قم بتبريد جهاز طرد مركزي دلو متأرجح مسبقا باستخدام 250 مل من إدخالات الأنبوب إلى 4 درجات مئوية. قم بإعداد وحدة تصفية طرد مركزي سعة 4 مل مع قطع 100 كيلو دالتون ومرشح حقنة PES محب للماء 0.22 ميكرومتر عن طريق المعالجة المسبقة لكل غشاء ب 2 مل من 10٪ Pluronic F-68 لمدة 1 ساعة على الأقل في RT.
- انقل خليط AAV-PEG / NaCl إلى أنبوب سعة 250 مل ، وجهاز طرد مركزي عند 2500 × جم لمدة 1 ساعة عند 4 درجات مئوية ، ثم قم بإزالة المادة الطافية بالكامل بعناية عن طريق الشفط.
- أعد تعليق الحبيبات الفيروسية البيج إلى الأبيض عن طريق الدوامة في 4 مل من 1 M HEPES حتى يتم إعادة شفطها بالكامل. إذا لزم الأمر ، دعها تقف لمدة 5 دقائق ، ودوامة مرة أخرى. أعد التعليق باستخدام ماصة مصلية سعة 5 مل ، وانقل الحجم الكلي إلى أنبوب سعة 15 مل.
- في غطاء الدخان ، أضف حجما متساويا من الكلوروفورم إلى معلق الفيروس - عادة 4 مل.
- دوامة قوية لمدة 2 دقيقة ، ثم أجهزة الطرد المركزي عند 1000 × جم لمدة 5 دقائق في RT.
- اجمع الطبقة العليا (طاف يحتوي على AAV) في أنبوب جديد سعة 50 مل ، وتخلص من الطبقة السفلية (الكلوروفورم).
تنبيه: المحاليل المحتوية على الكلوروفورم هي نفايات خطرة. اتبع المبادئ التوجيهية المؤسسية للتخلص منها. - ضع المادة الطافية المحتوية على AAV تحت غطاء دخان ، واترك الكلوروفورم المتبقي يتبخر لمدة 30 دقيقة.
- وفي الوقت نفسه ، اغسل وحدة مرشح الطرد المركزي المعالجة مسبقا ومرشح المحقنة.
- أضف 1.5 مل من محلول التركيبة إلى وحدة مرشح الطرد المركزي المعالجة مسبقا. جهاز طرد مركزي عند 3500 × جم لمدة 10 دقائق عند 15 درجة مئوية في دوار دلو متأرجح. كرر هذه الخطوة مع 4 مل من المخزن المؤقت لغسل الغشاء.
- اشطف مرشح المحقنة مرتين باستخدام 5 مل من محلول التركيبة باستخدام حقنة سعة 5 مل.
- قم بتحميل ~ 4 مل من المادة الطافية المحتوية على AAV من استخراج الكلوروفورم في حقنة سعة 5 مل ، وقم بتوصيل مرشح المحقنة المغسولة ، وقم بالتصفية مباشرة في وحدة مرشح الطرد المركزي.
- جهاز طرد مركزي عند 3500 × جم لمدة 25 دقيقة عند 15 درجة مئوية ، ثم تأكد من أن محلول AAV في المرشح يتراوح بين 50-100 ميكرولتر. إذا كان حجم المحلول >100 ميكرولتر ، فاستمر في أجهزة الطرد المركزي.
- بعد إزالة المرشح ، أضف 4 مل من المخزن المؤقت للتركيبة داخل كوب وحدة مرشح الطرد المركزي ، واخلط المحلول بشكل موحد عن طريق الماصة. جهاز طرد مركزي عند 3500 × جم لمدة 25 دقيقة عند 15 درجة مئوية ، ثم تأكد من أن محلول AAV في المرشح يتراوح بين 50-100 ميكرولتر. إذا كان حجم المحلول >100 ميكرولتر ، فاستمر في أجهزة الطرد المركزي. كرر هذه الخطوة لغسل آخر.
- بعد الطرد المركزي النهائي ، تأكد من أن حجم المحلول هو 50-70 ميكرولتر ؛ إذا لم يكن كذلك ، استمر في أجهزة الطرد المركزي. نقل التحضير إلى أنبوب 1.5 مل. القسمة إذا رغبت في ذلك ، وتخزينها في -80 درجة مئوية.
- بدون إزاحة الخلايا من الطبق ، اجمع كل طافت الخلية في وحدة مرشح بغشاء PES 0.2 ميكرومتر أكبر بنسبة 50٪ على الأقل من حجم الوسط المراد تصفيته. ثم قم بتصفية المادة الطافية.
- تحديد عيار AAV6 المؤتلف بواسطة qPCR
ملاحظة: تلدين بادئات qPCR في منطقة ITR وبالتالي يجب أن تكون مناسبة لجميع التركيبات المستنسخة في pAAV.- قم بإذابة حصة من rAAV6 ليتم معايرتها وحصة من المادة المرجعية AAV6. يجب أن تكون المادة المرجعية AAV6 قريبة من 4 × 1011 GC / مل ؛ خلاف ذلك ، اضبط التخفيفات وفقا لذلك.
- قم بإجراء هضم DNase I لإزالة أي حمض نووي بلازميد حر متبقي في إعداد rAAV6 من خلال الجمع بين 2.0 ميكرولتر من العينة أو المادة المرجعية AAV6 مع 15.6 ميكرولتر من H 2 O الخالي من النيوكلياز ، و2.0ميكرولتر من المخزن المؤقت 10x DNase I ، و 0.4 ميكرولتر من DNase I.
- اخلطي برفق واحتضنيها لمدة 30 دقيقة عند 37 درجة مئوية ، ثم انقليها إلى الثلج. هذا هو التخفيف 1 (انظر الجدول 3).
- تحضير التخفيفات التسلسلية الخمسة لجميع العينات والمواد المرجعية AAV6 كما في الجدول 3 أدناه بالماء.
- قم بإعداد مزيج SYBR Green qPCR الرئيسي. لكل بئر ، امزج 4.7 ميكرولتر من الماء الخالي من النيوكلياز مع 10 ميكرولتر من المزيج الرئيسي الأخضر SYBR ، و 0.15 ميكرولتر من التمهيدي ITR إلى الأمام عند 100 ميكرومتر ، و 0.15 ميكرولتر من عكس التمهيدي ITR عند 100 ميكرومتر.
ملاحظة: يتم قياس كل عينة في نسختين ، مع 16 بئرا للمعيار المرجعي ، و 8 آبار لكل عينة ، و 2 بئر لعنصر تحكم بدون قالب. قم بإعداد مزيج رئيسي أكثر بنسبة 10٪ لحساب خطأ السحب. - في لوحة تفاعل بصرية ذات 96 بئرا أو 384 بئرا ، قم بتحميل 15 ميكرولتر / بئر من المزيج الرئيسي SYBR Green qPCR.
- بعد ذلك ، قم بتحميل 5 ميكرولتر من العينات والمواد المرجعية AAV6 أو الماء الخالي من النيوكلياز للتحكم بدون قالب. بالنسبة للمعيار المرجعي AAV6 ، قم بتخفيف الحمل 2 إلى التخفيف 9. بالنسبة للعينات ، قم بتخفيف الحمل من 5 إلى التخفيف 8. قياس كل تخفيف في نسختين. تجنب الفقاعات.
- ختم لوحة محملة مع فيلم شفاف البصري ، وأجهزة الطرد المركزي في 800 × ز لمدة 1 دقيقة في RT ، وتحميل لوحة في أداة qPCR مع الإعداد المناسب 96 بئر أو 384 بئر.
- قم بإعداد وتشغيل جهاز qPCR باستخدام اكتشاف SYBR مع ظروف الدوران التالية: 98 درجة مئوية لمدة 3 دقائق ، ثم 40 دورة من 98 درجة مئوية لمدة 15 ثانية و 58 درجة مئوية لمدة 30 ثانية ، متبوعة بمنحنى ذوبان.
- قم بتحليل البيانات باستخدام برنامج الجهاز باستخدام تركيز المادة المرجعية AAV6 في نسخ الجينوم لكل ملليمتر (GC / mL) كمنحنى قياسي (انظر الجدول 3). احسب التركيز النهائي للعينة بالضرب في عامل التخفيف.
- تأكد من أن المنحنى القياسي R2 قريب من 1.0 ، وكفاءة PCR هي 90٪ -110٪ ، وتمت إزالة خط الأساس ، ويظهر منحنى الذوبان ذروة واحدة ، وتتغير قيم Ct وفقا للتخفيفات ، والتكرارات في حدود 0.5C t ؛ خلاف ذلك ، استبعاد القيم المتطرفة. توقع العوائد كما في الشكل 2.
2. تحضير وسائط الخلايا البائية والمحفزات
- تحضير وسط الذوبان: اجمع بين RPMI-1640 و 20٪ FCS. مرشح معقم من خلال وحدة مرشح غشاء PES 0.2 ميكرومتر. يحفظ في درجة حرارة 4 درجة مئوية.
- تحضير وسط زراعة الخلايا البائية: الجمع بين الكواشف في الجدول 4 ، ثم مرشح معقم من خلال وحدة مرشح غشاء PES 0.2 ميكرومتر. يحفظ في درجة حرارة 4 درجة مئوية.
- إعادة تعليق كل من منشطات الخلايا البائية في الجدول 5 بتركيزات المخزون في وسط زراعة الخلايا البائية ، باستثناء CpG ODN الذي يجب إعادة تعليقه في الماء الخالي من النيوكلياز. يحفظ في درجة حرارة -80 درجة مئوية.
- في حالة إجراء استنفاد سلبي للخلايا غير البائية (الخطوة 4 الاختيارية) ، قم بإعداد DPBS (بدون كالسيوم ، بدون مغنيسيوم) مع 2٪ FCS (DPBS 2٪ FCS). مرشح معقم من خلال وحدة مرشح غشاء PES 0.2 ميكرومتر. يحفظ في درجة حرارة 4 درجة مئوية.
3. تحضير وثقافة خلايا المكاك البائية الريسوس
ملاحظة: يتم استخدام PBMCs المكاك الريسوس المحفوظة بالتبريد أو الخلايا الطحالية لإعداد ثقافة الخلية30,31.
- وسط إذابة الدافئة ووسط زراعة الخلايا البائية في حمام مائي بدرجة حرارة 37 درجة مئوية. قم بإذابة منشطات الخلايا البائية من الجدول 5 على الجليد.
- قم بإعداد أنبوب بحجم مناسب يحتوي على وسط ذوبان مسخن مسبقا. يجب أن يكون هذا بشكل مثالي أكثر من 10 أضعاف حجم الخلايا المذابة.
- قم بإذابة واحد إلى اثنين من الكريوفيالات من PBMCs أو الخلايا الطحالية في وقت واحد في حمام مائي بدرجة حرارة 37 درجة مئوية ، وقم بصبها في الأنبوب المحضر بوسط مسخن مسبقا. شطف cryotubes لجمع كل الخلايا.
- أجهزة الطرد المركزي الخلايا في 200 × غرام لمدة 10 دقائق في RT.
ملاحظة: تقلل إعدادات الطرد المركزي هذه من تلوث الصفائح الدموية مع الحفاظ على إنتاجية PBMC. يمكن استخدام سرعات أعلى مثل 350 × جم لمدة 5 دقائق. - أعد تعليق الخلايا في وسط ذوبان 10 مل للغسيل.
- كرر الخطوتين 3.4 و 3.5 لما مجموعه ثلاثة أجهزة طرد مركزي لإزالة وسط التجمد. بعد الطرد المركزي الأخير ، أعد تعليق الخلايا عند ما يقدر ب ~ 5 × 106 خلايا / مل في وسط زراعة الخلايا البائية.
ملاحظة: البروتوكول أعلاه الثقافات PBMC كاملة أو الاستعدادات الطحال مع التلوث من قبل الخلايا الأخرى. إذا كانت هناك حاجة إلى مزارع خلايا بائية أنقى ، وإن كان ذلك بانخفاض كبير في إجمالي إنتاج الخلايا البائية ، فتابع الخطوة 4. لم تلاحظ أي اختلافات في كفاءات التحرير بين الطريقتين. - قم بتخفيف حصة 10 ميكرولتر من الخلايا حسب الضرورة باستخدام وسط زراعة الخلايا البائية للعد. عد باستخدام مقياس الدم وتلطيخ التريبان الأزرق ، والجمع بين كميات متساوية من الخلايا المعلقة ومحلول تريبان الأزرق 0.4 ٪.
- اضبط تركيز الخلية على 3 × 106 خلايا / مل باستخدام وسط زراعة الخلايا البائية وفقا لعدد الخلايا. ثم أضف منشطات الخلايا البائية إلى تركيزاتها النهائية وفقا للجدول 5 ، واخلطها.
- نقل الخلايا إلى طبق زراعة الخلايا المناسب. بشكل عام ، يوصى باستخدام 0.6 × 10 6-0.7 × 106 خلايا / سم2. احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO 2 لمدة 48 ساعة ±2 ساعة.
4. استنزاف سلبي اختياري للخلايا غير البائية
ملاحظة: يعتمد المحصول والنقاء على النسبة المئوية لمدخلات الخلايا البائية بين PBMCs ، والتي يمكن أن تختلف اختلافا كبيرا بين المكاك الريسوسالفردية 27. توقع نقاء 80٪ -95٪ ، كفاءة 60٪ ، و 1 × 10 6-1.5 × 106 خلايا من 1 × 107 PBMCs.
- بعد الغسيل الأخير (الخطوة 3.6) ، أعد تعليق الخلايا عند 1 × 108 خلايا / مل في DPBS 2٪ FCS وكتلة FC البشرية المخففة 1: 200. يعتمد عدد الخلايا على عدد الخلايا المذابة.
- احتضان لمدة 15 دقيقة على الجليد لمنع مستقبلات Fc ، ثم إضافة الأجسام المضادة biotinylated في الجدول 6. احتضان لمدة 20 دقيقة أخرى على الجليد.
- قم بتعبئة الأنبوب باستخدام DPBS 2٪ FCS ، وقم بتدويره عند 200 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- أعد تعليق الخلايا في DPBS 2٪ FCS عند 80٪ من الحجم من الخطوة 4.1 (أي 80 ميكرولتر لكل 1 × 107 خلايا).
- أضف حبات الستربتافيدين المغناطيسية إلى تعليق الخلية بنسبة 20٪ من الحجم من الخطوة 4.1 (أي 20 ميكرولتر من الخرز لكل 1 × 107 خلايا).
- احتضان الخلايا لمدة 15 دقيقة على الجليد ، وتحريكها من حين لآخر.
- وفي الوقت نفسه ، لكل 1 × 108 خلايا ، قم بإعداد فاصل مغناطيسي بعمود استنفاد مغناطيسي كبير ومرشح ما قبل الفصل. اشطف مرشح وعمود ما قبل الفصل ب 2 مل من DPBS 2٪ FCS عن طريق تدفق الجاذبية ، وتجاهل التدفق. قم بتركيب أنبوب تجميع سعة 15 مل.
ملاحظة: قد يؤدي استخدام أعمدة أخرى مثل أعمدة الاختيار الإيجابي أو أنظمة تنقية الخرزة المغناطيسية الأخرى إلى تقليل النقاء بشكل كبير. - بعد الحضانة ، قم بتعبئة الخلايا إلى 0.5 مل باستخدام DPBS 2٪ FCS إذا كان الحجم <0.5 مل. إذا كان الحجم ≥0.5 مل ، فما عليك سوى المتابعة.
- قم بتحميل تعليق الخلية في مرشح ما قبل الفصل على العمود المحضر ، واجمع التدفق في أنبوب سعة 15 مل.
- تخلص من الخلايا البائية المخصبة غير المنضمة مرتين بإضافة 1 مل من DPBS 2٪ FCS إلى مرشح ما قبل الفصل. اجمع الخلايا غير المنضمة في نفس الأنبوب عن طريق تدفق الجاذبية.
ملاحظة: قد يؤدي الشطف الإضافي إلى زيادة العائد. يمكن تقييم النقاء والكفاءة من خلال قياس التدفق الخلوي لخلايا الإدخال والخلايا المخصبة والخلايا المحتفظ بها على العمود. للحصول على الخلايا المحتفظ بها على العمود ، قم بإزالة العمود من المغناطيس ، واغسله ب 3 مل من DPBS 2٪ FCS باستخدام المكبس المقدم. إذا رغبت في ذلك ، قم بتقييم النقاء عن طريق قياس التدفق الخلوي كما في الشكل 3 باستخدام الكواشف في الجدول 7. - أجهزة الطرد المركزي الخلايا البائية المخصبة عند 200 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- أعد تعليق الخلايا عند ما يقدر ب ~ 5 × 106 خلايا / مل في وسط زراعة الخلايا البائية ، واستمر في الخطوة 3.7.
5. تحرير جين خلية المكاك البائية الريسوس الأولية
- بعد تنشيط خلايا المكاك البائية الريسوس لمدة 48 ساعة ± 2 ساعة ، قم بإعداد الكواشف للتثقيب الكهربائي والتنبيغ.
- Prewarm DMSO ، المخزن المؤقت المزدوج الخالي من النيوكلياز ، المخزن المؤقت T ، والمخزن المؤقت E (مجموعة التثقيب الكهربائي 10 ميكرولتر) أو E2 (مجموعة التثقيب الكهربائي 100 ميكرولتر) من مجموعة التثقيب الكهربائي إلى RT.
- قم بإذابة منشطات الخلايا البائية rAAV6 HDRT و B من الجدول 5 على الجليد.
- أعد تعليق CRISPR-Cas9 sgRNAs عند 100 ميكرومتر في المخزن المؤقت المزدوج. أعد تكوينه لمدة 10 دقائق في RT ، واخلطه عن طريق الدوامة والنقر. احتفظ ب sgRNAs المعاد تشكيلها على الثلج حتى الاستخدام. يحفظ في درجة حرارة -80 درجة مئوية.
ملاحظة: يمكن تصميم CRISPR-Cas9 sgRNAs باستخدام أدوات مختلفة عبر الإنترنت (انظر 1.1.1) ويمكن أن تختلف اختلافا كبيرا في كفاءة القطع. يوصى بإجراء اختبار تجريبي لكفاءة القطع باستخدام مقايسات مثل TIDE37 أو ICE38. - لكل 10 ميكرولتر من التثقيب الكهربائي ، قم بإعداد 550 ميكرولتر من وسط زراعة الخلايا البائية مع جميع المنشطات من الجدول 5 ، وأضف 1٪ DMSO. قم بتوسيع نطاق الأحجام بمقدار 10 أضعاف للحصول على 100 ميكرولتر من التثقيب الكهربائي. اختياريا ، يمكن تحضير 10 ٪ من هذا الوسيط دون المضادات الحيوية المضادة للبكتيريا ، مما يزيد قليلا من صلاحية الخلية بعد النقل.
- لكل 10 ميكرولتر من التثقيب الكهربائي ، قم بإعداد بئر من صفيحة زراعة الخلايا المكونة من 48 بئرا مع 50 ميكرولتر من وسط زراعة الخلايا البائية مع المنشطات وبدون مضاد حيوي مضاد حيوي ، في حالة استخدامه. للحصول على 100 ميكرولتر من التثقيب الكهربائي ، ماصة 500 ميكرولتر في آبار لوحة 6 آبار.
- أضف rAAV6 HDRT إلى الوسط في الآبار ، حتى 20٪ من الحجم في البئر. استهدف MOIs التي تتراوح من 1 × 10 5-1 × 10 6 بناء على عدد الخلايا لكل عملية نقل (10 ميكرولتر من التثقيب الكهربائي: 5 × 10 5 خلايا ؛ 100 ميكرولتر من التثقيب الكهربائي:5 × 106 خلايا) و GC في إعداد rAAV6. يوصى بتركيزات عالية من مخزون rAAV6 من 5 × 1013 GC / mL إلى 5 × 1014 GC / mL لتحقيق MOIs عالية مع أحجام منخفضة.
ملاحظة: قد يؤدي انخفاض MOIs إلى انخفاض كفاءة التحرير ، وتكون MOIs من 5 × 105 قريبة بشكل عام من الحد الأقصى لكفاءة التحرير التي رأيناها. لم يلاحظ تأثير MOIs المختلفة على صلاحية الخلايا البائية. يوصى بتضمين عناصر تحكم بدون rAAV6 HDRT ، وبدون نقل RNP ، وبدون كليهما. - سخن الأطباق المحضرة والوسط المتبقي عن طريق نقلها إلى حاضنة عند 37 درجة مئوية مع 5٪ CO2.
- لكل 10 ميكرولتر من التثقيب الكهربائي ، قم بإعداد 1.15 ميكرولتر من البروتين النووي الريبي (RNP): امزج 0.4 ميكرولتر من 61 ميكرومتر Cas9 مع 0.75 ميكرولتر من 100 ميكرومتر sgRNA في المخزن المؤقت المزدوج. تحضير إضافي (يوصى بزيادة 30٪ للتثقيب الكهربائي الفردي) بسبب خطأ في السحب ولتجنب الفقاعات عند تحميل أطراف التثقيب الكهربائي. مقياس 10 أضعاف لأطراف 100 ميكرولتر.
- احتضان RNP لمدة 15 دقيقة على الأقل في RT قبل الاختلاط مع الخلايا. بعد الحضانة ، يمكن الجمع بين RNPs متعددة إذا كان سيتم استهداف أكثر من موضع واحد في وقت واحد. لم تلاحظ فروق ذات دلالة إحصائية في الكفاءة مع ما يصل إلى ثلاثة مواقع في نفس الوقت.
- وفي الوقت نفسه ، قم بإعداد الخلايا للتثقيب الكهربائي. احتفظ بالخلايا في RT في جميع الأوقات لتجنب صدمات درجات الحرارة. حصاد الخلايا بعد 48 ساعة ± 2 ساعة من الثقافة في وعاء مناسب. شطف الأطباق مع DPBS لجمع أكبر عدد ممكن من الخلايا.
- أجهزة الطرد المركزي الخلايا في 200 × ز لمدة 10 دقائق في RT. تجاهل الطافع ، وإعادة تعليق الخلايا في DPBS في ~ 2 × 106 خلايا / مل.
- الجمع بين 10 ميكرولتر من محلول تريبان الأزرق 0.4 ٪ مع 10 ميكرولتر من تعليق الخلية ، والعد باستخدام مقياس الدم.
ملاحظة: في هذه المرحلة ، بسبب الخسارة أثناء الحصاد والغسيل ، توقع حوالي 60٪ من الخلايا التي تم وضعها في الثقافة قبل 48 ساعة ± 2 ساعة. - وفي الوقت نفسه ، أجهزة الطرد المركزي الخلايا في 200 × غرام لمدة 10 دقائق في RT. تخلص من المادة الطافية ، مع التأكد من تقليل أي DPBS متبقية. أعد تعليق الخلايا في المخزن المؤقت T المسخن مسبقا (RT) عند 5.55 × 107 خلايا / مل بناء على عدد الخلايا أعلاه.
- قم بإعداد نظام النقل عن طريق تشغيل الجهاز وضبطه على 1350 فولت و 15 مللي ثانية و 1 نبضة. ضع محطة الماصة داخل غطاء التدفق الصفحي
- لكل مجموعة من 10 ثقوب كهربائية ، قم بإعداد أنبوب نقل مع 3 مل من المخزن المؤقت E (لعمليات نقل 10 ميكرولتر) أو E2 (لنقل 100 ميكرولتر). أدخل الأنبوب في محطة الماصة.
- لكل 10 ميكرولتر من التثقيب الكهربائي ، اجمع بين 1.15 ميكرولتر من RNP مع 9 ميكرولتر من الخلايا. تأكد من وجود حجم كاف (+ 30٪) لتجنب شفط الهواء في طرف التثقيب الكهربائي. احتضان في RT لمدة 1-2 دقيقة قبل التثقيب الكهربائي.
- نضح 10 ميكرولتر أو 100 ميكرولتر من RNP وخليط الخلية في طرف التثقيب الكهربائي ذي الحجم المناسب على ماصة التثقيب الكهربائي ، وأدخل الماصة المحملة في محطة الماصة ، وابدأ التثقيب الكهربائي. تأكد من أن الأطراف خالية تماما من فقاعات الهواء لمنع الانحناء. راقب أثناء التثقيب الكهربائي للتحقق من عدم حدوث التقوس.
- قم على الفور بإخراج الخلايا المكهربة إلى الحجم الصغير المحضر والمسخن مسبقا من الوسط مع أو بدون rAAV6 داخل 48 بئرا (10 ميكرولتر) أو لوحة 6 آبار (100 ميكرولتر). كرر الخطوات 5.15-5.17 مع العينات المتبقية. إضافة عينات تحكم دون نقل إلى آبار الاستزراع.
- احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO 2 لمدة 4 ساعات ±2 ساعة ، ثم أضف وسط زراعة الخلايا البائية المحضرة والمسخنة مسبقا التي تحتوي على المنشطات ، DMSO ، والمضادات الحيوية / مضادات الفطريات: 450 ميكرولتر لعمليات نقل 10 ميكرولتر أو 4.5 مل لعمليات نقل 100 ميكرولتر.
- استمر في الحضانة عند 37 درجة مئوية مع 5٪ CO2 لمدة 12-24 ساعة. بعد ذلك ، قم بتغيير الوسط إلى وسط زراعة الخلايا البائية الذي يحتوي على المنشطات والمضادات الحيوية / مضادات الفطريات بدون DMSO إذا كانت الزراعة الممتدة مطلوبة. يمكن إجراء تحليل الحمض النووي الجينومي بعد 24 ساعة. يمكن استخدام PCR بالقطرات الرقمية باستخدام برايمر خارج ذراع التماثل وبرايمر داخل الملحق لتحديد كفاءة التحرير39. قم بإجراء PCRs لتضخيم موقع الإدراج وتسلسل سانجر للتحقق من التحرير الصحيح.
- لتحليل مستويات البروتين ، قم بزراعة الخلايا لمدة 40-48 ساعة بعد التثقيب الكهربائي للسماح بتغيرات تعبير البروتين ، وقم بإجراء تحليل عن طريق قياس التدفق الخلوي باستخدام الكواشف في الجدول 7.
النتائج
أدى إنتاج rAAV6 باستخدام مساعد الفيروس الغدي ذاتي الإسكات الذي يدعم التتراسيكلين إلى إنتاج 4 × 1010 GC / mL من وسط زراعة الخلايا في المتوسط ، وبالتالي تفوق على الإنتاج باستخدام نقل ثلاثي قياسي خال من المساعد بمقدار 30-40 ضعفا (الشكل 2).
أدت التنقية الاختيارية لخلايا المكاك البائية الريسوس إلى القضاء على الغالبية العظمى من خلايا CD3 + T و CD14 + و / أو خلايا CD16 + النخاعية ، مع نقاء 80٪ -95٪ CD20 + B يتم الحصول عليها بشكل روتيني (الشكل 3). استنادا إلى تصميماتنا السابقة في الخلايا البائية7 ، طورنا طريقة لتحرير خصوصية مستقبلات الخلايا البائية لخلايا المكاك البائية الريسوس مع الحفاظ في نفس الوقت على استبعاد الأليل في الغالبية العظمى من الخلايا البائية عن طريق حذف سلاسل ضوء الأجسام المضادة الداخلية من خلال تعطيل منطقتها الثابتة. قمنا ببناء HDRT بدون محفز ليتم إدخاله في موضع IGH بين آخر جين IGHJ ومحسن Eμ لخلايا المكاك البائية الريسوس (الشكل 4). يستخدم هذا البناء محفز VH الداخلي لمنطقة VDJ المعاد ترتيبها بشكل طبيعي في الخلايا البائية الناضجة ، وبالتالي لا يتم التعبير عنها بواسطة جينومات AAV العرضية. علاوة على ذلك ، يتطلب هذا البناء الربط في مناطق ثابتة من السلسلة الثقيلة للأجسام المضادة في اتجاه مجرى النهر ليتم التعبير عنها على سطح الخلية. ومن ثم، فإن ارتباط مولد الضد المحدد على سطح الخلية الموضح بقياس السريان الخلوي يشير إلى التكامل الصحيح لموضع الهدف، وأن التتابع المدرج وظيفي.
قمنا بتعبئة مثل هذا الجسم المضاد المشفر Ab1485 ، وهو مضاد لفيروس نقص المناعة البشرية bNAb40 مشتق من المكاك الريسوس ، في rAAV6 واستخدمناه لتحرير خلايا الطحال المكاك الأولية المنشطة أو مزارع PBMC ، كما هو موضح أعلاه (الشكل 5 أ). حافظ البروتوكول على قابلية عالية للخلية (~ 90٪) مع حذف تعبير السلسلة الخفيفة في ~ 80٪ من الخلايا البائية في نفس الوقت. لا تزال غالبية الخلايا البائية تعبر عن النمط المتماثل IgM (الشكل 5B). أدت إضافة rAAV6 الذي يشفر Ab1485 HDRT إلى تحرير الجينات والتعبير السطحي Ab1485 في 16٪ -21٪ من الخلايا البائية (الشكل 5A) ، وإن كان ذلك بكثافة مضان أقل لسلاسل الأجسام المضادة مقارنة بالخلايا البائية غير المحررة (الشكل 5A اللوحة اليمنى ، الشكل 5C). قد يكون هذا نتيجة لمنافسة الحواتم بين صبغة المستضد ووحيدات النسيلة المستخدمة للكشف عن BCR السطحي في قياس التدفق الخلوي ، بالإضافة إلى انخفاض التعبير البروتيني الفعلي بسبب الطبيعة متعددة السيسترونيك ل HDRT والربط الأقل كفاءة. أدت إضافة 1٪ DMSO والحضانات الموسعة والمركزة باستخدام rAAV6 HDRT بشكل عام إلى زيادة كفاءة التحرير (الشكل 6A-C). باستخدام هذه الطريقة المحددة ، عادة 5٪ -20٪ ، وما يصل إلى 40٪ ، يتم تحقيق كفاءة التحرير اعتمادا على المكاك الريسوس الفردية (الشكل 5A ، الشكل 6A-E) وجودة دفعة rAAV6 HDRT (الشكل 6E). بشكل عام ، نقدم بروتوكولات لإنتاج rAAV6 بكفاءة بالإضافة إلى زراعة وتنقية وتحرير الجينات لخلايا المكاك البائية الريسوس.
| الكواشف | حجم | رصيد | التركيز النهائي |
| DMEM ، ارتفاع الجلوكوز | 500 مل | 1 × | ~ 88.5٪ |
| FCS ، معطل حراري | 50 مل | 1 × | ~ 8.85٪ |
| مضاد حيوي / مضاد حيوي | 5 مل | 100 × | 1 × |
| الجلوتامين | 5 مل | 200 مللي متر | 2 مللي متر |
| بيروفات الصوديوم | 5 مل | 100 مللي متر | 1 مللي متر |
الجدول 1: وسط زراعة الخلايا 293AAV.
| الكواشف | حجم | رصيد | التركيز النهائي |
| DMEM ، ارتفاع الجلوكوز | 500 مل | 1 × | ~ 95.2٪ |
| FCS ، معطل حراري | 10 مل | 1 × | ~ 1.9٪ |
| مضاد حيوي / مضاد حيوي | 5 مل | 100 × | 1 × |
| الجلوتامين | 5 مل | 200 مللي متر | 2 مللي متر |
| بيروفات الصوديوم | 5 مل | 100 مللي متر | 1 مللي متر |
الجدول 2: وسط إنتاج الخلايا 293AAV.
| سلسلة التخفيف | حجم العينة (ميكرولتر) | مخفف وحجم | عامل التخفيف | التخفيف الكلي | الرقم المرجعي AAV6 |
| GC / مل | |||||
| التخفيف 1 | عينة 2 ميكرولتر أو معيار مرجعي AAV عند 4.1 × 1011 GC / mL | 18 ميكرولتر DNAseI العازلة والإنزيم | 10 × | 10 × | 4.1 س 1010 |
| التخفيف 2 | 15 ميكرولتر Dil. 1 | 60 ميكرولتر H2O | 5 × | 50 × | 8.2 س 109 |
| التخفيف 3 | 20 ميكرولتر Dil. 2 | 80 ميكرولتر H2O | 5 × | 250 × | 1.6 س 109 |
| التخفيف 4 | 20 ميكرولتر Dil. 3 | 80 ميكرولتر H2O | 5 × | 1250 س | 3.3 س 108 |
| التخفيف 5 | 20 ميكرولتر Dil. 4 | 80 ميكرولتر H2O | 5 × | 6250 ضعفا | 6.6 س 107 |
| التخفيف 6 | 20 ميكرولتر Dil. 5 | 80 ميكرولتر H2O | 5 × | 31250 س | 1.3 س 107 |
| التخفيف 7 | 20 ميكرولتر Dil. 6 | 80 ميكرولتر H2O | 5 × | 156250 س | 2.6 س 106 |
| التخفيف 8 | 20 ميكرولتر Dil. 6 | 80 ميكرولتر H2O | 5 × | 781250 س | 5.24 س 105 |
| التخفيف 9 | 20 ميكرولتر Dil. 7 | 80 ميكرولتر H2O | 5 × | 3906250 x | 1.05 س 105 |
الجدول 3: جدول تخفيف qPCR.
| الكاشف | حجم | رصيد | التركيز النهائي |
| RPMI-1640 | 420 مل | 1 × | 84% |
| FCS ، معطل حراري | 50 مل | 1 × | 10% |
| مضاد حيوي / مضاد حيوي | 5 مل | 100 × | 1 × |
| الجلوتامين | 5 مل | 200 مللي متر | 2 مللي متر |
| بيروفات الصوديوم | 5 مل | 100 مللي متر | 1 مللي متر |
| هيبس | 5 مل | 1 م | 10 مللي متر |
| 2-ب-ميركابتو-إيثانول | 550 ميكرولتر | 55 مللي متر | 55 ميكرومتر |
| الأحماض الأمينية غير الأساسية | 5 مل | 100 × | 1 × |
| الأنسولين - ترانسفيرين - السيلينيوم | 5 مل | 100 × | 1 × |
الجدول 4: وسط زراعة الخلايا البائية.
| الكاشف | التخفيف | رصيد | التركيز النهائي |
| ميجاسي دي 40 إل | 1:1000 | 100 ميكروغرام / مل | 100 نانوغرام / مل |
| كبجي ODN | 1:300 | 1 ملغ/مل | 3.33 ميكروغرام / مل |
| باف الإنسان | 1:1000 | 40 ميكروغرام / مل | 40 نانوغرام / مل |
| الإنسان IL-2 | 1:1000 | 50 ميكروغرام / مل | 50 نانوغرام / مل |
| الإنسان IL-10 | 1:1000 | 50 ميكروغرام / مل | 50 نانوغرام / مل |
الجدول 5: منشطات الخلايا البائية.
| جسم | استنساخ | التخفيف | النهائي Conc. |
| مكافحة الإنسان CD3 | إف إن-18 | 1:40 | 2.5 ميكروغرام / مل |
| CD8a المضادة للإنسان | تقنية RPA-T8 | 1:200 | 2.5 ميكروغرام / مل |
| CD14 المضادة للإنسان | M5E2 | 1:200 | 2.5 ميكروغرام / مل |
| CD16 المضادة للإنسان | 3G8 | 1:200 | 2.5 ميكروغرام / مل |
| CD33 المضادة للإنسان | AC104.3E3 | 1:50 | 1 اختبار |
| مكافحة الإنسان CD64 | 10.1 | 1:800 | 0.625 ميكروغرام / مل |
| مكافحة الإنسان CD66 | تيت2 | 1:11 | 1 اختبار |
| مكافحة الإنسان CD89 | أ 59 | 1:800 | 0.625 ميكروغرام / مل |
الجدول 6: الأجسام المضادة للنضوب الاختياري للخلايا غير البائية.
| الكاشف | النوع/الاستنساخ | تخفيف العمل / التركيز |
| مكافحة الإنسان CD14 اليكسا فلور647 | M5E2 | 1:50 |
| مكافحة الإنسان CD16 AlexaFluor700 | 3G8 | 1:50 |
| مكافحة الإنسان CD20 PECy7 | 2H7 | 1:50 |
| مكافحة الإنسان CD3 PE | SP34-2 | 1:50 |
| غيبوبة-نير | - | 1:500 |
| مكافحة الإنسان HLA-DR BV605 | إل243 | 1:200 |
| مكافحة الإنسان Ig سلسلة خفيفة لامدا APC | MHL-38 | 1:50 |
| مكافحة الإنسان كابا سلسلة خفيفة FITC | متعدد النسيلة | 1:500 |
| مكافحة الإنسان IgM BV421 | MHM-88 | 1:50 |
| مستضد RC1 ، بيوتينيل عشوائي | - | 5 ميكروغرام / مل |
| ستربتافيدين PE | - | 1:500 |
الجدول 7: كواشف التدفق الخلوي للتحليل.
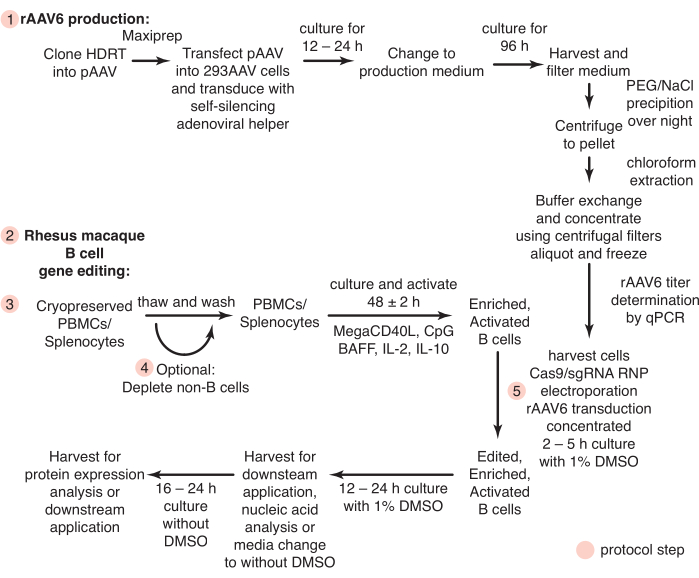
الشكل 1: نظرة عامة تخطيطية على إنتاج rAAV6 والتحرير الجيني لخلايا المكاك البائية الريسوس الأولية. تنقسم البروتوكولات إلى إنتاج rAAV6 (الخطوة 1) والتحرير الجيني لخلايا المكاك البائية الريسوس (الخطوات 2-5) ، بما في ذلك خطوة اختيارية لاستنفاد الخلايا غير البائية (الخطوة 4). يشار إلى الخطوات في البروتوكولات بدوائر حمراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
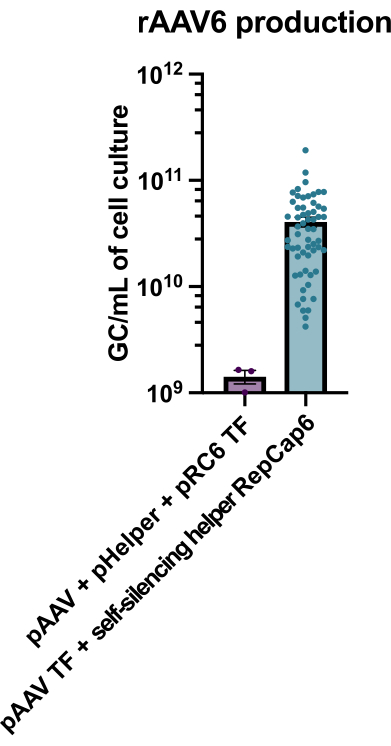
الشكل 2: غلة عالية من rAAV6 باستخدام مساعد فيروسي غدي ذاتي الإسكات. تم إنتاج rAAV6 باستخدام الطرق الموضحة هنا (نقل pAAV [TF] + مساعد الإسكات الذاتي RepCap6 ، مساعد الفيروس الغدي ذاتي الإسكات) أو النقل الثلاثي النموذجي الخالي من المساعد ل pAAV و pHelper و pRepCap6 (pRC6). تم تنقية rAAV6 من طافية الخلية فقط. أنتجت الطرق التي تستخدم النواقل المساعدة للفيروسات الغدية ذاتية الإسكات 30-40 ضعفا أكثر من rAAV الذي تمت معايرته بواسطة qPCR ، كما هو موضح أعلاه. تمثل كل نقطة إنتاج rAAV فرديا باستخدام تركيبات pAAV مختلفة من 2 إلى 20 تجربة مستقلة. يتم رسم متوسط ± SEM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
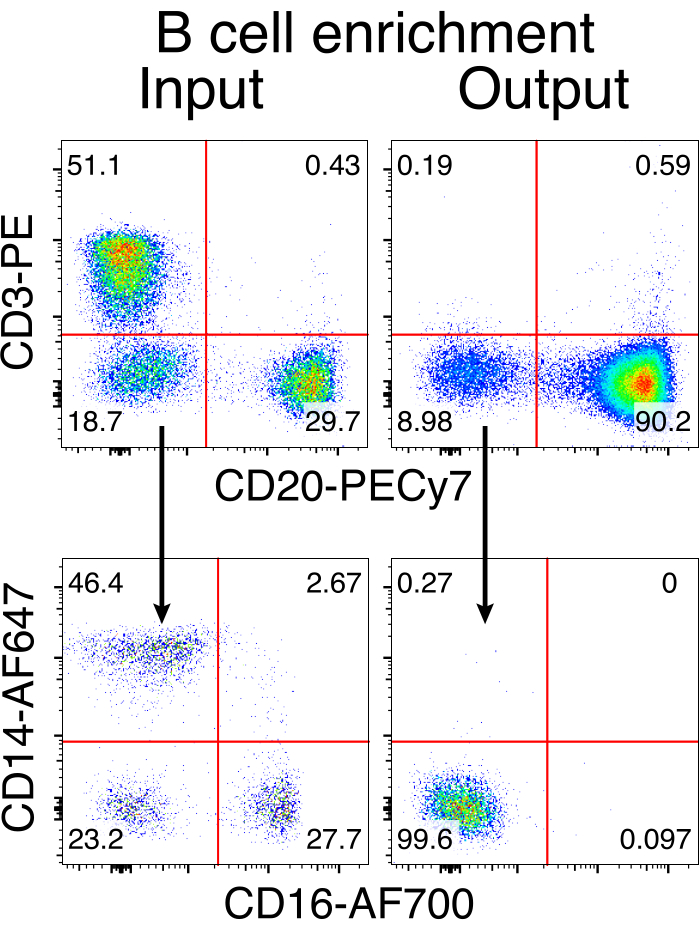
الشكل 3: إثراء الخلايا البائية بالنفاد السلبي للخلايا غير البائية. تم إثراء خلايا المكاك البائية الريسوس من PBMCs باستخدام البروتوكول الموصوف وتخصيبها إلى نقاء 90٪. يتم عرض مدخلات ومخرجات ما قبل التخصيب بعد الإثراء. بوابات على PBMCs الحية والمفردة. ممثل خمس تجارب مستقلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
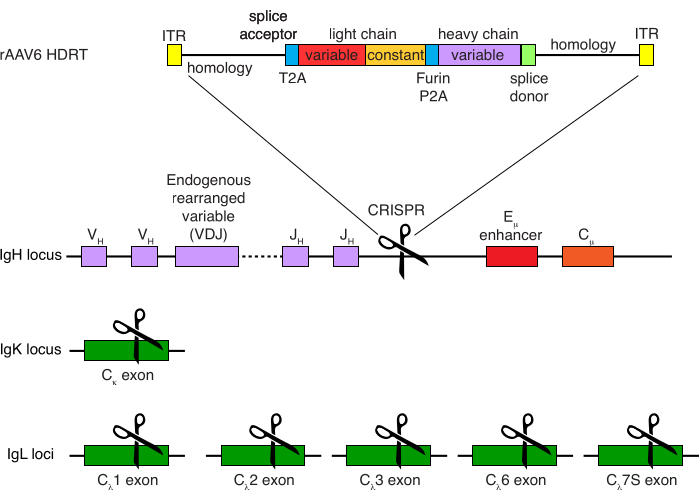
الشكل 4: استراتيجية الاستهداف المستخدمة لتحرير خصوصية مستقبلات الخلايا البائية لقرود المكاك الريسوس. تم إنتاج rAAV6 الذي يحتوي على HDRT المصور. يتكون HDRT من ذراع تماثل 266 bp 5 '، متبوعا ب 111 bp من متقبل لصق المكاك IGHM exon 1 ، ثم رابط GSG مع تسلسل الببتيد 2A ذاتي الشق لفيروس Thosea asigna (T2A) ، متبوعا بتسلسل رائد وسلسلة ضوئية كاملة من الجسم المضاد لقرود المكاك الريسوس Ab1485 مثل مكاك الريسوس IGLC1. يتبع ذلك موقع انقسام فورين ، ورابط GSG ، وتسلسل ببتيد 2A ذاتي الشق لفيروس الخنزير teschovirus (Furin-P2A) ، متبوعا بتسلسل قائد آخر ومتغير السلسلة الثقيلة Ab1485 ، متبوعا ب 52 نقطة أساس من تسلسل مانح لصق المكاك IGHJ4 من المكاك الريسوس ، للسماح بالربط في مناطق ثابتة للسلسلة الثقيلة للأجسام المضادة ، وذراع تماثل 514 bp. تم استهداف هذا البناء في موضع IGH بين جين IGHJ الأخير ومحسن Eμ باستخدام تسلسل هدف sgRNA GAGATGCCAGAGCAAACCAG. تم تصميم كلا ذراعي التماثل لينتهي في موقع القطع لهذا sgRNA ، وبالتالي إزالة التسلسل المستهدف والسماح بكفاءة التكامل المثلى. في الوقت نفسه ، للحفاظ على استبعاد الأليل والتعبير عن مستقبل خلية بائية واحدة ، قمنا بحذف سلاسل الضوء الداخلية باستخدام sgRNAs التي تستهدف المكاك الريسوس IGKC مع التسلسل المستهدف GGCGGGAAGATGAAGACAGA و IGLC1 و IGLC2 و IGLC3 و IGLC6 و IGLC7S باستخدام التسلسل المستهدف CTGATCAGTGACTTCTACCC. تضمن HDRT طفرات صامتة تمنع انشقاق تسلسل IGLC1 بواسطة sgRNA هذا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
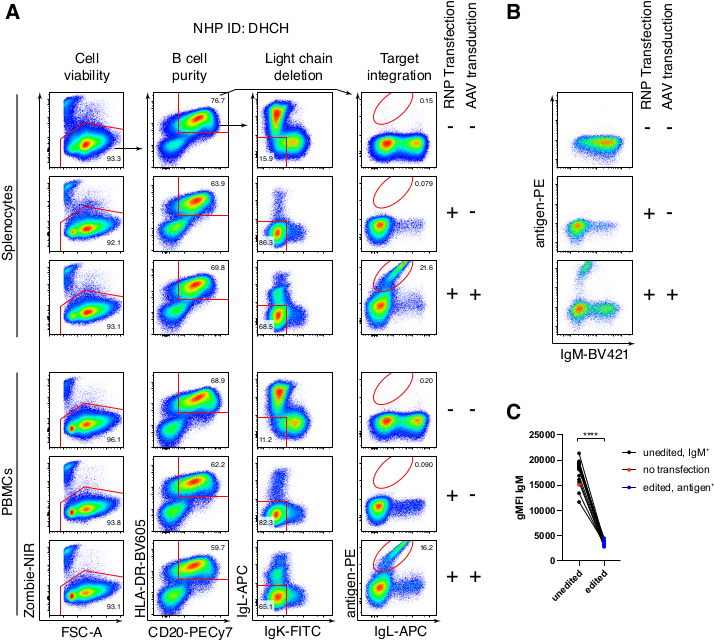
الشكل 5: التحرير الجيني لخلايا المكاك البائية الريسوس الأولية . (أ) تم استزراع الخلايا الطحالية الأولية (اللوحة العلوية) أو PBMCs (اللوحة السفلية) من نفس المكاك الريسوس دون استنفاد الخلايا غير البائية وتحريرها كما هو موضح أعلاه. كانت استراتيجية الاستهداف كما هو موضح في الشكل 4. بعد يومين من التثقيب الكهربائي ، تم حصاد الخلايا وتلطيخها سطحيا لتحليل التدفق الخلوي. تم إغلاق العمود الأيسر على خلايا مفردة ، ثم تم إدخال الأعمدة الأخرى ، كما هو موضح في الصف العلوي. يشار إلى صلاحية الخلايا ، ونقاء الخلايا البائية ، وكفاءة حذف سلاسل الضوء ، وكفاءة الضرب في Ab1485 عن طريق تلطيخ المستضد المحدد RC141 في العينات غير المعالجة أو المنقولة RNP أو RNP المنقولة + rAAV6 (MOI = 5 × 105). ممثل ست تجارب مستقلة مع خلايا من المكاك الريسوس المختلفة. (B) تعبير IgM على عناصر التحكم في خلية المكاك البائية المستزرعة أو بعد التحرير و (C) المتوسط الهندسي لشدة التألق (gMFI) ل IgM على الخلايا البائية التي لم تفقد تعبير Ig بسبب استهداف IgLC و IgKC (غير محرر) أو الخلايا البائية التي تربط المستضد المتوقع (محرر). تشير النقطة الحمراء إلى gMFI للخلايا البائية الضابطة غير المنقولة المستزرعة. يشير إلى p < 0.0001 في اختبار t المقترن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
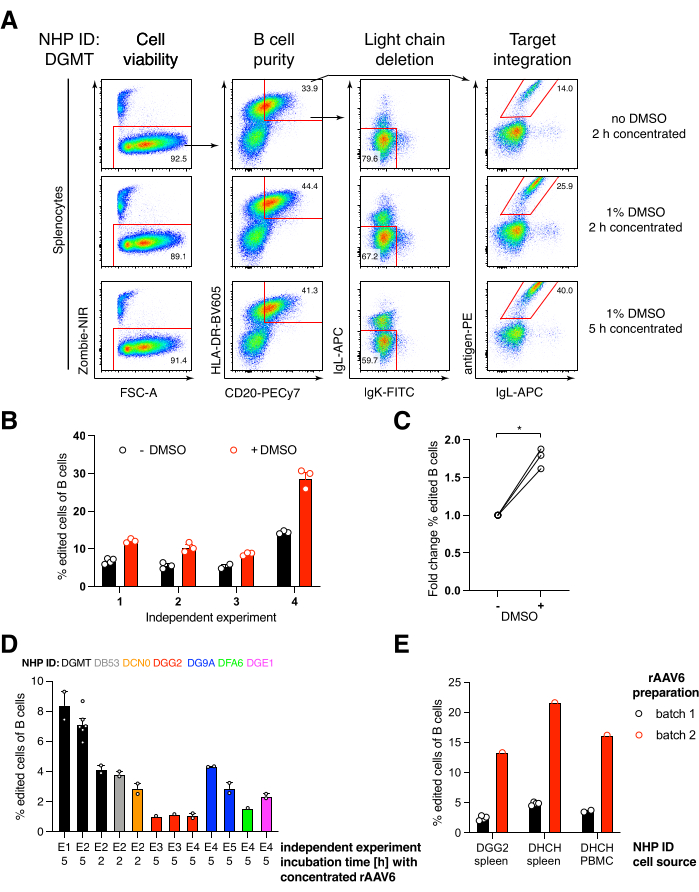
الشكل 6: تأثيرات DMSO ، والحضانة المركزة المطولة باستخدام rAAV6 HDRT ، وجودة دفعة rAAV ، وقابلية التكاثر بين مختلف NHPs المانحة على كفاءة تحرير الجينات في الخلايا البائية لقرود المكاك الريسوس الأولية. (أ) تمت زراعة الخلايا الطحالية وتحريرها كما هو موضح. بعد التثقيب الكهربائي ، تم استزراع 5 × 10 5 خلايا في وسط مع أو بدون 1٪ DMSO وتم تحضينها في 50 ميكرولتر من الوسط الذي يحتوي على rAAV6 HDRT عند MOI من 5 × 10 5 لمدة 2 ساعة أو5 ساعات قبل إضافة 450 ميكرولتر أخرى من الوسط. تم تحليل الخلايا بعد 2 أيام من التثقيب الكهربائي عن طريق قياس التدفق الخلوي ، كما في الشكل 5. ممثل أربع تجارب مستقلة. ب: القياس الكمي ل (أ) على أربع تجارب مستقلة. تشير النقاط إلى النسخ المتماثلة التقنية مع إعدادات نقل تبلغ 1350 فولت و 10-20 مللي ثانية ومدة التثقيب الكهربائي للنبضة الواحدة وتركيزات DMSO تتراوح من 0.75٪ إلى 1.25٪. (ج) متوسط التغير في كفاءة التحرير من (ب). * p > 0.05 في اختبار Mann-Whitney U. (د) تحرير الكفاءات على التجارب المستقلة مع المكاك المختلفة باستخدام دفعة rAAV6 التجارية منخفضة الكفاءة. (ه) كفاءة التحرير باستخدام دفعتين تجاريتين مختلفتين من rAAV6 حيث تم حزم نفس البنية في الخلايا البائية لاثنين من NHPs مختلفين في نفس التجربة. تشير النقاط إلى النسخ المتماثلة التقنية مع إعدادات نقل 1,350 فولت و 10-20 مللي ثانية و 1 نبضة كهربائية ثقبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توفر البروتوكولات المعروضة هنا طريقة سريعة وفعالة لتوليد غلات عالية وعيار من rAAV6s مثل HDRTs وطرق جديدة لتحرير الجينات بكفاءة خلايا المكاك البائية الأولية في المختبر.
بروتوكول إنتاج rAAV6 بسيط وسريع نسبيا ، مما يسمح بإنتاج واختبار العديد من التركيبات المختلفة في وقت واحد دون عمالة مفرطة. إذا رغبت في ذلك ، يمكن تنقية rAAV6 بشكل أكبر باستخدام البروتوكولات المعمول بها مثل الطرد المركزي الفائق التدرج اليوديكسانول34 أو التقسيم المائي على مرحلتين35 قبل التبادل المؤقت والتركيز.
على الرغم من أنه قلل من العائد الإجمالي ، فقد اخترنا استخدام وسط زراعة الخلايا المختزلة بالمصل فقط لتنقية rAAV6 بدلا من التنقية من حبيبات الخلية ، حيث يتم إطلاق غالبية rAAV6 في الوسط36 ، والتنقية من حبيبات الخلية تضيف المزيد من التكلفة والعمالة. أدى استخدام مساعد الفيروس الغدي المعطل ذاتيا إلى زيادة الغلة 30-40 ضعفا في المتوسط ، مما يسمح باختبار التركيبات المعبأة في AAV6 في طبق واحد 15 سم. على الرغم من أن طريقة التنقية لدينا أساسية ، باستخدام هذه الطريقة ، نحصل على تباين ضئيل نسبيا من دفعة إلى أخرى في كفاءة تحرير الجينات أو صلاحية الخلية بعد النقل باستخدام خطوط خلايا مختلفة أو خلايا أولية أخرى (البيانات غير معروضة).
لقد طورنا بروتوكول تنقية الخلايا البائية لقرود المكاك الريسوس للحصول على الخلايا البائية الأولية التي لم تمسها باستخدام النضوب السلبي للسكان غير المرغوب فيهم. على الرغم من أنه ليس ضروريا لتحرير الجينات لهذه الخلايا ، إلا أنه يوفر طريقة للحصول على مجموعة نقية نسبيا من خلايا المكاك البائية الريسوس الأولية لهذا التطبيق أو غيره من التطبيقات في حالة تداخل أنواع الخلايا الأخرى مع الأهداف التجريبية. ومع ذلك ، فإن النقاء يأتي على حساب انخفاض إنتاجية الخلايا البائية الإجمالية. والجدير بالذكر أنه بالنسبة لكل من مزارع الخلايا البائية المخصبة وغير المخصبة ، فإن جزء الخلايا البائية في الاستعدادات الأولية ل PBMC أو الخلايا الطحالية أمر بالغ الأهمية. بالنسبة ل PBMCs على وجه الخصوص ، نوصي بفحص المكاك المختلفة للأفراد الذين لديهم نسبة عالية من الخلايا البائية في الدم المحيطي للحصول على أعداد كبيرة من الخلايا البائية للتجارب ، حيث يمكن أن تختلف هذه القيمة بشكل كبير بين الأفراد27. يمكن الحصول على PBMCs عن طريق النزيف المنتظم أو فصادة الكريات البيض42.
يؤدي بروتوكول تحرير الجينات إلى تحرير الجينات بكفاءة ، عادة ما بين 60٪ -80٪ من الضربة القاضية و 5٪ -20٪ من الخلايا البائية ، على الرغم من أننا حققنا ما يصل إلى 90٪ من BCR بالضربة القاضية و 40٪ من الخلايا البائية الضربة القاضية BCR (الشكل 5 والشكل 6).
المعلمات الرئيسية للتحرير الفعال لخلايا المكاك البائية الريسوس هي كفاءة القطع ل sgRNA ، ومعلمات التثقيب الكهربائي ، و MOI ، وجودة تحضير rAAV6. وينبغي تحديد كفاءات القطع في البروتوكولات النووية الراديوية المرشحة تجريبيا للسماح بالتحرير والتصميم الأمثل لتقنية HDRT. تعمل معلمات التثقيب الكهربائي المعروضة هنا على موازنة الكفاءة مع الجدوى للحصول على الحد الأقصى من العدد الإجمالي للخلايا البائية المحررة بدلا من أعلى نسبة مئوية من الخلايا البائية المحررة. إذا كانت هناك حاجة إلى نسبة أعلى من الخلايا المحررة ، يوصى بزيادة الفولتية (حتى 1750 فولت) أو تغيير أطوال النبضات (10-30 مللي ثانية) ، على الرغم من أنه يمكن ملاحظة المزيد من موت الخلايا. لاحظنا أيضا كفاءات تحرير أعلى قليلا في الخلايا البائية الطحالية مقارنة بالخلايا البائية من PBMCs من نفس الفرد (الشكل 5) ؛ ومع ذلك ، فإن السبب الكامن وراء ذلك غير معروف حاليا.
وجدنا أن إضافة 1٪ DMSO بعد التثقيب الكهربائي زاد بشكل كبير من كفاءة تحرير الجينات بنسبة ~ 40٪ في خلايا المكاك B الريسوس دون التأثير على صلاحية الخلية (الشكل 6A-C) ، بما يتماشى مع التقارير في الخلايا الأخرى43. ومع ذلك ، يجب تجنب الثقافة الممتدة في 1٪ DMSO وقد تؤثر على صلاحية الخلية. قد يتم حذف DMSO تماما إذا رغبت في ذلك.
تؤدي ثقافة الخلايا في حجم صغير بعد التثقيب الكهربائي لعدة ساعات مع rAAV6 إلى زيادة كفاءة التحرير ، ربما بسبب النقل الأفضل ل HDRT بواسطة rAAV6 ، وبالتالي ، ارتفاع تركيز HDRT داخل الخلايا في الوقت المناسب عندما يكون Cas9 نشطا. وجدنا أن زراعة الخلايا بهذه الطريقة لمدة تصل إلى 8 ساعات لم يؤثر على صلاحية الخلية ، لكن كفاءات التحرير لم تزيد بشكل كبير عن 5 ساعات (الشكل 6). إذا كانت الضربة القاضية فقط بدلا من الضربة القاضية مطلوبة ، فقد يتم حذف هذه الخطوة.
في الختام ، نقدم بروتوكولات شاملة لتحرير الجينات لخلايا المكاك البائية الريسوس في المختبر وإنتاج rAAV6 HDRT الضروري للطرق الفعالة للتركيبات المرغوبة. تتيح هذه البروتوكولات إجراء اختبار سريع وفعال من حيث التكلفة للعديد من التركيبات المعبأة على أنها rAAV6 وتمكن من إجراء اختبار ما قبل السريري لجدوى وقابلية التوسع في علاجات الخلايا البائية في نموذج رئيسي غير بشري أكثر صلة.
Disclosures
لم يتم الإعلان عن أي مصالح متنافسة.
Acknowledgements
نود أن نشكر هاري ب. جريستيك وباميلا بيوركمان على توفير مستضد RC1 ومختبرات Nussenzweig وMartin بأكملها للمناقشة النقدية. تم دعم هذا العمل من خلال منحة مؤسسة بيل وميليندا غيتس INV-002777 (إلى MCN) وبرنامج البحوث الداخلية للمعهد الوطني للحساسية والأمراض المعدية ، المعاهد الوطنية للصحة. (ر. ج. و م. أ. م). M.C.N. هو محقق HHMI.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
References
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. Protein Electrophoresis - Serum., 6th edition. , Elsevier Saunders. St Louis, MO. 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850(2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851(2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995(2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630(2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934(2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144(2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973(2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855(2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182(2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168(2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686(2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991(2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved