Method Article
Edição Gênica de Células B Primárias de Macaco Rhesus
Neste Artigo
Resumo
Apresentamos um método de cultura e edição gênica de células B primárias de macaco rhesus usando CRISPR/Cas9 e vírus adenoassociado recombinante sorotipo 6 para o estudo de terapias com células B.
Resumo
As células B e sua progênie são as fontes de anticorpos altamente expressos. Suas capacidades de alta expressão de proteínas, juntamente com sua abundância, fácil acesso via sangue periférico e facilidade para transferências adotivas simples, tornaram-nas um alvo atraente para abordagens de edição genética para expressar anticorpos recombinantes ou outras proteínas terapêuticas. A edição genética de células B primárias humanas e de camundongos é eficiente, e modelos de camundongos para estudos in vivo têm se mostrado promissores, mas a viabilidade e escalabilidade para modelos animais maiores até agora não foram demonstradas. Por isso, desenvolvemos um protocolo de edição in vitro de células B primárias de macaco rhesus para viabilizar tais estudos. Relatamos condições para cultura in vitro e edição gênica de células B primárias de macaco rhesus a partir de células mononucleares ou esplenócitos do sangue periférico usando CRISPR/Cas9. Para alcançar a integração direcionada de grandes (<4,5 kb), um protocolo rápido e eficiente foi incluído para preparar o sorotipo 6 do vírus adenoassociado recombinante como um modelo de reparo dirigido por homologia usando um vetor auxiliar adenoviral autosilenciador habilitado para tetraciclina. Estes protocolos possibilitam o estudo da terapêutica prospectiva de células B em macacos rhesus.
Introdução
As células B são a base da imunidade humoral. Após ativação por antígeno cognato e sinais secundários, as células B virgens dão origem às células B do centro germinativo, às células B de memória e aos plasmócitos1. Esta última é a fonte dos anticorpos secretados que medeiam as funções protetoras da maioria das vacinas atualmente disponíveis2. Os plasmócitos têm sido descritos como fábricas de anticorpos, pois secretam grandes quantidades de anticorpos no soro - cerca de 2 ng/dia/célula3, totalizando 7-16 g/L de soro, tornando os anticorpos uma das três proteínas mais abundantes no soro4. As células B são abundantes no sangue e podem, portanto, ser facilmente obtidas e infundidas de volta em um indivíduo.
Essas características tornaram as células B um alvo dos esforços de terapia celular para editar genes o receptor de células B (BCR) e expressar anticorpos amplamente neutralizantes (bNAbs) contra o vírus da imunodeficiência humana (HIV)5,6,7,8,9,10,11,12,13,14,15 e outras proteínas 16, 17,18,19,20,21. Tais abordagens têm mostrado potencial em inúmeros estudos in vivo em camundongos7,8,10,11,16,22. No entanto, vários obstáculos ainda precisam ser superados para a tradução clínica9,15,23, entre eles a segurança, a duração e a magnitude da eficácia terapêutica, bem como a escalonamento para animais maiores, como primatas não humanos (NHPs). De fato, os NHPs, e em particular os macacos rhesus, que têm uma longa história na pesquisa de anticorpos e HIV24,25, são o modelo mais adequado para testar esses parâmetros.
Aqui, desenvolvemos protocolos que permitem que essas questões sejam abordadas. Até o momento, poucos estudos tentaram cultivar células B de macaco rhesus ex vivo, e apenas a seleção positiva usando CD20 foi relatada para a purificação de células B de macaco rhesus26,27,28. Estabelecemos um protocolo para o isolamento de células B de macaco rhesus intocadas pela depleção negativa de outros tipos celulares. Além disso, condições de cultivo são definidas para a edição gênica direcionada de células B de macaco rhesus. Este protocolo descreve o uso de ribonucleoproteínas CRISPR/Cas9 (RNPs) e vírus adenoassociado recombinante sorotipo 6 (rAAV6) como modelo de reparo dirigido por homologia (HDRT) para editar genes de células B de macaco rhesus cultivadas. Usando este protocolo, eficiências de edição de até 40% com insertos grandes (~1,5 kb) foram alcançadas. Também apresentamos um método rápido e econômico para produzir rAAV6 usando um auxiliar adenoviral autosilenciante habilitado para tetraciclina29 para permitir o teste rápido de HDRTs nesse formato. Combinados, esses protocolos descrevem um fluxo de trabalho eficiente para a edição gênica de células B de macaco rhesus (Figura 1), permitindo a avaliação de terapias com células B em um modelo de NHP.
Para iniciar os experimentos, o material doador pode ser encomendado de fontes comerciais ou obtido por flebotomias ou esplenectomia. Neste estudo, as flebotomias e coletas de sangue foram realizadas conforme descritoanteriormente30 utilizando o anticoagulante EDTA. Para a obtenção de células B esplênicas, primárias de macaco rhesus, foram realizadas esplenectomias parciais (25%-50%) ou totais, utilizando técnicas relatadasanteriormente31. Os animais permaneceram em jejum durante a noite antes da cirurgia. Resumidamente, durante a cirurgia, o abdome foi clipado e preparado com esfoliação alternada de clorexidina e álcool isopropílico a 70% três vezes. Uma incisão (5-10 cm) foi feita no abdome para identificar e isolar o baço. A vasculatura do baço foi ligada com suturas ou pinças vasculares. A incisão foi fechada em duas camadas com pontos de polidioxanona PDS 4-0. A esplenectomia foi realizada uma única vez para um animal individual. Suspensões unicelulares foram preparadas a partir de baços de macacos por maceração através de filtros celulares. Células mononucleares de suspensões de sangue e células esplênicas foram preparadas por centrifugação por gradiente de densidade e armazenadas em nitrogênio líquido.
Protocolo
Todos os procedimentos e experimentos com animais foram realizados de acordo com protocolos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Instituto Nacional de Alergia e Doenças Infecciosas do National Institutes of Health. Um resumo dos protocolos a seguir é apresentado na Figura 1. Macacos rhesus (Macaca mulatta), machos e fêmeas, de origem genética indiana, com idades entre 2 e 8 anos, foram alojados e cuidados de acordo com as diretrizes do Comitê de Cuidados e Uso de Animais de Laboratório em uma instalação de nível de biossegurança 2.
CUIDADO: Todos os experimentos foram realizados de acordo com as precauções universais para patógenos transmitidos pelo sangue, com técnicas estéreis/assépticas e equipamento adequado de nível 2 de biossegurança em capelas de fluxo laminar.
1. Produção de rAAV6
- Preparar os reagentes para a produção de rAAV6.
- Projetar e clonar o molde de reparo dirigido por homologia entre as repetições terminais invertidas (ITRs) de AAV2 no pAAV vetorial usando técnicas padrão. Certifique-se de que os braços de homologia sejam de pelo menos ~250 bp em ambos os lados, mas tão pouco quanto 60 bp podem ser suficientes, embora braços de homologia mais longos sejam preferidos se o design de construção permitir. Se as sequências alvo de qualquer um dos sgRNAs usados estiverem presentes na HDRT, remova-as usando mutações silenciosas, que são mais eficazes no motivo adjacente do protoespaçador ou na região da semente do local alvo.
NOTA: A síntese de genes combinada com a montagem de Gibson para clonagem eficiente32 pode ser realizada. Prepare um Maxiprep de um clone correto para transfecção. Para o design de sgRNA, o CHOPCHOP33 é recomendado, e uma lista de mais ferramentas pode ser encontrada em https://zlab.bio/guide-design-resources. A capacidade máxima de embalagem para AAV incluindo ITRs é de ~4,7 kb. AAV6 é o sorotipo mais comumente usado para edição de células hematopoéticas, particularmente células B9. Outros sorotipos de AAV para edição gênica de células B de macaco rhesus não foram testados, mas AAV28 e AAV-DJ10,11 foram usados em estudos em camundongos. - Preparar meio de cultura 293AAV e meio de produção de acordo com a Tabela 1 e Tabela 2. Filtro estéril através de uma unidade filtrante de membrana de polietersulfona (PES) de 0,2 μm. Conservar a 4 °C.
- Preparar 1x solução de polietilenimina (PEI) (1 mg/mL, 100 mL).
- Em um copo de vidro de 250 mL, aqueça ~ 70 mL de H2O em um micro-ondas por ~30 s e, em seguida, adicione 100 mg de PEI. Adicione um agitador magnético e mexa até que o PEI esteja praticamente dissolvido.
- Ajuste o pH para 7 com HCl 1 M, depois completar até 100 mL com H2O, aguarde 10 min, verifique o pH novamente e ajuste se necessário.
- Filtre estéril a solução de PEI através de uma unidade filtrante de membrana de PES de 0,2 μm, alíquota, e armazene −20 °C. Após o descongelamento, a solução pode ser armazenada a 4 °C por até 2 meses.
- Preparar 5x solução de polietilenoglicol (PEG)/NaCl.
- Pesar 400 g de PEG 8.000 e 24 g de NaCl.
- Adicione um agitador magnético a um copo de vidro de 2 L, adicione o PEG 8.000 e o NaCl pesados e enxágue com ~ 550 mL de água deionizada.
- Mexa com o aquecimento e deixe ferver ou 80-90 °C até dissolver completamente.
- Ajuste o pH para ~7,4 com NaOH 1 M, depois ajuste o volume para 1 L usando um cilindro de medição e transfira-o para uma garrafa de vidro de 2 L com o agitador magnético.
- Autoclave o frasco, o agitador magnético e a solução em banho-maria por 30 min a 121 °C.
- Após a autoclavagem, resfriar a solução em uma câmara fria enquanto agita usando o agitador magnético para evitar a separação em diferentes fases. Alíquota, se necessário, e conservar a 4 °C.
- Prepare o tampão de formulação.
- Misturar 500 mL de DPBS com 50 μL de F-68 Plurônico a 10%. Filtrar estéril através de uma unidade de filtro de membrana de PES de 0,2 μm e armazenar à temperatura ambiente (TR).
- Projetar e clonar o molde de reparo dirigido por homologia entre as repetições terminais invertidas (ITRs) de AAV2 no pAAV vetorial usando técnicas padrão. Certifique-se de que os braços de homologia sejam de pelo menos ~250 bp em ambos os lados, mas tão pouco quanto 60 bp podem ser suficientes, embora braços de homologia mais longos sejam preferidos se o design de construção permitir. Se as sequências alvo de qualquer um dos sgRNAs usados estiverem presentes na HDRT, remova-as usando mutações silenciosas, que são mais eficazes no motivo adjacente do protoespaçador ou na região da semente do local alvo.
- Cultura celular, transfecção e transdução para produção de rAAV6
- Descongelar, cultivar e congelar células de 293AAV conforme descrito pelo fabricante usando o meio de cultura 293AAV acima e tripsina-EDTA para divisão. Recomenda-se congelar algumas passagens iniciais e usar as células para produção de AAV antes que elas atinjam a passagem 40.
- Para a produção de rAAV6, semear quatro placas de cultura celular de 15 cm com 5 x 106 células em 30 mL cada. As células estão prontas para transfecção geralmente 1-2 dias após a semeadura, quando atingem 80%-90% de confluência.
- Descongelar um Maxiprep do plasmídeo pAAV contendo o HDRT para ser embalado em AAV6. Ressuspender 85,6 μg do plasmídeo pAAV em 3 mL de meio DMEM puro.
- Dissolver 342 μL de 1 mg/mL de solução de PEI em 3 mL de meio DMEM puro. Incubar ambas as soluções por 10 min no TR.
- Misture ambos os tubos de 3 mL em um tubo de ~6,4 mL de mistura de transfecção e incube por 20 min em RT.
- Enquanto isso, descongele o vetor auxiliar habilitado para tetraciclina RepCap6 do freezer de -80 °C em banho-maria de 37 °C. Para transduzir as células 293AAV, adicionar o vetor auxiliar a uma multiplicidade de infecção (MOI) de 25 usando a dose infecciosa mediana de cultura de tecido (TCID 50) e assumindo 1,15 x10 7 células/placa; normalmente, 2-10 μL é usado por prato de 15 cm. Agite e gire os pratos suavemente para distribuir.
- Após a incubação da mistura de transfecção, adicione 1,6 mL em cada uma das quatro placas de 15 cm. Incubar a 37 °C e 5% CO2 durante a noite.
NOTA: Alternativamente, se os vetores rAAV6 de interesse já estiverem disponíveis, esses vetores podem ser usados para fornecer o genoma viral a ser empacotado, o que nega a necessidade de quaisquer plasmídeos com este sistema e produz títulos rAAV6 comparáveis. Para esta abordagem, as células 293AAV são co-transduzidas com o rAAV6 desejado em um MOI de 50 (baseado em cópias do genoma do rAAV6 [GC]/mL) juntamente com o vetor auxiliar. - No dia seguinte, aspirar e descartar cuidadosamente o meio de cultura e substituir por 30 mL de meio de produção pré-aquecido. Incubar por mais 96 h antes da colheita. Nenhuma outra mudança de meio é recomendada para maximizar os rendimentos.
- Colheita e purificação do AAV6 recombinante do meio
- Sem deslocar as células da placa, colete todo o sobrenadante celular em uma unidade filtrante com uma membrana de PES de 0,2 μm pelo menos 50% maior do que o volume do meio a ser filtrado. Em seguida, filtre o sobrenadante.
OBS: Se forem desejados maiores rendimentos de rAAV6, as células podem ser colhidas e o rAAV extraído do pellet celular utilizando kits comerciais ou protocolos estabelecidos34,35. Como o AAV6 é secretado principalmente para o meio36, apenas sobrenadante foi usado, reduzindo mão de obra, custo e tempo. - Adicionar 5x solução de PEG/NaCl ao sobrenadante filtrado a 25% do volume coletado; isso é tipicamente 30 mL se quatro placas de 15 cm de 30 mL forem usadas.
- Misture bem invertendo e, em seguida, incube durante a noite a 4 °C para precipitar as partículas virais.
NOTA: As partículas de AAV são estáveis por até 2 dias nesta solução. - Pré-resfriar uma centrífuga de balde oscilante com 250 mL de insertos de tubo a 4 °C. Preparar uma unidade de filtro centrífugo de 4 mL com um ponto de corte de 100 kDa e um filtro de seringa de PES hidrofílico de 0,22 μm pré-tratando cada membrana com 2 mL de F-68 Plurônico a 10% por pelo menos 1 h em RT.
- Transfira a mistura AAV-PEG/NaCl para um tubo de 250 mL, centrifugar a 2.500 x g por 1 h a 4 °C e, em seguida, remover cuidadosamente todo o sobrenadante por aspiração.
- Ressuspender a pastilha viral bege a branca por vórtice em 4 mL de HEPES 1 M até ressuspender totalmente. Se necessário, deixe repousar por 5 min, e volte a vomitar. Ressuspender com pipeta sorológica de 5 mL e transferir o volume total para um tubo de 15 mL.
- Em um exaustor, adicione um volume igual de clorofórmio à suspensão do vírus - normalmente 4 mL.
- Vórtice vigorosamente por 2 min e, em seguida, centrifugue a 1.000 x g por 5 min no RT.
- Coletar a camada superior (sobrenadante contendo AAV) em um novo tubo de 50 mL e descartar a camada inferior (clorofórmio).
CUIDADO: Soluções contendo clorofórmio são resíduos perigosos. Seguir as orientações institucionais para seu descarte. - Coloque o sobrenadante contendo AAV sob uma capela de fumo e deixe evaporar o clorofórmio restante durante 30 minutos.
- Enquanto isso, lave a unidade de filtro centrífugo pré-tratado e o filtro de seringa.
- Adicionar 1,5 ml de tampão de formulação à unidade filtrante centrífuga pré-tratada. Centrifugar a 3.500 x g por 10 min a 15 °C em um rotor de caçamba oscilante. Repita esta etapa com 4 mL de tampão de formulação para lavar a membrana.
- Enxaguar o filtro da seringa duas vezes com 5 mL de tampão de formulação usando uma seringa de 5 mL.
- Coloque o sobrenadante contendo ~4 mL de AAV da extração de clorofórmio em uma seringa de 5 mL, conecte o filtro de seringa lavado e filtre diretamente na unidade de filtro centrífugo.
- Centrifugar a 3.500 x g durante 25 minutos a 15 °C e, em seguida, confirmar se a solução de AAV no filtro está entre 50-100 μL. Se o volume da solução for de >100 μL, continue a centrifugar.
- Depois de remover o filtrado, adicionar 4 mL de tampão de formulação dentro do copo da unidade filtrante centrífuga e misturar a solução uniformemente por pipetagem. Centrifugar a 3.500 x g durante 25 minutos a 15 °C e, em seguida, confirmar se a solução de AAV no filtro está entre 50-100 μL. Se o volume da solução for de >100 μL, continue a centrifugar. Repita este passo para outra lavagem.
- Após a centrifugação final, confirmar se o volume da solução é de 50-70 μL; se não, continue a centrifugar. Transfira a preparação para um tubo de 1,5 mL. Alíquota, se desejar, e armazenar a -80 °C.
- Sem deslocar as células da placa, colete todo o sobrenadante celular em uma unidade filtrante com uma membrana de PES de 0,2 μm pelo menos 50% maior do que o volume do meio a ser filtrado. Em seguida, filtre o sobrenadante.
- Determinação de títulos de AAV6 recombinante por qPCR
NOTA: Os primers qPCR recozidos na região ITR devem, portanto, ser adequados para todas as construções clonadas em pAAV.- Descongelar uma alíquota do rAAV6 a ser titulado e uma alíquota do material de referência AAV6. O material de referência AAV6 deve estar próximo de 4 x 1011 GC/mL; caso contrário, ajuste as diluições em conformidade.
- Realizar um digestor DNase I para remover qualquer DNA plasmidial livre remanescente na preparação rAAV6 combinando 2,0 μL da amostra ou material de referência AAV6 com 15,6 μL de H 2 O livre de nuclease,2,0μL de tampão 10x DNase I e 0,4 μL de DNase I.
- Misture e incube suavemente durante 30 minutos a 37 °C e, em seguida, transfira para o gelo. Trata-se da diluição 1 (ver Tabela 3).
- Preparar diluições seriadas de cinco vezes de todas as amostras e do material de referência AAV6, tal como indicado no quadro 3 abaixo, com água.
- Prepare um master mix de qPCR verde SYBR. Por poço, misturar 4,7 μL de água livre de nuclease com 10 μL de mistura mestre SYBR Green, 0,15 μL de primer ITR forward a 100 μM e 0,15 μL de ITR primer reverse a 100 μM.
NOTA: Cada amostra é medida em duplicata, com 16 poços para o padrão de referência, 8 poços por amostra e 2 poços para um controle sem gabarito. Prepare 10% a mais de combinação mestre para contabilizar o erro de pipetagem. - Em uma placa de reação óptica de 96 ou 384 poços, carregue 15 μL/poço da mistura mestre de qPCR verde SYBR.
- Em seguida, carregar 5 μL de amostras e material de referência AAV6 ou água livre de nuclease para o controle sem molde. Para o padrão de referência AAV6, diluição de carga 2 a diluição 9. Para as amostras, diluição da carga 5 à diluição 8. Meça cada diluição em duplicado. Evite bolhas.
- Sele a placa carregada com filme transparente óptico, centrifugue a 800 x g por 1 min no RT e carregue a placa no instrumento qPCR com a configuração apropriada de 96 ou 384 poços.
- Configure e execute o instrumento qPCR usando a detecção SYBR com as seguintes condições de ciclagem: 98 °C por 3 min, depois 40 ciclos de 98 °C por 15 s e 58 °C por 30 s, seguidos por uma curva de fusão.
- Analise os dados com o software do instrumento usando a concentração do material de referência AAV6 em cópias do genoma por milímetro (GC/mL) como curva padrão (ver Tabela 3). Calcular a concentração final da amostra multiplicando pelo factor de diluição.
- Certifique-se de que a curva padrão R2 está próxima de 1,0, a eficiência da PCR é de 90%-110%, a linha de base foi removida, a curva de fusão mostra um único pico, os valores de C t mudam de acordo com as diluições e as duplicatas estão dentro de 0,5C t; caso contrário, exclua valores atípicos. Espere rendimentos como na Figura 2.
2. Preparação de meios e estímulos de células B
- Prepare o meio de descongelamento: Combine RPMI-1640 com 20% FCS. Filtro estéril através de uma unidade de filtro de membrana de PES de 0,2 μm. Conservar a 4 °C.
- Preparar meio de cultura de células B: Combinar os reagentes da Tabela 4 e, em seguida, filtrar estéril através de uma unidade de filtro de membrana de PES de 0,2 μm. Conservar a 4 °C.
- Ressuspender cada um dos estimulantes de células B na Tabela 5 nas concentrações de estoque em meio de cultura de células B, exceto CpG ODN, que deve ser ressuspendido em água livre de nucleases. Conservar a -80 °C.
- Se realizar depleção negativa de células não B (etapa 4 opcional), prepare a DPBS (sem cálcio, sem magnésio) com 2% de SFB (DPBS a 2% de SFB). Filtro estéril através de uma unidade de filtro de membrana de PES de 0,2 μm. Conservar a 4 °C.
3. Preparação e cultura de células B de macaco rhesus
OBS: Macacos rhesus criopreservados PBMCs ou esplenócitos são utilizados para configurar a cultura celular30,31.
- Meio de descongelamento pré-aquecido e meio de cultura de células B em banho-maria a 37 °C. Descongelar os estimulantes de células B da Tabela 5 no gelo.
- Preparar um tubo de tamanho adequado contendo meio de descongelamento pré-aquecido. O ideal é que isso seja mais de 10 vezes o volume das células descongeladas.
- Descongelar um a dois criósforos de PBMCs ou esplenócitos de cada vez em banho-maria a 37 °C e decantar no tubo preparado com meio pré-aquecido. Enxágue os criotubos para coletar todas as células.
- Centrifugar as células a 200 x g por 10 min em TR.
NOTA: Essas configurações de centrifugação reduzem a contaminação plaquetária enquanto preservam os rendimentos do PBMC. Velocidades mais altas, como 350 x g por 5 min, podem ser usadas. - Ressuspender as células em meio de descongelamento de 10 mL para lavagem.
- Repetir os passos 3.4 e 3.5 para um total de três centrifugações para remover o meio de congelação. Após a última centrifugação, ressuspender as células a uma estimativa de ~5 x 106 células/mL em meio de cultura de células B.
NOTA: O protocolo acima cultiva PBMC inteiros ou preparações de esplenócitos com contaminação por outras células. Se forem necessárias culturas de células B mais puras, embora com rendimentos totais de células B significativamente reduzidos, continue com a etapa 4. Não foram observadas diferenças nas eficiências de edição entre os dois métodos. - Diluir uma alíquota de 10 μL de células, conforme necessário, com meio de cultura de células B para contagem. Contagem com hemocitômetro e coloração com azul de tripano, combinando volumes iguais de células ressuspensas e solução de azul de tripano a 0,4%.
- Ajustar a concentração celular para 3 x 106 células/mL com meio de cultura de células B de acordo com a contagem celular. Em seguida, adicione os estimulantes de células B às suas concentrações finais, de acordo com a Tabela 5, e misture.
- Transfira as células para uma placa de cultura celular apropriada. No geral, 0,6 x 10 6-0,7 x 106 células/cm 2 é recomendado. Incubar as células a 37 °C com 5% de CO 2 durante 48 h ±2 h.
4. Depleção negativa opcional de células não-B
NOTA: O rendimento e a pureza dependem da porcentagem de entrada de células B entre as CMSP, que podem diferir drasticamente entre macacos rhesus individuais27. Espere 80%-95% de pureza, 60% de eficiência e 1 x 10 6-1,5 x 106 células de 1 x 107 PBMCs.
- Após a última lavagem (passo 3.6), ressuspender as células a 1 x 108 células/mL em SFB DPBS 2% e bloco Fc humano diluído 1:200. As contagens de células são baseadas no número de células descongeladas.
- Incubar por 15 min em gelo para bloquear os receptores Fc e, em seguida, adicionar os anticorpos biotinilados na Tabela 6. Incubar por mais 20 min no gelo.
- Completar o tubo com DPBS 2% FCS e girar a 200 x g por 10 min a 4 °C.
- Ressuspender as células em SFB 2% DPBS a 80% do volume a partir do passo 4.1 (ou seja, 80 μL por 1 x 107 células).
- Adicionar esferas magnéticas de estreptavidina à suspensão celular a 20% do volume do passo 4.1 (ou seja, 20 μL de contas por 1 x 107 células).
- Incubar as células por 15 min no gelo e agitar ocasionalmente.
- Enquanto isso, por 1 x 108 células, prepare um separador magnético com uma grande coluna de depleção magnética e um filtro de pré-separação. Enxaguar o filtro e a coluna de pré-separação com 2 mL de DPBS 2% FCS por gravidade e descartar o fluxo. Instale um tubo de coleta de 15 mL.
NOTA: O uso de outras colunas, como colunas de seleção positiva ou outros sistemas de purificação de esferas magnéticas, pode reduzir drasticamente a pureza. - Após a incubação, completar as células para 0,5 mL com DPBS 2% FCS se o volume for <0,5 mL. Se o volume for ≥0,5 mL, basta prosseguir.
- Coloque a suspensão da célula no filtro de pré-separação na coluna preparada e colete o fluxo no tubo de 15 mL.
- Eluir as células B enriquecidas não ligadas duas vezes adicionando 1 mL de DPBS 2% FCS no filtro de pré-separação. Coletar as células não ligadas no mesmo tubo por fluxo de gravidade.
NOTA: Eluição adicional pode aumentar marginalmente o rendimento. A pureza e a eficiência podem ser avaliadas pela citometria de fluxo das células de entrada, das células enriquecidas e das células retidas na coluna. Para obter as células retidas na coluna, remova a coluna do ímã e lave com 3 mL de DPBS 2% FCS usando o êmbolo fornecido. Se desejar, avaliar a pureza por citometria de fluxo como na Figura 3 utilizando os reagentes da Tabela 7. - Centrifugar as células B enriquecidas a 200 x g durante 10 minutos a 4 °C.
- Ressuspender as células a uma estimativa de ~5 x 106 células/mL em meio de cultura de células B e continuar na etapa 3.7.
5. Edição genética primária de células B de macaco rhesus
- Após ativar as células B do macaco rhesus por 48 h ± 2 h, prepare os reagentes para eletroporação e transdução.
- Pré-aquecer DMSO, tampão duplex livre de nuclease, tampão T e tampão E (kit de eletroporação de 10 μL) ou E2 (kit de eletroporação de 100 μL) do kit de eletroporação para RT.
- Descongelar os estimulantes rAAV6 HDRT e células B da Tabela 5 no gelo.
- Ressuspenda os sgRNAs CRISPR-Cas9 a 100 μM em buffer duplex. Reconstitua por 10 min no RT e misture por vórtice e agitação. Mantenha os sgRNAs reconstituídos no gelo até o uso. Conservar a -80 °C.
NOTA: Os sgRNAs CRISPR-Cas9 podem ser projetados com várias ferramentas on-line (ver 1.1.1) e podem variar drasticamente em sua eficiência de corte. Recomenda-se o teste empírico da eficiência de corte usando ensaios como TIDE37 ou ICE38. - Por eletroporação de 10 μL, preparar 550 μL de meio de cultura de células B com todos os estimulantes da Tabela 5 e adicionar 1% de DMSO. Dimensione os volumes em 10 vezes para eletroporações de 100 μL. Opcionalmente, 10% desse meio pode ser preparado sem antibiótico-antimicótico, o que aumenta ligeiramente a viabilidade celular após a transfecção.
- Por eletroporação de 10 μL, preparar um poço de uma placa de cultura celular de 48 poços com 50 μL do meio de cultura de células B com estimulantes e sem antibiótico-antimicótico, se o utilizar. Para eletroporações de 100 μL, pipetar 500 μL para os poços de uma placa de 6 poços.
- Adicione rAAV6 HDRT ao meio nos poços, até 20% do volume no poço. Apontar para MOIs que variam de 1 x 10 5-1 x 10 6 com base no número de células por transfecção (eletroporação de 10 μL: 5 x 10 5 células; eletroporação de 100 μL:5 x 106 células) e o GC na preparação de rAAV6. Altas concentrações de estoque de rAAV6 de 5 x 1013 GC/mL a 5 x10 14 GC/mL são recomendadas para atingir MOIs altos com baixos volumes.
NOTA: MOIs mais baixos podem levar à redução da eficiência de edição, e MOIs de 5 x 105 geralmente estão perto das eficiências máximas de edição que vimos. Não foi observada influência de MOIs variáveis na viabilidade de células B. Recomenda-se a inclusão de controles sem rAAV6 HDRT, sem transfecção RNP e sem ambos. - Pré-aqueça os pratos preparados e o meio restante transferindo-os para uma incubadora a 37 °C com 5% de CO2.
- Por eletroporação de 10 μL, preparar 1,15 μL de ribonucleoproteína (RNP): Misturar 0,4 μL de 61 μM Cas9 com 0,75 μL de sgRNA 100 μM em tampão duplex. Prepare extra (recomenda-se 30% a mais para uma única eletroporação) devido a erro de pipetagem e para evitar bolhas ao carregar as pontas de eletroporação. Escala 10 vezes para pontas de 100 μL.
- Incubar o RNP por pelo menos 15 min em RT antes de misturar com as células. Após a incubação, várias RNPs podem ser combinadas se mais de um locus for alvo simultaneamente. Não foram observadas diferenças significativas na eficiência com até três locos ao mesmo tempo.
- Enquanto isso, prepare as células para a eletroporação. Mantenha as células em RT o tempo todo para evitar choques de temperatura. Colher as células após 48 h ± 2 h de cultura em recipiente apropriado. Enxágue as louças com DPBS para coletar o número máximo de células.
- Centrifugar as células a 200 x g por 10 min no TR. Descarte o sobrenadante e ressuspenda as células em DPBS a ~2 x 106 células/mL.
- Combinar 10 μL de solução de azul de tripano a 0,4% com 10 μL da suspensão celular e contar utilizando um hemocitómetro.
OBS: Neste momento, devido à perda durante a colheita e lavagem, espera-se cerca de 60% das células que foram colocadas em cultura 48 h ± 2h antes. - Enquanto isso, centrifugar as células a 200 x g por 10 min no RT. Descarte o sobrenadante, certificando-se de minimizar qualquer DPBS restante. Ressuspender as células em tampão T pré-aquecido (RT) a 5,55 x 107 células/mL com base na contagem de células acima.
- Configure o sistema de transfecção ligando a máquina e configurando-a para 1.350 V, 15 ms e 1 pulso. Coloque a estação de pipetas dentro da capela de fluxo laminar
- Para cada conjunto de 10 eletroporações, preparar um tubo de transfecção com 3 mL de tampão E (para transfecções de 10 μL) ou E2 (para transfecções de 100 μL). Insira o tubo na estação de pipetas.
- Por eletroporação de 10 μL, combinar 1,15 μL de RNP com 9 μL de células. Certifique-se de ter um volume suficiente (+ 30%) para evitar aspirar ar para a ponta de eletroporação. Incubar em RT por 1-2 min antes da eletroporação.
- Aspirar 10 μL ou 100 μL de RNP e mistura celular na ponta de eletroporação de tamanho adequado em uma pipeta de eletroporação, inserir a pipeta carregada na estação de pipeta e iniciar a eletroporação. Certifique-se de que as pontas estão completamente livres de bolhas de ar para evitar o arranque. Observe durante a eletroporação para verificar se o arco não ocorre.
- Ejetar imediatamente as células eletroporadas para o pequeno volume de meio preparado, pré-aquecido, com ou sem rAAV6 dentro da placa de 48 poços (transfecções de 10 μL) ou 6 poços (transfecções de 100 μL). Repita as etapas 5.15-5.17 com as amostras restantes. Adicionar amostras controle sem transfecção aos poços de cultura.
- Incubar as células a 37 °C com 5% de CO 2 por 4 h ±2 h e, em seguida, adicionar o meio de cultura de células B preparado e pré-aquecido contendo estimulantes, DMSO e antibiótico/antimicótico: 450 μL para transfecções de 10 μL ou 4,5 mL para transfecções de 100 μL.
- Continuar a incubação a 37 °C com 5% de CO2 por 12-24 h. Em seguida, trocar o meio para meio de cultura de células B contendo estimulantes e antibiótico/antimicótico sem DMSO se desejar cultura prolongada. A análise do DNA genômico pode ser feita após 24 h. A PCR digital em gotículas utilizando um primer fora do braço de homologia e um primer dentro da pastilha pode ser usada para quantificar a eficiência de edição39. Realizar PCRs para amplificar o local de inserção e sequenciamento de Sanger para verificar a edição correta.
- Para análise dos níveis de proteína, cultivar as células por 40-48 h após a eletroporação para permitir alterações na expressão proteica, e realizar uma análise por citometria de fluxo usando os reagentes da Tabela 7.
Resultados
A produção de rAAV6 com o uso do auxiliar adenoviral autosilenciante habilitado para tetraciclina resultou na produção de 4 x 10 10 GC/mL de meio de cultura celular em média, superando em 30 a40 vezes a produção com transfecção tripla padrão e livre de auxiliares (Figura 2).
A purificação opcional das células B do macaco rhesus resultou na eliminação da grande maioria das células T CD3+ e das células mieloides CD14+ e/ou CD16+, sendo obtidas rotineiramente purezas de 80%-95% de células B CD20+ (Figura 3). Com base em nossos projetos anteriores em células B murinas7, desenvolvemos um método para editar a especificidade do receptor de células B de macaco rhesus, mantendo simultaneamente a exclusão alélica na grande maioria das células B, excluindo cadeias leves de anticorpos endógenos através da interrupção de sua região constante. Construímos uma HDRT sem promotor para ser inserida no locus de IGH entre o último gene IGHJ e o intensificador Eμ de células B de macaco rhesus (Figura 4). Este construto utiliza o promotor VH endógeno da região VDJ naturalmente rearranjada a montante em células B maduras e, portanto, não é expresso por genomas epissomais de AAV. Além disso, essa construção requer o splicing em regiões constantes da cadeia pesada de anticorpos a jusante para serem expressas na superfície celular. Portanto, a ligação antigênica específica na superfície celular mostrada pela citometria de fluxo indica a correta integração do locus alvo e que a sequência inserida é funcional.
Empacotamos tal construto que codifica o anticorpo Ab1485, um anti-HIV bNAb40 derivado de macaco rhesus, em rAAV6 e o usamos para editar culturas de esplenócito primário de macaco rhesus ativado ou PBMC, conforme descrito acima (Figura 5A). O protocolo manteve alta viabilidade celular (~90%) enquanto simultaneamente apagava a expressão de cadeias leves em ~80% das células B. A maioria das células B ainda expressava o isotipo IgM (Figura 5B). A adição do rAAV6 que codifica a HDRT Ab1485 resultou em edição gênica e expressão de superfície de Ab1485 em 16%-21% das células B (Figura 5A), embora em uma intensidade de fluorescência menor para cadeias de anticorpos do que em células B não editadas (Figura 5A painel direito, Figura 5C). Isso pode ser resultado da competição de epítopos entre a coloração antigênica e os monoclonais usados para detectar a BCR de superfície em citometria de fluxo, bem como da real expressão proteica reduzida devido à natureza policistrônica da HDRT e splicing menos eficiente. A adição de DMSO a 1% e incubações prolongadas e concentradas com a HDRT rAAV6 geralmente aumentaram a eficiência de edição (Figura 6A-C). Usando esse método específico, tipicamente 5%-20% e até 40%, a eficiência de edição é alcançada dependendo do macaco rhesus individual (Figura 5A, Figura 6A-E) e da qualidade do lote rAAV6 HDRT (Figura 6E). Em geral, apresentamos protocolos para a produção eficiente de rAAV6, bem como a cultura, purificação e edição genética de células B de macaco rhesus.
| Reagentes | Volume | Estoque | Concentração final |
| DMEM, Glicose Alta | 500 mL | 1 x | ~ 88,5% |
| FCS, inactivado pelo calor | 50 mL | 1 x | ~ 8,85% |
| Antibiótico/Antimicótico | 5 mL | 100 x | 1 x |
| Glutamina | 5 mL | 200 mM | 2 mM |
| Piruvato de Sódio | 5 mL | 100 mM | 1 mM |
Tabela 1: Meio de cultura celular 293AAV.
| Reagentes | Volume | Estoque | Concentração final |
| DMEM, Glicose Alta | 500 mL | 1 x | ~ 95,2% |
| FCS, inactivado pelo calor | 10 mL | 1 x | ~ 1,9% |
| Antibiótico/Antimicótico | 5 mL | 100 x | 1 x |
| Glutamina | 5 mL | 200 mM | 2 mM |
| Piruvato de Sódio | 5 mL | 100 mM | 1 mM |
Tabela 2: Meio de produção celular 293AAV.
| Série de diluição | Volume de amostra (μL) | Diluente e volume | Fator de diluição | Diluição total | Referência AAV6 |
| GC/mL | |||||
| Diluição 1 | Amostra de 2 μL ou padrão de referência AAV a 4,1 x 1011 GC/mL | Tampão e enzima DNAseI de 18 μL | 10 x | 10 x | 4,1 x 1010 |
| Diluição 2 | 15 μL Dil. 1 | 60 μL H2O | 5 x | 50 x | 8,2 x 109 |
| Diluição 3 | 20 μL Dil. 2 | 80 μL H2O | 5 x | 250 x | 1,6 x 109 |
| Diluição 4 | 20 μL Dil. 3 | 80 μL H2O | 5 x | 1250 x | 3,3 x 108 |
| Diluição 5 | 20 μL Dil. 4 | 80 μL H2O | 5 x | 6250x | 6,6 x 107 |
| Diluição 6 | 20 μL Dil. 5 | 80 μL H2O | 5 x | 31250 x | 1,3 x 107 |
| Diluição 7 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 156250 x | 2,6 x 106 |
| Diluição 8 | 20 μL Dil. 6 | 80 μL H2O | 5 x | 781250 x | 5,24 x 105 |
| Diluição 9 | 20 μL Dil. 7 | 80 μL H2O | 5 x | 3906250 x | 1,05 x 105 |
Tabela 3: Tabela de diluição qPCR.
| Reagente | Volume | Estoque | Concentração final |
| RPMI-1640 | 420 mL | 1 x | 84% |
| FCS, inactivado pelo calor | 50 mL | 1 x | 10% |
| Antibiótico/Antimicótico | 5 mL | 100 x | 1 x |
| Glutamina | 5 mL | 200 mM | 2 mM |
| Piruvato de Sódio | 5 mL | 100 mM | 1 mM |
| HEPES | 5 mL | 1 milh | 10 mM |
| 2-B-mercapto-etanol | 550 μL | 55 mM | 55 μM |
| Aminoácidos não essenciais | 5 mL | 100 x | 1 x |
| Insulina-Transferina-Selênio | 5 mL | 100 x | 1 x |
Tabela 4: Meio de cultura de células B.
| Reagente | Diluição | Estoque | Concentração final |
| MegaCD40L | 1:1000 | 100 μg/mL | 100 ng/mL |
| CpG ODN | 1:300 | 1 mg/mL | 3,33 μg/mL |
| BAFF Humano | 1:1000 | 40 μg/mL | 40 ng/mL |
| IL-2 humana | 1:1000 | 50 μg/mL | 50 ng/mL |
| IL-10 humana | 1:1000 | 50 μg/mL | 50 ng/mL |
Tabela 5: Estimulantes de células B.
| Anticorpo | Clone | Diluição | Final Conc. |
| CD3 anti-humano | FN-18 | 1:40 | 2,5 μg/mL |
| CD8a anti-humano | RPA-T8 | 1:200 | 2,5 μg/mL |
| CD14 anti-humano | M5E2 | 1:200 | 2,5 μg/mL |
| CD16 anti-humano | 3G8 | 1:200 | 2,5 μg/mL |
| CD33 anti-humano | AC104.3E3 | 1:50 | 1 teste |
| CD64 anti-humano | 10.1 | 1:800 | 0,625 μg/mL |
| CD66 anti-humano | TET2 | 1:11 | 1 teste |
| CD89 anti-humano | A59 | 1:800 | 0,625 μg/mL |
Tabela 6: Anticorpos para a depleção opcional de células não-B.
| Reagente | Tipo/clone | diluição/concentração de trabalho |
| anti-humano CD14 AlexaFluor647 | M5E2 | 1:50 |
| anti-humano CD16 AlexaFluor700 | 3G8 | 1:50 |
| anti-humano CD20 PECy7 | 2H7 | 1:50 |
| EP CD3 anti-humano | SP34-2 | 1:50 |
| Zumbi-NIR | - | 1:500 |
| anti-humano HLA-DR BV605 | L243 | 1:200 |
| anti-humano Ig cadeia leve lambda APC | MHL-38 | 1:50 |
| anti-humano Kappa Light Chain FITC | policlonal | 1:500 |
| IgM BV421 anti-humano | MHM-88 | 1:50 |
| Antígeno RC1, biotinilado aleatoriamente | - | 5 μg/mL |
| Streptavidina-PE | - | 1:500 |
Tabela 7: Reagentes de citometria de fluxo para análise.
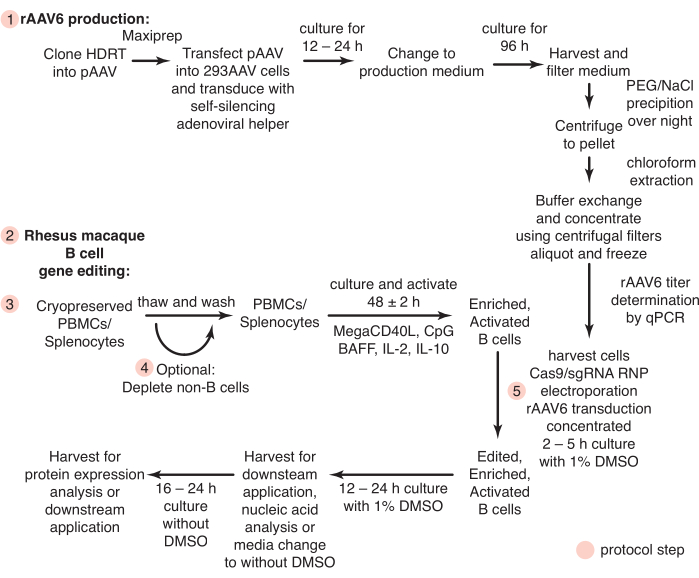
Figura 1: Visão geral esquemática da produção de rAAV6 e da edição gênica de células B primárias de macaco rhesus. Os protocolos são divididos em produção de rAAV6 (etapa 1) e edição gênica de células B de macaco rhesus (etapas 2-5), incluindo uma etapa opcional para a depleção de células não-B (etapa 4). As etapas dos protocolos são indicadas com círculos vermelhos. Clique aqui para ver uma versão maior desta figura.
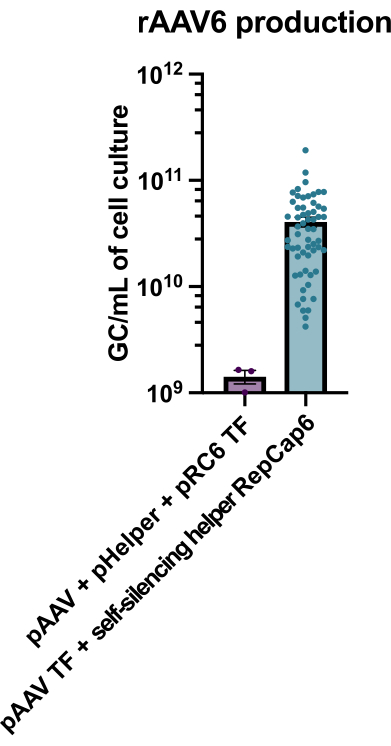
Figura 2: Altos rendimentos de rAAV6 usando um auxiliar adenoviral auto-silenciador. O rAAV6 foi produzido usando os métodos descritos aqui (transfecção de pAAV [TF] + helper auto-silenciador RepCap6, helper adenoviral auto-silenciante) ou transfecção tripla típica sem ajudante de pAAV, pHelper e pRepCap6 (pRC6). rAAV6 foi purificado apenas do sobrenadante celular. Os métodos que utilizaram os vetores auxiliares adenovirais autosilenciadores produziram 30-40 vezes mais rAAV titulados por qPCR, como descrito acima. Cada ponto representa uma produção individual de rAAV usando várias construções de pAAV de 2 a 20 experimentos independentes. Média ± MEV é plotada. Clique aqui para ver uma versão maior desta figura.
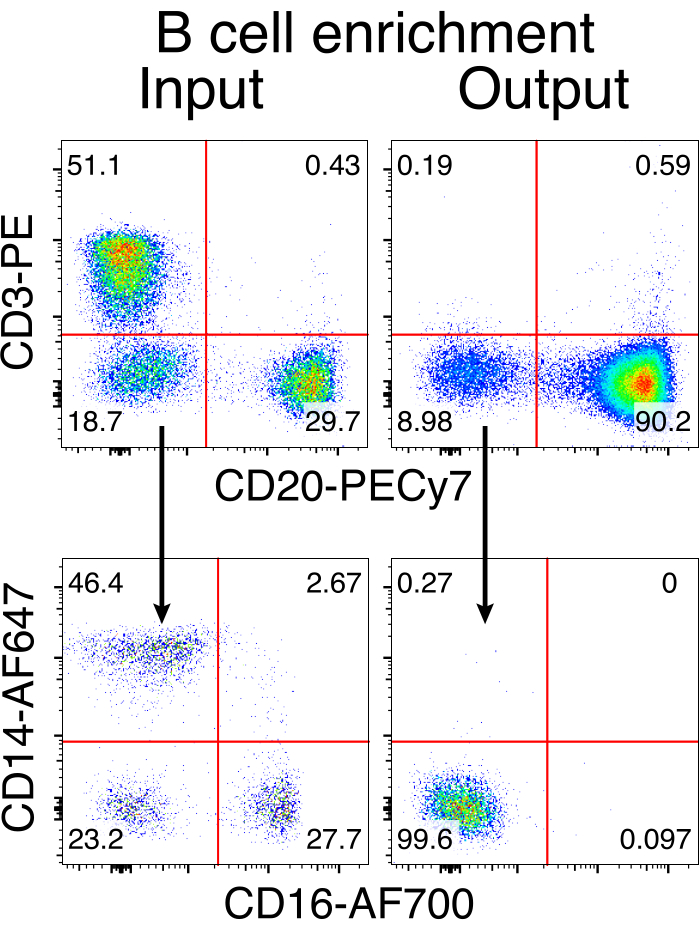
Figura 3: Enriquecimento de células B pela depleção negativa de células não-B. Células B de macaco rhesus foram enriquecidas a partir de CMSP usando o protocolo descrito e enriquecidas com 90% de pureza. A entrada e a saída pré-enriquecimento após o enriquecimento são mostradas. Representante de cinco experimentos independentes. Clique aqui para ver uma versão maior desta figura.
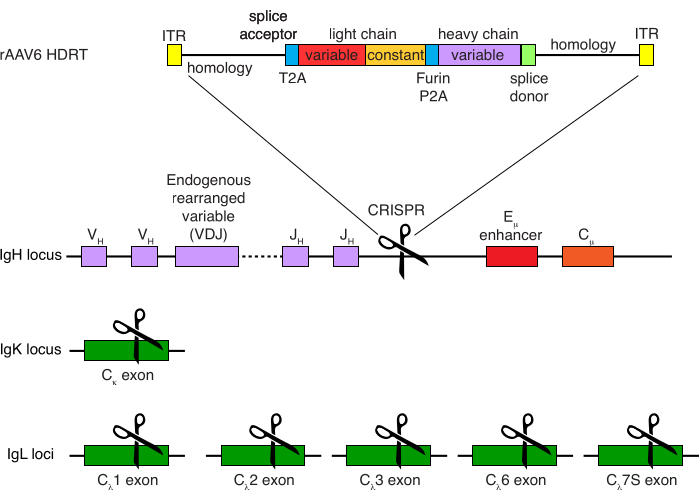
Figura 4: Estratégia de direcionamento usada para editar a especificidade do receptor de células B de macaco rhesus. O rAAV6 foi produzido contendo a HDRT representada. A HDRT consiste em um braço de homologia de 266 pb 5', seguido por 111 pb do aceitador de emenda IGHM 1 do macaco rhesus, depois um ligante GSG com uma sequência peptídica 2A autoclivando do vírus Thosea asigna (T2A), seguido por uma sequência líder e a cadeia leve completa do anticorpo Ab1485 do macaco rhesus como IGLC1 do macaco rhesus. Segue-se um sítio de clivagem de furina, um ligante GSG e uma sequência de peptídeo 2A de autoclivagem de tescovírus suíno (Furin-P2A), seguida por outra sequência líder e a variável de cadeia pesada Ab1485, seguida por 52 pb da sequência doadora de emenda IGHJ4 de macaco rhesus, para permitir o splicing em regiões constantes de cadeia pesada de anticorpos a jusante e um braço de homologia de 514 pb. Este construto foi direcionado para o locus de IGH entre o último gene IGHJ e o intensificador Eμ usando a sequência alvo de sgRNA GAGATGCCAGAGCAAACCAG. Ambos os braços de homologia foram projetados para terminar no local de corte deste sgRNA, removendo assim a sequência alvo e permitindo eficiências de integração ideais. Simultaneamente, para manter a exclusão alélica e a expressão de um único receptor de célula B, excluímos cadeias leves endógenas usando sgRNAs visando o macaco rhesus IGKC com a sequência alvo GGCGGGAAGATGAAGACAGA e IGLC1, IGLC2, IGLC3, IGLC6 e IGLC7S usando a sequência alvo CTGATCAGTGACTTCTACCC. A HDRT incluiu mutações silenciosas impedindo a clivagem da sequência IGLC1 por este sgRNA. Clique aqui para ver uma versão maior desta figura.
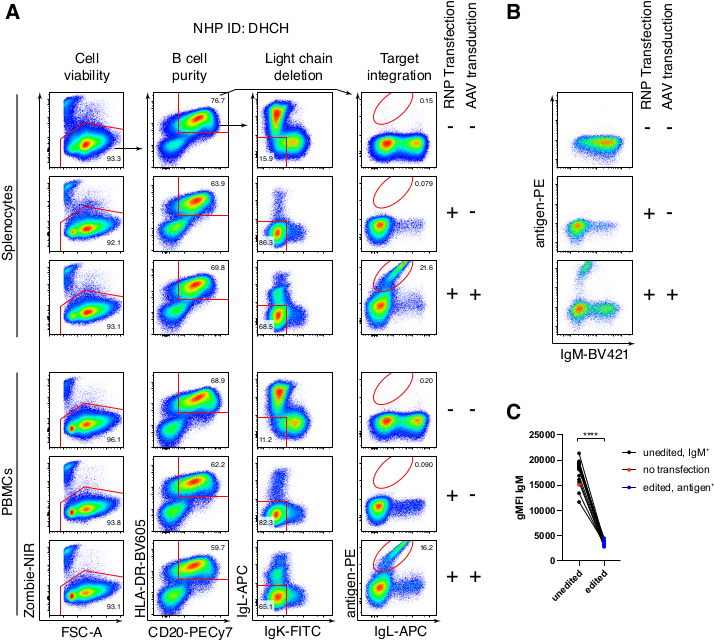
Figura 5: Edição gênica de células B primárias de macaco rhesus. (A) Esplenócitos primários (painel superior) ou PBMCs (painel inferior) do mesmo macaco rhesus foram cultivados sem a depleção de células não-B e editados conforme descrito acima. A estratégia de direcionamento foi a mostrada na Figura 4. Dois dias após a eletroporação, as células foram colhidas e coradas superficialmente para análise por citometria de fluxo. A coluna esquerda foi fechada sobre células singletes, e as outras colunas foram então fechadas, conforme indicado na linha superior. A viabilidade das células, a pureza das células B, a eficiência de deleção das cadeias leves e a eficiência de knock-in do Ab1485 pela coloração com o antígeno específico RC141 são indicadas em amostras transfectadas com RNP não tratadas, ou transfectadas com RNP + rAAV6 transduzidas (MOI = 5 x 105). Representante de seis experimentos independentes com células de diferentes macacos rhesus. (B) expressão de IgM em cultura de controles de células B de macaco rhesus ou após edição e (C) intensidade de fluorescência média geométrica (gMFI) de IgM em células B que não perderam a expressão de Ig devido ao direcionamento de IgLC e IgKC (não editado) ou células B que se ligam ao antígeno esperado (editado). O ponto vermelho indica a gMFI de células B controle não transfectadas cultivadas. indica p < 0,0001 em um teste t pareado. Clique aqui para ver uma versão maior desta figura.
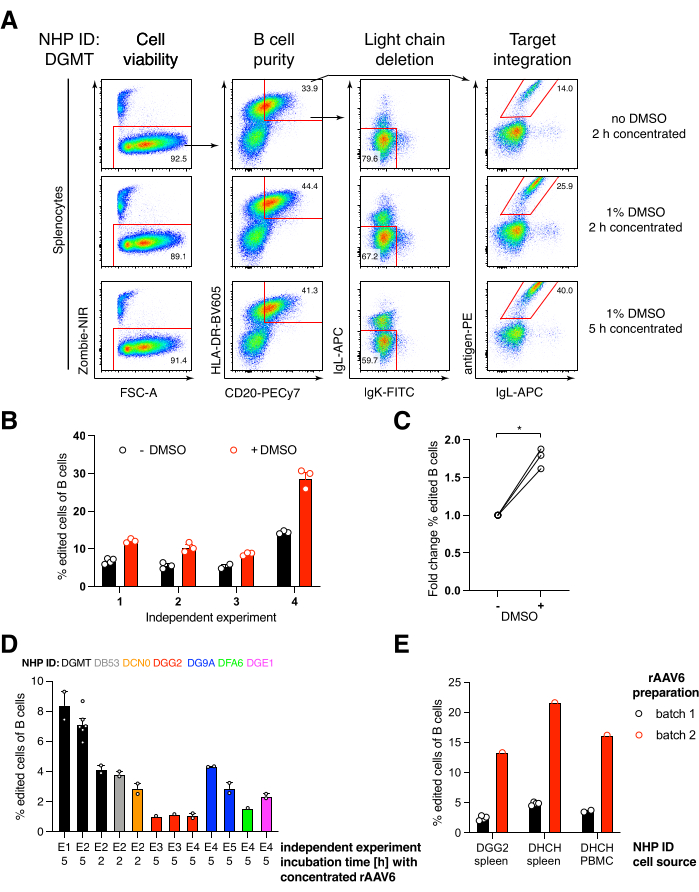
Figura 6: Efeitos do DMSO, incubação concentrada prolongada com HDRT rAAV6, qualidade do lote rAAV e reprodutibilidade entre diferentes NHPs doadores na eficiência de edição gênica em células B primárias de macaco rhesus. (A) Os esplenócitos foram cultivados e editados conforme descrito. Após a eletroporação, 5 x 10 5 células foram cultivadas em meio com ou sem DMSO a 1% e incubadas em 50 μL de meio contendo rAAV6 HDRT a um MOI de 5 x 10 5 por 2 h ou5 h antes da adição de mais 450 μL de meio. As células foram analisadas 2 dias após a eletroporação por citometria de fluxo, conforme Figura 5. Representante de quatro experimentos independentes. (B) Quantificação de (A) ao longo de quatro experimentos independentes. Os pontos indicam réplicas técnicas com ajustes de transfecção de 1.350 V, 10-20 ms e duração da eletroporação de 1 pulso e concentrações de DMSO variando de 0,75%-1,25%. (C) Variação média de dobras na eficiência de edição de (B). * p > 0,05 no teste U de Mann-Whitney. (D) Eficiência de edição em experimentos independentes com diferentes macacos usando um lote comercial rAAV6 de menor eficiência. (E) Eficiência de edição usando dois lotes comerciais diferentes de rAAV6 nos quais a mesma construção foi embalada nas células B de dois NHPs diferentes no mesmo experimento. Os pontos indicam réplicas técnicas com ajustes de transfecção de 1.350 V, 10-20 ms e eletroporação de 1 pulso. Clique aqui para ver uma versão maior desta figura.
Discussão
Os protocolos aqui apresentados fornecem um método rápido e eficiente para gerar altos rendimentos e títulos de rAAV6s como HDRTs e novos métodos para editar eficientemente células B primárias de macaco rhesus in vitro.
O protocolo de produção do rAAV6 é comparativamente simples e rápido, permitindo a produção e teste de muitas construções diferentes simultaneamente sem trabalho excessivo. Se desejado, o rAAV6 pode ser purificado usando protocolos estabelecidos, como ultracentrifugação com gradiente de iodixanol34 ou partição bifásica aquosa35 antes da troca e concentração do tampão.
Embora tenha reduzido o rendimento global, optou-se por usar apenas meio de cultura celular com soro reduzido para a purificação do rAAV6 em vez da purificação do pellet celular, uma vez que a maioria do rAAV6 é liberada no meio36, e a purificação do pellet celular adiciona mais custo e mão de obra. O uso do auxiliar adenoviral auto-inativador aumentou os rendimentos em média de 30 a 40 vezes, permitindo o teste de construtos embalados em AAV6 em um único prato de 15 cm. Embora nosso método de purificação seja básico, usando este método, obtemos relativamente pouca variação lote a lote na eficiência de edição de genes ou viabilidade celular após transdução usando várias linhagens celulares ou outras células primárias (dados não mostrados).
Desenvolvemos um protocolo de purificação de células B de macaco rhesus para obter células B primárias intocadas usando a depleção negativa de populações indesejadas. Embora não seja necessário para a edição gênica dessas células, ele fornece uma maneira de obter uma população relativamente pura de células B primárias de macaco rhesus para esta ou outras aplicações, caso outros tipos celulares interfiram nos objetivos experimentais. No entanto, a pureza vem ao custo de rendimentos globais reduzidos de células B. Notavelmente, para as culturas de células B enriquecidas e não enriquecidas, a fração de células B nas PBMC iniciais ou preparações de espleócitos é crucial. Para PBMCs em particular, recomendamos a triagem de diferentes macacos para indivíduos com uma alta porcentagem de células B no sangue periférico para obter um alto número de células B para experimentos, pois esse valor pode diferir dramaticamente entre os indivíduos27. As CMSP podem ser obtidas por sangramento regular ou leucaferese42.
O protocolo de edição gênica leva à edição gênica eficiente, tipicamente entre 60%-80% de knock-out e 5%-20% de knock-in de células B, embora tenhamos alcançado até 90% de knock-out de BCR e 40% de células B de knock-in de BCR (Figura 5 e Figura 6).
Os principais parâmetros para a edição eficiente de células B de macaco rhesus são a eficiência de corte do sgRNA, os parâmetros de eletroporação, o MOI e a qualidade da preparação de rAAV6. As eficiências de corte dos sgRNAs candidatos devem ser determinadas empiricamente para permitir a edição e o design ideais da HDRT. Os parâmetros de eletroporação aqui apresentados equilibram a eficiência com a viabilidade de obter o número total máximo de células B editadas em vez da maior porcentagem de células B editadas. Se uma porcentagem maior de células editadas for necessária, tensões aumentadas (até 1.750 V) ou comprimentos de pulso alterados (10-30 ms) são recomendados, embora mais morte celular possa ser observada. Também observamos eficiências de edição ligeiramente maiores em células B esplênicas em comparação com células B de PBMCs do mesmo indivíduo (Figura 5); no entanto, a razão subjacente para isso é atualmente desconhecida.
Observamos que a adição de DMSO a 1% após eletroporação aumentou significativamente a eficiência de edição gênica em ~40% em células B de macaco rhesus, sem afetar a viabilidade celular (Figura 6A-C), em concordância com relatos em outras células43. No entanto, a cultura prolongada em DMSO a 1% deve ser evitada e pode afetar a viabilidade celular. O DMSO pode ser completamente omitido, se desejado.
O cultivo das células em pequeno volume após eletroporação por várias horas em conjunto com o rAAV6 leva a maiores eficiências de edição, provavelmente devido à melhor transdução da HDRT pelo rAAV6 e, portanto, à maior concentração intracelular de HDRT no momento relevante em que Cas9 está ativo. Descobrimos que cultivar as células dessa forma por até 8 h não afetou a viabilidade celular, mas as eficiências de edição não aumentaram dramaticamente além de 5 h (Figura 6). Se apenas knock-out em vez de knock-in for necessário, esta etapa pode ser omitida.
Em conclusão, apresentamos protocolos abrangentes para a edição gênica de células B de macaco rhesus in vitro e a produção de rAAV6 HDRT necessária para o knock-in eficiente de construtos desejados. Esses protocolos permitem o teste rápido e custo-efetivo de muitos construtos empacotados como rAAV6 e permitem o teste pré-clínico da viabilidade e escalabilidade de terapias com células B em um modelo de primata não humano mais relevante.
Divulgações
Não são declarados interesses concorrentes.
Agradecimentos
Gostaríamos de agradecer a Harry B. Gristick e Pamela Bjorkman por fornecerem o antígeno RC1 e a todos os laboratórios Nussenzweig e Martin para discussão crítica. Este trabalho foi apoiado pela bolsa INV-002777 da Fundação Bill e Melinda Gates (para M.C.N.) e pelo Programa de Pesquisa Intramuros do Instituto Nacional de Alergia e Doenças Infecciosas, Institutos Nacionais de Saúde. (R.G. e M.A.M). M.C.N. é Investigador do HHMI.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
Referências
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. Protein Electrophoresis - Serum., 6th edition. , Elsevier Saunders. St Louis, MO. 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850(2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851(2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995(2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630(2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934(2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144(2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973(2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855(2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182(2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168(2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686(2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991(2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637(2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados