Method Article
初代アカゲザルB細胞の遺伝子編集
要約
B細胞療法の研究のために、CRISPR/Cas9および組換えアデノ随伴ウイルス血清型6を用いて初代アカゲザルB細胞を培養および遺伝子編集する方法を紹介します。
要約
B細胞とその子孫は、高発現抗体の供給源です。その高いタンパク質発現能力、その豊富さ、末梢血 を介した 容易なアクセス性、および単純な養子縁組移植への快適性により、組換え抗体または他の治療用タンパク質を発現するための遺伝子編集アプローチの魅力的な標的となっています。マウスおよびヒト初代B細胞の遺伝子編集は効率的であり、 in vivo 研究用のマウスモデルは有望であることが示されていますが、より大きな動物モデルの実現可能性とスケーラビリティはこれまでのところ実証されていません。したがって、このような研究を可能にするために、アカゲザルの初代B細胞 をin vitroで 編集するプロトコルを開発しました。CRISPR/Cas9を用いた末梢血単核球または脾細胞由来の初代アカゲザルB細胞の in vitro 培養および遺伝子編集の条件について報告する。大型(<4.5 kb)カセットの標的統合を達成するために、テトラサイクリン対応の自己サイレンシングアデノウイルスヘルパーベクターを使用して、相同性指向性修復テンプレートとして組換えアデノ随伴ウイルス血清型6を調製するための高速で効率的なプロトコルが含まれていました。これらのプロトコルは、アカゲザルにおける将来のB細胞治療薬の研究を可能にします。
概要
B細胞は液性免疫の基盤です。同族の抗原および二次シグナルによって活性化されると、ナイーブB細胞は胚中心B細胞、メモリーB細胞、および形質細胞を生じさせる1。後者は、現在利用可能なほとんどのワクチンの保護機能を媒介する分泌抗体の供給源です2。形質細胞は、血清中に約2 ng /日/細胞3、7〜16 g / Lの血清に相当する膨大な量の抗体を分泌するため、抗体工場として説明されており、抗体は血清4の中で最も豊富な3つのタンパク質の1つになっています。B細胞は血液中に豊富に含まれているため、簡単に入手して個体に戻すことができます。
これらの形質により、B細胞は、B細胞受容体(BCR)を遺伝子編集し、ヒト免疫不全ウイルス(HIV)5,6,7,8,9,10,11,12,13,14,15および他のタンパク質に対して広域中和抗体(bNAb)を発現するための細胞療法の取り組みの標的となっています16。 17,18,19,20,21。このようなアプローチは、インビボでの多数のマウス研究において可能性を示している7、8、10、11、16、22。しかし、臨床翻訳9,15,23には、安全性、治療効果の期間、大きさ、非ヒト霊長類(NHP)などの大型動物へのスケーリングなど、いくつかのハードルを克服する必要があります。実際、NHP、特に抗体およびHIV研究で長い歴史を持つアカゲザル24,25は、これらのパラメーターをテストするのに最も適したモデルです。
ここでは、これらの問題に対処できるプロトコルを開発しました。今日まで、アカゲザルB細胞をex vivoで培養しようとした研究はほとんどなく、アカゲザルB細胞の精製のためにCD20を用いたポジティブ選択のみが報告されている26、27、28。我々は、他の細胞タイプの負の枯渇によって手つかずのアカゲザルB細胞を単離するためのプロトコルを確立しました。さらに、アカゲザルB細胞の標的遺伝子編集のための培養条件が規定されている。このプロトコルでは、CRISPR/Cas9リボ核タンパク質(RNP)および組換えアデノ随伴ウイルス血清型6(rAAV6)を、培養アカゲザルB細胞を遺伝子編集するための相同性指向性修復テンプレート(HDRT)として使用することを概説しています。このプロトコルを使用すると、大きな(~1.5 kb)挿入で最大40%の編集効率が達成されました。また、テトラサイクリン対応の自己サイレンシングアデノウイルスヘルパー29を使用してrAAV6を生成するための高速で費用効果の高い方法を提示し、この形式のHDRTの高速テストを可能にします。これらのプロトコルを組み合わせることで、アカゲザルB細胞の遺伝子編集のための効率的なワークフローが記述され(図1)、NHPモデルでのB細胞療法の評価が可能になります。
実験を開始するために、ドナー材料は商業的な供給源から注文するか、または瀉血または脾臓摘出術によって得ることができる。この研究では、瀉血および採血は、抗凝固剤EDTAを用いて前述のように実施された30 。脾臓、初代アカゲザルB細胞を得るために、部分的(25%〜50%)または全脾臓摘出術を、以前に報告された技術を用いて実施した31。動物を手術前に一晩絶食させた。簡単に説明すると、手術中に腹部を切り取り、クロルヘキシジンと70%イソプロピルアルコールの交互のスクラブで3回調製した。腹部を切開(5〜10 cm)して、脾臓を特定して分離しました。脾臓の血管系は、縫合糸または血管クランプのいずれかで結紮された。切開部は、4-0 PDSポリジオキサノン縫合糸で2層に閉じた。脾臓摘出術は、個々の動物に対して1回行われた。シングルセル懸濁液は、細胞ストレーナーを介した浸軟によってマカクザル脾臓から調製した。血液および脾臓細胞懸濁液からの単核球を密度勾配遠心分離を用いて調製し、液体窒素中で保存した。
プロトコル
すべての動物の手順と実験は、国立衛生研究所の国立アレルギー感染症研究所の施設内動物管理および使用委員会によって承認されたプロトコルに従って実施されました。以下のプロトコルの概要を 図 1 に示します。2〜8歳のインドの遺伝的起源のオスとメスのアカゲザル(Macaca mulatta)は、実験動物の世話と使用に関する委員会のガイドラインに従って、バイオセーフティレベル2の施設で飼育され、世話をされました。
注意:すべての実験は、血液媒介 病原体に対する普遍的な予防措置に準拠して、無菌/無菌技術と層流フード内の適切なバイオセーフティレベル2機器を使用して実施されました。
1. rAAV6の生産
- rAAV6産生用の試薬を準備します。
- 標準的な手法を使用して、ベクターpAAV内のAAV2の逆末端リピート(ITR)の間に相同性指向修復テンプレートを設計し、クローニングします。ホモロジーアームが両側で少なくとも~250 bpであることを確認してくださいが、構成設計で許可されている場合は、より長いホモロジーアームが望ましいですが、わずか60 bpで十分です。使用されるsgRNAのいずれかの標的配列がHDRTに存在する場合は、標的部位のプロトスペーサー隣接モチーフまたはシード領域で最も効果的なサイレント変異を使用してそれらを除去します。
注:効率的なクローニング32のためのギブソンアセンブリと組み合わせた遺伝子合成を実行できます。トランスフェクション用の正しいクローンのMaxiprepを準備します。sgRNAの設計にはCHOPCHOP33が推奨されており、その他のツールのリストは https://zlab.bio/guide-design-resources にあります。ITR を含む AAV の最大パッケージ容量は ~4.7 kb です。AAV6は、造血細胞、特にB細胞9の編集に最も一般的に使用される血清型です。アカゲザルB細胞の遺伝子編集のためのAAVの他の血清型は試験されていないが、AAV28およびAAV-DJ10,11がマウス研究で使用されている。 - 表1および表2に従って293AAV培地および生産培地を調製する。0.2 μmのポリエーテルスルホン(PES)メンブレンフィルターユニットを通した滅菌フィルター。4°Cで保存してください。
- 1xポリエチレンイミン(PEI)溶液(1 mg / mL、100 mL)を調製します。
- 250 mLのガラスビーカーで、電子レンジで~70 mLのH2Oを~30秒間加熱し、次に100 mgのPEIを加えます。マグネチックスターラーを追加し、PEIがほとんど溶解するまで攪拌します。
- 1 M HClでpHを7に調整し、次にH2Oで100 mLまで補充し、10分待ってからpHを再度確認し、必要に応じて調整します。
- PEI溶液を0.2 μmのPESメンブレンフィルターユニットで滅菌ろ過し、アリコートして-20°Cで保存します。 解凍後、溶液は4°Cで最大2ヶ月間保存できます。
- 5xポリエチレングリコール(PEG)/NaCl溶液を調製します。
- 400 gのPEG 8,000と24 gのNaClを計量します。
- 2Lガラスビーカーにマグネチックスターラーを加え、計量したPEG8,000とNaClを加え、~550mLの脱イオン水ですすいでください。
- 加熱しながらかき混ぜ、完全に溶解するまで沸騰させるか、80〜90°Cにします。
- 1 M NaOHでpHを~7.4に調整し、メスシリンダーを使用して容量を1 Lに調整し、マグネチックスターラーで2 Lガラス瓶に移します。
- このボトルをオートクレーブし、マグネチックスターラー、および溶液を水浴中で121°Cで30分間行った。
- オートクレーブ後、異なる相への分離を防ぐために、マグネチックスターラーを使用して攪拌しながら、低温室で溶液を冷却します。必要に応じて分注し、4°Cで保存する。
- 製剤バッファーを調製する。
- 500 mLのDPBSを50 μLの10%プルロニックF-68と混合します。滅菌フィルターを0.2 μm PESメンブレンフィルターユニットに通し、室温(RT)で保存します。
- 標準的な手法を使用して、ベクターpAAV内のAAV2の逆末端リピート(ITR)の間に相同性指向修復テンプレートを設計し、クローニングします。ホモロジーアームが両側で少なくとも~250 bpであることを確認してくださいが、構成設計で許可されている場合は、より長いホモロジーアームが望ましいですが、わずか60 bpで十分です。使用されるsgRNAのいずれかの標的配列がHDRTに存在する場合は、標的部位のプロトスペーサー隣接モチーフまたはシード領域で最も効果的なサイレント変異を使用してそれらを除去します。
- rAAV6生産のための細胞培養、トランスフェクション、形質導入
- 解凍、培養、および分割のための上記の293AAV培養培地およびトリプシン−EDTAを用いて製造業者によって記載された293AAV細胞を凍結する。いくつかの初期の継代を凍結し、継代40に達する前に細胞をAAV産生に使用することをお勧めします。
- rAAV6生産のために、4つの15cm細胞培養皿にそれぞれ30mLの5 x 106 細胞を播種します。細胞は、通常、播種後1〜2日で80%〜90%のコンフルエントに達すると、トランスフェクションの準備が整います。
- AAV6にパッケージ化されるHDRTを含むpAAVプラスミドのマキシプレップを解凍する。85.6 μgのpAAVプラスミドを3 mLの純粋なDMEM培地に再懸濁します。
- 342 μL の 1 mg/mL PEI 溶液を 3 mL の純粋な DMEM 培地に溶解します。両方の溶液をRTで10分間インキュベートします。
- 両方の 3 mL チューブを 1 本のチューブに ~6.4 mL のトランスフェクションミックスで混合し、RT で 20 分間インキュベートします。
- 一方、テトラサイクリン対応の自己サイレンシングヘルパーベクターRepCap6を-80°Cの冷凍庫から37°Cの水浴中で解凍します。293AAV細胞を形質導入するには、組織培養感染量の中央値(TCID 50)を使用し、1.15 x10 7 細胞/皿を仮定して、感染多重度(MOI)25でヘルパーベクターを追加します。通常、15 cmディッシュあたり2〜10 μLが使用されます。皿をそっと揺り動かして回転させて分配します。
- トランスフェクションミックスをインキュベーションした後、15 cmディッシュ4枚ずつ1.6 mLずつ滴下します。37°C、5%CO2 で一晩インキュベートします。
注:あるいは、目的のrAAV6ベクターがすでに利用可能な場合、これらのベクターを使用してパッケージ化するウイルスゲノムを提供することができ、これにより、このシステムを備えたプラスミドの必要性がなくなり、同等のrAAV6力価が得られます。このアプローチでは、293AAV細胞を、ヘルパーベクターとともに、50のMOI(rAAV6ゲノムコピー[GC]/mLに基づく)で目的のrAAV6と共形質導入します。 - 翌日、培養液を注意深く吸引して廃棄し、予温した生産培地30 mLと交換します。収穫する前にさらに96時間インキュベートします。歩留まりを最大化するために、これ以上の中程度の変更は推奨されません。
- 培地からの組換えAAV6の収穫と精製
- ディッシュから細胞を剥がすことなく、すべての細胞上清を、ろ過する培地の量よりも少なくとも50%大きい0.2 μmのPES膜を備えたフィルターユニットに集めます。次に、上清をろ過する。
注:rAAV6のより高い収率が必要な場合は、市販のキットまたは確立されたプロトコルを使用して細胞を回収し、細胞ペレットからrAAVを抽出することができます34,35。AAV6は培地36にほとんど分泌されるため、上清のみを使用し、労力、コスト、および時間を削減しました。 - 5x PEG/NaCl溶液を、採取した容量の25%でろ過した上清に加えます。30 mLの15 cmディッシュを4つ使用する場合、これは通常30 mLです。
- 転倒させてよく混合し、4°Cで一晩インキュベートしてウイルス粒子を沈殿させます。
注意: AAV粒子は、この溶液で最大2日間安定しています。 - 250 mLのチューブインサートを備えたスイングバケット遠心分離機を4°Cに予冷します。 各メンブレンを2 mLの10%プルロニックF-68でRTで少なくとも1時間前処理することにより、カットオフが100 kDaの4 mL遠心フィルターユニットと0.22 μmの親水性PESシリンジフィルターを準備します。
- AAV-PEG/NaCl混合物を250 mLチューブに移し、2,500 x g で4°Cで1時間遠心分離した後、吸引によって上清全体を慎重に除去します。
- 完全に再懸濁されるまで4 mLの1 M HEPESにボルテックスすることにより、ベージュから白色のウイルスペレットを再懸濁します。必要に応じて、5分間放置し、再びボルテックスします。5 mL血清学的ピペットを使用して再懸濁し、全容量を15 mLチューブに移します。
- ヒュームフードで、ウイルス懸濁液に同量のクロロホルム(通常は4mL)を加えます。
- 2分間激しくボルテックスした後、RTで1,000 x gで5分間遠心分離します。
- 最上層(AAV含有上清)を新しい50 mLチューブに集め、最下層(クロロホルム)を廃棄します。
注意: クロロホルム含有溶液は有害廃棄物です。その処分のための制度的ガイドラインに従ってください。 - AAV含有上清をヒュームフードの下に置き、残りのクロロホルムを30分間蒸発させます。
- その間、前処理された遠心フィルターユニットとシリンジフィルターを洗浄します。
- 前処理された遠心フィルターユニットに1.5 mLの製剤バッファーを追加します。スイングバケットローターで3,500 x g で15°Cで10分間遠心分離します。4 mLの製剤バッファーでこの手順を繰り返し、メンブレンを洗浄します。
- 5 mLシリンジを使用して、シリンジフィルターを5 mLの製剤バッファーで2回すすぎます。
- クロロホルム抽出液からの~4 mLのAAV含有上清を5 mLシリンジにロードし、洗浄したシリンジフィルターを取り付け、遠心フィルターユニットに直接ろ過します。
- 3,500 x g で15°Cで25分間遠心分離し、フィルター内のAAV溶液が約50〜100 μLであることを確認します。溶液の容量が>100 μLの場合は、遠心分離を続けます。
- ろ液を除去した後、遠心フィルターユニットのカップ内に製剤緩衝液4mLを加え、ピペッティングにより溶液を均一に混合する。3,500 x g で15°Cで25分間遠心分離し、フィルター内のAAV溶液が50〜100 μLであることを確認します。溶液の容量が>100 μLの場合は、遠心分離を続けます。別の洗浄のためにこの手順を繰り返します。
- 最後の遠心分離後、溶液の容量が50〜70μLであることを確認します。そうでない場合は、遠心分離を続けます。調製物を1.5 mLチューブに移します。必要に応じて分注し、-80°Cで保存します。
- ディッシュから細胞を剥がすことなく、すべての細胞上清を、ろ過する培地の量よりも少なくとも50%大きい0.2 μmのPES膜を備えたフィルターユニットに集めます。次に、上清をろ過する。
- qPCRによる組換えAAV6力価測定
注:qPCRプライマーはITR領域でアニールするため、pAAVにクローニングされたすべてのコンストラクトに適しているはずです。- 滴定するrAAV6のアリコートとAAV6標準物質のアリコートを解凍します。AAV6標準物質は、4 x 1011 GC / mLに近い必要があります。それ以外の場合は、それに応じて希釈を調整します。
- DNase I 消化を行い、2.0 μLのサンプルまたはAAV6標準物質を15.6 μLのヌクレアーゼフリーH 2 O、2.0μLの10x DNase Iバッファー、および0.4 μLのDNase Iと組み合わせることにより、rAAV6調製物に残っている遊離プラスミドDNAを除去します。
- 穏やかに混合し、37°Cで30分間インキュベートした後、氷に移します。これが希釈1である( 表3参照)。
- 以下の 表3 のように、すべてのサンプルとAAV6標準物質の5倍段階希釈液を水で調製します。
- SYBR グリーン qPCR マスターミックスを準備します。ウェルあたり、4.7 μLのヌクレアーゼフリー水を10 μLのSYBR Greenマスターミックス、0.15 μLのITRプライマーフォワードを100 μM、0.15 μLのITRプライマーリバースを100 μMで混合します。
注:各サンプルは、参照標準用に16ウェル、サンプルあたり8ウェル、テンプレートなしコントロール用に2ウェルで、重複して測定されます。ピペッティングエラーを考慮して、マスターミックスを10%多く準備します。 - 光学 96 ウェルまたは 384 ウェルの反応プレートに、15 μL/ウェルの SYBR Green qPCR マスターミックスをロードします。
- 次に、5 μLのサンプルとAAV6標準物質またはヌクレアーゼフリーの水をノンテンプレートコントロールにロードします。AAV6参照標準の場合、希釈2を希釈9にロードします。サンプルについては、希釈液5を希釈液8に負荷します。各希釈液を二重に測定します。泡を避けてください。
- 装填したプレートを光学透明フィルムで密封し、800 x g でRTで1分間遠心分離し、適切な96ウェルまたは384ウェルのセットアップでプレートをqPCR装置にロードします。
- 次のサイクル条件でSYBR検出を使用してqPCR装置をセットアップして実行します:98°Cで3分間、次に98°Cで15秒間、58°Cで30秒間40サイクル、その後に融解曲線が続きます。
- AAV6標準物質のゲノムコピー/ミリメートル(GC/mL)濃度を標準曲線として使用して、機器のソフトウェアでデータを解析します( 表3を参照)。希釈係数を掛けて、サンプルの最終濃度を計算します。
- 標準曲線R2 が1.0に近く、PCR効率が90%〜110%であり、ベースラインが削除され、融解曲線が単一のピークを示し、Ct 値が希釈に応じて変化し、重複が0.5 Ct以内であることを確認します。それ以外の場合は、外れ値を除外します。 図2のような利回りを期待してください。
2. B細胞培地と刺激の調製
- 解凍培地の準備:RPMI-1640と20%FCSを組み合わせます。0.2 μmのPESメンブレンフィルターユニットを通した滅菌フィルター。4°Cで保存してください。
- B細胞培養培地の調製: 表4の試薬を合わせ、0.2 μmのPESメンブレンフィルターユニットを通して滅菌フィルターをかけます。4°Cで保存してください。
- 表5のB細胞刺激剤の各々を、ヌクレアーゼフリー水に再懸濁すべきCpG ODNを除くB細胞培養培地中のストック濃度で再懸濁する。-80°Cで保存してください。
- 非B細胞陰性枯渇(オプションのステップ4)を行う場合は、2%FCS(DPBS 2%FCS)でDPBS(カルシウムなし、マグネシウムなし)を調製します。0.2 μmのPESメンブレンフィルターユニットを通した滅菌フィルター。4°Cで保存してください。
3. アカゲザルB細胞の調製と培養
注:凍結保存されたアカゲザルPBMCまたは脾細胞は、細胞培養をセットアップするために使用されます30、31。
- 解凍培地およびB細胞培養培地を37°Cの水浴中で予め温める。 表5 のB細胞刺激剤を氷上で解凍する。
- 予熱した解凍媒体を含む適切なサイズのチューブを準備します。これは理想的には解凍した細胞の体積の10倍以上でなければなりません。
- PBMCまたは脾細胞のクライオバイアルを37°Cの水浴中で一度に1〜2個解凍し、予熱した培地で調製したチューブにデカントします。クライオチューブをすすぎ、すべての細胞を収集します。
- 細胞を200 x g でRTで10分間遠心分離します。
注:これらの遠心分離設定は、PBMC収量を維持しながら血小板汚染を低減します。350 x g で5分間などの高速を使用できます。 - 洗浄のために細胞を10 mL解凍培地に再懸濁します。
- ステップ3.4とステップ3.5を合計3回の遠心分離で繰り返し、凍結培地を除去します。最後の遠心分離後、B細胞培養培地に推定~5 x 106 細胞/mLで細胞を再懸濁します。
注:上記のプロトコルは、PBMCまたは脾細胞調製物全体を他の細胞による汚染で培養します。より純粋なB細胞培養が必要な場合は、総B細胞収量は大幅に低下しますが、ステップ4に進みます。2つの方法間で編集効率に違いは見られませんでした。 - 必要に応じて10 μLの細胞アリコートをB細胞培養培地で希釈して計数します。血球計算盤およびトリパンブルー染色を用いて計数し、等量の再懸濁細胞とトリパンブルー0.4%溶液を組み合わせる。
- 細胞数に応じてB細胞培養培地で細胞濃度を3 x 106 cells/mLに調整します。次いで、表 5に記載のB細胞刺激剤をそれらの最終濃度となるように添加し、混合する。
- 細胞を適切な細胞培養皿に移します。全体的に、0.6 x 10 6-0.7 x 106セル/ cm2が推奨されます。細胞を5%CO2と共に37°Cで48時間±2時間インキュベートする。
4.非B細胞のオプションの負の枯渇
注:収量と純度は、PBMC間のB細胞の投入割合に依存し、個々のアカゲザル間で大幅に異なる可能性があります27。1 x 107 PBMCから80%〜95%の純度、60%の効率、および1 x 10 6-1.5 x10 6セルを期待してください。
- 最後の洗浄(ステップ3.6)の後、細胞をDPBS 2%FCSおよび1:200に希釈したヒトFcブロックに1 x 108 細胞/mLで再懸濁します。細胞数は、融解された細胞の数に基づいています。
- 氷上で15分間インキュベートしてFc受容体を遮断し、 表6のビオチン化抗体を加えます。氷上でさらに20分間インキュベートします。
- チューブにDPBS 2% FCSを補充し、200 x g で4°Cで10分間回転させます。
- ステップ4.1の体積の80%で細胞をDPBS 2% FCSに再懸濁します(すなわち、1 x 107 細胞あたり80 μL)。
- ステップ4.1からの体積の20%で磁気ストレプトアビジンビーズを細胞懸濁液に加える(すなわち、1 x 107 細胞当たり20μLのビーズ)。
- 細胞を氷上で15分間インキュベートし、時々攪拌します。
- 一方、1×108セルあたり 、大型の磁気空乏カラムと予備分離フィルターを備えた磁気分離器を用意する。分離前のフィルターとカラムを2 mLのDPBS 2% FCSで重力流によりすすぎ、フロースルーを廃棄します。15 mLの収集チューブを取り付けます。
注:ポジティブセレクションカラムや他の磁気ビーズ精製システムなどの他のカラムを使用すると、純度が大幅に低下する可能性があります。 - インキュベーション後、容量が<0.5 mLの場合は、DPBS 2% FCSで細胞を0.5 mLに補充します。容量が≥0.5 mLの場合は、そのまま進めてください。
- 細胞懸濁液を調製カラムの予備分離フィルターにロードし、フロースルーを15 mLチューブに回収します。
- 1 mLのDPBS 2% FCSを分離前フィルターに加え、未結合の濃縮B細胞を2回溶出します。結合していない細胞を重力流によって同じチューブに集めます。
注:追加の溶出により、収量がわずかに増加する可能性があります。純度と効率は、入力細胞、濃縮細胞、およびカラムに保持された細胞のフローサイトメトリーによって評価できます。カラムに保持されているセルを得るには、カラムを磁石から取り外し、付属のプランジャーを使用して3 mLのDPBS 2%FCSで洗い流します。所望により、表7の試薬を用いて図3のようなフローサイトメトリーにより純度を評価する。 - 濃縮B細胞を200 x g で4°Cで10分間遠心分離します。
- B細胞培養培地に推定~5 x 106 細胞/mLで細胞を再懸濁し、ステップ3.7に進みます。
5.初代アカゲザルB細胞遺伝子編集
- アカゲザルB細胞を48時間±2時間活性化した後、エレクトロポレーションおよび形質導入用の試薬を調製する。
- DMSO、ヌクレアーゼフリーの二本鎖バッファー、バッファーT、およびバッファーE(10 μLエレクトロポレーションキット)またはE2(100 μLエレクトロポレーションキット)をエレクトロポレーションキットからRTに予熱します。
- 表5のrAAV6 HDRTおよびB細胞刺激剤を氷上で解凍する。
- CRISPR-Cas9 sgRNAを100 μMのデュプレックスバッファーに再懸濁します。RTで10分間再構成し、ボルテックスとフリックで混合します。再構成したsgRNAは、使用するまで氷上に保管してください。-80°Cで保存してください。
注:CRISPR-Cas9 sgRNAは、さまざまなオンラインツール(1.1.1を参照)で設計でき、切断効率が大幅に異なる場合があります。切断効率の実証的試験は、TIDE37 やICE38などのアッセイを使用して推奨されます。 - 10 μLエレクトロポレーションあたり、表5のすべての刺激剤を含む550 μLのB細胞培養培地を調製し、1%DMSOを添加します。100 μLのエレクトロポレーション用に容量を10倍にスケーリングします。場合により、この培地の10%を抗生物質 - 抗真菌剤なしで調製することができ、これはトランスフェクション後の細胞生存率をわずかに増加させる。
- 10 μLのエレクトロポレーションごとに、50 μLのB細胞培養培地に刺激剤を使用し、抗生物質抗真菌剤を使用しない48ウェル細胞培養プレートのウェルを調製します。100 μLのエレクトロポレーションの場合、500 μLを6ウェルプレートのウェルにピペットで入れます。
- rAAV6 HDRTをウェル内の培地に添加し、ウェル内の体積の最大20%まで添加します。トランスフェクションあたりの細胞数(10 μLエレクトロポレーション:5 x 10 5細胞、100 μLエレクトロポレーション:5 x 106細胞)およびrAAV6調製液中のGCに基づいて、1 x 105-1 x 106の範囲のMOIを目指します。低容量で高MOIを達成するには、5 x 1013 GC/mLから5 x 1014 GC/mLの高rAAV6ストック濃度が推奨されます。
注:MOIが低いと編集効率が低下する可能性があり、5 x 105 のMOIは一般的にこれまでに見た最大編集効率に近いです。B細胞の生存率に対するMOIの変化の影響は観察されていません。rAAV6 HDRTなし、RNPトランスフェクションなし、および両方なしのコントロールを含めることをお勧めします。 - 準備した皿と残りの培地を5%CO2を含む37°Cのインキュベーターに移して予熱します。
- 10 μLエレクトロポレーションごとに、1.15 μLのリボ核タンパク質(RNP)を調製します:0.4 μLの61 μM Cas9と0.75 μLの100 μM sgRNAを二重鎖バッファーで混合します。ピペッティングエラーのために余分に準備し(1回のエレクトロポレーションで30%以上を推奨)、エレクトロポレーションチップをロードする際の気泡を避けます。100 μLのチップで10倍にスケールします。
- RNPをRTで少なくとも15分間インキュベートしてから、細胞と混合します。インキュベーション後、複数の遺伝子座を同時に標的にする場合は、複数のRNPを組み合わせることができます。同時に最大3つの遺伝子座で効率に大きな違いは観察されていません。
- その間、エレクトロポレーション用のセルを準備します。温度ショックを避けるために、セルを常にRTに保ちます。培養の48時間±2時間後に細胞を適切な容器に回収します。最大数の細胞を集めるためにDPBSで皿をすすぎます。
- 細胞を200 x g でRTで10分間遠心分離し、上清を廃棄し、細胞を~2 x 106 細胞/mLのDPBSに再懸濁します。
- 10 μLのトリパンブルー0.4%溶液と10 μLの細胞懸濁液を組み合わせ、血球計算盤を使用してカウントします。
注:この時点で、収穫および洗浄中の損失により、48時間±2時間早く培養された細胞の約60%が予想されます。 - その間、細胞を200 x g でRTで10分間遠心分離し、上清を廃棄し、残っているDPBSを最小限に抑えるようにします。上記の細胞数に基づいて、5.55 x 107 細胞/mLの予熱(RT)バッファーTに細胞を再懸濁します。
- トランスフェクションシステムを設定するには、マシンの電源を入れ、1,350 V、15 ms、1パルスに設定します。ピペットステーションを層流フード内に置きます
- 10 回のエレクトロポレーションセットごとに、3 mL のバッファー E(10 μL トランスフェクションの場合)または E2 (100 μL トランスフェクションの場合) を含むトランスフェクションチューブを調製します。チューブをピペットステーションに挿入します。
- 10 μLのエレクトロポレーションごとに、1.15 μLのRNPと9 μLの細胞を組み合わせます。エレクトロポレーションチップに空気が吸引されないように、十分な量(+ 30%)があることを確認してください。エレクトロポレーションの前にRTで1〜2分間インキュベートします。
- 10 μLまたは100 μLのRNPと細胞混合物をエレクトロポレーションピペットの適切なサイズのエレクトロポレーションチップに吸引し、ロードしたピペットをピペットステーションに挿入して、エレクトロポレーションを開始します。アーク放電を防ぐために、チップに気泡が完全にないことを確認してください。エレクトロポレーション中に監視して、アーク放電が発生しないことを確認します。
- エレクトロポレーションした細胞を、48ウェル(10 μLトランスフェクション)または6ウェルプレート(100 μLトランスフェクション)内のrAAV6の有無にかかわらず、調製し、予熱した少量の培地に直ちに排出します。残りのサンプルで手順5.15〜5.17を繰り返します。トランスフェクションなしでコントロールサンプルを培養ウェルに追加します。
- 細胞を5%CO2 で37°Cで4時間±2時間インキュベートし、次に、刺激剤、DMSO、および抗生物質/抗真菌剤を含む調製し、予熱したB細胞培養培地を加えます:10 μLトランスフェクションの場合は450 μL、100 μLトランスフェクションの場合は4.5 mL。
- 5%CO2を用いて37°Cで12 〜24時間インキュベーションを続ける。その後、長期培養が必要な場合は、刺激剤と抗生物質/抗真菌剤を含まないB細胞培養培地に変更してください。ゲノムDNAの分析は24時間後に行うことができます。相同性アームの外側のプライマーおよびインサート内のプライマーを用いたデジタルドロップレットPCRは、編集効率を定量するために使用することができる39。PCRを実行して挿入部位を増幅し、サンガーシーケンシングを実行して正しい編集を確認します。
- タンパク質レベルの分析のために、エレクトロポレーション後に40〜48時間細胞を培養してタンパク質発現変化を許容し、 表7の試薬を用いてフローサイトメトリーによる分析を行った。
結果
テトラサイクリン対応の自己サイレンシングアデノウイルスヘルパーを使用したrAAV6の生産は、平均して4 x 10 10 GC/mLの細胞培養培地の生産をもたらし、したがって、標準的なヘルパーフリーのトリプルトランスフェクションを使用した生産を30〜40 倍上回りました(図2)。
アカゲザルB細胞を任意に精製した結果、CD3+ T細胞とCD14+および/またはCD16+骨髄系細胞の大部分が排除され、80%〜95%のCD20+ B細胞の純度が日常的に得られました(図3)。マウスB細胞7での以前のデザインに基づいて、アカゲザルB細胞のB細胞受容体特異性を編集すると同時に、定常領域の破壊によって内因性抗体軽鎖を欠失させることにより、大多数のB細胞の対立遺伝子排除を維持する方法を開発しました。アカゲザルB細胞の最終IGHJ遺伝子とEμエンハンサーの間のIGH遺伝子座に挿入するプロモーターレスHDRTを構築しました(図4)。この構築物は、成熟B細胞において自然に再編成された上流VDJ領域の内因性VHプロモーターを利用しており、したがって、エピソームAAVゲノムによって発現されない。さらに、この構築物は、細胞表面上に発現される下流の抗体重鎖定常領域へのスプライシングを必要とする。したがって、フローサイトメトリーによって示される細胞表面上の特異的抗原結合は、正しい標的遺伝子座の組み込みおよび挿入された配列が機能的であることを示す。
アカゲザル由来の抗HIVbNAb 40であるAb1485をコードする抗体Ab1485をrAAV6にパッケージングし、上記のように活性化初代アカゲザル脾細胞またはPBMC培養物の編集に使用しました(図5A)。このプロトコルは、高い細胞生存率(~90%)を維持しながら、同時にB細胞の~80%で軽鎖発現を削除しました。B細胞の大部分は依然としてアイソタイプIgMを発現していた(図5B)。Ab1485 HDRTをコードするrAAV6の添加は、未編集のB細胞よりも抗体鎖の蛍光強度が低いにもかかわらず、B細胞の16%〜21%で遺伝子編集およびAb1485表面発現をもたらした(図5A)。これは、抗原染色とフローサイトメトリーで表面BCRを検出するために使用されるモノクローナルとの間のエピトープ競合、およびHDRTのポリシストロニックな性質と効率の低いスプライシングによる実際のタンパク質発現の低下の結果である可能性があります。1%DMSOを添加し、rAAV6 HDRTとの濃縮インキュベーションを延長すると、一般的に編集効率が向上しました(図6A-C)。この特定の方法を使用すると、通常5%〜20%、最大40%の編集効率が、個々のアカゲザル(図5A、図6A〜E)およびrAAV6 HDRTバッチの品質(図6E)に応じて達成されます。全体として、アカゲザルB細胞の効率的なrAAV6産生、および培養、精製、および遺伝子編集のためのプロトコルを紹介します。
| 試薬 | 容積 | 株式 | 最終濃度 |
| DMEM, 高グルコース | 500ミリリットル | 1×1 | ~ 88.5% |
| FCS, 熱不活性化 | 50ミリリットル | 1×1 | ~ 8.85% |
| 抗生物質/抗真菌薬 | 5ミリリットル | 100× | 1×1 |
| グルタミン | 5ミリリットル | 200ミリメートル | 2ミリメートル |
| ピルビン酸ナトリウム | 5ミリリットル | 100ミリメートル | 1ミリリットル |
表1:293AAV細胞培養培地。
| 試薬 | 容積 | 株式 | 最終濃度 |
| DMEM, 高グルコース | 500ミリリットル | 1×1 | ~ 95.2% |
| FCS, 熱不活性化 | 10ミリリットル | 1×1 | ~ 1.9% |
| 抗生物質/抗真菌薬 | 5ミリリットル | 100× | 1×1 |
| グルタミン | 5ミリリットル | 200ミリメートル | 2ミリメートル |
| ピルビン酸ナトリウム | 5ミリリットル | 100ミリメートル | 1ミリリットル |
表2:293AAV細胞生産培地。
| 希釈シリーズ | サンプル量(μL) | 希釈剤と容量 | 希釈係数 | 全希釈 | リファレンス AAV6 |
| GC/mL | |||||
| 希釈1 | 2 μL サンプルまたは AAV 標準物質 (4.1 x 1011 GC/mL) | 18 μL DNAseI バッファーおよび酵素 | 10× | 10× | 4.1×1010 |
| 希釈2 | 15 μL ディル 1 | 60 μL H2O | 5倍 | 50× | 8.2×109 |
| 希釈3 | 20 μL ディル 2 | 80 μL H2O | 5倍 | 250× | 1.6×109 |
| 希釈4 | 20 μL ディル 3 | 80 μL H2O | 5倍 | 1250× | 3.3×108 |
| 希釈 5 | 20 μL ディル 4 | 80 μL H2O | 5倍 | 6250倍 | 6.6×107 |
| 希釈 6 | 20 μL ディル 5 | 80 μL H2O | 5倍 | 31250× | 1.3×107 |
| 希釈 7 | 20 μL ディル 6 | 80 μL H2O | 5倍 | 156250× | 2.6×106 |
| 希釈 8 | 20 μL ディル 6 | 80 μL H2O | 5倍 | 781250× | 5.24×105 |
| 希釈9 | 20 μL ディル 7 | 80 μL H2O | 5倍 | 3906250× | 1.05×105 |
表3:qPCR希釈表。
| 試薬 | 容積 | 株式 | 最終濃度 |
| RPMI-1640 | 420ミリリットル | 1×1 | 84% |
| FCS, 熱不活性化 | 50ミリリットル | 1×1 | 10% |
| 抗生物質/抗真菌薬 | 5ミリリットル | 100× | 1×1 |
| グルタミン | 5ミリリットル | 200ミリメートル | 2ミリメートル |
| ピルビン酸ナトリウム | 5ミリリットル | 100ミリメートル | 1ミリリットル |
| ヘペス | 5ミリリットル | 1メートル | 10ミリメートル |
| 2-B-メルカプトエタノール | 550 μL | 55ミリメートル | 55マイクロメートル |
| 非必須アミノ酸 | 5ミリリットル | 100× | 1×1 |
| インスリン-トランスフェリン-セレン | 5ミリリットル | 100× | 1×1 |
表4:B細胞培養培地。
| 試薬 | 希釈 | 株式 | 最終濃度 |
| メガCD40L | 1:1000 | 100 μg/mL | 100 ng/mL |
| CpG ODN | 1:300 | 1ミリグラム/ミリリットル | 3.33 μg/mL |
| 人間バフ | 1:1000 | 40 μg/mL | 40 ng/mL |
| ヒトIL-2 | 1:1000 | 50 μg/mL | 50 ng/mL |
| ヒトIL-10 | 1:1000 | 50 μg/mL | 50 ng/mL |
表5:B細胞刺激剤。
| 抗体 | クローン | 希釈 | 最終コンク |
| 抗ヒトCD3 | FN-18 | 1:40 | 2.5 μg/mL |
| 抗ヒトCD8a | RPA-T8 | 1:200 | 2.5 μg/mL |
| 抗ヒトCD14 | M5E2 | 1:200 | 2.5 μg/mL |
| 抗ヒトCD16 | 3G8 | 1:200 | 2.5 μg/mL |
| 抗ヒトCD33 | AC104.3E3 | 1:50 | 1テスト |
| 抗ヒトCD64 | 10.1 | 1:800 | 0.625 μg/mL |
| 抗ヒトCD66 | テト2 | 1:11 | 1テスト |
| 抗ヒトCD89 | A59 | 1:800 | 0.625 μg/mL |
表6:非B細胞の任意の枯渇に対する抗体。
| 試薬 | タイプ/クローン | 作業希釈/濃度 |
| 反人間CD14 AlexaFluor647 | M5E2 | 1:50 |
| 抗人間CD16 AlexaFluor700 | 3G8 | 1:50 |
| 抗ヒトCD20 PECy7 | 2H7 | 1:50 |
| 抗ヒトCD3 PE | SP34-2 | 1:50 |
| ゾンビ近赤外 | - | 1:500 |
| 抗ヒト型HLA-DR BV605 | L243 | 1:200 |
| 抗ヒトIg軽鎖ラムダAPC | MHL-38 | 1:50 |
| 反人間カッパライトチェーンFITC | ポリクローナル | 1:500 |
| 抗ヒト型IgM BV421 | MHM-88 | 1:50 |
| RC1抗原、ランダムにビオチン化 | - | 5 μg/mL |
| ストレプトアビジン-PE | - | 1:500 |
表7:分析用フローサイトメトリー試薬。
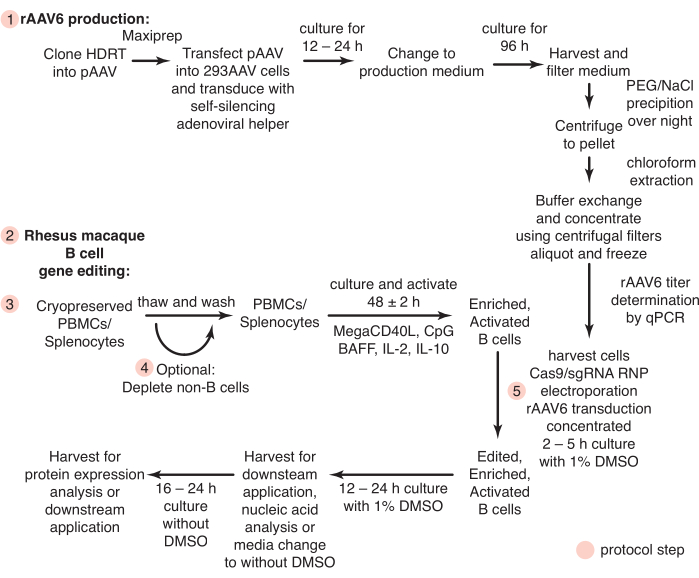
図1:初代アカゲザルB細胞のrAAV6産生と遺伝子編集の概略図。 プロトコルは、アカゲザルB細胞のrAAV6産生(ステップ1)および遺伝子編集(ステップ2〜5)に分けられ、非B細胞の枯渇のための任意のステップ(ステップ4)を含む。プロトコルのステップは赤い円で示されています。 この図の拡大版を表示するには、ここをクリックしてください。
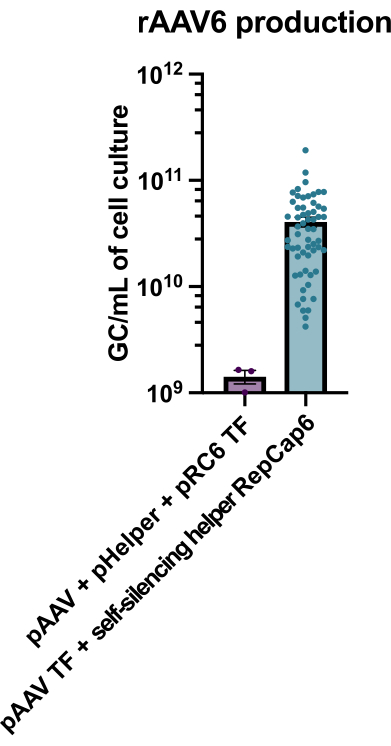
図2:自己サイレンシングアデノウイルスヘルパーを用いた高rAAV6収率 。 rAAV6は、ここに記載の方法(pAAVトランスフェクション[TF] + 自己サイレンシングヘルパーRepCap6、セルフサイレンシングアデノウイルスヘルパー)またはpAAV、pHelper、およびpRepCap6(pRC6)の典型的なヘルパーフリートリプルトランスフェクションを使用して製造されました。rAAV6は細胞上清のみから精製した。自己サイレンシングアデノウイルスヘルパーベクターを用いた方法は、上記のように、qPCRによって30〜40倍以上のrAAV力価を生じた。各ドットは、2〜20の独立した実験からの様々なpAAV構築物を用いた個々のrAAV産生を表す。SEM±平均がプロットされます。 この図の拡大版を表示するには、ここをクリックしてください。
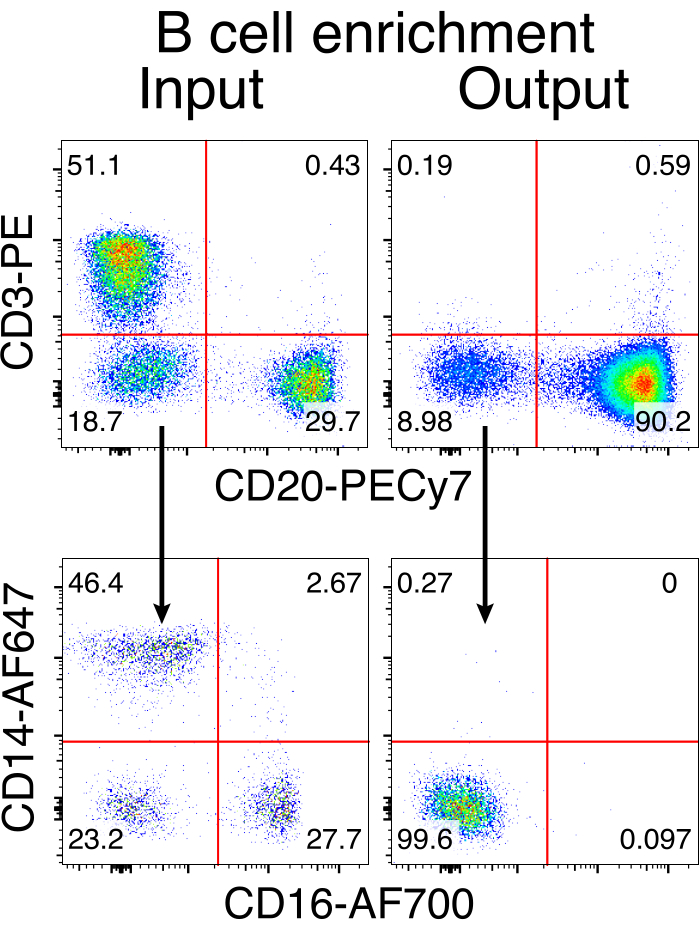
図3:非B細胞の負の枯渇によるB細胞濃縮。 アカゲザルB細胞は、記載されたプロトコルを用いてPBMCから濃縮され、90%の純度まで濃縮された。エンリッチメント前の入力とエンリッチメント後の出力が表示されます。ライブのシングレットPBMCでゲートされ、5つの独立した実験の代表です。 この図の拡大版を表示するには、ここをクリックしてください。
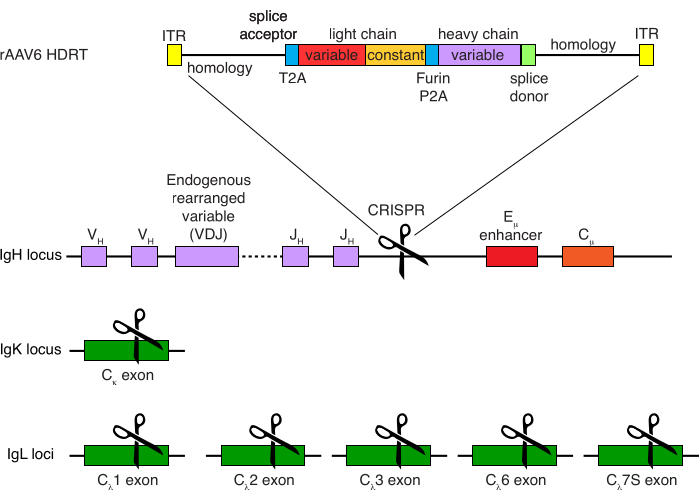
図4:アカゲザルB細胞のB細胞受容体特異性を編集するために使用されるターゲティング戦略。 rAAV6は、描かれているHDRTを含むように製造されました。HDRTは、266 bp 5'相同性アーム、111 bpのアカゲザルIGHMエクソン1スプライスアクセプター、次に トセアアシグ ナウイルス自己切断2Aペプチド配列(T2A)を有するGSGリンカー、続いてリーダー配列、およびアカゲザルIGLC1としてのアカゲザル抗体Ab1485の完全な軽鎖で構成されています。これに続いて、フューリン切断部位、GSGリンカー、およびブタテスコウイルス自己切断2Aペプチド配列(Furin-P2A)、続いて別のリーダー配列およびAb1485重鎖変数、続いて52 bpのアカゲザルIGHJ4スプライスドナー配列、下流の抗体重鎖定常領域へのスプライシングを可能にする、および514 bp相同性アームが続く。この構築物を、sgRNA標的配列GAGATGCCAGAGCAAACCAGを用いて、最後のIGHJ遺伝子とEμエンハンサーとの間のIGH遺伝子座に標的化した。両方の相同性アームは、このsgRNAの切断部位で終了するように設計されているため、標的配列が除去され、最適な統合効率が可能になります。同時に、対立遺伝子の排除と単一のB細胞受容体の発現を維持するために、標的配列GGGGGAAGATGAAGAAGAGAGAGAGAGAGAGAGAGAGAGAGAGおよび標的配列CTGATCAGTGTctacccを用いたアカゲザルIGKCを標的とするsgRNAおよびIGLC1、IGLC2、IGLC3、IGLC6、およびIGLC7Sを用いて内因性軽鎖を欠失させた。HDRTには、このsgRNAによるIGLC1配列の切断を妨げるサイレント変異が含まれていました。 この図の拡大版を表示するには、ここをクリックしてください。
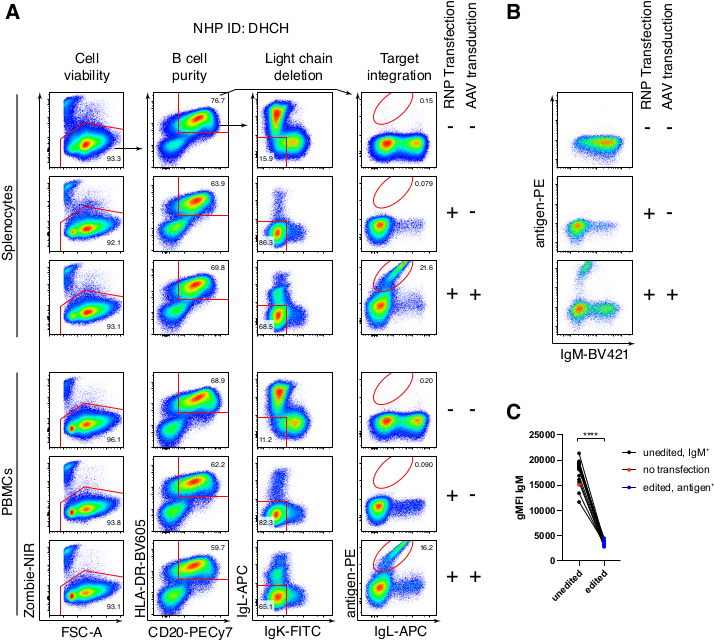
図5:初代アカゲザルB細胞の遺伝子編集 。 (A)同じアカゲザルの初代脾細胞(上パネル)またはPBMC(下パネル)を非B細胞を枯渇させることなく培養し、上記のように編集した。ターゲティング戦略は 図4の通りでした。エレクトロポレーションの2日後、細胞を回収し、フローサイトメトリー分析のために表面染色しました。一番上の行に示すように、左側の列はシングレットセルでゲートされ、他の列はゲートされました。細胞の生存率、B細胞の純度、軽鎖の欠失効率、および特異的抗原RC141 による染色によるAb1485のノックイン効率は、未処理、RNPトランスフェクト、またはRNPトランスフェクト+rAAV6トランスフェクトサンプル(MOI = 5 x 105)で示されています。異なるアカゲザルからの細胞を用いた6つの独立した実験の代表。(B)培養アカゲザルB細胞コントロール上または編集後のIgM発現、および(C)IgLCおよびIgKCターゲティングによりIg発現が失われていないB細胞上のIgMの幾何平均蛍光強度(gMFI)または予想される抗原に結合するB細胞(編集済み)。赤い点は、培養された非トランスフェクトコントロールB細胞のgMFIを示す。対応のあるt検定で p <0.0001を示します。 この図の拡大版を表示するには、ここをクリックしてください。
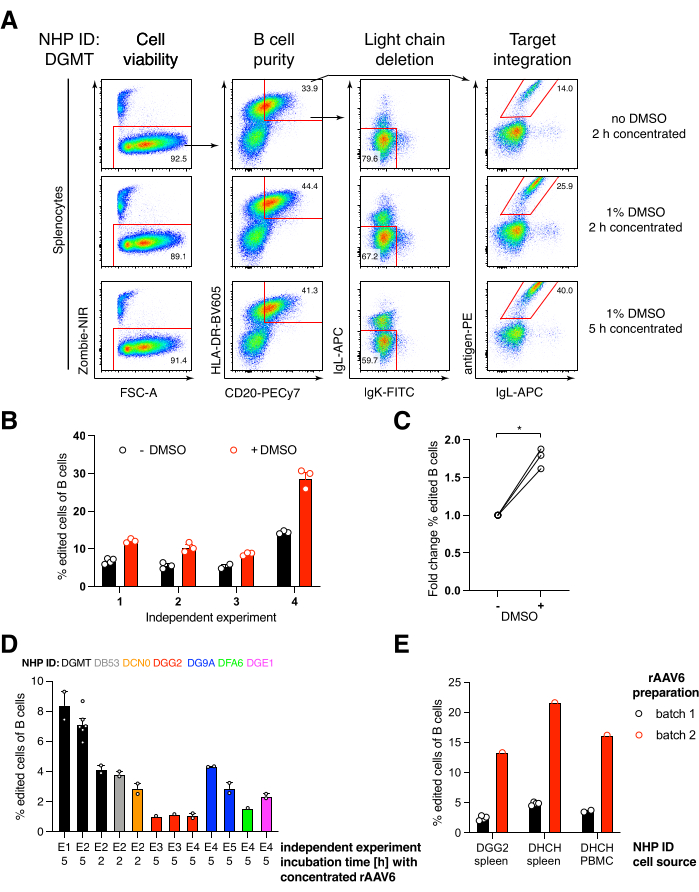
図6:初代アカゲザルB細胞の遺伝子編集効率に対するDMSO、rAAV6 HDRTによる長期濃縮インキュベーション、rAAVバッチ品質、および異なるドナーNHP間の再現性の影響。 (A)脾細胞を培養し、記載したように編集した。エレクトロポレーション後、5 x 10 5細胞を1%DMSOの有無にかかわらず培地で培養し、rAAV6 HDRTを含む50 μLの培地中で5 x 10 5のMOIで2時間または5時間インキュベートした後、さらに450 μLの培地を添加しました。細胞を、図5のようにフローサイトメトリーによってエレクトロポレーションの2日後に分析した。4つの独立した実験の代表。(B)4回の独立した実験にわたる(A)の定量化。ドットは、トランスフェクション設定が1,350 V、10-20 ms、1パルスのエレクトロポレーション持続時間、DMSO濃度が0.75%-1.25%の範囲のテクニカルレプリケートを示しています。(C)(B)からの編集効率の平均倍率変化。* p > マン・ホイットニーU検定では0.05。(D)低効率の商用rAAV6バッチを使用した異なるマカクでの独立した実験に対する編集効率。(E)同じ実験において、同じ構築物を2つの異なるNHPのB細胞にパッケージ化したrAAV6の2つの異なる市販バッチを使用した編集効率。ドットは、1,350 V、10-20 ms、および1パルスエレクトロポレーションのトランスフェクション設定によるテクニカルレプリケートを示します。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここで紹介するプロトコルは、rAAV6をHDRTとして高収率と力価を生成するための迅速かつ効率的な方法と、 in vitroで初代アカゲザルB細胞を効率的に遺伝子編集するための新しい方法を提供します。
rAAV6生産プロトコルは比較的シンプルで高速であり、過度の労力をかけずに多くの異なる構造を同時に生産およびテストすることができます。所望であれば、rAAV6は、緩衝液交換および濃縮の前に、ヨージキサノール勾配超遠心分離34 または水性二相分配35 などの確立されたプロトコールを用いてさらに精製することができる。
全体的な収率は低下したが、rAAV6の大部分が培地36に放出され、細胞ペレットからの精製はコストと労力が増えるため、細胞ペレットからの精製ではなく、血清還元細胞培養培地のみを使用することを選択した。自己不活性化アデノウイルスヘルパーを使用すると、収量が平均30〜40倍に増加し、単一の15 cmディッシュでAAV6にパッケージ化されたコンストラクトの試験が可能になりました。我々の精製法は基本ですが、この方法を用いると、様々な細胞株や他の初代細胞を用いた形質導入後の遺伝子編集効率や細胞生存率のバッチ間のばらつきが比較的少ない(データ未掲載)。
我々は、望ましくない集団の負の枯渇を使用して手つかずの初代B細胞を得るために、アカゲザルB細胞精製プロトコルを開発しました。これらの細胞の遺伝子編集には必要ありませんが、他の細胞型が実験目標を妨害する場合に、このアプリケーションまたは他のアプリケーションのために、初代アカゲザルB細胞の比較的純粋な集団を得る方法を提供します。ただし、純度はB細胞全体の収率を低下させるという犠牲を伴います。特に、濃縮B細胞培養と非濃縮B細胞培養の両方にとって、初期PBMCまたは脾細胞調製物中のB細胞の画分が重要です。特にPBMCの場合、末梢血中のB細胞の割合が高い個体に対して異なるマカクザルをスクリーニングして、実験用のB細胞の数が多いことを推奨します。PBMCは、定期的な出血または白血球アフェレーシスによって得ることができる42。
遺伝子編集プロトコルは、通常、ノックアウトB細胞の60%〜80%からノックインB細胞の5%〜20%の間の効率的な遺伝子編集につながりますが、最大90%のBCRノックアウトと40%のBCRノックインB細胞を達成しました(図5 および 図6)。
アカゲザルB細胞を効率的に編集するための主要なパラメータは、sgRNAの切断効率、エレクトロポレーションパラメータ、MOI、およびrAAV6調製の品質です。候補sgRNAの切断効率は、HDRTの最適な編集と設計を可能にするために経験的に決定する必要があります。ここに提示されるエレクトロポレーションパラメータは、効率と生存率のバランスを取り、編集されたB細胞の最大割合ではなく、編集されたB細胞の最大数を取得します。編集された細胞の割合を高くする必要がある場合は、電圧の増加(最大1,750 V)またはパルス長の変更(10〜30 ms)が推奨されますが、より多くの細胞死が観察される可能性があります。また、同じ個体のPBMCのB細胞と比較して、脾臓のB細胞の編集効率がわずかに高いことも確認しました(図5)。ただし、この根本的な理由は現在不明です。
エレクトロポレーション後に1%DMSOを添加すると、アカゲザルB細胞では細胞の生存率に影響を与えることなく遺伝子編集効率が~40%有意に向上し(図6A-C)、他の細胞での報告と一致していることがわかりました43。ただし、1%DMSOでの長期培養は避けるべきであり、細胞の生存率に影響を与える可能性があります。DMSOは、必要に応じて完全に省略できます。
rAAV6と一緒に数時間エレクトロポレーションした後の少量の細胞の培養は、おそらくrAAV6によるHDRTのより良い形質導入、したがってCas9が活性である関連時間におけるHDRTのより高い細胞内濃度のために、より高い編集効率をもたらす。この方法で最大8時間培養しても細胞の生存率には影響しませんが、編集効率は5時間を超えて劇的に増加しないことがわかりました(図6)。ノックインではなくノックアウトのみが必要な場合は、この手順を省略できます。
結論として、アカゲザルB細胞のin vitro での遺伝子編集と、目的の構築物の効率的なノックインに必要なrAAV6 HDRTの生産のための包括的なプロトコルを提示します。これらのプロトコルは、rAAV6としてパッケージ化された多くのコンストラクトの迅速で費用効果の高い試験を可能にし、より関連性の高い非ヒト霊長類モデルにおけるB細胞療法の実現可能性とスケーラビリティの前臨床試験を可能にします。
開示事項
競合する利害関係は宣言されていません。
謝辞
RC1抗原を提供してくれたハリー・B・グリスティックとパメラ・ビョークマン、そして重要な議論のためにヌッセンツヴァイクとマーティンの研究所全体に感謝します。この研究は、ビル・アンド・メリンダ・ゲイツ財団の助成金INV-002777(M.C.N.)および国立衛生研究所の国立アレルギー感染症研究所の学内研究プログラムによって支援されました。(R.G.とM.A.M.)。M.C.N.はHHMIの調査員です。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
参考文献
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. Protein Electrophoresis - Serum., 6th edition. , Elsevier Saunders. St Louis, MO. 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850(2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851(2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995(2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630(2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934(2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144(2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973(2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855(2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182(2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168(2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686(2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991(2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637(2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved