Method Article
تصوير أحادي الجزيء للحركة الجانبية ونشاط القناة الأيونية في طبقات الدهون المزدوجة باستخدام المجهر الفلوري للانعكاس الداخلي الكلي (TIRF)
In This Article
Summary
يصف هذا البروتوكول كيفية استخدام مجهر TIRF لتتبع القنوات الأيونية الفردية وتحديد نشاطها في الأغشية الدهنية المدعومة ، وبالتالي تحديد التفاعل بين حركة الغشاء الجانبي ووظيفة القناة. يصف كيفية تحضير الأغشية وتسجيل البيانات وتحليل النتائج.
Abstract
أظهرت تقنيات التصوير عالية الدقة أن العديد من القنوات الأيونية ليست ثابتة ، ولكنها تخضع لعمليات ديناميكية للغاية ، بما في ذلك الارتباط العابر لتشكيل المسام والوحدات الفرعية المساعدة ، والانتشار الجانبي ، والتجميع مع البروتينات الأخرى. ومع ذلك ، فإن العلاقة بين الانتشار الجانبي والوظيفة غير مفهومة بشكل جيد. للتعامل مع هذه المشكلة ، نصف كيف يمكن مراقبة الحركة الجانبية ونشاط القنوات الفردية في الأغشية الدهنية المدعومة وربطها باستخدام مجهر الانعكاس الداخلي الكلي (TIRF). يتم تصنيع الأغشية على ركيزة هيدروجيل فائقة النحافة باستخدام تقنية ثنائية الطبقة واجهة القطيرات (DIB). بالمقارنة مع الأنواع الأخرى من الأغشية النموذجية ، تتمتع هذه الأغشية بميزة كونها قوية ميكانيكيا ومناسبة للتقنيات التحليلية شديدة الحساسية. يقيس هذا البروتوكول التدفق الأيوني Ca 2+ من خلال قنوات مفردة من خلال مراقبة انبعاث التألق لصبغة حساسة ل Ca2+ على مقربة من الغشاء. على عكس نهج تتبع الجزيء الواحد الكلاسيكي ، لا يلزم وجود بروتينات أو ملصقات اندماج فلورية ، والتي يمكن أن تتداخل مع الحركة الجانبية والوظيفة في الغشاء. التغييرات المحتملة في تدفق الأيونات المرتبطة بالتغيرات التوافقية للبروتين ناتجة فقط عن الحركة الجانبية للبروتين في الغشاء. يتم عرض النتائج التمثيلية باستخدام قناة نقل بروتين الميتوكوندريا TOM-CC والقناة البكتيرية OmpF. على عكس OmpF ، فإن بوابة TOM-CC حساسة للغاية للحبس الجزيئي وطبيعة الانتشار الجانبي. ومن ثم ، فإن الطبقات الثنائية لواجهة القطيرات المدعومة هي أداة قوية لتوصيف الارتباط بين الانتشار الجانبي ووظيفة القنوات الأيونية.
Introduction
يهدف هذا البروتوكول إلى وصف كيفية دراسة العلاقة بين حركة الغشاء ونفاذية القناة الأيونية للبروتينات الغشائية في الأغشية ثنائية الطبقة ذات السطح البيني (DIB) المدعومة بالبوليمر1،2،3.
تكمل التقنية الحالية مجموعة رائعة من الأدوات التحليلية البصرية والسطحية المتقدمة ، مثل تتبع الجسيمات المفردة4,5 ، والتحليل الطيفي للارتباط الفلوري6,7 ، ومجهر القوة الذرية عالي السرعة 8,9,10. توفر هذه رؤى قيمة حول التركيب الديناميكي وهيكل الأغشية التي تؤثر على التفاعلات القائمة على الغشاء11،12،13. بينما تعتمد الحركة والانتشار الجانبي للبروتينات على الكثافة المحلية للبروتينات في الغشاء ، يمكن أيضا احتجاز جزيئات البروتين الفردية في طوافات الدهون14 وتفاعلات البروتينوالبروتين 15,16. اعتمادا على مجالات البروتين البارزة من الغشاء إلى البيئة خارج الخلية أو العصارة الخلوية ، يمكن أن تختلف حركة البروتين من متحركة للغاية إلى غير متحركة تماما. ومع ذلك ، نظرا لتعقيد الغشاء وهياكله المحيطية ، غالبا ما يكون من الصعب فك التفاعل بين طبيعة الحركة الجانبية ووظيفة البروتين17.
أثبتت أغشية DIB أنها منصة فعالة لتحليلات الجزيء الأحادي البيوفيزيائي للبروتينات الغشائية18،19،20،21،22. تتشكل عن طريق التجميع الذاتي للدهون من خلال ملامسة القطرات المائية مع ركائز مدعومة بهيدروجيل في مرحلة الدهون / الزيت. على غرار طبقات الدهون الثنائية المدعومة شائعة الاستخدام (SLBs) 1،23،24،25 ، تسمح DIBs بالضبط المحلي للحركة الجانبية عن طريق الارتباط المؤقت أو الدائم للبروتينات بمصفوفة البوليمر عند تشغيلها باستخدام روابط مناسبة17. هذا الأخير يمكن أن يكون بمثابة نظام نموذجي للعمليات الكيميائية الحيوية في أغشية الخلايا مع توزيع البروتين غير المتجانسة10.
يعتمد النهج التجريبي الموصوف هنا على مضان الأصباغ الحساسة للكالسيوم 2+ لقياس تدفق أيون الكالسيوم 2+ من خلال القنوات الفردية على مقربة من الغشاء 2,22 باستخدام مجهر TIRF. يحد هذا النهج البصري من إضاءة العينة إلى مسافة قريبة من الغشاء ، مما يؤدي ، بسبب الخصائص الفيزيائية لضوء الإثارة الزائل ، إلى انخفاض كبير في خلفية التألق. هذا الأخير هو شرط أساسي إذا كانت هناك حاجة إلى دقة مكانية وزمانية عالية للكشف عن جزيئات واحدة. على عكس الطرق الكهربية الكلاسيكية26،27 ، لا يلزم وجود جهد غشائي لدراسة تدفق الأيونات من خلال القنوات الفردية. علاوة على ذلك ، لا تتطلب الطريقة وضع العلامات على أصباغ الفلورسنت أو الجزيئات التي يمكن أن تتداخل مع الحركة الجانبية للقنوات في الغشاء.
هذه الطريقة مفيدة بشكل خاص لدراسة قنوات البروتين المضمنة في الغشاء على مستوى الجزيء الواحد دون استخدام الفيزيولوجيا الكهربية الكلاسيكية. باستخدام قناة توصيل بروتين الميتوكوندريا TOM-CC من Neurospora crassa28،29،30 و OmpF ، والتي تدعم انتشار الجزيئات الصغيرة المحبة للماء عبر الغشاء الخارجي للإشريكية القولونية17،31 ، نوضح كيف يمكن دراسة وربط حركات الغشاء وأنشطة القناة للبروتينين. نقترح أن هذا النهج ، على الرغم من تحسينه ل TOM-CC و OmpF ، يمكن تطبيقه بسهولة على قنوات البروتين الأخرى.
Protocol
1. إنتاج البروتين
ملاحظة: يصف هذا القسم الإجراء الخاص بعزل OmpF من الإشريكية القولونية BE BL21 (DE3) omp631,32 ، والتي تفتقر إلى LamB و OmpC ، ومركب TOM الأساسي من Neurospora crassa (الشكل 1)28,29. يتطلب هذا الأخير عزل الميتوكوندريا من سلالة N. crassa 28 التي تحتوي على شكل يحمل علامة 6xHis من الوحدة الفرعية TOM Tom22 (الشكل 1A) ، والتي يمكن عزلها كما هو موضح28. عادة ما تنتج البروتوكولات التالية 1-2 ملغ من N. crassa TOM-CC و 10 ملغ من الإشريكية القولونية OmpF. إذا كان سيتم تعديل الكمية ، فمن المهم الحفاظ على نسب البروتين / المنظفات بدقة. ما لم ينص على خلاف ذلك ، يجب تنفيذ جميع الخطوات عند 4 درجات مئوية.
- عزل مجمع TOM الأساسي
- إذابة الميتوكوندريا النقية N. crassa (2 جم من البروتين) التي تم الحصول عليها عن طريق الترسيب التفاضلي من حوالي 1.5 كجم (وزن رطب) خيوط ، وفقا ل Bausewein et al.30 ، بتركيز بروتين 10 مجم / مل في 20 مللي مول Tris-HCl (درجة الحموضة 8.5) ، 1٪ (وزن / حجم) DDM ، 20٪ (v / v) جلسرين ، 300 مللي مول كلوريد الصوديوم ، 20 مللي مول إيميدازول ، و 1 مللي متر فينيل ميثيل سلفونيل فلوريد (PMSF) لمدة 30 دقيقة عند 4 درجات مئوية.
تنبيه: PMSF سام. ارتداء معدات الحماية الشخصية المناسبة. - نقل الميتوكوندريا القابلة للذوبان إلى أنابيب الطرد المركزي الفائقة وفصل الأغشية غير القابلة للذوبان عن بروتينات الغشاء القابل للذوبان عن طريق الطرد المركزي الفائق عند 130000 × جم لمدة 40 دقيقة عند 4 درجات مئوية والترشيح باستخدام ورق ترشيح قياسي.
- قم بموازنة عمود Ni-NTA معبأ مسبقا (حجم 5 مل) مع حوالي 5 أحجام أعمدة (CV) من المخزن المؤقت A1 (الجدول 1) باستخدام نظام تنقية البروتين الآلي. قم بتشغيل عمود Ni-NTA بمعدل تدفق ثابت يبلغ 1 مل / دقيقة أثناء جميع الخطوات. استخدم عمودا أقل حجما (1 مل) إذا تم عزل البروتينات من أقل من 2 جم من الميتوكوندريا.
- قم بتحميل عينة البروتين المذاب على عمود Ni-NTA بمعدل تدفق 1 مل / دقيقة.
- اغسل عمود Ni-NTA ب 5 CV من المخزن المؤقت A1 (الجدول 1) لإزالة البروتينات غير المنضمة.
- Elute His-Taged TOM-CC مع 30٪ عازلة A2 (الجدول 1 ؛ 300 مللي متر إيميدازول) وجمع ذروة البروتين كما تظهر في مخطط كروماتوجرام 280 نانومتر (الشكل 1 ب).
- لمزيد من تنقية TOM-CC ، قم بموازنة عمود تبادل الأنيون المعبأ مسبقا (1 مل) مع 5 CV لكل من المخزن المؤقت B1 و B2 و B1 (الجدول 1) باستخدام نظام تنقية البروتين الآلي. قم بتشغيل عمود تبادل الأنيون بمعدل تدفق ثابت قدره 1 مل / دقيقة خلال جميع الخطوات.
- قم بتحميل جزء الذروة TOM-CC (الخطوة 1.1.6) على عمود تبادل الأنيون (معدل تدفق 1 مل / دقيقة).
- قم بإزالة البروتينات غير المنضمة عن طريق غسل العمود ب 5 CV من المخزن المؤقت B1 (الجدول 1) وتدرج الملح الخطي بنسبة 0٪ -20٪ buffer B2 (الجدول 1).
- Elute TOM-CC مع تدرج ملح خطي من 20٪ -35٪ عازلة B2 ، وجمع جزء ذروة البروتين كما يظهر في مخطط كروماتوجرام 280 نانومتر (الشكل 1C).
- قم بتقييم نقاء العينة بواسطة SDS-PAGE (الشكل 1 د) وحدد تركيز البروتين باستخدام مقايسة البروتين المتاحة تجاريا ، وفقا لبروتوكول الشركة المصنعة (انظر جدول المواد).
- قم بتجميد عينات البروتين في النيتروجين السائل وتخزينها في -80 درجة مئوية حتى الاستخدام مرة أخرى.
تنبيه: يجب التعامل مع النيتروجين السائل في مناطق جيدة التهوية. ارتداء معدات الحماية الشخصية المناسبة.
- إذابة الميتوكوندريا النقية N. crassa (2 جم من البروتين) التي تم الحصول عليها عن طريق الترسيب التفاضلي من حوالي 1.5 كجم (وزن رطب) خيوط ، وفقا ل Bausewein et al.30 ، بتركيز بروتين 10 مجم / مل في 20 مللي مول Tris-HCl (درجة الحموضة 8.5) ، 1٪ (وزن / حجم) DDM ، 20٪ (v / v) جلسرين ، 300 مللي مول كلوريد الصوديوم ، 20 مللي مول إيميدازول ، و 1 مللي متر فينيل ميثيل سلفونيل فلوريد (PMSF) لمدة 30 دقيقة عند 4 درجات مئوية.
- عزل OmpF
- استعادة سلالة الإشريكية القولونية BE BL21 (DE3) omp6 ، التي تفتقر إلى LamB و OmpC32 ، من مخزون الجلسرين المجمد في ظل ظروف معقمة ، وخط على صفيحة أجار Luria-Bertani (LB) (الجدول 2). للقيام بذلك ، انشر العينة تدريجيا بالتساوي على اللوحة بأكملها.
- اترك العينة تنقع في الآجار لمدة 5 دقائق ، قبل قلب اللوحة مع إغلاق الغطاء واحتضانها طوال الليل عند 37 درجة مئوية.
- اختر مستعمرة واحدة من الإشريكية القولونية ، وقم بتلقيح 7.5 مل من وسط LB (الجدول 2) بهذه المستعمرة المفردة باستخدام عود أسنان معقم ، واتركها تنمو طوال الليل (14 ساعة) مع التقليب (170 دورة في الدقيقة) عند 37 درجة مئوية.
- انقل 2 × 1 مل من خلايا الإشريكية القولونية ذات الماصات المعقمة إلى 2 × 500 مل من وسط LB (الجدول 2) ، واتركه ينمو طوال الليل (~ 14 ساعة) عند 37 درجة مئوية مع التقليب (~ 170 دورة في الدقيقة) في شاكر.
- حصاد الخلايا عن طريق الطرد المركزي عند 5000 × غرام لمدة 20 دقيقة عند 4 درجات مئوية ، وتجميد الحبيبات في النيتروجين السائل ، وتخزينها في -80 درجة مئوية حتى الاستخدام مرة أخرى.
ملاحظة: الوزن الرطب لحبيبات الخلية عادة ما يكون 5 جم لكل 1 لتر من الثقافة. في هذه المرحلة ، يمكن إيقاف البروتوكول مؤقتا. - قم بإذابة الخلايا وإعادة تعليقها (2 جم) في 20 مل من محلول التحلل C1 (الجدول 2) ، وقم بتمرير التعليق ثلاث مرات عند 1000 رطل لكل بوصة مربعة من خلال نظام تعطيل الخلايا عالي الضغط المبرد مسبقا (4 درجات مئوية) ، بحد أقصى لحجم العينة يبلغ 35 مل ، وفقا لتعليمات الشركة المصنعة.
تنبيه: يمكن أن يؤدي استخدام الصحافة الفرنسية إلى إصابات خطيرة. لا تتجاوز أبدا حد ضغط الخلية المستخدمة. ارتداء معدات الحماية الشخصية المناسبة. - قم بإزالة الخلايا غير المكسورة من المحللة عن طريق الطرد المركزي عند 4000 × جم لمدة 15 دقيقة ، واجمع المادة الطافية.
- جمع الأغشية عن طريق الطرد المركزي الفائق عند 100000 × جم لمدة 1 ساعة.
- أعد تعليق حبيبات الغشاء في 10 مل من المخزن المؤقت C2 (الجدول 2) ، واخلطها مع حجم متساو من المخزن المؤقت SDS C3 (الجدول 2) باستخدام خالط زجاجي محمل كروي.
تنبيه: β-ميركابتوإيثانول في المخزن المؤقت C3 سام. اتبع جميع لوائح السلامة ذات الصلة. - احتضان المعلق في حمام مائي على حرارة 50 درجة مئوية لمدة 30 دقيقة.
- أجهزة الطرد المركزي العينة عند 100000 × جم عند 20 درجة مئوية لمدة 1 ساعة.
- أعد تعليق حبيبات الغشاء في 10 مل من المخزن المؤقت SDS C4 (الجدول 2) باستخدام خالط زجاجي محمل كروي ، واحتضان المعلق في حمام مائي عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: إذا تعذر إعادة تنشيط الحبيبات، أضف المزيد من المخزن المؤقت SDS C4 حتى حجم 20 مل. - أجهزة الطرد المركزي العينة عند 100000 × جم عند 20 درجة مئوية لمدة 30 دقيقة ، وجمع المادة الطافية.
- امزج المادة الطافية مع أوكتيل بولي أوكسي إيثيلين (أوكتيل POE) إلى تركيز منظف نهائي بنسبة 0.5٪ (وزن / حجم) ، وقم بغسيل العينة مرتين مقابل المخزن المؤقت C5 (الجدول 2) عند 4 درجات مئوية لمدة 24 ساعة. لهذا الغرض ، استخدم أنابيب غسيل الكلى بقطع 20 كيلو دالتون ، وفقا لتعليمات الشركة المصنعة ، وضع العينة في أنبوب أو جهاز غسيل الكلى.
ملاحظة: يجب تعديل قطع أنبوب غسيل الكلى في حالة غسيل البروتينات ذات الكتل الجزيئية الأخرى. - تقييم نقاء العينة بواسطة SDS-PAGE وتحديد تركيز البروتين باستخدام مقايسة البروتين المتاحة تجاريا ، وفقا لبروتوكول الشركة المصنعة (جدول المواد).
ملاحظة: العينات التي يتم تسخينها إلى 95 درجة مئوية تظهر OmpF أحادي. تظهر العينات غير المسخنة OmpF في شكله الثلاثي (الشكل 1F). - تجميد الصدمات OmpF في القسامات في النيتروجين السائل ، وتخزينها في -20 درجة مئوية حتى الاستخدام مرة أخرى.
تنبيه: يجب التعامل مع النيتروجين السائل في مناطق جيدة التهوية. ارتداء معدات الحماية الشخصية المناسبة.
2. التسجيل البصري أحادي القناة للقنوات الأيونية في أغشية DIB
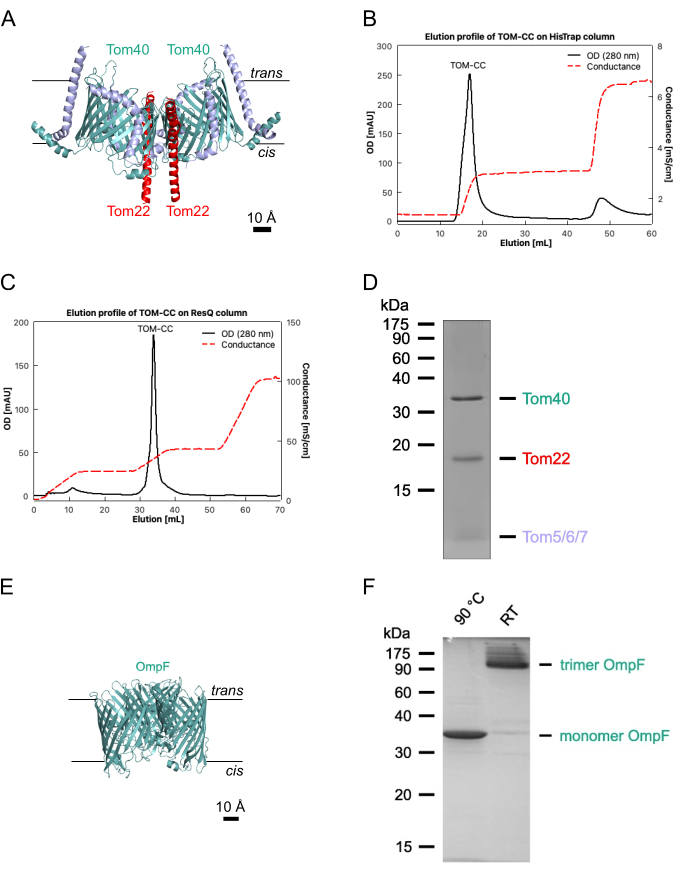
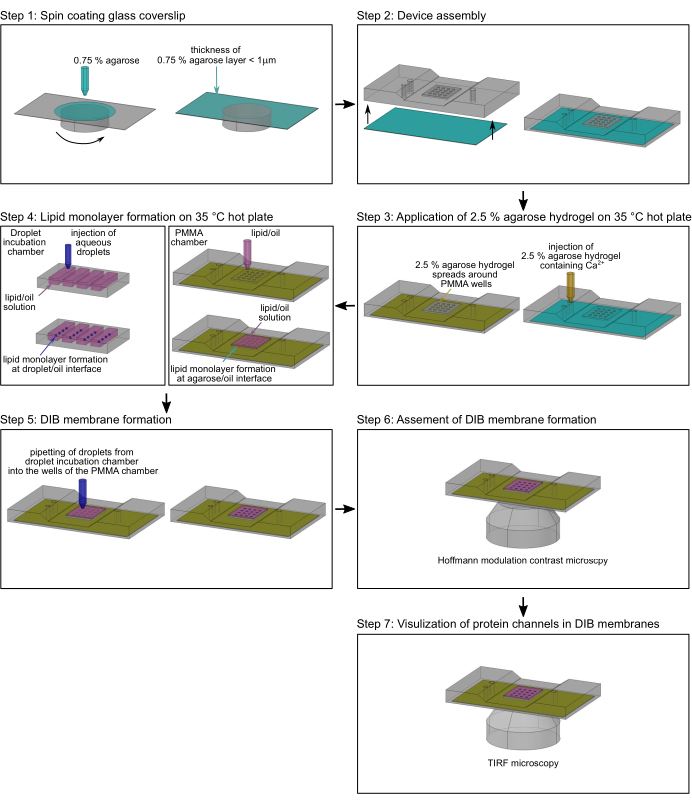
ملاحظة: يصف هذا القسم الإجراء الخاص بإعداد أغشية DIB في غرف polymethyl methacrylate (PMMA) المصنعةالدقيقة 2 لمراقبة حركة البروتين الجانبية وتدفق الأيونات من خلال قنوات الأيوناتالمفردة 17. يمكن العثور على الأبعاد والرسومات الدقيقة لتصنيع الغرفة في Lepthin et al.2. يقدم الشكل 2 لمحة عامة عن تجميع غرفة PMMA2 وتشكيل أغشية DIB. ما لم ينص على خلاف ذلك ، يتم تنفيذ جميع الخطوات في درجة حرارة الغرفة (RT). يوضح الشكل 3 تمثيلا تخطيطيا لغشاء DIB وكيف يتم استخدام تدفق Ca2+ عبر بروتين قناة واحدة لمراقبة كل من الحركة في الغشاء والحالة المفتوحة والمغلقة للقناة.
- تحضير الدهون
- قم بإزالة محلول مخزون الدهون الذي يحتوي على 1،2-diphytanoyl-sn-glycero-3-phosphocholine (25 مجم / مل DPhPC) المذاب في الكلوروفورم من الفريزر عند -20 درجة مئوية ، ودافئ إلى RT. لهذا الغرض ، يكفي عموما تسخين العينة ببطء باليد لبضع دقائق.
تنبيه: الكلوروفورم سام. ارتداء معدات الحماية الشخصية المناسبة وتنفيذ جميع الإجراءات التي تنطوي على الكلوروفورم تحت غطاء الدخان. - انقل 380 ميكرولتر من محلول مخزون DPhPC (25 مجم / مل DPhPC) إلى قنينة زجاجية. تجنب الماصات ذات السدادات المطاطية. بدلا من ذلك ، استخدم المحاقن الزجاجية ميكرولتر مع الغطاسات الفولاذ المقاوم للصدأ.
- بعد التعامل مع محلول مخزون الدهون ، قم بتراكب محلول مخزون الدهون بغاز Ar أو N2 لمنع أكسدة الدهون. استخدم أقل تدفق ممكن للغاز لتجنب تبخر المذيب العضوي الذي تذوب فيه الدهون أو رش بخاخات المذيبات من القارورة. تأكد من أن أغطية القوارير الزجاجية التي تحتوي على الدهون مع المذيبات العضوية مغلفة ببولي تترافلورو إيثيلين (PTFE) من الداخل.
- جفف عينة الدهون (الخطوة 2.1.2) تحت تيار N 2 ، وقم بإزالة المذيب العضوي المتبقي من عينة الدهون طوال الليل تحت فراغ (2.0 ملي بار) باستخدام مضخة تفريغ خالية من الزيت.
- قم بإذابة طبقة الدهون في محلول زيت سداسي ديكان / سيليكون عن طريق إضافة كميات متساوية من سداسي ديكان وزيت السيليكون (500 ميكرولتر لكل منهما) باستخدام حقنة زجاجية ميكرولتر إلى تركيز دهون نهائي يبلغ 9.5 مجم / مل.
ملاحظة: محلول الدهون مستقر في RT لعدة أسابيع.
- قم بإزالة محلول مخزون الدهون الذي يحتوي على 1،2-diphytanoyl-sn-glycero-3-phosphocholine (25 مجم / مل DPhPC) المذاب في الكلوروفورم من الفريزر عند -20 درجة مئوية ، ودافئ إلى RT. لهذا الغرض ، يكفي عموما تسخين العينة ببطء باليد لبضع دقائق.
- إعداد أغاروز هيدروجيل
- قم بإعداد ما يقرب من 1 مل من محلول الأغاروز منخفض الذوبان (0.75٪ [w / v]) في ماء مزدوج منزوع الأيونات ، وقم بتسخينه إلى 85 درجة مئوية في كتلة تسخين لمدة 20 دقيقة لاستخدامها في أغطية الزجاج المطلية بالدوران.
ملاحظة: يمكن الاحتفاظ بمحلول الأغاروز في RT لعدة أسابيع ويمكن إعادة تسخينه عدة مرات. - تحضير محلول أغاروز منخفض الانصهار 2.5٪ (وزن / حجم) في 0.66 M CaCl 2 و 8.8 mM HEPES (درجة الحموضة7.2 ) ، وتسخينه إلى 85 درجة مئوية في كتلة تسخين لمدة 20 دقيقة. تأكد من ذوبان الأغاروز جيدا.
ملاحظة: يمكن الاحتفاظ بمحلول الأغاروز لعدة أسابيع في RT ويمكن إعادة تسخينه عدة مرات ، تماما مثل الأغاروز (الخطوة 2.2.1) المستخدم في طلاء الدوران.
- قم بإعداد ما يقرب من 1 مل من محلول الأغاروز منخفض الذوبان (0.75٪ [w / v]) في ماء مزدوج منزوع الأيونات ، وقم بتسخينه إلى 85 درجة مئوية في كتلة تسخين لمدة 20 دقيقة لاستخدامها في أغطية الزجاج المطلية بالدوران.
- تجميع غرفة بولي ميثيل ميثاكريلات (PMMA) وتشكيل أحادي الطبقة الدهنية في واجهة هيدروجيل هيكساديكان / زيت السيليكون
- ضع بعض أغطية الزجاج (40 مم × 24 مم × 0.13 مم) في حامل غطاء من الفولاذ المقاوم للصدأ ، وقم بتنظيفها في دورق زجاجي لمدة 10 دقائق باستخدام الأسيتون في منظف بالموجات فوق الصوتية. استخدم ما يكفي من الأسيتون لغمر أغطية الغطاء وتغطية الدورق بشكل غير محكم بلوحة زجاجية لإنشاء نظام مغلق بدون ضغط يقلل من هروب الأبخرة أثناء عملية التنظيف.
تنبيه: الأسيتون مذيب شديد الاشتعال مع نقطة وميض منخفضة. مخاليط البخار / الهواء متفجرة. قم بتشغيل المنظف بالموجات فوق الصوتية في منطقة جيدة التهوية. ارتد معدات الحماية الشخصية المناسبة واتبع احتياطات السلامة الرسمية (على سبيل المثال ، لا لهب مكشوف ولا شرر). - شطف الأغطية الزجاجية بالماء منزوع الأيونات المزدوج وجففها تحت تيار من N2.
ملاحظة: يمكن تخزين أغطية الغطاء التي يتم تنظيفها بهذه الطريقة لعدة أسابيع. - مزيد من التنظيف وتجفيف الغطاء في منظف البلازما بالأكسجين (0.5 ملي بار) لمدة 5 دقائق.
ملاحظة: نفذ هذه الخطوة مباشرة قبل طلاء الدوران بمحلول الأغاروز ، حيث يتلاشى التأثير المحب للماء لتنظيف البلازما بمرور الوقت. - قم بتركيب غطاء معالج بالبلازما على طبقة دوارة (الشكل 2 ، الخطوة 1).
- قم بتغطية الغطاء بطبقة بسمك أقل من ميكرومتر من الأغاروز عن طريق إضافة 140 ميكرولتر ببطء من الأغاروز منخفض الانصهار بنسبة 0.75٪ (وزن / حجم) (الخطوة 2.2.1) عند 3000 دورة في الدقيقة لمدة 30 ثانية ، باستخدام ماصة 200 ميكرولتر (الشكل 2 ، الخطوة 1).
ملاحظة: يمكن تحديد سمك فيلم الأغاروز بواسطة مجهر القوة الذرية (AFM) ، كما هو موضح17. - قم على الفور بتوصيل الغطاء المطلي بالدوران بطبقة رقيقة من هيدروجيل الأغاروز بالجانب السفلي من غرفة PMMA2. تأكد من أن هيدروجيل الأغاروز يشير إلى الأعلى (الشكل 2 ، الخطوة 2).
- ثبت حواف غطاء الغطاء على جهاز PMMA الصغير بشريط لاصق شفاف.
- ضع جهاز PMMA على طبق ساخن يسخن إلى 35 درجة مئوية (الشكل 2 ، الخطوة 3).
- صب بعناية 200 ميكرولتر من محلول الأغاروز 2.5٪ (الخطوة 2.2.2) في مدخل الغرفة باستخدام ماصة (الشكل 2 ، الخطوة 3) ، دون إنشاء فقاعات هواء بحيث يمكن للهيدروجيل الرقيق المطبق بواسطة طلاء الدوران أن يتوازن مع المخزن المؤقت لمحلول الأغاروز 2.5٪ ويبقى رطبا. تأكد من أن محلول الأغاروز بنسبة 2.5٪ منتشر حول هيدروجيل الأغاروز المطلي بالدوران ولكن ليس فوقه (الشكل 3 أ) ، والذي يمكن تجنبه عن طريق الضغط برفق على حجرة PMMA على لوحة التسخين.
- قم على الفور بتغطية آبار غرفة PMMA (الشكل 2 ، الخطوة 4) بإجمالي 60 ميكرولتر من محلول الدهون / الزيت (الخطوة 2.1.5) ، لبدء تكوين طبقة أحادية الطبقة الدهنية عند واجهة زيت الأغاروز ولتجنب جفاف الأغاروز المغلف بالدوران في آبار غرفة PMMA. احتفظ بالجهاز على طبق ساخن عند 35 درجة مئوية لمدة 2 ساعة تقريبا.
ملاحظة: يبلغ قطر الآبار الدائرية في غرفة PMMA 0.5 مم وعمق 1.8 مم ، وفقا للعمل المنشورسابقا 2.
- ضع بعض أغطية الزجاج (40 مم × 24 مم × 0.13 مم) في حامل غطاء من الفولاذ المقاوم للصدأ ، وقم بتنظيفها في دورق زجاجي لمدة 10 دقائق باستخدام الأسيتون في منظف بالموجات فوق الصوتية. استخدم ما يكفي من الأسيتون لغمر أغطية الغطاء وتغطية الدورق بشكل غير محكم بلوحة زجاجية لإنشاء نظام مغلق بدون ضغط يقلل من هروب الأبخرة أثناء عملية التنظيف.
- تحضير قطرات مائية مغلفة بالدهون في محلول زيت سداسي ديكان / سيليكون
- ضع 20 ميكرولتر من محلول زيت سداسي ديكان الدهون / زيت السيليكون (الخطوة 2.1.5) في كل من الآبار المصنعة الدقيقة في غرفة حضانة القطيرات (الشكل 2 ، الخطوة 4). الحاويات المناسبة لمحلول زيت سداسي ديكان الدهون / السيليكون عبارة عن تجاويف صغيرة بحجم 40 مم × 30 مم × 3.5 مم في لوحة PMMA رقيقة2.
- قم بإعداد إبرة زجاجية ذات شعيرات دقيقة بقطر فتحة طرف يبلغ 20 ميكرومتر باستخدام مجتذب ماصة دقيقة رأسي أو أفقي (على سبيل المثال ، يستخدم لصنع ماصات التصحيح أو الأقطاب الزجاجية الحادة). تقدير قطر فتحة الإبرة الزجاجية الشعرية الدقيقة تحت مجهر مجسم ثنائي العينين عند التكبير المنخفض ، في نطاق تكبير بين 7.5x و 35x.
ملاحظة: يجب تحديد إعدادات وضع التسخين المسبق قبل سحب الشعيرات الدموية الزجاجية ، ووضع التسخين للسحب ، وقوة الجر بشكل تجريبي مسبقا ، وفقا لمواصفات الشركة المصنعة لجهاز السحب ونوع الشعيرات الدموية. - املأ الإبرة الزجاجية ذات الشعيرات الدموية الدقيقة ب 5 ميكرولتر من محلول الحقن المائي الذي يحتوي على 8.8 mM HEPES (درجة الحموضة 7.2) ، 7 ميكرومتر Fluo-8 ، 400 μM EDTA ، 1.32 M KCl ، و 30 nM TOM core complex ، أو بدلا من ذلك 20 نانومتر OmpF باستخدام طرف ماصة الشعيرات الدموية الدقيقة. استخدم فقط الماء المقطر المزدوج المعالج مسبقا براتنج مخلب يربط أيونات المعادن متعددة التكافؤ (Ca2+) لتحضير محلول الحقن المائي.
- قم بتركيب الإبرة الزجاجية ذات الشعيرات الدموية الدقيقة بمحلول الحقن المائي على حاقن نانوي يحركه بيزو.
- حقن 100-200 نانومتر من القطرات المائية (الشكل 2 ، الخطوة 4) التي تحتوي على 8.8 مللي متر HEPES (درجة الحموضة 7.2) ، 7 ميكرومتر Fluo-8 ، 400 μM EDTA ، 1.32 M KCl ، و 30 نانومتر مركب TOM الأساسي (الخطوة 1.1.12) ، أو بدلا من ذلك 20 نانومتر OmpF (الخطوة 1.2.16) في الآبار في غرفة حضانة القطيرات المملوءة بمحلول زيت سداسي ديكان الدهون / السيليكون (انظر 2.1.5) باستخدام الحاقن النانوي. تأكد من أن القطرات لا تلمس بعضها البعض عن طريق وضعها على بعد عدة ملليمترات (>10 مم) في الآبار. خلاف ذلك ، إذا لم تتشكل الطبقات الأحادية الدهنية بعد عند واجهة الزيت / المخزن المؤقت ، فسوف تندمج في قطرات أكبر.
ملاحظة: في حالة عدم توفر الشعيرات الدموية الطبقية وعدم وجود حاقنات نانوية ، يمكن بدلا من ذلك تحضير القطرات يدويا باستخدام ماصات ميكرولتر أحادية القناة لأحجام تتراوح بين 0.1 ميكرولتر و 0.5 ميكرولتر ، كما هو موضح2. ومع ذلك ، في هذه الحالة ، فإن أحجام القطيرات ليست دقيقة. - السماح بتكوين طبقة أحادية دهنية عند واجهة القطرة / الزيت لمدة ساعتين تقريبا عن طريق الحفاظ على PMMA وغرف حضانة القطيرات (الشكل 2 ، الخطوة 4) على صفيحة ساخنة يتم تسخينها إلى 35 درجة مئوية.
- تحضير وتصوير القنوات الأيونية المفردة في أغشية DIB
- قم بنقل القطرات المائية الفردية يدويا من آبار غرفة حضانة القطيرات تحت المجهر المجسم إلى آبار غرفة PMMA (الشكل 2 ، الخطوة 5) ، باستخدام ماصة ميكرولتر أحادية القناة مع طرف بولي بروبيلين يمكن التخلص منه 10 ميكرولتر. اسمح للقطرات بالغرق على الطبقات الأحادية الدهنية المتكونة في واجهات الهيدروجيل والزيت لمدة 5 دقائق تقريبا لتشكيل طبقة ثنائية دهنية (الشكل 3) بين القطرات وهيدروجيل الأغاروز.
- قم بتركيب غرفة PMMA بأغشية DIB على حامل العينة لمجهر ضوئي مقلوب وقم بتقييم تكوين الغشاء باستخدام هدف تباين تعديل هوفمان 10x (الشكل 2 ، الخطوة 6). يشار إلى تكوين غشاء DIB بواسطة حلقة بيضاء واضحة في الواجهة بين القطرة والهيدروجيل (الشكل 4 أ). أغشية DIB التي تم كسرها لا تظهر هذه الحلقة (الشكل 4B).
ملاحظة: بدلا من ذلك ، يمكن تصور أغشية DIB عند تكبير 10x بواسطة تباين الطور أو الفحص المجهري لتباين التداخل التفاضلي (DIC). - إذا تشكلت أغشية DIB ، فقم بتركيب غرفة PMMA على حامل عينة مجهر TIRF (الشكل 2 ، الخطوة 7) المجهز بمصدر ضوء تقليدي لإضاءة التألق ، وليزر 488 نانومتر (Pmax = 100 mW) ، وكاميرا CCD مضاءة بإضاءة خلفية مضاعفة الإلكترون (512 × 512 بكسل ؛ >95٪ QE) لتحقيق حجم بكسل ~ 0.16 ميكرومتر.
- ركز حافة غشاء DIB بهدف تكبير 10x تحت إضاءة التألق مع مصدر ضوء عالي الكثافة باستخدام مجموعة مرشح GFP.
- قم بالتركيز الدقيق على نفس حافة غشاء DIB عند التكبير العالي مع هدف TIRF لزيت الأبوكرومات 100x / N.A. 1.49 ، مرة أخرى تحت إضاءة التألق ، مع مصدر الضوء عالي الكثافة باستخدام مجموعة مرشح GFP التي تسمح بتصور مضان الخلفية الضعيف لصبغة الفلورسنت Fluo-8 في القطرة (الشكل 4C).
- قم بتغيير إعداد المرشح من GFP إلى مجموعة مرشحات TIRF رباعية النطاق.
- قم بتشغيل ليزر 488 نانومتر واضبط شدة الليزر على العدسة الشيئية على قيمة تتراوح بين 8 ميجاوات و 10 ميجاوات.
ملاحظة: نظرا لعدم وجود معلومات كمية في كثير من الأحيان عن شدة الليزر في العدسة الموضوعية ، يجب معايرة إعدادات شدة الليزر مسبقا في قياسات منفصلة في العدسة ، باستخدام مقياس طاقة ليزر بصري مزود بمستشعر الصمام الثنائي الضوئي ، وفقا لمواصفات الشركة المصنعة.
تنبيه: لضمان التشغيل الآمن لليزر ، يجب أن يكون المشغل على دراية بالمخاطر المحتملة لإشعاع الليزر ولوائح الوقاية من الحوادث. - لتصور القنوات الأيونية المفردة ، اضبط زاوية TIRF وكسب الكاميرا EMCCD (على سبيل المثال ، إعداد مضاعف كسب EM: 285) بحيث تظهر القنوات الأيونية المفتوحة في غشاء DIB كبقع فلورية عالية التباين على خلفية داكنة (الشكل 4D-G) ، وتصل نسبة الإشارة إلى الخلفية ، عند فحصها بصريا ، إلى الحد الأقصى. تأكد من أن البقع ، المقابلة لتدفق Ca2+ من خلال قنوات أيونية مفردة ، تظل في بؤرة التركيز ولها شكل دائري ، مع كثافة عالية في المركز وتتناقص تدريجيا نحو المحيط. تظهر الأغشية بدون قنوات مضان الخلفية فقط (الشكل 4C).
- قبل تسجيل الحركة والنشاط المفتوح والمغلق للقنوات الفردية بمرور الوقت ، تحقق من أن البقع الفلورية في بؤرة التركيز ، للتأكد من أن القنوات الأيونية قد أعيد تشكيلها في أغشية DIB وتتحرك بشكل جانبي في مستوى الغشاء. إذا لم يكن الأمر كذلك ، فقد يشير ذلك إلى أن جزيء الفلورسنت يغطس داخل وخارج المجال الزائل الناتج عن الليزر بالقرب من الغشاء.
- سجل سلسلة من الصور الغشائية التي تسمح بالتتبع المناسب لموضع ومراقبة الحالة المفتوحة والمغلقة للقنوات الأيونية الفردية. لتحديد نوع الحركة الجانبية (على سبيل المثال ، الحركة الحرة مقابل المرسى العابر [للإشارة ، انظر16]) وحالة نشاط القناة (على سبيل المثال ، مفتوحة أو مغلقة) ، اكتسب مسارات طويلة بما فيه الكفاية (على سبيل المثال ، 30 ثانية إلى 1 دقيقة) ومسارات عينة جيدة (على سبيل المثال ، معدل إطارات 48 s-1).
ملاحظة: تتطلب ملاحظة الانتشار الموجه أو المقيد أو القفزة16 أن يكون معدل أخذ العينات سريعا بما يكفي لقياس الانتشار غير المقيد داخل الحدود الضيقة. بالإضافة إلى ذلك ، تأكد من أن وقت أخذ عينات البيانات طويل بما يكفي لقياس الانتقال من الانتشار غير المقيد إلى الانتشار المقيد (لمزيد من التفاصيل ، انظر Jacobson et al.16).
- معالجة الصور والبيانات
ملاحظة: يمكن استخدام حزم معالجة الصور مفتوحة المصدر33 أو الإجراءات المكتوبة ذاتيا17 بناء على حزم البرامج التجارية لتحليل الديناميكيات الزمانية المكانية للقنوات الأيونية الفردية في DIBs. لتكون قادرة على ربط حركة الغشاء الجانبي مع تدفق الأيونات من خلال القنوات الفردية ، لا ينبغي تطبيق خوارزميات المرشح.- تصحيح السلاسل الزمنية للصورة للتبييض من خلال تطبيق الإجراءات القياسية34 باستخدام إجراءات مكتوبة ذاتيا ، عن طريق ملاءمة متوسط كثافة
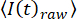 الإطار للصورة الكاملة إلى
الإطار للصورة الكاملة إلى 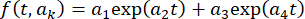 ، حيث t هو مؤشر الإطار (الوقت) و kهي معلمات التركيب. ثم قم بتصحيح السلسلة الزمنية وفقا ل
، حيث t هو مؤشر الإطار (الوقت) و kهي معلمات التركيب. ثم قم بتصحيح السلسلة الزمنية وفقا ل 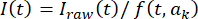 ، حيث I (t) هي الشدة. بدلا من ذلك ، بالنسبة لتحليلات البيانات الأولية ، قم بإجراء تصحيحات في الخلفية باستخدام برنامج مفتوح المصدر مع خوارزميات الكرة المتدحرجة المنفذة33 ونصف قطر الكرة المتدحرجة ، اعتمادا على بقعة الكاميرا وحجمها (على سبيل المثال ، 50 بكسل).
، حيث I (t) هي الشدة. بدلا من ذلك ، بالنسبة لتحليلات البيانات الأولية ، قم بإجراء تصحيحات في الخلفية باستخدام برنامج مفتوح المصدر مع خوارزميات الكرة المتدحرجة المنفذة33 ونصف قطر الكرة المتدحرجة ، اعتمادا على بقعة الكاميرا وحجمها (على سبيل المثال ، 50 بكسل). - تحديد المواضع المكانية والسعة لبقعة مضان داخل منطقة اهتمام محددة (على سبيل المثال ، 30 × 30 بكسل) ، عن طريق تركيب I (t) في وقت معين t إلى دالة Gaussian ثنائية الأبعاد مع إمالة مستوية تمثل تدرجات الإضاءة المحلية المحتملة وفقا ل
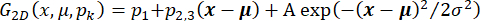 . هنا ، x = (x ، y) هو عائد الاستثمار مع معلومات شدة التألق ، A و σ هما سعة وعرض Gaussian ، pk هي المعلمات التي تميز شدة الخلفية لعائد الاستثمار ، و μ = (x 0 ، y 0) يحدد موضع Gaussian. يتم إعطاء التدفق الأيوني عبر قناة فردية بواسطة المعلمة A. يتم إعطاء مسار القناة بواسطة x ، ويسمح بتحديد الحركة الجانبية للقناة. بدلا من ذلك ، من الممكن تحديد مواضع وشدة البقع الفردية باستخدام منصات مفتوحة المصدر33 والمكونات الإضافية كما هو موضح35,36. تقدير الدقة الموضعية37 بعد تحويل قراءات كاميرا EMCCD إلى أرقام الفوتون38.
. هنا ، x = (x ، y) هو عائد الاستثمار مع معلومات شدة التألق ، A و σ هما سعة وعرض Gaussian ، pk هي المعلمات التي تميز شدة الخلفية لعائد الاستثمار ، و μ = (x 0 ، y 0) يحدد موضع Gaussian. يتم إعطاء التدفق الأيوني عبر قناة فردية بواسطة المعلمة A. يتم إعطاء مسار القناة بواسطة x ، ويسمح بتحديد الحركة الجانبية للقناة. بدلا من ذلك ، من الممكن تحديد مواضع وشدة البقع الفردية باستخدام منصات مفتوحة المصدر33 والمكونات الإضافية كما هو موضح35,36. تقدير الدقة الموضعية37 بعد تحويل قراءات كاميرا EMCCD إلى أرقام الفوتون38. - ارسم السعة الفلورية A مقابل الوقت والمسار المقابل x لتحديد العلاقة المحتملة بين انتشار القناة وتدفق الأيونات عبر القناة. قم بإجراء ذلك مع أي برنامج رسومات. في حالة حركة القناة الجانبية الحرة ، حدد معامل الانتشار الجانبي D عن طريق الانحدار الخطي للتأخير الزمني τ ، واحسب متوسط الإزاحة التربيعية للبقع من x وفقا ل
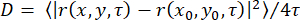 .
.
ملاحظة: تتراوح معاملات الانتشار النموذجية17 ل TOM-CC و OmpF التي تتحرك بحرية في أغشية DIB بين 0.5 و 1.5 ميكرومتر2 s-1. يتم تعريف الجزيئات التي يكون ثابت انتشارها أقل من 0.01 مم2 · s-1 على أنها ثابتة17.
- تصحيح السلاسل الزمنية للصورة للتبييض من خلال تطبيق الإجراءات القياسية34 باستخدام إجراءات مكتوبة ذاتيا ، عن طريق ملاءمة متوسط كثافة
النتائج
يكشف التسجيل البصري أحادي القناة الخالي من الأقطاب الكهربائية في الوقت الفعلي عن التفاعل بين حركة البروتين الجانبية ووظيفة القنوات الأيونية الفردية في أغشية DIB. توضح إعادة تكوين مركب TOM الأساسي للميتوكوندريا (الشكل 1 أ) في غشاء DIB (الشكل 4 د) وجود علاقة زمنية قوية بين الحركة الجانبية ونفاذية الأيونات (الشكل 5 أ). يبدو أن بوابة TOM-CC حساسة لوضع الحركة الجانبية17. تظهر القنوات المتحركة تدفق Ca2+ من خلال مسامها وشدة نقطة التألق العالية. تظهر الجزيئات المحاصرة غير المتحركة شدة مضان منخفضة ومتوسطة. بالنسبة لمسام استيراد البروتين العامة للميتوكوندريا TOM-CC ، كشف نهج الجزيء الفردي هذا عن وجود علاقة زمنية قوية بين الحركة الجانبية ونفاذية الأيونات ، مما يشير إلى أن قناة TOM-CC لها خصائص حساسة ميكانيكيا17. يرافق التوقف الجانبي لجزيئات TOM-CC المتحركة بحرية إغلاق جزئي أو كامل لقناة TOM-CC. لا يظهر تصوير أغشية DIB باستخدام OmpF (الشكل 1E والشكل 4F) ، والذي يتم تضمينه بالكامل تقريبا في الغشاء ، أي تأثيرات توقف وانطلاق (الشكل 5B). لا ترتبط التوقفات العشوائية ل OmpF بتغيير في شدتها ، وبالتالي بإغلاق مسامها. بناء على إشارات التألق38 ، يمكن تقدير الدقة الموضعية للقنوات الفردية في النطاق بين 5 و 10 نانومتر. ومع ذلك ، تجدر الإشارة إلى أنه لا يمكن تحقيق هذه الدقة إذا كانت القنوات تتأرجح قليلا بسبب التثبيت المتحرك مع هيدروجيل الأغاروز ، كما هو موضح ، على سبيل المثال ، لجزيئات TOM-CC في حالة وسيطة مع إزاحة جذر متوسط 120 نانومتر (الشكل 5 أ).
الشكل 1: عزل TOM-CC. (أ) هيكل Cryo EM ل N. crassa TOM-CC30,39. تم إذابة الميتوكوندريا من سلالة N. crassa التي تحتوي على Tom22 مع علامة 6xHis في DDM وخضعت لكروماتوغرافيا تقارب Ni-NTA (B) وكروماتوغرافيا تبادل الأنيون (C). (د) SDS-PAGE من TOM-CC المعزولة. (ه) البنية البلورية (PDB ، 1OPF) و (F) SDS-PAGE من الإشريكية القولونية المنقاة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: مخطط انسيابي لتجميع غرفة PMMA. الخطوة 1: غطاء زجاجي مغطى بالدوران بهيدروجيل أغاروز. الخطوة 2: يتم تركيب غطاء الغطاء المطلي بالدوران في غرفة مجهر PMMA مصنوعة خصيصا. الخطوة 3: يضاف أغاروز إضافي منخفض الذوبان إلى منفذ مدخل غرفة PMMA على لوح تسخين 35 درجة مئوية. الخطوة 4: تتشكل أحاديات الدهون حول قطرات مائية عند واجهة عازلة / زيتية (يسار) وعلى واجهة هيدروجيل / زيت الأغاروز (يمين). الخطوة 5: يتم سحب قطرات مائية فردية في آبار غرفة PMMA لتشكيل طبقة ثنائية دهنية عند ملامسة الطبقتين الأحاديتين من الدهون. الخطوة 6: يتم التحقق من صحة تكوين أغشية DIB بواسطة مجهر تباين تعديل هوفمان. الخطوة 7: يتم الحصول على صور لمناطق مختارة من أغشية DIB مع قنوات أيونية مدرجة بواسطة مجهر TIRF. أخضر: 0.75٪ أغاروز ؛ الأصفر: 2.5٪ أغاروز يحتوي على أيونات الكالسيوم2+ ؛ أرجواني: مرحلة الدهون / الزيت. أزرق غامق: محلول قطرات مائي يحتوي على صبغة وبروتين حساس للكنسيوم2+. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
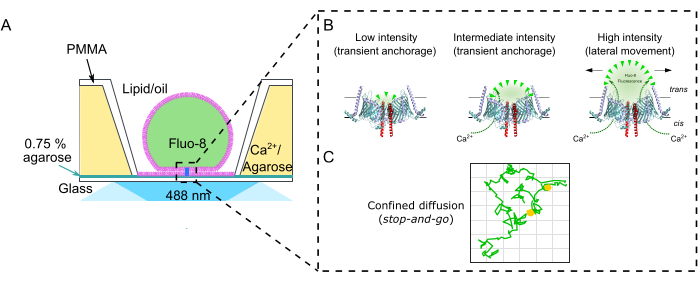
الشكل 3: الإعداد التجريبي. (أ) التمثيل التخطيطي لغشاء DIB في بئر PMMA. ترتكز الطبقة الثنائية على فيلم أغاروز فائق النحافة بنسبة 0.75٪ للسماح بتصوير TIRF لتدفق الكالسيوم 2+ من خلال قناة أيونية بمرور الوقت باستخدام صبغة مضان حساسة للكنسيوم 2+ (Fluo-8) في trans. (ب) يتم التحكم في تدفق الكالسيوم2+ حصريا عن طريق الضغط الأسموزي من رابطة الدول المستقلة إلى عبر. هذا يسمح لكل من تحديد الموضع في الغشاء والحالة المفتوحة والمغلقة للقناة. القناة الموضحة هنا هي القناة الموصلة للبروتين TOM-CC ل N. crassa mitochondria30. (ج) مسار قناة TOM-CC واحدة. الأخضر: قناة متحركة. الأصفر: قناة غير متحركة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تصوير TOM-CC و OmpF في أغشية DIB. (أ) غشاء DIB تم تصويره بواسطة مجهر تباين تعديل هوفمان الذي يوضح منطقة التلامس ثنائية الطبقة بين الهيدروجيل والقطرة. (ب) غشاء DIB مكسور مصور كما في (A). السهم ، حافة غرفة PMMA. (C) غشاء DIB تم تصويره بواسطة مجهر TIRF بدون قنوات بروتينية. (D) غشاء DIB مع TOM-CC المعاد تشكيله ، تم تصويره بواسطة مجهر TIRF. تشير المربعات البيضاء إلى بقع عالية (SH) ومتوسطة (SI) ومنخفضة (SL). (ه) يكشف تركيب ملف تعريف شدة التألق للنقاط الثلاث المحددة في (A) إلى وظائف Gaussian ثنائية الأبعاد عن موضع TOM-CCs الفردية وتدفق Ca2+ عبر القناة. (F) غشاء DIB مع OmpF المعاد تشكيله. (ز) الملاءمة الغاوسية للبقعة الفلورية المشار إليها ب (F). على عكس مركب البروتين المكون من β برميل ثنائي المسام TOM-CC ، يكشف OmpF ثلاثي المسام β برميل عن حالة نفاذية واحدة فقط. حجم بكسل ، 0.16 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: يرتبط نشاط القناة بالحركة الجانبية ل TOM-CC. (أ) يشير تتبع سعة الفلورسنت (أعلى) والمسار المقابل (أسفل) ل TOM-CC إلى أن نشاط القناة المفتوحة والمغلقة ل TOM-CC يرتبط بحركة الغشاء الجانبي للمجمع. يعرض المسار ثلاث حالات نفاذية. الأخضر: حالة مفتوحة بالكامل ؛ الأصفر: حالة نفاذية وسيطة ؛ الأحمر: حالة القناة المغلقة ؛ النجمة الحمراء: يتذبذب TOM-CC في الحالة المتوسطة حول موقعه المتوسط بحوالي ±60 نانومتر. تتراوح الدقة الموضعية37 بناء على إشارات التألق في الحالات المفتوحة والوسيطة بالكامل بين 5 نانومتر و 10 نانومتر. (B) تتبع سعة الفلورسنت (أعلى) والمسار المقابل (أسفل) ل OmpF. يكشف OmpF عن مستوى شدة واحد فقط ، بغض النظر عما إذا كان في حالة حركة أو محاصر. يتم تمييز أجزاء المسار المقابلة للفترات الزمنية للجزيئات المحاصرة باللون الرمادي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مخزن مؤقت | تركيزات الكاشف | حجم | ||
| أ1* | 20 مللي مول Tris-HCl pH 8.5 ، 0.1٪ (وزن / حجم) n-dodecyl-β-D-maltoside (DDM) ، 10٪ (v / v) جلسرين ، 300 مللي مول كلوريد الصوديوم ، و 1 مللي مول فينيل ميثيل سلفونيل فلوريد (PMSF) | 100 مل | ||
| أ2* | 20 مللي مول Tris-HCl pH 8.5 ، 0.1٪ (وزن / حجم) DDM ، 10٪ (v / v) جلسرين ، 1 M إيميدازول و 1 mM PMSF | 100 مل | ||
| ب1* | 20 مللي متر HEPES درجة الحموضة 7.2 ، 0.1٪ (وزن / حجم) DDM ، 2٪ (v / v) ثنائي ميثيل سلفوكسيد (DMSO) | 100 مل | ||
| ب2* | 20 مللي متر HEPES درجة الحموضة 7.2 ، 0.1٪ (وزن / حجم) DDM ، 1 M KCl ، 2٪ (v / v) ثنائي ميثيل سلفوكسيد (DMSO) | 100 مل | ||
| * قم بإزالة الغازات وتمر عبر مرشح 0.22 ميكرومتر قبل الاستخدام. | ||||
الجدول 1: حلول المخزن المؤقت لعزل TOM-CC.
| مخزن مؤقت | تركيزات الكاشف | حجم | ||
| رطل* | 1٪ (وزن / حجم) التربتون، 1٪ (وزن / حجم) كلوريد الصوديوم و 0.5٪ (ث / حجم) استخراج الخميرة | 1100 مل | ||
| ج1 | 2 mM MgCl2 ، و ~ 750 وحدة DNAse و 50 mM Tris-HCl pH 7.5 | 20 مل | ||
| ج2 | 50 مللي متر Tris-HCl ، درجة الحموضة 7.5 | 50 مل | ||
| ج3 | 4٪ (وزن / حجم) كبريتات دوديسيل الصوديوم (SDS) ، 2 مللي مول β-ميركابتوإيثانول و 50 مللي متر تريس-حمض الهيدروكلوريك درجة الحموضة 7.5 | 50 مل | ||
| ج4 | 2٪ (وزن / حجم) SDS ، 500 مللي مول كلوريد الصوديوم و 50 مللي متر Tris-HCl درجة الحموضة 7.5 | 50 مل | ||
| ج5 | 0.5٪ (وزن / حجم) أوكتيل بولي أوكسي إيثيلين (أوكتيل POE) ، 1 مللي متر EDTA و 20 مللي متر تريس درجة الحموضة 8.5 | 1000 مل | ||
| * تعقيم قبل الاستخدام. | ||||
الجدول 2: حلول المخزن المؤقت لعزل OmpF.
Discussion
يوفر البروتوكول المقدم هنا مقدمة لاستخدام أغشية DIB لدراسة التفاعل بين حركة القناة الأيونية الجانبية ووظيفة القناة باستخدام مجهر TIRF أحادي الجزيء. للحصول على أفضل البيانات الممكنة ، يعد تحضير أغشية DIB المستقرة بأكبر عدد ممكن من القنوات المنفصلة جيدا أمرا بالغ الأهمية للحصول على سلسلة زمنية من الجسيمات الفردية ، والتي يمكن تحليلها بشكل مرض.
تشمل المعلمات الحرجة التي يجب تحسينها اختيار الدهون ، وتركيز الدهون في مرحلة الزيت ، وتركيزات البروتين والمنظفات في القطرات المائية. الليبيدات المستخدمة غير عادية ، لأنها لا تظهر انتقالا واضحا للطور في درجات حرارة منخفضة. DPhPC هو دهون شائعة الاستخدام لإنتاج أنظمة غشاء مستقرة40. من حيث المبدأ ، قد يكون أي دهون تحافظ على بيئتها السائلة في درجات حرارة منخفضة مناسبة لهذا التطبيق. بالإضافة إلى ذلك ، يجب ألا تكون الدهون حساسة للأكسدة. يجب أن يكون تركيز المنظف في القطرات منخفضا قدر الإمكان لتجنب تمزق الغشاء. يتم تحقيق الأغشية المستقرة ومعدلات دمج البروتين الجيدة بشكل عام بتركيزات المنظفات التي تقل عن تركيز المذيلة الحرج (cmc) ، نظرا لأن بروتين الغشاء لا يترسب.
إذا كانت أغشية DIB لا تتحمل منظفات معينة21,41 ، أو إذا لم تندمج البروتينات من محلول منظف منخفض في أغشية DIB ، فيمكن أولا إعادة تشكيل قنوات البروتين في حويصلات دهنية صغيرة أحادية الصفيحة (SUVs) ، والتي يتم دمجها بعد ذلك في أغشية DIB من جانب القطرة ، كما هو موضح بنجاح مع E. coli MscL 42 . في بعض الأحيان ، لا تتشكل أغشية DIB لأن تركيز الدهون في مرحلة الزيت منخفض جدا. لمنع أغشية DIB من الانفجار ، يجب على المرء أيضا أن يدرك أن الضغط التناضحي بين الهيدروجيل والقطرة يجب أن يكون متوازنا بدقة دون التأثير على تدفق الكالسيوم2 + من رابطة الدول المستقلة إلى المتحولين بشكل مفرط. يبدو أن سمك الأغاروز الأمثل وحجم الشبكة أمران حاسمان لمراقبة انتشار بروتينات الغشاء. يجب تجنب أي تجفيف لطبقة الأغاروز. يمكن تحديد السماكة باستخدام مجهر القوة الذرية17. من خلال تغيير تركيز الأغاروز وحجمه وسرعة دورانه أثناء طلاء الدوران ، يمكن تحسين حجم الشبكة وسمك الهيدروجيل. لاحظ ، مع ذلك ، أن سمك طبقة الهيدروجيل يؤثر على تباين الصورة. لالتقاط البروتينات الغشائية في DIBs ، يمكن استبدال هيدروجيل الأغاروز بأغاروز مركب خصيصا ، وغير متشابك ، ومعدل Ni-NTA ، ومنخفض الذوبان لاحتجازها عبر His-tag17. غالبا ما تحدث خلفية مضان عالية بشكل مفرط بسبب تمزق أغشية DIB. هذه مشكلة خاصة مع الغرف متعددة الآبار ، حيث تنتشر الصبغة الحساسة للكنسيوم2+ في الهيدروجيل. في هذه الحالة ، يجب تجنب الآبار المجاورة. لا ينبغي أن يكون التبييض الفلوري للصبغة الحساسة للكالسيوم2+ فوق الغشاء عاملا مقيدا كبيرا ، حيث يتم استبداله بأصباغ غير متحمسة في الجزء الأكبر من القطرة (الشكل 3 أ) خارج حقل TIRF المتلاشي. يتم إعطاء دقة توطين البروتين من خلال دقة تركيب البقع وحجم البكسل.
يمكن أن تحدث إشارات مضان ضعيفة بسبب انخفاض تدفق الكالسيوم2+ عبر القناة. تشمل الأسباب المحتملة: (i) إعدادات TIRF غير الدقيقة (على سبيل المثال ، شدة الليزر) ، (ii) ضغط Ca 2+ التناضحي عبر الغشاء ، أو (iii) نفاذية Ca2+ الجوهرية للقنوات منخفضة للغاية. للتعامل مع المشكلة الأولى ، يجب تحسين شدة الليزر وزاوية TIRF وكسب الكاميرا. يمكن التغلب على المشكلتين الأخيرتين من خلال تطبيق جهد كهربائي عبر الغشاء 2,43. ومع ذلك ، فإن تطبيق الفولتية الخارجية يمكن أن يشوه النتيجة ، حيث يمكن أن تؤثر التأثيرات الكهربائية على فتح القناة للقنوات الأيونية ذات البوابات أو الحساسة ميكانيكيا والتي لا يتم التحكم فيها في الواقع بالجهد. ومن الأمثلة على هذه القنوات بروتين الميتوكوندريا TOM-CC27 ، ووحدته الفرعية المكونة للقناة Tom4026،44،45،46. أخيرا ، تجدر الإشارة إلى أن إدخال بروتينات الغشاء في أغشية DIB في اتجاه معين لتحقيق الوظيفة المطلوبة أمر صعب ، والدراسات الكمية نادرة47,48. في بعض الحالات ، يكون اتجاه البروتينات المتكاملة عشوائيا. هذه مشكلة خطيرة لدراسة بروتينات الغشاء ، لأن بعض بروتينات الغشاء يتم تنشيطها على جانب واحد فقط من الغشاء.
الفحص المجهري TIRF هو طريقة قوية لمعالجة أحداث الجزيء الواحد في الأغشية المدعومة المستوية49. ومن الأمثلة على ذلك التجميع وتوضيح مسار الطي لبروتينات القناة مثل α-hemolysin50 و perfringolysin O 51 و OmpG52. تضمنت هذه الدراسات FRET كتقنية إضافية. بالإضافة إلى ذلك ، تمت دراسة تنشيط القناة الأيونية الحساسة ميكانيكيا MscL سابقا عن طريق التحفيز الميكانيكي لطبقات DIBالمزدوجة 42 المدعومة باستخدام القياسات الحالية. بناء على هذا العمل ، يمكن للدراسات المستقبلية الجمع بين المنصة الموصوفة هنا وتجارب FRET أحادية الجزيء لمعالجة القنوات الحساسة ميكانيكيا على مستوى الجزيء الواحد بطريقة بصرية17. يمكن استخدام حقن المخزن المؤقت في القطرة ، أو تمديد الطبقة الأحادية DIB الداخلية ، أو الربط المستهدف للقنوات الفردية بالهيدروجيل الأساسي لمزيد من الدراسة ليس فقط للآلية الفيزيائية للقنوات المنشطة ميكانيكيا ، والتي تستجيب لتوتر الغشاء و / أو الانحناء كما هو موضح في MscL و MscS ، المجال ثنائي المسام K + - القنوات ، TREK-1 ، TREK-2 و TRAAK و PIEZO (للمراجعة ، انظر53) ، ولكن أيضا الارتباط المحلي بالهيكل الخلوي الخلوي ، كما هو موضح للقناة الأيونية الحساسة للمس NOMPC54,55.
Disclosures
نعلن عدم وجود تضارب في المصالح.
Acknowledgements
نشكر Beate Nitschke على مساعدتها في تحضير البروتين وروبن غوش ومايكل شفايكرت (شتوتغارت) وماكسيميلان أولبريتش (فرايبورغ) على المناقشات الثاقبة. تم دعم هذا العمل من قبل مركز أبحاث شتوتغارت لبيولوجيا الأنظمة (SRCSB) ومنحة من مؤسسة بادن فورتمبيرغ (BiofMO-6 إلى SN).
Materials
| Name | Company | Catalog Number | Comments |
| 1,2-diphytanoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850356C | |
| 100x Oil objective Apochromat N.A. 1.49 | Nikon | MRD01991 | TIRF microscope |
| 10x Hoffmann modulation contrast objective NA 0.25 | Nikon | Microscope to assess DIB membrane formation | |
| 10x objective N.A. 0.25 | Nikon | MRL00102 | TIRF microscope |
| 40x Hoffmann modulation contrast objective NA 0.55 | Nikon | Microscope to assess DIB membrane formation | |
| 488 nm laser, 100 mW | Visitron | TIRF microscope | |
| Adhesive tape | |||
| Äkta pure | Cytiva | Protein purification system | |
| Bradford assay kit, Pierce | Thermo Fisher | 23236 | |
| CaCl2 | Roth | 5239.2 | |
| Chelax 100 resin | Biorad | 143-2832 | |
| Chloroform | Sigma-Aldrich | MC1024452500 | |
| Dialysis cassettes Slide-A-Lyzer 20 k MWCO | Thermo Fisher | 87735 | |
| DIB chamber | Custom made | PMMA chamber for DIB membranes | |
| Digital power meter and energy console | Thorlabs | PM100D | Laser power meter |
| Dimethyl sulfoxide | Roth | 4720.1 | |
| Double distilled H2O | |||
| Eclipse TS 100 Hoffmann modulation contrast microscope | Nikon | Microscope to assess DIB membrane formation | |
| EDTA | Roth | 8042.2 | |
| EMCCD camera iXon Ultra 897 | Andor | TIRF microscope | |
| Ethanol | Sigma-Aldrich | 32205-M | |
| Fixed angle rotor Ti70 | Beckman Coulter | ||
| Fluo-8, CalciFluorTM | Santa Cruz Biotechnology | SC-362561 | Ca2+-sensitive dye |
| French press cell disruption homogenizer | Igneus | Igneus 40000 psi | |
| GFP filter | AHF | Filter seeting used for excitation of DIB-membranes by epifluorescence with white light source | |
| Glass capillaries | World Precision Instruments | 4878 | |
| Glass coverslips 40 mm x 24 mm x 0.13 mm | Roth | 1870.2 | |
| Glycerol | Roth | 3783.2 | |
| Hamilton syringe 10 mL | Roth | X033.1 | |
| Hamilton syringe 100 mL | Roth | X049.1 | |
| Hamilton syringe 500 mL | Roth | EY49.1 | |
| Heating block | Eppendorf | Thermomixer comfort | |
| Heating plate | Minitube | HT200 | |
| Hepes | Roth | 9205.3 | |
| Hexadcane | Sigma-Aldrich | 296317 | |
| His Trap HP 1 mL | Cytiva | 29051021 | Ni-NTA column |
| Imidazole | Sigma-Aldrich | 1.04716.1000 | |
| KCl | Honeywell | 10314243 | |
| KLM spin coater | Schaefer Tec | SCV-10 | |
| List medical L/M-3P-A vertical pipette puller | Artisan Technology Group | 57761-1 | |
| Low melting point agarose | Sigma-Aldrich | A9414 | |
| M8 Stereomicroscope | Wild | Stereomicrosope | |
| Matlab | MathWorks | R2022a | |
| Methanol | Sigma-Aldrich | 34860 | |
| MicroFil pipette tips | World Precision Instruments | MF34G-5 | |
| N2 gas | |||
| NaCl | Roth | 3957.1 | |
| Nanoliter 2010 injector | World Precision Instruments | Nanoliter 2010 | |
| n-dodecyl-b-D-maltoside | Glycon Biochemicals | D97002-C | |
| Ni-NTA agarose, non-crosslinked | Cube Biotech | 124115393 | Custom made |
| NIS-Elements AR software | Nikon | MQS31100/MQS42560/MQS42580/MQS42780/MQS41930 | Imaging software |
| n-octyl-polyoxyethylene | Sigma-Aldrich | 40530 | |
| O2 gas | |||
| Phenylmethylsulfonyl fluoride | Roth | 6367.3 | |
| Photodiode sensor Si, 400 - 1100 nm, 500 mW | Thorlabs | S130C | Sensor for laser power meter |
| Plasma cleaner | Diener Electronics | Zepto | |
| Preparative ultracentrifuge Optima | Beckman Coulter | ||
| Quad-band TIRF-filter 446/523/600/677 HC | AHF | Filter setting used for excitation of DIB-membranes with 488 nm laser | |
| Resource Q 1 mL | Cytiva | 17117701 | Anion exchange column |
| Silicon oil AR 20 | Sigma-Aldrich | 10836 | |
| Sodium dodecyl sulfate | Roth | 2326.2 | |
| Super LoLux camera | JVC | Stereomicrosope | |
| Thermoshaker | Gerhardt | THL 500/1 | |
| Ti-E Fluorescence microscope | Nikon | MEA53100 | |
| Tris-HCl | Sigma-Aldrich | 9090.3 | |
| Tryptone | Roth | 8952.2 | |
| Ultrasonic bath | Bandelin Sonorex | RK 100 | |
| Vaccum pump | Vacuubrand | MD 4C NT | |
| White light source for epifluorescence illumination (100 W) | Nikon | MBF72655 | TIRF microscope |
| Yeast extract | Roth | 2363.2 | |
| β-mercaptoethanol | Sigma-Aldrich | M3148 |
References
- Tanaka, M., Sackmann, E. Polymer-supported membranes as models of the cell surface. Nature. 437 (7059), 656-663 (2005).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Thompson, J. R., Heron, A. J., Santoso, Y., Wallace, M. I. Enhanced stability and fluidity in droplet on hydrogel bilayers for measuring membrane protein diffusion. Nano Letters. 7 (12), 3875-3878 (2007).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34 (1), 351-378 (2005).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysical Journal. 60 (4), 910-921 (1991).
- Kusumi, A., Shirai, Y. M., Koyama-Honda, I., Suzuki, K. G. N., Fujiwara, T. K. Hierarchical organization of the plasma membrane: Investigations by single-molecule tracking vs. fluorescence correlation spectroscopy. FEBS Letters. 584 (9), 1814-1823 (2010).
- Betaneli, V., Schwille, P. Fluorescence correlation spectroscopy to examine protein-lipid interactions in membranes. Methods in Molecular Biology. 974, 253-278 (2013).
- Ando, T., et al. A high-speed atomic force microscope for studying biological macromolecules. Proceedings of the National Academy of Sciences. 98 (22), 12468-12472 (2001).
- Casuso, I., et al. Characterization of the motion of membrane proteins using high-speed atomic force microscopy. Nature Nanotechnology. 7 (8), 525-529 (2012).
- Karner, A., et al. Tuning membrane protein mobility by confinement into nanodomains. Nature Nanotechnology. 12 (3), 260-266 (2017).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118 (6), 1099-1102 (2005).
- Schink, K. O., Tan, K. -. W., Stenmark, H. Phosphoinositides in control of membrane dynamics. Annual Review of Cell and Developmental Biology. 32 (1), 143-171 (2016).
- Schafer, D. A. Coupling actin dynamics and membrane dynamics during endocytosis. Current Opinion in Cell Biology. 14 (1), 76-81 (2002).
- Lingwood, D., Ries, J., Schwille, P., Simons, K. Plasma membranes are poised for activation of raft phase coalescence at physiological temperature. Proceedings of the National Academy of Sciences. 105 (29), 10005-10010 (2008).
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Jacobson, K., Liu, P., Lagerholm, B. C. The lateral organization and mobility of plasma membrane components. Cell. 177 (4), 806-819 (2019).
- Wang, S., et al. Spatiotemporal stop-and-go dynamics of the mitochondrial TOM core complex correlates with channel activity. Communications Biology. 5 (1), 471 (2022).
- Ide, T., Yanagida, T. An artificial lipid bilayer formed on an agarose-coated glass for simultaneous electrical and optical measurement of single ion channels. Biochemical and Biophysical Research Communications. 265 (2), 595-599 (1999).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid bilayer formation by contacting monolayers in a microfluidic device for membrane protein analysis. Analytical Chemistry. 78 (24), 8169-8174 (2006).
- Heron, A. J., Thompson, J. R., Mason, A. E., Wallace, M. I. Direct detection of membrane channels from gels using water-in-oil droplet bilayers. Journal of the American Chemical Society. 129 (51), 16042-16047 (2007).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Huang, S., Romero-Ruiz, M., Castell, O. K., Bayley, H., Wallace, M. I. High-throughput optical sensing of nucleic acids in a nanopore array. Nature Nanotechnology. 10 (11), 986-991 (2015).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271 (5245), 43-48 (1996).
- Kiessling, V., Yang, S. -. T., Tamm, L. K. Supported lipid bilayers as models for studying membrane domains. Current Topics in Membranes. 75, 1-23 (2015).
- Murray, D. H., Tamm, L. K., Kiessling, V. Supported double membranes. Journal of Structural Biology. 168 (1), 183-189 (2009).
- Hill, K., et al. Tom40 forms the hydrophilic channel of the mitochondrial import pore for preproteins. Nature. 395 (6701), 516-521 (1998).
- Poynor, M., Eckert, R., Nussberger, S. Dynamics of the preprotein translocation channel of the outer membrane of mitochondria. Biophysical Journal. 95 (3), 1511-1522 (2008).
- Künkele, K. P., et al. The preprotein translocation channel of the outer membrane of mitochondria. Cell. 93 (6), 1009-1019 (1998).
- Ahting, U., et al. The TOM core complex: the general protein import pore of the outer membrane of mitochondria. The Journal of Cell Biology. 147 (5), 959-968 (1999).
- Bausewein, T., et al. Cryo-EM structure of the TOM core complex from Neurospora crassa. Cell. 170 (4), 693-700 (2017).
- Cowan, S. W., et al. Crystal structures explain functional properties of two E. coli porins. Nature. 358 (6389), 727-733 (1992).
- Bieligmeyer, M., et al. Reconstitution of the membrane protein OmpF into biomimetic block copolymer-phospholipid hybrid membranes. Beilstein Journal of Nanotechnology. 7, 881-892 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Vicente, N. B., Zamboni, J. E. D., Adur, J. F., Paravani, E. V., Casco, V. H. Photobleaching correction in fluorescence microscopy images. Journal of Physics: Conference Series. 90 (1), 012068 (2007).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Ershov, D., et al. TrackMate 7: integrating state-of-the-art segmentation algorithms into tracking pipelines. Nature Methods. 19 (7), 829-832 (2022).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Hirsch, M., Wareham, R. J., Martin-Fernandez, M. L., Hobson, M. P., Rolfe, D. J. A stochastic model for electron multiplication charge-coupled devices - From theory to practice. PLoS One. 8 (1), 53671 (2013).
- Bausewein, T., Naveed, H., Liang, J., Nussberger, S. The structure of the TOM core complex in the mitochondrial outer membrane. Biological Chemistry. 401 (6-7), 687-697 (2020).
- Lindsey, H., Petersen, N. O., Chan, S. I. Physicochemical characterization of 1,2-diphytanoyl-sn-glycero-3-phosphocholine in model membrane systems. Biochimica et Biophysica Acta. 555 (1), 147-167 (1979).
- Manafirad, A. Single ion-channel analysis in droplet interface bilayer. Methods in Molecular Biology. 2186, 187-195 (2021).
- Rosholm, K. R., et al. Activation of the mechanosensitive ion channel MscL by mechanical stimulation of supported Droplet-Hydrogel bilayers. Scientific Reports. 7 (1), 45180 (2017).
- Wang, Y., et al. Electrode-free nanopore sensing by DiffusiOptoPhysiology. Science Advances. 5 (9), (2019).
- Ahting, U., et al. the pore-forming component of the protein-conducting TOM channel in the outer membrane of mitochondria. The Journal of Cell Biology. 153 (6), 1151-1160 (2001).
- Romero-Ruiz, M., Mahendran, K. R., Eckert, R., Winterhalter, M., Nussberger, S. Interactions of mitochondrial presequence peptides with the mitochondrial outer membrane preprotein translocase TOM. Biophysical Journal. 99 (3), 774-781 (2010).
- Kuszak, A. J., et al. Evidence of distinct channel conformations and substrate binding affinities for the mitochondrial outer membrane protein translocase pore Tom40. The Journal of Biological Chemistry. 290 (43), 26204-26217 (2015).
- Yanagisawa, M., Iwamoto, M., Kato, A., Yoshikawa, K., Oiki, S. Oriented reconstitution of a membrane protein in a giant unilamellar vesicle: Experimental verification with the potassium channel KcsA. Journal of the American Chemical Society. 133 (30), 11774-11779 (2011).
- Goers, R., et al. Optimized reconstitution of membrane proteins into synthetic membranes. Communications Chemistry. 1, 35 (2018).
- Castell, O. K., Dijkman, P. M., Wiseman, D. N., Goddard, A. D. Single molecule fluorescence for membrane proteins. Methods. 147, 221-228 (2018).
- Thompson, J. R., Cronin, B., Bayley, H., Wallace, M. I. Rapid assembly of a multimeric membrane protein pore. Biophysical Journal. 101 (11), 2679-2683 (2011).
- Senior, M. J. T., et al. Single-molecule tracking of perfringolysin O assembly and membrane insertion uncoupling. The FEBS Journal. , (2022).
- Weatherill, E. E., et al. Fast slow folding of an outer membrane porin. Proceedings of the National Academy of Sciences. 119 (20), 2121487119 (2022).
- Kefauver, J. M., Ward, A. B., Patapoutian, A. Discoveries in structure and physiology of mechanically activated ion channels. Nature. 587 (7835), 567-576 (2020).
- Yan, Z., et al. Drosophila NOMPC is a mechanotransduction channel subunit for gentle-touch sensation. Nature. 493 (7431), 221-225 (2013).
- Wang, Y., et al. The push-to-open mechanism of the tethered mechanosensitive ion channel NompC. eLife. 10, 58388 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved