Method Article
TIRF(Total Internal Reflection Fluorescence) 현미경을 사용한 지질 이중층의 측면 이동성 및 이온 채널 활성에 대한 단일 분자 이미징
요약
이 프로토콜은 TIRF 현미경을 사용하여 개별 이온 채널을 추적하고 지지된 지질막에서 그 활성을 결정하여 측면 막 이동과 채널 기능 간의 상호 작용을 정의하는 방법을 설명합니다. 멤브레인을 준비하고, 데이터를 기록하고, 결과를 분석하는 방법을 설명합니다.
초록
고해상도 이미징 기술은 많은 이온 채널이 정적이지 않고 기공 형성 및 보조 서브유닛의 일시적인 결합, 측면 확산 및 다른 단백질과의 클러스터링을 포함하여 매우 역동적인 과정을 겪는다는 것을 보여주었습니다. 그러나 측면 확산과 기능 사이의 관계는 잘 알려져 있지 않습니다. 이 문제에 접근하기 위해 우리는 전반사 형광(TIRF) 현미경을 사용하여 지지된 지질막에서 개별 채널의 측면 이동성과 활동을 모니터링하고 상호 연관시킬 수 있는 방법을 설명합니다. 멤브레인은 DIB(droplet interface bilayer) 기술을 사용하여 초박형 하이드로겔 기판에 제조됩니다. 다른 유형의 모델 멤브레인과 비교할 때 이러한 멤브레인은 기계적으로 견고하고 고감도 분석 기술에 적합하다는 장점이 있습니다. 이 프로토콜은 멤브레인에 근접한 Ca 2+ 민감성 염료의 형광 방출을 관찰하여 단일 채널을 통한 Ca2+ 이온 플럭스를 측정합니다. 기존의 단일 분자 추적 접근법과 달리, 멤브레인의 측면 이동 및 기능을 방해할 수 있는 형광 융합 단백질 또는 표지가 필요하지 않습니다. 단백질의 구조적 변화와 관련된 이온 플럭스의 가능한 변화는 막의 단백질 측면 운동으로 인한 것입니다. 대표적인 결과는 미토콘드리아 단백질 전위 채널 TOM-CC 및 박테리아 채널 OmpF를 사용하여 나타내었다. OmpF와 달리 TOM-CC의 게이팅은 분자 구속 및 측면 확산의 특성에 매우 민감합니다. 따라서 지원되는 액적 계면 이중층은 측면 확산과 이온 채널 기능 간의 연결을 특성화하는 강력한 도구입니다.
서문
본 프로토콜은 고분자 지지 액적 계면 이중층(DIB) 막 1,2,3에서 막 이동성과 막 단백질의 이온 채널 투과성 사이의 상관관계를 연구하는 방법을 설명하는 것을 목표로 합니다.
본 기술은 단일 입자 추적4,5, 형광 상관 분광법 6,7 및 고속 원자력 현미경 8,9,10과 같은 고급 광학 및 표면 분석 도구의 인상적인 배열을 보완합니다. 이는 막 기반 반응에 영향을 미치는 막의 동적 구성과 구조에 대한 귀중한 통찰력을 제공합니다11,12,13. 단백질의 이동과 측면 확산은 막에 있는 단백질의 국소 밀도에 따라 달라지지만, 개별 단백질 분자는 지질 뗏목(14)과 단백질-단백질 상호작용(15,16)에 의해 갇힐 수도 있다. 막에서 세포외 환경 또는 세포질로 돌출된 단백질 도메인에 따라 단백질 이동성은 이동성이 높은 것부터 완전히 움직이지 않는 것까지 다양할 수 있습니다. 그러나, 멤브레인과 그 주변 구조의 복잡성으로 인해, 측면 이동성의 특성과 단백질 기능 사이의 상호작용을 해독하는 것은 종종 어렵다17.
DIB 멤브레인은 멤브레인 단백질 18,19,20,21,22의 생물물리학적 단일 분자 분석을 위한 효율적인 플랫폼임이 입증되었습니다. 이들은 지질/유상에서 수성 방울과 하이드로겔 지지 기질의 접촉을 통한 지질 자가 조립에 의해 형성됩니다. 일반적으로 사용되는 지지된 지질 이중층(SLB)1,23,24,25과 유사하게, DIB는 적절한 리간드로 기능화될 때 단백질을 중합체 매트릭스에 일시적 또는 영구적으로 결합시킴으로써 측면 이동성의 국소 조정을 허용한다(17). 후자는 이질적인 단백질 분포를 갖는 세포막에서 생화학적 과정을 위한 모델 시스템 역할을 할 수 있다10.
여기에 기술된 실험적 접근법은 TIRF 현미경을 사용하여 멤브레인(2,22)에 근접한 개별 채널을 통한 Ca2+ 이온 플럭스를 측정하기 위해Ca2+-민감성 염료의 형광에 의존한다. 이 광학적 접근 방식은 샘플의 조명을 멤브레인에 가까운 거리로 제한하며, 이는 소멸 여기 광의 물리적 특성으로 인해 형광 배경을 크게 감소시킵니다. 후자는 단일 분자의 검출을 위해 높은 공간 및 시간 분해능이 필요한 경우 전제 조건입니다. 고전적인 전기생리학적 방법(26,27)과 달리, 개별 채널을 통한 이온 플럭스를 연구하기 위해 멤브레인 전압이 필요하지 않습니다. 또한, 이 방법은 멤브레인에서 채널의 측면 이동을 방해할 수 있는 형광 염료 또는 분자로 표지할 필요가 없습니다.
이 방법은 고전적인 전기 생리학을 사용하지 않고 단일 분자 수준에서 멤브레인에 내장된 단백질 채널을 연구하는 데 특히 유용합니다. Neurospora crassa28,29,30의 미토콘드리아 단백질 전도 채널 TOM-CC와 대장균17,31의 외막을 가로질러 작은 친수성 분자의 확산을 지원하는 OmpF를 사용하여 두 단백질의 막 이동성과 채널 활성을 연구하고 상관시킬 수 있는 방법을 설명합니다. 이 접근법은 TOM-CC 및 OmpF에 최적화되어 있지만 다른 단백질 채널에 쉽게 적용될 수 있음을 시사합니다.
프로토콜
1. 단백질 생산
참고: 이 섹션에서는 LamB 및 OmpC가 없는 대장균 BE BL21(DE3) omp631,32에서 OmpF를 분리하는 절차와 Neurospora crassa에서 TOM 코어 복합체를 분리하는 절차를 설명합니다(그림 1)28,29. 후자는 TOM 서브유닛Tom22(도 1A)의 6xHis-표지된 형태를 함유하는 N. crassa 균주 28로부터 분리된 미토콘드리아를 필요로 하며, 이는 기재된 바와 같이 분리될 수 있다(28). 다음 프로토콜은 일반적으로 1-2mg의 N. crassa TOM-CC와 10mg의 대장균 OmpF를 생성합니다. 양을 조절하려면 단백질/세제 비율을 정확하게 유지하는 것이 중요합니다. 달리 명시되지 않는 한, 모든 단계는 4°C에서 수행되어야 합니다.
- TOM 코어 복합체의 분리
- Bausewein et al.30에 따르면 약 1.5kg(습윤 중량) 균사로부터 차등 침전으로 얻은 정제된 N. crassa 미토콘드리아(단백질 2g)를 20mM Tris-HCl(pH 8.5), 1%(w/v) DDM, 20%(v/v) 글리세롤, 300mM NaCl, 20mM 이미다졸 및 1mM 페닐메틸설포닐 플루오라이드(PMSF) 중 4°C에서 30분 동안.
주의 : PMSF는 독성이 있습니다. 적절한 개인 보호 장비를 착용하십시오. - 가용화된 미토콘드리아를 초원심분리기 튜브로 옮기고 4°C에서 40분 동안 130,000 x g 에서 초원심분리하고 표준 등급 여과지로 여과하여 가용화된 막 단백질에서 가용화되지 않은 막을 분리합니다.
- 자동 단백질 정제 시스템을 사용하여 사전 충전된 Ni-NTA 컬럼(부피 5mL)을 완충액 A1(표 1)의 약 5컬럼 부피(CV)와 평형을 이룹니다. 모든 단계에서 1mL/분의 일정한 유속으로 Ni-NTA 컬럼을 실행합니다. 단백질이 2g 미만의 미토콘드리아에서 분리된 경우 더 낮은 부피의 컬럼(1mL)을 사용합니다.
- 가용화된 단백질 샘플을 1mL/분의 유속으로 Ni-NTA 컬럼에 로드합니다.
- Ni-NTA 컬럼을 버퍼 A1의 5CV로 세척하여(표 1) 결합되지 않은 단백질을 제거하였다.
- His-tagged TOM-CC를 30% 완충액 A2로 용리하고(표 1; 300 mM 이미다졸) 280 nm 크로마토그램에 나타나는 단백질 피크를 수집하였다(도 1B).
- TOM-CC의 추가 정제를 위해 자동 단백질 정제 시스템을 사용하여 버퍼 B1, B2 및 B1 각각(표 1)의 5CV로 미리 충전된 음이온 교환 컬럼(1mL)을 평형화합니다. 모든 단계에서 1mL/분의 일정한 유속으로 음이온 교환 컬럼을 실행합니다.
- 음이온 교환 컬럼에 TOM-CC 피크 분획(단계 1.1.6)을 로드합니다(유속 1mL/분).
- 버퍼 B1의 5CV(표 1) 및 0%-20% 버퍼 B2(표 1)의 선형 염 구배로 컬럼을 세척하여 결합되지 않은 단백질을 제거합니다.
- 20%-35% 버퍼 B2의 선형 염 구배로 TOM-CC를 용리하고 280nm 크로마토그램에 나타나는 단백질 피크 분획을 수집합니다(그림 1C).
- SDS-PAGE로 시료 순도를 평가하고(그림 1D) 제조업체의 프로토콜에 따라 상업적으로 이용 가능한 단백질 분석을 사용하여 단백질 농도를 결정합니다( 재료 표 참조).
- 단백질 샘플을 액체 질소에서 동결하고 추가 사용이 있을 때까지 -80°C에서 보관합니다.
주의 : 액체 질소는 환기가 잘 되는 곳에서 취급해야 합니다. 적절한 개인 보호 장비를 착용하십시오.
- Bausewein et al.30에 따르면 약 1.5kg(습윤 중량) 균사로부터 차등 침전으로 얻은 정제된 N. crassa 미토콘드리아(단백질 2g)를 20mM Tris-HCl(pH 8.5), 1%(w/v) DDM, 20%(v/v) 글리세롤, 300mM NaCl, 20mM 이미다졸 및 1mM 페닐메틸설포닐 플루오라이드(PMSF) 중 4°C에서 30분 동안.
- OmpF의 분리
- LamB 및 OmpC32가 결여된 대장균 균주 BE BL21(DE3) omp6을 멸균 조건 하에서 냉동 글리세롤 스톡에서 회수하고 Luria-Bertani(LB) 한천 플레이트에 연속으로 부착합니다(표 2). 이렇게하려면 샘플을 전체 플레이트에 골고루 펴십시오.
- 샘플을 한천에 5분 동안 담근 후 뚜껑을 닫은 상태에서 플레이트를 뒤집고 37°C에서 밤새 배양합니다.
- 단일 대장균 콜로니를 선택하고, 멸균 이쑤시개를 사용하여 이 단일 콜로니에 7.5mL의 LB 배지(표 2)를 접종하고, 37°C에서 교반(170rpm)하면서 밤새(14시간) 성장하도록 둡니다.
- 멸균 피펫이 있는 2 x 1 mL의 대장균 세포를 2 x 500 mL의 LB 배지로 옮기고(표 2), 진탕기에서 교반(~170 rpm)하면서 37°C에서 하룻밤(~14시간) 성장하도록 둡니다.
- 4°C에서 20분 동안 5,000 x g 에서 원심분리하여 세포를 수확하고, 펠릿을 액체 질소에서 동결하고, 추가 사용이 될 때까지 -80°C에서 저장한다.
참고: 세포 펠릿의 습윤 중량은 일반적으로 배양 1L당 5g입니다. 이 시점에서 프로토콜을 일시 중지할 수 있습니다. - 세포(2g)를 20mL의 용해 완충액 C1(표 2)에서 해동 및 재현탁하고, 제조업체의 지침에 따라 최대 샘플 부피 35mL로 예냉식(4°C) 고압 세포 파괴 시스템을 통해 1,000psi에서 현탁액을 3회 통과시킵니다.
주의 : 프렌치 프레스를 사용하면 심각한 부상을 입을 수 있습니다. 사용된 셀의 압력 한계를 초과하지 마십시오. 적절한 개인 보호 장비를 착용하십시오. - 4,000 x g 에서 15분 동안 원심분리하여 용해물로부터 깨지지 않은 세포를 제거하고, 상청액을 수집한다.
- 1시간 동안 100,000 x g 에서 초원심분리하여 멤브레인을 수집합니다.
- 멤브레인 펠릿을 10mL의 완충액 C2(표 2)에 재현탁하고 볼 베어링 유리 균질기를 사용하여 동일한 부피의 SDS 완충액 C3(표 2)과 혼합합니다.
주의 : 완충액 C3의 β-메르캅토에탄올은 독성이 있습니다. 모든 관련 안전 규정을 따르십시오. - 현탁액을 50°C의 수조에서 30분 동안 인큐베이션합니다.
- 시료를 100,000 x g , 20°C에서 1시간 동안 원심분리합니다.
- 멤브레인 펠릿을 볼 베어링 유리 균질기를 사용하여 10 mL의 SDS 완충액 C4(표 2)에 재현탁하고, 37°C의 수조에서 30분 동안 현탁액을 배양합니다.
알림: 펠릿을 재현탁할 수 없는 경우 SDS 버퍼 C4를 최대 20mL 용량까지 추가합니다. - 샘플을 20°C에서 100,000 x g 에서 30분 동안 원심분리하고, 상층액을 수집한다.
- 상청액을 옥틸 폴리옥시에틸렌(옥틸 POE)과 최종 세제 농도 0.5%(w/v)로 혼합하고 샘플을 4°C에서 버퍼 C5(표 2)에 대해 24시간 동안 두 번 투석합니다. 이를 위해 제조업체의 지침에 따라 20kDa를 잘라낸 투석 튜브를 사용하고 s를 투석 튜브 또는 장치에 넣습니다.
알림: 투석 튜브의 절단은 다른 분자량을 가진 단백질을 투석해야 합니다. - SDS-PAGE로 샘플 순도를 평가하고 제조업체의 프로토콜(표 재료 표)에 따라 상업적으로 이용 가능한 단백질 분석을 사용하여 단백질 농도를 결정합니다.
참고: 95°C로 가열된 샘플은 단량체 OmpF를 나타냅니다. 가열되지 않은 샘플은 OmpF를 삼량체 형태로 보여줍니다(그림 1F). - OmpF를 액체 질소 중 분취량으로 충격-동결하고, 추가 사용이 있을 때까지 -20°C에서 보관한다.
주의 : 액체 질소는 환기가 잘 되는 곳에서 취급해야 합니다. 적절한 개인 보호 장비를 착용하십시오.
2. DIB 멤브레인에서 이온 채널의 광학 단일 채널 기록
참고: 이 섹션에서는 단일 이온 채널(17)을 통한 측면 단백질 이동 및 이온 플럭스를 모니터링하기 위해 미세 가공된 폴리메틸 메타크릴레이트(PMMA) 챔버(2)에서 DIB 멤브레인을 준비하는 절차를 설명합니다. 챔버 제조를 위한 치수 및 정확한 도면은 Lepthin et al.2에서 찾을 수 있습니다. 그림 2는 PMMA 챔버(2)의 조립 및 DIB 멤브레인의 형성에 대한 개요를 제공합니다. 달리 특정되지 않는 한, 모든 단계는 실온(RT)에서 수행된다. 그림 3은 DIB 멤브레인의 개략도를 보여주며, 단일 채널 단백질을 통한Ca2+ 플럭스가 멤브레인에서의 움직임과 채널의 개방-폐쇄 상태 모두를 모니터링하는 데 어떻게 사용되는지를 보여줍니다.
- 지질의 제조
- 클로로포름에 용해된 1,2-디피타노일-sn-글리세로-3-포스포콜린(25mg/mL DPhPC)이 함유된 지질 원액을 -20°C의 냉동고에서 꺼내고 RT로 가온합니다. 이를 위해 일반적으로 샘플을 몇 분 동안 손으로 천천히 예열하는 것으로 충분합니다.
주의 : 클로로포름은 독성이 있습니다. 적절한 개인 보호 장비를 착용하고 흄 후드 아래에서 클로로포름과 관련된 모든 절차를 수행하십시오. - 380μL의 DPhPC 원액(25mg/mL DPhPC)을 유리 바이알에 옮깁니다. 고무 밀봉이 있는 피펫을 피하십시오. 대신 스테인리스 스틸 플런저가 있는 마이크로리터 유리 주사기를 사용하십시오.
- 지질 원액을 취급한 후 지질 원액을 Ar 또는N2 가스로 덮어 지질 산화를 방지한다. 지질이 용해된 유기 용매가 증발하거나 바이알에서 용매가 튀는 것을 방지하기 위해 가능한 가장 낮은 가스 흐름을 사용하십시오. 유기 용제가 함유된 지질이 들어 있는 유리 바이알의 뚜껑이 내부에 폴리테트라플루오로에틸렌(PTFE)으로 코팅되어 있는지 확인하십시오.
- N2의 스트림 하에서 지질 샘플을 건조시키고(단계 2.1.2), 오일-프리 진공 펌프를 사용하여 진공(2.0 mbar) 하룻밤 동안 지질 샘플로부터 잔류 유기 용매를 제거한다.
- 마이크로리터 유리 주사기를 사용하여 동일한 부피의 헥사데칸과 실리콘 오일(각각 500μL)을 최종 지질 농도 9.5mg/mL에 추가하여 헥사데칸/실리콘 오일 용액에 지질 필름을 녹입니다.
참고: 지질 용액은 RT에서 몇 주 동안 안정적입니다.
- 클로로포름에 용해된 1,2-디피타노일-sn-글리세로-3-포스포콜린(25mg/mL DPhPC)이 함유된 지질 원액을 -20°C의 냉동고에서 꺼내고 RT로 가온합니다. 이를 위해 일반적으로 샘플을 몇 분 동안 손으로 천천히 예열하는 것으로 충분합니다.
- 아가로스 하이드로겔의 제조
- 이중 탈이온수에 약 1mL의 저융점 아가로스 용액(0.75%[w/v])을 준비하고 가열 블록에서 85°C로 20분 동안 가열하여 유리 커버슬립을 스핀 코팅하는 데 사용합니다.
참고: 아가로스 용액은 RT에서 몇 주 동안 보관할 수 있으며 여러 번 재가열할 수 있습니다. - 0.66MCaCl2 및 8.8mM HEPES(pH 7.2) 중 저융점 2.5%(w/v) 아가로스 용액을 준비하고, 20분 동안 가열 블록에서 85°C로 가열합니다. 용설로오스가 잘 녹았는지 확인하십시오.
참고: 아가로스 용액은 RT에서 몇 주 동안 보관할 수 있으며 스핀 코팅에 사용되는 아가로스(단계 2.2.1)와 마찬가지로 여러 번 재가열할 수 있습니다.
- 이중 탈이온수에 약 1mL의 저융점 아가로스 용액(0.75%[w/v])을 준비하고 가열 블록에서 85°C로 20분 동안 가열하여 유리 커버슬립을 스핀 코팅하는 데 사용합니다.
- 폴리메틸 메타크릴레이트(PMMA) 챔버 어셈블리 및 하이드로겔 헥사데칸/실리콘 오일 계면에서 지질 단층 형성
- 유리 커버슬립(40mm x 24mm x 0.13mm)을 스테인리스 스틸 커버슬립 홀더에 넣고 초음파 세척기의 아세톤으로 유리 비커에서 10분 동안 청소합니다. 커버슬립을 물에 잠길 만큼만 아세톤을 사용하고 유리판으로 비커를 느슨하게 덮어 세척 과정에서 증기 누출을 최소화하는 무압력 폐쇄 시스템을 만듭니다.
주의 : 아세톤은 인화점이 낮은 고인화성 용매입니다. 증기/공기 혼합물은 폭발성이 있습니다. 환기가 잘 되는 곳에서 초음파 세척기를 작동하십시오. 적절한 개인 보호 장비를 착용하고 공식 안전 예방 조치(예: 화염 및 스파크 금지)를 준수하십시오. - 유리 커버 슬립을 이중 탈 이온수로 헹구고 N2 흐름에서 건조시킵니다.
알림: 이러한 방식으로 청소한 커버슬립은 몇 주 동안 보관할 수 있습니다. - 플라즈마 클리너에서 커버슬립을 산소(0.5mbar)로 5분 동안 추가로 세척하고 친수성화합니다.
참고: 플라즈마 세척의 친수성 효과는 시간이 지남에 따라 사라지므로 아가로스 용액으로 스핀 코팅하기 직전에 이 단계를 수행하십시오. - 스핀 코터에 플라즈마 처리된 커버슬립을 장착합니다(그림 2, 1단계).
- 200μL 피펫을 사용하여 3,000rpm에서 30초 동안 가열된 0.75%(w/v) 저융점 아가로스(단계 2.2.1)의 140μL를 천천히 추가하여 커버슬립을 서브마이크로미터 두께의 아가로오스 필름으로 코팅합니다(그림 2, 1단계).
주: 아가로스 필름의 두께는 기재된 바와 같이 원자력 현미경(AFM)에 의해 결정될 수 있다(도 17). - 아가로스 하이드로겔의 얇은 층이 있는 스핀 코팅된 커버슬립을 PMMA 챔버(2)의 밑면에 즉시 부착합니다. 아가로스 하이드로겔이 위쪽을 향하도록 합니다(그림 2, 2단계).
- 커버슬립의 가장자리를 투명 접착 테이프로 PMMA 미세 가공 장치에 고정합니다.
- 35°C로 가열된 핫플레이트에 PMMA 장치를 놓습니다(그림 2, 3단계).
- 스핀 코팅에 의해 적용된 얇은 하이드로겔이 2.5% 아가로스 용액의 완충액과 평형을 이루고 수화된 상태를 유지할 수 있도록 기포를 생성하지 않고 2.5% 아가로스 용액(단계 2.2.2)의 2.5% 아가로스 용액(단계 2.2.2)을 피펫으로 챔버의 입구에 조심스럽게 붓습니다. 2.5% 아가로스 용액이 스핀 코팅된 아가로스 하이드로겔 주위에 퍼지지만 그 위에 퍼지지 않도록 하며(그림 3A), PMMA 챔버를 가열판에 부드럽게 눌러 방지할 수 있습니다.
- PMMA 챔버의 웰(그림 2, 단계 4)을 총 60μL의 지질/오일 용액(단계 2.1.5)으로 즉시 덮어 아가로스-오일 계면에서 지질 단층 형성을 시작하고 PMMA 챔버의 웰에서 스핀 코팅된 아가로스의 탈수를 방지합니다. 장치를 35°C의 핫 플레이트에 약 2시간 동안 보관합니다.
참고: PMMA 챔버의 원형 웰은 이전에 발표된 작업2에 따라 직경 0.5mm, 깊이 1.8mm입니다.
- 유리 커버슬립(40mm x 24mm x 0.13mm)을 스테인리스 스틸 커버슬립 홀더에 넣고 초음파 세척기의 아세톤으로 유리 비커에서 10분 동안 청소합니다. 커버슬립을 물에 잠길 만큼만 아세톤을 사용하고 유리판으로 비커를 느슨하게 덮어 세척 과정에서 증기 누출을 최소화하는 무압력 폐쇄 시스템을 만듭니다.
- 헥사데칸/실리콘 오일 용액에 지질 코팅된 수성 액적의 제조
- 20μL의 지질 헥사데칸/실리콘 오일 용액(2.1.5단계)을 액적 배양 챔버의 여러 미세 가공 웰 각각에 놓습니다(그림 2, 4단계). 지질 헥사데칸/실리콘 오일 용액에 적합한 용기는 얇은 PMMA 플레이트2에 40mm x 30mm x 3.5mm의 작은 홈입니다.
- 수직 또는 수평 마이크로피펫 풀러(예: 패치 피펫 또는 날카로운 유리 전극 제조에 사용)를 사용하여 팁 개구부 직경이 20μm인 미세모세관 유리 바늘을 준비합니다. 7.5x에서 35x 사이의 줌 범위에서 저배율로 쌍안경 실체 현미경으로 미세모세관 유리 바늘의 개방 직경을 추정합니다.
알림: 유리 모세관을 당기기 전의 예열 모드 설정, 당기기 가열 모드 및 견인력은 제조업체의 당김 장치 사양 및 모세관 유형에 따라 사전에 실험적으로 결정해야 합니다. - 미세모세관 피펫 팁을 사용하여 8.8mM HEPES(pH 7.2), 7μM Fluo-8, 400μM EDTA, 1.32M KCl 및 30nM TOM 코어 복합체 또는 대안적으로 20nM OmpF를 포함하는 5μL의 수성 주사 용액으로 미세모세관 유리 바늘을 채웁니다. 다가 금속 이온(Ca2+)이 결합하는 킬레이트 수지로 미리 처리된 이중 증류수만을 사용하여 주입액을 제조한다.
- 압전 구동 나노 인젝터에 수성 주입 용액과 함께 미세 모세관 유리 바늘을 장착합니다.
- 8.8 mM HEPES (pH 7.2), 7 μM Fluo-8, 400 μM EDTA, 1.32 M KCl 및 30 nM TOM 코어 복합체 (단계 1.1.12)를 포함하는 100-200 nL의 수성 방울 (그림 2, 단계 4)을 나노 인젝터를 사용하여 지질 헥사 데칸 / 실리콘 오일 용액 (2.1.5 참조)으로 채워진 액적 배양 챔버의 웰에 주입합니다. 물방울을 웰에 몇 밀리미터(>10mm) 간격으로 배치하여 물방울이 서로 닿지 않도록 합니다. 그렇지 않으면 지질 단층이 오일/완충액 계면에서 아직 형성되지 않은 경우 더 큰 액적으로 병합됩니다.
참고: 클래스 모세관과 나노인젝터를 사용할 수 없는 경우, 0.1 μL에서 0.5 μL 사이의 부피에 대해 단일 채널 마이크로리터 피펫을 사용하여 액적을 수동으로 준비할 수 있습니다(2). 그러나 이 경우 액적 부피가 정확하지 않습니다. - 35°C로 가열된 핫 플레이트에서 PMMA 및 액적 배양 챔버(그림 2, 4단계)를 유지하여 액적/오일 계면에서 약 2시간 동안 지질 단층을 형성할 수 있습니다.
- DIB 멤브레인에서 단일 이온 채널의 준비 및 이미징
- 10μL 일회용 폴리프로필렌 팁이 있는 단일 채널 마이크로리터 피펫을 사용하여 실체현미경으로 액적 배양 챔버의 웰에서 PMMA 챔버의 웰로 개별 수성 방울을 수동으로 옮깁니다(그림 2, 5단계). 액적이 하이드로겔-오일 계면에 형성된 지질 단층에 약 5분 동안 가라앉도록 하여 액적과 아가로스 하이드로겔 사이에 지질 이중층(그림 3)을 형성합니다.
- 도립 광학 현미경의 샘플 홀더에 DIB 멤브레인이 있는 PMMA 챔버를 장착하고 10x Hoffman 변조 대비 대물렌즈를 사용하여 멤브레인 형성을 평가합니다(그림 2, 6단계). DIB 막 형성은 액적과 하이드로겔 사이의 계면에서 투명한 흰색 고리로 표시됩니다(그림 4A). 파손된 DIB 멤브레인에는 이 링이 표시되지 않습니다(그림 4B).
참고: 또는 DIB 멤브레인을 위상차 또는 미분 간섭 대비(DIC) 현미경으로 10배 배율로 시각화할 수 있습니다. - DIB 멤브레인이 형성된 경우 EPIOORESCENCE 조명용 기존 광원, 488nm 레이저(Pmax = 100mW) 및 이면조사형 전자 증식 CCD 카메라(512 x 512픽셀>95% QE)가 장착된 TIRF 현미경(그림 2, 7단계)의 샘플 홀더에 PMMA 챔버를 장착하여 ~0.16μm의 픽셀 크기를 달성합니다.
- GFP 필터 세트를 사용하여 고강도 광원으로 에피형광 조명 아래에서 10x 배율 대물렌즈로 DIB 멤브레인의 가장자리를 초점을 맞춥니다.
- 100x/N.A. 1.49 아포크로닉 오일 TIRF 대물렌즈를 사용하여 고배율로 DIB 멤브레인의 동일한 가장자리를 미세 초점화하고, 다시 에피형광 조명 하에서 GFP 필터 세트를 사용하여 고강도 광원을 사용하여 액적에서 형광 염료 Fluo-8의 약한 배경 형광을 시각화할 수 있습니다(그림 4C).
- 필터 설정을 GFP에서 쿼드 밴드 TIRF 필터 세트로 변경합니다.
- 488nm 레이저를 켜고 대물 렌즈의 레이저 강도를 8mW에서 10mW 사이의 값으로 설정합니다.
참고: 대물 렌즈의 레이저 강도에 대한 정량적 정보가 없는 경우가 많기 때문에 레이저 강도 설정은 제조업체의 사양에 따라 포토다이오드 센서가 장착된 광학 레이저 파워 미터를 사용하여 렌즈에서 별도로 측정하여 미리 보정해야 합니다.
주의 : 레이저의 안전한 작동을 보장하기 위해 작업자는 레이저 방사선의 가능한 위험과 사고 예방 규정을 알고 있어야 합니다. - 단일 이온 채널을 시각화하려면 TIRF 각도와 EMCCD 카메라 게인(예: EM 게인 배율기 설정: 285)을 조정하여 DIB 멤브레인의 개방 이온 채널이 어두운 배경에 고대비 형광 반점으로 나타나도록 하고(그림 4D-G), 육안으로 검사할 때 신호 대 배경 비율이 최대에 도달하도록 합니다. 단일 이온 채널을 통한 Ca2+-플럭스에 해당하는 스폿이 초점을 유지하고 중앙에서 강도가 높고 주변으로 갈수록 점차 감소하는 둥근 모양을 갖도록 합니다. 채널이 없는 멤브레인은 배경 형광만 표시합니다(그림 4C).
- 시간 경과에 따른 개별 채널의 움직임 및 개폐 활동을 기록하기 전에 형광 반점에 초점이 맞춰져 있는지 확인하여 이온 채널이 DIB 멤브레인으로 재구성되고 멤브레인 평면에서 측면으로 움직이는지 확인하십시오. 그렇지 않은 경우 형광 분자가 멤브레인 근처의 레이저에 의해 생성된 소멸 필드 안팎으로 침지되고 있음을 나타낼 수 있습니다.
- 위치를 적절하게 추적하고 개별 이온 채널의 개방-폐쇄 상태를 모니터링할 수 있는 일련의 멤브레인 이미지를 기록합니다. 측면 이동도의 유형(예를 들어, 자유 운동 대 일시적인 앵커리지[참고를 위해,16 참조]) 및 채널 활동의 상태(예를 들어, 개방 또는 폐쇄)를 결정하기 위해, 충분히 길고(예를 들어, 30초 내지 1분) 및 잘 샘플링된 궤적(예를 들어, 48초-1의 프레임 속도)을 획득한다.
참고: 채널링, 제한 또는 홉 확산(16 )의 관찰은 샘플링 속도가 제한된 경계 내에서 무제한 확산을 측정할 수 있을 만큼 충분히 빠를 것을 요구한다. 또한 데이터 샘플링 시간이 비제약 확산에서 제약 확산으로의 전환을 측정할 수 있을 만큼 충분히 긴지 확인합니다(자세한 내용은 Jacobson et al.16 참조).
- 이미지 및 데이터 처리
주: 상용 소프트웨어 패키지에 기초한 오픈 소스 이미지 프로세싱 패키지들(33 ) 또는 자체-작성된 루틴들(17 )은 DIB들에서 개별적인 이온 채널들의 시공간 동역학을 분석하기 위해 사용될 수 있다. 측면 멤브레인 이동성과 개별 채널을 통한 이온 플럭스의 상관관계를 파악하려면 필터 알고리즘을 적용해서는 안 됩니다.- 전체 이미지의
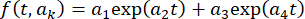 평균 프레임 강도
평균 프레임 강도 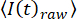 를 에 피팅함으로써, 자체 기록 루틴을 사용하여 표준 절차(34)를 적용함으로써 표백을 위한 이미지 시계열을 수정하고, 여기서 t는 프레임 인덱스(시간)이고 ak는 피팅 파라미터이다. 그런 다음, 에 따라
를 에 피팅함으로써, 자체 기록 루틴을 사용하여 표준 절차(34)를 적용함으로써 표백을 위한 이미지 시계열을 수정하고, 여기서 t는 프레임 인덱스(시간)이고 ak는 피팅 파라미터이다. 그런 다음, 에 따라 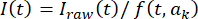 시계열을 수정하며, 여기서 I(t)는 강도입니다. 대안적으로, 초기 데이터 분석을 위해, 롤링볼 알고리즘(33) 및 롤링볼 반경을 갖는 오픈 소스 소프트웨어를 사용하여 배경 보정을 수행하고, 카메라의 스폿 및 픽셀 크기(예를 들어, 50 픽셀)에 의존한다.
시계열을 수정하며, 여기서 I(t)는 강도입니다. 대안적으로, 초기 데이터 분석을 위해, 롤링볼 알고리즘(33) 및 롤링볼 반경을 갖는 오픈 소스 소프트웨어를 사용하여 배경 보정을 수행하고, 카메라의 스폿 및 픽셀 크기(예를 들어, 50 픽셀)에 의존한다. - 정의된 관심 영역(ROI)(예를 들어, 30 x 30 픽셀) 내에서 형광 스폿의 공간적 위치 및 진폭을 결정하고, 주어진 시간 t에서 I(t)를 에 따라
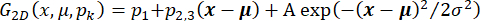 가능한 국부 조명 구배를 설명하는 평면 기울기를 갖는 2차원 가우스 함수에 피팅한다. 여기서, x=(x,y)는 형광 강도 정보를 이용한 ROI이고, A와 σ는 가우시안의 진폭과 폭이며, pk는 ROI의 배경 강도를 특징짓는 파라미터이며, μ=(x0,y0)는 가우시안의 위치를 정의한다. 개별 채널을 통과하는 이온 플럭스는 매개변수 A에 의해 제공됩니다. 채널의 궤적은 x로 주어지며 채널의 측면 이동성을 결정할 수 있습니다. 대안적으로, 설명된 바와 같이 오픈 소스 플랫폼(33) 및 플러그인(35, 36)을 사용하여 개별 스폿의 위치 및 강도를 결정할 수 있다. EMCCD 카메라 판독값을 광자 수(38)로 변환한 후 위치 정확도(37)를 추정합니다.
가능한 국부 조명 구배를 설명하는 평면 기울기를 갖는 2차원 가우스 함수에 피팅한다. 여기서, x=(x,y)는 형광 강도 정보를 이용한 ROI이고, A와 σ는 가우시안의 진폭과 폭이며, pk는 ROI의 배경 강도를 특징짓는 파라미터이며, μ=(x0,y0)는 가우시안의 위치를 정의한다. 개별 채널을 통과하는 이온 플럭스는 매개변수 A에 의해 제공됩니다. 채널의 궤적은 x로 주어지며 채널의 측면 이동성을 결정할 수 있습니다. 대안적으로, 설명된 바와 같이 오픈 소스 플랫폼(33) 및 플러그인(35, 36)을 사용하여 개별 스폿의 위치 및 강도를 결정할 수 있다. EMCCD 카메라 판독값을 광자 수(38)로 변환한 후 위치 정확도(37)를 추정합니다. - 형광 진폭 A 대 시간 및 해당 궤적 x를 플로팅하여 채널 확산도와 채널을 통과하는 이온 플럭스 사이의 가능한 상관 관계를 결정합니다. 모든 그래픽 소프트웨어에서 이 작업을 수행합니다. 자유 횡 채널 이동의 경우, 시간 지연 τ의 선형 회귀에 의해 횡방향 확산 계수 D를 결정하고, 에 따라 x로부터 스폿의 평균 제곱 변위를 계산한다
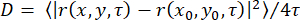 .
.
참고: DIB 멤브레인에서 자유롭게 이동하는 TOM-CC 및 OmpF에 대한 일반적인 확산 계수17 은 0.5 내지 1.5 μm2 s-1 범위이다. 확산 상수가 0.01 mm2·s-1 미만인 분자는 고정화된 것으로 정의된다17.
- 전체 이미지의
결과
실시간 무전극 광학 단일 채널 기록은 측면 단백질 이동과 DIB 멤브레인에서 개별 이온 채널의 기능 간의 상호 작용을 보여줍니다. 미토콘드리아 TOM 코어 복합체(도 1A)를 DIB 막(도 4D)으로 재구성한 것은 측면 이동성과 이온 투과성 사이의 강한 시간적 상관관계를 보여줍니다(도 5A). TOM-CC 게이팅은 횡방향 이동 모드(17)에 민감한 것으로 보인다. 움직이는 채널은 기공을 통해 Ca2+ 플럭스와 높은 형광점 강도를 보여줍니다. 갇힌 움직이지 않는 분자는 낮은 형광 강도와 중간 형광 강도를 나타냅니다. 미토콘드리아 TOM-CC의 일반적인 단백질 수입 공극의 경우, 이 단일 분자 접근법은 측면 이동성과 이온 투과성 사이에 강한 시간적 상관관계를 나타냈으며, 이는 TOM-CC 채널이 기계감응성을 가지고 있음을 시사한다17. 자유롭게 움직이는 TOM-CC 분자의 측면 정지는 TOM-CC 채널의 부분적 또는 완전한 폐쇄를 동반합니다. 멤브레인에 거의 완전히 내장된 OmpF(그림 1E 및 그림 4F)를 사용하여 DIB 멤브레인을 이미징하면 스톱 앤 고 효과가 나타나지 않습니다(그림 5B). OmpF의 무작위 정지는 강도의 변화와 관련이 없으므로 모공이 닫히는 것과 관련이 없습니다. 형광 신호들(38)에 기초하여, 개별 채널들의 위치 정확도는 5 내지 10 nm 사이의 범위에서 추정될 수 있다. 그러나, 예를 들어, 120 nm의 평균 변위를 갖는 중간 상태의 TOM-CC 분자에 대해 도시된 바와 같이, 아가로스 하이드로겔을 사용한 이동 앵커링으로 인해 채널이 약간 흔들리는 경우에는 이러한 정확도를 달성할 수 없다는 점에 유의해야 한다(도 5A).
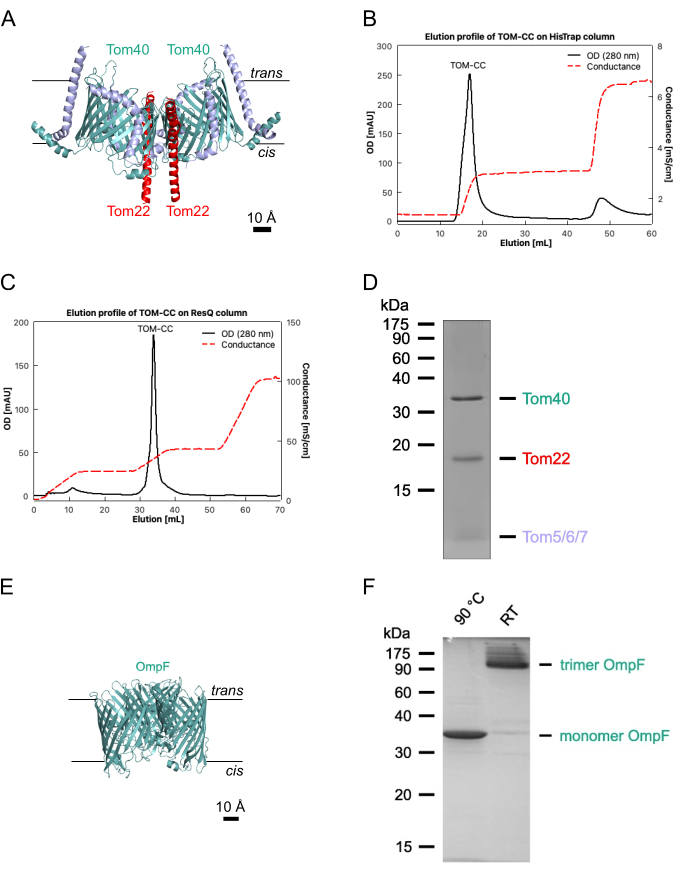
그림 1: TOM-CC의 분리. (A) N. crassa TOM-CC30,39의 Cryo EM 구조. 6xHis 태그가 있는 Tom22를 함유하는 N. crassa 균주의 미토콘드리아를 DDM에 가용화하고 Ni-NTA 친화성 크로마토그래피(B) 및 음이온 교환 크로마토그래피(C)를 실시했습니다. (D) 분리된 TOM-CC의 SDS-PAGE. (E) 정제된 대장균 OmpF의 결정구조(PDB, 1OPF) 및 (F) SDS-PAGE. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
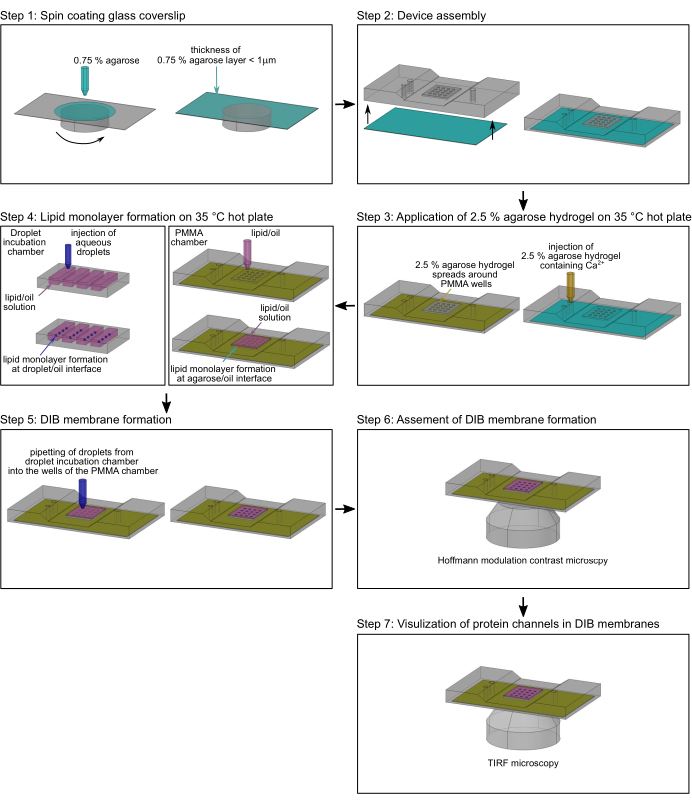
그림 2: PMMA 챔버 어셈블리의 흐름도. 1단계: 유리 커버슬립을 아가로스 하이드로겔로 스핀 코팅합니다. 2단계: 스핀 코팅된 커버슬립을 맞춤형 PMMA 현미경 챔버에 장착합니다. 단계 3: 추가적인 저용융 아가로스를 35°C 열판 상의 PMMA 챔버의 입구 포트에 첨가한다. 4단계: 완충액/오일 계면(왼쪽)과 아가로스 하이드로겔/오일 계면(오른쪽)에서 수성 방울 주위에 지질 단층이 형성됩니다. 5단계: 개별 수성 방울을 PMMA 챔버의 웰에 피펫팅하여 두 개의 지질 단층이 접촉할 때 지질 이중층을 형성합니다. 6단계: DIB 멤브레인의 형성은 Hofmann 변조 조영 현미경으로 검증됩니다. 7단계: 이온 채널이 삽입된 DIB 멤브레인의 선택된 영역의 이미지를 TIRF 현미경으로 획득합니다. 녹색: 0.75% 아가로스; 황색:Ca2+ 이온을 함유하는 2.5% 아가로스; 마젠타: 지질/유상; 진한 파란색: Ca2+ 민감성 염료 및 단백질을 함유한 수성 액적 완충액. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3: 실험 설정. (A) PMMA 웰에 있는 DIB 멤브레인의 개략도. 이중층은 트랜스에서Ca2+-민감성 형광 염료(Fluo-8)를 사용하여 시간 경과에 따라 이온 채널을 통해 Ca2+-플럭스의 TIRF 이미징을 허용하기 위해 초박형 0.75% 아가로스 필름 위에 놓여 있습니다. (B) Ca2+-플럭스는 cis에서 trans까지의 삼투압에 의해서만 제어됩니다. 이를 통해 멤브레인의 위치와 채널의 개방 폐쇄 상태를 모두 결정할 수 있습니다. 여기에 표시된 채널은 N. crassa 미토콘드리아30의 단백질 전도성 채널 TOM-CC입니다. (C) 단일 TOM-CC 채널의 궤적. 녹색: 움직이는 채널; 노란색: 움직이지 않는 채널. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: DIB 멤브레인에서 TOM-CC 및 OmpF 이미징. (A) 하이드로겔과 액적 사이의 이중층 접촉 면적을 보여주는 Hoffmann 변조 대조 현미경으로 이미지화된 DIB 멤브레인. (B) (A)와 같이 이미징된 파손된 DIB 멤브레인. 화살표, PMMA 챔버의 가장자리. (C) 단백질 채널 없이 TIRF 현미경으로 이미지화한 DIB 멤브레인. (D) TIRF 현미경으로 이미지화한 재구성 TOM-CC가 있는 DIB 멤브레인. 흰색 사각형은 높음(SH), 중간(S I) 및 낮음(SL) 강도의 반점을 표시합니다. (E) (A)에 표시된 3개 지점의 형광 강도 프로파일을 2차원 가우스 함수에 맞추면 개별 TOM-CC의 위치와 채널을 통한Ca2+ 플럭스가 나타납니다. (F) 재구성된 OmpF가 있는 DIB 멤브레인. (G) (F)에 표시된 형광 스폿의 가우스 피팅. 2 기공 β 배럴 단백질 복합체 TOM-CC와 달리 3 기공 β 배럴 OmpF는 단 하나의 투과성 상태를 나타냅니다. 픽셀 크기, 0.16μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 채널 활동은 TOM-CC의 측면 이동도와 상관관계가 있습니다. (A) TOM-CC의 형광 진폭 트레이스(위)와 해당 궤적(아래)은 TOM-CC의 개방-폐쇄 채널 활성이 복합체의 측면 막 이동도와 상관관계가 있음을 나타냅니다. 궤적에는 세 가지 투과성 상태가 표시됩니다. 녹색: 완전히 열린 상태; 노란색 : 중간 투과성 상태; 빨간색: 닫힌 채널 상태; 붉은 별: 중간 상태의 TOM-CC는 평균 위치에서 약 ±60nm 정도 흔들립니다. 완전 개방 및 중간 상태에서의 형광 신호에 기초한 위치 정확도(37)는 5 nm 내지 10 nm 사이의 범위이다. (B) OmpF의 형광 진폭 트레이스(위) 및 해당 궤적(아래). OmpF는 이동 중인지 갇혀 있는지에 관계없이 하나의 강도 수준만 나타냅니다. 갇힌 분자의 기간에 해당하는 궤적 세그먼트는 회색으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 완충기 | 시약 농도 | 음량 | ||
| 대답 1* | 20mM Tris-HCl pH 8.5, 0.1%(w/v) n-도데실-β-D-말토사이드(DDM), 10%(v/v) 글리세롤, 300mM NaCl 및 1mM 페닐메틸설포닐 플루오라이드(PMSF) | 100 밀리리터 | ||
| 대답 2* | 20mM Tris-HCl pH 8.5, 0.1%(w/v) DDM, 10%(v/v) 글리세롤, 1M 이미다졸 및 1mM PMSF | 100 밀리리터 | ||
| 나1* | 20mM HEPES pH 7.2, 0.1%(w/v) DDM, 2%(v/v) 디메틸 설폭사이드(DMSO) | 100 밀리리터 | ||
| B2* | 20mM HEPES pH 7.2, 0.1%(w/v) DDM, 1M KCl, 2%(v/v) 디메틸 설폭사이드(DMSO) | 100 밀리리터 | ||
| * 사용하기 전에 가스를 제거하고 0.22μm 필터를 통과시킵니다. | ||||
표 1: TOM-CC 분리를 위한 버퍼 솔루션.
| 완충기 | 시약 농도 | 음량 | ||
| 파운드* | 1%(w/v) 트립톤, 1%(w/v) NaCl 및 0.5%(w/v) 효모 추출물 | 1100 mL의 | ||
| 씨1 | 2 mM MgCl2 및 ~750 단위 DNAse 및 50 mM Tris-HCl pH 7.5 | 20 밀리리터 | ||
| 씨2 | 50mM 트리스-HCl, pH 7.5 | 50 밀리리터 | ||
| 씨3 | 4%(w/v) 소듐 도데실 설페이트(SDS), 2mM β-메르캅토에탄올 및 50mM Tris-HCl pH 7.5 | 50 밀리리터 | ||
| 씨4 | 2%(w/v) SDS, 500mM NaCl 및 50mM Tris-HCl pH 7.5 | 50 밀리리터 | ||
| 씨5 | 0.5%(w/v) 옥틸 폴리옥시에틸렌(옥틸 POE), 1mM EDTA 및 20mM 트리스 pH 8.5 | 1000 mL | ||
| * 사용하기 전에 소독하십시오. | ||||
표 2: OmpF 분리를 위한 버퍼 용액.
토론
여기에 제시된 프로토콜은 단일 분자 TIRF 현미경을 사용하여 측면 이온 채널 이동과 채널 기능 간의 상호 작용을 연구하기 위해 DIB 멤브레인을 사용하는 방법을 소개합니다. 최상의 데이터를 얻기 위해서는 가능한 한 많은 잘 분리된 채널이 있는 안정적인 DIB 멤브레인을 준비하는 것이 만족스럽게 분석할 수 있는 개별 입자의 시계열을 얻는 데 중요합니다.
최적화해야 할 중요한 파라미터에는 지질 선택, 유상의 지질 농도, 수성 방울의 단백질 및 세제 농도가 포함됩니다. 사용된 지질은 저온에서 명확한 상전이를 나타내지 않는다는 점에서 특이합니다. DPhPC는 안정한 멤브레인 시스템(40)을 생산하기 위해 통상적으로 사용되는 지질이다. 원칙적으로, 저온에서 그의 유체 환경을 유지하는 임의의 지질이 이러한 적용에 적합할 수 있다. 또한, 지질은 산화에 민감하지 않아야 한다. 액적의 세제 농도는 막 파열을 방지하기 위해 가능한 한 낮아야 합니다. 안정적인 멤브레인 및 양호한 단백질 혼입률은 일반적으로 멤브레인 단백질이 침전되지 않는다는 점을 감안할 때 임계 미셀 농도(cmc) 미만의 세제 농도에서 달성됩니다.
DIB 막이 특정 세제를 견디지 못하는 경우21,41, 또는 단백질이 낮은 세제 용액에서 DIB 막으로 통합되지 않는 경우, 단백질 채널은 먼저 작은 단층 지질 소포 (SUV)로 재구성 될 수 있으며, 이는 E. coli MscL 42에 대해 성공적으로 나타난 바와 같이 액적 측면에서 DIB 막으로 융합됩니다 . 때때로 DIB 멤브레인은 유상의 지질 농도가 너무 낮기 때문에 형성되지 않습니다. DIB 멤브레인이 파열되는 것을 방지하기 위해 하이드로겔과 액적 사이의 삼투압은 시스에서 트랜스로의 Ca2+-플럭스에 과도하게 영향을 미치지 않으면서 정확하게 균형을 이루어야 한다는 점도 알고 있어야 합니다. 최적화된 아가로스 두께 및 메쉬 크기는 막 단백질의 확산을 관찰하는 데 중요한 것으로 보인다. 아가로스 층의 건조는 피해야 한다. 두께는 원자력 현미경(17)을 사용하여 결정할 수 있다. 스핀 코팅 동안 아가로스 농도, 부피 및 회전 속도를 변화시킴으로써, 히드로겔의 메쉬 크기 및 두께가 최적화될 수 있다. 그러나 수화겔 층 두께는 이미지 대비에 영향을 미칩니다. DIB에서 막 단백질을 포획하기 위해, 아가로스 하이드로겔은 맞춤형 합성, 비가교결합, Ni-NTA 변형, 저융점 아가로스로 대체되어 His-tag17을 통해 이들을 포획할 수 있습니다. 지나치게 높은 형광 배경은 종종 DIB 막의 파열로 인해 발생합니다. 이것은 Ca2+-민감성 염료가 하이드로겔로 확산되기 때문에 멀티웰 챔버에서 특히 문제가 됩니다. 이 경우 인접한 우물은 피해야합니다. 멤브레인 위의 Ca2+ 민감성 염료의 형광 표백은 TIRF 소멸장 외부의 액적 벌크(그림 3A)에서 여기되지 않은 염료로 교환되기 때문에 중요한 제한 요소가 되어서는 안 됩니다. 단백질의 국소화 정밀도는 스폿과 픽셀 크기를 맞추는 정확도에 의해 주어집니다.
약한 형광 신호는 채널을 통한 낮은Ca2+-플럭스로 인해 발생할 수 있습니다. 가능한 이유는 다음과 같습니다 : (i) 부정확 한 TIRF 설정 (예 : 레이저 강도), (ii) 멤브레인을 가로 지르는 삼투압 Ca 2+ 압력 또는 (iii) 채널의 고유 Ca2+ 투과성이 너무 낮습니다. 첫 번째 문제에 대처하려면 레이저 강도, TIRF 각도 및 카메라 게인을 최적화해야 합니다. 후자의 두 가지 문제는 멤브레인(2,43)을 가로지르는 전위의 인가에 의해 극복될 수 있다. 그러나 전기적 효과가 실제로 전압으로 제어되지 않는 리간드 개폐 또는 기계에 민감한 이온 채널의 채널 개방에 영향을 미칠 수 있기 때문에 외부 전압을 적용하면 결과가 왜곡될 수 있습니다. 이러한 채널의 예는 미토콘드리아 단백질 트랜스로카제 TOM-CC27 및 그의 채널 형성 서브유닛 Tom40 26,44,45,46입니다. 마지막으로, 원하는 기능을 달성하기 위해 특정 방향으로 DIB 막에 막 단백질을 삽입하는 것은 까다롭고 정량적 연구는 드뭅니다47,48. 일부 경우에, 통합된 단백질의 배향은 랜덤하다. 이것은 특정 막 단백질이 막의 한쪽에서만 활성화되기 때문에 막 단백질을 연구하는 데 심각한 문제입니다.
TIRF 현미경은 평면 지지 멤브레인49에서 단일 분자 이벤트를 해결하기 위한 강력한 방법입니다. 예를 들면 α-헤몰리신50, 퍼프린골리신 O 51 및 OmpG52와 같은 채널 단백질의 조립 및 폴딩 경로 설명이 있습니다. 이 연구에는 추가 기술로 FRET가 포함되었습니다. 또한, 기계감응성 이온 채널 MscL의 활성화는 전류 측정치를 사용하여 지지된 DIB 이중층(42)의 기계적 자극에 의해 이전에 연구되었다. 이 작업을 기반으로 향후 연구에서는 여기에 설명된 플랫폼을 단일 분자 FRET 실험과 결합하여 광학 방식으로 단일 분자 수준에서 기계 민감성 채널을 처리할 수 있습니다17. 액적에 완충액을 주입하거나, 내부 DIB 단층을 늘리거나, 개별 채널을 기본 하이드로겔에 표적으로 결합하는 것은 MscL 및 MscS, 2-공극 도메인 K+-채널, TREK-1, TREK-2, 및 TRAAK, 및 PIEZO (검토를 위해,53 참조)는 또한 터치 민감성 이온 채널 NOMPC54,55에 대해 나타낸 바와 같이 세포 세포골격에 대한 국소 결합이다.
공개
우리는 이해 상충을 선언하지 않습니다.
감사의 말
단백질 준비에 도움을 준 Beate Nitschke와 통찰력 있는 토론을 해준 Robin Ghosh, Michael Schweikert(슈투트가르트), Maximilan Ulbrich(프라이부르크)에게 감사드립니다. 이 연구는 슈투트가르트 연구 센터 시스템 생물학 (SRCSB)과 바덴 뷔 르템 베르크 재단 (BiofMO-6 to SN)의 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1,2-diphytanoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850356C | |
| 100x Oil objective Apochromat N.A. 1.49 | Nikon | MRD01991 | TIRF microscope |
| 10x Hoffmann modulation contrast objective NA 0.25 | Nikon | Microscope to assess DIB membrane formation | |
| 10x objective N.A. 0.25 | Nikon | MRL00102 | TIRF microscope |
| 40x Hoffmann modulation contrast objective NA 0.55 | Nikon | Microscope to assess DIB membrane formation | |
| 488 nm laser, 100 mW | Visitron | TIRF microscope | |
| Adhesive tape | |||
| Äkta pure | Cytiva | Protein purification system | |
| Bradford assay kit, Pierce | Thermo Fisher | 23236 | |
| CaCl2 | Roth | 5239.2 | |
| Chelax 100 resin | Biorad | 143-2832 | |
| Chloroform | Sigma-Aldrich | MC1024452500 | |
| Dialysis cassettes Slide-A-Lyzer 20 k MWCO | Thermo Fisher | 87735 | |
| DIB chamber | Custom made | PMMA chamber for DIB membranes | |
| Digital power meter and energy console | Thorlabs | PM100D | Laser power meter |
| Dimethyl sulfoxide | Roth | 4720.1 | |
| Double distilled H2O | |||
| Eclipse TS 100 Hoffmann modulation contrast microscope | Nikon | Microscope to assess DIB membrane formation | |
| EDTA | Roth | 8042.2 | |
| EMCCD camera iXon Ultra 897 | Andor | TIRF microscope | |
| Ethanol | Sigma-Aldrich | 32205-M | |
| Fixed angle rotor Ti70 | Beckman Coulter | ||
| Fluo-8, CalciFluorTM | Santa Cruz Biotechnology | SC-362561 | Ca2+-sensitive dye |
| French press cell disruption homogenizer | Igneus | Igneus 40000 psi | |
| GFP filter | AHF | Filter seeting used for excitation of DIB-membranes by epifluorescence with white light source | |
| Glass capillaries | World Precision Instruments | 4878 | |
| Glass coverslips 40 mm x 24 mm x 0.13 mm | Roth | 1870.2 | |
| Glycerol | Roth | 3783.2 | |
| Hamilton syringe 10 mL | Roth | X033.1 | |
| Hamilton syringe 100 mL | Roth | X049.1 | |
| Hamilton syringe 500 mL | Roth | EY49.1 | |
| Heating block | Eppendorf | Thermomixer comfort | |
| Heating plate | Minitube | HT200 | |
| Hepes | Roth | 9205.3 | |
| Hexadcane | Sigma-Aldrich | 296317 | |
| His Trap HP 1 mL | Cytiva | 29051021 | Ni-NTA column |
| Imidazole | Sigma-Aldrich | 1.04716.1000 | |
| KCl | Honeywell | 10314243 | |
| KLM spin coater | Schaefer Tec | SCV-10 | |
| List medical L/M-3P-A vertical pipette puller | Artisan Technology Group | 57761-1 | |
| Low melting point agarose | Sigma-Aldrich | A9414 | |
| M8 Stereomicroscope | Wild | Stereomicrosope | |
| Matlab | MathWorks | R2022a | |
| Methanol | Sigma-Aldrich | 34860 | |
| MicroFil pipette tips | World Precision Instruments | MF34G-5 | |
| N2 gas | |||
| NaCl | Roth | 3957.1 | |
| Nanoliter 2010 injector | World Precision Instruments | Nanoliter 2010 | |
| n-dodecyl-b-D-maltoside | Glycon Biochemicals | D97002-C | |
| Ni-NTA agarose, non-crosslinked | Cube Biotech | 124115393 | Custom made |
| NIS-Elements AR software | Nikon | MQS31100/MQS42560/MQS42580/MQS42780/MQS41930 | Imaging software |
| n-octyl-polyoxyethylene | Sigma-Aldrich | 40530 | |
| O2 gas | |||
| Phenylmethylsulfonyl fluoride | Roth | 6367.3 | |
| Photodiode sensor Si, 400 - 1100 nm, 500 mW | Thorlabs | S130C | Sensor for laser power meter |
| Plasma cleaner | Diener Electronics | Zepto | |
| Preparative ultracentrifuge Optima | Beckman Coulter | ||
| Quad-band TIRF-filter 446/523/600/677 HC | AHF | Filter setting used for excitation of DIB-membranes with 488 nm laser | |
| Resource Q 1 mL | Cytiva | 17117701 | Anion exchange column |
| Silicon oil AR 20 | Sigma-Aldrich | 10836 | |
| Sodium dodecyl sulfate | Roth | 2326.2 | |
| Super LoLux camera | JVC | Stereomicrosope | |
| Thermoshaker | Gerhardt | THL 500/1 | |
| Ti-E Fluorescence microscope | Nikon | MEA53100 | |
| Tris-HCl | Sigma-Aldrich | 9090.3 | |
| Tryptone | Roth | 8952.2 | |
| Ultrasonic bath | Bandelin Sonorex | RK 100 | |
| Vaccum pump | Vacuubrand | MD 4C NT | |
| White light source for epifluorescence illumination (100 W) | Nikon | MBF72655 | TIRF microscope |
| Yeast extract | Roth | 2363.2 | |
| β-mercaptoethanol | Sigma-Aldrich | M3148 |
참고문헌
- Tanaka, M., Sackmann, E. Polymer-supported membranes as models of the cell surface. Nature. 437 (7059), 656-663 (2005).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Thompson, J. R., Heron, A. J., Santoso, Y., Wallace, M. I. Enhanced stability and fluidity in droplet on hydrogel bilayers for measuring membrane protein diffusion. Nano Letters. 7 (12), 3875-3878 (2007).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34 (1), 351-378 (2005).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysical Journal. 60 (4), 910-921 (1991).
- Kusumi, A., Shirai, Y. M., Koyama-Honda, I., Suzuki, K. G. N., Fujiwara, T. K. Hierarchical organization of the plasma membrane: Investigations by single-molecule tracking vs. fluorescence correlation spectroscopy. FEBS Letters. 584 (9), 1814-1823 (2010).
- Betaneli, V., Schwille, P. Fluorescence correlation spectroscopy to examine protein-lipid interactions in membranes. Methods in Molecular Biology. 974, 253-278 (2013).
- Ando, T., et al. A high-speed atomic force microscope for studying biological macromolecules. Proceedings of the National Academy of Sciences. 98 (22), 12468-12472 (2001).
- Casuso, I., et al. Characterization of the motion of membrane proteins using high-speed atomic force microscopy. Nature Nanotechnology. 7 (8), 525-529 (2012).
- Karner, A., et al. Tuning membrane protein mobility by confinement into nanodomains. Nature Nanotechnology. 12 (3), 260-266 (2017).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118 (6), 1099-1102 (2005).
- Schink, K. O., Tan, K. -. W., Stenmark, H. Phosphoinositides in control of membrane dynamics. Annual Review of Cell and Developmental Biology. 32 (1), 143-171 (2016).
- Schafer, D. A. Coupling actin dynamics and membrane dynamics during endocytosis. Current Opinion in Cell Biology. 14 (1), 76-81 (2002).
- Lingwood, D., Ries, J., Schwille, P., Simons, K. Plasma membranes are poised for activation of raft phase coalescence at physiological temperature. Proceedings of the National Academy of Sciences. 105 (29), 10005-10010 (2008).
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Jacobson, K., Liu, P., Lagerholm, B. C. The lateral organization and mobility of plasma membrane components. Cell. 177 (4), 806-819 (2019).
- Wang, S., et al. Spatiotemporal stop-and-go dynamics of the mitochondrial TOM core complex correlates with channel activity. Communications Biology. 5 (1), 471 (2022).
- Ide, T., Yanagida, T. An artificial lipid bilayer formed on an agarose-coated glass for simultaneous electrical and optical measurement of single ion channels. Biochemical and Biophysical Research Communications. 265 (2), 595-599 (1999).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid bilayer formation by contacting monolayers in a microfluidic device for membrane protein analysis. Analytical Chemistry. 78 (24), 8169-8174 (2006).
- Heron, A. J., Thompson, J. R., Mason, A. E., Wallace, M. I. Direct detection of membrane channels from gels using water-in-oil droplet bilayers. Journal of the American Chemical Society. 129 (51), 16042-16047 (2007).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Huang, S., Romero-Ruiz, M., Castell, O. K., Bayley, H., Wallace, M. I. High-throughput optical sensing of nucleic acids in a nanopore array. Nature Nanotechnology. 10 (11), 986-991 (2015).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271 (5245), 43-48 (1996).
- Kiessling, V., Yang, S. -. T., Tamm, L. K. Supported lipid bilayers as models for studying membrane domains. Current Topics in Membranes. 75, 1-23 (2015).
- Murray, D. H., Tamm, L. K., Kiessling, V. Supported double membranes. Journal of Structural Biology. 168 (1), 183-189 (2009).
- Hill, K., et al. Tom40 forms the hydrophilic channel of the mitochondrial import pore for preproteins. Nature. 395 (6701), 516-521 (1998).
- Poynor, M., Eckert, R., Nussberger, S. Dynamics of the preprotein translocation channel of the outer membrane of mitochondria. Biophysical Journal. 95 (3), 1511-1522 (2008).
- Künkele, K. P., et al. The preprotein translocation channel of the outer membrane of mitochondria. Cell. 93 (6), 1009-1019 (1998).
- Ahting, U., et al. The TOM core complex: the general protein import pore of the outer membrane of mitochondria. The Journal of Cell Biology. 147 (5), 959-968 (1999).
- Bausewein, T., et al. Cryo-EM structure of the TOM core complex from Neurospora crassa. Cell. 170 (4), 693-700 (2017).
- Cowan, S. W., et al. Crystal structures explain functional properties of two E. coli porins. Nature. 358 (6389), 727-733 (1992).
- Bieligmeyer, M., et al. Reconstitution of the membrane protein OmpF into biomimetic block copolymer-phospholipid hybrid membranes. Beilstein Journal of Nanotechnology. 7, 881-892 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Vicente, N. B., Zamboni, J. E. D., Adur, J. F., Paravani, E. V., Casco, V. H. Photobleaching correction in fluorescence microscopy images. Journal of Physics: Conference Series. 90 (1), 012068 (2007).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Ershov, D., et al. TrackMate 7: integrating state-of-the-art segmentation algorithms into tracking pipelines. Nature Methods. 19 (7), 829-832 (2022).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Hirsch, M., Wareham, R. J., Martin-Fernandez, M. L., Hobson, M. P., Rolfe, D. J. A stochastic model for electron multiplication charge-coupled devices - From theory to practice. PLoS One. 8 (1), 53671 (2013).
- Bausewein, T., Naveed, H., Liang, J., Nussberger, S. The structure of the TOM core complex in the mitochondrial outer membrane. Biological Chemistry. 401 (6-7), 687-697 (2020).
- Lindsey, H., Petersen, N. O., Chan, S. I. Physicochemical characterization of 1,2-diphytanoyl-sn-glycero-3-phosphocholine in model membrane systems. Biochimica et Biophysica Acta. 555 (1), 147-167 (1979).
- Manafirad, A. Single ion-channel analysis in droplet interface bilayer. Methods in Molecular Biology. 2186, 187-195 (2021).
- Rosholm, K. R., et al. Activation of the mechanosensitive ion channel MscL by mechanical stimulation of supported Droplet-Hydrogel bilayers. Scientific Reports. 7 (1), 45180 (2017).
- Wang, Y., et al. Electrode-free nanopore sensing by DiffusiOptoPhysiology. Science Advances. 5 (9), (2019).
- Ahting, U., et al. the pore-forming component of the protein-conducting TOM channel in the outer membrane of mitochondria. The Journal of Cell Biology. 153 (6), 1151-1160 (2001).
- Romero-Ruiz, M., Mahendran, K. R., Eckert, R., Winterhalter, M., Nussberger, S. Interactions of mitochondrial presequence peptides with the mitochondrial outer membrane preprotein translocase TOM. Biophysical Journal. 99 (3), 774-781 (2010).
- Kuszak, A. J., et al. Evidence of distinct channel conformations and substrate binding affinities for the mitochondrial outer membrane protein translocase pore Tom40. The Journal of Biological Chemistry. 290 (43), 26204-26217 (2015).
- Yanagisawa, M., Iwamoto, M., Kato, A., Yoshikawa, K., Oiki, S. Oriented reconstitution of a membrane protein in a giant unilamellar vesicle: Experimental verification with the potassium channel KcsA. Journal of the American Chemical Society. 133 (30), 11774-11779 (2011).
- Goers, R., et al. Optimized reconstitution of membrane proteins into synthetic membranes. Communications Chemistry. 1, 35 (2018).
- Castell, O. K., Dijkman, P. M., Wiseman, D. N., Goddard, A. D. Single molecule fluorescence for membrane proteins. Methods. 147, 221-228 (2018).
- Thompson, J. R., Cronin, B., Bayley, H., Wallace, M. I. Rapid assembly of a multimeric membrane protein pore. Biophysical Journal. 101 (11), 2679-2683 (2011).
- Senior, M. J. T., et al. Single-molecule tracking of perfringolysin O assembly and membrane insertion uncoupling. The FEBS Journal. , (2022).
- Weatherill, E. E., et al. Fast slow folding of an outer membrane porin. Proceedings of the National Academy of Sciences. 119 (20), 2121487119 (2022).
- Kefauver, J. M., Ward, A. B., Patapoutian, A. Discoveries in structure and physiology of mechanically activated ion channels. Nature. 587 (7835), 567-576 (2020).
- Yan, Z., et al. Drosophila NOMPC is a mechanotransduction channel subunit for gentle-touch sensation. Nature. 493 (7431), 221-225 (2013).
- Wang, Y., et al. The push-to-open mechanism of the tethered mechanosensitive ion channel NompC. eLife. 10, 58388 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유