Method Article
Imagerie à molécule unique de la mobilité latérale et de l’activité des canaux ioniques dans les bicouches lipidiques à l’aide de la microscopie à fluorescence par réflexion interne totale (TIRF)
Dans cet article
Résumé
Ce protocole décrit comment utiliser la microscopie TIRF pour suivre les canaux ioniques individuels et déterminer leur activité dans les membranes lipidiques soutenues, définissant ainsi l’interaction entre le mouvement de la membrane latérale et la fonction des canaux. Il décrit comment préparer les membranes, enregistrer les données et analyser les résultats.
Résumé
Les techniques d’imagerie à haute résolution ont montré que de nombreux canaux ioniques ne sont pas statiques, mais soumis à des processus hautement dynamiques, y compris l’association transitoire de sous-unités porogènes et auxiliaires, la diffusion latérale et le regroupement avec d’autres protéines. Cependant, la relation entre la diffusion latérale et la fonction est mal comprise. Pour aborder ce problème, nous décrivons comment la mobilité latérale et l’activité des canaux individuels dans les membranes lipidiques soutenues peuvent être surveillées et corrélées à l’aide de la microscopie à fluorescence par réflexion interne totale (TIRF). Les membranes sont fabriquées sur un substrat d’hydrogel ultramince à l’aide de la technique DIB (Droplet Interface Bilayer). Par rapport à d’autres types de membranes modèles, ces membranes ont l’avantage d’être mécaniquement robustes et adaptées à des techniques analytiques très sensibles. Ce protocole mesure le flux d’ions Ca 2+ à travers des canaux simples en observant l’émission de fluorescence d’un colorant sensible au Ca2+ à proximité de la membrane. Contrairement aux approches classiques de suivi d’une seule molécule, aucune protéine de fusion fluorescente ou marqueur, qui peut interférer avec le mouvement latéral et la fonction dans la membrane, n’est nécessaire. Les changements possibles dans le flux ionique associés aux changements conformationnels de la protéine ne sont dus qu’au mouvement latéral de la protéine dans la membrane. Des résultats représentatifs sont présentés en utilisant le canal de translocation de protéines mitochondriales TOM-CC et le canal bactérien OmpF. Contrairement à l’OmpF, le gating du TOM-CC est très sensible au confinement moléculaire et à la nature de la diffusion latérale. Par conséquent, les bicouches d’interface gouttelettes prises en charge sont un outil puissant pour caractériser le lien entre la diffusion latérale et la fonction des canaux ioniques.
Introduction
Le présent protocole vise à décrire comment étudier la corrélation entre la mobilité membranaire et la perméabilité des canaux ioniques des protéines membranaires dans les membranes bicouches à interface gouttelettes (DIB)supportées par polymère 1,2,3.
La technique actuelle complète une gamme impressionnante d’outils optiques et analytiques de surface avancés, tels que le suivi des particules uniques 4,5, la spectroscopie de corrélation de fluorescence6,7 et la microscopie à force atomique à grande vitesse 8,9,10. Ceux-ci fournissent des informations précieuses sur la composition dynamique et la structure des membranes qui influencent les réactions membranaires11,12,13. Alors que le mouvement et la diffusion latérale des protéines dépendent de la densité locale des protéines dans la membrane, les molécules protéiques individuelles peuvent également être piégées dans des radeaux lipidiques14 et par des interactions protéine-protéine15,16. Selon les domaines protéiques dépassant de la membrane dans l’environnement extracellulaire ou cytosol, la mobilité des protéines peut varier de très mobile à complètement immobile. Cependant, en raison de la complexité de la membrane et de ses structures périphériques, il est souvent difficile de déchiffrer l’interaction entre la nature de la mobilité latérale et la fonction protéique17.
Les membranes DIB se sont révélées être une plate-forme efficace pour les analyses biophysiques à molécule unique des protéines membranaires 18,19,20,21,22. Ils sont formés par auto-assemblage lipidique par contact de gouttelettes aqueuses avec des substrats supportés par hydrogel dans une phase lipidique / huileuse. Semblables aux bicouches lipidiques supportées (SLB)1,23,24,25 couramment utilisées, les DIB permettent un réglage local de la mobilité latérale par liaison temporaire ou permanente des protéines à la matrice polymère lorsqu’elles sont fonctionnalisées avec des ligands appropriés17. Ce dernier peut servir de système modèle pour les processus biochimiques dans les membranes cellulaires avec une distribution protéique hétérogène10.
L’approche expérimentale décrite ici repose sur la fluorescence de colorants sensibles au Ca 2+ pour mesurer le flux d’ions Ca 2+ à travers des canaux individuels à proximité immédiate de la membrane 2,22 à l’aide de la microscopie TIRF. Cette approche optique limite l’éclairage de l’échantillon à une distance proche de la membrane, ce qui, en raison des propriétés physiques de la lumière d’excitation évanescente, conduit à une réduction significative du fond de fluorescence. Ce dernier est une condition préalable si une résolution spatiale et temporelle élevée est requise pour la détection de molécules uniques. Contrairement aux méthodes électrophysiologiques classiques26,27, aucune tension membranaire n’est nécessaire pour étudier le flux d’ions à travers des canaux individuels. De plus, la méthode ne nécessite pas de marquage avec des colorants fluorescents ou des molécules qui pourraient interférer avec le mouvement latéral des canaux dans la membrane.
La méthode est particulièrement utile pour étudier les canaux protéiques intégrés dans la membrane au niveau de la molécule unique sans utiliser l’électrophysiologie classique. En utilisant le canal conducteur de protéines mitochondriales TOM-CC de Neurospora crassa28,29,30 et OmpF, qui soutient la diffusion de petites molécules hydrophiles à travers la membrane externe d’Escherichia coli17,31, nous illustrons comment les mobilités membranaires et les activités des canaux des deux protéines peuvent être étudiées et corrélées. Nous suggérons que cette approche, bien qu’optimisée pour TOM-CC et OmpF, peut être facilement appliquée à d’autres canaux protéiques.
Protocole
1. Production de protéines
REMARQUE : Cette section décrit la procédure d’isolement de l’OmpF d’Escherichia coli BE BL21(DE3) omp631,32, qui manque de LamB et d’OmpC, et du complexe TOM de Neurospora crassa (Figure 1)28,29. Ce dernier nécessite des mitochondries isolées à partir d’une souche 28 de N. crassa contenant une forme marquée 6xHis de la sous-unité TOM Tom22 (Figure 1A), qui peut être isolée comme décrit28. Les protocoles suivants donnent habituellement 1-2 mg de N. crassa TOM-CC et 10 mg d’E. coli OmpF. Si la quantité doit être ajustée, il est important que les ratios protéines/détergents soient maintenus avec précision. Sauf indication contraire, toutes les étapes doivent être effectuées à 4 °C.
- Isolement du complexe central TOM
- Solubiliser les mitochondries purifiées de N. crassa (2 g de protéines) obtenues par sédimentation différentielle à partir d’environ 1,5 kg (poids humide) d’hyphes, selon Bausewein et coll.30, à une concentration protéique de 10 mg/mL dans 20 mM de Tris-HCl (pH 8,5), 1 % (p/v) de DDM, 20 % (v/v) de glycérol, 300 mM de NaCl, 20 mM d’imidazole et 1 mM de fluorure de phénylméthylsulfonyle (PMSF) pendant 30 min à 4 °C.
ATTENTION : Le PMSF est toxique. Portez un équipement de protection individuelle approprié. - Transférer les mitochondries solubilisées dans des tubes à ultracentrifugation et séparer les membranes non solubilisées des protéines membranaires solubilisées par ultracentrifugation à 130 000 x g pendant 40 min à 4 °C et filtration avec du papier filtre de qualité standard.
- Équilibrer une colonne de Ni-NTA préemballée (volume de 5 mL) avec environ 5 volumes de colonne (CV) de tampon A1 (tableau 1) à l’aide d’un système automatisé de purification des protéines. Faire fonctionner la colonne Ni-NTA à un débit constant de 1 mL/min pendant toutes les étapes. Utilisez une colonne de volume inférieur (1 mL) si les protéines ont été isolées de moins de 2 g de mitochondries.
- Charger l’échantillon de protéines solubilisées sur la colonne de Ni-NTA à un débit de 1 mL/min.
- Laver la colonne Ni-NTA avec 5 CV de tampon A1 (tableau 1) pour éliminer les protéines non liées.
- Éluez le TOM-CC marqué à l’état de His avec un tampon A2 à 30 % (tableau 1; imidazole de 300 mM) et recueillez le pic protéique tel qu’il apparaît dans le chromatogramme de 280 nm (figure 1B).
- Pour une purification plus poussée du TOM-CC, équilibrer la colonne échangeuse d’anions préemballée (1 mL) avec 5 CV chacun de tampon B1, B2 et B1 (tableau 1) à l’aide du système automatisé de purification des protéines. Faire fonctionner la colonne d’échange d’anions à un débit constant de 1 mL/min pendant toutes les étapes.
- Charger la fraction de crête TOM-CC (étape 1.1.6) sur la colonne d’échange d’anions (débit de 1 mL/min).
- Éliminer les protéines non liées en lavant la colonne avec 5 CV de tampon B1 (tableau 1) et un gradient linéaire de sel de 0% à 20% tampon B2 (tableau 1).
- Éluez TOM-CC avec un gradient linéaire de sel de 20% à 35% tampon B2, et collectez la fraction de pic protéique telle qu’elle apparaît dans le chromatogramme 280 nm (Figure 1C).
- Évaluer la pureté de l’échantillon à l’aide de la FDS-PAGE (figure 1D) et déterminer la concentration en protéines à l’aide d’un dosage des protéines disponible dans le commerce, conformément au protocole du fabricant (voir le tableau des matériaux).
- Congeler les échantillons de protéines dans de l’azote liquide et les conserver à -80 °C jusqu’à nouvelle utilisation.
ATTENTION : L’azote liquide doit être manipulé dans des endroits bien ventilés. Portez un équipement de protection individuelle approprié.
- Solubiliser les mitochondries purifiées de N. crassa (2 g de protéines) obtenues par sédimentation différentielle à partir d’environ 1,5 kg (poids humide) d’hyphes, selon Bausewein et coll.30, à une concentration protéique de 10 mg/mL dans 20 mM de Tris-HCl (pH 8,5), 1 % (p/v) de DDM, 20 % (v/v) de glycérol, 300 mM de NaCl, 20 mM d’imidazole et 1 mM de fluorure de phénylméthylsulfonyle (PMSF) pendant 30 min à 4 °C.
- Isolement de l’OmpF
- Récupérer la souche d’E. coli BE BL21(DE3) omp6, dépourvue de LamB et d’OmpC32, à partir d’un stock de glycérol congelé dans des conditions stériles, et la glisser sur une plaque de gélose Luria-Bertani (LB) (tableau 2). Pour ce faire, répartissez progressivement l’échantillon uniformément sur toute la plaque.
- Laisser tremper l’échantillon dans la gélose pendant 5 min, avant de retourner la plaque avec le couvercle fermé et d’incuber pendant la nuit à 37 °C.
- Sélectionner une seule colonie d’E. coli , inoculer 7,5 mL de milieu LB (tableau 2) avec cette seule colonie à l’aide d’un cure-dent stérile, et laisser pousser pendant la nuit (14 h) en agitant (170 tr/min) à 37 °C.
- Transférer 2 mL de cellules d’E. coli à l’aide de pipettes stériles dans 2 x 500 mL de milieu LB (tableau 2) et laisser pousser pendant la nuit (~14 h) à 37 °C en agitant (~170 tr/min) dans un agitateur.
- Récolter les cellules par centrifugation à 5 000 x g pendant 20 min à 4 °C, congeler la pastille dans de l’azote liquide et conserver à -80 °C jusqu’à nouvelle utilisation.
REMARQUE: Le poids humide de la pastille cellulaire est généralement de 5 g par 1 L de culture. À ce stade, le protocole peut être suspendu. - Décongeler et remettre en suspension les cellules (2 g) dans 20 mL de tampon de lyse C1 (tableau 2), et passer la suspension trois fois à 1 000 psi dans un système de rupture cellulaire haute pression prérefroidi (4 °C), avec un volume d’échantillon maximal de 35 mL, conformément aux instructions du fabricant.
ATTENTION : L’utilisation d’une presse française peut entraîner des blessures graves. Ne jamais dépasser la limite de pression de la cellule utilisée. Portez un équipement de protection individuelle approprié. - Retirer les cellules intactes du lysat par centrifugation à 4 000 x g pendant 15 min, et recueillir le surnageant.
- Recueillir les membranes par ultracentrifugation à 100 000 x g pendant 1 h.
- Remettez en suspension la pastille de membrane dans 10 mL de tampon C2 (tableau 2) et mélangez-la avec un volume égal de tampon SDS C3 (tableau 2) à l’aide d’un homogénéisateur en verre à roulement à billes.
ATTENTION : Le β-mercaptoéthanol contenu dans le tampon C3 est toxique. Suivez toutes les règles de sécurité pertinentes. - Incuber la suspension au bain-marie à 50 °C pendant 30 min.
- Centrifuger l’échantillon à 100 000 x g à 20 °C pendant 1 h.
- Resuspendre la pastille de membrane dans 10 mL de tampon SDS C4 (tableau 2) à l’aide d’un homogénéisateur en verre à roulement à billes, et incuber la suspension dans un bain-marie à 37 °C pendant 30 min.
REMARQUE : Si la pastille ne peut pas être remise en suspension, ajouter plus de tampon FDS C4 jusqu’à un volume de 20 mL. - Centrifuger l’échantillon à 100 000 x g à 20 °C pendant 30 min et prélever le surnageant.
- Mélanger le surnageant avec du polyoxyéthylène octyle (POE octyle) jusqu’à obtention d’une concentration finale de détergent de 0,5 % (p/v) et dialyser l’échantillon deux fois contre le tampon C5 (tableau 2) à 4 °C pendant 24 h. À cette fin, utilisez un tube de dialyse avec une coupure de 20 kDa, conformément aux instructions du fabricant, et placez l’échantillon dans le tube ou le dispositif de dialyse.
REMARQUE: La coupure de la tubulure de dialyse doit être ajustée si des protéines avec d’autres masses moléculaires sont dialysées. - Évaluer la pureté de l’échantillon à l’aide de la FDS-PAGE et déterminer la concentration en protéines à l’aide d’un dosage des protéines disponible dans le commerce, conformément au protocole du fabricant (Tableau des matériaux).
NOTE: Les échantillons chauffés à 95 °C montrent une OmpF monomère. Les échantillons non chauffés montrent l’OmpF sous sa forme trimérique (figure 1F). - Congeler l’OmpF dialysé dans des aliquotes dans de l’azote liquide et conserver à -20 °C jusqu’à nouvelle utilisation.
ATTENTION : L’azote liquide doit être manipulé dans des endroits bien ventilés. Portez un équipement de protection individuelle approprié.
2. Enregistrement optique monocanal des canaux ioniques dans les membranes DIB
NOTE: Cette section décrit la procédure de préparation des membranes DIB dans les chambres microfabriquées de polyméthacrylate de méthyle (PMMA)2 pour surveiller le mouvement latéral des protéines et le flux ionique à travers des canaux ioniques simples17. Les dimensions et les dessins exacts pour la fabrication de la chambre peuvent être trouvés dans Lepthin et al.2. La figure 2 donne un aperçu de l’assemblage de la chambre PMMA2 et de la formation des membranes DIB. Sauf indication contraire, toutes les étapes sont effectuées à température ambiante (RT). La figure 3 montre une représentation schématique d’une membrane DIB et comment le flux Ca2+ à travers une protéine à canal unique est utilisé pour surveiller à la fois le mouvement dans la membrane et l’état ouvert-fermé du canal.
- Préparation des lipides
- Retirer la solution mère lipidique contenant du 1,2-diphytanoyl-sn-glycéro-3-phosphocholine (25 mg/mL de DPhPC) dissoute dans le chloroforme du congélateur à -20 °C et la réchauffer à TA. Pour ce faire, il suffit généralement de réchauffer l’échantillon lentement à la main pendant quelques minutes.
ATTENTION : Le chloroforme est toxique. Porter un équipement de protection individuelle approprié et effectuer toutes les procédures impliquant du chloroforme sous une hotte. - Transférer 380 μL de solution mère de DPhPC (25 mg/mL de DPhPC) dans un flacon en verre. Évitez les pipettes munies de joints en caoutchouc. Utilisez plutôt des seringues en verre de microlitres avec des pistons en acier inoxydable.
- Après avoir manipulé la solution mère de lipides, superposer la solution mère de lipides avec du gaz Ar ou N2 pour empêcher l’oxydation des lipides. Utilisez le débit de gaz le plus faible possible pour éviter l’évaporation du solvant organique dans lequel les lipides sont dissous ou les éclaboussures des pulvérisations de solvant du flacon. Assurez-vous que les couvercles des flacons en verre contenant des lipides avec un solvant organique sont recouverts de polytétrafluoroéthylène (PTFE) à l’intérieur.
- Sécher l’échantillon lipidique (étape 2.1.2) sous un jet deN2 et retirer le solvant organique restant de l’échantillon lipidique pendant une nuit sous vide (2,0 mbar) à l’aide d’une pompe à vide sans huile.
- Dissoudre le film lipidique dans une solution d’huile hexadécane / silicone en ajoutant des volumes égaux d’hexadécane et d’huile de silicone (500 μL chacun) à l’aide d’une seringue en verre de microlitre à une concentration lipidique finale de 9,5 mg / mL.
REMARQUE: La solution lipidique est stable à RT pendant plusieurs semaines.
- Retirer la solution mère lipidique contenant du 1,2-diphytanoyl-sn-glycéro-3-phosphocholine (25 mg/mL de DPhPC) dissoute dans le chloroforme du congélateur à -20 °C et la réchauffer à TA. Pour ce faire, il suffit généralement de réchauffer l’échantillon lentement à la main pendant quelques minutes.
- Préparation de l’hydrogel d’agarose
- Préparer environ 1 mL de solution d’agarose à bas point de fusion (0,75 % [p/v]) dans de l’eau à double désionisation et chauffer à 85 °C dans un bloc chauffant pendant 20 minutes pour l’utiliser pour essorer les lamelles de verre de revêtement.
REMARQUE: La solution d’agarose peut être conservée à RT pendant plusieurs semaines et peut être réchauffée plusieurs fois. - Préparer une solution d’agarose à bas point de fusion à 2,5 % (p/v) dans 0,66 M CaCl 2 et 8,8 mM HEPES (pH7,2 ), et chauffer à 85 °C dans un bloc chauffant pendant 20 min. Assurez-vous que l’agarose est bien fondue.
NOTE: La solution d’agarose peut être conservée pendant plusieurs semaines à RT et peut être réchauffée plusieurs fois, tout comme l’agarose (étape 2.2.1) utilisée pour le revêtement par centrifugation.
- Préparer environ 1 mL de solution d’agarose à bas point de fusion (0,75 % [p/v]) dans de l’eau à double désionisation et chauffer à 85 °C dans un bloc chauffant pendant 20 minutes pour l’utiliser pour essorer les lamelles de verre de revêtement.
- Assemblage de chambre de polyméthacrylate de méthyle (PMMA) et formation de monocouche lipidique à l’interface hexadécane d’hydrogel/huile de silicone
- Placez des lamelles de verre (40 mm x 24 mm x 0,13 mm) dans un porte-lamelles en acier inoxydable et nettoyez-les dans un bécher en verre pendant 10 minutes avec de l’acétone dans un nettoyeur à ultrasons. Utilisez juste assez d’acétone pour immerger les lamelles de couverture et couvrez le bécher lâchement avec une plaque de verre pour créer un système fermé sans pression qui minimise la fuite de vapeurs pendant le processus de nettoyage.
ATTENTION : L’acétone est un solvant hautement inflammable avec un point d’éclair bas. Les mélanges vapeur/air sont explosifs. Utilisez le nettoyeur à ultrasons dans un endroit bien ventilé. Portez l’équipement de protection individuelle approprié et observez les mesures de sécurité officielles (p. ex., pas de flammes nues ni d’étincelles). - Rincer les lamelles de verre à l’eau doublement désionisée et les sécher sous un jet deN2.
REMARQUE: Les lamelles de couverture nettoyées de cette manière peuvent être stockées pendant plusieurs semaines. - Nettoyez et hydrophilissez ensuite une lamelle de couverture dans un nettoyant plasma avec de l’oxygène (0,5 mbar) pendant 5 min.
REMARQUE: Effectuez cette étape immédiatement avant le revêtement par centrifugation avec une solution d’agarose, car l’effet hydrophile du nettoyage au plasma s’estompe avec le temps. - Montez une lamelle de couverture traitée au plasma sur un enrobage (Figure 2, étape 1).
- Enduisez la lamelle de couverture d’une pellicule d’agarose d’une épaisseur inférieure au micromètre en ajoutant lentement 140 μL d’agarose chauffée à bas point de fusion à 0,75 % (p/v) (étape 2.2.1) à 3 000 tr/min pendant 30 s, à l’aide d’une pipette de 200 μL (figure 2, étape 1).
NOTE: L’épaisseur du film d’agarose peut être déterminée par microscopie à force atomique (AFM), comme décrit17. - Fixez immédiatement la lamelle de couverture enduite d’essorage avec la fine couche d’hydrogel d’agarose à la face inférieure de la chambre en PMMA2. Assurez-vous que l’hydrogel d’agarose pointe vers le haut (Figure 2, étape 2).
- Fixez les bords de la lamelle de couverture au dispositif micro-usiné en PMMA avec du ruban adhésif transparent.
- Placez le dispositif en PMMA sur une plaque chauffante chauffée à 35 °C (Figure 2, étape 3).
- Verser délicatement 200 μL de solution d’agarose à 2,5 % (étape 2.2.2) dans l’entrée de la chambre à l’aide d’une pipette (figure 2, étape 3), sans créer de bulles d’air afin que l’hydrogel mince appliqué par spin coating puisse s’équilibrer avec le tampon de la solution d’agarose à 2,5 % et rester hydraté. S’assurer que la solution d’agarose à 2,5 % est étalée autour de l’hydrogel d’agarose enduit d’essorage, mais pas dessus (figure 3A), ce qui peut être évité en appuyant doucement sur la chambre en PMMA sur la plaque chauffante.
- Couvrir immédiatement les puits de la chambre en PMMA (figure 2, étape 4) avec un total de 60 μL de solution lipidique/huile (étape 2.1.5), afin d’initier la formation de monocouche lipidique à l’interface agarose-huile et d’éviter la déshydratation de l’agarose enrobée de spin dans les puits de la chambre en PMMA. Conserver l’appareil sur une plaque chauffante à 35 °C pendant environ 2 h.
NOTE: Les puits circulaires dans la chambre en PMMA ont un diamètre de 0,5 mm et une profondeur de 1,8 mm, selon les travaux précédemment publiés2.
- Placez des lamelles de verre (40 mm x 24 mm x 0,13 mm) dans un porte-lamelles en acier inoxydable et nettoyez-les dans un bécher en verre pendant 10 minutes avec de l’acétone dans un nettoyeur à ultrasons. Utilisez juste assez d’acétone pour immerger les lamelles de couverture et couvrez le bécher lâchement avec une plaque de verre pour créer un système fermé sans pression qui minimise la fuite de vapeurs pendant le processus de nettoyage.
- Préparation de gouttelettes aqueuses enrobées de lipides dans une solution d’huile hexadécane/silicone
- Placer 20 μL de solution lipidique hexadécane/huile de silicone (étape 2.1.5) dans chacun des puits microfabriqués dans une chambre d’incubation de gouttelettes (figure 2, étape 4). Les récipients appropriés pour la solution d’huile lipidique hexadécane/silicone sont de petits renfoncements de 40 mm x 30 mm x 3,5 mm dans une plaque mince de PMMA2.
- Préparez une aiguille en verre microcapillaire d’un diamètre d’ouverture de pointe de 20 μm à l’aide d’un extracteur de micropipettes vertical ou horizontal (p. ex. utilisé pour fabriquer des pipettes patch ou des électrodes en verre tranchantes). Estimer le diamètre d’ouverture de l’aiguille de verre microcapillaire sous un stéréomicroscope binoculaire à faible grossissement, dans une plage de zoom comprise entre 7,5x et 35x.
NOTE: Les réglages du mode de préchauffage avant que le capillaire en verre ne soit tiré, le mode de chauffage pour tirer et la force de traction doivent être déterminés expérimentalement à l’avance, selon les spécifications du fabricant du dispositif de traction et du type de capillaire. - Remplir l’aiguille de verre microcapillaire avec 5 μL de solution d’injection aqueuse contenant 8,8 mM HEPES (pH 7,2), 7 μM Fluo-8, 400 μM EDTA, 1,32 M KCl et 30 nM TOM noyau complexe, ou bien 20 nM OmpF à l’aide d’une pointe de pipette microcapillaire. Utilisez uniquement de l’eau bidistillée préalablement traitée avec une résine chélatante qui lie les ions métalliques multivalents (Ca2+) pour préparer la solution d’injection aqueuse.
- Montez l’aiguille en verre microcapillaire avec la solution d’injection aqueuse sur un nanoinjecteur piézoélectrique.
- Injecter 100-200 nL de gouttelettes aqueuses (Figure 2, étape 4) contenant 8,8 mM HEPES (pH 7,2), 7 μM Fluo-8, 400 μM EDTA, 1,32 M KCl et 30 nM TOM core complex (étape 1.1.12), ou bien 20 nM OmpF (étape 1.2.16) dans les puits de la chambre d’incubation des gouttelettes remplie de solution lipidique d’hexadécane/huile de silicone (voir 2.1.5) à l’aide du nanoinjecteur. Assurez-vous que les gouttelettes ne se touchent pas en les plaçant à plusieurs millimètres (>10 mm) l’une de l’autre dans les puits. Sinon, si les monocouches lipidiques ne se sont pas encore formées à l’interface huile/tampon, elles fusionneront en gouttelettes plus grosses.
REMARQUE: Si aucun capillaire de classe et aucun nanoinjecteur ne sont disponibles, les gouttelettes peuvent également être préparées manuellement avec des pipettes microlitres à canal unique pour des volumes compris entre 0,1 μL et 0,5 μL, comme décrit2. Dans ce cas, cependant, les volumes de gouttelettes ne sont pas aussi précis. - Laisser se former une monocouche lipidique à l’interface gouttelettes/huile pendant environ 2 h en maintenant les chambres d’incubation en PMMA et gouttelettes (Figure 2, étape 4) sur une plaque chauffante chauffée à 35 °C.
- Préparation et imagerie de canaux ioniques simples dans des membranes DIB
- Transférer manuellement les gouttelettes aqueuses individuelles des puits de la chambre d’incubation des gouttelettes au stéréomicroscope dans les puits de la chambre en PMMA (Figure 2, étape 5), à l’aide d’une pipette microlitre à canal unique munie d’une pointe en polypropylène jetable de 10 μL. Laisser les gouttelettes couler sur les monocouches lipidiques formées aux interfaces hydrogel-huile pendant environ 5 minutes pour former une bicouche lipidique (Figure 3) entre les gouttelettes et l’hydrogel d’agarose.
- Montez la chambre en PMMA avec des membranes DIB sur le porte-échantillon d’un microscope à lumière inversée et évaluez la formation de la membrane à l’aide d’un objectif de contraste de modulation de Hoffman 10x (Figure 2, étape 6). La formation de la membrane DIB est indiquée par un anneau blanc clair à l’interface entre la gouttelette et l’hydrogel (figure 4A). Les membranes DIB qui ont été brisées ne montrent pas cet anneau (Figure 4B).
REMARQUE: Alternativement, les membranes DIB peuvent être visualisées à un grossissement de 10x par contraste de phase ou microscopie à contraste interférentiel différentiel (DIC). - Si des membranes DIB se sont formées, montez la chambre en PMMA sur le porte-échantillon d’un microscope TIRF (Figure 2, étape 7) équipé d’une source lumineuse conventionnelle pour l’éclairage par épifluorescence, d’un laser de 488 nm (Pmax = 100 mW) et d’une caméra CCD multi-électrons rétroéclairée (512 x 512 pixels; >95% QE) pour atteindre une taille de pixel de ~0,16 μm.
- Focalisez le bord d’une membrane DIB avec un objectif de grossissement de 10x sous un éclairage par épifluorescence avec une source lumineuse de haute intensité à l’aide d’un ensemble de filtres GFP.
- Focaliser finement le même bord de la membrane DIB à fort grossissement avec un objectif TIRF d’huile apochromatique 100x/N.A. 1.49, encore une fois sous éclairage par épifluorescence, avec la source lumineuse de haute intensité utilisant un ensemble de filtres GFP qui permet de visualiser la faible fluorescence de fond du colorant fluorescent Fluo-8 dans la gouttelette (Figure 4C).
- Remplacez le paramètre de filtre GFP par le jeu de filtres TIRF quadribandes.
- Allumez le laser 488 nm et réglez l’intensité du laser sur l’objectif sur une valeur comprise entre 8 mW et 10 mW.
REMARQUE: Comme il n’y a souvent pas d’informations quantitatives sur l’intensité laser à la lentille de l’objectif, les réglages d’intensité laser doivent être étalonnés au préalable dans des mesures séparées sur la lentille, avec un capteur de puissance laser optique équipé d’un capteur de photodiode, selon les spécifications du fabricant.
ATTENTION : Pour assurer un fonctionnement sûr du laser, l’opérateur doit être conscient des dangers possibles du rayonnement laser et des règlements de prévention des accidents. - Pour visualiser des canaux ioniques uniques, régler l’angle TIRF et le gain de la caméra EMCCD (par exemple, réglage du multiplicateur de gain EM : 285) de sorte que les canaux ioniques ouverts dans la membrane DIB apparaissent comme des taches fluorescentes à contraste élevé sur un fond sombre (figure 4D-G) et que le rapport signal/arrière-plan, lorsqu’il est inspecté visuellement, atteigne un maximum. Assurez-vous que les taches, correspondant au flux Ca2+ à travers des canaux ioniques simples, restent nettes et ont une forme ronde, avec une intensité élevée au centre et diminuant progressivement vers la périphérie. Les membranes sans canaux ne présentent qu’une fluorescence de fond (Figure 4C).
- Avant d’enregistrer le mouvement et l’activité ouverte-fermée des canaux individuels au fil du temps, vérifiez que les taches fluorescentes sont au point, pour s’assurer que les canaux ioniques se sont reconstitués dans les membranes DIB et se déplacent latéralement dans le plan de la membrane. Si ce n’est pas le cas, cela pourrait indiquer qu’une molécule fluorescente plonge dans et hors du champ évanescent généré par le laser près de la membrane.
- Enregistrez une série d’images membranaires qui permettent un suivi approprié de la position et une surveillance de l’état ouvert-fermé des canaux ioniques individuels. Pour déterminer le type de mobilité latérale (p. ex., mouvement libre vs ancrage transitoire [pour référence, voir16]) et l’état de l’activité du chenal (p. ex., ouvert ou fermé), acquérir des trajectoires suffisamment longues (p. ex., 30 s à 1 min) et bien échantillonnées (p. ex., fréquence d’images de 48 s-1).
NOTE: L’observation de la diffusion canalisée, restreinte ou houblonnée16 exige que la fréquence d’échantillonnage soit suffisamment rapide pour mesurer la diffusion sans restriction à l’intérieur des limites de confinement. De plus, s’assurer que le temps d’échantillonnage des données est suffisamment long pour mesurer la transition de la diffusion sans contrainte à la diffusion contrainte (pour plus de détails, voir Jacobson et al.16).
- Traitement des images et des données
REMARQUE: Les progiciels de traitement d’imagesopen source 33 ou les routines auto-écrites17 basées sur des progiciels commerciaux peuvent être utilisés pour analyser la dynamique spatio-temporelle de canaux ioniques individuels dans les DIB. Pour pouvoir corréler la mobilité de la membrane latérale avec le flux ionique à travers les canaux individuels, aucun algorithme de filtre ne doit être appliqué.- Corriger les séries chronologiques d’images pour le blanchiment en appliquant les procédures standard34 à l’aide de routines auto-écrites, en ajustant l’intensité
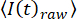 moyenne de l’image complète à
moyenne de l’image complète à 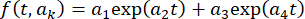 , où t est l’indice d’image (temps) et kest les paramètres d’ajustement. Ensuite, corrigez la série chronologique selon
, où t est l’indice d’image (temps) et kest les paramètres d’ajustement. Ensuite, corrigez la série chronologique selon 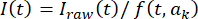 , où I(t) est l’intensité. Sinon, pour les analyses de données initiales, effectuez des corrections d’arrière-plan à l’aide d’un logiciel open source avec des algorithmes de bille roulanteimplémentés 33 et un rayon de boule roulante, en fonction du point et de la taille des pixels de la caméra (par exemple, 50 pixels).
, où I(t) est l’intensité. Sinon, pour les analyses de données initiales, effectuez des corrections d’arrière-plan à l’aide d’un logiciel open source avec des algorithmes de bille roulanteimplémentés 33 et un rayon de boule roulante, en fonction du point et de la taille des pixels de la caméra (par exemple, 50 pixels). - Déterminer les positions spatiales et les amplitudes d’un point de fluorescence dans une région d’intérêt (ROI) définie (par exemple, 30 x 30 pixels), en ajustant I(t) à un instant donné t à une fonction gaussienne bidimensionnelle avec inclinaison plane qui tient compte des gradients d’éclairage locaux possibles selon
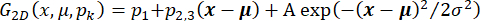 . Ici, x = (x, y) est le ROI avec les informations d’intensité de fluorescence, A et σ sont l’amplitude et les largeurs du gaussien, pk sont des paramètres qui caractérisent l’intensité de fond du ROI, et μ = (x 0, y 0) définit la position du Gaussien. Le flux ionique à travers un canal individuel est donné par le paramètre A. La trajectoire du canal est donnée par x, et permet de déterminer la mobilité latérale du canal. Alternativement, il est possible de déterminer les positions et les intensités des spots individuels à l’aide de plates-formes open source33 et de plug-ins comme décrit35,36. Estimer la précision de position37 après conversion de la lecture de la caméra EMCCD en nombres de photons38.
. Ici, x = (x, y) est le ROI avec les informations d’intensité de fluorescence, A et σ sont l’amplitude et les largeurs du gaussien, pk sont des paramètres qui caractérisent l’intensité de fond du ROI, et μ = (x 0, y 0) définit la position du Gaussien. Le flux ionique à travers un canal individuel est donné par le paramètre A. La trajectoire du canal est donnée par x, et permet de déterminer la mobilité latérale du canal. Alternativement, il est possible de déterminer les positions et les intensités des spots individuels à l’aide de plates-formes open source33 et de plug-ins comme décrit35,36. Estimer la précision de position37 après conversion de la lecture de la caméra EMCCD en nombres de photons38. - Tracer l’amplitude de fluorescence A en fonction du temps et la trajectoire x correspondante pour déterminer une corrélation possible entre la diffusivité du canal et le flux d’ions à travers le canal. Effectuez cette opération avec n’importe quel logiciel graphique. En cas de mouvement du canal latéral libre, déterminer le coefficient de diffusion latérale D par régression linéaire du délai τ, et calculer le déplacement carré moyen des taches de x selon
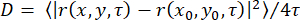 .
.
NOTE: Les coefficients de diffusion typiques17 pour TOM-CC et OmpF se déplaçant librement dans les membranes DIB vont entre 0,5 et 1,5 μm2 s-1. Les molécules dont la constante de diffusion est inférieure à 0,01 mm2·s-1 sont définies comme immobilisées17.
- Corriger les séries chronologiques d’images pour le blanchiment en appliquant les procédures standard34 à l’aide de routines auto-écrites, en ajustant l’intensité
Résultats
L’enregistrement optique monocanal sans électrode en temps réel révèle l’interaction entre le mouvement latéral des protéines et la fonction des canaux ioniques individuels dans les membranes DIB. La reconstitution du complexe mitochondrial TOM (Figure 1A) en membrane DIB (Figure 4D) illustre une forte corrélation temporelle entre la mobilité latérale et la perméabilité ionique (Figure 5A). Le point de contrôle TOM-CC semble être sensible au mode de mouvement latéral17. Les canaux mobiles montrent un flux Ca2+ à travers leurs pores et des intensités de point de fluorescence élevées. Les molécules piégées et immobiles présentent des intensités de fluorescence faibles et moyennes. Pour le pore général d’importation de protéines des mitochondries TOM-CC, cette approche à molécule unique a révélé une forte corrélation temporelle entre la mobilité latérale et la perméabilité ionique, suggérant que le canal TOM-CC a des propriétés mécanosensibles17. Un arrêt latéral des molécules TOM-CC en mouvement libre s’accompagne d’une fermeture partielle ou complète du canal TOM-CC. L’imagerie des membranes DIB avec OmpF (Figure 1E et Figure 4F), qui est presque entièrement intégrée dans la membrane, ne montre aucun effet stop-and-go (Figure 5B). Les arrêts aléatoires d’OmpF ne sont pas associés à un changement d’intensité et, par conséquent, à la fermeture de ses pores. Sur la base des signaux de fluorescence38, la précision de position des canaux individuels peut être estimée dans la plage comprise entre 5 et 10 nm. Cependant, il convient de noter que cette précision ne peut être atteinte si les canaux vacillent légèrement en raison de l’ancrage mobile avec l’hydrogel d’agarose, comme le montre, par exemple, les molécules TOM-CC à l’état intermédiaire avec un déplacement moyen racinaire de 120 nm (Figure 5A).
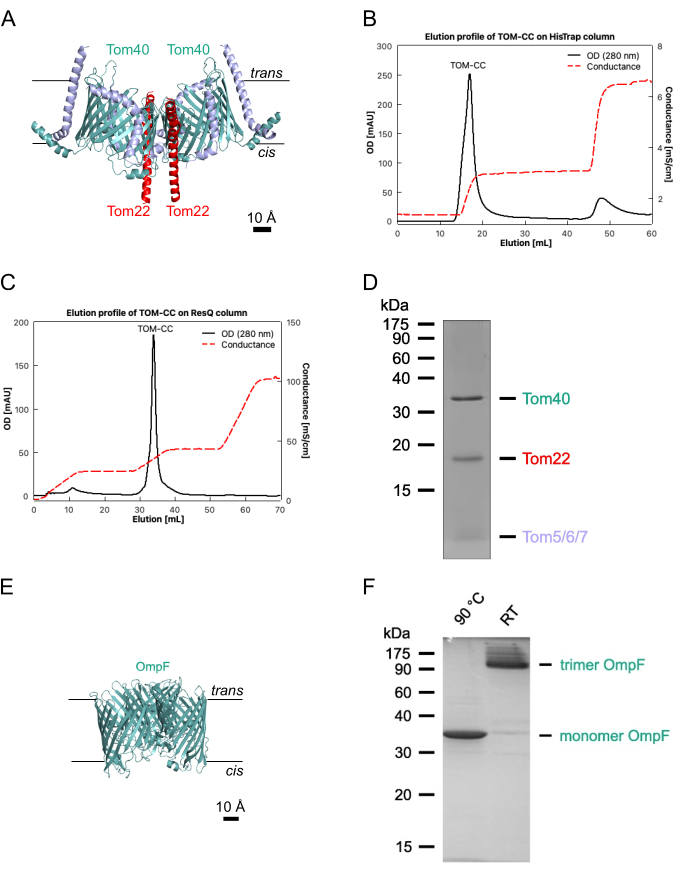
Figure 1 : Isolation de TOM-CC. (A) Structure Cryo EM de N. crassa TOM-CC30,39. Les mitochondries d’une souche de N. crassa contenant un Tom22 avec une étiquette 6xHis ont été solubilisées dans DDM et soumises à une chromatographie d’affinité Ni-NTA (B) et à une chromatographie par échange d’anions (C). (D) FDS-PAGE du TOM-CC isolé. (E) Structure cristalline (PDB, 1OPF) et (F) FDS-PAGE d’E. coli OmpF purifié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
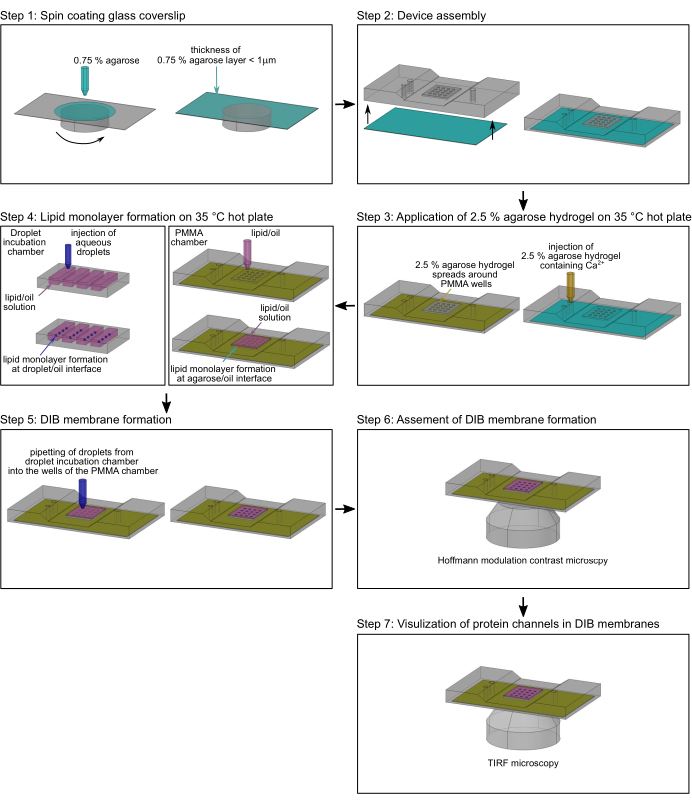
Figure 2 : Organigramme de l’assemblage de la chambre en PMMA. Étape 1: Une lamelle de couverture en verre est recouverte d’un hydrogel d’agarose. Étape 2: Le couvercle enduit d’essorage est monté dans une chambre de microscopie en PMMA sur mesure. Étape 3: De l’agarose supplémentaire à bas point de fusion est ajoutée dans l’orifice d’entrée de la chambre en PMMA sur une plaque chauffante à 35 °C. Étape 4 : Les monocouches lipidiques sont formées autour de gouttelettes aqueuses à l’interface tampon/huile (à gauche) et à l’interface agarose hydrogel/huile (à droite). Étape 5: Des gouttelettes aqueuses individuelles sont pipetées dans les puits de la chambre en PMMA pour former une bicouche lipidique au contact des deux monocouches lipidiques. Étape 6 : La formation des membranes DIB est validée par microscopie à contraste de modulation de Hofmann. Étape 7 : Les images de zones sélectionnées des membranes DIB avec des canaux ioniques insérés sont acquises par microscopie TIRF. Vert : agarose à 0,75 %; jaune : agarose à 2,5 % contenant des ions Ca2+ ; magenta: phase lipidique / huileuse; bleu foncé : tampon aqueux de gouttelettes contenant un colorant et des protéines sensibles au Ca2+. Veuillez cliquer ici pour voir une version agrandie de cette figure.
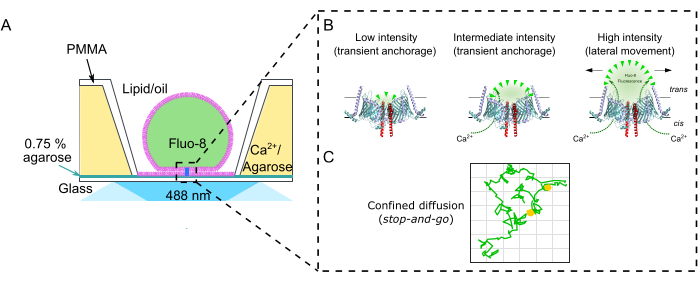
Figure 3 : Installation expérimentale. (A) Représentation schématique d’une membrane DIB dans un puits en PMMA. La bicouche repose sur un film d’agarose ultramince à 0,75 % pour permettre l’imagerie TIRF du flux Ca 2+ à travers un canal ionique au fil du temps à l’aide d’un colorant de fluorescence sensible au Ca2+ (Fluo-8) en trans. (B) Le flux Ca2+ est contrôlé exclusivement par la pression osmotique de cis à trans. Cela permet à la fois de déterminer la position dans la membrane et l’état ouvert-fermé du canal. Le canal montré ici est le canal conducteur de protéines TOM-CC de N. crassa mitochondria30. (C) Trajectoire d’un seul canal TOM-CC. Vert : canal mobile; jaune : canal immobile. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Imagerie TOM-CC et OmpF dans les membranes DIB. (A) Membrane DIB imagée par microscopie de contraste à modulation Hoffmann montrant la zone de contact bicouche entre l’hydrogel et la gouttelette. (B) Membrane DIB brisée imagée comme en (A). Flèche, bord de la chambre en PMMA. (C) Membrane DIB imagée par microscopie TIRF sans canaux protéiques. (D) Membrane DIB avec TOM-CC reconstitué, imagée par microscopie TIRF. Les carrés blancs marquent les taches d’intensité élevée (SH), intermédiaire (SI) et faible (SL). (E) L’ajustement du profil d’intensité de fluorescence des trois taches marquées en (A) aux fonctions gaussiennes bidimensionnelles révèle la position des TOM-CC individuels et le flux Ca2+ à travers le canal. F) Membrane DIB avec OmpF reconstitué. (G) Ajustement gaussien de la tache fluorescente marquée en (F). Contrairement au complexe protéique à deux pores à β barils TOM-CC, l’OmpF à β barils à trois pores ne révèle qu’un seul état de perméabilité. Taille des pixels, 0,16 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : L’activité du canal est en corrélation avec la mobilité latérale du TOM-CC. (A) La trace d’amplitude fluorescente (en haut) et la trajectoire correspondante (en bas) de TOM-CC indiquent que l’activité du canal ouvert-fermé de TOM-CC est en corrélation avec la mobilité de la membrane latérale du complexe. La trajectoire affiche trois états de perméabilité. Vert : état entièrement ouvert ; jaune: état de perméabilité intermédiaire; rouge : état du canal fermé ; étoile rouge: TOM-CC à l’état intermédiaire oscille autour de sa position moyenne d’environ ±60 nm. Les précisions de position37 basées sur les signaux de fluorescence dans les états complètement ouverts et intermédiaires vont entre 5 nm et 10 nm. (B) Trace d’amplitude fluorescente (en haut) et trajectoire correspondante (en bas) de l’OmpF. L’OmpF ne révèle qu’un seul niveau d’intensité, qu’il soit en mouvement ou piégé. Les segments de trajectoire correspondant aux périodes de temps des molécules piégées sont marqués en gris. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Tampon | Concentrations de réactifs | Volume | ||
| A1* | 20 mM Tris-HCl pH 8,5, 0,1 % (p/v) de n-dodécyl-β-D-maltoside (DDM), 10 % (v/v) de glycérol, 300 mM de NaCl et 1 mM de fluorure de phénylméthylsulfonyle (PMSF) | 100 mL | ||
| A2* | 20 mM Tris-HCl pH 8,5, 0,1 % (p/v) DDM, 10 % (v/v) glycérol, 1 M d’imidazole et 1 mM de PMSF | 100 mL | ||
| B1* | 20 mM HEPES pH 7,2, 0,1 % (p/v) DDM, 2 % (v/v) diméthylsulfoxyde (DMSO) | 100 mL | ||
| B2* | 20 mM HEPES pH 7,2, 0,1 % (p/v) DDM, 1 M KCl, 2 % (v/v) diméthylsulfoxyde (DMSO) | 100 mL | ||
| * Dégazer et passer à travers un filtre de 0,22 μm avant utilisation. | ||||
Tableau 1 : Solutions tampons pour l’isolation TOM-CC.
| Tampon | Concentrations de réactifs | Volume | ||
| LB* | 1 % (p/v) tryptone, 1 % (p/v) NaCl et 0,5 % (p/v) extrait de levure | 1100 mL | ||
| C1 | 2 mM MgCl2, et ~750 unités DNAse et 50 mM Tris-HCl pH 7,5 | 20 mL | ||
| C2 | 50 mM Tris-HCl, pH 7,5 | 50 mL | ||
| C3 | 4 % (p/v) de dodécylsulfate de sodium (SDS), 2 mM β-mercaptoéthanol et 50 mM Tris-HCl pH 7,5 | 50 mL | ||
| C4 | 2 % (p/v) SDS, 500 mM NaCl et 50 mM Tris-HCl pH 7,5 | 50 mL | ||
| C5 | 0,5 % (p/v) de polyoxyéthylène octyle (POE octyle), 1 mM EDTA et 20 mM Tris pH 8,5 | 1000 mL | ||
| * Stériliser avant utilisation. | ||||
Tableau 2 : Solutions tampons pour l’isolation OmpF.
Discussion
Le protocole présenté ici fournit une introduction à l’utilisation des membranes DIB pour étudier l’interaction entre le mouvement du canal ionique latéral et la fonction du canal à l’aide de la microscopie TIRF à molécule unique. Pour obtenir les meilleures données possibles, la préparation de membranes DIB stables avec autant de canaux bien séparés que possible est cruciale pour obtenir des séries temporelles de particules individuelles, qui peuvent être analysées de manière satisfaisante.
Les paramètres critiques à optimiser comprennent le choix des lipides, la concentration en lipides dans la phase huileuse et les concentrations en protéines et en détergents dans les gouttelettes aqueuses. Les lipides employés sont inhabituels, en ce sens qu’ils ne montrent pas de transition de phase claire à basse température. Le DPhPC est un lipide couramment utilisé pour produire des systèmes membranaires stables40. En principe, tout lipide qui maintient son environnement fluide à basse température peut convenir à cette application. De plus, le lipide ne doit pas être sensible à l’oxydation. La concentration de détergent dans les gouttelettes doit être aussi faible que possible pour éviter la rupture de la membrane. Des membranes stables et de bons taux d’incorporation des protéines sont généralement obtenus avec des concentrations de détergent inférieures à la concentration micellaire critique (cmc), étant donné que la protéine membranaire ne précipite pas.
Si les membranes DIB ne tolèrent pas les détergents spécifiques21,41, ou si les protéines ne s’intègrent pas à partir d’une solution de faible détergent dans les membranes DIB, les canaux protéiques peuvent d’abord être reconstitués en petites vésicules lipidiques unilamellaires (SUV), qui sont ensuite fusionnées aux membranes DIB du côté gouttelettes, comme cela a été démontré avec succès pour E. coli MscL 42 . Parfois, les membranes DIB ne se forment pas parce que la concentration de lipides dans la phase huileuse est trop faible. Pour éviter l’éclatement des membranes DIB, il faut également savoir que la pression osmotique entre l’hydrogel et la gouttelette doit être équilibrée avec précision sans affecter excessivement le flux Ca2+ de cis à trans. L’optimisation de l’épaisseur de l’agarose et de la taille des mailles semble cruciale pour observer la diffusion des protéines membranaires. Tout séchage de la couche d’agarose doit être évité. L’épaisseur peut être déterminée par microscopie à force atomique17. En faisant varier la concentration, le volume et la vitesse de rotation de l’agarose pendant le revêtement par essorage, la taille et l’épaisseur du maillage de l’hydrogel peuvent être optimisées. Notez cependant que l’épaisseur de la couche d’hydrogel affecte le contraste de l’image. Pour capturer les protéines membranaires dans les DIB, l’hydrogel d’agarose peut être remplacé par de l’agarose synthétisée sur mesure, non réticulée, modifiée par Ni-NTA et à bas point de fusion pour les piéger via un His-tag17. Un fond de fluorescence excessivement élevé est souvent causé par la rupture des membranes DIB. C’est particulièrement un problème avec les chambres multi-puits, car le colorant sensible au Ca2+ diffuse dans l’hydrogel. Dans ce cas, les puits adjacents doivent être évités. Le blanchiment par fluorescence du colorant sensible au Ca2+ au-dessus de la membrane ne devrait pas être un facteur limitant important, car il est échangé par des colorants non excités dans la majeure partie de la gouttelette (figure 3A) à l’extérieur du champ évanescent TIRF. La précision de localisation de la protéine est donnée par la précision de l’ajustement des taches et de la taille des pixels.
Les signaux de fluorescence faibles peuvent être causés par un faible flux de Ca2+ à travers le canal. Les raisons possibles incluent: (i) des réglages TIRF inexacts (par exemple, intensité laser), (ii) la pression osmotique Ca 2+ à travers la membrane, ou (iii) la perméabilité intrinsèque Ca2+ des canaux est trop faible. Pour faire face au premier problème, l’intensité laser, l’angle TIRF et le gain de la caméra doivent être optimisés. Ces deux derniers problèmes peuvent être surmontés par l’application d’un potentiel électrique à travers la membrane 2,43. Cependant, l’application de tensions externes peut fausser le résultat, car les effets électriques peuvent influencer l’ouverture du canal des canaux ioniques dépendants du ligand ou mécanosensibles qui ne sont en réalité pas contrôlés par la tension. Des exemples de tels canaux sont la protéine mitochondriale translocase TOM-CC27, et sa sous-unité formant des canaux Tom40 26,44,45,46. Enfin, il convient de noter que l’insertion de protéines membranaires dans les membranes DIB dans une orientation spécifique pour atteindre une fonctionnalité souhaitée est délicate, et les études quantitatives sont rares47,48. Dans certains cas, l’orientation des protéines intégrées est aléatoire. C’est un problème sérieux pour l’étude des protéines membranaires, car certaines protéines membranaires ne sont activées que d’un seul côté de la membrane.
La microscopie TIRF est une méthode puissante pour traiter les événements monomoléculaires dans les membranes supportées planaires49. Les exemples incluent l’élucidation par voie d’assemblage et de repliement de protéines de canal telles que la α-hémolysine50, la perfringolysine O 51 et l’OmpG52. Ces études incluaient FRET comme technique supplémentaire. De plus, l’activation du canal ionique mécanosensible MscL a déjà été étudiée par stimulation mécanique des bicouches DIBsupportées 42 à l’aide de mesures de courant. Sur la base de ces travaux, des études futures pourraient combiner la plate-forme décrite ici avec des expériences FRET à molécule unique pour traiter les canaux mécanosensibles au niveau de la molécule unique de manière optique17. L’injection de tampon dans la gouttelette, l’étirement de la monocouche DIB interne ou la liaison ciblée de canaux individuels à l’hydrogel sous-jacent peuvent être utilisés pour étudier plus avant non seulement le mécanisme physique des canaux activés mécaniquement, qui répondent à la tension et/ou à la courbure de la membrane, comme indiqué pour MscL et MscS, les canaux K+ à deux pores, TREK-1, TREK-2, et TRAAK, et PIEZO (pour examen, voir53), mais aussi la liaison locale au cytosquelette cellulaire, comme le montre le canal ionique tactile NOMPC54,55.
Déclarations de divulgation
Nous ne déclarons aucun conflit d’intérêts.
Remerciements
Nous remercions Beate Nitschke pour son aide dans la préparation des protéines et Robin Ghosh, Michael Schweikert (Stuttgart) et Maximilan Ulbrich (Fribourg) pour leurs discussions perspicaces. Ce travail a été soutenu par le Centre de recherche de Stuttgart Systems Biology (SRCSB) et une subvention de la Fondation du Bade-Wurtemberg (BiofMO-6 to SN).
matériels
| Name | Company | Catalog Number | Comments |
| 1,2-diphytanoyl-sn-glycero-3-phosphocholine | Avanti Polar Lipids | 850356C | |
| 100x Oil objective Apochromat N.A. 1.49 | Nikon | MRD01991 | TIRF microscope |
| 10x Hoffmann modulation contrast objective NA 0.25 | Nikon | Microscope to assess DIB membrane formation | |
| 10x objective N.A. 0.25 | Nikon | MRL00102 | TIRF microscope |
| 40x Hoffmann modulation contrast objective NA 0.55 | Nikon | Microscope to assess DIB membrane formation | |
| 488 nm laser, 100 mW | Visitron | TIRF microscope | |
| Adhesive tape | |||
| Äkta pure | Cytiva | Protein purification system | |
| Bradford assay kit, Pierce | Thermo Fisher | 23236 | |
| CaCl2 | Roth | 5239.2 | |
| Chelax 100 resin | Biorad | 143-2832 | |
| Chloroform | Sigma-Aldrich | MC1024452500 | |
| Dialysis cassettes Slide-A-Lyzer 20 k MWCO | Thermo Fisher | 87735 | |
| DIB chamber | Custom made | PMMA chamber for DIB membranes | |
| Digital power meter and energy console | Thorlabs | PM100D | Laser power meter |
| Dimethyl sulfoxide | Roth | 4720.1 | |
| Double distilled H2O | |||
| Eclipse TS 100 Hoffmann modulation contrast microscope | Nikon | Microscope to assess DIB membrane formation | |
| EDTA | Roth | 8042.2 | |
| EMCCD camera iXon Ultra 897 | Andor | TIRF microscope | |
| Ethanol | Sigma-Aldrich | 32205-M | |
| Fixed angle rotor Ti70 | Beckman Coulter | ||
| Fluo-8, CalciFluorTM | Santa Cruz Biotechnology | SC-362561 | Ca2+-sensitive dye |
| French press cell disruption homogenizer | Igneus | Igneus 40000 psi | |
| GFP filter | AHF | Filter seeting used for excitation of DIB-membranes by epifluorescence with white light source | |
| Glass capillaries | World Precision Instruments | 4878 | |
| Glass coverslips 40 mm x 24 mm x 0.13 mm | Roth | 1870.2 | |
| Glycerol | Roth | 3783.2 | |
| Hamilton syringe 10 mL | Roth | X033.1 | |
| Hamilton syringe 100 mL | Roth | X049.1 | |
| Hamilton syringe 500 mL | Roth | EY49.1 | |
| Heating block | Eppendorf | Thermomixer comfort | |
| Heating plate | Minitube | HT200 | |
| Hepes | Roth | 9205.3 | |
| Hexadcane | Sigma-Aldrich | 296317 | |
| His Trap HP 1 mL | Cytiva | 29051021 | Ni-NTA column |
| Imidazole | Sigma-Aldrich | 1.04716.1000 | |
| KCl | Honeywell | 10314243 | |
| KLM spin coater | Schaefer Tec | SCV-10 | |
| List medical L/M-3P-A vertical pipette puller | Artisan Technology Group | 57761-1 | |
| Low melting point agarose | Sigma-Aldrich | A9414 | |
| M8 Stereomicroscope | Wild | Stereomicrosope | |
| Matlab | MathWorks | R2022a | |
| Methanol | Sigma-Aldrich | 34860 | |
| MicroFil pipette tips | World Precision Instruments | MF34G-5 | |
| N2 gas | |||
| NaCl | Roth | 3957.1 | |
| Nanoliter 2010 injector | World Precision Instruments | Nanoliter 2010 | |
| n-dodecyl-b-D-maltoside | Glycon Biochemicals | D97002-C | |
| Ni-NTA agarose, non-crosslinked | Cube Biotech | 124115393 | Custom made |
| NIS-Elements AR software | Nikon | MQS31100/MQS42560/MQS42580/MQS42780/MQS41930 | Imaging software |
| n-octyl-polyoxyethylene | Sigma-Aldrich | 40530 | |
| O2 gas | |||
| Phenylmethylsulfonyl fluoride | Roth | 6367.3 | |
| Photodiode sensor Si, 400 - 1100 nm, 500 mW | Thorlabs | S130C | Sensor for laser power meter |
| Plasma cleaner | Diener Electronics | Zepto | |
| Preparative ultracentrifuge Optima | Beckman Coulter | ||
| Quad-band TIRF-filter 446/523/600/677 HC | AHF | Filter setting used for excitation of DIB-membranes with 488 nm laser | |
| Resource Q 1 mL | Cytiva | 17117701 | Anion exchange column |
| Silicon oil AR 20 | Sigma-Aldrich | 10836 | |
| Sodium dodecyl sulfate | Roth | 2326.2 | |
| Super LoLux camera | JVC | Stereomicrosope | |
| Thermoshaker | Gerhardt | THL 500/1 | |
| Ti-E Fluorescence microscope | Nikon | MEA53100 | |
| Tris-HCl | Sigma-Aldrich | 9090.3 | |
| Tryptone | Roth | 8952.2 | |
| Ultrasonic bath | Bandelin Sonorex | RK 100 | |
| Vaccum pump | Vacuubrand | MD 4C NT | |
| White light source for epifluorescence illumination (100 W) | Nikon | MBF72655 | TIRF microscope |
| Yeast extract | Roth | 2363.2 | |
| β-mercaptoethanol | Sigma-Aldrich | M3148 |
Références
- Tanaka, M., Sackmann, E. Polymer-supported membranes as models of the cell surface. Nature. 437 (7059), 656-663 (2005).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Thompson, J. R., Heron, A. J., Santoso, Y., Wallace, M. I. Enhanced stability and fluidity in droplet on hydrogel bilayers for measuring membrane protein diffusion. Nano Letters. 7 (12), 3875-3878 (2007).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34 (1), 351-378 (2005).
- Qian, H., Sheetz, M. P., Elson, E. L. Single particle tracking. Analysis of diffusion and flow in two-dimensional systems. Biophysical Journal. 60 (4), 910-921 (1991).
- Kusumi, A., Shirai, Y. M., Koyama-Honda, I., Suzuki, K. G. N., Fujiwara, T. K. Hierarchical organization of the plasma membrane: Investigations by single-molecule tracking vs. fluorescence correlation spectroscopy. FEBS Letters. 584 (9), 1814-1823 (2010).
- Betaneli, V., Schwille, P. Fluorescence correlation spectroscopy to examine protein-lipid interactions in membranes. Methods in Molecular Biology. 974, 253-278 (2013).
- Ando, T., et al. A high-speed atomic force microscope for studying biological macromolecules. Proceedings of the National Academy of Sciences. 98 (22), 12468-12472 (2001).
- Casuso, I., et al. Characterization of the motion of membrane proteins using high-speed atomic force microscopy. Nature Nanotechnology. 7 (8), 525-529 (2012).
- Karner, A., et al. Tuning membrane protein mobility by confinement into nanodomains. Nature Nanotechnology. 12 (3), 260-266 (2017).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118 (6), 1099-1102 (2005).
- Schink, K. O., Tan, K. -. W., Stenmark, H. Phosphoinositides in control of membrane dynamics. Annual Review of Cell and Developmental Biology. 32 (1), 143-171 (2016).
- Schafer, D. A. Coupling actin dynamics and membrane dynamics during endocytosis. Current Opinion in Cell Biology. 14 (1), 76-81 (2002).
- Lingwood, D., Ries, J., Schwille, P., Simons, K. Plasma membranes are poised for activation of raft phase coalescence at physiological temperature. Proceedings of the National Academy of Sciences. 105 (29), 10005-10010 (2008).
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Jacobson, K., Liu, P., Lagerholm, B. C. The lateral organization and mobility of plasma membrane components. Cell. 177 (4), 806-819 (2019).
- Wang, S., et al. Spatiotemporal stop-and-go dynamics of the mitochondrial TOM core complex correlates with channel activity. Communications Biology. 5 (1), 471 (2022).
- Ide, T., Yanagida, T. An artificial lipid bilayer formed on an agarose-coated glass for simultaneous electrical and optical measurement of single ion channels. Biochemical and Biophysical Research Communications. 265 (2), 595-599 (1999).
- Funakoshi, K., Suzuki, H., Takeuchi, S. Lipid bilayer formation by contacting monolayers in a microfluidic device for membrane protein analysis. Analytical Chemistry. 78 (24), 8169-8174 (2006).
- Heron, A. J., Thompson, J. R., Mason, A. E., Wallace, M. I. Direct detection of membrane channels from gels using water-in-oil droplet bilayers. Journal of the American Chemical Society. 129 (51), 16042-16047 (2007).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Huang, S., Romero-Ruiz, M., Castell, O. K., Bayley, H., Wallace, M. I. High-throughput optical sensing of nucleic acids in a nanopore array. Nature Nanotechnology. 10 (11), 986-991 (2015).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271 (5245), 43-48 (1996).
- Kiessling, V., Yang, S. -. T., Tamm, L. K. Supported lipid bilayers as models for studying membrane domains. Current Topics in Membranes. 75, 1-23 (2015).
- Murray, D. H., Tamm, L. K., Kiessling, V. Supported double membranes. Journal of Structural Biology. 168 (1), 183-189 (2009).
- Hill, K., et al. Tom40 forms the hydrophilic channel of the mitochondrial import pore for preproteins. Nature. 395 (6701), 516-521 (1998).
- Poynor, M., Eckert, R., Nussberger, S. Dynamics of the preprotein translocation channel of the outer membrane of mitochondria. Biophysical Journal. 95 (3), 1511-1522 (2008).
- Künkele, K. P., et al. The preprotein translocation channel of the outer membrane of mitochondria. Cell. 93 (6), 1009-1019 (1998).
- Ahting, U., et al. The TOM core complex: the general protein import pore of the outer membrane of mitochondria. The Journal of Cell Biology. 147 (5), 959-968 (1999).
- Bausewein, T., et al. Cryo-EM structure of the TOM core complex from Neurospora crassa. Cell. 170 (4), 693-700 (2017).
- Cowan, S. W., et al. Crystal structures explain functional properties of two E. coli porins. Nature. 358 (6389), 727-733 (1992).
- Bieligmeyer, M., et al. Reconstitution of the membrane protein OmpF into biomimetic block copolymer-phospholipid hybrid membranes. Beilstein Journal of Nanotechnology. 7, 881-892 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Vicente, N. B., Zamboni, J. E. D., Adur, J. F., Paravani, E. V., Casco, V. H. Photobleaching correction in fluorescence microscopy images. Journal of Physics: Conference Series. 90 (1), 012068 (2007).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Ershov, D., et al. TrackMate 7: integrating state-of-the-art segmentation algorithms into tracking pipelines. Nature Methods. 19 (7), 829-832 (2022).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Hirsch, M., Wareham, R. J., Martin-Fernandez, M. L., Hobson, M. P., Rolfe, D. J. A stochastic model for electron multiplication charge-coupled devices - From theory to practice. PLoS One. 8 (1), 53671 (2013).
- Bausewein, T., Naveed, H., Liang, J., Nussberger, S. The structure of the TOM core complex in the mitochondrial outer membrane. Biological Chemistry. 401 (6-7), 687-697 (2020).
- Lindsey, H., Petersen, N. O., Chan, S. I. Physicochemical characterization of 1,2-diphytanoyl-sn-glycero-3-phosphocholine in model membrane systems. Biochimica et Biophysica Acta. 555 (1), 147-167 (1979).
- Manafirad, A. Single ion-channel analysis in droplet interface bilayer. Methods in Molecular Biology. 2186, 187-195 (2021).
- Rosholm, K. R., et al. Activation of the mechanosensitive ion channel MscL by mechanical stimulation of supported Droplet-Hydrogel bilayers. Scientific Reports. 7 (1), 45180 (2017).
- Wang, Y., et al. Electrode-free nanopore sensing by DiffusiOptoPhysiology. Science Advances. 5 (9), (2019).
- Ahting, U., et al. the pore-forming component of the protein-conducting TOM channel in the outer membrane of mitochondria. The Journal of Cell Biology. 153 (6), 1151-1160 (2001).
- Romero-Ruiz, M., Mahendran, K. R., Eckert, R., Winterhalter, M., Nussberger, S. Interactions of mitochondrial presequence peptides with the mitochondrial outer membrane preprotein translocase TOM. Biophysical Journal. 99 (3), 774-781 (2010).
- Kuszak, A. J., et al. Evidence of distinct channel conformations and substrate binding affinities for the mitochondrial outer membrane protein translocase pore Tom40. The Journal of Biological Chemistry. 290 (43), 26204-26217 (2015).
- Yanagisawa, M., Iwamoto, M., Kato, A., Yoshikawa, K., Oiki, S. Oriented reconstitution of a membrane protein in a giant unilamellar vesicle: Experimental verification with the potassium channel KcsA. Journal of the American Chemical Society. 133 (30), 11774-11779 (2011).
- Goers, R., et al. Optimized reconstitution of membrane proteins into synthetic membranes. Communications Chemistry. 1, 35 (2018).
- Castell, O. K., Dijkman, P. M., Wiseman, D. N., Goddard, A. D. Single molecule fluorescence for membrane proteins. Methods. 147, 221-228 (2018).
- Thompson, J. R., Cronin, B., Bayley, H., Wallace, M. I. Rapid assembly of a multimeric membrane protein pore. Biophysical Journal. 101 (11), 2679-2683 (2011).
- Senior, M. J. T., et al. Single-molecule tracking of perfringolysin O assembly and membrane insertion uncoupling. The FEBS Journal. , (2022).
- Weatherill, E. E., et al. Fast slow folding of an outer membrane porin. Proceedings of the National Academy of Sciences. 119 (20), 2121487119 (2022).
- Kefauver, J. M., Ward, A. B., Patapoutian, A. Discoveries in structure and physiology of mechanically activated ion channels. Nature. 587 (7835), 567-576 (2020).
- Yan, Z., et al. Drosophila NOMPC is a mechanotransduction channel subunit for gentle-touch sensation. Nature. 493 (7431), 221-225 (2013).
- Wang, Y., et al. The push-to-open mechanism of the tethered mechanosensitive ion channel NompC. eLife. 10, 58388 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon