Method Article
قابلية النقل القابلة للتطوير لبروتوبلاستات ميزوفيل الذرة
In This Article
Summary
هنا ، نقدم بروتوكولا عالي الإنتاجية لنقل ملايين بروتوبلاستات الذرة بشكل عابر لاختبار مكتبات كبيرة من البلازميدات في خلايا ميزوفيل الذرة.
Abstract
غالبا ما يتضمن نقل خلايا ميزوفيل الذرة هضم الجدران الخلوية للنبات لتكوين البروتوبلاستات ثم إدخال الحمض النووي عن طريق التثقيب الكهربائي أو البولي إيثيلين جلايكول (PEG). تم تطوير الطرق السابقة لإنتاج عشرات الآلاف من البروتوبلاستيدات المنقولة في وقت واحد. هنا ، نصف طريقة مباشرة لعزل ونقل الملايين من بروتوبلاستات الميزوفيل الورقية في الذرة (Zea mays L.). تزيل هذه العملية المبسطة بعض الخطوات الأولية الشائعة ، مثل الغسيل في W5. بالإضافة إلى ذلك ، تم تعديل خطوات مثل الطرد المركزي ، والنقل بوساطة PEG ، والحضانة للعمل مع عدد أكبر من البروتوبلاستات. تتيح القدرة على التعبير عن مكتبات كبيرة من تركيبات البلازميد إجراء تجارب على نطاق الجينوم ، مثل مقايسات المراسل المتوازية على نطاق واسع في الذرة.
Introduction
التعبير الجيني العابر هو أداة قوية في بيولوجيا النبات. لكن من الصعب نقل الخلايا النباتية؛ لأنها محاطة بجدار خلوي. هذا الحاجز أمام دخول الحمض النووي غير موجود في أنواع الخلايا الأخرى التي تمت دراستها بشكل شائع مثل خلايا الثدييات أو الحشرات. عالجت الأبحاث السابقة هذا التحدي من خلال استخدام البروتوبلاست: الخلايا النباتية التي تم هضم جدرانها الخلوية وإزالتها. على عكس أنسجة الأوراق غير المعالجة ، من السهل التعامل مع البروتوبلاستيدات النباتية في التعليق وقابلة لتقنيات النقل بوساطة التثقيب الكهربائي أو البولي إيثيلين جلايكول (PEG) 1. تحتفظ الخلايا النباتية بالكثير من وظائفها حتى بعد إزالة الجدار الخلوي. وبالتالي ، يتم استخدام البروتوبلاستيدات في مجموعة متنوعة من النباتات لدراسة وظيفة الجينات والبروتين 2,3 ، لفهم نقل الإشارة4 ، وتحديد الأهداف المحتملة لتربية النباتات5. البروتوبلاست هي أيضا وسيلة ملائمة لفحص تركيبات تحرير الجينوم في أنواع المحاصيل المتنوعة بما في ذلك القمح والبطاطس 6,7. باختصار ، لا غنى عن المقايسات العابرة في البروتوبلاست للتكنولوجيا الحيوية الزراعية.
الذرة (Zea mays L.) هي محصول الحبوب الرائد عالميا من حيث الحمولة. على هذا النحو ، فهو محور رئيسي لأبحاث علوم النبات الأساسية والتطبيقية8. ومع ذلك ، على عكس النباتات النموذجية مثل Nicotiana tabacum9 ، لا يتم إجراء التعبير العابر للجينات المحورة في أوراق الذرة السليمة بشكل روتيني. تم استخدام البروتوبلاستاج للحصول على خلايا ميزوفيل أوراق الذرة ونقلها10،11. حققت الطرق السابقة كفاءات نقل تصل إلى 75٪ باستخدام التثقيب الكهربائي وأنتجت البروتوبلاستيدات المنقولة على نطاق عشرات الآلاف10,15.
يفصل هذا البروتوكول كيفية بروتوبلاست ملايين خلايا الميزوفيل الذرة ونقلها بكفاءة مماثلة للطرق السابقة. تتمثل الخطوات الرئيسية في زراعة شتلات الذرة ، وحصاد أنسجة الأوراق ، وهضم جدار الخلية النباتية ، وتوصيل الحمض النووي البلازميد إلى الخلايا باستخدام PEG. تتمثل المساهمة الرئيسية لهذا البروتوكول في القدرة على توسيع نطاق نقل البروتوبلاست مع الحفاظ على صلاحية الخلية المطلوبة للمقايسات الوظيفية. وهذا يتيح استخدام التجارب على نطاق الجينوم ، مثل مقايسات المراسل المتوازية على نطاق واسع ، والتي يمكن أن تختبر وظيفة مئات الآلاف من المناطق في جميع أنحاء جينوم الذرة. تم استخدام هذه الطريقة مؤخرا للتحقيق في مكتبات كبيرة من عناصر الحمض النووي التنظيمية لرابطة الدول المستقلة بما في ذلك المعززات والمروجين12،13،14.
Protocol
1. نمو المواد النباتية
- شطف حبات الذرة مرتين بماء الصنبور. نقع الحبوب في ماء الصنبور طوال الليل في درجة حرارة الغرفة.
- في اليوم التالي ، املأ صينية بداية البذور المكونة من 72 خلية بالفيرميكوليت المبلل 1: 1: طحالب. اشطف الحبوب مرة واحدة وزرعها في قلب ، نواة واحدة لكل خلية.
- تنمو تحت ظروف يوم طويل (16 ساعة ضوء ، 8 ساعات مظلمة) عند 25 درجة مئوية لمدة 3 أيام.
- نقل إلى الظلام المستمر عند 25 درجة مئوية ، وتنمو لمدة 9-11 يوما.
2. عزل البلازميد
- تحويل الإشريكية القولونية التجارية المختصة كيميائيا مع البلازميد (البلازميدات) ذات الأهمية وفقا لتعليمات الشركة الصانعة.
- تنمو الإشريكية القولونية المحولة في 50 مل من وسط LB السائل مع المضادات الحيوية المناسبة طوال الليل عند 37 درجة مئوية مع الرج.
- قم بتجميع الإشريكية القولونية عن طريق الطرد المركزي لمدة 10 دقائق عند 3000 × جم في درجة حرارة الغرفة. استخرج البلازميدات باستخدام مجموعة عزل الحمض النووي البلازميد midiprep المتوفرة تجاريا.
- تقدير تركيز الحمض النووي للبلازميد باستخدام مقياس الطيف الضوئي المجهري.
ملاحظة: يجب أن يكون تركيز المواد المناسبة للنقل ≥800 نانوغرام / ميكرولتر و A260 / A280 من ≥1.8.
3. عزل البروتوبلاست
- تحضير 20 مل من محلول الإنزيم.
- أضف 2.18 جم من مانيتول ، و 0.30 جم من السليولاز R-10 ، و 0.06 جم من ماسيروزيم R-10 إلى أنبوب طرد مركزي سعة 50 مل. اقلب لخلط المساحيق. أضف H2O منزوع الأيونات إلى 15 مل. أضف 200 ميكرولتر من 1 M MES ، درجة الحموضة 5.7. دوامة لخلط.
- سخني المحلول على حرارة 55 درجة مئوية لمدة 10 دقائق. تبرد في درجة حرارة الغرفة لمدة 10 دقائق.
- أضف 20 ميكرولتر من 1 M CaCl2 ، و 0.02 جم من ألبومين مصل الأبقار ، و 100 ميكرولتر من 1 M β-mercaptoethanol.
- املأ إلى 20 مل باستخدام H2O. صب في دورق ملفوف بورق القصدير سعة 250 مل.
- أخرج شتلات الذرة من الظلام. اقطعها بضعة سنتيمترات فوق التربة باستخدام شفرة حلاقة جديدة. ضع الأطراف المقطوعة في الماء. احتفظ بها في الظلام في درجة حرارة الغرفة أثناء عدم استخدامها.
- حدد الأوراق الثانية والثالثة لكل شتلة ، مع الحرص على استبعاد الأوراق ذات المناطق البنية أو التالفة. حدد 12-16 ورقة. قطع ~ 1 سم من طرف كل ورقة وتجاهل. ثم ، قطع قسم 10 سم من كل ورقة.
ملاحظة: إذا كانت هناك حاجة إلى المزيد من الأنسجة ، استخدم حجما إضافيا قدره 20 مل من محلول الإنزيم في دورق إضافي سعة 250 مل. يمكن أن يؤدي وجود الكثير من مادة الأوراق في كمية معينة من محلول الإنزيم إلى تقليل الصلاحية. - قم بتكديس أقسام الأوراق فوق بعضها البعض مع الأطراف القاعدية معا. ثبت الحزمة معا في الطرف القاعدي باستخدام مشبك الموثق. ضع حزمة الأوراق على قطعة من الورق الأبيض.
- قبضة الأوراق ~ 1 سم من النهاية البعيدة. باستخدام شفرة حلاقة جديدة ، قم بقطع الأوراق من الطرف البعيد عموديا على الأوردة إلى شرائح رقيقة (0.5-1 مم). تجنب التقطيع لأسفل بشكل مستقيم ، بل قم بعمل شرائح قصيرة للأمام عبر المنديل.
- قم بتبديل شفرات الحلاقة كلما بدأت البقايا المرئية في الترسب على الورق. تشير البقايا المرئية إلى هرس الأنسجة بسبب شفرة مملة أو تقنية سيئة.
- بعد قطع ~ 2 سم من طول حزمة الأوراق ، انقل الشرائح على الفور إلى دورق محلول الإنزيم. لا تدع المادة تجف ، لأن هذا سيقلل من عدد البروتوبلاستات التي تم الحصول عليها. قم بتدوير محلول الإنزيم برفق لتبليل المادة.
- ضع غطاء رقائق معدنية فوق الدورق لحجب الضوء. كرر عملية التقطيع والنقل حتى يتم قطع الحزمة بأكملها بالقرب من مشبك الموثق.
- انقل كأس محلول الإنزيم إلى جرة جرس. يتسلل الفراغ بين -50.8 كيلو باسكال و -67.7 كيلو باسكال بالنسبة للضغط المحيط لمدة 3 دقائق في درجة حرارة الغرفة.
- انقل الدورق إلى شاكر منضدية. يهز عند 40 دورة في الدقيقة لمدة 2.5 ساعة في درجة حرارة الغرفة. حرك الدورق برفق باليد. عند هضمه بالكامل ، سيظهر محلول الإنزيم حليبي قليلا. إذا كان الحل لا يزال واضحا ، فاستمر في الاهتزاز عند 40 دورة في الدقيقة لمدة تصل إلى ساعة إضافية. لا تتجاوز 3.5 ساعة.
- أثناء الهضم ، اصنع محلول مانيتول + MES + MgCl2 (MMG) ، ومحلول بولي إيثيلين جلايكول (PEG) ، ومحلول حضانة.
- MMG: أضف 5.47 جم من مانيتول ، 200 ميكرولتر من 1 M MES ، درجة الحموضة 5.7 ، و 750 ميكرولتر من 1 M MgCl2 إلى أنبوب طرد مركزي 50 مل. ملء إلى 50 مل مع المقطر H2O. دوامة ليذوب. مكان على الجليد.
- محلول الحضانة: أضف 5.47 جم من مانيتول ، و 200 ميكرولتر من 1 M MES عند درجة الحموضة 5.7 ، و 200 ميكرولتر من 1 M KCl إلى أنبوب طرد مركزي سعة 50 مل. ملء إلى 50 مل مع المقطر H2O. دوامة ليذوب. مكان على الجليد.
- محلول PEG: أضف 0.44 جم من مانيتول ، و 1.0 جم من PEG ، و 400 ميكرولتر من 1 M CaCl2 إلى أنبوب طرد مركزي سعة 15 مل. ملء إلى 4 مل مع المقطر H2O. دوامة لخلط. احتضان على حرارة 37 درجة مئوية مع رج لمدة 30 دقيقة حتى يذوب تماما. يحفظ في درجة حرارة الغرفة.
- رج محلول الإنزيم عند 80 دورة في الدقيقة لمدة 10 دقائق في درجة حرارة الغرفة.
- ضع الكأس الزجاجية مع محلول الإنزيم على الثلج. لا تقم بإزالة غطاء الرقائق. أضف 20 مل من MMG المثلج البارد إلى محلول الإنزيم. قم بالتصفية من خلال مصفاة خلية 40 ميكرومتر في أنبوب طرد مركزي سعة 50 مل.
ملاحظة: احتفظ بجميع الحلول على الجليد للخطوات التالية حتى إضافة PEG. حافظ على البروتوبلاست مغطاة بورق لتقليل التعرض للضوء. - قسم المرشح إلى أحجام متساوية كل منها 10 مل. صب كل حجم في أنبوب طرد مركزي زجاجي مستدير القاع ، وقم بتدويره لأسفل لمدة 4 دقائق عند 100 × جم في درجة حرارة الغرفة.
- تخلص من المادة الطافية وأضف 1 مل من MMG المثلج البارد إلى كل أنبوب. أعد تعليق الكريات عن طريق الدوران برفق والنقر على الأنابيب. ادمج العينات في أنبوب طرد مركزي زجاجي واحد مستدير القاع. أضف MMG إلى حجم إجمالي قدره 5 مل. قم بتدويره لمدة 3 دقائق عند 100 × جم في درجة حرارة الغرفة.
- يغسل ب 5 مل من MMG ، ويقلب لمدة 3 دقائق عند 100 × جم في درجة حرارة الغرفة.
- كرر الغسيل مع 5 مل من MMG ، وقم بتدويره لمدة 3 دقائق عند 100 × جم في درجة حرارة الغرفة. بعد الدوران لأسفل الغسيل الثاني ، لاحظ ما إذا كان الطافي واضحا. إذا ظل غائما ، فقم بإجراء غسل ثالث.
- أعد تعليق البروتوبلاستيدات في 1 مل من MMG. غطيها بشكل غير محكم بورق القصدير واتركيها على الجليد.
- تحديد العائد البروتوبلاست والتحقق من الجدوى.
- في أنبوب طرد مركزي دقيق سعة 1.5 مل ، اجمع معا 4 ميكرولتر من البروتوبلاست و 72 ميكرولتر من MMG.
- في أنبوب طرد مركزي دقيق سعة 1.5 مل ، أضف 1 ميكرولتر من محلول مخزون ثنائي أسيتات الفلوريسئين (FDA) بنسبة 0.5٪ إلى 49 ميكرولتر من MMG لصنع حل عمل 20x. أضف 4 ميكرولتر من محلول عمل FDA إلى الأنبوب باستخدام البروتوبلاست المخفف. احتضان لمدة 5 دقائق في الظلام في درجة حرارة الغرفة.
- قم بتحميل 11 ميكرولتر من خليط البروتوبلاست على مقياس الدم. ضع تحت المجهر الضوئي برايتفيلد. تأكد بصريا من أن الخلايا تفتقر إلى جدران الخلايا. ثم احسب عدد البروتوبلاستات. استخدم هذا العدد لتقدير العدد الإجمالي للبروتوبلاستات التي تم الحصول عليها. بعد ذلك ، احسب عدد البروتوبلاستات التي تتألق باللون الأخضر تحت ضوء الأشعة فوق البنفسجية عند تلطيخها بإدارة الغذاء والدواء. تسفر عزلات البروتوبلاست الناجحة عن جدوى بنسبة 70٪ -90٪.
4. نقل بوساطة PEG
- بدءا من تركيز البروتوبلاست المقدر من الخطوة 3.17 ، اضبط على ~ 10000 بروتوبلاست / ميكرولتر. إذا كان التركيز منخفضا ، قم باستخدام أجهزة الطرد المركزي لمدة 3 دقائق عند 100 × جم ، وأعد التعليق في MMG إلى تركيز ~ 10000 بروتوبلاست / ميكرولتر.
- امزج ~ 1,000,000 بروتوبلاست مع 15 ميكروغرام من الحمض النووي في أنبوب طرد مركزي دقيق سعة 1.5 مل. قم بتعبئة الخليط باستخدام MMG إلى 114.4 ميكرولتر ، واحتضانه على الثلج لمدة 30 دقيقة.
- أعد تعليق البروتوبلاستيدات عن طريق النقر على جانب الأنبوب. أضف 105.6 ميكرولتر من محلول PEG بنسبة 25٪ إلى البلاستيدات الأولية للوصول إلى الوزن / الحجم النهائي بنسبة 12٪ PEG. تخلط بلطف عن طريق قلب 5-10 مرات. البروتوبلاستيدات في محلول PEG هشة. لا تهز الأنبوب. احتضان لمدة 10 دقائق في الظلام في درجة حرارة الغرفة.
ملاحظة: يمكن زيادة حجم النقل بمضاعفات وحدات التخزين الواردة في الخطوتين 4.2 والخطوة 4.3. على سبيل المثال ، يمكن تعليق 10 ملايين بروتوبلاست و 150 ميكروغرام من الحمض النووي في 1،444 ميكرولتر من MMG ومعالجتها بمحلول PEG 1،056 ميكرولتر في أنبوب طرد مركزي سعة 50 مل. - تمييع مع 5 مجلدات من محلول الحضانة. تخلط بلطف عن طريق الانقلاب. تدور لمدة 4 دقائق عند 100 × غرام في درجة حرارة الغرفة.
ملاحظة: في حالة التوسع, قسم البروتوبلاست إلى عدة أنابيب زجاجية مستديرة القاع لا تحتوي على أكثر من 10 مل لكل منها لضمان التكوير الكامل. قم بزيادة حجم محلول الحضانة المستخدم للغسيل بشكل متناسب. - قم بإزالة المادة الطافية عن طريق الماصة. يغسل مع 1-5 مل من محلول الحضانة ، وتدور لأسفل لمدة 3 دقائق في 100 × غرام في درجة حرارة الغرفة.
- أعد تعليق البروتوبلاستيدات في محلول الحضانة إلى تركيز 500-1000 خلية / ميكرولتر.
- احتضان البروتوبلاست في الظلام بين عشية وضحاها (~ 16 ساعة) في درجة حرارة الغرفة.
5. استعادة البروتوبلاست والتحقق من التعبير
- قم بتدوير البروتوبلاستيدات لمدة 4 دقائق عند 100 × جم في درجة حرارة الغرفة. ملاحظة: في حالة التوسع ، قسم البروتوبلاست إلى عدة أنابيب زجاجية مستديرة القاع لا تحتوي كل منها على أكثر من 10 مل.
- يغسل مع 1-5 مل من محلول الحضانة ، وتدور لأسفل لمدة 3 دقائق في 100 × غرام في درجة حرارة الغرفة.
- تعليق ، والجمع في 1-5 مل من محلول الحضانة.
- إذا تم نقل البروتوبلاستيدات بجين مراسل فلوري (على سبيل المثال ، GFP) ، خذ قسمة للتحقق من كفاءة النقل. باستخدام مقياس الدم ، قم أولا بحساب العدد الإجمالي للبروتوبلاست باستخدام المجهر الضوئي برايتفيلد. ثم احسب جزء البروتوبلاستيدات الفلورية تحت ضوء الأشعة فوق البنفسجية.
- أجهزة الطرد المركزي البروتوبلاست لمدة 3 دقائق عند 100 × غرام في درجة حرارة الغرفة.
ملاحظة: البروتوبلاستيدات جاهزة الآن للتطبيقات النهائية مثل استخراج الحمض النووي الريبي مع الفينول والجوانيدين أيزوثيوسيانات.
النتائج
الأنسجة الأنسب لعزل البروتوبلاست هي الأوراق الثانية والثالثة من الشتلات التي يتراوح عمرها بين 10 و 11 يوما (الشكل 1). في هذا العمل ، حصلنا على ما يقرب من 10 ملايين بروتوبلاست من 16 قسما للأوراق ، يبلغ طول كل منها 10 سم. يعتمد عدد البروتوبلاستيدات المعزولة على كتلة مادة الورقة وعرض شرائح الأوراق التي يتم هضمها في محلول الإنزيم.
تحت مجهر ضوء برايت فيلد ، تظهر البروتوبلاستيدات غير التالفة كروية تقريبا ، مع بقع البلاستيدات على السطح (الشكل 2 أ). قبل الشروع في النقل ، يمكن التحقق من الصلاحية عن طريق تلطيخ حصة صغيرة من البروتوبلاستيدات مع ثنائي أسيتات الفلوريسئين (FDA). تعتبر البروتوبلاستيدات الملطخة بإدارة الغذاء والدواء والتي تتألق تحت ضوء الأشعة فوق البنفسجية قابلة للحياة (الشكل 2B ، C). لا تزال جميع البروتوبلاستات التي تبدو غير تالفة قابلة للحياة ، وقد تكون بعض البروتوبلاستات القابلة للحياة في طور الموت عن طريق الإخلاء (الشكل 2C). في هذه الخلايا ، تتورم الفجوة العصارية وسيتم إخراجها في النهاية من الغشاء الخلوي.
يوضح الشكل 3 أن البروتوبلاستات تحولت باستخدام pJT01 ، وهو تعبير ذرة 4.3 كيلو بايت بلازميد مشتق من CD3-911 (ABRC) 15. ينتج عن النقل التعبير عن sGFP الموسوم بإشارة توطين نووي C-terminal من c-Myc (الشكل 3A). تم قياس نسبة البروتوبلاستيدات المعبرة عن sGFP على مدى تجارب متعددة باستخدام مقياس الدم. كان متوسط كفاءة النقل الذي حققته هذه الطريقة 40٪ بعد الحضانة الليلية (n = 9 ، الشكل 4 ، الجدول 1) ، وهو ما يمكن مقارنته بالطرق المنشورة سابقا15. اعتمادا على التطبيق التجريبي ، إذا كانت مكتبة البلازميد أو البلازميد تفتقر إلى مراسل الفلورسنت ، فمن المستحسن تضمين عنصر تحكم إيجابي لتأكيد النقل.

الشكل 1: شتلة الذرة الممثلة التي تزرع في الظلام لمدة 10 أيام بعد الإنبات. تشير الأسهم إلى الأوراق الثانية والثالثة ، والتي هي الأنسب للبروتوباستينج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
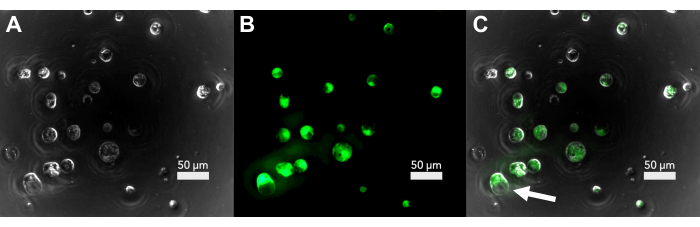
الشكل 2: الفحص المجهري الفلوري لصلاحية البلاستيدات الأولية بعد العزل . (أ) صورة برايتفيلد للبروتوبلاستيدات بعد العزل مباشرة. (ب) الإشارة الفلورية للبروتوبلاستيدات الملطخة بإدارة الغذاء والدواء. (ج) تداخل الحقل الساطع والتألق الذي يوضح البروتوبلاستات القابلة للحياة. يوضح السهم بروتوبلاست يخضع للإخلاء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
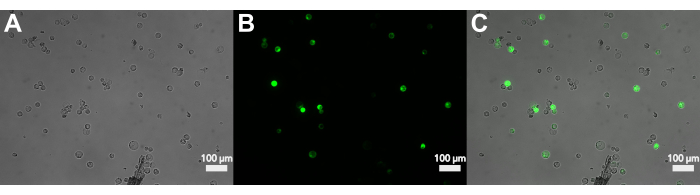
الشكل 3: الفحص المجهري الفلوري للبروتوبلاستات المنقولة باستخدام sGFP . (أ) صورة برايتفيلد للبروتوبلاستات بعد النقل. (ب) الإشارة الفلورية للبروتوبلاستيدات المنقولة في قناة هيئة أجيال السلام. (ج) تداخل الحقل الساطع والتألق الذي يوضح البروتوبلاستات المحولة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
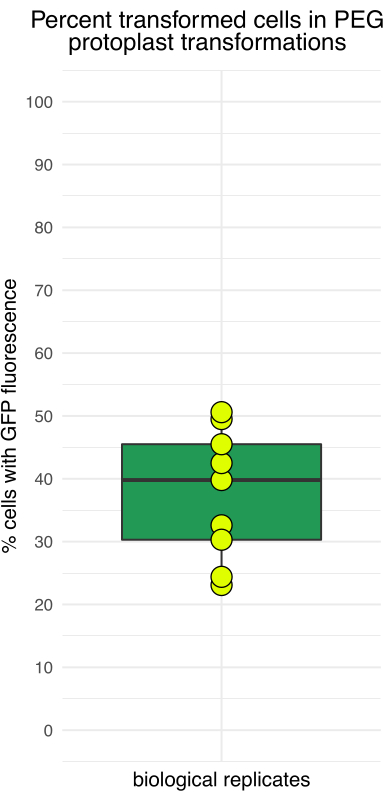
الشكل 4: النسبة المئوية للبروتوبلاستات التي تظهر مضان GFP بعد 16 ساعة من الحضانة. تباينت كفاءة النقل بين التجارب المستقلة ، حيث كانت أدنى كفاءة حوالي 20٪ وأعلى كفاءة قريبة من 50٪. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| محاكمة | خلايا GFP التي تم حسابها | إجمالي الخلايا التي تم عدها | نسبة GFP |
| 1 | 104 | 261 | 39.8 |
| 2 | 148 | 298 | 49.5 |
| 3 | 84 | 258 | 32.6 |
| 4 | 137 | 271 | 50.6 |
| 5 | 127 | 299 | 42.5 |
| 6 | 107 | 235 | 45.5 |
| 7 | 83 | 360 | 23.1 |
| 8 | 134 | 549 | 24.4 |
| 9 | 61 | 201 | 30.3 |
| دني | 109 | 304 | 36 |
| الانحراف المعياري | 29 | 102 | 10 |
الجدول 1: كفاءة نقل البروتوبلاست التمثيلية. بيانات من تسع تجارب بروتوبيداست حديثة في مختبر المؤلفين.
الملف التكميلي 1: ملف نصي بتنسيق GenBank مع تسلسل pJT01. يعمل بلازميد تعبير sGFP سعة 4.3 كيلو بايت كعنصر تحكم إيجابي في بروتوبلاستيدات الذرة المنقولة. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
كما ذكر سابقا ، فإن جودة المواد النباتية المستخدمة في البروتوبلاست ضرورية للحصول على البروتوبلاستيدات عالية الجودة16،17،18. من الأهمية بمكان اختيار أوراق صحية لا تشوبها شائبة. استخدم هذا العمل صنف الذرة البحثي الشهير B73. لم نختبر أصنافا أخرى. نمت شتلات الذرة المستخدمة في هذا البروتوكول في الظلام لأن الأوراق المأهولة تنتج البروتوبلاستيدات مع قابلية أكبر للبقاء بعد 16 ساعة من النقل مقارنة بالبروتوبلاستيدات من الأوراق الخضراء. بالنسبة للتطبيقات التي لا تتطلب حضانة بين عشية وضحاها ، سيكون من الممكن استخدام مادة الأوراق الخضراء أو الخضراء.
الخطوة الحاسمة هي قطع مادة الأوراق بشكل صحيح إلى شرائح رقيقة قبل الهضم الأنزيمي. تزيد هذه العملية من مساحة سطح خلايا النسيج المتوسط التي تتعرض لمحلول الإنزيم، وهو ما يزيد من عدد البروتوبلاستيدات المستعادة. يتم التخلص من أطراف الأوراق البعيدة ، ويتم قطع شرائح رفيعة (≤1 مم) بشفرات حلاقة جديدة ، والتي يتم تبديلها فورا عندما تبدأ في التلاشي. بالنسبة لكمية معينة من الأنسجة ، تنتج الشرائح الرقيقة المزيد من البروتوبلاستيدات بشرط استخدام التقنية الصحيحة لتقليل سحق الأوراق.
من المهم أيضا غسل البروتوبلاستيدات بشكل صحيح ، لأنها حساسة للغاية بعد خضوعها لإزالة جدار الخلية. بعد الهضم ، يتم الاحتفاظ بجميع المحاليل على الجليد ، ويتم حماية البروتوبلاستيدات الداكنة من الضوء. يتم تخزين الأسمولية ودرجة الحموضة عن طريق إجراء الغسيل في محلول MMG. لعزل البروتوبلاستيدات عن الحطام الخلوي الأقل كثافة ، يحدث الطرد المركزي عند 100 × جم. تظهر البروتوبلاستيدات التي يتم طردها بالطرد المركزي عند 200 × جم قابلية مماثلة للحياة بعد العزلة ولكنها أقل قابلية للحياة في اليوم التالي ، وتتحول إلى النصف تقريبا أيضا. نوصي بالتحقق من صلاحية البروتوبلاست عن طريق تلطيخ FDA (ثنائي أسيتات الفلوريسين) مباشرة بعد العزلة ؛ تتراوح الصلاحية الطبيعية بين 70٪ -90٪. البروتوبلاستيدات ذات الصلاحية أقل من 40٪ بعد العزل تنتج القليل من المحولات.
يكون التكوير والغسيل أسهل عند العمل مع العديد من البروتوبلاست لأنه يتم الحصول على حبيبات مرئية بوضوح بعد النقل. لهذا السبب ، يتم إجراء النقل باستخدام 1 مليون بروتوبلاست أو أكثر. عند توسيع نطاق البروتوكول ، يجب اختيار وعاء بحجم مناسب لخطوات الحضانة (أنبوب طرد مركزي 1.5 مل أو 15 مل أو 50 مل) ، ويجب تغيير حجم المحلول المستخدم في خطوات الغسيل وفقا لذلك. في أي حال ، من المفيد استخدام أجهزة الطرد المركزي في ≤10 مل من القسامات لضمان عدم بقاء البروتوبلاست في المادة الطافية. أحد ابتكارات هذا البروتوكول هو إزالة خطوة الحضانة والغسيل لمدة 1 ساعة في محلول W5 المدرج في البروتوكولات الأخرى14,19 ، والتي ثبت أنها غير ضرورية في أيدينا.
كما رأينا في دراسات أخرى ، فإن كمية ونوعية الحمض النووي كلاهما أمر بالغ الأهمية لنجاح النقل19. بالنسبة للبلازميدات في نطاق 4-6 كيلو بايت ، يتم استخدام 15 ميكروغرام من الحمض النووي لكل 1 مليون بروتوبلاست. يمكن أن تؤدي مستحضرات الحمض النووي ذات الجودة الرديئة إلى تقليل قابلية البقاء بعد النقل ، لذلك نوصي باستخدام مجموعة استخراج الحمض النووي التجارية عند عزل البلازميدات عن البكتيريا. يتم احتضان البروتوبلاستيدات طوال الليل في درجة حرارة الغرفة في الظلام للسماح بنسخ مكتبة البلازميد أو البلازميد مع تقليل الإجهاد. بعد الحضانة بين عشية وضحاها ، يتم استرداد ما يقرب من نصف عدد البروتوبلاستيدات المنقولة في الأصل. يتم تخفيف البروتوبلاستيدات إلى تركيز 500-1000 خلية / ميكرولتر للحضانة بين عشية وضحاها. البروتوبلاستيدات التي تركت لاحتضانها بين عشية وضحاها بتركيزات أعلى من 1000 خلية / ميكرولتر لها معدلات استرداد أقل وقابلية بقاء أقل. عند التركيزات الأعلى ، قد يساهم الحطام من البروتوبلاستيدات التالفة والميتة في موت البروتوبلاستات المجاورة. غسل البروتوبلاست بعد الحضانة بين عشية وضحاها يعمل على إزالة هذا الحطام وإزالة البلازميد الزائد.
مثل هذه البروتوكولات لها قيود على أنه ليست كل أنواع النباتات أو أنواع الأنسجة قابلة للبروتوبلاستينج. علاوة على ذلك ، قد تحدث اختلافات التعبير الجيني بسبب عملية البروتوبلاستيد.
باختصار ، قمنا بتفصيل بروتوكول بسيط وقابل للتطوير لعزل ونقل ملايين البروتوبلاستيدات القابلة للحياة من المحصول الزراعي الأساسي Z. mays. يمكن لهذه الطريقة نقل العديد من البروتوبلاستات باستخدام PEG ، مع كفاءة تحويل عالية تقريبا مثل الطرق القائمة على التثقيب الكهربائي15. يتيح العدد الصافي الأكبر للمحولات اختبار مئات أو آلاف التركيبات في تجارب واسعة النطاق مثل فحوصات المراسل المتوازية على نطاق واسع12,13. ستسمح التجارب المستقبلية على نطاق الجينوم في الذرة للعلماء بفهم أفضل للتعبير الجيني للذرة وتنظيم الجينات.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني لبحوث الجينوم البشري للتدريب متعدد التخصصات في علوم الجينوم (منحة تدريب T32 رقم HG000035 إلى JT) والمعهد الوطني للصحة (NIGMS 1R35GM139532 إلى C.Q.) والمؤسسة الوطنية للعلوم (RESEARCH-PGR IOS-1748843 و PlantSynBio 2240888 إلى CQ). نشكر أندريا جالوفاتي من جامعة روتجرز على هدية بذور الذرة.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL graduated microcentrifuge tubes | VWR | 490004-444 | |
| 15 mL Falcon conical centrifuge tube | Corning | 05-527-90 | |
| 250 mL Pyrex glass beaker | Fisher | 50-121-5005 | |
| 40 um nylon mesh cell strainer | Fisher | 22363547 | |
| 50 mL Falcon tube | Corning | 14-432-22 | |
| 72 cell propagation tray | T.O. Plastics | 725607C | |
| Aluminum foil | VWR | 89107-732 | |
| Bell jar | Bel-Art | F42022-0000 | |
| Benchtop centrifuge | Eppendorf | 5424-R | |
| Beta-mercaptoethanol | Sigma-Aldrich | M6250-250ML | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Bovine serum albumin | Sigma-Aldrich | A2153 | |
| Calcium chloride dihydrate (CaCl2*2H2O) | PhytoTech Labs | C135 | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Cellulase Onozuka R-10 | Duchefa Biochemie | C8001.0010 | |
| D-Mannitol | PhytoTech Labs | M562 | |
| Dissecting scope | Reichert | Microstar IV | |
| Fluorescein Diacetate (FDA) | Thermofischer Scientific | F1303 | Dissolve in acetone at 0.5% weight/volume to make a 1000X stock solution. Protect from light and store at -20 °C. |
| Fluorescence Illumination Systems | Prior | Lumen200 | |
| Fluorescence microscope | Leica | MDG36 | |
| High-capacity centrifuge | Eppendorf | 5810 R | |
| Macerozyme | Duchefa Biochemie | M8002.0005 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | M292-1KG | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Maize seeds | B73 | USDA-ARS | https://npgsweb.ars-grin.gov/gringlobal/accessiondetail?accid=PI+550473 |
| Medium binder clip | Uline | S-24649 | |
| MES | Sigma-Aldrich | M5287-250G | Dissolve in ultrapure H2O to make a 1M stock solution. Adjust pH to 5.7 using KOH. Protect from light and store at room temperature. |
| Micropipette 20-200 uL | Gilson | F123601G | |
| Nanodrop microvolume spectrophotometer | Thermofischer Scientific | ND-1000 | |
| NEB 5-alpha competent E. coli | New England BioLabs | C2987H | |
| Neubauer hemocytometer | Daigger Scientific | EF16034F | |
| No. 9 Single-edge razor blade | Excel | 20009 | |
| Orbital shaker | VWR | 89032-104 | |
| Poly(ethylene) glycol 4,000 | Sigma-Aldrich | 81240-1KG | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541-1KG | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Professional Grade Vermiculite | NK Lawn & Garden | G208 | |
| Round-bottom glass centrifuge tube 30 mL | Kimble Chase | 45500-30 | |
| Rubber adapter for Corex centrifuge tubes | Corning | CLS8445AO | |
| Sphagnum peat moss | Premier Horticulture | 0128P | |
| TRIzol Reagent | Thermofischer Scientific | 15596018 | |
| Tygon vacuum tubing | VWR | 76336-844 | |
| Vacuum gauge | Wika | 4269978 |
References
- Jiang, F., Zhu, J., Liu, H. -. L. Protoplasts: A useful research system for plant cell biology, especially dedifferentiation. Protoplasma. 250 (6), 1231-1238 (2013).
- Wang, S., Tiwari, S. B., Hagen, G., Guilfoyle, T. J. AUXIN RESPONSE FACTOR7 restores the expression of auxin-responsive genes in mutant Arabidopsis leaf mesophyll protoplasts. The Plant Cell. 17 (7), 1979-1993 (2005).
- Hirner, A., et al. Arabidopsis LHT1 is a high-affinity transporter for cellular amino acid uptake in both root epidermis and leaf mesophyll. The Plant Cell. 18 (8), 1931-1946 (2006).
- Hwang, I., Sheen, J. Two-component circuitry in Arabidopsis cytokinin signal transduction. Nature. 413 (6854), 383-389 (2001).
- Tan, M. -. L. M. C., Rietveld, E. M., van Marrewijk, G. A. M., Kool, A. J. Regeneration of leaf mesophyll protoplasts of tomato cultivars (L. esculentum): Factors important for efficient protoplast culture and plant regeneration. Plant Cell Reports. 6 (3), 172-175 (1987).
- Brandt, K. M., Gunn, H., Moretti, N., Zemetra, R. S. A streamlined protocol for wheat (Triticum aestivum) protoplast isolation and transformation with CRISPR-Cas ribonucleoprotein complexes. Frontiers in Plant Science. 11, 769 (2020).
- Nadakuduti, S. S., et al. Evaluation of methods to assess in vivo activity of engineered genome-editing nucleases in protoplasts. Frontiers in Plant Science. 10, 110 (2019).
- OECD, Food and Agriculture Organization of the United Nations. OECD-FAO Agricultural Outlook 2021-2030. OECD, Food and Agriculture Organization of the United Nations. , (2021).
- Gallois, P., Marinho, P. Leaf disk transformation using Agrobacterium tumefaciens-expression of heterologous genes in tobacco. Plant Gene Transfer and Expression Protocols. 49, 39-48 (1995).
- Schäffner, A. R., Sheen, J. Maize rbcS promoter activity depends on sequence elements not found in dicot rbcS promoters. The Plant Cell. 3 (9), 997-1012 (1991).
- Sheen, J. Molecular mechanisms underlying the differential expression of maize pyruvate, orthophosphate dikinase genes. The Plant Cell. 3 (3), 225-245 (1991).
- Jores, T., et al. Identification of plant enhancers and their constituent elements by STARR-seq in tobacco leaves. The Plant Cell. 32 (7), 2120-2131 (2020).
- Jores, T., et al. Synthetic promoter designs enabled by a comprehensive analysis of plant core promoters. Nature Plants. 7 (6), 842-855 (2021).
- Ricci, W. A., et al. Widespread long-range cis-regulatory elements in the maize genome. Nature Plants. 5 (12), 1237-1249 (2019).
- Sheen, J. Signal transduction in maize and Arabidopsis mesophyll protoplasts. Plant Physiology. 127 (4), 1466-1475 (2001).
- Jeon, J. M., et al. Efficient transient expression and transformation of PEG-mediated gene uptake into mesophyll protoplasts of pepper (Capsicum annuum L.). Plant Cell, Tissue and Organ Culture. 88 (2), 225-232 (2007).
- Pindel, A. Optimization of isolation conditions of Cymbidium protoplasts. Folia Horticulturae. 19, 79-88 (2007).
- Ren, R., et al. Highly efficient leaf base protoplast isolation and transient expression systems for orchids and other important monocot crops. Frontiers in Plant Science. 12, 626015 (2021).
- Yoo, S. -. D., Cho, Y. -. H., Sheen, J. Arabidopsis mesophyll protoplasts: A versatile cell system for transient gene expression analysis. Nature Protocols. 2 (7), 1565-1572 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved