Method Article
טרנספקציה ניתנת להרחבה של פרוטופלסטים של מזופיל תירס
In This Article
Summary
כאן, אנו מציגים פרוטוקול בתפוקה גבוהה להעברה זמנית של מיליוני פרוטופלסטים של תירס לבדיקת ספריות גדולות של פלסמידים בתאי מזופיל תירס.
Abstract
הטרנספקציה של תאי מזופיל תירס כרוכה לעתים קרובות בעיכול דפנות תאי הצמח ליצירת פרוטופלסטים ולאחר מכן החדרת דנ"א באמצעות אלקטרופורציה או פוליאתילן גליקול (PEG). שיטות קודמות פותחו כדי לייצר עשרות אלפי פרוטופלסטים נגועים בבת אחת. במאמר זה אנו מתארים שיטה פשוטה לבודד ולהדביק מיליוני פרוטופלסטים של מזופיל עלים בתירס (Zea mays L). תהליך יעיל זה מסיר כמה שלבים נפוצים לאורך זמן, כגון כביסה בקיר 5. בנוסף, שלבים כגון צנטריפוגה, טרנספקציה בתיווך PEG ואינקובציה שונו כדי לעבוד עם מספר גדול יותר של פרוטופלסטים. היכולת לבטא ספריות גדולות של מבני פלסמיד מאפשרת ניסויים בקנה מידה גנומי, כגון מבחני כתב מקבילים מסיביים בתירס.
Introduction
ביטוי גנים חולפים הוא כלי רב עוצמה בביולוגיה של הצמח. אולם קשה להדביק תאי צמח מאחר שהם מוקפים בדופן התא. מחסום זה לכניסת דנ"א אינו קיים בסוגי תאים נפוצים אחרים כגון תאי יונקים או חרקים. מחקרי עבר התמודדו עם אתגר זה על ידי שימוש בפרוטופלסטים: תאי צמח שדפנות התא שלהם עוכלו והוסרו. בניגוד לרקמת עלים לא מעובדת, פרוטופלסטים צמחיים קלים לעבודה בתרחיף ומתאימים לטכניקות טרנספקציה המתווכות על ידי אלקטרופורציה או פוליאתילן גליקול (PEG)1. תאי צמחים שומרים על רוב הפונקציונליות שלהם גם לאחר הסרת דופן התא. לפיכך, פרוטופלסטים משמשים במגוון צמחים לחקר תפקוד גנים וחלבונים2,3, להבנת העברת אותות4, ולזיהוי מטרות אפשריות לרבייה של צמחים5. פרוטופלסטים הם גם כלי נוח לסינון מבני עריכת גנום בזני יבול מגוונים, כולל חיטה ותפוח אדמה 6,7. בקיצור, בדיקות ארעיות בפרוטופלסטים הן הכרחיות לביוטכנולוגיה חקלאית.
תירס (Zea mays L.) הוא יבול הדגנים המוביל בעולם לפי טונות; ככזה, הוא מוקד עיקרי של מחקר בסיסי ויישומי במדעי הצמח8. עם זאת, שלא כמו בצמחי מודל כגון Nicotiana tabacum9, ביטוי טרנסגנים חולפים בעלי תירס שלמים אינו מבוצע באופן שגרתי. Protoplasting שימש כדי להשיג ולהדביק תאי מזופיל עלה תירס10,11. שיטות קודמות השיגו יעילות טרנספקציה של עד 75% באמצעות אלקטרופורציה וייצרו פרוטופלסטים נגועים בקנה מידה של עשרות אלפי10,15.
פרוטוקול זה מפרט כיצד לבצע פרוטופלסטים של מיליוני תאי מזופיל תירס ולהדביק אותם ביעילות דומה לשיטות קודמות. השלבים העיקריים הם גידול שתילי תירס שעברו אטיולציה, קצירת רקמת העלה, עיכול דופן תא הצמח והעברת DNA פלסמיד לתאים באמצעות PEG. תרומתו העיקרית של פרוטוקול זה היא היכולת להגדיל את הטרנספקציה הפרוטופלסטית תוך שמירה על כדאיות התא הנדרשת לבדיקות פונקציונליות. זה מאפשר שימוש בניסויים בקנה מידה גנומי, כגון מבחני כתב מקבילים מאסיביים, שיכולים לבחון את תפקודם של מאות אלפי אזורים ברחבי גנום התירס. שיטה זו שימשה לאחרונה לחקר ספריות גדולות של רכיבי DNA cis-regulatory כולל משפרים ומקדמים12,13,14.
Protocol
1. גידול החומר הצמחי
- שטפו את גרעיני התירס פעמיים במי ברז. משרים את הגרעינים במי ברז למשך הלילה בטמפרטורת החדר.
- למחרת, מלאו מגש פתיחה של 72 תאים זרעים עם ורמיקוליט רטוב 1:1: אזוב כבול. שוטפים את הגרעינים פעם אחת ושותלים אותם בקצה הפקק, גרעין אחד בכל תא.
- לגדול בתנאים של יום ארוך (16 שעות אור, 8 שעות חשוכות) ב 25 °C במשך 3 ימים.
- מעבירים לחושך מתמיד ב 25 מעלות צלזיוס, וגדלים במשך 9-11 ימים.
2. בידוד פלסמיד
- הפוך E. coli מסחרי מוכשר כימית עם פלסמיד(ים) של עניין על פי הוראות היצרן.
- לגדל את E. coli שעבר טרנספורמציה ב 50 מ"ל של LB בינוני נוזלי עם אנטיביוטיקה מתאימה לילה ב 37 ° C עם רעיד.
- משחררים את האי-קולי על ידי צנטריפוגה למשך 10 דקות בטמפרטורה של 3,000 x גרם בטמפרטורת החדר. חלצו את הפלסמידים באמצעות ערכת בידוד DNA של פלסמיד midiprep הזמינה באופן מסחרי.
- הערך את ריכוז ה- DNA של פלסמיד באמצעות ספקטרופוטומטר מיקרו-נפח.
הערה: חומר המתאים לטרנספקציה צריך להיות בריכוז של ≥800 ננוגרם/μL ו-A260/A280 של ≥1.8.
3. בידוד פרוטופלסט
- הכן 20 מ"ל של תמיסת אנזים.
- הוסף 2.18 גרם של מניטול, 0.30 גרם של צלולאז R-10, ו 0.06 גרם של macerozyme R-10 לצינור צנטריפוגה 50 מ"ל. הפוך כדי לערבב את האבקות. הוסף H2O נטול יונים ל- 15 מ"ל. הוסף 200 μL של 1 M MES, pH 5.7. מערבולת לערבב.
- חממו את התמיסה ב-55°C למשך 10 דקות. מצננים בטמפרטורת החדר למשך 10 דקות.
- הוסף 20 μL של 1 M CaCl2, 0.02 גרם של אלבומין בסרום בקר, ו 100 μL של 1 M β-mercaptoethanol.
- ממלאים עד 20 מ"ל עם H2O. יוצקים לתוך עטופה בנייר כסף 250 מ"ל.
- הוציאו את שתילי התירס מהחושך. חותכים אותם כמה סנטימטרים מעל הקרקע באמצעות סכין גילוח חדש. מניחים את הקצוות החתוכים במים. יש לשמור אותם בחושך בטמפרטורת החדר בזמן שאינם בשימוש.
- בחר את העלים השני והשלישי של כל שתיל, דואג להוציא עלים עם אזורים חומים או פגומים. בחר 12-16 דף. חותכים ~1 ס"מ מקצה כל עלה ומשליכים. לאחר מכן, חותכים קטע של 10 ס"מ מכל עלה.
הערה: אם יש צורך ברקמה נוספת, השתמש בנפח נוסף של 20 מ"ל של תמיסת אנזים במיכל נוסף של 250 מ"ל. כמות גדולה מדי של חומר עלים בכמות נתונה של תמיסת אנזימים עלולה להפחית את הכדאיות. - ערמו את חלקי העלים זה על גבי זה עם קצוות הבסיס יחד. הדקו את הצרור יחד בקצה הבסיס באמצעות תפס קלסר. מניחים את צרור העלים על פיסת נייר לבן.
- אוחזים את העלים ~ 1 ס"מ מהקצה הדיסטלי. בעזרת סכין גילוח חדש, חותכים את העלים מהקצה הדיסטלי בניצב לורידים לפרוסות דקות (0.5-1 מ"מ). הימנעו מחיתוך ישר למטה, אלא עשו פרוסות קצרות קדימה דרך הרקמה.
- החליפו את סכיני הגילוח בכל פעם ששאריות גלויות מתחילות להיות מונחות על הנייר. שאריות גלויות מעידות על מעיכה של הרקמה עקב להב עמום או טכניקה לקויה.
- לאחר חיתוך ~ 2 ס"מ מאורך צרור העלים, העבירו מיד את הפרוסות לכוס תמיסת האנזים. אל תאפשר לחומר להתייבש, מכיוון שהדבר יפחית את מספר הפרוטופלסטים המתקבלים. מערבלים בעדינות את תמיסת האנזים כדי להרטיב את החומר.
- הניחו מכסה רדיד אלומיניום מעל הכד כדי לחסום את האור. חזור על תהליך החיתוך וההעברה עד שכל החבילה נחתכת קרוב לתפס הקלסר.
- מעבירים את תמיסת האנזים לצנצנת פעמון. חדירת ואקום בין -50.8 kPa ל- -67.7 kPa ביחס ללחץ הסביבה למשך 3 דקות בטמפרטורת החדר.
- מעבירים את הכד לשייקר שולחן. יש לנער ב-40 סל"ד במשך 2.5 שעות בטמפרטורת החדר. סובבו בעדינות את הכד ביד. כאשר מתעכל במלואו, תמיסת האנזים תיראה מעט חלבית. אם הפתרון עדיין ברור, המשיכו לרעוד ב-40 סל"ד עד שעה נוספת. אין לחרוג מ-3.5 שעות.
- במהלך העיכול, הכינו תמיסת מניטול + MES + MgCl2 (MMG), תמיסת פוליאתילן גליקול (PEG) ותמיסת דגירה.
- MMG: הוסף 5.47 גרם מניטול, 200 מיקרוליטר של 1 M MES, pH 5.7 ו- 750 μL של 1 M MgCl2 לצינור צנטריפוגה של 50 מ"ל. ממלאים עד 50 מ"ל במערבולת H2O. מזוקקת להתמוססות. מניחים על קרח.
- תמיסת דגירה: הוסף 5.47 גרם מניטול, 200 מיקרוליטר של 1 M MES ב- pH 5.7, ו- 200 μL של 1 M KCl לצינור צנטריפוגה של 50 מ"ל. ממלאים עד 50 מ"ל במערבולת H2O. מזוקקת להתמוססות. מניחים על קרח.
- תמיסת PEG: הוסף 0.44 גרם מניטול, 1.0 גרם PEG ו-400 מיקרוליטר של 1 M CaCl2 לצינור צנטריפוגה של 15 מ"ל. ממלאים עד 4 מ"ל במערבולת H2O. מזוקקת לערבוב. יש לדגור בטמפרטורה של 37°C עם ניעור במשך 30 דקות עד להמסה מלאה. יש לשמור בטמפרטורת החדר.
- נערו את תמיסת האנזים במהירות 80 סל"ד למשך 10 דקות בטמפרטורת החדר.
- מניחים את הכד עם תמיסת האנזים על קרח. אין להסיר את כיסוי נייר הכסף. הוסף 20 מ"ל של MMG קר כקרח לתמיסת האנזים. סנן דרך מסננת תאים 40 מיקרומטר לתוך צינור צנטריפוגה 50 מ"ל.
הערה: שמור את כל הפתרונות על קרח עבור השלבים הבאים עד להוספת ה- PEG. שמור את הפרוטופלסטים מכוסים בנייר כסף כדי למזער את החשיפה לאור. - לפצל את התסנין לנפחים שווים של 10 מ"ל כל אחד. יוצקים כל נפח לתוך צינור צנטריפוגת זכוכית עגול, ומסתובבים כלפי מטה במשך 4 דקות ב 100 x גרם בטמפרטורת החדר.
- השליכו את הסופרנאטנט והוסיפו 1 מ"ל MMG קר כקרח לכל צינור. השהה מחדש את הכדוריות על ידי ערבול עדין והקשה על הצינורות. שלבו את הדגימות לצינור צנטריפוגת זכוכית עגול אחד. הוסף MMG לנפח כולל של 5 מ"ל. יש לסחוט כלפי מטה במשך 3 דקות במהירות של 100 x גרם בטמפרטורת החדר.
- יש לשטוף עם 5 מ"ל MMG, ולסובב כלפי מטה במשך 3 דקות במהירות של 100 x גרם בטמפרטורת החדר.
- חזור על הכביסה עם 5 מ"ל MMG, וסחרור כלפי מטה במשך 3 דקות ב 100 x גרם בטמפרטורת החדר. לאחר סיבוב השטיפה השנייה, שימו לב אם הסופרנאטנט צלול. אם נשאר מעונן, בצעו שטיפה שלישית.
- להשעות מחדש את protoplasts ב 1 מ"ל של MMG. מכסים באופן רופף בנייר כסף ושומרים על קרח.
- לקבוע את תשואת protoplast ולבדוק את הכדאיות.
- בצינור מיקרוצנטריפוגה של 1.5 מ"ל, הוסף יחד 4 μL של פרוטופלסטים ו- 72 μL של MMG.
- בצינור מיקרוצנטריפוגה של 1.5 מ"ל, הוסף 1 μL של תמיסת מלאי דיאצטט פלואורסצאין 0.5% (FDA) ל- 49 μL של MMG כדי ליצור פתרון עבודה פי 20. הוסף 4 μL של תמיסת עבודה של ה- FDA לצינור עם הפרוטופלסטים המדוללים. דוגרים במשך 5 דקות בחושך בטמפרטורת החדר.
- טען 11 μL של תערובת protoplast על hemocytometer. מניחים מתחת למיקרוסקופ אור בהיר. אשרו חזותית שהתאים חסרים קירות תאים. לאחר מכן, לספור את מספר protoplasts. השתמש בספירה זו כדי להעריך את המספר הכולל של פרוטופלסטים שהושגו. לאחר מכן, יש לספור את מספר הפרוטופלסטים שזוהרים בירוק תחת אור UV כאשר הם מוכתמים ב-FDA. בידודים מוצלחים של פרוטופלסטים מניבים כדאיות של 70%-90%.
4. טרנספקציה בתיווך PEG
- החל מריכוז הפרוטופלסט המשוער משלב 3.17, התאם ל~10,000 פרוטופלסטים/μL. אם הריכוז נמוך, צנטריפוגה למשך 3 דקות ב 100 x גרם, והשהה מחדש ב- MMG לריכוז של ~ 10,000 פרוטופלסטים / μL.
- ערבבו ~1,000,000 פרוטופלסטים עם 15 מיקרוגרם DNA בצינור מיקרוצנטריפוגה של 1.5 מ"ל. ממלאים את התערובת ב-MMG ל-114.4 מיקרוליטר, ודגרים על קרח במשך 30 דקות.
- השהה מחדש את הפרוטופלסטים על ידי הקשה על צד הצינור. הוסף 105.6 μL של תמיסת 25% PEG לפרוטופלסטים כדי להגיע למשקל/נפח סופי של 12% PEG. מערבבים בעדינות על ידי היפוך 5-10 פעמים. פרוטופלסטים בתמיסת PEG הם שבירים; אין לנער את הצינור. דוגרים במשך 10 דקות בחושך בטמפרטורת החדר.
הערה: ניתן להגדיל את הטרנספקציה בכפולות של אמצעי האחסון שניתנו בשלבים 4.2 ובשלב 4.3. לדוגמה, 10 מיליון פרוטופלסטים ו-150 מיקרוגרם דנ"א יכולים להיות מושהים ב-1,444 מיקרוליטר MMG ומטופלים בתמיסת PEG של 1,056 מיקרוליטר בצינור צנטריפוגה של 50 מ"ל. - לדלל עם 5 כרכים של תמיסת הדגירה. מערבבים בעדינות על ידי היפוך. יש לסחוט כלפי מטה במשך 4 דקות במהירות של 100 x גרם בטמפרטורת החדר.
הערה: אם מגדילים את קנה המידה, פצלו את הפרוטופלסטים למספר צינורות זכוכית בעלי תחתית עגולה המכילים לא יותר מ-10 מ"ל כל אחד כדי להבטיח כדוריות מלאות. הגדילו באופן פרופורציונלי את נפח תמיסת הדגירה המשמשת לשטיפה. - מוציאים את הסופרנאטנט על ידי פיפטנט. יש לשטוף עם 1-5 מ"ל של תמיסת דגירה, ולסובב למטה במשך 3 דקות ב 100 x גרם בטמפרטורת החדר.
- משעים מחדש את הפרוטופלסטים בתמיסת הדגירה לריכוז של 500-1,000 תאים/μL.
- לדגור על הפרוטופלסטים בחושך למשך הלילה (~ 16 שעות) בטמפרטורת החדר.
5. שחזור Protoplast ואימות הבעה
- סובבו את הפרוטופלסטים במשך 4 דקות במהירות של 100 x גרם בטמפרטורת החדר. הערה: במקרה של הגדלת קנה מידה, פצל את הפרוטופלסטים למספר צינורות זכוכית בעלי תחתית עגולה המכילים לא יותר מ-10 מ"ל כל אחד.
- יש לשטוף עם 1-5 מ"ל של תמיסת דגירה, ולסובב למטה במשך 3 דקות ב 100 x גרם בטמפרטורת החדר.
- להשהות מחדש, ולשלב 1-5 מ"ל של פתרון הדגירה.
- אם הפרוטופלסטים נגועים בגן כתב פלואורסצנטי (למשל, GFP), קח aliquot כדי לבדוק את יעילות הטרנספקציה. באמצעות המוציטומטר, תחילה לספור את המספר הכולל של protoplasts באמצעות מיקרוסקופ אור בהיר. לאחר מכן, ספור את החלק של פרוטופלסטים פלואורסצנטיים תחת אור UV.
- צנטריפוגה את הפרוטופלסטים למשך 3 דקות ב 100 x גרם בטמפרטורת החדר.
הערה: הפרוטופלסטים מוכנים כעת ליישומים במורד הזרם, כגון מיצוי RNA עם פנול ואיזותיוציאנט גואנידין.
תוצאות
הרקמה המתאימה ביותר לבידוד פרוטופלסטים היא העלים השני והשלישי של שתילים בני 10-11 ימים (איור 1). בעבודה זו השגנו כ-10 מיליון פרוטופלסטים מ-16 חלקי עלים, שכל אחד מהם היה באורך 10 ס"מ. מספר הפרוטופלסטים המבודדים תלוי במסת חומר העלה וברוחב פרוסות העלה המתעכלות בתמיסת האנזים.
תחת מיקרוסקופ אור בהיר, פרוטופלסטים שלא ניזוקו נראים בערך כדוריים, עם פלסטידים המנקדים את פני השטח (איור 2A). לפני שתמשיך transfection, הכדאיות ניתן לבדוק על ידי צביעת aliquot קטן של protoplasts עם diacetate fluorescein (FDA). פרוטופלסטים מוכתמים ב-FDA שפלואורסים תחת אור על-סגול נחשבים בני קיימא (איור 2B,C). לא כל הפרוטופלסטים שנראים לא פגומים הם עדיין בני קיימא, וייתכן שחלק מהפרוטופלסטים בני קיימא נמצאים בתהליך של גסיסה על-ידי פינוי (איור 2C). בתאים אלה, החללית מתנפחת ובסופו של דבר תיפלט מקרום התא.
איור 3 מראה פרוטופלסטים שעברו טרנספורמציה באמצעות pJT01, פלסמיד ביטוי תירס בנפח 4.3 קילו-בתים שנגזר מ-CD3-911 (ABRC)15. טרנספקציה גורמת לביטוי של sGFP המתויג עם אות לוקליזציה גרעינית מסוף C מ-c-Myc (איור 3A). שיעור הפרוטופלסטים המבטאים sGFP נמדד במהלך ניסויים מרובים באמצעות המוציטומטר. יעילות הטרנספקציה החציונית שהושגה בשיטה זו הייתה 40% לאחר דגירה לילית (n = 9, איור 4, טבלה 1), הדומה לשיטות15 שפורסמו בעבר. בהתאם ליישום הניסוי, אם ספריית הפלסמיד או הפלסמיד חסרה מדווח פלואורסצנטי, מומלץ לכלול בקרה חיובית כדי לאשר טרנספקציה.

איור 1: שתיל תירס מייצג שגדל בחשיכה במשך 10 ימים לאחר הנביטה. החיצים מציינים את העלים השני והשלישי, המתאימים ביותר לפרוטופלסטים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
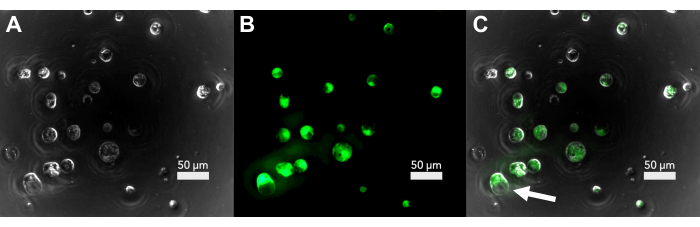
איור 2: מיקרוסקופ פלואורסצנטי של יכולת הקיום של הפרוטופלסט לאחר בידוד . (A) תמונת שדה בהיר של פרוטופלסטים מיד לאחר הבידוד. (B) אות הפלואורסצנטיות של הפרוטופלסטים המוכתמים ב-FDA. (C) חפיפה של שדה בהיר ופלואורסצנטיות המראה את הפרוטופלסטים הקיימים. החץ מראה פרוטופלסט שעובר פינוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
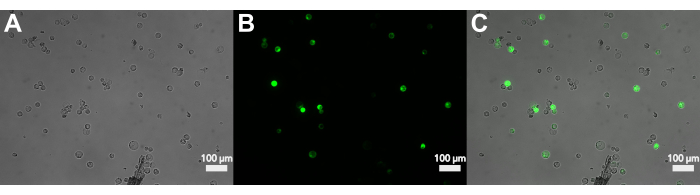
איור 3: מיקרוסקופ פלואורסצנטי של פרוטופלסטים שעברו טרנספקציה עם sGFP. (A) תמונת שדה בהיר של פרוטופלסטים לאחר טרנספקציה. (B) האות הפלואורסצנטי של הפרוטופלסטים הנגועים בתעלת GFP. (C) חפיפה של שדה בהיר ופלואורסצנטיות המראה את הפרוטופלסטים שעברו טרנספורמציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
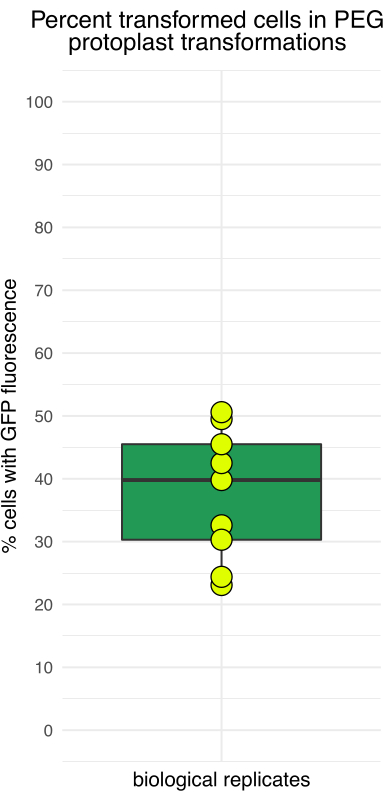
איור 4: אחוז הפרוטופלסטים המראים פלואורסצנטיות GFP לאחר 16 שעות של דגירה. יעילות הטרנספקציה השתנתה בין ניסויים עצמאיים, כאשר היעילות הנמוכה ביותר נעה סביב 20% והגבוהה ביותר קרוב ל-50%. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| בדיקה | תאי GFP נספרו | סה"כ תאים שנספרו | אחוז GFP |
| 1 | 104 | 261 | 39.8 |
| 2 | 148 | 298 | 49.5 |
| 3 | 84 | 258 | 32.6 |
| 4 | 137 | 271 | 50.6 |
| 5 | 127 | 299 | 42.5 |
| 6 | 107 | 235 | 45.5 |
| 7 | 83 | 360 | 23.1 |
| 8 | 134 | 549 | 24.4 |
| 9 | 61 | 201 | 30.3 |
| התכוון | 109 | 304 | 36 |
| סטיית תקן | 29 | 102 | 10 |
טבלה 1: יעילות טרנספקציה פרוטופלסט מייצגת. נתונים מתשעה ניסויים ראשונים שנערכו לאחרונה במעבדת המחברים.
קובץ משלים 1: קובץ טקסט בפורמט GenBank עם רצף של pJT01. פלסמיד ביטוי sGFP של 4.3 קילובייט משמש כבקרה חיובית בפרוטופלסטים של תירס נגוע. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
כפי שדווח בעבר, איכות החומר הצמחי המשמש לפרוטופלסטים חיונית להשגת פרוטופלסטים באיכות גבוהה16,17,18. חשוב לבחור עלים בריאים ללא פגם. עבודה זו השתמשה במחקר הפופולרי תירס זן B73. לא בדקנו זנים אחרים. שתילי התירס ששימשו לפרוטוקול זה גודלו בחושך מכיוון שעלים אטיולטים מייצרים פרוטופלסטים בעלי יכולת קיום גבוהה יותר 16 שעות לאחר הטרנספקציה בהשוואה לפרוטופלסטים מעלים ירוקים. עבור יישומים שאינם דורשים דגירה לילה, שימוש בחומר עלים ירוק או ירוק יהיה אפשרי.
שלב קריטי הוא חיתוך נכון של חומר העלה לפרוסות דקות לפני העיכול האנזימטי. תהליך זה מגדיל את שטח הפנים של תאי מזופיל להיחשף לתמיסת האנזים, מה שמגדיל את מספר הפרוטופלסטים המוחזרים. קצות העלים הדיסטליים מושלכים, ופרוסות דקות (≤1 מ"מ) נחתכות עם סכיני גילוח חדשים, אשר מוחלפים מיד כאשר הם מתחילים להקהות. עבור כמות נתונה של רקמה, פרוסות דקות יותר מניבות יותר פרוטופלסטים בתנאי שמשתמשים בטכניקה הנכונה כדי למזער את ריסוק העלים.
שטיפת הפרוטופלסטים בצורה נכונה חשובה גם היא, שכן הם עדינים למדי לאחר שעברו הסרת דופן התא. לאחר העיכול, כל התמיסות נשמרות על קרח, והפרוטופלסטים הכהים מוגנים מפני אור. האוסמולריות וה- pH חוצצים על ידי ביצוע השטיפות בתמיסת MMG. כדי לבודד את הפרוטופלסטים מהפסולת התאית הפחות צפופה, הצנטריפוגה מתבצעת ב 100 x גרם. פרוטופלסטים שצנטריפוגות במהירות של 200 x גרם מראות כדאיות דומה לאחר בידוד, אך כדאיות נמוכה יותר למחרת, והן משתנות כמחצית. אנו ממליצים לבדוק את הכדאיות של הפרוטופלסטים על ידי צביעה ב- FDA (fluorescein diacetate) מיד לאחר הבידוד; הכדאיות הנורמלית נעה בין 70%-90%. פרוטופלסטים עם כדאיות נמוכה מ-40% לאחר בידוד מניבים מעט טרנספורמנטים.
Pelleting ושטיפה קלים יותר כאשר עובדים עם protoplasts רבים כי גלולה גלוי בבירור מתקבל לאחר transfection. מסיבה זו, transfection מבוצעת עם 1 מיליון או יותר protoplasts. בעת הרחבת הפרוטוקול, יש לבחור כלי בגודל מתאים לשלבי הדגירה (1.5 מ"ל, 15 מ"ל או 50 מ"ל צינור צנטריפוגה), ולהגדיל את נפח התמיסה המשמשת לשלבי השטיפה בהתאם. בכל מקרה, כדאי לצנטריפוגה באליציטוטים של ≤10 מ"ל כדי להבטיח שהפרוטופלסטים לא יישארו בסופרנטנט. אחד החידושים של פרוטוקול זה הוא הסרת שלב הדגירה והשטיפה של שעה בתמיסת W5 המופיע בפרוטוקולים אחרים14,19, שהתברר כמיותר בידינו.
כפי שניתן לראות במחקרים אחרים, כמות ואיכות הדנ"א הן קריטיות להעברה מוצלחת19. עבור פלסמידים בטווח של 4-6 קילובייט, 15 מיקרוגרם DNA משמש לכל מיליון פרוטופלסטים. תכשירי DNA באיכות ירודה עלולים לגרום לירידה בכדאיות לאחר ההדבקה, ולכן אנו ממליצים להשתמש בערכת מיצוי DNA מסחרית בעת בידוד פלסמידים מחיידקים. הדגירה של הפרוטופלסטים למשך הלילה נעשית בטמפרטורת החדר בחושך כדי לאפשר שעתוק של ספריית הפלסמיד או הפלסמיד תוך מזעור מתח. לאחר דגירה של לילה, כמחצית ממספר הפרוטופלסטים המקוריים מתאוששים. פרוטופלסטים מדוללים לריכוז של 500-1,000 תאים/μL לצורך דגירה של לילה. פרוטופלסטים שהושארו לדגור לילה בריכוזים גבוהים מ-1,000 תאים/μL הם בעלי שיעורי התאוששות נמוכים יותר וכדאיות נמוכה יותר. בריכוזים גבוהים יותר, פסולת מפרוטופלסטים פגומים ומתים עלולה לתרום למותם של פרוטופלסטים שכנים. שטיפת הפרוטופלסטים לאחר דגירה של לילה משמשת הן להסרת פסולת זו והן להסרת הפלסמיד העודף.
פרוטוקולים כגון אלה יש את המגבלה כי לא כל מיני צמחים או סוגי רקמות מקובלים protoplasting. יתר על כן, הבדלים בביטוי גנים עשויים להיגרם על ידי תהליך protoplast.
לסיכום, פירטנו פרוטוקול פשוט וניתן להרחבה כדי לבודד ולהדביק מיליוני פרוטופלסטים בני קיימא מהיבול החקלאי העיקרי Z. mays. שיטה זו יכולה להדביק הרבה יותר פרוטופלסטים באמצעות PEG, עם יעילות טרנספורמציה גבוהה כמעט כמו שיטות מבוססות אלקטרופורציה15. המספר נטו הגדול יותר של טרנספורמטורים מאפשר בדיקה של מאות או אלפי מבנים בניסויים בקנה מידה גדול כגון מבחני כתב מקבילים מסיביים12,13. ניסויים עתידיים בקנה מידה גנומי בתירס יאפשרו למדענים להבין טוב יותר את ביטוי הגנים בתירס ואת בקרת הגנים.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לחקר הגנום האנושי הכשרה בין-תחומית במדעי הגנום (מענק הכשרה T32 מס' HG000035 ל- J.T.) והמכון הלאומי לבריאות (NIGMS 1R35GM139532 ל- C.Q.) ועל ידי הקרן הלאומית למדע (RESEARCH-PGR IOS-1748843 ו- PlantSynBio 2240888 ל- CQ). אנו מודים לאנדראה גאלובאטי מאוניברסיטת ראטגרס על מתנת זרעי התירס.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL graduated microcentrifuge tubes | VWR | 490004-444 | |
| 15 mL Falcon conical centrifuge tube | Corning | 05-527-90 | |
| 250 mL Pyrex glass beaker | Fisher | 50-121-5005 | |
| 40 um nylon mesh cell strainer | Fisher | 22363547 | |
| 50 mL Falcon tube | Corning | 14-432-22 | |
| 72 cell propagation tray | T.O. Plastics | 725607C | |
| Aluminum foil | VWR | 89107-732 | |
| Bell jar | Bel-Art | F42022-0000 | |
| Benchtop centrifuge | Eppendorf | 5424-R | |
| Beta-mercaptoethanol | Sigma-Aldrich | M6250-250ML | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Bovine serum albumin | Sigma-Aldrich | A2153 | |
| Calcium chloride dihydrate (CaCl2*2H2O) | PhytoTech Labs | C135 | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Cellulase Onozuka R-10 | Duchefa Biochemie | C8001.0010 | |
| D-Mannitol | PhytoTech Labs | M562 | |
| Dissecting scope | Reichert | Microstar IV | |
| Fluorescein Diacetate (FDA) | Thermofischer Scientific | F1303 | Dissolve in acetone at 0.5% weight/volume to make a 1000X stock solution. Protect from light and store at -20 °C. |
| Fluorescence Illumination Systems | Prior | Lumen200 | |
| Fluorescence microscope | Leica | MDG36 | |
| High-capacity centrifuge | Eppendorf | 5810 R | |
| Macerozyme | Duchefa Biochemie | M8002.0005 | |
| Magnesium chloride (MgCl2) | Sigma-Aldrich | M292-1KG | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Maize seeds | B73 | USDA-ARS | https://npgsweb.ars-grin.gov/gringlobal/accessiondetail?accid=PI+550473 |
| Medium binder clip | Uline | S-24649 | |
| MES | Sigma-Aldrich | M5287-250G | Dissolve in ultrapure H2O to make a 1M stock solution. Adjust pH to 5.7 using KOH. Protect from light and store at room temperature. |
| Micropipette 20-200 uL | Gilson | F123601G | |
| Nanodrop microvolume spectrophotometer | Thermofischer Scientific | ND-1000 | |
| NEB 5-alpha competent E. coli | New England BioLabs | C2987H | |
| Neubauer hemocytometer | Daigger Scientific | EF16034F | |
| No. 9 Single-edge razor blade | Excel | 20009 | |
| Orbital shaker | VWR | 89032-104 | |
| Poly(ethylene) glycol 4,000 | Sigma-Aldrich | 81240-1KG | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541-1KG | Dissolve in ultrapure H2O to make a 1M stock solution. Store at room temperature. |
| Professional Grade Vermiculite | NK Lawn & Garden | G208 | |
| Round-bottom glass centrifuge tube 30 mL | Kimble Chase | 45500-30 | |
| Rubber adapter for Corex centrifuge tubes | Corning | CLS8445AO | |
| Sphagnum peat moss | Premier Horticulture | 0128P | |
| TRIzol Reagent | Thermofischer Scientific | 15596018 | |
| Tygon vacuum tubing | VWR | 76336-844 | |
| Vacuum gauge | Wika | 4269978 |
References
- Jiang, F., Zhu, J., Liu, H. -. L. Protoplasts: A useful research system for plant cell biology, especially dedifferentiation. Protoplasma. 250 (6), 1231-1238 (2013).
- Wang, S., Tiwari, S. B., Hagen, G., Guilfoyle, T. J. AUXIN RESPONSE FACTOR7 restores the expression of auxin-responsive genes in mutant Arabidopsis leaf mesophyll protoplasts. The Plant Cell. 17 (7), 1979-1993 (2005).
- Hirner, A., et al. Arabidopsis LHT1 is a high-affinity transporter for cellular amino acid uptake in both root epidermis and leaf mesophyll. The Plant Cell. 18 (8), 1931-1946 (2006).
- Hwang, I., Sheen, J. Two-component circuitry in Arabidopsis cytokinin signal transduction. Nature. 413 (6854), 383-389 (2001).
- Tan, M. -. L. M. C., Rietveld, E. M., van Marrewijk, G. A. M., Kool, A. J. Regeneration of leaf mesophyll protoplasts of tomato cultivars (L. esculentum): Factors important for efficient protoplast culture and plant regeneration. Plant Cell Reports. 6 (3), 172-175 (1987).
- Brandt, K. M., Gunn, H., Moretti, N., Zemetra, R. S. A streamlined protocol for wheat (Triticum aestivum) protoplast isolation and transformation with CRISPR-Cas ribonucleoprotein complexes. Frontiers in Plant Science. 11, 769 (2020).
- Nadakuduti, S. S., et al. Evaluation of methods to assess in vivo activity of engineered genome-editing nucleases in protoplasts. Frontiers in Plant Science. 10, 110 (2019).
- OECD, Food and Agriculture Organization of the United Nations. OECD-FAO Agricultural Outlook 2021-2030. OECD, Food and Agriculture Organization of the United Nations. , (2021).
- Gallois, P., Marinho, P. Leaf disk transformation using Agrobacterium tumefaciens-expression of heterologous genes in tobacco. Plant Gene Transfer and Expression Protocols. 49, 39-48 (1995).
- Schäffner, A. R., Sheen, J. Maize rbcS promoter activity depends on sequence elements not found in dicot rbcS promoters. The Plant Cell. 3 (9), 997-1012 (1991).
- Sheen, J. Molecular mechanisms underlying the differential expression of maize pyruvate, orthophosphate dikinase genes. The Plant Cell. 3 (3), 225-245 (1991).
- Jores, T., et al. Identification of plant enhancers and their constituent elements by STARR-seq in tobacco leaves. The Plant Cell. 32 (7), 2120-2131 (2020).
- Jores, T., et al. Synthetic promoter designs enabled by a comprehensive analysis of plant core promoters. Nature Plants. 7 (6), 842-855 (2021).
- Ricci, W. A., et al. Widespread long-range cis-regulatory elements in the maize genome. Nature Plants. 5 (12), 1237-1249 (2019).
- Sheen, J. Signal transduction in maize and Arabidopsis mesophyll protoplasts. Plant Physiology. 127 (4), 1466-1475 (2001).
- Jeon, J. M., et al. Efficient transient expression and transformation of PEG-mediated gene uptake into mesophyll protoplasts of pepper (Capsicum annuum L.). Plant Cell, Tissue and Organ Culture. 88 (2), 225-232 (2007).
- Pindel, A. Optimization of isolation conditions of Cymbidium protoplasts. Folia Horticulturae. 19, 79-88 (2007).
- Ren, R., et al. Highly efficient leaf base protoplast isolation and transient expression systems for orchids and other important monocot crops. Frontiers in Plant Science. 12, 626015 (2021).
- Yoo, S. -. D., Cho, Y. -. H., Sheen, J. Arabidopsis mesophyll protoplasts: A versatile cell system for transient gene expression analysis. Nature Protocols. 2 (7), 1565-1572 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved