Method Article
نظام زراعة كبدي بشري بالكامل لتطبيقات تطوير الأدوية
In This Article
Summary
مكنت التطورات التقنية الحديثة من الإنتاج الموسع لمنصة في المختبر لتطبيقات استقلاب الأدوية والسمية. يوفر نظام الكبد 2D + البشري بالكامل (TV2D +) نتائج ذات صلة من الناحية الفسيولوجية باستخدام طرق الثقافة التقليدية ثنائية الأبعاد. سيدعم هذا البروتوكول المستخدمين النهائيين في إعداد النظام وصيانته وتطبيقه.
Abstract
لا يزال العثور على نموذج ثقافي طويل الأجل ذي صلة بالإنسان لخلايا الكبد البشرية الأولية (PHHs) للدراسات الدوائية والسمية يمثل تحديا. غالبا ما تكون منصات النماذج الحالية في المختبر غير مريحة ومعقدة ، وتفتقر إلى استقرار النمط الظاهري بمرور الوقت ، ولا تدعم مجموعات PHH المتعددة ، وتفتقر إلى قابلية التكرار التجريبي والمرونة. هنا ، نقدم بروتوكولا مفصلا لإذابة وطلاء وصيانة نظام كبدي 2D + بشري بالكامل (TV2D +) ، والذي يستفيد من تقنيات ومعدات الاستزراع القياسية ثنائية الأبعاد (2D) مع الحفاظ على طول العمر والاستقرار الظاهري بمرور الوقت الذي يصاحب عادة أنظمة ثلاثية الأبعاد (3D) أكثر تعقيدا. أظهرت النتائج التعلق والنسبة المئوية للطلاء في TV2D + كدالة لكثافة البذر PHH ، بالإضافة إلى وظيفة مستقرة لمدة أسبوعين على الأقل في الثقافة. يتم تقييم مجموعة من كثافات بذر PHH لتحقيق ثقافة ناجحة على المدى الطويل. عند إنشائها بشكل صحيح ، يتم تنظيم PHHs في TV2D + في مستعمرات خلايا الكبد ، وتعبر عن علامة خاصة بالكبد ، وتحافظ على الجدوى ، والسلامة المعمارية ، والمستويات ذات الصلة من الناحية الفسيولوجية من الألبومين واليوريا. هذا المزيج الفريد من السمات يجعل نظام TV2D + نموذجا كبديا مناسبا لمجموعة متنوعة من التطبيقات الدوائية والسمية.
Introduction
يعد التنبؤ بالسلامة العلاجية وفعاليتها جزءا مهما من تطوير الأدوية قبل السريرية. ومع ذلك ، فإن النماذج الكبدية التقليدية قبل السريرية في المختبر محدودة في قدرتها على محاكاة البيئة الدقيقة الخلوية للكبد في الجسم الحي بدقة والحفاظ على وظائف خلايا الكبد ومورفولوجيتها بمرور الوقت. هناك حاجة للنماذج التي توفر كفاءة التمثيل الغذائي مستقرة لأكثر من 1 أسبوع لتقييم المركبات بطيئة الدوران أو التحقيق في النتائج المرتبطة بالتعرض شبه الحاد أو المزمن. غالبا ما تفشل الاختبارات الحيوانية في الجسم الحي في التنبؤ بفعالية الدواء ومخاطره بسبب اختلافات الأنواع الانتقالية في آليات إزالة الكبد البشري1. تفتقر النماذج الكبدية الحالية في المختبر ثنائية الأبعاد (2D) ، مثل الزراعة الأحادية التقليدية لخلايا الكبد البشرية الأولية (PHH) أو مزارع الساندويتش ، إلى استقرار النمط الظاهري وطول العمر في الثقافة ، مما يؤدي إلى فقدان وظيفة الخلايا الكبدية الرئيسية والسلامة المعمارية بمرور الوقت2. تتضمن الطريقة البديلة تكوين كرويات خلايا الكبد ثلاثية الأبعاد (3D) ، مما يوفر بيئة دقيقة أكثر صلة مقابل ثقافة 2D. ومع ذلك ، فإن هذه الطريقة محدودة بتوافر المواد الخام ، واختيار مجموعة المانحين PHH ، والتكاثر ، وفقدان الصلاحية مع زيادة حجم الكرة3،4،5،6. تم إدخال منصات متعددة الخلايا حيث يتم زرع PHHs بخلايا مغذية على ألواح ثابتة الحجم ومنقوشة دقيقة. على الرغم من أن هذه النماذج قد تتيح أوقات زراعة أطول ، إلا أن الخلايا المغذية غير البشرية المستخدمة في هذه المنصات يمكن أن تغير النتائج التجريبية وتحد من تطبيقها بسبب مساهمة الخلفية الفطرية في إزالة الأدوية والملامح الأيضية 1,7. تم تطوير نظام TruVivo الكبدي 2D + البشري بالكامل (TV2D +) الموصوف مؤخرا في Weaver ، et al8 ، لمعالجة بعض قيود طرق الثقافة التقليدية والمشتركة و 3D ل PHHs. تقلل الخلايا المغذية غير الكبدية من الاختلافات بين الأنواع في التمثيل الغذائي وإنتاج الباراكرين وتوفر الدعم اللازم لخلايا الكبد الأولية بطريقة قابلة للتكرار وقوية لا يمكن توفيرها بواسطة خلايا الكبد غير المتنية المقابلة من متبرع واحد بسبب القيود في التوسع والنمط الظاهري والأداء. كانت الخلايا المغذية المختارة قادرة على التوسع باستمرار قبل الاستخدام وتفتقر إلى الحاجة إلى التحول أو التمايز. كما هو موضح من قبل Glicklis et al.4 و Khetani et al.5 ، تواجه نماذج الثقافة ثلاثية الأبعاد مثل كرويات خلايا الكبد تحديات في التكاثر بسبب تباين المانحين والحفاظ على الاتساق في حجم الكرة ، مما يؤثر على انتشار المغذيات في الكرويات أكبر من 200 ميكرومتر ، مما يؤدي إلى انخفاض الجدوى والوظائف. مثل تشكيل كروي 3D ، يعتمد نظام TV2D + على التجميع الذاتي ل PHHs ؛ ومع ذلك ، فإن مستعمرات PHH المتكونة منتشرة على مساحة سطح البئر على عمق خلية واحدة بدلا من ضغطها في مجموعة واحدة. قد تكون طريقة الاستزراع هذه مفيدة لمعالجة تباين الجهات المانحة ، مما يسمح بطلاء PHHs واستزراعها والحفاظ على الوظائف الأساسية بكثافات البذر المختلفة. قد يزيد نظام TV2D + أيضا من متانة تعامل المستخدم بسبب الخسارة أثناء التلاعب أو المعدات المتخصصة المطلوبة لأداء ثقافة ممتدة في كرويات ثلاثية الأبعاد.
يجمع نظام TV2D + بين ثقافة ثنائية الأبعاد القياسية وطول العمر والاستقرار الظاهري الذي يصاحب عادة أنظمة 3D. يوفر البروتوكول الموصوف هنا توجيهات خطوة بخطوة للمستخدمين ذوي المهارات الأساسية لزراعة الأنسجة في المختبرات المجهزة بمعدات قياسية مثل خزانات السلامة الحيوية وأجهزة الطرد المركزي وحاضنات CO2 . يتم تحديد كل خطوة في العملية بالتفصيل ، بما في ذلك إعداد الوسائط ، والذوبان ، والطلاء ، وصيانة نظام الاستزراع الناتج. يحتوي البروتوكول أيضا على طريقة لتحديد مخرجات وظائف خلايا الكبد الأساسية ، والألبومين ، واليوريا ، بالإضافة إلى تحليل الصورة المناعية لتحديد ارتباط PHH للتطبيع. عند إنشائها بشكل صحيح ، يتم تنظيم PHHs في TV2D + في مستعمرات خلايا الكبد ، ومحاكاة مورفولوجيا الكبد الأصلية ، والحفاظ على قابلية ممتدة ، والسلامة المعمارية ، والمستويات ذات الصلة من الناحية الفسيولوجية من الألبومين واليوريا لمدة أسبوعين على الأقل8. نظرا لأن النظام يمكن أن يسمح بمجموعة من كثافات بذر PHH ، فقد يكون مفيدا في زيادة توافر قطع PHH الأقل قابلية للطلاء والتي لها خصائص مانحة مرغوبة. هذا المزيج من إمكانية الوصول والوظائف يجعل TV2D + نموذجا كبديا مناسبا لمجموعة متنوعة من التطبيقات الدوائية والسمية.
Protocol
يتبع هذا البروتوكول إرشادات لجنة الأخلاقيات في Lifenet Health. لا تحتوي المخطوطة على أي دراسات مع مشاركين بشريين أو دراسات حيوانية أجراها أي من المؤلفين. تم عزل جميع الخلايا من أنسجة المتبرع بالموافقة الكاملة لأغراض البحث من قبل Lifenet Health.
1. إعداد المتوسطة
- قم بإذابة زجاجة واحدة لكل وسط ذوبان خلية مغذية ، والملحق A ، والملحق B ، والملحق C (انظر جدول المواد) في حمام مائي 37 درجة مئوية أو 16-24 ساعة عند 4 درجات مئوية.
- قسمة الزجاجة بأكملها (10 مل) من وسط إذابة الخلايا المغذية في أنبوب مخروطي 15 مل أو 50 مل.
ملاحظة: سيكون من الأسهل عرض حجم حبيبات الخلية باستخدام أنبوب مخروطي سعة 15 مل. - أضف 4.5 مل من الملحق B و 11 مل من الملحق A إلى زجاجة واحدة من وسط الطلاء (75 مل) (انظر جدول المواد) لعمل وسط طلاء كامل.
ملاحظة: يحتوي وسط الطلاء الكامل على تركيز FBS <5٪ v / v. - في زجاجة منفصلة ، أضف 100 مل من وسط الاستزراع (انظر جدول المواد) ، و 1 مل مكمل C ، و 14 مل مكمل A لعمل وسط استزراع كامل.
ملاحظة: يحتوي وسط الاستزراع الكامل على تركيز FBS <1٪ v / v - يخزن المكمل المتبقي C والملحق A في درجة حرارة -20 درجة مئوية حتى الأسبوع 2 من التحضير المتوسط.
ملاحظة: دورات التجميد والذوبان المتكررة ستقلل من العمر الافتراضي للمكملات الغذائية. يوصى بتجميد ذوبان الجليد مرة واحدة فقط. - قبل الاستخدام ، قم بتسخين 10 مل من وسط إذابة الخلايا المغذية ، ووسط ذوبان خلايا الكبد ، ووسط الطلاء الكامل ، ووسط الاستزراع الكامل لمدة 20-30 دقيقة في حمام مائي 37 درجة مئوية.
2. إذابة خلايا التغذية البشرية وعدها وطلائها (الشكل 1 أ)
- قم بزراعة الخلايا المغذية حوالي 1 ساعة قبل بذر PHHs. قم بإذابة خلايا التغذية (انظر جدول المواد) في حمام مائي 37 درجة مئوية لمدة 1-2 دقيقة.
ملاحظة: تجنب التعرض لفترات طويلة (على سبيل المثال ، >2 دقيقة) عن طريق مراقبة ذوبان الجليد وإزالة القارورة عندما يصبح السائل فضفاضا في cryovial عند قلبه. - مباشرة بعد ذوبان الجليد ، ضع الخلايا المغذية على الجليد.
- باستخدام تقنيات التعقيم ، في خزانة السلامة الحيوية (BSC) ، أضف الخلايا المذابة حديثا إلى 10 مل من وسط ذوبان الخلايا المغذية.
- استخدم ماصة سعة 1000 ميكرولتر لغسل القارورة مرة واحدة باستخدام 1 مل من معلق متوسط الخلية / الذوبان وجمعها.
- تدور عند 400 × جم لمدة 4 دقائق في درجة حرارة الغرفة (RT).
- تخلص بعناية من المادة الطافية حتى لا تزعج حبيبات الخلية عن طريق السحب أو الشفط بالتفريغ. أعد تعليق حبيبات الخلية في 1 مل من وسط الطلاء الكامل وعد الخلايا المغذية.
ملاحظة: يمكن عد الخلايا المغذية باستخدام برتقال الأكريدين ويوديد البروبيديوم (AOPI) على عداد الخلايا الآلي أو التريبان الأزرق باستخدام مقياس الدم. قد يختلف عدد الخلايا حسب التكنولوجيا والمستخدم. للحصول على أفضل النتائج ، عد العينات المكررة وحافظ على اتساقها في المنهجية المختارة. - قم بتخفيف تعليق الخلية إلى 100000 خلية / مل باستخدام وسط الطلاء الكامل.
- لوحة 500 ميكرولتر (50000 خلية) لكل بئر من تعليق الخلية المخففة على لوحة 24 بئر مطلية بالكولاجين (انظر جدول المواد).
- هز اللوحة في حركة الشمال (N) - الجنوب (S) - الشرق (E) - الغرب (W) باستخدام حركة ذهابا وإيابا في اتجاه N-S 2 مرات متبوعة بنفس الحركة E-W. كرر بروتوكول الاهتزاز هذا 2 مرات أكثر لما مجموعه 3 جولات.
ملاحظة: قم بالاهتزاز باستخدام قوة معتدلة لتجنب تناثر غطاء اللوحة مع الاستمرار في المساعدة في توزيع الخلايا (يرجى الرجوع إلى الفيديو). - احتضان في درجة حرارة 37 درجة مئوية / 5٪ CO2 لمدة 60 دقيقة.
- عرض مرفق الخلية المغذية قبل الشروع في إذابة خلايا الكبد.
ملاحظة: يكون مرفق خلية وحدة التغذية المقبول متقاربا بصريا بنسبة 50٪ تقريبا.
3. إذابة خلايا الكبد البشرية الأولية وعدها وطلائها (الشكل 1 ب)
- بعد 30 دقيقة من زراعة الخلايا المغذية ، قم بتصفية وسط إذابة خلايا الكبد الدافئة مسبقا من خلال وحدة مرشح بولي إيثر سلفون (PES) 0.2 ميكرومتر.
- قم بإذابة PHHs في حمام مائي على حرارة 37 درجة مئوية لمدة 1-2 دقيقة.
ملاحظة: تجنب التعرض لفترات طويلة (على سبيل المثال ، >2 دقيقة) عن طريق مراقبة ذوبان الجليد وإزالة القارورة عندما يصبح السائل فضفاضا في cryovial عند قلبه. - مباشرة بعد ذوبان الجليد ، ضع PHHs على الجليد.
- في BSC ، صب تعليق PHH في وسط ذوبان خلايا الكبد.
ملاحظة: تجنب سحب معلقات خلايا PHH عندما يكون ذلك ممكنا. من الأهمية بمكان عدم إجراء أي سحب أثناء نقل PHHs المذابة من الوسط المبرد إلى وسط الذوبان. - استخدم ماصة سعة 1000 ميكرولتر لغسل القارورة 3-4 مرات عن طريق سحب 1 مل من معلق خلايا الكبد / الذوبان المتوسط برفق في القارورة وجمع الغسيل عن طريق سكبه مرة أخرى في وسط الذوبان.
- قم بتغطية تعليق PHH المذاب وعكسه برفق 5 مرات.
- تدور عند 100 × جم لمدة 8 دقائق في RT.
- تخلص بعناية من المادة الطافية حتى لا تزعج حبيبات الخلية عن طريق السحب أو الشفط بالتفريغ. إلى جدار الأنبوب المخروطي ، أضف 3 مل من وسط الطلاء الكامل.
- صخرة الأنبوب المخروطي من جانب إلى آخر لإعادة تعليق حبيبات الخلية.
- أضف 5 مل إضافية من وسط الطلاء الكامل إلى خلايا الكبد المعاد تعليقها.
- عد PHHs.
ملاحظة: يمكن حساب PHHs باستخدام AOPI على عداد خلية آلي أو تريبان أزرق باستخدام مقياس الدم. قد يختلف عدد الخلايا حسب التكنولوجيا والمستخدم. للحصول على أفضل النتائج ، عد العينات المكررة وحافظ على اتساقها في المنهجية المختارة. - قم بتخفيف معلق الخلية إلى كثافة البذر المطلوبة (300000-600000 PHHs / mL) باستخدام وسط الطلاء الكامل.
ملاحظة: قد تختلف كثافة بذر خلايا الكبد المثلى من دفعة إلى أخرى. سيتم توفير كثافة البذر الموصى بها لقطعة معينة في شهادة التحليل (COA). استخدم المعادلة الآتية لتحديد خلايا الكبد/مل للوحة مكونة من 24 بئرا.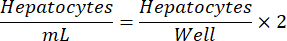
- من خلايا التغذية المطلية ، قم بإزالة الوسط عن طريق السحب أو شفط الفراغ.
ملاحظة: لضمان صلاحية خلايا التغذية ، يوصى بتغيير ما لا يزيد عن 3 آبار في المرة الواحدة. - صفيحة فورية 500 ميكرولتر (150,000-300,000 خلية) لكل بئر من معلق خلايا الكبد المخففة على صفيحة الكولاجين المغلفة مسبقا المكونة من 24 بئرا والتي تحتوي على خلايا مغذية.
- هز اللوحة في حركة N-S-E-W باستخدام حركة ذهابا وإيابا في اتجاه N-S 2 مرات متبوعة بنفس الحركة E-W. كرر بروتوكول الاهتزاز هذا 2 مرات أكثر لما مجموعه 3 جولات.
ملاحظة: قم بالاهتزاز باستخدام قوة معتدلة لتجنب تناثر غطاء اللوحة مع الاستمرار في المساعدة في توزيع الخلايا. - احتضان عند 37 درجة مئوية / 5٪ CO2 لمدة 2-4 ساعات. لأول 60 دقيقة من الثقافة ، هز اللوحة كل 15 دقيقة في حركة N-S-E-W كما في الخطوة 3.15 أعلاه.
- بعد الحضانة ، قم بإزالة اللوحة من الحاضنة ووضعها في BSC.
- هز اللوحة وإزالة وسط الطلاء الكامل عن طريق سحب أو شفط فراغ.
ملاحظة: لضمان صلاحية الثقافة ، يوصى بتغيير ما لا يزيد عن 3 آبار في المرة الواحدة. - أضف على الفور 500 ميكرولتر من وسط الاستزراع الكامل المسخن مسبقا إلى كل بئر.
4. الصيانة
- القسمة ووسط الاستزراع الكامل قبل التسخين في حمام مائي 37 درجة مئوية لمدة 20-30 دقيقة. هناك حاجة إلى حوالي 13.5 مل من الوسط للوحة واحدة من 24 بئرا.
- قم بتغذية المستنبتات يوميا ب 500 ميكرولتر لكل بئر من وسط الاستزراع الكامل الطازج الذي تم تسخينه مسبقا.
ملاحظة: لضمان صلاحية الثقافة ، يوصى بتغيير ما لا يزيد عن 3 آبار في المرة الواحدة. - قم بإعداد وسط ثقافة كامل طازج كل 7 أيام.
5. جمع عينات طاف الثقافة لقياس الألبومين واليوريا
- في الأيام 7 و 10 و 14 ، اجمع 500 ميكرولتر من الوسط من بئر (آبار) العينة المطلوبة في أنبوب (أنابيب) الطرد المركزي الدقيقة ، كما هو موضح في الشكل 1C.
- قم بتدوير العينة (العينات) عند 320 × جم لمدة 10 دقائق عند 4 درجات مئوية لحطام الحبيبات.
- استخدم ماصة لنقل عينة (طقات) إلى أنبوب (أنابيب) طرد مركزي دقيق جديد ، وتجنب تعطيل الحبيبات.
- قم بتشغيل العينات على مقايسة الألبومين و / أو اليوريا (انظر القسمين 10 و 11 ، على التوالي).
ملاحظة: يمكن تخزين العينات في -20 درجة مئوية إلى -80 درجة مئوية لمدة 2 أسابيع.
6. تلطيخ اليوم الأول
تنبيه: يحتوي مخزن التثبيت المؤقت على بارافورمالدهيد. يمكن أن يسبب بارافورمالدهيد تلف العين وتهيج الجلد وسمية الأعضاء. العمل في منطقة ذات تهوية جيدة وارتداء معدات الحماية الشخصية المناسبة (PPE).
- بعد جمع العينات المتوسطة في اليوم 14 ، أضف 300 ميكرولتر من مخزن التثبيت المؤقت (انظر جدول المواد) إلى كل بئر ليتم تلطيخها ، كما هو موضح في الشكل 1C. وصمة عار ما لا يقل عن 2 آبار.
- احتضان في 4 درجة مئوية لمدة 20-60 دقيقة.
- قم بإعداد مخزن مؤقت للنفاذية 1x (انظر جدول المواد) بإضافة 5 مل من محلول مخزون 10x إلى 45 مل من 1x PBS (انظر جدول المواد).
ملاحظة: يمكن تخزين المخزن المؤقت للنفاذية 1x عند 4 درجات مئوية لمدة شهر واحد. - يغسل 2 مرات مع 300 ميكرولتر من 1x العازلة نفاذية على الجليد.
- أضف 300 ميكرولتر من السيتوكيراتين 18 للأجسام المضادة الأولية (انظر جدول المواد) باستخدام تخفيف 1: 1000 في مخزن مؤقت نفاذية 1x على الجليد.
ملاحظة: الحد الأدنى ، احتضان بئر واحد مع 1x العازلة نفاذية فقط للتحكم الثانوي في الأجسام المضادة فقط. - احتضان 16-24 ساعة عند 4 درجات مئوية.
7. تلطيخ اليوم الثاني
- في اليوم التالي ، قم بإزالة الجسم المضاد الأساسي عن طريق السحب أو الشفط بالتفريغ.
- يغسل 2 مرات مع 300 ميكرولتر لكل بئر من 1x العازلة نفاذية على الجليد.
- أضف 300 ميكرولتر من الأجسام المضادة الثانوية الفلورية (انظر جدول المواد) باستخدام تخفيف 1: 500 في مخزن مؤقت نفاذية 1x (بما في ذلك التحكم الثانوي فقط).
ملاحظة: تجنب الضوء عند استخدام الأجسام المضادة الفلورية. - احتضان لمدة 30-45 دقيقة في 4 درجات مئوية في الظلام.
- قم بإزالة الجسم المضاد الثانوي عن طريق السحب أو الشفط بالتفريغ.
- يغسل 2 مرات مع 300 ميكرولتر لكل بئر من 1x العازلة نفاذية على الجليد.
- اغسل مرة واحدة مع 300 ميكرولتر لكل بئر من 1x PBS.
- أضف 150 ميكرولتر من وسط تركيب 4 ′ ، 6-diamidino-2-phenylindole (DAPI) (انظر جدول المواد) إلى كل بئر واحتضانها لمدة 15 دقيقة في RT في الظلام.
ملاحظة: يمكن لف اللوحة في بارافيلم وتخزينها في 4 °C في الظلام لمدة 1 أسبوع. - عرض تحت المجهر الفلورسنت. التقط 5 صور لكل قناة فلورسنت محددة لكل بئر باستخدام عدسة الهدف 10x (تأكد من أن الصورة الواحدة بها شريط مقياس).
ملاحظة: DAPI لديه إثارة / انبعاث 358 نانومتر / 461 نانومتر. استخدم مجهرا فلوريا مزودا بمرشحات الكشف المناسبة لكل من DAPI وفلوروفور الجسم المضاد الثانوي.
8. تحليل ImageJ (الشكل 2)
ملاحظة: يوصى باستخدام ImageJ الإصدار 1.52a أو أعلى.
- افتح صورة تحتوي على شريط مقياس في ImageJ. انقر فوق رمز الخط المستقيم وارسم خطا بالطول الدقيق لشريط المقياس [الشكل 2 (1)]
ملاحظة: إذا لزم الأمر، انقر فوق رمز العدسة المكبرة للتكبير أو التصغير. - انقر فوق علامة التبويب تحليل . ظلل وانقر فوق تعيين المقياس.
- قم بتغيير المسافة المعروفة إلى مسافة شريط المقياس. قم بتغيير وحدات الطول إلى وحدات شريط المقياس. قم بتطبيق الإعدادات عالميا عن طريق تحديد عالمي. انقر فوق موافق لضبط المقياس.
ملاحظة: بمجرد تطبيق هذا الإعداد ، ستعرض كل صورة مفتوحة المنطقة المحسوبة لمجال الرؤية في إدخال الوحدات من قبل المستخدم. - افتح صورة DAPI فقط في ImageJ. انقر فوق علامة التبويب العملية وقم بتمييز طرح الخلفية. قم بإزالة الخلفية 50 بكسل في المرة الواحدة حتى تصبح المناطق غير الملوثة سوداء.
ملاحظة: إذا كانت الصورة لا تحتوي على خلفية، فهذه الخطوة غير مطلوبة. - انقر فوق علامة التبويب صورة وقم بتمييز النوع. انقر فوق 8 بت لجعل الصورة ذات تدرج رمادي [الشكل 2 (2)].
- قم بعتبة الصورة يدويا أو تلقائيا لتضمين جميع جسيمات DAPI (توخ الحذر من تجاوز الحد يدويا) [الشكل 2 (3)]. انقر فوق علامة التبويب صورة وقم بتمييز ضبط. انقر فوق العتبة. انقر فوق تطبيق عند الانتهاء.
- انقر فوق علامة التبويب عملية وقم بتمييز ثنائي. انقر فوق مستجمعات المياه.
- انقر فوق علامة التبويب تحليل وقم بتمييز / انقر فوق تحليل الجسيمات [الشكل 2 (4)]. اضبط الحجم على 5 إلى ما لا نهاية والدائرية إلى 0.00-1.00. في علامة التبويب المنسدلة إظهار ، حدد المخططات التفصيلية. تأكد من تحديد نتائج العرض والتلخيص وتضمين الثقوب . انقر فوق موافق.
ملاحظة: يمكن ضبط نطاق الجسيمات المطلوب إذا كانت العتبة تنتج وحدات بكسل في الخلفية. - سجل نتيجة العد ك إجمالي DAPI.
- افتح صورة Cytokeratin 18/DAPI مدمجة في ImageJ.
- استخدم رمز متعدد النقاط [الشكل 2 (5)] لحساب جميع جزيئات DAPI غير الملوثة بالسيتوكيراتين 18 يدويا.
- سجل النتيجة كخلايا مغذية. استخدم المعادلة الآتية لتحديد DAPI للخلايا الكبدية.
خلايا الكبد DAPI = إجمالي DAPI - خلية التغذية DAPI
9. تحديد كمية خلايا الكبد الكلية المرفقة ونسبة التعلق (قابلية التصفية)
- قم بإنشاء عامل مقياس لمنطقة الاستزراع المكونة من 24 بئرا باستخدام المعادلة أدناه. يمكن العثور على قياسات مجال الرؤية في الجزء العلوي من كل صورة مفتوحة [الشكل 2 (2) ، المربع الأخضر].
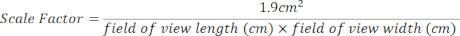
- احسب إجمالي خلايا الكبد المرتبطة باستخدام المعادلة الآتية.
خلايا الكبد المرفقة = عامل المقياس × خلايا الكبد DAPI - احسب النسبة المئوية لارتباط الخلايا الكبدية باستخدام المعادلة الآتية.
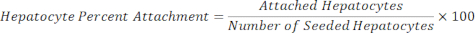
10. مقايسة الزلال
- قم بقياس إنتاج الألبومين باستخدام مقايسة الممتز المناعي المرتبط بإنزيم الساندويتش (ELISA) (انظر جدول المواد) على العينات المخففة عند 1: 200.
ملاحظة: للتأكد من دقتها، يؤكد المستخدم أن العينات تقع ضمن النطاق الخطي للمنحنى القياسي. توفر المجموعة المحددة جميع المواد والتعليمات لإجراء الفحص. - تطبيع تركيزات العينة مع الخلايا الكبدية المرتبطة باستخدام المعادلة الآتية.
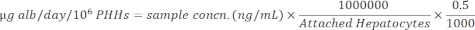
11. مقايسة اليوريا
تنبيه: يحتوي كاشف حمض نيتروجين اليوريا في الدم (BUN) على حمض الكبريتيك. يعتبر تركيز حمض الكبريتيك في كاشف حمض BUN مادة أكالة. لا تبتلعه. العمل في منطقة جيدة التهوية وارتداء معدات الوقاية الشخصية المناسبة.
- يتم قياس تخليق اليوريا باستخدام طريقة أحادية الأسيتيل المعدلة (انظر جدول المواد).
- قم بتخفيف 53.3 ميكرولتر من 75 مجم / ديسيلتر من اليوريا إلى 346.7 ميكرولتر من وسط الاستزراع الكامل لصنع معيار # 1 (100 ميكروغرام / مل)
- أنابيب التسمية 2-8 واستخدام التخفيف التسلسلي 1: 2 لجعل معايير فحص اليوريا (الجدول 1).
- أضف 10 ميكرولتر من العينة أو المعيار إلى آبار صفيحة 96 بئر ذات جدران سوداء وشفافة (انظر جدول المواد).
- أضف 150 ميكرولتر من كاشف BUN إلى كل عينة تحتوي على بئر. تحضير كاشف BUN عن طريق خلط 1/3 من كاشف اللون BUN مع كاشف حمض 2/3 BUN. استخدم المعادلة أدناه للمساعدة في العمليات الحسابية.
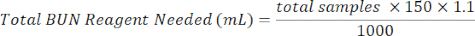
كاشف اللون BUN (مل) = إجمالي كاشف BUN المطلوب × 0.333
كاشف حمض BUN (مل) = إجمالي كاشف BUN المطلوب × 0.667 - احتضان الطبق لمدة 90 دقيقة في فرن أو حاضنة على حرارة 60 درجة مئوية.
- اقرأ امتصاص اللوحة على الفور عند 540 نانومتر و 650 نانومتر.
- قم بإنشاء منحنى قياسي عن طريق طرح امتصاص الفراغ والخلفية (650 نانومتر) من جميع العينات والمعايير. قم بإنشاء خط مناسب بشكل أفضل عن طريق تحليل الانحدار الخطي.
- تحديد تركيز العينة المجهول من المنحنى القياسي.
- تطبيع تركيزات العينة إلى خلايا الكبد المرتبطة باستخدام المعادلة الآتية.
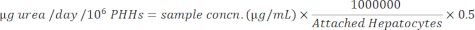
النتائج
تتضمن الطريقة الكلية للطلاء والاستزراع واختبار الوظائف الأساسية لجهاز الاستزراع الكبدي تقنيات وتحليل زراعة الخلايا الأولية الشائعة ، كما هو موضح في الشكل 1. تم حساب ارتباط خلايا الكبد والنسبة المئوية للطلاء في اليوم 14 باستخدام تحليل ImageJ لما لا يقل عن خمس صور ل Cytokeratin 18 و DAPI تلطيخ لكل بئر (الشكل 2). يوضح الشكل 3 صورا تمثيلية ل PHHs المستزرعة بالخلايا المغذية. أظهرت كثافات البذر الكبدية المختلفة اختلافات بصرية في التقاء بناء على كثافة البذر وحافظت على مورفولوجيا كبدية مكعبة نموذجية لمدة 14 يوما من الثقافة. تم التقاط صور لقطعتي المتبرعين بخلايا الكبد A و B لكل كثافة بذر مختبرة (الشكل 4 أ). كان متوسط النسبة المئوية للقابلية للطلاء للمتبرع B (89.04٪ ± 3.99٪ ، 198,552 ± 49,885 PHHs) أعلى من المتبرع A (66.08٪ ± 6.67٪ ، 146,128 ± 33,063 PHHs) عبر جميع كثافات البذر المستخدمة (الشكل 4 ب). كان لدى المتبرع أ قابلية أعلى بكثير للطلاء باستخدام 150,000 PHHs / بئر (76.07٪ ± 12.87٪) مقارنة ب 250,000-300,000 PHHs / بئر (62.75٪ ± 9.64٪). لم يظهر المتبرع B أي فروق ذات دلالة إحصائية في قابلية قابلية احتواء خلايا الكبد. كان لدى المتبرع B أدنى قابلية لتصفيح خلايا الكبد (85.78٪ ± 13.25٪) بأعلى كثافة بذر ، 300000 PHHs / بئر. على غرار المتبرع أ ، كان لدى المتبرع بالبذور B عند 150,000 PHHs / well أعلى نسبة قابلية للذوبان لخلايا الكبد (94.75٪ ± 15.07٪).
تم قياس إنتاج الألبومين وتخليق اليوريا في ثلاث نقاط زمنية خلال فترة الاستزراع التي استمرت 14 يوما وتم تطبيعها إلى خلايا الكبد المرفقة المحسوبة. بشكل عام ، زاد المتبرع A من إنتاج الألبومين مقارنة بالمتبرع B (41.32 ± 4.58 ميكروغرام alb / يوم / 106 PHHs مقابل 34.66 ± 10.03 ميكروغرام alb / يوم / 106 PHHs) (الشكل 5). كان لدى المتبرعين A و B أعلى إنتاج للخلايا الكبدية في البذر من الألبومين عند 150000 PHHs / حسنا ، و 45.91 ± 5.96 ميكروغرام alb / يوم / 106 PHHs و 48.67 ± 20.44 ميكروغرام alb / يوم / 106 PHHs ، على التوالي. لم تلاحظ فروق ذات دلالة إحصائية في إنتاج الألبومين في كثافات البذر المستخدمة. كما ذكر Baudy et al.3 ، من المستحسن أن تحافظ أنظمة الفسيولوجية الدقيقة للكبد على إنتاج الألبومين المتسق وتخليق اليوريا مع تغيير أقل من 50٪ على مدار 14 يوما من الثقافة. تم حساب معامل الاختلاف (CV) بقسمة المتوسط على الانحراف المعياري للأيام 7 و 10 و 14. تم تشغيل جميع العينات في نسخة. كانت السيرة الذاتية لإنتاج الألبومين خلال فترة الاستزراع التي استمرت 14 يوما عند 150,000 PHHs / well 12.24٪ للمتبرع A و 37.97٪ للمتبرع B ، أي أقل من معيار 50٪ المطلوب. لوحظ تباين كبير في إنتاج الألبومين في كل من المتبرع A والمتبرع B عند البذر عند 250,000 و 300,000 PHHs / well. في كثافات البذر هذه ، يعاني كلا المتبرعين من انخفاض حاد في إنتاج الألبومين بين الأيام 7 و 10 و 14 من الثقافة (المتبرع بالسيرة الذاتية A ، 22.49٪ ، والمتبرع B ، 45.07٪).
تمت زيادة تخليق اليوريا المانحة B (95.09 ± 18.91 ميكروغرام من اليوريا / يوم / 106) مقارنة بالمتبرع A (64.92 ± 4.66 ميكروغرام من اليوريا / يوم / 106 PHHs) عند متوسط الأيام 7 و 10 و 14 بيانات محددة ل PHH (الشكل 6). كان لدى المتبرع B (113.49 ± 37.34 ميكروغرام من اليوريا / يوم / 106 PHHs) والمتبرع A (69.12 ± 17.06 ميكروغرام من اليوريا / يوم / 106 PHHs) أكبر تخليق لليوريا خلال فترة استزراع مدتها 14 يوما بذر بكثافة 150000 PHHs / بئر و 200000 PHHs / بئر ، على التوالي. كان لدى كلا المتبرعين أقل إنتاج لليوريا وأعلى سيرة ذاتية عند 300000 PHHs / well. لم يلاحظ وجود فروق ذات دلالة إحصائية في تخليق اليوريا في كثافات البذر المستخدمة. شوهدت أدنى سيرة ذاتية لتخليق اليوريا للمتبرع أ عند استزراعها عند 250,000 PPHs / بئر (23.11٪) و 200,000 PHHs / بئر للمتبرع B (28.26٪). وكما أبرزت هذه النتائج، فإن كثافة البذر المثلى لكمية معينة من الأس الهيدروجيني تعتمد على مستوى الالتقاء المطلوب في وقت الفحص وطبيعة النتائج التي يجري قياسها؛ قد لا ترتبط كثافة البذر الأعلى دائما بإشارة أعلى أو نطاق ديناميكي.
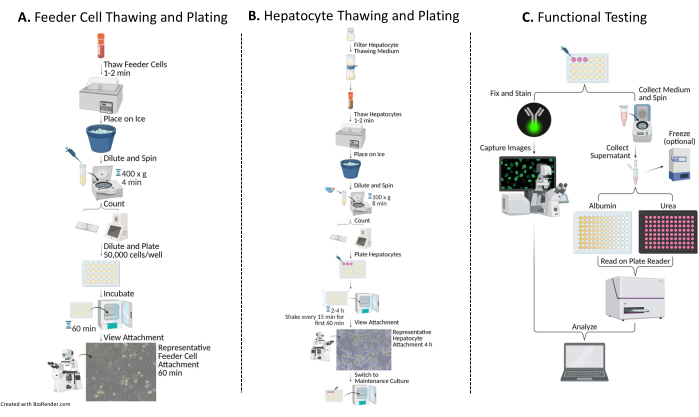
الشكل 1: مخطط انسيابي للطلاء والزراعة والاختبار الوظيفي للخلايا الكبدية ذات الخلايا المغذية. (أ) تذوب الخلايا المغذية في وسط ذوبان معين (انظر جدول المواد)، ويعاد تعليقها في وسط طلاء كامل (انظر جدول المواد)، ويتم عد الخلايا. يتم تخفيف الخلايا وطلائها وتحضينها لمدة 60 دقيقة عند 37 درجة مئوية / 5٪ CO2. (ب) تذوب الخلايا الكبدية في وسط ذوبان معين (انظر جدول المواد)، ويعاد تعليقها في وسط طلاء كامل، وتحسب الخلايا. يتم تخفيف خلايا الكبد ومطلية بالخلايا المغذية. يتم تحضين الخلايا لمدة 2-4 ساعات عند 37 درجة مئوية / 5٪ CO2 ، وتهتز في حركة N-S-E-W كل 15 دقيقة لأول 60 دقيقة من الثقافة. يتم استبدال وسط الطلاء بوسط استزراع كامل تم تسخينه مسبقا للحفاظ على الثقافة (انظر جدول المواد). يتم تغذية الثقافات يوميا. (ج) في الأيام 7 و10 و14، تجمع عينات متوسطة لاختبار الألبومين واليوريا. بعد جمع العينات في اليوم 14 ، يتم تثبيت الخلايا وتلطيخها بالجسم المضاد Cytokeratin 18 (انظر جدول المواد) 16-24 ساعة عند 4 درجات مئوية. علاوة على ذلك ، يتم تحضينها في جسم مضاد ثانوي مناسب ، وغسلها وتركيبها باستخدام DAPI (انظر جدول المواد) لالتقاط الصور وتحليلها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحليل الصور باستخدام برنامج ImageJ. معالجة ImageJ للصور الملتقطة. الخطوة 1: يتم تطبيق مقياس على جميع الصور بناء على شريط المقياس الخاص بالمجهر. الخطوة 2: تم تغيير نوع الصورة. الخطوة 3: يتم تطبيق حد عتبة لتحديد جزيئات DAPI. الخطوة 4: يتم إجراء تحليل الجسيمات ، ويتم تسجيل العد. الخطوة 5: لتحديد عدد خلايا التغذية المرفقة ، يتم حساب صورة مدمجة باستخدام الأداة متعددة النقاط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
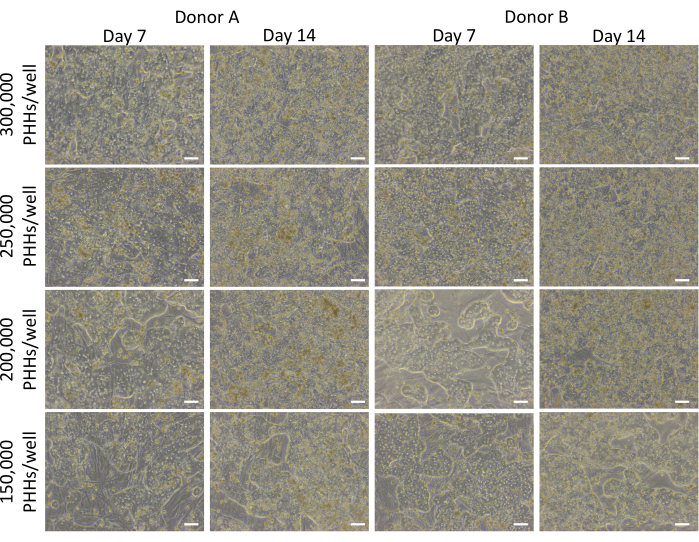
الشكل 3: مورفولوجيا كثافات البذر الكبدية المختلفة المستزرعة بالخلايا المغذية. صور تمثيلية في اليومين 7 و 14 من PHHs المزروعة بالخلايا المغذية (50000 خلية / بئر) بكثافة بذر كبدي تبلغ 150000 و 200000 و 250000 و 300000 PHHs / آبار. تم التقاط الصور باستخدام عدسة موضوعية 10x على مجهر تباين الطور المقلوب. شريط المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
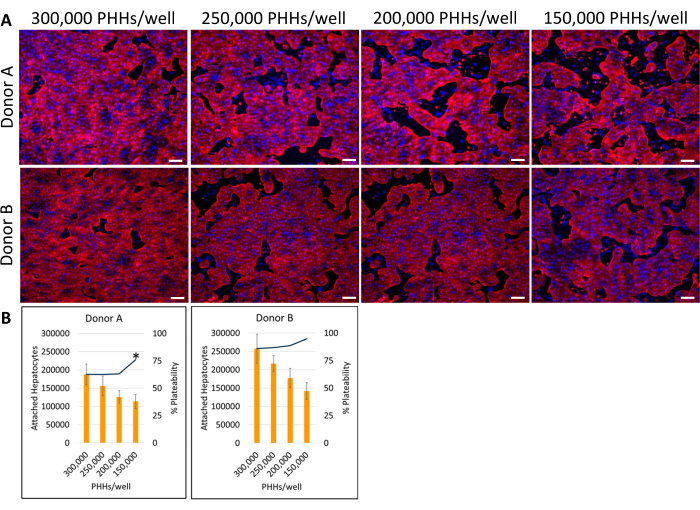
الشكل 4: الكيمياء الخلوية المناعية الفلورية لكثافات بذر كبدية مختلفة مستزرعة بالخلايا المغذية. (أ) صور تمثيلية لتلطيخ السيتوكيراتين 18 (الأحمر) في اليوم 14 بكثافة بذر كبدي تبلغ 150000 و200000 و250000 و300000 PHHs / آبار. تم تثبيت بئرين لكل كثافة بذر لمدة 30 دقيقة عند 4 درجات مئوية. تم تحضين الآبار 16-24 ساعة عند 4 درجات مئوية مع الأجسام المضادة الأولية في 1: 1000. تم استخدام جسم مضاد ثانوي في الساعة 1: 500 لمدة 30 دقيقة عند 4 درجات مئوية في الظلام. تمت إضافة بقعة DAPI (الزرقاء) النووية إلى الآبار لمدة 15 دقيقة في درجة حرارة الغرفة. تم التقاط الصور باستخدام عدسة موضوعية 10X على مجهر فلوري مقلوب. شريط المقياس = 100 ميكرومتر. (B) الخلايا الكبدية المرتبطة المحسوبة والنسبة المئوية للقابلية للطلاء لمختلف كثافات البذر الكبدي المحسوبة باستخدام ImageJ. * p ≤ 0.05 ، إلى النسبة المئوية لقابلية الطلاء ل 200000 و 250000 و 300000 PHHs / بئر. تمثل أشرطة الخطأ الانحراف المعياري (n ≥ 5 صور لكل حالة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
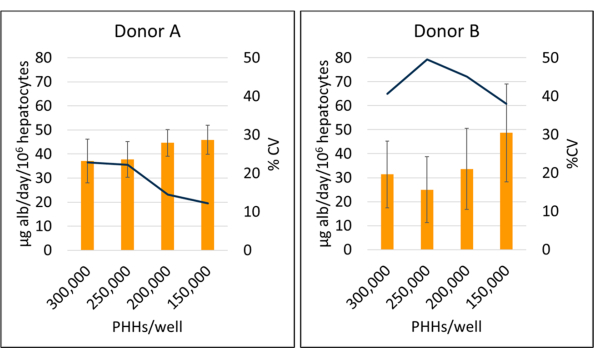
الشكل 5: إنتاج الزلال للخلايا الكبدية المستزرعة بالخلايا المغذية. إنتاج الألبومين من كثافات البذر الكبدي عند 150,000 و 200,000 و 250,000 و 300,000 PHHs / بئر. تمثل الأعمدة متوسط 14 يوما من ميكروغرام من الألبومين / يوم طبيعي إلى إجمالي خلايا الكبد المرفقة. يمثل السطر السيرة الذاتية بين الأيام 7 و 10 و 14. تمثل أشرطة الخطأ الانحراف المعياري (n ≥ 2 بئر لكل حالة مع النسخ المتماثلة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
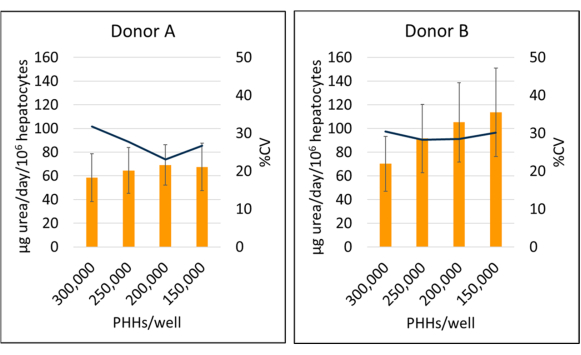
الشكل 6: تخليق اليوريا للخلايا الكبدية المزروعة بالخلايا المغذية. تخليق اليوريا من كثافات البذر الكبدي عند 150,000 و 200,000 و 250,000 و 300,000 PHHs / بئر. تمثل الأعمدة متوسط 14 يوما من ميكروغرام من اليوريا / يوم طبيعي إلى إجمالي خلايا الكبد المرفقة. يمثل السطر النسبة المئوية للسيرة الذاتية بين الأيام 7 و 10 و 14. تمثل أشرطة الخطأ الانحراف المعياري (n ≥ 2 بئر لكل حالة مع النسخ المتماثلة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المعيار (S) # | التركيز (ميكروغرام / مل) | محلول اليوريا (ميكرولتر) | الثقافة الكاملة (ميكرولتر) |
| 1 | 100 | 53.3 مخزون 75 ملغم/دل | 346.7 |
| 2 | 50 | 100 (حل S1) | 100 |
| 3 | 25 | 100 (حل S2) | 100 |
| 4 | 12.5 | 100 (حل S3) | 100 |
| 5 | 6.26 | 100 (حل S4) | 100 |
| 6 | 3.125 | 100 (حل S5) | 100 |
| 7 | 1.5625 | 100 (حل S6) | 100 |
| خلبي | 0 | 0 | 100 |
الجدول 1: تحضير عينة اليوريا القياسية. باستخدام مخزون اليوريا 75 مجم / ديسيلتر ، قم بإعداد محلول اليوريا 100 ميكروغرام / مل. قم باقتباس الأحجام المقترحة للوصول إلى التركيز النهائي للمنحنى القياسي.
Discussion
يمكن إنشاء نظام زراعة الكبد الموصوف في المختبرات المجهزة بأجهزة زراعة الأنسجة القياسية. يتألف النظام من PHHs المستزرعة بالخلايا المغذية ، ويسمح للمستخدم بزراعة PHHs لمدة أسبوعين على الأقل مع إنتاج مستقر للألبومين وتخليق اليوريا. نظرا لتباين الكثير من المتبرعين ب PHH ، يوصى فقط باستخدام PHHs المؤهلة والمحددة مسبقا للاستخدام في النظام. على الرغم من أن عدد PHHs المرفقة يختلف بناء على الكثير من المانحين وكثافة البذر ، إلا أن قابلية الطلاء النسبية تظل متشابهة داخل كل مجموعة مانحة. بينما ينصح بكثافات البذر الموصى بها ، تشير البيانات المذكورة أعلاه إلى أنه يمكن تعديل كثافة بذر خلايا الكبد لتلبية الاحتياجات التجريبية المختلفة. ومع ذلك ، تجدر الإشارة إلى أن بذر عدد أكبر من PHHs قد لا يوفر مخرجات وظيفية أعلى أو أكثر اتساقا. أظهر تحليل حصص PHH التي تم تقييمها أدنى سيرة ذاتية لإنتاج الألبومين وتخليق اليوريا باستخدام كثافات بذر أقل تبلغ 150000 PHHs / بئر و 200000 PHHs / بئر. ومع ذلك ، لم يتم العثور على فروق ذات دلالة إحصائية بين الألبومين واليوريا في أي كثافة بذر. تظهر كثافات البذر الأعلى البالغة 250,000 PHHs / بئر و 300,000 PHHs / well انخفاضا أكبر في الألبومين واليوريا خلال فترة الاستزراع التي تبلغ 14 يوما. قد يؤثر التباين المتأصل للمانحين في قابلية التصفيح على اتساق إنتاج الألبومين وتخليق اليوريا عند 250,000 PHHs / بئر و 300,000 PHHs / well لمجموعات المانحين المختبرة. على غرار كرويات خلايا الكبد الكبيرة ، قد يكون للإفراط في بذر PHHs في نظام TV2D + آثار سلبية على ثقافة ووظائف PHHs على المدى الطويل.
جميع الخطوات في الذوبان والطلاء والصيانة ضرورية لنجاح الثقافة وتوليد البيانات. ومع ذلك ، هناك العديد من الأخطاء الشائعة التي يمكن للمستخدمين عديمي الخبرة تجنبها. PHHs معرضة بشدة للتلف الثانوي لتقلب درجة الحرارة وإجهاد القص والتعرض للهواء 9,10. يجب اتخاذ الاحتياطات عند إذابة PHHs لتجنب الأطر الزمنية الطويلة للذوبان والسحب المفرط للسحب. سيؤدي استخدام طريقة الصب اليدوي ، والمؤقت ، والنقل الفوري من حمام مائي إلى ثلج إلى تقليل هذه الأخطاء الشائعة التي يمكن أن تؤثر على صلاحية وقابلية طلاء PHHs. بالإضافة إلى ذلك ، مع تزايد شيوع مشكلات سلسلة التوريد ، قد يكون من الصعب الحصول على ألواح مطلية بالكولاجين. يمكن استخدام الطلاء اليدوي للألواح المعالجة بزراعة الأنسجة باستخدام المحاليل التجارية من النوع الأول من الكولاجين (5-10 ميكروغرام / سم2) للتغلب على هذه المشكلة ؛ ومع ذلك ، للحصول على الأداء الأمثل والاتساق ، يوصى باستخدام ألواح الكولاجين المطلية مسبقا. في عملية الانتقال من ثقافة الخلايا المغذية فقط إلى إدخال PHHs ، من الأهمية بمكان منع طبقة الخلايا المغذية من الجفاف. لا تسمح أبدا بتعرض الهواء للخلايا المغذية. قد يؤدي أي وقت للتعرض للهواء إلى ضعف جودة طبقة الخلايا المغذية ، مما سيؤثر سلبا على ثقافة PHHs على المدى الطويل. من أفضل الممارسات السماح ببقاء كمية صغيرة من الوسط المتبقي بين التغييرات المتوسطة. في بعض الأحيان ، قد تحتوي PHHs على حطام زائد من العزلة ، مما قد يجعل مشاهدة مورفولوجيا صعبة. للمساعدة في حل هذه المشكلة ، هز اللوحة قبل تغيير متوسط واستخدم شفط الفراغ. أخيرا ، عند إجراء تغيير متوسط ، قم باستنشاق الوسط المستهلك بعناية ، مع الحرص على عدم إزعاج الخلايا المزروعة. ماصة متوسطة الحجم طازجة أسفل جانب البئر لتجنب السحب مباشرة على طبقة الخلية. يجب على المستخدم أيضا تجنب التعرض للهواء عند كل تغيير وسيط ، باستخدام التغيير الموصى به من 3 آبار (القسمان 3 و 4). وتجدر الإشارة أيضا إلى أن التغيير اليومي المتوسط مثالي ولكنه غير مطلوب.
على الرغم من أن المجاهر الفلورية أصبحت شائعة في معظم المختبرات ، إلا أن البرامج اللازمة لإجراء تحليل صور محددة يمكن أن تتكبد نفقات إضافية. يمكن تنزيل ImageJ مجانا ، مما يجعله أداة تحليل صور يسهل الوصول إليها. توفر الخطوات الواردة في البروتوكول أساسا قد يحتاج المستخدم إلى تحسينه ، وتحديدا تحليل الجسيمات لتلطيخ DAPI ؛ ومع ذلك ، في حالة عدم وجود قدرة تصوير الفلورسنت ، يتم توفير قيم ارتباط PHH في اليوم 14 على شهادات تحليل خاصة بالكثير. سيؤدي ضعف العتبة إلى عد غير دقيق لجسيمات DAPI. يوصى أيضا بالتحقق من مساحة سطح جزيئات DAPI الفردية قبل تعيين استبعاد الحجم. يمكن تحقيق ذلك باستخدام الرمز البيضاوي [الشكل 2 (1) ، رمز الدائرة أسفل علامة التبويب تحرير ] ورسم دائرة تشمل جسيم DAPI. يمكن بعد ذلك استخدام علامة التبويب تحليل لقياس مساحة جسيم DAPI المحدد. يمكن تحديد قياسات محددة باستخدام تعيين القياسات ضمن علامة التبويب تحليل [الخطوة 8.9 والشكل 2 (4)].
تتضمن الطرق الحالية لزراعة PHHs استخدام الطلاءات مثل الكولاجين-I لزيادة ارتباط الخلية في الزراعة الأحادية التقليدية ثنائية الأبعاد11 أو التراكب مع مصفوفة خارج الخلية ، مثل Matrigel القائم على murine ، وهي تقنية يشار إليها عادة باسم "ثقافة الساندويتش"12،13،14،15. في حين أن تقنية زراعة الساندويتش تعمل على تحسين مورفولوجيا PHH وقطبية بمرور الوقت مقارنة بالزراعة الأحادية التقليدية ، لا يزال كلا النهجين يفتقران إلى استقرار النمط الظاهري طويل الأجل في الثقافة لمعظم الكثير من PHHs القابلة للتصفيح. طريقة أخرى تستخدم لثقافة PHHs هي صنع كرويات 3D. ومع ذلك ، كما ذكر سابقا Glicklis et al.4 ، يمكن أن تكون هناك تحديات فنية مع استنساخ حجم كروي بسبب تباين المانحين. في محاولة لجعل نموذج الكبد أكثر ملاءمة من الناحية الفسيولوجية ، تم تطوير نماذج متعددة الخلايا. كما وصفه Ware et al.7 ، فإن استخدام الأنماط الدقيقة والخلايا الليفية للفأر والخلايا البطانية الجيبية للكبد البشري الأولية المحاطة ب PHHs مكن من وقت أطول في أوقات الثقافة المختبرية . ومع ذلك ، يمكن أن تكون النماذج الدقيقة عملية معقدة وتستغرق وقتا طويلا ، وقد تساهم خلايا التغذية غير البشرية في الخلفية في الإشارات الأيضية ، مما يحد من فائدة هذه المنصة في تطبيقات معينة. أظهر استخدام العديد من الخلايا غير الكبدية ، بما في ذلك الخلايا الليفية الجلدية البشرية والفئران والخلايا البطانية للشريان الأورطي البقري كخلايا مغذية للزراعة المشتركة لخلايا الكبد ، إفراز الألبومين وتشكيل تقاطع ضيق مشابه للمزارع المشتركة للخلايا المغذية من أصل الكبد16. ومع ذلك ، فإن آلية التفاعلات بين الخلايا المغذية غير الكبدية TV2D + و PHHs في الثقافة تحتاج إلى مزيد من التحقيق لفهم التأثير على استقرار ووظائف PHHs في هذا النظام بشكل أفضل. يمكن لنظام الاستزراع الذي وصفه Weaver et al.8 سابقا زراعة PHHs بنجاح في المستعمرات الكبدية لمدة تصل إلى 42 يوما ، مما يشكل شبكات قناة صفراء واسعة النطاق. حافظت PHHs المستزرعة في هذا النظام على وظائف الكبد الرئيسية ، بما في ذلك نشاط السيتوكروم 1A2 و 2B6 و 3A4 ونشاط الإنزيم القائم على Uridine 5′-diphospho-glucuronosyltransferase (UGT) ، وتشكيل مستقلب المرحلتين الأولى والثانية ، وإنتاج الألبومين ، وتخليق اليوريا لمدة 22 يوما على الأقل في المختبر بدون Matrigel. ينتج نظام الاستزراع هذا مخرجات مستقرة وذات صلة من الناحية الفسيولوجية يمكن تكييفها بسهولة مع أي مختبر للتطبيقات الدوائية والسمية. على الرغم من الحفاظ على وظائف PHH الرئيسية في نظام TV2D + ، لم يتم إجراء مقارنات مباشرة مع نموذج كروي ثلاثي الأبعاد ؛ ومع ذلك ، فإن العمل المستقبلي الذي يقارن نفس الجهات المانحة ل PHH بين أنظمة الاستزراع سيثبت قيمته في تحديد حدود ومزايا كلتا الطريقتين.
تشمل التطبيقات المحتملة ل TV2D + تقييم التصفية الأيضية والتفاعلات الدوائية للمركبات منخفضة الدوران ، وإصابة الكبد التي يسببها الدواء ، وتقييم مخاطر الكيماويات الزراعية. يعتمد التنبؤ الدقيق بالتصفية الكبدية للأدوية الجديدة والناشئة على ثقافة PHH مستقرة وطويلة الأمد مع الاحتفاظ بوظائف الخلايا الكبدية الرئيسية ، وهو أمر صعب بشكل خاص عند تقييم المركبات منخفضة الدوران. بالإضافة إلى ذلك ، يعد تقييم المخاطر وسمية الكبد التي يسببها الكيميائي من الشواغل الصحية الرئيسية ، ولا توفر النماذج الحالية الاستقرار والوظائف على المدى الطويل في الثقافة لإجراء تقييم دقيق للسمية الكيميائية المزمنة المحتملة التي قد تكون ثانوية للتعرض الحاد. أظهرت PHHs الصحية والمريضة المزروعة في TV2D + اختلافات مميزة في الوظيفة والتخلص من الدهون التي تم الاحتفاظ بها بمرور الوقت17. تدعم هذه الدراسات TV2D + كأداة واعدة لمجموعة متنوعة من التطبيقات الدوائية والسمية.
Disclosures
JO ، LW ، EG ، EL ، SP ، و JW هم موظفون في LifeNet Health ، المنظمة غير الربحية التي تنتج TV2D +.
Acknowledgements
نود أن نشكر ميليسا كيلر وويندي هيتمان على مساعدتهما في مراجعة المخطوطات والأشكال.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES filter unit | Thermo Fisher Scientific | 565-0020 | User preference |
| 15 mL or 50 mL conical tubes | Thermo Fisher Scientific | 352196 or 352070 | User preference |
| Alexa Fluor 555, goat anti-rabbit | Thermo Fisher Scientific | A-21428 | Other secondary antibodies can work |
| Anti-Cytokeratin 18 antibody | abcam | ab24561 | Necessary using same dilution |
| AOPI | Nexcelom | CS2-0106-5mL | Used for Cellometer counting |
| Biosafety cabinet | Labconoco | 3460801 | User preference |
| Black-walled, clear bottom, 96-well plate | Thermo Fisher Scientific | 165305 | User preference |
| Centrifuge | Thermo Fisher Scientific | Sorvall X4R | Capable of speeds up to 400 x g |
| Collagen coated plate, 24-well | Greiner Bio-One | 662950 | Rat tail collagen coating |
| Counting slides | Nexcelom | CHT4-SD100-002 | Used for Cellometer counting |
| Culture medium | LifeNet Health | MED-TCCM | |
| Culture supplement | LifeNet Health | MED-TCSC | |
| DAPI | Thermo Fisher Scientific | 00-4959-52 | Contains mounting medium |
| DPBS (-Ca, -Mg) | Thermo Fisher Scientific | 14190250 | User preference |
| Feeder cell supplement | LifeNet Health | MED-TCSA | |
| Feeder cell thawing medium | LifeNet Health | MED-FCTM | |
| Fluorescent microscope | Zeiss | AxioObserver Z1 | Equipped with user specific filters |
| Hepatocyte thawing medium | LifeNet Health | MED-HHTM4C-50ML | |
| Human albumin ELISA kit | abcam | ab108788 | Necessary if using same dilution |
| Human feeder cells | LifeNet Health | PHFC24 | |
| Humidified incubator | VWR | 97025-842 | Capable of 5% CO2 |
| IC Fixation buffer | Thermo Fisher Scientific | 00-8222-49 | Paraformaldehyde based, 10% formalin can also be used |
| ImageJ | National Insitute of Health | Version 1.52a | 1.52a or higher |
| Inverted phase contrast microscope | Olympus | CK40-F100 | User preference |
| Microcentrifuge tubes | VWR | 20170-022 | User preference |
| Micropipettes (various sizes) | USA Scientific | ErgoOne | User preference |
| Permeabilization buffer (10x) | Thermo Fisher Scientific | 00-8333-56 | Other permeabilization buffers can work |
| Plate reader | BMG Labtech | CLARIOstar | Capable of reading absorbance 450-640 nm |
| Plating medium | LifeNet Health | MED-TCPM | |
| Plating supplement | LifeNet Health | MED-TCSB | |
| Primary human hepatocytes | LifeNet Health | various | Catalog number may vary based on lot number |
| Secondary antibody | Thermo Fisher Scientific | A-21428 | User preference |
| Serological pipet controller | Gilson | F110120 | User preference |
| Storage bottle 100–500 mL | VWR | 76311-770 | User preference |
| Urea Nitrogen (BUN) Test | Stanbio | 0580-250 | |
| Water bath | PolyScience | WBE05 | Capable for use at 37 °C |
References
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- Swift, B., Pfeifer, N. D., Brouwer, K. L. Sandwich-cultured hepatocytes: an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity. Drug Metabolism Reviews. 42 (3), 446-471 (2010).
- Baudy, A. R., et al. Liver microphysiological systems development guidelines for safety risk assessment in the pharmaceutical industry. Lab on a Chip. 20 (2), 215-225 (2020).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Khetani, S. R., et al. Microengineered liver tissues for drug testing. Journal of Laboratory Automation. 20 (3), 216-250 (2015).
- Monckton, C. P., Brown, G. E., Khetani, S. R. Latest impact of engineered human liver platforms on drug development. APL Bioengineering. 5 (3), 031506 (2021).
- Ware, B. R., Durham, M. J., Monckton, C. P., Khetani, S. R. A cell culture platform to maintain long-term phenotype of primary human hepatocytes and endothelial cells. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 187-207 (2018).
- Weaver, J. R., et al. The morphology, functionality, and longevity of a novel all human hepatic cell-based tri-culture system. Toxicology In Vitro. 86, 105504 (2023).
- Li, W., et al. Matrix stiffness and shear stresses modulate hepatocyte functions in a fibrotic liver sinusoidal model. American Journal of Physiology, Gastrointestinal and Liver Physiology. 320 (3), G272-G282 (2021).
- Thompson, S. M., et al. Heat stress induced cell death mechanisms in hepatocytes and hepatocellular carcinoma: in vitro and in vivo study. Lasers in Surgery and Medicine. 46 (4), 290-301 (2014).
- Mooney, D., et al. Switching from differentiation to growth in hepatocytes: control by extracellular matrix. Journal of Cellular Physiology. 151 (3), 497-505 (1992).
- Berthiaume, F., Moghe, P. V., Toner, M., Yarmush, M. L. Effect of extracellular matrix topology on cell structure, function, and physiological responsiveness: hepatocytes cultured in a sandwich configuration. The FASEB Journal. 10 (13), 1471-1484 (1996).
- Hamilton, G. A., et al. Regulation of cell morphology and cytochrome P450 expression in human hepatocytes by extracellular matrix and cell-cell interactions. Cell and Tissue Research. 306 (1), 85-99 (2001).
- Orkin, R. W., et al. A murine tumor producing a matrix of basement membrane. Journal of Experimental Medicine. 145 (1), 204-220 (1977).
- Sivaraman, A., et al. A microscale in vitro physiological model of the liver: predictive screens for drug metabolism and enzyme induction. Current Drug Metabolism. 6 (6), 569-591 (2005).
- Goulet, F., Normand, C., Morin, O. Cellular interactions promote tissue-specific function, biomatrix deposition and junctional communication of primary cultured hepatocytes. Hepatology. 8 (5), 1010-1018 (1988).
- Odanga, J. J., Breathwaite, E. K., Presnel, S., LeCluyse, E. L., Weaver, J. R. Characterization of primary human hepatocytes from diseased and healthy livers in an all-human cell based triculture system. The Toxicologist, a Supplement to Toxicological Sciences. , 4283 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved