Method Article
Ein rein humanes Leberkultursystem für Anwendungen in der Arzneimittelentwicklung
In diesem Artikel
Zusammenfassung
Jüngste technische Fortschritte ermöglichten die skalierte Produktion einer In-vitro-Plattform für Anwendungen im Bereich des Arzneimittelstoffwechsels und der Toxizität. Ein rein humanes 2D+ Lebersystem (TV2D+) liefert physiologisch relevante Ergebnisse mit herkömmlichen zweidimensionalen Kulturmethoden. Dieses Protokoll unterstützt Endbenutzer bei der Einrichtung, Wartung und Anwendung des Systems.
Zusammenfassung
Die Suche nach einem langfristigen, humanrelevanten Kulturmodell für primäre humane Hepatozyten (PHHs) für pharmakologische und toxikologische Studien stellt nach wie vor eine Herausforderung dar. Derzeitige In-vitro-Modellplattformen sind oft unpraktisch und komplex, es fehlt ihnen an phänotypischer Stabilität im Laufe der Zeit und sie unterstützen nicht mehrere PHH-Chargen, da es ihnen an experimenteller Reproduzierbarkeit und Flexibilität mangelt. Hier stellen wir ein detailliertes Protokoll für das Auftauen, Plattieren und Warten eines rein menschlichen 2D+-Lebersystems (TV2D+) zur Verfügung, das die Vorteile von zweidimensionalen (2D) Standardkulturtechniken und -geräten nutzt und gleichzeitig die Langlebigkeit und phänotypische Stabilität im Laufe der Zeit beibehält, die typischerweise mit komplexeren dreidimensionalen (3D) Systemen einhergehen. Die Ergebnisse zeigen die Anheftung und prozentuale Beschichtbarkeit in TV2D+ in Abhängigkeit von der PHH-Aussaatdichte sowie eine stabile Funktionalität für mindestens 2 Wochen in Kultur. Eine Reihe von PHH-Aussaatdichten wird bewertet, um eine erfolgreiche Langzeitkultur zu erreichen. Wenn sie richtig etabliert sind, organisieren sich die PHHs in TV2D+ in Hepatozytenkolonien, exprimieren einen Leber-spezifischen Marker und erhalten die Lebensfähigkeit, die architektonische Integrität und physiologisch relevante Konzentrationen von Albumin und Harnstoff. Diese einzigartige Kombination von Eigenschaften macht das TV2D+ System zu einem geeigneten Lebermodell für eine Vielzahl von pharmakologischen und toxikologischen Anwendungen.
Einleitung
Die Vorhersage der therapeutischen Sicherheit und Wirksamkeit ist ein wichtiger Bestandteil der präklinischen Arzneimittelentwicklung. Herkömmliche präklinische In-vitro-Lebermodelle sind jedoch nur begrenzt in der Lage, die zelluläre Mikroumgebung der Leber genau nachzuahmen und die Funktionalität und Morphologie der Hepatozyten im Laufe der Zeit aufrechtzuerhalten. Es besteht ein Bedarf an Modellen, die eine stabile metabolische Kompetenz für mehr als 1 Woche bieten, um Verbindungen mit langsamem Umsatz zu bewerten oder Ergebnisse im Zusammenhang mit subakuter oder chronischer Exposition zu untersuchen. In-vivo-Tierversuche sind oft nicht in der Lage, die Wirksamkeit und das Risiko von Arzneimitteln vorherzusagen, da translationale Speziesunterschiede in den menschlichen Leberclearance-Mechanismen bestehen1. Derzeitige 2-dimensionale (2D) In-vitro-Lebermodelle, wie z. B. traditionelle primäre humane Hepatozyten-Monokulturen (PHH) oder Sandwich-Kulturen, weisen in der Kultur keine phänotypische Stabilität und Langlebigkeit auf, was im Laufe der Zeit zum Verlust wichtiger hepatozellulärer Funktionen und architektonischer Integrität führt2. Eine alternative Methode beinhaltet die Bildung von 3-dimensionalen (3D) Hepatozyten-Sphäroiden, die eine relevantere Mikroumgebung als eine 2D-Kultur bieten. Diese Methode ist jedoch durch die Verfügbarkeit von Rohstoffen, die Auswahl der PHH-Spender-Chargen, die Reproduzierbarkeit und den Verlust der Lebensfähigkeit mit zunehmender Sphäroidgrößebegrenzt 3,4,5,6. Es wurden multizelluläre Plattformen eingeführt, bei denen PHHs mit Feederzellen auf Platten mit fester Größe, mikrostrukturierten Platten ausgesät werden. Obwohl diese Modelle längere Kulturzeiten ermöglichen können, können nicht-menschliche Feederzellen, die auf diesen Plattformen verwendet werden, die experimentellen Ergebnisse verändern und ihre Anwendung aufgrund ihres angeborenen Hintergrundbeitrags zur Wirkstoffclearance und zu metabolischen Profilen einschränken 1,7. Das TruVivo All-Human 2D+ Lebersystem (TV2D+), das kürzlich in Weaver et al.8 beschrieben wurde, wurde entwickelt, um einige der Einschränkungen traditioneller, Co-Kultur- und 3D-Kulturmethoden von PHHs zu überwinden. Die Nicht-Leber-Feeder-Zellen reduzieren die Unterschiede zwischen den Spezies im Stoffwechsel und in der parakrinen Produktion und bieten die notwendige Unterstützung für primäre Hepatozyten in einer reproduzierbaren, robusten Weise, die von entsprechenden nicht-parenchymalen Leberzellen aus einer einzigen Spendercharge aufgrund von Einschränkungen in Expansion, Phänotyp und Leistung nicht bereitgestellt werden kann. Die ausgewählten Feeder-Zellen konnten vor der Verwendung konsequent expandiert werden und es fehlte die Notwendigkeit einer Transformation oder Differenzierung. Wie von Glicklis et al.4 und Khetani et al.5 beschrieben, haben 3D-Kulturmodelle wie Hepatozyten-Sphäroide aufgrund der Variabilität der Spender und der Aufrechterhaltung der Konsistenz der Sphäroidgröße Schwierigkeiten mit der Reproduzierbarkeit, was sich auf die Nährstoffdiffusion in Sphäroiden über 200 μm auswirkt, was zu einer verminderten Lebensfähigkeit und Funktionalität führt. Wie bei der 3D-Sphäroidbildung beruht das TV2D+-System auf der Selbstorganisation von PHHs. Die gebildeten PHH-Kolonien sind jedoch über die Oberfläche des Bohrlochs in einer Einzelzelltiefe verteilt, anstatt zu einem einzigen Aggregat verdichtet zu werden. Diese Kulturmethode kann nützlich sein, um die Variabilität der Spender zu berücksichtigen, so dass PHHs plattiert und kultiviert werden können und die grundlegende Funktionalität bei verschiedenen Aussaatdichten aufrechterhalten werden können. Das TV2D+-System kann auch die Robustheit der Benutzerhandhabung aufgrund von Verlusten während der Manipulation oder spezieller Ausrüstung erhöhen, die für die Durchführung einer erweiterten Kultur in 3D-Sphäroiden erforderlich ist.
Das TV2D+-System kombiniert die Standard-2D-Kultur mit der Langlebigkeit und phänotypischen Stabilität, die typischerweise mit 3D-Systemen einhergehen. Das hier beschriebene Protokoll bietet Schritt-für-Schritt-Anleitungen für Benutzer mit grundlegenden Gewebekulturkenntnissen in Laboren, die mit Standardgeräten wie Biosicherheitswerkbänken, Zentrifugen und CO2 -Inkubatoren ausgestattet sind. Jeder Schritt des Prozesses wird detailliert beschrieben, einschließlich der Medienvorbereitung, des Auftauens, der Beschichtung und der Wartung des resultierenden Kultursystems. Das Protokoll enthält auch eine Methode zur Bestimmung der grundlegenden Hepatozytenfunktionalität, Albumin und Harnstoff, sowie eine immunfluoreszierende Bildanalyse zur Bestimmung der PHH-Bindung für die Normalisierung. Wenn sie richtig etabliert sind, organisieren sich die PHHs in TV2D+ in Hepatozytenkolonien, ahmen die native Lebermorphologie nach und halten eine verlängerte Lebensfähigkeit, architektonische Integrität und physiologisch relevante Mengen an Albumin und Harnstoff für mindestens 2 Wochen aufrecht8. Da das System eine Reihe von PHH-Aussaatdichten zulassen kann, kann es nützlich sein, um die Verfügbarkeit von weniger plattierbaren PHH-Chargen zu erhöhen, die wünschenswerte Spendereigenschaften aufweisen. Diese Kombination aus Zugänglichkeit und Funktionalität macht TV2D+ zu einem geeigneten Lebermodell für eine Vielzahl pharmakologischer und toxikologischer Anwendungen.
Protokoll
Dieses Protokoll folgt den Richtlinien der Ethikkommission von Lifenet Health. Das Manuskript enthält keine Studien mit menschlichen Teilnehmern oder Tierversuche, die von einem der Autoren durchgeführt wurden. Alle Zellen wurden aus Spendergewebe isoliert, das von Lifenet Health zu Forschungszwecken vollständig genehmigt wurde.
1. Mittlere Vorbereitung
- Je eine Flasche Auftaumedium der Feederzelle, Ergänzung A, Ergänzung B und Ergänzung C (siehe Materialtabelle) in einem Wasserbad von 37 °C oder 16-24 h bei 4 °C auftauen.
- Aliquotieren Sie die gesamte Flasche (10 ml) des Auftaumediums der Feeder-Zelle in ein konisches 15-ml- oder 50-ml-Röhrchen.
HINWEIS: Die Größe des Zellpellets ist mit einem konischen 15-ml-Röhrchen leichter zu erkennen. - Geben Sie 4,5 ml Supplement B und 11 ml Supplement A in eine Flasche Beschichtungsmedium (75 ml) (siehe Materialtabelle), um ein vollständiges Beschichtungsmedium herzustellen.
HINWEIS: Das komplette Beschichtungsmedium hat eine Konzentration von FBS <5% v/v. - Geben Sie in eine separate Flasche 100 ml Nährmedium (siehe Materialtabelle), 1 ml Ergänzung C und 14 ml Ergänzung A, um ein vollständiges Nährmedium herzustellen.
HINWEIS: Vollständiges Nährmedium hat eine Konzentration von FBS <1% v/v - Restliche Ergänzung C und Ergänzung A bei -20 °C bis zur mittleren Zubereitung in Woche 2 lagern.
HINWEIS: Wiederholte Gefrier-Auftau-Zyklen verkürzen die Haltbarkeit der Nahrungsergänzungsmittel. Es wird empfohlen, nur einmal einzufrieren und aufzutauen. - Vor Gebrauch 10 ml Auftaumedium der Feederzelle, Hepatozyten-Auftaumedium, vollständiges Plattierungsmedium und vollständiges Nährmedium 20-30 min in einem 37 °C warmen Wasserbad erwärmen.
2. Auftauen, Zählen und Plattieren menschlicher Feederzellen (Abbildung 1A)
- Die Feederzellen ca. 1 h vor der Aussaat der PHHs kultivieren. Feederzellen (siehe Materialtabelle) in einem 37 °C warmen Wasserbad für 1-2 min auftauen.
HINWEIS: Vermeiden Sie eine längere Exposition (z. B. >2 Minuten), indem Sie das Auftauen überwachen und die Durchstechflasche entfernen, wenn sich die Flüssigkeit im Kryoröhrchen löst, wenn sie umgedreht wird. - Unmittelbar nach dem Auftauen die Futterzellen auf Eis legen.
- Unter Verwendung aseptischer Techniken werden frisch aufgetaute Zellen in einer Biosicherheitswerkbank (BSC) zu 10 ml Auftaumedium der Feeder-Zellen gegeben.
- Verwenden Sie eine 1000-μl-Pipette, um die Durchstechflasche einmal mit 1 ml Zell-/Auftaumedium-Suspension zu waschen und aufzufangen.
- Bei 400 x g 4 min bei Raumtemperatur (RT) schleudern.
- Entsorgen Sie den Überstand vorsichtig, um das Zellpellet nicht durch Pipettieren oder Vakuumaspiration zu stören. Resuspendieren Sie das Zellpellet in 1 ml des vollständigen Beschichtungsmediums und zählen Sie die Feeder-Zellen.
HINWEIS: Feederzellen können mit Acridinorange und Propidiumiodid (AOPI) auf einem automatisierten Zellzähler oder Trypanblau mit einem Hämazytometer gezählt werden. Die Zellzahl kann je nach Technologie und Benutzer variieren. Die besten Ergebnisse erzielen Sie, wenn Sie doppelte Proben zählen und in der gewählten Methodik konsistent bleiben. - Verdünnen Sie die Zellsuspension auf 100.000 Zellen/ml unter Verwendung des vollständigen Beschichtungsmediums.
- 500 μl (50.000 Zellen) der verdünnten Zellsuspension pro Well auf eine kollagenbeschichtete 24-Well-Platte geben (siehe Materialtabelle).
- Schütteln Sie die Platte in einer Nord (N)-Süd (S)-Ost (E)-West (W) Bewegung, indem Sie 2 Mal eine Hin- und Herbewegung in N-S-Richtung ausführen, gefolgt von der gleichen Bewegung E-W. Wiederholen Sie dieses Schüttelprotokoll 2 weitere Male für insgesamt 3 Runden.
HINWEIS: Schütteln Sie es mit mäßiger Kraft, um ein Spritzen auf dem Plattendeckel zu vermeiden und gleichzeitig die Zellverteilung zu unterstützen (siehe Video). - Bei 37 °C/5 % CO2 für 60 min inkubieren.
- Sehen Sie sich die Anhaftung der Feederzellen an, bevor Sie mit dem Auftauen der Hepatozyten fortfahren.
HINWEIS: Die akzeptable Anhaftung der Feeder-Zellen ist visuell zu etwa 50 % konfluiert.
3. Auftauen, Zählen und Plattieren von primären menschlichen Hepatozyten (Abbildung 1B)
- Nach 30 Minuten Feeder-Zellkultur wird das vorgewärmte Hepatozyten-Auftaumedium durch eine 0,2-μm-Polyethersulfon-Filtereinheit (PES) gefiltert.
- PHHs im 37 °C warmen Wasserbad 1-2 min auftauen.
HINWEIS: Vermeiden Sie eine längere Exposition (z. B. >2 Minuten), indem Sie das Auftauen überwachen und die Durchstechflasche entfernen, wenn sich die Flüssigkeit im Kryoröhrchen löst, wenn sie umgedreht wird. - Unmittelbar nach dem Auftauen PHHs auf Eis legen.
- Gießen Sie in einer BSC eine PHH-Suspension in das Hepatozyten-Auftaumedium.
HINWEIS: Vermeiden Sie nach Möglichkeit das Pipettieren von PHH-Zellsuspensionen. Es ist äußerst wichtig, während des Transfers von aufgetauten PHHs vom Kryoröhrchen zum Auftaumedium kein Pipettieren durchzuführen. - Verwenden Sie eine 1000-μl-Pipette, um die Durchstechflasche 3-4 Mal zu waschen, indem Sie vorsichtig 1 ml Hepatozyten-/Auftaumedium-Suspension zurück in die Durchstechflasche pipettieren und die Wäsche auffangen, indem Sie sie wieder in das Auftaumedium gießen.
- Kappen Sie die aufgetaute PHH-Suspension 5 Mal und drehen Sie sie vorsichtig um.
- Bei 100 x g 8 min bei RT schleudern.
- Entsorgen Sie den Überstand vorsichtig, um das Zellpellet nicht durch Pipettieren oder Vakuumaspiration zu stören. Geben Sie an der Wand des konischen Röhrchens 3 ml des vollständigen Beschichtungsmediums hinzu.
- Schaukeln Sie das konische Röhrchen von einer Seite zur anderen, um das Zellpellet zu resuspendieren.
- Fügen Sie den resuspendierten Hepatozyten weitere 5 ml des vollständigen Beschichtungsmediums hinzu.
- Zählen Sie PHHs.
HINWEIS: PHHs können mit AOPI auf einem automatisierten Zellzähler oder Trypanblau mit einem Hämazytometer gezählt werden. Die Zellzahl kann je nach Technologie und Benutzer variieren. Die besten Ergebnisse erzielen Sie, wenn Sie doppelte Proben zählen und in der gewählten Methodik konsistent bleiben. - Verdünnen Sie die Zellsuspension auf die gewünschte Aussaatdichte (300.000-600.000 PHHs/ml) unter Verwendung des vollständigen Beschichtungsmediums.
HINWEIS: Die optimale Hepatozyten-Aussaatdichte kann von Charge zu Charge variieren. Die empfohlene Aussaatdichte für eine bestimmte Partie wird im Analysenzertifikat (COA) angegeben. Verwenden Sie die folgende Gleichung, um Hepatozyten/ml für eine 24-Well-Platte zu bestimmen.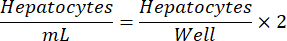
- Entnehmen Sie das Medium aus den plattierten Dosierzellen durch Pipettieren oder Vakuumaspiration.
HINWEIS: Um die Lebensfähigkeit der Feeder-Zellen zu gewährleisten, wird empfohlen, nicht mehr als 3 Wells gleichzeitig zu wechseln. - Sofort 500 μl (150.000-300.000 Zellen) der verdünnten Hepatozytensuspension pro Vertiefung auf die vorbeschichtete Kollagen-24-Well-Platte mit Feeder-Zellen auftragen.
- Schütteln Sie die Platte in einer N-S-E-W-Bewegung, indem Sie 2 Mal eine Hin- und Herbewegung in N-S-Richtung ausführen, gefolgt von derselben Bewegung E-W. Wiederholen Sie dieses Schüttelprotokoll 2 weitere Male für insgesamt 3 Runden.
HINWEIS: Schütteln Sie mit mäßiger Kraft, um Spritzer auf dem Plattendeckel zu vermeiden und gleichzeitig die Zellverteilung zu unterstützen. - Bei 37 °C/5 % CO2 für 2-4 h inkubieren. In den ersten 60 Minuten der Kultur wird die Platte alle 15 Minuten in N-S-E-W-Bewegung geschüttelt, wie in Schritt 3.15 oben.
- Nehmen Sie nach der Inkubation die Platte aus dem Inkubator und legen Sie sie in BSC.
- Schütteln Sie die Platte und entfernen Sie das komplette Beschichtungsmedium durch Pipettieren oder Vakuumaspiration.
HINWEIS: Um die Lebensfähigkeit der Kultur zu gewährleisten, wird empfohlen, nicht mehr als 3 Vertiefungen gleichzeitig zu wechseln. - Geben Sie sofort 500 μl vorgewärmtes vollständiges Nährmedium in jede Vertiefung.
4. Wartung
- Aliquot und Vorwärmen des kompletten Nährmediums in einem 37 °C warmen Wasserbad für 20-30 min. Für eine 24-Well-Platte werden ca. 13,5 ml Medium benötigt.
- Füttern Sie Kulturen täglich mit 500 μl frischem, vorgewärmtem Alleinnährmedium pro Well.
HINWEIS: Um die Lebensfähigkeit der Kultur zu gewährleisten, wird empfohlen, nicht mehr als 3 Vertiefungen gleichzeitig zu wechseln. - Bereiten Sie alle 7 Tage ein frisches, vollständiges Nährmedium zu.
5. Entnahme von Kulturüberstandsproben zur Messung von Albumin und Harnstoff
- An den Tagen 7, 10 und 14 werden 500 μl Medium aus den gewünschten Probenvertiefungen in ein Mikrozentrifugenröhrchen gesammelt, wie in Abbildung 1C dargestellt.
- Die Probe(n) wird bei 320 x g für 10 min bei 4 °C zu Pelletresten geschleudert.
- Verwenden Sie eine Pipette, um den Probenüberstand in neue Mikrozentrifugenröhrchen zu überführen, um eine Unterbrechung des Pellets zu vermeiden.
- Führen Sie die Proben im Albumin- und/oder Harnstoff-Assay durch (siehe Abschnitte 10 bzw. 11).
HINWEIS: Die Proben können 2 Wochen lang bei -20 °C bis -80 °C gelagert werden.
6. Färbetag I
VORSICHT: Der Fixierungspuffer enthält Paraformaldehyd. Paraformaldehyd kann Augenschäden, Hautreizungen und Organtoxizität verursachen. Arbeiten Sie in einem gut belüfteten Bereich und tragen Sie geeignete persönliche Schutzausrüstung (PSA).
- Nach der Entnahme der Mediumsproben am 14. Tag werden 300 μl Fixierungspuffer (siehe Materialtabelle) in jede zu färbende Vertiefung gegeben, wie in Abbildung 1C dargestellt. Färben Sie mindestens 2 Vertiefungen.
- Bei 4 °C 20-60 min inkubieren.
- Bereiten Sie 1x Permeabilisierungspuffer (siehe Materialtabelle) vor, indem Sie 5 ml 10x Stammlösung zu 45 ml 1x PBS (siehe Materialtabelle) geben.
HINWEIS: Der 1x Permeabilisierungspuffer kann bei 4° C 1 Monat gelagert werden. - 2 Mal mit 300 μl 1x Permeabilisierungspuffer auf Eis waschen.
- Geben Sie 300 μl Primärantikörper Zytokeratin 18 (siehe Materialtabelle) in einer Verdünnung von 1:1000 in 1x Permeabilisierungspuffer auf Eis hinzu.
HINWEIS: Inkubieren Sie mindestens eine Vertiefung mit 1x Permeabilisierungspuffer nur für eine Sekundärantikörperkontrolle. - 16-24 h bei 4 °C inkubieren.
7. Färbetag II
- Am nächsten Tag wird der Primärantikörper durch Pipettieren oder Vakuumaspiration entfernt.
- 2 mal mit 300 μl pro Vertiefung 1x Permeabilisierungspuffer auf Eis waschen.
- Fügen Sie 300 μl fluoreszierenden Sekundärantikörper (siehe Materialtabelle) in einer Verdünnung von 1:500 in 1-fachem Permeabilisierungspuffer hinzu (nur Sekundärkontrolle enthalten).
HINWEIS: Vermeiden Sie Licht, wenn Sie fluoreszierende Antikörper verwenden. - 30-45 min bei 4 °C im Dunkeln inkubieren.
- Entfernen Sie den sekundären Antikörper durch Pipettieren oder Vakuumaspiration.
- 2 mal mit 300 μl pro Vertiefung 1x Permeabilisierungspuffer auf Eis waschen.
- 1 Mal mit 300 μL pro Well von 1x PBS waschen.
- 150 μl 4′,6-Diamidino-2-phenylindol (DAPI)-Eindeckmedium (siehe Materialtabelle) in jede Vertiefung geben und 15 min bei RT im Dunkeln inkubieren.
HINWEIS: Die Platte kann in Parafilm eingewickelt und bei 4 °C im Dunkeln 1 Woche lang gelagert werden. - Blick unter dem Fluoreszenzmikroskop. Nehmen Sie 5 Bilder von jedem spezifischen Fluoreszenzkanal für jede Vertiefung mit der 10-fach-Objektivlinse auf (stellen Sie sicher, dass ein Bild eine Maßstabsleiste hat).
HINWEIS: DAPI hat eine Anregung/Emission von 358 nm/461 nm. Verwenden Sie ein Fluoreszenzmikroskop, das mit den entsprechenden Detektionsfiltern sowohl für DAPI als auch für den sekundären Antikörper-Fluorophor ausgestattet ist.
8. ImageJ-Analyse (Abbildung 2)
HINWEIS: Es wird empfohlen, ImageJ Version 1.52a oder höher zu verwenden.
- Öffnen Sie ein Bild mit einer Maßstabsleiste in ImageJ. Klicken Sie auf das Symbol "Gerade Linie " und zeichnen Sie eine Linie auf die genaue Länge der Maßstabsleiste [Abbildung 2 (1)]
HINWEIS: Klicken Sie bei Bedarf auf das Symbol "Vergrößerungsglas ", um die Ansicht zu vergrößern oder zu verkleinern. - Klicken Sie auf die Registerkarte Analysieren . Markieren Sie und klicken Sie auf Maßstab festlegen.
- Ändern Sie die bekannte Entfernung in den Abstand der Maßstabsleiste. Ändern Sie die Längeneinheiten in die Einheiten der Maßstabsleiste. Wenden Sie die Einstellungen global an, indem Sie Global aktivieren. Klicken Sie auf OK, um den Maßstab festzulegen.
HINWEIS: Sobald diese Einstellung angewendet wurde, wird für jedes geöffnete Bild der berechnete Bereich des Sichtfelds in vom Benutzer eingegebenen Einheiten angezeigt. - Öffnen Sie ein reines DAPI-Bild in ImageJ. Klicken Sie auf die Registerkarte Prozess und markieren Sie Hintergrund subtrahieren. Entfernen Sie den Hintergrund jeweils 50 Pixel, bis die ungefärbten Bereiche schwarz sind.
HINWEIS: Wenn das Bild keinen Hintergrund enthält, ist dieser Schritt nicht erforderlich. - Klicken Sie auf die Registerkarte Bild und markieren Sie Typ. Klicken Sie auf 8-Bit, um das Bild in Graustufen umzuwandeln [Abbildung 2 (2)].
- Legen Sie den Schwellenwert für das Bild manuell oder automatisch fest, um alle DAPI-Partikel einzuschließen (achten Sie darauf, den Schwellenwert nicht manuell zu überschreiten) [Abbildung 2 (3)]. Klicken Sie auf die Registerkarte Bild und markieren Sie Anpassen. Klicken Sie auf Schwellenwert. Klicken Sie auf Übernehmen , wenn Sie fertig sind.
- Klicken Sie auf die Registerkarte Prozess , und markieren Sie Binär. Klicken Sie auf Abflussgebiet.
- Klicken Sie auf die Registerkarte "Analysieren" und markieren Sie "Partikel analysieren" [Abbildung 2 (4)]. Legen Sie die Größe auf 5-unendlich und die Kreisförmigkeit auf 0,00-1,00 fest. Wählen Sie auf der Dropdown-Registerkarte Anzeigen die Option Konturen aus. Stellen Sie sicher, dass Ergebnisse anzeigen, Zusammenfassen und Bohrungen einschließen aktiviert sind. Klicken Sie auf OK.
HINWEIS: Der gewünschte Partikelbereich kann angepasst werden, wenn der Schwellenwert Hintergrundpixel ergibt. - Zeichnen Sie das Zählergebnis als TOTAL DAPI auf.
- Öffnen Sie ein zusammengeführtes Cytokeratin 18/DAPI-Bild in ImageJ.
- Verwenden Sie das Multi-Point-Symbol [Abbildung 2 (5)], um alle DAPI-Partikel, die nicht für Cytokeratin 18 gefärbt sind, manuell zu zählen.
- Zeichnen Sie das Ergebnis als FEEDER-ZELLEN auf. Verwenden Sie die folgende Gleichung, um die DAPI der Hepatozyten zu bestimmen.
Hepatozyten-DAPI = Gesamt-DAPI - Feeder-Zell-DAPI
9. Quantifizierung der gesamten angehängten Hepatozyten und prozentuale Anheftung (Plattenfähigkeit)
- Erstellen Sie einen Skalierungsfaktor für den 24-Well-Kulturbereich mithilfe der folgenden Gleichung. Die Sichtfeldmessungen befinden sich am oberen Rand jedes geöffneten Bildes [Abbildung 2 (2), grüner Kasten].
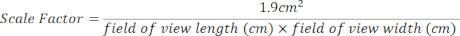
- Berechnen Sie die Gesamtzahl der angehängten Hepatozyten anhand der folgenden Gleichung.
Angehängte Hepatozyten = Skalierungsfaktor × Hepatozyten-DAPI - Berechnen Sie die prozentuale Anheftung der Hepatozyten mit der folgenden Gleichung.
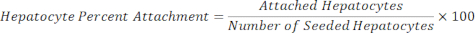
10. Albumin-Assay
- Messen Sie die Albuminproduktion mit einem Sandwich-ELISA (Enzyme-Linked Immunosorbent Assay) (siehe Materialtabelle) an Proben, die im Verhältnis 1:200 verdünnt sind.
HINWEIS: Aus Gründen der Genauigkeit bestätigt der Benutzer, dass die Proben innerhalb des linearen Standardbereichs der Kurve liegen. Das angegebene Kit enthält alle Materialien und Anweisungen zur Durchführung des Assays. - Normalisieren Sie die Probenkonzentrationen auf angehängte Hepatozyten mit der folgenden Gleichung.
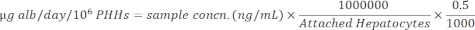
11. Harnstoff-Assay
VORSICHT: Blutharnstoff-Stickstoff (BUN)-Säurereagenz enthält Schwefelsäure. Die Schwefelsäurekonzentration im BUN-Säure-Reagenz gilt als korrosiv. Nicht einnehmen. Arbeiten Sie in einem Bereich mit guter Belüftung und tragen Sie geeignete PSA.
- Die Harnstoffsynthese wird mit einer modifizierten Diacetylmonoxim-Methode gemessen (siehe Materialtabelle).
- Verdünnen Sie 53,3 μl 75 mg/dl Harnstoff in 346,7 μl vollständiges Nährmedium, um Standard #1 (100 μg/ml) herzustellen
- Beschriften Sie die Röhrchen 2-8 und verwenden Sie eine serielle Verdünnung von 1:2, um die Harnstoff-Assay-Standards herzustellen (Tabelle 1).
- Geben Sie 10 μl Probe oder Standard in die Vertiefungen einer schwarzwandigen, durchsichtigen 96-Well-Platte (siehe Materialtabelle).
- Geben Sie 150 μl BUN-Reagenz in jede Vertiefung mit der Probe. Bereiten Sie das BUN-Reagenz vor, indem Sie 1/3 des BUN-Farbreagenzes mit 2/3 BUN-Säurereagenz mischen. Verwenden Sie die folgende Gleichung, um die Berechnungen zu erleichtern.
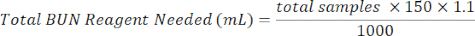
BUN-Farbreagenz (ml) = Benötigtes Gesamt-BUN-Reagenz × 0,333
BUN-Säure-Reagenz (ml) = Benötigtes Gesamt-BUN-Reagenz × 0,667 - Platte für 90 min in einem Ofen oder Inkubator bei 60 °C inkubieren.
- Sofort wird die Plattenabsorption bei 540 nm und 650 nm abgelesen.
- Erstellen Sie eine Standardkurve, indem Sie die Blind- und Hintergrundabsorption (650 nm) von allen Proben und Standards subtrahieren. Generieren Sie eine Best-Fit-Linie durch lineare Regressionsanalyse.
- Bestimmen Sie die unbekannte Probenkonzentration anhand der Standardkurve.
- Normalisieren Sie die Probenkonzentrationen auf angehängte Hepatozyten mit der folgenden Gleichung.
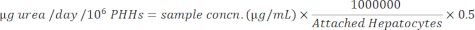
Ergebnisse
Die Gesamtmethode der Plattierung, Kultivierung und grundlegenden Funktionsprüfung des Leberkultursystems umfasst gängige primäre Zellkulturtechniken und -analysen, wie in Abbildung 1 dargestellt. Die Hepatozytenanheftung und die prozentuale Plattenfähigkeit wurden an Tag 14 anhand der ImageJ-Analyse von mindestens fünf Bildern von Cytokeratin 18 und der DAPI-Färbung pro Well berechnet (Abbildung 2). Repräsentative Bilder von PHHs, die mit Feederzellen kultiviert wurden, sind in Abbildung 3 dargestellt. Die verschiedenen hepatischen Aussaatdichten zeigten visuelle Unterschiede in der Konfluenz basierend auf der Aussaatdichte und behielten die typische hepatische, quaderförmige Morphologie für 14 Tage Kultur bei. Für jede getestete Aussaatdichte wurden Bilder der Hepatozytenspender-Lots A und B aufgenommen (Abbildung 4A). Die durchschnittliche prozentuale Beschichtbarkeit für Spender B (89,04 % ± 3,99 %, 198.552 ± 49.885 PHHs) war über alle verwendeten Aussaatdichten hinweg höher als die von Spender A (66,08 % ± 6,67 %, 146.128 ± 33.063 PHHs) (Abbildung 4B). Spender A hatte eine signifikant höhere prozentuale Beschichtbarkeit bei Verwendung von 150.000 PHHs/Well (76,07 % ± 12,87 %) im Vergleich zu 250.000-300.000 PHHs/Well (62,75 % ± 9,64 %). Spender B zeigte keine signifikanten Unterschiede in der prozentualen Plattenfähigkeit der Hepatozyten. Spender B hatte die niedrigste Hepatozyten-Plattenfähigkeit (85,78 % ± 13,25 %) bei der höchsten Aussaatdichte, 300.000 PHHs/Well. Ähnlich wie bei Spender A wies die Aussaat von Spender B mit 150.000 PHHs/Well die höchste prozentuale Beschichtbarkeit der Hepatozyten auf (94,75 % ± 15,07 %).
Die Albuminproduktion und die Harnstoffsynthese wurden zu drei Zeitpunkten während der 14-tägigen Kulturperiode gemessen und auf berechnete angehängte Hepatozyten normalisiert. Insgesamt hatte Spender A eine erhöhte Albuminproduktion im Vergleich zu Spender B (41,32 ± 4,58 μg Alb/Tag/106 PHHs vs. 34,66 ± 10,03 μg Alb/Tag/106 PHHs) (Abbildung 5). Die Spender A und B wiesen mit 150.000 PHHs/Well, 45,91 ± 5,96 μg alb/Tag/106 PHHs bzw. 48,67 ± 20,44 μg alb/Tag/106 PHHs die höchste Albuminproduktion auf. Es wurden keine signifikanten Unterschiede in der Albuminproduktion bei den verwendeten Aussaatdichten festgestellt. Wie von Baudy et al.3 festgestellt, ist es wünschenswert, dass die mikrophysiologischen Systeme der Leber eine konsistente Albuminproduktion und Harnstoffsynthese mit weniger als 50% Veränderung über 14 Tage Kultur aufrechterhalten. Der Variationskoeffizient (CV) wurde berechnet, indem der Mittelwert durch die Standardabweichung für die Tage 7, 10 und 14 dividiert wurde. Alle Proben wurden in Duplikaten durchgeführt. Der CV für die Albuminausbeute während der 14-tägigen Kulturperiode bei 150.000 PHHs/Well betrug 12,24 % für Spender A und 37,97 % für Spender B, weniger als das gewünschte 50 %-Kriterium. Eine hohe Varianz in der Albuminproduktion wurde sowohl bei Spender A als auch bei Spender B beobachtet, wenn sie mit 250.000 und 300.000 PHHs/Well ausgesät wurden. Bei diesen Aussaatdichten kommt es bei beiden Spendern zu einem steilen Rückgang der Albuminproduktion zwischen den Tagen 7, 10 und 14 der Kultur (CV-Spender A, 22,49 % und Spender B, 45,07 %).
Die Harnstoffsynthese von Donor B (95,09 ± 18,91 μg Harnstoff/Tag/106) war im Vergleich zu Donator A (64,92 ± 4,66 μg Harnstoff/Tag/106 PHHs) erhöht, wenn die chargenspezifischen Daten der Tage 7, 10 und 14 PHH gemittelt wurden (Abbildung 6). Spender B (113,49 ± 37,34 μg Harnstoff/Tag/106 PHHs) und Spender A (69,12 ± 17,06 μg Harnstoff/Tag/106 PHHs) wiesen die größte Harnstoffsynthese über eine 14-tägige Kulturperiode bei einer Dichte von 150.000 PHHs/Well bzw. 200.000 PHHs/Well auf. Beide Spenderchargen wiesen mit 300.000 PHHs/Well den niedrigsten Harnstoffausstoß und den höchsten CV-Wert auf. Es wurden keine signifikanten Unterschiede in der Harnstoffsynthese bei den verwendeten Aussaatdichten festgestellt. Die niedrigste CV für die Harnstoffsynthese für Spender A wurde bei der Kultivierung von 250.000 PPHs/Well (23,11 %) und 200.000 PHHs/Well für Spender B (28,26 %) beobachtet. Wie aus diesen Ergebnissen hervorgeht, hängt die optimale Aussaatdichte für eine bestimmte Charge PHH vom Grad der Konfluenz ab, der zum Zeitpunkt des Assays gewünscht wird, und von der Art der Ergebnisse, die gemessen werden. Eine höhere Seeding-Dichte korreliert nicht immer mit einem höheren Signal- oder Dynamikbereich.
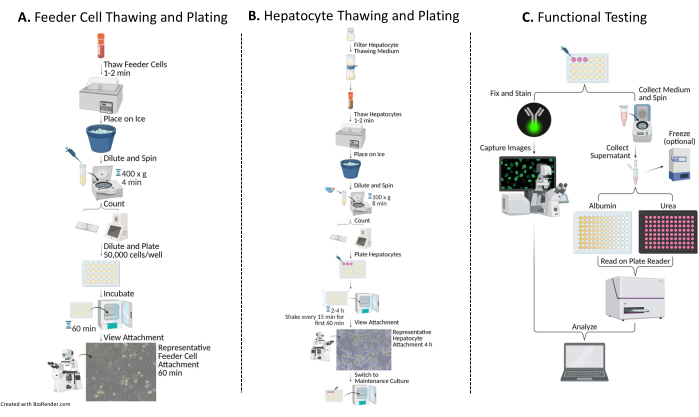
Abbildung 1: Flussdiagramm der Plattierung, Kultivierung und Funktionsprüfung von Hepatozyten mit Feederzellen. (A) Die Feeder-Zellen werden in einem speziellen Auftaumedium aufgetaut (siehe Materialtabelle), in einem vollständigen Beschichtungsmedium resuspendiert (siehe Materialtabelle) und die Zellen werden gezählt. Die Zellen werden verdünnt, plattiert und 60 min lang bei 37 °C/5 %CO2 inkubiert. (B) Hepatozyten werden in einem speziellen Auftaumedium aufgetaut (siehe Materialtabelle), in einem vollständigen Plattierungsmedium resuspendiert und die Zellen gezählt. Die Hepatozyten werden verdünnt und mit Feederzellen plattiert. Die Zellen werden für 2-4 h bei 37 °C/5 %CO2 inkubiert, wobei in den ersten 60 Minuten der Kultur alle 15 Minuten in einer N-S-E-W-Bewegung geschüttelt wird. Das Beschichtungsmedium wird durch ein vorgewärmtes vollständiges Nährmedium ersetzt, um die Kultur zu erhalten (siehe Materialtabelle). Die Kulturen werden täglich gefüttert. (C) An den Tagen 7, 10 und 14 werden mittlere Proben für Albumin- und Harnstofftests entnommen. Nach der Probenentnahme am 14. Tag werden die Zellen fixiert und 16-24 h bei 4 °C mit dem Antikörper Cytokeratin 18 (siehe Materialtabelle) gefärbt. Darüber hinaus werden sie in einem geeigneten sekundären Antikörper inkubiert, gewaschen und mit DAPI (siehe Materialtabelle) zur Aufnahme und Bildanalyse eingelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Bildanalyse mit der Software ImageJ. ImageJ-Verarbeitung von aufgenommenen Bildern. Schritt 1: Auf alle Bilder wird eine Skala angewendet, die auf der mikroskopspezifischen Maßstabsleiste basiert. Schritt 2: Der Bildtyp wird geändert. Schritt 3: Ein Schwellenwert wird angewendet, um DAPI-Partikel auszuwählen. Schritt 4: Es wird eine Partikelanalyse durchgeführt und die Zählung aufgezeichnet. Schritt 5: Um die Anzahl der angehängten Feeder-Zellen zu bestimmen, wird ein zusammengefügtes Bild mit dem Multi-Point-Tool gezählt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
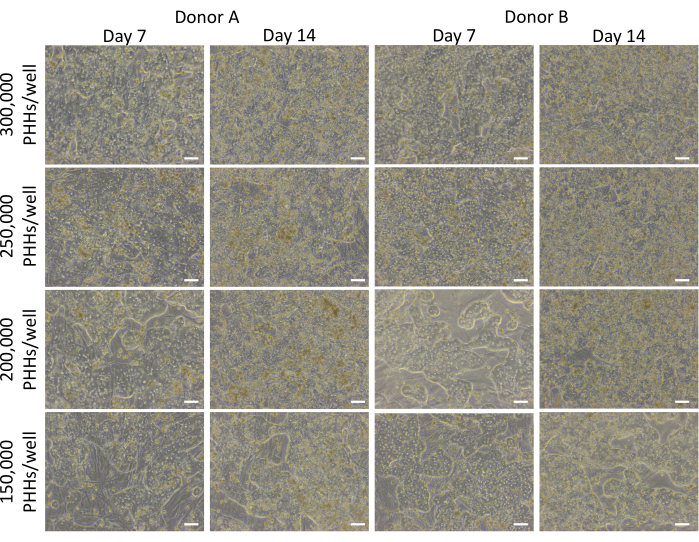
Abbildung 3: Morphologie verschiedener hepatischer Aussaatdichten, kultiviert mit Feederzellen. Repräsentative Bilder an den Tagen 7 und 14 von PHHs, die mit Feederzellen (50.000 Zellen/Well) bei hepatischen Aussaatdichten von 150.000, 200.000, 250.000 und 300.000 PHHs/Wells kultiviert wurden. Die Bilder wurden mit einem 10-fach-Objektiv an einem inversen Phasenkontrastmikroskop aufgenommen. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
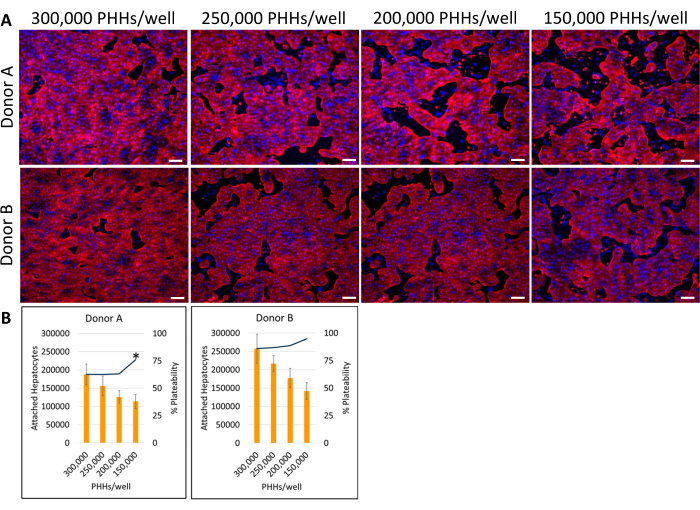
Abbildung 4: Fluoreszierende Immunzytochemie verschiedener hepatischer Aussaatdichten, kultiviert mit Feederzellen. (A) Repräsentative Bilder der Cytokeratin-18-Färbung (rot) an Tag 14 bei hepatischen Aussaatdichten von 150.000, 200.000, 250.000 und 300.000 PHHs/Wells. Zwei Vertiefungen für jede Aussaatdichte wurden für 30 min bei 4 °C fixiert. Die Wells wurden 16-24 h bei 4° C mit Primärantikörper bei 1:1000 inkubiert. Ein sekundärer Antikörper wurde bei 1:500 für 30 min bei 4 °C im Dunkeln verwendet. Die Kernfärbung DAPI (blau) wurde 15 Minuten lang bei Raumtemperatur in die Vertiefungen gegeben. Die Bilder wurden mit einem 10-fachen Objektiv auf einem inversen Fluoreszenzmikroskop aufgenommen. Maßstabsbalken = 100 μm. (B) Berechnete angehängte Hepatozyten und prozentuale Plattenfähigkeit verschiedener hepatischer Seeding-Dichten, berechnet mit ImageJ. *p ≤ 0,05 bis zur prozentualen Plattenfähigkeit für 200.000, 250.000 und 300.000 PHHs/Well. Fehlerbalken stellen die Standardabweichung dar (n ≥ 5 Bilder pro Bedingung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
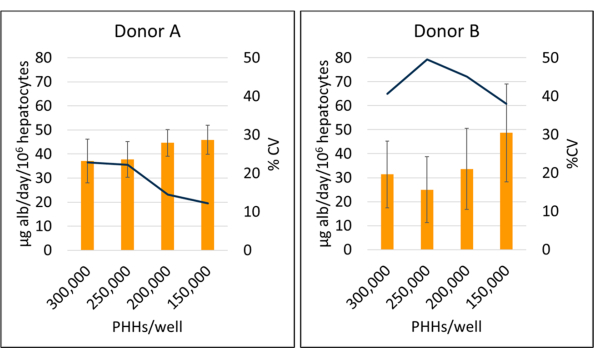
Abbildung 5: Albuminproduktion von Hepatozyten, die mit Feederzellen kultiviert wurden. Albuminproduktion aus hepatischen Aussaatdichten bei 150.000, 200.000, 250.000 und 300.000 PHHs/Well. Die Spalten stellen den 14-Tage-Durchschnitt von Mikrogramm Albumin/Tag dar, normalisiert auf die Gesamtzahl der angehängten Hepatozyten. Eine Linie stellt den Lebenslauf zwischen den Tagen 7, 10 und 14 dar. Fehlerbalken stellen die Standardabweichung dar (n ≥ 2 Wells pro Bedingung mit Replikationen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
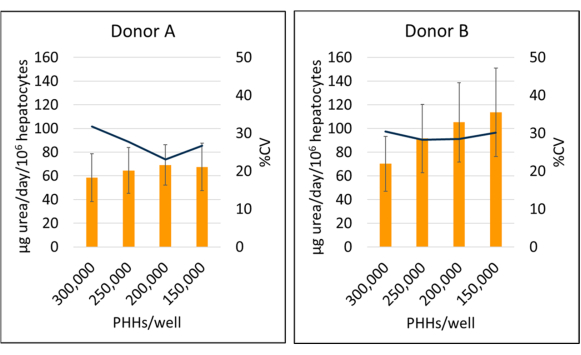
Abbildung 6: Harnstoffsynthese von Hepatozyten, die mit Feederzellen kultiviert wurden. Harnstoffsynthese aus hepatischen Aussaatdichten bei 150.000, 200.000, 250.000 und 300.000 PHHs/Well. Die Säulen stellen den 14-Tage-Durchschnitt von μg Harnstoff/Tag dar, normalisiert auf die Gesamtzahl der angehängten Hepatozyten. Eine Linie stellt %CV zwischen den Tagen 7, 10 und 14 dar. Fehlerbalken stellen die Standardabweichung dar (n ≥ 2 Wells pro Bedingung mit Replikationen). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Standard (S) # | Konzentration (μg/ml) | Harnstoff-Lösung (μL) | Vollständige Kultur (μL) |
| 1 | 100 | 53.3 75 mg/dl Brühe | 346.7 |
| 2 | 50 | 100 (S1-Lösung) | 100 |
| 3 | 25 | 100 (S2-Lösung) | 100 |
| 4 | 12.5 | 100 (S3-Lösung) | 100 |
| 5 | 6.26 | 100 (S4-Lösung) | 100 |
| 6 | 3.125 | 100 (S5-Lösung) | 100 |
| 7 | 1.5625 | 100 (S6-Lösung) | 100 |
| Leer | 0 | 0 | 100 |
Tabelle 1: Harnstoff-Standardprobenvorbereitung. Mit 75 mg/dl Harnstoff eine 100 μg/ml Harnstofflösung herstellen. Aliquotieren Sie die vorgeschlagenen Volumina, um die Endkonzentration für die Standardkurve zu erreichen.
Diskussion
Das beschriebene Leberkultursystem kann in Laboratorien etabliert werden, die mit Standard-Gewebekulturinstrumenten ausgestattet sind. Das System besteht aus PHHs, die mit Feeder-Zellen kultiviert wurden, und ermöglicht es dem Benutzer, PHHs mindestens zwei Wochen lang mit stabiler Albuminproduktion und Harnstoffsynthese zu kultivieren. Aufgrund der Variabilität der PHH-Spenderchargen werden nur vorgeprüfte und qualifizierte PHHs für die Verwendung im System empfohlen. Obwohl die Anzahl der gebundenen PHHs je nach Spendercharge und Aussaatdichte variiert, bleibt die relative Plattenfähigkeit innerhalb jeder Spendercharge ähnlich. Während empfohlene Aussaatdichten empfohlen werden, deuten die oben genannten Daten darauf hin, dass die Aussaatdichte von Hepatozyten an unterschiedliche experimentelle Bedürfnisse angepasst werden kann. Es sollte jedoch beachtet werden, dass das Seeding einer größeren Anzahl von PHHs möglicherweise keine höheren oder konsistenteren funktionalen Ergebnisse liefert. Die Analyse der ausgewerteten PHH-Chargen ergab den niedrigsten CV für die Albuminproduktion und die Harnstoffsynthese bei niedrigeren Aussaatdichten von 150.000 PHHs/Well und 200.000 PHHs/Well; Es wurden jedoch keine signifikanten Unterschiede zwischen Albumin und Harnstoff bei irgendeiner Aussaatdichte gefunden. Höhere Aussaatdichten von 250.000 PHHs/Well und 300.000 PHHs/Well zeigen eine stärkere Abnahme von Albumin und Harnstoff über die 14-tägige Kulturperiode. Die inhärente Variabilität der Plattenfähigkeit der Spender kann die Konsistenz der Albuminproduktion und der Harnstoffsynthese bei 250.000 PHHs/Well und 300.000 PHHs/Well für die getesteten Spenderchargen beeinträchtigen. Ähnlich wie bei großen Hepatozyten-Sphäroiden kann die Übersaat von PHHs im TV2D+-System negative Auswirkungen auf die Langzeitkultur und -funktionalität von PHHs haben.
Alle Schritte des Auftauens, der Beschichtung und der Wartung sind entscheidend für eine erfolgreiche Kultur- und Datengenerierung. Es gibt jedoch einige häufige Fehler, die unerfahrene Benutzer vermeiden können. PHHs sind sehr anfällig für Schäden infolge von Temperaturschwankungen, Scherspannungen und Lufteinwirkung 9,10. Beim Auftauen von PHHs sollten Vorsichtsmaßnahmen getroffen werden, um längere Auftauzeiten und übermäßiges Pipettieren zu vermeiden. Die Verwendung einer Handgießmethode, eines Timers und des sofortigen Transfers vom Wasserbad auf Eis reduziert diese häufigen Fehler, die die Lebensfähigkeit und Plattenfähigkeit der PHHs beeinträchtigen können. Da Probleme in der Lieferkette immer häufiger auftreten, kann es außerdem schwierig sein, kollagenbeschichtete Platten zu erhalten. Die manuelle Beschichtung von mit Gewebekulturen behandelten Platten mit handelsüblichen Lösungen von Kollagen Typ I (5-10 μg/cm2) kann verwendet werden, um dieses Problem zu lösen. Für eine optimale Leistung und Konsistenz wird jedoch empfohlen, vorbeschichtete Kollagenplatten zu verwenden. Beim Übergang von der reinen Feederzellkultur zur Einführung von PHHs ist es wichtig, ein Austrocknen der Feederzellschicht zu verhindern. Lassen Sie die Feeder-Zellen niemals mit Luft in Berührung kommen. Jede Expositionszeit an der Luft kann zu einer schlechten Qualität der Feeder-Zellschicht führen, was sich negativ auf die Langzeitkultur von PHHs auswirkt. Es empfiehlt sich, eine kleine Menge Restmedium zwischen den Mediumwechseln verbleiben zu lassen. Gelegentlich können PHHs überschüssige Ablagerungen aus der Isolierung enthalten, was die Betrachtung der Morphologie erschweren kann. Um dieses Problem zu lösen, schütteln Sie die Platte vor einem Mediumwechsel und verwenden Sie eine Vakuumaspiration. Wenn Sie schließlich einen Mediumwechsel durchführen, saugen Sie das verbrauchte Medium vorsichtig an und achten Sie darauf, die kultivierten Zellen nicht zu stören. Pipettieren Sie frisches Mediumvolumen an der Seite des Wells, um zu vermeiden, dass Sie direkt auf die Zellschicht pipettieren. Der Benutzer sollte auch die Luftexposition bei jedem Medienwechsel vermeiden, indem er den empfohlenen 3-Well-Wechsel (Abschnitte 3 und 4) verwendet. Zu beachten ist auch, dass ein täglicher Mediumwechsel ideal, aber nicht erforderlich ist.
Obwohl Fluoreszenzmikroskope in den meisten Laboren üblich geworden sind, kann die Software, die für die Durchführung spezifischer Bildanalysen benötigt wird, zusätzliche Kosten verursachen. ImageJ kann kostenlos heruntergeladen werden, was es zu einem leicht zugänglichen Bildanalysewerkzeug macht. Die Schritte im Protokoll bieten eine Grundlage, auf der der Benutzer möglicherweise optimieren muss, insbesondere die Partikelanalyse der DAPI-Färbung; In Ermangelung einer Fluoreszenzbildgebung werden die PHH-Bindungswerte an Tag 14 jedoch auf chargenspezifischen Analysezertifikaten angegeben. Ein schlechter Schwellenwert führt zu einer ungenauen Zählung der DAPI-Partikel. Es wird auch empfohlen, die Oberfläche einzelner DAPI-Partikel zu überprüfen, bevor Sie einen Größenausschluss festlegen. Dies kann erreicht werden, indem Sie das ovale Symbol [Abbildung 2 (1), Kreissymbol unter der Registerkarte Bearbeiten ] verwenden und einen Kreis zeichnen, der das DAPI-Partikel umfasst. Auf der Registerkarte Analysieren kann dann die Fläche des ausgewählten DAPI-Partikels gemessen werden. Bestimmte Messungen können über die Option Messungen festlegen auf der Registerkarte Analysieren ausgewählt werden [Schritt 8.9 und Abbildung 2 (4)].
Derzeitige Methoden zur Kultivierung von PHHs beinhalten die Verwendung von Beschichtungen wie Kollagen-I zur Erhöhung der Zelladhäsion in traditionellen 2-dimensionalen Monokulturen11 oder die Überlagerung mit einer extrazellulären Matrix, wie das murinbasierte Matrigel, eine Technik, die allgemein als "Sandwichkultur" bezeichnet wird12,13,14,15. Während die Sandwich-Kulturtechnik die PHH-Morphologie und -Polarität im Vergleich zur traditionellen Monokultur im Laufe der Zeit verbessert, fehlt es beiden Ansätzen immer noch an langfristiger phänotypischer Stabilität in der Kultur für die meisten plattierbaren Chargen von PHHs. Eine weitere Methode zur Kultivierung von PHHs ist die Herstellung von 3D-Sphäroide. Wie bereits von Glicklis et al.4 erwähnt, kann es jedoch aufgrund der Variabilität der Spender technische Herausforderungen bei der Reproduzierbarkeit der Sphäroidgröße geben. In dem Bestreben, ein physiologisch relevanteres Lebermodell zu erstellen, wurden mehrzellige Modelle entwickelt. Wie von Ware et al.7 beschrieben, ermöglichten murine Fibroblasten und primäre menschliche Lebersinus-Endothelzellen, die von PHHs umgeben waren, mit Hilfe von Mikrostrukturierung längere In-vitro-Kulturzeiten. Die Mikrostrukturierung kann jedoch ein komplexer und zeitaufwändiger Prozess sein, und die nicht-menschlichen Feeder-Zellen können zum Hintergrund von Stoffwechselsignalen beitragen, was den Nutzen dieser Plattform in bestimmten Anwendungen einschränkt. Die Verwendung verschiedener Nicht-Leberzellen, einschließlich dermaler Fibroblasten von Menschen und Ratten sowie Endothelzellen der Rinderaorta als Feederzellen für die Co-Kultur von Hepatozyten hat eine Albuminsekretion und Tight-Junction-Bildung gezeigt, die denen von Kokulturen von Feederzellen aus der Leber ähnelt16. Der Mechanismus der Interaktionen zwischen TV2D+-Nicht-Leber-Feederzellen und den PHHs in Kultur muss jedoch weiter untersucht werden, um den Einfluss auf die Stabilität und Funktionalität der PHHs in diesem System besser zu verstehen. Das zuvor von Weaver et al.8 beschriebene Kultursystem kann PHHs in Leberkolonien bis zu 42 Tage lang erfolgreich kultivieren und dabei ausgedehnte gallenkanalikuläre Netzwerke bilden. Die PHHs, die in diesem System kultiviert wurden, behielten die wichtigsten Leberfunktionen bei, einschließlich der Aktivität von Cytochrom 1A2, 2B6 und 3A4 und der auf Uridine 5′-Diphospho-Glucuronosyltransferase (UGT) basierenden Enzymaktivität, der Metabolitenbildung der Phasen I und II, der Albuminproduktion und der Harnstoffsynthese für mindestens 22 Tage in vitro ohne Matrigel. Dieses Kultursystem erzeugt stabile, physiologisch relevante Ergebnisse, die für pharmakologische und toxikologische Anwendungen leicht an jedes Labor angepasst werden können. Obwohl wichtige PHH-Funktionen im TV2D+-System beibehalten werden, wurden keine direkten Vergleiche mit dem 3D-Sphäroidmodell angestellt. Zukünftige Arbeiten, die dieselben PHH-Donatoren zwischen den Kultursystemen vergleichen, werden sich jedoch als wertvoll erweisen, um die Grenzen und Vorteile beider Methoden zu bestimmen.
Zu den möglichen Anwendungen von TV2D+ gehören die Bewertung der metabolischen Clearance und der Arzneimittelwechselwirkungen von Verbindungen mit geringem Umsatz, arzneimittelinduzierte Leberschäden und die Risikobewertung von Agrochemikalien. Die genaue Vorhersage der hepatischen Clearance von neuen und aufkommenden Medikamenten hängt von einer stabilen und verlängerten PHH-Kultur unter Beibehaltung der wichtigsten hepatozellulären Funktionalität ab, was bei der Bewertung von Verbindungen mit geringem Umsatz eine besondere Herausforderung darstellt. Darüber hinaus sind die Risikobewertung und die chemisch induzierte Lebertoxizität ein großes Gesundheitsproblem, und die derzeitigen Modelle bieten nicht die langfristige Stabilität und Funktionalität in Kultur, um eine potenzielle chronische chemische Toxizität, die als Folge einer akuten Exposition auftreten kann, genau zu bewerten. Gesunde und erkrankte PHHs, die in TV2D+ kultiviert wurden, zeigten charakteristische Unterschiede in der Funktion und Lipiddisposition, die über die Zeit erhalten blieben17. Diese Studien unterstützen TV2D+ als vielversprechendes Werkzeug für eine Vielzahl pharmakologischer und toxikologischer Anwendungen.
Offenlegungen
JO, LW, EG, EL, SP und JW sind Mitarbeiter von LifeNet Health, der gemeinnützigen Organisation, die TV2D+ produziert.
Danksagungen
Wir danken Mellissa Keller und Wendy Hetman für ihre Unterstützung bei der Manuskript- und Abbildungsprüfung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES filter unit | Thermo Fisher Scientific | 565-0020 | User preference |
| 15 mL or 50 mL conical tubes | Thermo Fisher Scientific | 352196 or 352070 | User preference |
| Alexa Fluor 555, goat anti-rabbit | Thermo Fisher Scientific | A-21428 | Other secondary antibodies can work |
| Anti-Cytokeratin 18 antibody | abcam | ab24561 | Necessary using same dilution |
| AOPI | Nexcelom | CS2-0106-5mL | Used for Cellometer counting |
| Biosafety cabinet | Labconoco | 3460801 | User preference |
| Black-walled, clear bottom, 96-well plate | Thermo Fisher Scientific | 165305 | User preference |
| Centrifuge | Thermo Fisher Scientific | Sorvall X4R | Capable of speeds up to 400 x g |
| Collagen coated plate, 24-well | Greiner Bio-One | 662950 | Rat tail collagen coating |
| Counting slides | Nexcelom | CHT4-SD100-002 | Used for Cellometer counting |
| Culture medium | LifeNet Health | MED-TCCM | |
| Culture supplement | LifeNet Health | MED-TCSC | |
| DAPI | Thermo Fisher Scientific | 00-4959-52 | Contains mounting medium |
| DPBS (-Ca, -Mg) | Thermo Fisher Scientific | 14190250 | User preference |
| Feeder cell supplement | LifeNet Health | MED-TCSA | |
| Feeder cell thawing medium | LifeNet Health | MED-FCTM | |
| Fluorescent microscope | Zeiss | AxioObserver Z1 | Equipped with user specific filters |
| Hepatocyte thawing medium | LifeNet Health | MED-HHTM4C-50ML | |
| Human albumin ELISA kit | abcam | ab108788 | Necessary if using same dilution |
| Human feeder cells | LifeNet Health | PHFC24 | |
| Humidified incubator | VWR | 97025-842 | Capable of 5% CO2 |
| IC Fixation buffer | Thermo Fisher Scientific | 00-8222-49 | Paraformaldehyde based, 10% formalin can also be used |
| ImageJ | National Insitute of Health | Version 1.52a | 1.52a or higher |
| Inverted phase contrast microscope | Olympus | CK40-F100 | User preference |
| Microcentrifuge tubes | VWR | 20170-022 | User preference |
| Micropipettes (various sizes) | USA Scientific | ErgoOne | User preference |
| Permeabilization buffer (10x) | Thermo Fisher Scientific | 00-8333-56 | Other permeabilization buffers can work |
| Plate reader | BMG Labtech | CLARIOstar | Capable of reading absorbance 450-640 nm |
| Plating medium | LifeNet Health | MED-TCPM | |
| Plating supplement | LifeNet Health | MED-TCSB | |
| Primary human hepatocytes | LifeNet Health | various | Catalog number may vary based on lot number |
| Secondary antibody | Thermo Fisher Scientific | A-21428 | User preference |
| Serological pipet controller | Gilson | F110120 | User preference |
| Storage bottle 100–500 mL | VWR | 76311-770 | User preference |
| Urea Nitrogen (BUN) Test | Stanbio | 0580-250 | |
| Water bath | PolyScience | WBE05 | Capable for use at 37 °C |
Referenzen
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- Swift, B., Pfeifer, N. D., Brouwer, K. L. Sandwich-cultured hepatocytes: an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity. Drug Metabolism Reviews. 42 (3), 446-471 (2010).
- Baudy, A. R., et al. Liver microphysiological systems development guidelines for safety risk assessment in the pharmaceutical industry. Lab on a Chip. 20 (2), 215-225 (2020).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Khetani, S. R., et al. Microengineered liver tissues for drug testing. Journal of Laboratory Automation. 20 (3), 216-250 (2015).
- Monckton, C. P., Brown, G. E., Khetani, S. R. Latest impact of engineered human liver platforms on drug development. APL Bioengineering. 5 (3), 031506 (2021).
- Ware, B. R., Durham, M. J., Monckton, C. P., Khetani, S. R. A cell culture platform to maintain long-term phenotype of primary human hepatocytes and endothelial cells. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 187-207 (2018).
- Weaver, J. R., et al. The morphology, functionality, and longevity of a novel all human hepatic cell-based tri-culture system. Toxicology In Vitro. 86, 105504 (2023).
- Li, W., et al. Matrix stiffness and shear stresses modulate hepatocyte functions in a fibrotic liver sinusoidal model. American Journal of Physiology, Gastrointestinal and Liver Physiology. 320 (3), G272-G282 (2021).
- Thompson, S. M., et al. Heat stress induced cell death mechanisms in hepatocytes and hepatocellular carcinoma: in vitro and in vivo study. Lasers in Surgery and Medicine. 46 (4), 290-301 (2014).
- Mooney, D., et al. Switching from differentiation to growth in hepatocytes: control by extracellular matrix. Journal of Cellular Physiology. 151 (3), 497-505 (1992).
- Berthiaume, F., Moghe, P. V., Toner, M., Yarmush, M. L. Effect of extracellular matrix topology on cell structure, function, and physiological responsiveness: hepatocytes cultured in a sandwich configuration. The FASEB Journal. 10 (13), 1471-1484 (1996).
- Hamilton, G. A., et al. Regulation of cell morphology and cytochrome P450 expression in human hepatocytes by extracellular matrix and cell-cell interactions. Cell and Tissue Research. 306 (1), 85-99 (2001).
- Orkin, R. W., et al. A murine tumor producing a matrix of basement membrane. Journal of Experimental Medicine. 145 (1), 204-220 (1977).
- Sivaraman, A., et al. A microscale in vitro physiological model of the liver: predictive screens for drug metabolism and enzyme induction. Current Drug Metabolism. 6 (6), 569-591 (2005).
- Goulet, F., Normand, C., Morin, O. Cellular interactions promote tissue-specific function, biomatrix deposition and junctional communication of primary cultured hepatocytes. Hepatology. 8 (5), 1010-1018 (1988).
- Odanga, J. J., Breathwaite, E. K., Presnel, S., LeCluyse, E. L., Weaver, J. R. Characterization of primary human hepatocytes from diseased and healthy livers in an all-human cell based triculture system. The Toxicologist, a Supplement to Toxicological Sciences. , 4283 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten