Method Article
Um Sistema de Cultura Hepática Totalmente Humano para Aplicações no Desenvolvimento de Fármacos
Neste Artigo
Resumo
Avanços técnicos recentes possibilitaram a produção em escala de uma plataforma in vitro para aplicações em metabolismo e toxicidade de fármacos. Um sistema hepático 2D+ totalmente humano (TV2D+) fornece resultados fisiologicamente relevantes usando métodos tradicionais de cultura bidimensional. Esse protocolo dará suporte aos usuários finais na configuração, manutenção e aplicação do sistema.
Resumo
Encontrar um modelo de cultura relevante para humanos a longo prazo para hepatócitos humanos primários (HPHs) para estudos farmacológicos e toxicológicos permanece um desafio. As plataformas atuais de modelos in vitro são frequentemente inconvenientes e complexas, carecem de estabilidade fenotípica ao longo do tempo e não suportam múltiplos lotes de PHH, carecendo de reprodutibilidade e flexibilidade experimentais. Aqui, fornecemos um protocolo detalhado para o descongelamento, plaqueamento e manutenção de um sistema hepático 2D+ totalmente humano (TV2D+), que aproveita as técnicas e equipamentos de cultura bidimensional (2D) padrão, mantendo a longevidade e a estabilidade fenotípica ao longo do tempo que normalmente acompanham sistemas tridimensionais (3D) mais complexos. Os resultados mostram fixação e porcentagem de plaqueabilidade em TV2D+ em função da densidade de semeadura de PHH, bem como funcionalidade estável por pelo menos 2 semanas em cultura. Uma variedade de densidades de semeadura de PHH é avaliada para alcançar um cultivo bem-sucedido a longo prazo. Quando estabelecidas adequadamente, as HPHs em TV2D+ organizam-se em colônias de hepatócitos, expressam um marcador hepato-específico e mantêm viabilidade, integridade arquitetural e níveis fisiologicamente relevantes de albumina e ureia. Esta combinação única de atributos torna o sistema TV2D+ um modelo hepático adequado para uma variedade de aplicações farmacológicas e toxicológicas.
Introdução
Predizer a segurança e eficácia terapêutica é uma parte importante do desenvolvimento pré-clínico de medicamentos. No entanto, os modelos hepáticos pré-clínicos convencionais in vitro são limitados em sua capacidade de mimetizar com precisão o microambiente celular hepático in vivo e manter a funcionalidade e a morfologia dos hepatócitos ao longo do tempo. Há necessidade de modelos que forneçam competência metabólica estável por mais de 1 semana para avaliar compostos de turnover lento ou investigar desfechos associados à exposição subaguda ou crônica. Testes in vivo em animais frequentemente falham em predizer a eficácia e o risco do fármaco devido a diferenças translacionais entre espécies e mecanismos de depuração hepática humana1. Os modelos hepáticos atuais in vitro de 2 dimensões (2D), como a monocultura primária tradicional de hepatócitos humanos (PHH) ou culturas sanduíche, carecem de estabilidade fenotípica e longevidade em cultura, levando à perda da função hepatocelular chave e integridade arquitetural ao longo do tempo2. Um método alternativo envolve a formação de esferoides hepatócitos tridimensionais (3D), oferecendo um microambiente mais relevante do que a cultura 2D. Entretanto, esse método é limitado pela disponibilidade de matéria-prima, seleção do lote doador de PHH, reprodutibilidade e perda de viabilidade com o aumento do tamanho do esferoide 3,4,5,6. Plataformas multicelulares foram introduzidas por meio das quais PHHs são semeadas com células alimentadoras em placas de tamanho fixo e micropadronizadas. Embora esses modelos possam permitir tempos de cultivo mais longos, células alimentadoras não humanas usadas nessas plataformas podem alterar os resultados experimentais e limitar sua aplicação devido à contribuição inata de fundo para a depuração de drogas e perfis metabólicos 1,7. O sistema hepático 2D+ totalmente humano TruVivo (TV2D+) recentemente descrito em Weaver, et al8, foi desenvolvido para abordar algumas das limitações dos métodos tradicionais, de co-cultivo e de cultura 3D de HPHs. As células não alimentadoras de fígado reduzem as diferenças interespécies no metabolismo e na produção parácrina e fornecem o suporte necessário para hepatócitos primários de forma reprodutível e robusta que não pode ser fornecida por células hepáticas não parenquimatosas correspondentes de um único lote de doadores devido a limitações na expansão, fenótipo e desempenho. As células alimentadoras escolhidas foram capazes de ser consistentemente expandidas antes do uso e não tiveram a necessidade de transformação ou diferenciação. Como descrito por Glicklis et al.4 e Khetani et al.5, modelos de cultura 3D como os esferoides de hepatócitos apresentam desafios com a reprodutibilidade devido à variabilidade do doador e à manutenção da consistência no tamanho do esferoide, o que afeta a difusão de nutrientes em esferoides maiores que 200 μm, levando à diminuição da viabilidade e funcionalidade. Como a formação esferoide 3D, o sistema TV2D+ depende da auto-montagem de PHHs; no entanto, as colônias de PHH formadas estão dispersas sobre a área superficial do poço a uma profundidade de célula única, em vez de compactadas em um único agregado. Este método de cultura pode ser útil para abordar a variabilidade do doador, permitindo que os PHHs sejam plaqueados, cultivados e mantenham a funcionalidade básica em várias densidades de semeadura. O sistema TV2D+ também pode aumentar a robustez do manuseio do usuário devido à perda durante a manipulação ou equipamentos especializados necessários para realizar cultura estendida em esferoides 3D.
O sistema TV2D+ combina a cultura 2D padrão com a longevidade e estabilidade fenotípica que normalmente acompanham os sistemas 3D. O protocolo aqui descrito fornece instruções passo a passo para usuários com habilidades básicas de cultura de tecidos em laboratórios equipados com equipamentos padrão, como gabinetes de biossegurança, centrífugas e incubadoras de CO2 . Cada etapa do processo é descrita em detalhes, incluindo a preparação do meio, descongelamento, chapeamento e manutenção do sistema de cultura resultante. O protocolo também contém um método para determinar as saídas básicas da funcionalidade dos hepatócitos, albumina e ureia, bem como análise de imagens de imunofluorescência para determinar a fixação de HPH para normalização. Quando adequadamente estabelecidos, os HPHs em TV2D+ organizam-se em colônias de hepatócitos, mimetizando a morfologia hepática nativa, e mantêm viabilidade prolongada, integridade arquitetural e níveis fisiologicamente relevantes de albumina e ureia por pelo menos 2 semanas8. Como o sistema pode permitir uma variedade de densidades de semeadura de PHH, ele pode ser útil para aumentar a disponibilidade de lotes de PHH menos plaqueáveis que tenham características desejáveis de doadores. Esta combinação de acessibilidade e funcionalidade faz do TV2D+ um modelo hepático adequado para uma variedade de aplicações farmacológicas e toxicológicas.
Protocolo
Este protocolo segue as diretrizes do comitê de ética da Lifenet Health. O manuscrito não contém estudos com participantes humanos ou estudos em animais realizados por qualquer um dos autores. Todas as células foram isoladas do tecido doador totalmente consentidas para fins de pesquisa pela Lifenet Health.
1. Preparação do meio
- Descongelar uma garrafa em cada meio de descongelamento de células alimentadoras, suplemento A, suplemento B e suplemento C (ver Tabela de Materiais) em banho-maria a 37 °C ou 16-24 h a 4 °C.
- Alíquota todo o frasco (10 mL) de meio de descongelamento de células alimentadoras em um tubo cônico de 15 mL ou 50 mL.
NOTA: O tamanho da pastilha de célula será mais fácil de visualizar usando um tubo cônico de 15 mL. - Adicionar 4,5 ml de suplemento B e 11 ml de suplemento A a um frasco de meio de chapeamento (75 ml) (ver Tabela de Materiais) para obter um meio de chapeamento completo.
NOTA: O meio de plaqueamento completo tem uma concentração de FBS <5% v/v. - Em um frasco separado, adicione 100 mL de meio de cultura (ver Tabela de Materiais), 1 mL de suplemento C e 14 mL de suplemento A para fazer um meio de cultura completo.
NOTA: O meio de cultura completo tem uma concentração de FBS <1% v/v - Conservar o suplemento C restante e o suplemento A a -20 °C até à preparação média da semana 2.
NOTA: Ciclos repetidos de congelamento-descongelamento reduzirão a vida útil dos suplementos. Recomenda-se congelar-descongelar apenas uma vez. - Antes do uso, aquecer 10 mL de meio de descongelamento de células alimentadoras, meio de descongelamento de hepatócitos, meio de plaqueamento completo e meio de cultura completo por 20-30 min em banho-maria a 37 °C.
2. Descongelamento, contagem e revestimento de células alimentadoras humanas (Figura 1A)
- Cultivar as células alimentadoras aproximadamente 1 h antes da semeadura PHHs. Descongelar células alimentadoras (ver Tabela de Materiais) em banho-maria a 37 °C por 1-2 min.
NOTA: Evite a exposição prolongada (por exemplo, >2 min) monitorando o descongelamento e removendo o frasco para injetáveis quando o líquido se solta no criovial quando invertido. - Imediatamente após o descongelamento, coloque as células alimentadoras no gelo.
- Usando técnicas assépticas, em um gabinete de biossegurança (BSC), adicionar células recém-descongeladas a 10 mL de meio de descongelamento de células alimentadoras.
- Use uma pipeta de 1000 μL para lavar o frasco para injetáveis uma vez com 1 mL de suspensão de meio celular/descongelamento e colete.
- Gire a 400 x g por 4 min à temperatura ambiente (TR).
- Descarte cuidadosamente o sobrenadante para não perturbar o pellet celular por pipetagem ou aspiração a vácuo. Ressuspender o pellet celular em 1 mL de meio de plaqueamento completo e contar as células alimentadoras.
NOTA: As células alimentadoras podem ser contadas usando laranja de acridina e iodeto de propídio (AOPI) em um contador de células automatizado ou azul de tripano usando um hemicômetro. As contagens de células podem variar dependendo da tecnologia e do usuário. Para melhores resultados, conte amostras duplicadas e permaneça consistente na metodologia escolhida. - Diluir a suspensão celular para 100.000 células/mL usando o meio de revestimento completo.
- Placa de 500 μL (50.000 células) por poço da suspensão celular diluída em uma placa de 24 poços revestida de colágeno (ver Tabela de Materiais).
- Agite a placa em um movimento Norte (N)-Sul (S)-Leste (E)-Oeste (W) usando um movimento de vaivém na direção N-S 2 vezes seguido pelo mesmo movimento E-W. Repita este protocolo de agitação mais 2 vezes para um total de 3 rodadas.
NOTA: Execute o tremor usando força moderada para evitar respingos na tampa da placa enquanto ainda auxilia na distribuição celular (consulte o vídeo). - Incubar a 37 °C/5% CO2 durante 60 min.
- Veja a fixação da célula alimentadora antes de proceder ao descongelamento dos hepatócitos.
NOTA: A conexão de célula de alimentação aceitável é visualmente aproximadamente 50% confluente.
3. Descongelamento, contagem e plaqueamento de hepatócitos humanos primários (Figura 1B)
- Após 30 min de cultura de células alimentadoras, filtre o meio de descongelamento de hepatócitos pré-aquecido através de uma unidade filtrante de polietersulfona (PES) de 0,2 μm.
- Descongelar PHHs em banho-maria a 37 °C por 1-2 min.
NOTA: Evite a exposição prolongada (por exemplo, >2 min) monitorando o descongelamento e removendo o frasco para injetáveis quando o líquido se solta no criovial quando invertido. - Imediatamente após o descongelamento, coloque PHHs no gelo.
- Em um BSC, despeje a suspensão de PHH no meio de descongelamento do hepatócito.
NOTA: Evite pipetar suspensões de células PHH quando possível. É mais crítico não realizar pipetagem durante a transferência de PHHs descongelados do meio criovial para o meio de descongelamento. - Use uma pipeta de 1000 μL para lavar o frasco para injetáveis 3-4 vezes, pipetando suavemente 1 mL de suspensão de hepatócitos/meio de descongelamento de volta para o frasco para injetáveis e coletando a lavagem despejando-a de volta no meio de descongelamento.
- Tampar e inverter suavemente a suspensão PHH descongelada 5 vezes.
- Gire a 100 x g por 8 min em RT.
- Descarte cuidadosamente o sobrenadante para não perturbar o pellet celular por pipetagem ou aspiração a vácuo. À parede do tubo cônico, adicionar 3 mL de meio de plaqueamento completo.
- Balançar o tubo cônico de um lado para o outro para ressuspender a pastilha celular.
- Adicionar mais 5 mL de meio de plaqueamento completo aos hepatócitos ressuspensos.
- Conte PHHs.
NOTA: PHHs podem ser contados usando AOPI em um contador de células automatizado ou azul de tripano usando um hemacitômetro. As contagens de células podem variar dependendo da tecnologia e do usuário. Para melhores resultados, conte amostras duplicadas e permaneça consistente na metodologia escolhida. - Diluir a suspensão celular até a densidade de semeadura desejada (300.000-600.000 PHHs/mL) usando o meio de plaqueamento completo.
NOTA: A densidade ideal de semeadura de hepatócitos pode variar de lote para lote. A densidade de semeadura recomendada para um determinado lote será fornecida no certificado de análise (COA). Use a equação abaixo para determinar hepatócitos/mL para uma placa de 24 poços.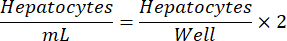
- Das células alimentadoras chapeadas, remova o meio por pipetagem ou aspiração a vácuo.
NOTA: Para garantir a viabilidade das células alimentadoras, recomenda-se a troca de no máximo 3 poços por vez. - Imediatamente placa de 500 μL (150.000-300.000 células) por poço da suspensão diluída de hepatócitos sobre a placa de colágeno pré-revestida de 24 poços contendo células alimentadoras.
- Agite a placa em um movimento N-S-E-W usando um movimento de vai-e-vem na direção N-S 2 vezes seguido pelo mesmo movimento E-W. Repita este protocolo de agitação mais 2 vezes para um total de 3 rodadas.
NOTA: Realizar agitação usando força moderada para evitar respingos na tampa da placa enquanto ainda auxilia na distribuição celular. - Incubar a 37 °C/5% CO2 durante 2-4 h. Para os primeiros 60 min de cultura, agite a placa a cada 15 min em movimento N-S-E-W como na etapa 3.15 acima.
- Após a incubação, retire a placa da incubadora e coloque-a no BSC.
- Agite a placa e remova o meio de chapeamento completo por pipetagem ou aspiração a vácuo.
OBS: Para garantir a viabilidade da cultura, recomenda-se a troca de no máximo 3 poços por vez. - Adicionar imediatamente 500 μL de meio de cultura completo pré-aquecido a cada poço.
4. Manutenção
- Alíquota e meio de cultura completo pré-aquecido em banho-maria a 37 °C por 20-30 min. Aproximadamente 13,5 mL de meio são necessários para uma placa de 24 poços.
- Alimentar culturas diariamente com 500 μL por poço de meio de cultura completo fresco pré-aquecido.
OBS: Para garantir a viabilidade da cultura, recomenda-se a troca de no máximo 3 poços por vez. - Preparar meio de cultura fresco completo a cada 7 dias.
5. Coleta de amostras sobrenadantes de cultura para dosagem de albumina e ureia
- Aos dias 7, 10 e 14, coletar 500 μL de meio do(s) poço(s) de amostra desejado(s) em um(s) tubo(s) de microcentrífuga, como mostra a Figura 1C.
- Gire a(s) amostra(s) a 320 x g durante 10 minutos a 4 °C para detritos de pellets.
- Use uma pipeta para transferir o(s) sobrenadante(s) da amostra para o(s) novo(s) tubo(s) de microcentrífuga, evitando a ruptura do pellet.
- Executar as amostras no ensaio de albumina e/ou ureia (ver secções 10 e 11, respetivamente).
NOTA: As amostras podem ser armazenadas a -20 °C a -80 °C durante 2 semanas.
6. Dia da coloração I
CUIDADO: O tampão de fixação contém Paraformaldeído. O paraformaldeído pode causar danos nos olhos, irritação da pele e toxicidade de órgãos. Trabalhar em uma área com boa ventilação e usar equipamentos de proteção individual (EPIs) apropriados.
- Após a coleta das amostras do meio no 14º dia, adicionar 300 μL de tampão de fixação (ver Tabela de Materiais) em cada poço a ser corado, como mostra a Figura 1C. Manchar no mínimo 2 poços.
- Incubar a 4 °C durante 20-60 min.
- Preparar 1x tampão de permeabilização (ver Tabela de Materiais) adicionando 5 mL de solução estoque de 10x a 45 mL de 1x PBS (ver Tabela de Materiais).
NOTA: O tampão de permeabilização de 1x pode ser armazenado a 4°C por 1 mês. - Lavar 2 vezes com 300 μL de tampão de permeabilização 1x sobre gelo.
- Adicionar 300 μL de citoqueratina 18 do anticorpo primário (ver Tabela de Materiais) utilizando uma diluição de 1:1000 em tampão de permeabilização 1x sobre gelo.
NOTA: Incubar minimamente um poço com 1x tampão de permeabilização apenas para um controle secundário somente de anticorpos. - Incubar 16-24 h a 4 °C.
7. Dia da coloração II
- No dia seguinte, remova o anticorpo primário por pipetagem ou aspiração a vácuo.
- Lavar 2 vezes com 300 μL por poço de 1x tampão de permeabilização sobre gelo.
- Adicionar 300 μL de anticorpo secundário fluorescente (ver Tabela de Materiais) utilizando uma diluição de 1:500 em tampão de permeabilização 1x (incluir controlo apenas secundário).
NOTA: Evite a luz ao usar anticorpos fluorescentes. - Incubar durante 30-45 min a 4 °C no escuro.
- Remova o anticorpo secundário por pipetagem ou aspiração a vácuo.
- Lavar 2 vezes com 300 μL por poço de 1x tampão de permeabilização sobre gelo.
- Lavar 1 vez com 300 μL por poço de 1x PBS.
- Adicionar 150 μL de meio de montagem 4′,6-diamidino-2-fenilindol (DAPI) (ver Tabela de Materiais) a cada poço e incubar durante 15 minutos em RT no escuro.
NOTA: A placa pode ser envolvida em parafilme e armazenada a 4 °C no escuro por 1 semana. - Vista sob um microscópio fluorescente. Capture 5 imagens de cada canal fluorescente específico para cada poço usando a lente objetiva de 10x (certifique-se de que uma imagem tenha uma barra de escala).
NOTA: DAPI tem uma excitação/emissão de 358 nm/461 nm. Use um microscópio fluorescente equipado com os filtros de detecção apropriados para DAPI e o fluoróforo de anticorpo secundário.
8. Análise ImageJ (Figura 2)
Observação : é recomendável usar o ImageJ versão 1.52a ou superior.
- Abra uma imagem que contém uma barra de escala no ImageJ. Clique no ícone Linha reta e desenhe uma linha até o comprimento exato da barra de escala [Figura 2 (1)]
Observação : se necessário, clique no ícone de lupa para ampliar ou reduzir. - Clique na guia Analisar . Realce e clique em Definir escala.
- Altere a Distância Conhecida para a distância da barra de escala. Altere Unidades de Comprimento para as unidades da barra de escala. Aplique globalmente as configurações marcando Global. Clique em OK para definir a escala.
Observação : uma vez que essa configuração é aplicada, cada imagem aberta mostrará a área calculada do campo de visão em unidades inseridas pelo usuário. - Abra uma imagem somente DAPI no ImageJ. Clique na guia Processo e realce Subtrair plano de fundo. Remova o plano de fundo 50 pixels de cada vez até que as áreas sem manchas fiquem pretas.
Observação : se a imagem não contém plano de fundo, esta etapa não é necessária. - Clique na guia Imagem e realce Tipo. Clique em 8-bit para fazer a escala de cinza da imagem [Figura 2 (2)].
- Limite a imagem manual ou automaticamente para incluir todas as partículas DAPI (tome cuidado para não ultrapassar manualmente o limite) [Figura 2 (3)]. Clique na guia Imagem e realce Ajustar. Clique em Limite. Clique em Aplicar quando concluir.
- Clique na guia Processo e realce Binário. Clique em Bacia hidrográfica.
- Clique na guia Analyze e realce /click Analyze Particles [Figura 2 (4)]. Defina o tamanho como 5-infinito e circularidade como 0,00-1,00. Na guia suspensa Mostrar, selecione Contornos. Verifique se os resultados da exibição, Resumo e Incluir furos estão marcados. Clique em OK.
NOTA: O intervalo de partículas desejado pode ser ajustado se o limiar produzir pixels de fundo. - Registre o resultado da contagem como DAPI TOTAL.
- Abra uma imagem mesclada de Citoqueratina 18/DAPI no ImageJ.
- Use o ícone Multi-Point [Figura 2 (5)] para contar manualmente todas as partículas DAPI não coradas para Citoqueratina 18.
- Registre o resultado como CÉLULAS ALIMENTADORAS. Use a equação abaixo para determinar o DAPI do hepatócito.
DAPI Hepatócito = DAPI Total - DAPI Célula Alimentadora
9. Quantificação do total de hepatócitos aderidos e porcentagem de inserção (Plateabilidade)
- Crie um fator de escala para a área de cultura de 24 poços usando a equação abaixo. As medidas do campo de visão podem ser encontradas na parte superior de cada imagem aberta [Figura 2 (2), caixa verde].
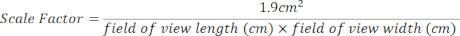
- Calcule o total de hepatócitos aderidos usando a equação abaixo.
Hepatócitos Anexados = Fator de escala × Hepatócito DAPI - Calcule a porcentagem de fixação dos hepatócitos usando a equação abaixo.
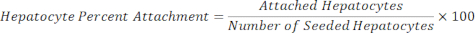
10. Ensaio de albumina
- Medir a produção de albumina utilizando um ensaio imunoenzimático sanduíche (ELISA) (ver Tabela de Materiais) em amostras diluídas a 1:200.
NOTA: Para precisão, o usuário confirma que as amostras estão dentro do intervalo linear da curva padrão. O kit especificado fornece todos os materiais e instruções para realizar o ensaio. - Normalizar as concentrações da amostra para hepatócitos anexados usando a equação abaixo.
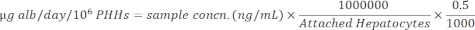
11. Ensaio de ureia
CUIDADO: O reagente ácido de nitrogênio ureico (BUN) no sangue contém ácido sulfúrico. A concentração de ácido sulfúrico no reagente ácido BUN é considerada corrosiva. Não ingerir. Trabalhe em uma área com boa ventilação e use EPIs adequados.
- A síntese de ureia é medida utilizando um método modificado de diacetilmonoxima (ver Tabela de Materiais).
- Diluir 53,3 μL de 75 mg/dL de ureia em 346,7 μL de meio de cultura completo para fazer o Padrão #1 (100 μg/mL)
- Rotular os tubos 2-8 e usar uma diluição seriada 1:2 para fazer os padrões de ensaio de ureia (Tabela 1).
- Adicionar 10 μL de amostra ou padrão a poços de uma placa de fundo transparente de 96 poços de paredes pretas (ver Tabela de Materiais).
- Adicionar 150 μL de reagente BUN a cada poço contendo amostra. Prepare o reagente BUN misturando 1/3 do reagente de cor BUN com 2/3 reagente ácido BUN. Use a equação abaixo para auxiliar nos cálculos.
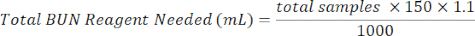
Reagente de cor de ureia (mL) = Total de reagente de ureia necessário × 0,333
Reagente ácido BUN (mL) = Total de reagentes BUN necessários × 0,667 - Incubar a placa durante 90 minutos num forno ou incubadora a 60 °C.
- Leia a absorbância da placa imediatamente a 540 nm e 650 nm.
- Crie uma curva padrão subtraindo a absorvância em branco e de fundo (650 nm) de todas as amostras e padrões. Gere uma linha de melhor ajuste por análise de regressão linear.
- Determinar a concentração desconhecida da amostra a partir da curva padrão.
- Normalizar as concentrações da amostra para hepatócitos anexados usando a equação abaixo.
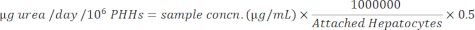
Resultados
O método geral de plaqueamento, cultivo e teste básico de funcionalidade do sistema de cultura hepática envolve técnicas e análises comuns de cultura de células primárias, como ilustrado na Figura 1. A fixação de hepatócitos e a porcentagem de plaqueabilidade foram calculadas no 14º dia usando a análise ImageJ de pelo menos cinco imagens de Citoqueratina 18 e coloração DAPI por poço (Figura 2). Imagens representativas de HPHs cultivadas com células alimentadoras são mostradas na Figura 3. As várias densidades de semeadura hepática apresentaram diferenças visuais de confluência com base na densidade de semeadura e mantiveram a morfologia típica hepática cuboidal por 14 dias de cultivo. Imagens dos lotes A e B de hepatócitos doados foram capturadas para cada densidade de semeadura testada (Figura 4A). A porcentagem média de plaqueabilidade do doador B (89,04% ± 3,99%, 198.552 ± 49.885 HPHs) foi superior à do doador A (66,08% ± 6,67%, 146.128 ± 33.063 HPHs) em todas as densidades de semeadura utilizadas (Figura 4B). O doador A apresentou percentual de plaqueabilidade significativamente maior utilizando 150.000 HPHs/poço (76,07% ± 12,87%) comparado a 250.000-300.000 HPHs/poço (62,75% ± 9,64%). O doador B não apresentou diferenças significativas na platabilidade percentual dos hepatócitos. O doador B apresentou a menor plaqueabilidade dos hepatócitos (85,78% ± 13,25%) na maior densidade de semeadura, 300.000 HPHs/poço. Assim como o doador A, o doador B semeante com 150.000 HPHs/poço apresentou o maior percentual de plaquetabilidade dos hepatócitos (94,75% ± 15,07%).
A produção de albumina e a síntese de ureia foram medidas em três momentos durante o período de cultura de 14 dias e normalizadas para hepatócitos aderidos. No geral, o doador A apresentou maior produção de albumina em relação ao doador B (41,32 ± 4,58 μg alb/dia/106 HPHs vs. 34,66 ± 10,03 μg alb/dia/106 PHHs) (Figura 5). Os doadores A e B apresentaram a maior produção de albumina semeando hepatócitos com 150.000 HPHs/poço, 45,91 ± 5,96 μg alb/dia/106 PHHs e 48,67 ± 20,44 μg alb/dia/106 PHHs, respectivamente. Não foram observadas diferenças significativas na produção de albumina nas densidades de semeadura utilizadas. Como afirmam Baudy et al.3, é desejável que os sistemas microfisiológicos hepáticos mantenham consistente a produção de albumina e a síntese de ureia com menos de 50% de alteração ao longo de 14 dias de cultura. O coeficiente de variação (CV) foi calculado dividindo-se a média pelo desvio-padrão para os dias 7, 10 e 14. Todas as amostras foram executadas em duplicatas. O CV para a produção de albumina no período de 14 dias de cultura a 150.000 HPHs/poço foi de 12,24% para o doador A e 37,97% para o doador B, abaixo do critério de 50% desejado. Uma alta variância na produção de albumina foi observada tanto no doador A quanto no doador B quando semeado a 250.000 e 300.000 HPHs/poço. Nessas densidades de semeadura, ambos os doadores experimentam uma queda acentuada na produção de albumina entre os dias 7, 10 e 14 de cultivo (doador CV A, 22,49%, e doador B, 45,07%).
A síntese de ureia do doador B (95,09 ± 18,91 μg ureia/dia/106) foi aumentada em relação ao doador A (64,92 ± 4,66 μg ureia/dia/106 HPHs) quando os dados médios dos lotes PHH 7, 10 e 14 dias (Figura 6). O doador B (113,49 ± 37,34 μg ureia/dia/106 PHHs) e o doador A (69,12 ± 17,06 μg ureia/dia/106 PHHs) apresentaram a maior síntese de ureia durante um período de cultura de 14 dias, semeado a uma densidade de 150.000 PHHs/poço e 200.000 PHHs/poço, respectivamente. Ambos os lotes doadores apresentaram a menor produção de ureia e o maior CV com 300.000 PHHs/poço. Não foram observadas diferenças significativas na síntese de ureia nas densidades de semeadura utilizadas. O menor CV para síntese de ureia para o doador A foi observado quando cultivado a 250.000 PPHs/poço (23,11%) e 200.000 HPHs/poço para o doador B (28,26%). Como destacado por esses resultados, a densidade ótima de semeadura para um determinado lote de PHH depende do nível de confluência desejado no momento do ensaio e da natureza dos resultados que estão sendo medidos; Maior densidade de semeadura nem sempre pode se correlacionar com maior sinal ou faixa dinâmica.
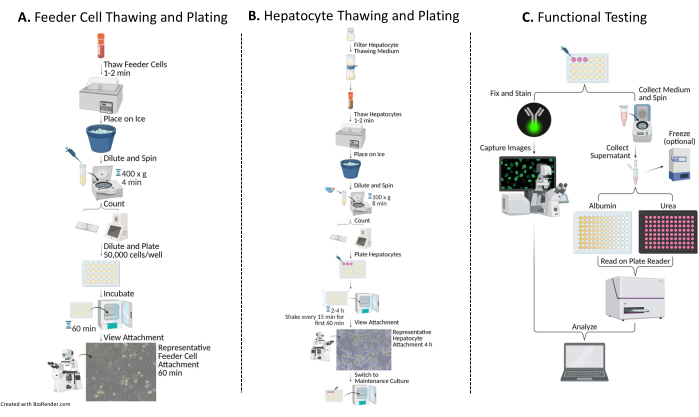
Figura 1: Fluxograma de plaqueamento, cultivo e testes funcionais de hepatócitos com células alimentadoras. (A) As células alimentadoras são descongeladas em um meio de descongelamento específico (ver Tabela de Materiais), ressuspensas em um meio de revestimento completo (ver Tabela de Materiais) e as células são contadas. As células são diluídas, plaqueadas e incubadas por 60 min a 37 °C/5% CO2. (B) Os hepatócitos são descongelados em um meio de descongelamento específico (ver Tabela de Materiais), ressuspensos em um meio de revestimento completo e as células são contadas. Os hepatócitos são diluídos e plaqueados com células alimentadoras. As células são incubadas por 2-4 h a 37 °C/5% CO2, agitando em movimento N-S-E-W a cada 15 min durante os primeiros 60 min de cultura. O meio de revestimento é substituído por um meio de cultura completo pré-aquecido para manutenção da cultura (ver Tabela de Materiais). As culturas são alimentadas diariamente. (C) Nos dias 7, 10 e 14, amostras do meio são coletadas para dosagem de albumina e ureia. Após a coleta de amostras no dia 14, as células são fixadas e coradas com o anticorpo Citoqueratina 18 (ver Tabela de Materiais) 16-24 h a 4 °C. Além disso, eles são incubados em um anticorpo secundário apropriado, lavados e montados com DAPI (ver Tabela de Materiais) para captura e análise de imagens. Clique aqui para ver uma versão maior desta figura.

Figura 2: Análise das imagens utilizando o software ImageJ. Processamento ImageJ das imagens capturadas. Passo 1: uma escala é aplicada a todas as imagens com base na barra de escala específica do microscópio. Passo 2: o tipo de imagem é alterado. Etapa 3: um limite de limite é aplicado para selecionar partículas DAPI. Passo 4: é realizada uma análise de partículas, e a contagem é registrada. Passo 5: para determinar o número de células do alimentador anexadas, uma imagem mesclada é contada usando a ferramenta multiponto. Clique aqui para ver uma versão maior desta figura.
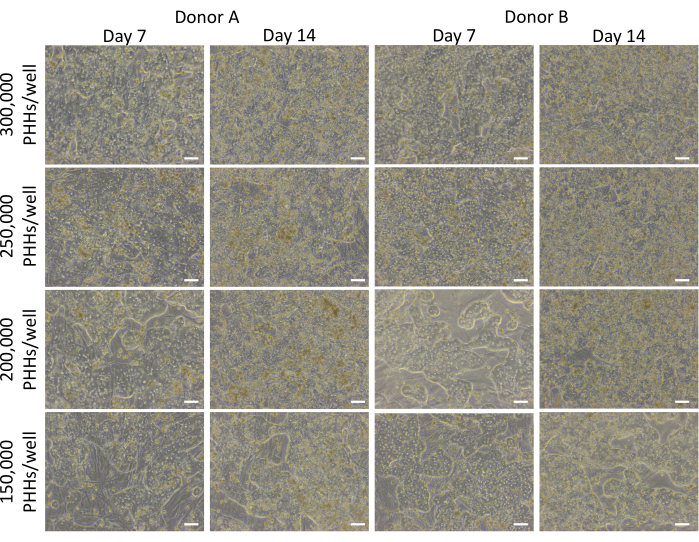
Figura 3: Morfologia das várias densidades de semeadura hepática cultivadas com células alimentadoras. Imagens representativas nos dias 7 e 14 de PHHs cultivadas com células alimentadoras (50.000 células/poço) em densidades de semeadura hepática de 150.000, 200.000, 250.000 e 300.000 PHHs/poços. As imagens foram obtidas com objetiva de 10x em microscópio de contraste de fase invertido. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
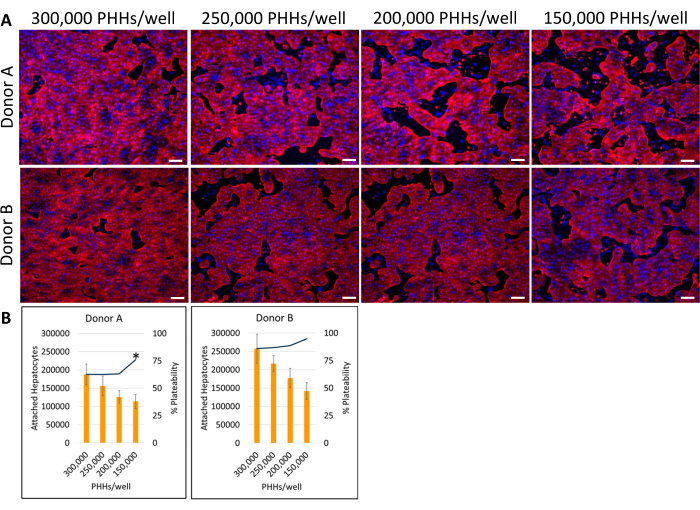
Figura 4: Imunocitoquímica fluorescente de várias densidades de semeadura hepática cultivadas com células alimentadoras. (A) Imagens representativas da coloração de citoqueratina 18 (vermelho) no dia 14 em densidades de semeadura hepática de 150.000, 200.000, 250.000 e 300.000 PHHs/poços. Dois poços para cada densidade de semeadura foram fixados por 30 min a 4 °C. Os poços foram incubados 16-24 h a 4°C com anticorpo primário a 1:1000. Um anticorpo secundário foi usado a 1:500 por 30 min a 4 °C no escuro. A coloração nuclear DAPI (azul) foi adicionada aos poços por 15 min à temperatura ambiente. As imagens foram obtidas com objetiva de 10X em microscópio fluorescente invertido. Barra de escala = 100 μm. (B) Hepatócitos aderidos calculados e porcentagem de plaqueabilidade de várias densidades de semeadura hepática calculadas usando ImageJ. *p ≤ 0,05, para platerização percentual para 200.000, 250.000 e 300.000 PHHs/poço. As barras de erro representam o desvio padrão (n ≥ 5 imagens por condição). Clique aqui para ver uma versão maior desta figura.
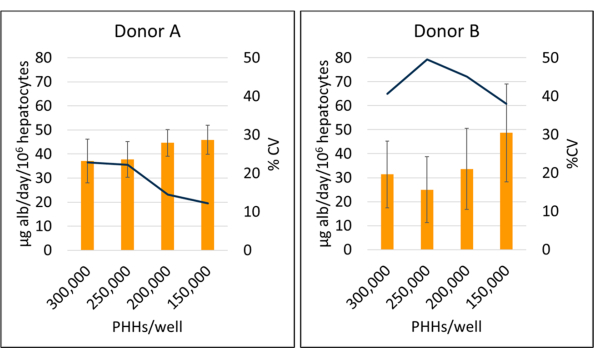
Figura 5: Produção de albumina de hepatócitos cultivados com células alimentadoras. Produção de albumina a partir de densidades de semeadura hepática em 150.000, 200.000, 250.000 e 300.000 PHHs/poço. As colunas representam a média de 14 dias de microgramas de albumina/dia normalizados para o total de hepatócitos aderidos. Uma linha representa o CV entre os dias 7, 10 e 14. As barras de erro representam o desvio padrão (n ≥ 2 poços por condição com repetições). Clique aqui para ver uma versão maior desta figura.
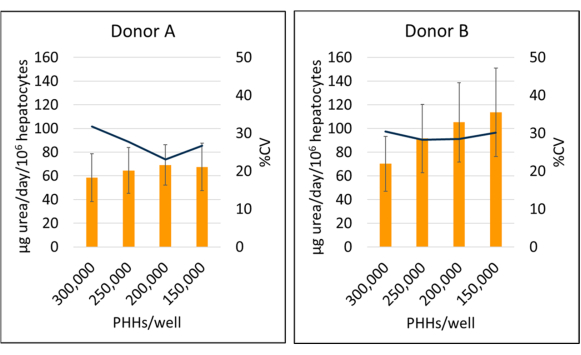
Figura 6: Síntese de ureia de hepatócitos cultivados com células alimentadoras. Síntese de ureia a partir de densidades de semeadura hepática em 150.000, 200.000, 250.000 e 300.000 PHHs/poço. As colunas representam a média de 14 dias de μg de ureia/dia normalizada para o total de hepatócitos aderidos. Uma linha representa %CV entre os dias 7, 10 e 14. As barras de erro representam o desvio padrão (n ≥ 2 poços por condição com repetições). Clique aqui para ver uma versão maior desta figura.
| Padrão (S) # | Concentração (μg/mL) | Solução de ureia (μL) | Cultura Completa (μL) |
| 1 | 100 | 53.3 75 mg/dL estoque | 346.7 |
| 2 | 50 | 100 (Solução S1) | 100 |
| 3 | 25 | 100 (Solução S2) | 100 |
| 4 | 12.5 | 100 (Solução S3) | 100 |
| 5 | 6.26 | 100 (Solução S4) | 100 |
| 6 | 3.125 | 100 (Solução S5) | 100 |
| 7 | 1.5625 | 100 (Solução S6) | 100 |
| Em branco | 0 | 0 | 100 |
Tabela 1: Preparação da amostra padrão de ureia. Usando 75 mg/dL de ureia-estoque, preparar uma solução de ureia de 100 μg/mL. Alíquota os volumes sugeridos para atingir a concentração final para a curva padrão.
Discussão
O sistema de cultura hepática descrito pode ser estabelecido em laboratórios equipados com instrumentação padrão para cultura de tecidos. Composto por PHHs cultivadas com células alimentadoras, o sistema permite ao usuário cultivar PHHs por pelo menos duas semanas com produção estável de albumina e síntese de ureia. Devido à variabilidade do lote de doadores de HPH, apenas HPHs pré-triadas e qualificadas são recomendadas para uso no sistema. Embora o número de HPHs anexadas varie com base no lote doador e na densidade de semeadura, a plaqueabilidade relativa permanece semelhante dentro de cada lote doador. Embora as densidades de semeadura recomendadas sejam recomendadas, os dados acima sugerem que a densidade de semeadura de hepatócitos pode ser ajustada para diferentes necessidades experimentais; no entanto, deve-se notar que semear um número maior de HPHs pode não fornecer saídas funcionais mais altas ou mais consistentes. A análise dos lotes de HPH avaliados mostrou o menor CV para produção de albumina e síntese de ureia utilizando menores densidades de semeadura de 150.000 PHHs/poço e 200.000 PHHs/poço; no entanto, não foram encontradas diferenças significativas entre albumina e ureia em qualquer densidade de semeadura. Maiores densidades de semeadura de 250.000 PHHs/poço e 300.000 PHHs/poço mostram maior diminuição de albumina e ureia ao longo dos 14 dias de cultivo. A variabilidade inerente do doador na platabilidade pode afetar a consistência da produção de albumina e a síntese de ureia em 250.000 PHHs/poço e 300.000 PHHs/poço para os lotes de doadores testados. Semelhante aos grandes esferoides hepatócitos, a sobresemeadura de PHHs no sistema TV2D+ pode ter efeitos negativos sobre a cultura e a funcionalidade a longo prazo de HPHs.
Todas as etapas de descongelamento, chapeamento e manutenção são críticas para o sucesso da cultura e da geração de dados; No entanto, existem vários erros comuns que usuários inexperientes podem evitar. Os HPHs são altamente suscetíveis a danos secundários à flutuação de temperatura, tensão de cisalhamento e exposição ao ar 9,10. Precauções devem ser tomadas ao descongelar PHHs para evitar períodos prolongados de descongelamento e pipetagem excessiva. O uso de um método de derramamento manual, um temporizador e a transferência imediata do banho-maria para o gelo reduzirão esses erros comuns que podem afetar a viabilidade e a plaqueabilidade dos HPHs. Além disso, com os problemas da cadeia de suprimentos se tornando mais comuns, pode ser difícil obter placas revestidas com colágeno. O revestimento manual de placas tratadas com cultura de tecidos utilizando soluções comerciais de colágeno tipo I (5-10 μg/cm2) pode ser utilizado para superar essa questão; No entanto, para um ótimo desempenho e consistência, recomenda-se o uso de placas de colágeno pré-revestidas. No processo de transição da cultura somente de células alimentadoras para a introdução de PHHs, é fundamental evitar que a camada de células alimentadoras seque. Nunca permita a exposição do ar às células alimentadoras. Qualquer tempo de exposição ao ar pode levar a uma má qualidade da camada de células alimentadoras, o que afetará negativamente a cultura de PHHs a longo prazo. É uma prática recomendada permitir que uma pequena quantidade de meio residual permaneça entre as mudanças médias. Ocasionalmente, os HPHs podem conter excesso de detritos provenientes do isolamento, o que pode dificultar a visualização da morfologia. Para ajudar com esse problema, agite a placa antes de uma troca de meio e use aspiração a vácuo. Finalmente, ao realizar uma troca de meio, aspirar cuidadosamente o meio gasto, tomando cuidado para não perturbar as células cultivadas. Pipetar o volume médio fresco na lateral do poço para evitar a pipetagem diretamente na camada celular. O usuário também deve evitar a exposição ao ar a cada mudança de meio, usando a troca recomendada de 3 poços (Seções 3 e 4). Deve-se notar também que uma mudança de meio diária é ideal, mas não necessária.
Embora microscópios fluorescentes tenham se tornado comuns na maioria dos laboratórios, softwares necessários para realizar análises específicas de imagens podem incorrer em despesas adicionais. O ImageJ pode ser baixado gratuitamente, tornando-se uma ferramenta de análise de imagens de fácil acesso. As etapas do protocolo fornecem uma base para a qual o usuário pode precisar otimizar, especificamente a análise de partículas da coloração DAPI; no entanto, na ausência de capacidade de imagem fluorescente, os valores de fixação de PHH no dia 14 são fornecidos em certificados de análise específicos do lote. Um limiar deficiente resultará em uma contagem imprecisa das partículas DAPI. Também é recomendável verificar a área de superfície de partículas DAPI individuais antes de definir uma exclusão de tamanho. Isso pode ser feito usando o ícone Oval [Figura 2 (1), ícone de círculo abaixo da guia Editar ] e desenhando um círculo que engloba a partícula DAPI. A guia Analisar pode ser usada para medir a área da partícula DAPI selecionada. Medidas específicas podem ser selecionadas usando o conjunto de medidas na guia Analisar [etapa 8.9 e Figura 2 (4)].
Os métodos atuais de cultivo de HPHs envolvem o uso de revestimentos como o colágeno-I para aumentar a fixação celular na monocultura tradicional de 2dimensões11 ou sobreposição com uma matriz extracelular, como o Matrigel à base de murina, uma técnica comumente referida como "cultura sanduíche"12,13,14,15. Embora a técnica de cultura sanduíche melhore a morfologia e polaridade do PHH ao longo do tempo em comparação com a monocultura tradicional, ambas as abordagens ainda carecem de estabilidade fenotípica em longo prazo na cultura para a maioria dos lotes plaqueáveis de PHHs. Outro método usado para cultivar PHHs é fazer esferoides 3D; no entanto, como dito anteriormente por Glicklis et al.4, pode haver desafios técnicos com a reprodutibilidade do tamanho do esferoide devido à variabilidade do doador. Em um esforço para fazer um modelo hepático fisiologicamente mais relevante, modelos multicelulares têm sido desenvolvidos. Como descrito por Ware et al.7, o uso de micropadronização, fibroblastos murinos e células endoteliais sinusóides hepáticas primárias humanas cercadas por HPHs possibilitaram maior tempo de cultivo in vitro. No entanto, a micropadronização pode ser um processo complexo e demorado, e as células alimentadoras não humanas podem contribuir para o background em sinais metabólicos, limitando a utilidade dessa plataforma em determinadas aplicações. O uso de várias células não-hepáticas, incluindo fibroblastos dérmicos humanos e de ratos e células endoteliais da aorta bovina como células alimentadoras para co-cultura de hepatócitos, tem mostrado secreção de albumina e formação de tight junction semelhante às co-culturas de células alimentadoras de origemhepática16. No entanto, o mecanismo de interações entre as células não-alimentadoras de TV2D+ e os HPHs em cultura precisa ser mais bem investigado para melhor compreender a influência na estabilidade e funcionalidade dos HPHs neste sistema. O sistema de cultura previamente descrito por Weaver et al.8 pode cultivar HPHs com sucesso em colônias hepáticas por até 42 dias, formando extensas redes biliares canaliculares. Os PHHs cultivados neste sistema mantiveram a funcionalidade hepática chave, incluindo a atividade do citocromo 1A2, 2B6 e 3A4 e a atividade enzimática baseada na uridina 5′-difosfo-glucuroniltransferase (UGT), formação de metabólitos de fase I e II, produção de albumina e síntese de ureia por pelo menos 22 dias in vitro sem Matrigel. Este sistema de cultura produz resultados estáveis e fisiologicamente relevantes que são facilmente adaptáveis a qualquer laboratório para aplicações farmacológicas e toxicológicas. Embora as principais funções PHH sejam mantidas no sistema TV2D+, nenhuma comparação direta foi feita com o modelo esferoide 3D; no entanto, trabalhos futuros comparando os mesmos doadores de HPH entre os sistemas de cultura serão valiosos para determinar os limites e vantagens de ambos os métodos.
Aplicações potenciais do TV2D+ incluem avaliação da depuração metabólica e interações medicamentosas de compostos de baixa rotação, lesão hepática induzida por drogas e avaliação de risco de agroquímicos. A previsão precisa da depuração hepática de drogas novas e emergentes depende de uma cultura de PHH estável e prolongada com retenção da funcionalidade hepatocelular chave, o que é particularmente desafiador quando se avaliam compostos de baixo turnover. Além disso, a avaliação de risco e a toxicidade hepática induzida por produtos químicos são grandes preocupações para a saúde, e os modelos atuais não fornecem estabilidade e funcionalidade a longo prazo em cultura para avaliar com precisão a potencial toxicidade química crônica que pode ser secundária à exposição aguda. HPHs saudáveis e doentes cultivadas em TV2D+ mostraram diferenças características na função e disposição lipídica que foram mantidas ao longo do tempo17. Estes estudos suportam TV2D+ como uma ferramenta promissora para uma variedade de aplicações farmacológicas e toxicológicas.
Divulgações
JO, LW, EG, EL, SP e JW são funcionários da LifeNet Health, a organização sem fins lucrativos que produz TV2D+.
Agradecimentos
Gostaríamos de agradecer a Mellissa Keller e Wendy Hetman por sua assistência com a revisão de manuscritos e figuras.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 µm PES filter unit | Thermo Fisher Scientific | 565-0020 | User preference |
| 15 mL or 50 mL conical tubes | Thermo Fisher Scientific | 352196 or 352070 | User preference |
| Alexa Fluor 555, goat anti-rabbit | Thermo Fisher Scientific | A-21428 | Other secondary antibodies can work |
| Anti-Cytokeratin 18 antibody | abcam | ab24561 | Necessary using same dilution |
| AOPI | Nexcelom | CS2-0106-5mL | Used for Cellometer counting |
| Biosafety cabinet | Labconoco | 3460801 | User preference |
| Black-walled, clear bottom, 96-well plate | Thermo Fisher Scientific | 165305 | User preference |
| Centrifuge | Thermo Fisher Scientific | Sorvall X4R | Capable of speeds up to 400 x g |
| Collagen coated plate, 24-well | Greiner Bio-One | 662950 | Rat tail collagen coating |
| Counting slides | Nexcelom | CHT4-SD100-002 | Used for Cellometer counting |
| Culture medium | LifeNet Health | MED-TCCM | |
| Culture supplement | LifeNet Health | MED-TCSC | |
| DAPI | Thermo Fisher Scientific | 00-4959-52 | Contains mounting medium |
| DPBS (-Ca, -Mg) | Thermo Fisher Scientific | 14190250 | User preference |
| Feeder cell supplement | LifeNet Health | MED-TCSA | |
| Feeder cell thawing medium | LifeNet Health | MED-FCTM | |
| Fluorescent microscope | Zeiss | AxioObserver Z1 | Equipped with user specific filters |
| Hepatocyte thawing medium | LifeNet Health | MED-HHTM4C-50ML | |
| Human albumin ELISA kit | abcam | ab108788 | Necessary if using same dilution |
| Human feeder cells | LifeNet Health | PHFC24 | |
| Humidified incubator | VWR | 97025-842 | Capable of 5% CO2 |
| IC Fixation buffer | Thermo Fisher Scientific | 00-8222-49 | Paraformaldehyde based, 10% formalin can also be used |
| ImageJ | National Insitute of Health | Version 1.52a | 1.52a or higher |
| Inverted phase contrast microscope | Olympus | CK40-F100 | User preference |
| Microcentrifuge tubes | VWR | 20170-022 | User preference |
| Micropipettes (various sizes) | USA Scientific | ErgoOne | User preference |
| Permeabilization buffer (10x) | Thermo Fisher Scientific | 00-8333-56 | Other permeabilization buffers can work |
| Plate reader | BMG Labtech | CLARIOstar | Capable of reading absorbance 450-640 nm |
| Plating medium | LifeNet Health | MED-TCPM | |
| Plating supplement | LifeNet Health | MED-TCSB | |
| Primary human hepatocytes | LifeNet Health | various | Catalog number may vary based on lot number |
| Secondary antibody | Thermo Fisher Scientific | A-21428 | User preference |
| Serological pipet controller | Gilson | F110120 | User preference |
| Storage bottle 100–500 mL | VWR | 76311-770 | User preference |
| Urea Nitrogen (BUN) Test | Stanbio | 0580-250 | |
| Water bath | PolyScience | WBE05 | Capable for use at 37 °C |
Referências
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- Swift, B., Pfeifer, N. D., Brouwer, K. L. Sandwich-cultured hepatocytes: an in vitro model to evaluate hepatobiliary transporter-based drug interactions and hepatotoxicity. Drug Metabolism Reviews. 42 (3), 446-471 (2010).
- Baudy, A. R., et al. Liver microphysiological systems development guidelines for safety risk assessment in the pharmaceutical industry. Lab on a Chip. 20 (2), 215-225 (2020).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86 (6), 672-680 (2004).
- Khetani, S. R., et al. Microengineered liver tissues for drug testing. Journal of Laboratory Automation. 20 (3), 216-250 (2015).
- Monckton, C. P., Brown, G. E., Khetani, S. R. Latest impact of engineered human liver platforms on drug development. APL Bioengineering. 5 (3), 031506 (2021).
- Ware, B. R., Durham, M. J., Monckton, C. P., Khetani, S. R. A cell culture platform to maintain long-term phenotype of primary human hepatocytes and endothelial cells. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 187-207 (2018).
- Weaver, J. R., et al. The morphology, functionality, and longevity of a novel all human hepatic cell-based tri-culture system. Toxicology In Vitro. 86, 105504 (2023).
- Li, W., et al. Matrix stiffness and shear stresses modulate hepatocyte functions in a fibrotic liver sinusoidal model. American Journal of Physiology, Gastrointestinal and Liver Physiology. 320 (3), G272-G282 (2021).
- Thompson, S. M., et al. Heat stress induced cell death mechanisms in hepatocytes and hepatocellular carcinoma: in vitro and in vivo study. Lasers in Surgery and Medicine. 46 (4), 290-301 (2014).
- Mooney, D., et al. Switching from differentiation to growth in hepatocytes: control by extracellular matrix. Journal of Cellular Physiology. 151 (3), 497-505 (1992).
- Berthiaume, F., Moghe, P. V., Toner, M., Yarmush, M. L. Effect of extracellular matrix topology on cell structure, function, and physiological responsiveness: hepatocytes cultured in a sandwich configuration. The FASEB Journal. 10 (13), 1471-1484 (1996).
- Hamilton, G. A., et al. Regulation of cell morphology and cytochrome P450 expression in human hepatocytes by extracellular matrix and cell-cell interactions. Cell and Tissue Research. 306 (1), 85-99 (2001).
- Orkin, R. W., et al. A murine tumor producing a matrix of basement membrane. Journal of Experimental Medicine. 145 (1), 204-220 (1977).
- Sivaraman, A., et al. A microscale in vitro physiological model of the liver: predictive screens for drug metabolism and enzyme induction. Current Drug Metabolism. 6 (6), 569-591 (2005).
- Goulet, F., Normand, C., Morin, O. Cellular interactions promote tissue-specific function, biomatrix deposition and junctional communication of primary cultured hepatocytes. Hepatology. 8 (5), 1010-1018 (1988).
- Odanga, J. J., Breathwaite, E. K., Presnel, S., LeCluyse, E. L., Weaver, J. R. Characterization of primary human hepatocytes from diseased and healthy livers in an all-human cell based triculture system. The Toxicologist, a Supplement to Toxicological Sciences. , 4283 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados