Method Article
دراسة الخلايا البطانية الدهنية / الخلايا الشحمية في الأنسجة الدهنية تحت الجلد البشرية
In This Article
Summary
هنا ، نصف بروتوكولا لعزل الخلايا البطانية الوعائية الدقيقة وزراعتها وتنميطها الظاهري من الأنسجة الدهنية البشرية تحت الجلد (hSATMVECs). بالإضافة إلى ذلك ، وصفنا نموذجا تجريبيا للحديث المتقاطع للخلايا الشحمية hSATMVEC.
Abstract
تلعب الخلايا البطانية الوعائية الدقيقة (MVECs) العديد من الأدوار الحاسمة ، بما في ذلك التحكم في نغمة الأوعية الدموية ، وتنظيم تجلط الدم ، وتكوين الأوعية. يعتمد عدم التجانس الكبير في النمط الجيني للخلايا البطانية (EC) والنمط الظاهري على السرير الوعائي وحالة المرض المضيف. توفر القدرة على عزل MVECs من أسرة الأوعية الدموية الخاصة بالأنسجة ومجموعات المرضى الفردية الفرصة لمقارنة وظيفة MVEC مباشرة في حالات مرضية مختلفة. هنا ، باستخدام الأنسجة الدهنية تحت الجلد (SAT) التي تم التقاطها في وقت إدخال الأجهزة الإلكترونية القابلة للزرع القلبية (CIED) ، وصفنا طريقة لعزل مجموعة نقية من الأنسجة الدهنية البشرية تحت الجلد الوظيفية MVEC (hSATMVEC) ونموذج تجريبي للحديث المتقاطع hSATMVEC-adipocyte.
تم عزل hSATMVEC بعد الهضم الأنزيمي ل SAT عن طريق الحضانة باستخدام حبات مغناطيسية مغلفة بالأجسام المضادة CD31 والمرور عبر الأعمدة المغناطيسية. تم زراعة hSATMVEC وتمريرها على ألواح مغلفة بالجيلاتين. استخدمت التجارب الخلايا في الممرات 2-4. حافظت الخلايا على السمات الكلاسيكية لمورفولوجيا EC حتى المقطع 5 على الأقل. أظهر تقييم قياس التدفق الخلوي نقاء 99.5٪ من hSATMVEC المعزول ، والذي تم تعريفه على أنه CD31 + / CD144 + / CD45-. كان وقت تضاعف عدد hSATMVEC المعزول من الضوابط حوالي 57 ساعة ، وتم تأكيد الانتشار النشط باستخدام مجموعة تصوير تكاثر الخلايا. تم تقييم وظيفة hSATMVEC المعزولة باستخدام استجابتها لتحفيز الأنسولين وإمكانية تكوين أنبوب وعائي. ثم أنشأنا نموذج زراعة الخلايا الشحمية تحت الجلد hSATMVEC لدراسة الحديث الخلوي وأظهرنا تأثير المصب ل hSATMVEC على وظيفة الخلايا الشحمية.
يمكن عزل hSATMVEC من SAT المأخوذ في وقت إدخال CIED وهو ذو نقاء كاف لكل من النمط الظاهري التجريبي ودراسة الحديث المتقاطع للخلايا الشحمية hSATMVEC.
Introduction
الخلايا البطانية (ECs) هي خلايا حرشفية تبطن السطح الداخلي لجدار الأوعية الدموية كطبقة أحادية. لديهم العديد من الأدوار الأساسية ، بما في ذلك التحكم في لهجة الأوعية الدموية ، وتنظيم تجلط الدم ، وتعديل الاستجابة الالتهابية ، والمساهمة في تكوين الأوعية1. نظرا لأهمية الخلايا البطانية في فسيولوجيا القلب والأوعية الدموية ، فإنها تستخدم بشكل متكرر تجريبيا لتعزيز فهم الفيزيولوجيا المرضية وفحص العلاجات الدوائية الجديدة لأمراض القلب والأوعية الدموية.
ومع ذلك ، هناك عدم تجانس هائل في مورفولوجيا الخلايا البطانية ، والوظيفة ، والتعبير الجيني ، وتكوين المستضد اعتمادا على أصل السرير الوعائي2. في حين أن الخلايا البطانية من الشرايين الكبيرة هي الأنسب لدراسات تصلب الشرايين ، فإن الخلايا البطانية من الأوعية الصغيرة ، والمعروفة باسم الخلايا البطانية الوعائية الدقيقة (MVECs) ، هي أكثر ملاءمة لدراسات تكوين الأوعيةالدموية 2. قد يوفر فهم الأساس الجزيئي لعدم التجانس البطاني رؤى قيمة حول العلاجات الخاصة بالسرير الوعائي. تختلف وظيفة بطانة الأوعية الدموية الدقيقة أيضا بشكل كبير في العديد من الأمراض ، بما في ذلك مرض السكري وأمراض القلب والأوعية الدموية والعدوى الجهازية 3,4. لذلك ، فإن القدرة على عزل الخلايا البطانية من مجموعات محددة من المرضى تسمح بإجراء مقارنة مباشرة لوظيفة الخلايا البطانية والحديث الخلوي5.
في هذه الورقة ، وصفنا طريقة جديدة لعزل MVECs البشرية من الأنسجة الدهنية تحت الجلد (hSATMVEC) التي تم أخذها في وقت إدخال الجهاز الإلكتروني القابل للزرع في القلب (CIED). تم عزل hSATMVEC بعد الهضم الأنزيمي للأنسجة الدهنية تحت الجلد (SAT) وتمريرها على ألواح مغلفة بالجيلاتين. ثم نصف مجموعة من فحوصات التنميط الظاهري التي تم تطبيقها بنجاح على hSATMVECs من أجل التحقق من صحة النمط الظاهري وإثبات استخدامها في فحوصات الخلايا البطانية الروتينية. أخيرا ، نصف تطبيقا ل hSATMVECs في نموذج تجريبي للحديث المتقاطع بين hSATMVECs-adipocyte.
Protocol
تم أخذ عينات من الأنسجة البشرية المستخدمة في التقنية الموصوفة من المرضى الذين يخضعون لإدخال CIEDs المشار إليه وفقا للممارسة السريرية الروتينية في مستشفيات ليدز التعليمية NHS Trust (ليدز ، المملكة المتحدة). تمت الموافقة على بروتوكول الدراسة ، إلى جانب جميع الوثائق الأخرى ، من قبل لجنة الأخلاقيات المحلية (11 / YH / 0291) قبل تسجيل المشاركين. وقد أجريت الدراسة امتثالا لمبادئ إعلان هلسنكي.
1. عدد المرضى
- الحصول على الأنسجة الدهنية الطازجة تحت الجلد (SAT) أثناء زرع CIED من SAT التي تغطي العضلة الصدرية الرئيسية.
- عزل عينات SAT تحت ظروف معقمة والتعامل مع عينات الأنسجة بعد جمعها في غطاء التدفق الصفحي في ظل ظروف معقمة صارمة لمنع التلوث البكتيري.
2. عزل الخلايا البطانية والثقافة
ملاحظة: يظهر رسم تخطيطي لعزل hSATMVEC في الشكل 1.
- لعزل hSATMVEC ، استخدم ما لا يقل عن 250 مجم من الأنسجة الدهنية الطازجة تحت الجلد (SAT) التي تم الحصول عليها أثناء زرع CIED من SAT فوق العضلة الصدرية الرئيسية (انظر الشكل 1).
ملاحظة: يؤدي استخدام كميات أكبر من SAT الطازج إلى زيادة إنتاجية hSATMVEC أثناء العزلة ولديه أعلى فرصة لنجاح العزلة وثقافة hSATMVEC. - ضع SAT على الفور في محلول تخزين الأنسجة المنشط مغناطيسيا (MACS) المنشط بالثلج في أنبوب طرد مركزي دقيق سعة 1.5 مل قبل نقله إلى المختبر.
ملاحظة: للحصول على أعلى فرصة لعزل ناجح ، يجب إجراء عزل hSATMVEC في أسرع وقت ممكن. ومع ذلك ، يمكن تخزين SAT لمدة تصل إلى 24 ساعة على الجليد قبل العزل إذا لزم الأمر. - قم بإعداد محلول عمل كولاجيناز / ديباز 1 مجم / مل على النحو التالي.
- أولا ، أعد تكوين 500 مجم من مسحوق كولاجيناز / ديسباز المجفف بالتجميد في 5 مل من الماء المعقم لتشكيل محلول كولاجيناز / ديسباز بتركيز 100 مجم / مل.
- لكل عزل hSATMVEC، قم بتخفيف 100 ميكرولتر من محلول مخزون الكولاجيناز/التناثر في 10 مل من محلول الملح المتوازن البارد هانكس لينتهي الأمر بمحلول عمل 1 ملغ/مل.
- في خزانة التدفق الصفحي ، استخدم مشرطين لفرم الأنسجة إلى ~ 1 مم3 قطع في 500 ميكرولتر من محلول كولاجيناز / ديسباز 1 مجم / مل على غطاء طبق بتري ، وسحنه ونقله إلى أنبوب طرد مركزي نظيف سعة 50 مل.
- اغسل غطاء طبق بتري ب 4.5 مل من محلول كولاجيناز / ديسباز الطازج 1 مجم / مل وأضفه إلى أنبوب الطرد المركزي سعة 50 مل. اتركيه ليهضم لمدة 30 دقيقة عند 37 درجة مئوية في أنبوب دوار عند 20 دورة في الدقيقة. أوقف عملية الهضم بإضافة 10 مل من وسائط نمو EC الكاملة MV.
- سحن المزيج المهضوم ومرره عبر غربال خلية 70 ميكرومتر. شطف الغربال مع 10 مل من محلول ملحي مخزن بالفوسفات 0.5 ٪ - العازلة ألبومين مصل الأبقار (PBS-BSA). قم بطرد العينة عند 300 × جم لمدة 10 دقائق في درجة حرارة الغرفة وتخلص من المادة الطافية. كرر هذه الخطوة مع 5 مل أخرى من 0.5٪ PBS-BSA.
- ثم قم بإزالة الخلايا الميتة باستخدام مجموعة إزالة الخلايا الميتة. للقيام بذلك ، احتضان بيليه الخلية في 200 ميكرولتر من حبات إزالة الخلايا الميتة (دوامة قبل الاستخدام) لمدة 15 دقيقة في درجة حرارة الغرفة (RT) في أنبوب طرد مركزي دقيق سعة 1.5 مل.
- قم بتوصيل عمود LS بمرشح 30 ميكرومتر بمغناطيس الفاصل وضع أنبوب طرد مركزي سعة 15 مل تحته. اغسل العمود المغناطيسي مرة واحدة باستخدام 1 مل من المخزن المؤقت لإزالة الخلايا الميتة قبل إضافة تعليق العينة / الخرزة واتركه يمر بشكل سلبي تحت الجاذبية.
- بعد ذلك ، اغسل العمود بإضافة 0.5 مل من المخزن المؤقت للربط واتركه يمر بشكل سلبي عبر العمود. كرر هذا الغسيل أربع مرات.
- اجمع الشطف كجزء خلية حية ، وقم بتدوير الخلايا عند 300 × جم في RT لمدة 10 دقائق ، ثم اغسل الحبيبات الناتجة وأعد تعليقها في 400 ميكرولتر من 0.5٪ PBS-BSA.
- أضف 20 ميكرولتر من الخرزات المغناطيسية المطلية المضادة ل CD31 إلى الخلايا العالقة واحتضانها لمدة 20 دقيقة عند 4 درجات مئوية. بعد الحضانة ، قم بطرد العينة عند 300 × جم لمدة 5 دقائق في RT وتخلص من المادة الطافية. أعد تعليق حبيبات الخلية في 500 ميكرولتر من 0.5٪ PBS-BSA.
- قم بتوصيل عمود MS بمرشح 30 ميكرومتر بمغناطيس الفاصل وضع أنبوب طرد مركزي سعة 15 مل تحته. قم بتجهيز العمود ب 500 ميكرولتر من 0.5٪ PBS-BSA. كرر هذه الخطوة مرتين.
- أضف تعليق الخلية الميكروبية واتركه يمر تحت الجاذبية. اغسل العمود ب 500 ميكرولتر من 0.5٪ PBS-BSA ثلاث مرات. يحتوي التدفق في أنبوب الطرد المركزي أسفل العمود على جزء CD31.
- لجمع جزء CD31 + (أي الجزء الذي يحتوي على hSATMVECs) ، قم بإزالة عمود MS من مغناطيس الفاصل وضعه في أنبوب طرد مركزي جديد سعة 15 مل. أضف 1 مل من 0.5٪ PBS-BSA ، وفي إجراء واحد سلس ، قم بتطبيق مكبس العمود لتحرير hSATMVECs الملتقطة.
- أجهزة الطرد المركزي العينة في 300 × غرام لمدة 5 دقائق في RT وتجاهل المادة الطافية. أعد تعليق حبيبات الخلية في 1 مل من وسائط نمو EC الكاملة MV وقسم محلول الخلية سعة 1 مل بين بئر واحد أو بئرين (حسب حجم الحبيبات) من لوحة 24 بئرا مطلية بالجيلاتين بنسبة 2٪ (الممر 0).
ملاحظة: لا تقلق إذا كان هناك عدد قليل من الخلايا الملتصقة في الأيام القليلة الأولى بعد العزل. - تغيير الوسائط كل 3 أيام. خلايا المزرعة عند 37 درجة مئوية مع 5٪ CO2. بمجرد أن تصل الخلايا المعزولة إلى التقاء ~ 80٪ (2-4 أسابيع) ، قم بتمريرها إلى بئر واحدة من صفيحة من ستة آبار (الممر 1).
ملاحظة: يمكن للممرات اللاحقة إعادة صفيحة الخلايا من بئر مانح متلاقى إلى آبار متلقية. أجريت التجارب على خلايا الممر 2-4 جيل بعد أن أظهرت الخلايا نقاء >99٪ باستخدام قياس التدفق الخلوي (انظر القسم 3). حافظت الخلايا على مورفولوجيا البطانة النموذجية حتى مرور 5 على الأقل.
3. قياس التدفق الخلوي
- قبل قياس التدفق الخلوي ، تحقق بصريا من hSATMVECs للتأكد من أنها تبدو متقاربة وممثلة شكليا. إجراء تقييم التدفق الخلوي ل hSATMVECs عند الممر 2 ، باستخدام خلايا من بئر واحد من لوحة 6 آبار.
- اغسل الخلايا مرتين باستخدام برنامج تلفزيوني عن طريق إضافة 500 ميكرولتر من PBS جيدا والشفط في كل مرة. ثم أضف 300 ميكرولتر / بئر من محلول التربسين / EDTA الدافئ (0.25٪). احتضان في 37 درجة مئوية مع 5٪ CO2 لمدة 2 دقيقة.
- بمجرد الانفصال ، قم بتحييد محلول التربسين / EDTA ب 700 ميكرولتر من وسائط نمو EC الكاملة MV ونقلها إلى أنبوب طرد مركزي دقيق سعة 1.5 مل.
- جهاز طرد مركزي تعليق الخلية عند 400 × جم لمدة 8 دقائق في RT. تخلص من المادة الطافية دون إزعاج الحبيبات. بعد ذلك ، أعد تعليق حبيبات الخلية في مخزن مؤقت MACS سعة 1 مل وقسم بين أنبوبي طرد مركزي دقيق سعة 1.5 مل مكتوب عليهما تحكم غير ملوث وعينة ملطخة (500 ميكرولتر لكل بئر).
- أضف 500 ميكرولتر إضافية من المخزن المؤقت MACS إلى كل أنبوب طرد مركزي دقيق ، قبل الطرد المركزي مرة أخرى عند 400 × جم لمدة 8 دقائق في RT.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 100 ميكرولتر من المخزن المؤقت MACS للتحكم غير الملوث وكوكتيل تلطيخ 100 ميكرولتر (الجدول التكميلي 1) للعينة الملطخة. وصمة عار الخلايا مع CD45-FITC (علامة الكريات البيض عموم الدم) ، وكذلك CD144-PE و CD31-PerCP (التي يتم التعبير عنها بواسطة الخلايا البطانية).
- دوامة لفترة وجيزة الخلايا العالقة لمدة 5 ثوان ، ثم احتضانها عند 4 درجات مئوية لمدة 10 دقائق. بعد ذلك ، أضف 1 مل من المخزن المؤقت MACS إلى كل أنبوب ، وأجهزة الطرد المركزي مرة أخرى عند 400 × g لمدة 8 دقائق في RT ، وتخلص من المادة الطافية.
- أخيرا ، أعد تعليق حبيبات الخلية في 500 ميكرولتر من المخزن المؤقت MACS وانقلها إلى أنبوب طرد مركزي دقيق جديد سعة 1.5 مل. ضع الأنبوب المسمى في صندوق ثلج مغطى جاهز للتحليل.
ملاحظة: تم إجراء جميع تحليلات قياس التدفق الخلوي المضمنة على نظام مقياس التدفق الخلوي Beckman Coulter Cytoflex 4-laser (باستخدام ليزر الإثارة 488 نانومتر فقط). - قم بإعداد الحد الأقصى للطول الموجي للانبعاث والمرشح لكل فلوروكوم على النحو التالي: CD45-FITC - الحد الأقصى للانبعاثات 520 نانومتر ، المرشح 525/50 ؛ CD144-PE - الحد الأقصى للانبعاثات 578 نانومتر ، المرشح 585/40 ؛ CD31-PerCP - الحد الأقصى للانبعاثات 675 نانومتر ، مرشح 655-730.
- كما هو موضح في الشكل 2 ، سجل بيانات 10000 خلية لكل عينة في بوابة مفردة (P2). تحقق من أن P1 يحيط بمجموعة خلايا رئيسية وأن معظم هذه الخلايا تقع في البوابة الفردية P2. تأكد من أن عنصر التحكم غير الملوث يحتوي على الحد الأدنى من خلايا CD45-CD144 + CD31 + كنسبة مئوية من الخلايا الفردية.
- سجل النسبة المئوية لمفردات الخلايا CD45-CD144 + CD31 + في العينة الملطخة.
4. وقت مضاعفة الخلايا البطانية وتكاثر الخلايا (الشكل 3)
- في المقطعين 2 و 3 ، احسب عدد hSATMVECs القابلة للحياة لكل عينة باستخدام قياس الدم. سجل تاريخ ووقت كل عدد خلايا.
- احسب عدد مضاعفة السكان بين هذه النقاط وفقا للمعادلة: مضاعفة الوقت = (المدة × log (2)) / (log (التركيز النهائي) - log (التركيز الأولي)).
ملاحظة: تتوفر آلة حاسبة عبر الإنترنت في https://doubling-time.com/compute.php. - تقييم انتشار hSATMVECs باستخدام مجموعة تصوير انتشار الخلايا المتاحة تجاريا. قم بزراعة hSATMVECs بكثافة 20000 خلية لكل بئر في صفيحة من 24 بئرا واتركها طوال الليل في وسائط نمو EC كاملة MV للتعافي.
- في اليوم التالي ، أضف 5-Ethynyl-2'-deoxyuridine (EdU) إلى كل بئر مخفف في وسائط نمو EC كاملة MV بتركيز نهائي قدره 10 ميكرومتر. احتضان عند 37 درجة مئوية (5٪ CO2) لمدة 2 ساعة.
- قم بإزالة الوسائط التي تحتوي على EdU واغسل كل منها جيدا مرتين باستخدام برنامج تلفزيوني. ثبت الخلايا بنسبة 4٪ بارافورمالدهيد لمدة 15 دقيقة في RT. اغسل كل بئر مرتين باستخدام PBS وأضف 500 ميكرولتر من 0.5٪ Triton X-100 في محلول ملحي مؤقت (TBS). اتركيه لاحتضانه في RT لمدة 20 دقيقة.
ملاحظة: هذا يتخلل غشاء الخلية ، مما يسمح بدخول أزيد الفلور 488 المسمى Alexa fluor إلى الخلية. - قم بإعداد كوكتيل Azide المسمى Alexa fluor 488 وفقا لتعليمات الشركة المصنعة ، اعتمادا على عدد الآبار (انظر6). اغسل كل بئر مرتين باستخدام PBS قبل إضافة 100 ميكرولتر من كوكتيل Azide المسمى Alexa fluor 488 واحتضانه لمدة 30 دقيقة في RT محمي من الضوء.
ملاحظة: يتفاعل كوكتيل أزيد الفلور 488 المسمى Alexa fluor مع EdU في تفاعل نقرة. - قم بإزالة كوكتيل Azide المسمى Alexa fluor 488 واغسله مرتين باستخدام برنامج تلفزيوني. أضف 500 ميكرولتر من يوديد البروبيديوم لكل بئر واحتضانها لمدة 20 دقيقة في RT.
ملاحظة: تؤدي هذه الخطوة إلى تلطيخ النوى (المتكاثرة وغير المتكاثرة) باللون الأحمر.
قم بإزالة يوديد البروبيديوم ، واغسله مرتين باستخدام برنامج تلفزيوني ، واترك كل بئر في 500 ميكرولتر من برنامج تلفزيوني للتصوير. - صور كل بئر في 4 حقول عالية الطاقة بتكبير 10x ، مع إثارة / انبعاث 495/519 نانومتر للأزيد 488 نانومتر (انظر الشكل 3C).
ملاحظة: تم التقاط الصور في الأشكال باستخدام نظام تحليل الخلايا الحية عند تكبير 10x مع وقت تعريض 800 مللي ثانية. - احسب عدد الخلايا المتكاثرة (الخضراء) وعبر عنها كنسبة مئوية (٪) من إجمالي الخلايا داخل كل حقل عالي الطاقة (متوسط 4 مناطق لكل بئر).
5. تشكيل أنبوب الخلية البطانية
- اترك Matrigel (مصفوفة الغشاء القاعدي. BMM) لتذويب بين عشية وضحاها على الجليد. في اليوم التالي ، مع وضع اللوحة على الجليد ، أضف 160 ميكرولتر من BMM إلى كل بئر من لوحة 24 بئرا حسب الحاجة. قم بإمالة اللوحة للحصول على تغطية كاملة لكل بئر باستخدام BMM. ضع اللوحة في حاضنة عند 37 درجة مئوية مع 5٪ CO2 لضبطها أثناء تحضير الخلايا.
- بذرة hSATMVECs في 100000 خلية (في 1 مل من الوسائط) لكل بئر. ماصة على جانب البئر والحرص على ماصة ببطء لتجنب انفصال المصفوفة. احتضان اللوحة عند 37 درجة مئوية مع 5٪ CO2 لمدة 4 ساعات.
ملاحظة: في هذه المرحلة، تكون اللوحة جاهزة للتصوير. تم استخدام النتائج والأرقام الموجودة أسفل التصوير الطوري على نظام تحليل الخلايا الحية عند تكبير 10x في 5 مناطق بئر مختلفة (انظر الشكل 3D). - احسب عدد الأنابيب الكاملة في كل مجال عالي الطاقة واحسب متوسط القيمة لكل عينة.
6. تحفيز الأنسولين من hSATMVEC
- استزرع hSATMVEC في لوحة 6 آبار عند 37 درجة مئوية مع 5٪ CO2. بمجرد أن تتلاقى ، قم بإزالة وسائط نمو الخلايا البطانية الكاملة MV واغسلها مرتين باستخدام برنامج تلفزيوني.
- أضف 500 ميكرولتر من وسائط تجويع المصل (وسائط نمو الخلايا البطانية MV بدون مكملات غذائية) إلى كل بئر واتركها لتحضن عند 37 درجة مئوية مع 5٪ CO2 لمدة 4 ساعات. خلال هذا الوقت ، قم بإعداد 500 ميكرولتر من حصص زيادة تركيزات الأنسولين (0-150 ميكرومتر) المحضرة في وسائط تجويع المصل.
- بعد تجويع المصل لمدة 4 ساعات ، قم بإزالة الوسائط من الآبار ، وأضف 1 مل من الوسائط المحتوية على الأنسولين (بتركيزات متزايدة) إلى كل بئر ، واحتضانها لمدة 10 دقائق عند 37 درجة مئوية مع 5٪ CO2.
- اغسل مرتين باستخدام برنامج تلفزيوني بارد قبل إضافة 100 ميكرولتر من محلول تحلل البروتين الذي يحتوي على مثبطات الأنزيم البروتيني والفوسفاتيز إلى خلايا التحلل للحصول على البروتين. تحديد كمية البروتين باستخدام مقايسة BCA.
ملاحظة: في التجربة الموضحة أدناه ، تم تحضين محللات الخلايا لمدة 30 دقيقة في حمام جليدي وتم طردها مركزيا عند 20000 × جم لمدة 15 دقيقة. قبل الرحلان الكهربائي ، تم غلي عينات البروتين لتشويه البروتينات عند 95 درجة مئوية لمدة 5 دقائق. تم تحليل البروتينات على NuPAGE 4-12٪ Bis-Tris Gel ونقلها إلى غشاء النيتروسليلوز. تم إجراء تحليل اللطخة المناعية وفقا للبروتوكولات القياسية باستخدام الأجسام المضادة للبروتين الفوسفاتي ذات الصلة والأجسام المضادة للبروتين الكلي (وفقا لتعليمات الشركة الصانعة). تم استخدام جسم مضاد ثانوي مناسب Ig / HRP للكشف عن الجسم المضاد الأساسي (وفقا لتعليمات الشركة المصنعة). تم تحديد مستويات البروتين باستخدام قياس الكثافة بناء على شدة النطاقات من كل عينة. تم استخدام ß-actin كعنصر تحكم في التحميل عند الاقتضاء.
7. إعداد الثقافة المشتركة للخلايا الدهنية hSATMVEC (الشكل 4)
ملاحظة: في النتائج أدناه ، تم استخدام الخلايا تحت الجلد البيضاء البشرية المتاحة تجاريا في الممر 2 من متبرع قوقازي ذكر واحد في جميع فحوصات الخلايا الشحمية. تم توسيع الخلايا الأولية في البداية من القارورة التي يوفرها البائع (الممر 0) إلى اثني عشر كريوفيال تحتوي على وسائط تجميد cryo-SFM (المقطع 1).
- تتطلب كل صفيحة استزراع مشترك مكونة من 24 بئرا كريوبيا واحدا من الخلايا السابقة للحرارة (المقطع 1). قم بإذابة كل قارورة وصفيحة بسرعة في دورق T75 يحتوي على 12-15 مل من وسائط PGM-2 الدافئة (تحتوي على 10٪ FBS و 30 ميكروغرام / مل L-glutamine و 15 نانوغرام / مل GA-1000 SingleQuots). قم بتغيير الوسائط كل 3 أيام حتى تتلاقى 90٪.
- بمجرد التقاء 90٪ ، اغسل الخلايا preadipocytes البيضاء تحت الجلد البشرية مع PBS ثم أضف 1 مل من محلول التربسين / EDTA (0.25٪). اتركيه في RT لمدة 2 دقيقة وتأكد من الانفصال باستخدام الفحص المجهري الضوئي. أضف 23 مل من وسائط PGM-2 لتحييد التربسين / EDTA وصنع محلول معلق preadipocyte سعة 24 مل.
- ضع 1 مل من محلول الخلايا البيضاء تحت الجلد البشري المعلق في كل بئر من صفيحة مصاحبة للثقافة المشتركة مكونة من 24 بئرا وتنمو إلى نقطة التقاء (عادة 2-3 أيام).
- أثناء النمو إلى الالتقاء ، قم بإعداد وسائط تمايز الخلايا preadipocyte (PDM). لتحضير PDM ، قم بعمل مخزون PDM 2x عن طريق إضافة مزيج خاص من الأنسولين وديكساميثازون والإندوميتاسين والأيزوبوتيل ميثيل زانثين إلى وسائط PGM الأساسية. قم بتخفيف 2x PDM بنسبة 1: 1 باستخدام PGM لعمل 1x PDM.
- بمجرد التقارب ، قم بتمييز الخلايا البشرية البيضاء تحت الجلد عن طريق تغيير الوسائط إلى 1 مل من وسائط PDM 1x في كل بئر (اليوم 0). اترك الخلايا البشرية البيضاء تحت الجلد لاحتضانها عند 37 درجة مئوية 5٪ CO2 لمدة 10 أيام (بدون تغييرات في الوسائط) للتمييز الكامل. مراقبة التمايز باستخدام مجهر الطور الضوئي (انظر الشكل 4 ب).
ملاحظة: لا يمكن تمرير الخلايا الشحمية المتمايزة ويمكن استخدامها للمقايسات من اليوم 10 إلى اليوم 12. يمكن قياس تمايز الخلايا الشحمية عن طريق تضخيم mRNA لليبتين والأديبونيكتين و PPAR-γ. - في اليوم 6 من التمايز ، تكمل hSATMVECs البذور بكثافة 5 × 104 خلايا لكل إدراج في 500 ميكرولتر وسائط نمو EC MV على إدخالات التوابع (غشاء 0.4 ميكرومتر). ضع إدخالات البئر في بئر مع 500 ميكرولتر من وسائط نمو EC الكاملة MV () وتنمو إلى التقاء عند 37 درجة مئوية في 5٪ CO2.
- في اليوم 10 ، عندما يتم تمييز الخلايا الشحمية تماما ، قم بإزالة نصف وسائط PDM من كل بئر ونقل إدخالات transwell التي تحتوي على hSATMVEC المتقارب في وسائطها الخاصة (ECGM-MV) إلى كل بئر (انظر الشكل 4A).
- اترك الخلايا في مزرعة مشتركة لمدة 24 ساعة قبل إزالة إدخالات البئر وإجراء فحوصات لتقييم وظيفة الخلايا الشحمية.
ملاحظة: في هذه المرحلة الزمنية ، يمكن أيضا تحلل الخلايا الشحمية إما لعزل البروتين أو الحمض النووي الريبي إذا لزم الأمر.
8. الخلايا الشحمية 2- (N- (7-نيتروبنز -2-أوكسا -1،3-ديازول-4-يل) أمينو) -2-ديوكسي جلوكوز (2-NBD) - امتصاص الجلوكوز
- بعد 24 ساعة في الثقافة المشتركة ، قم بإزالة إدخالات الخلايا التي تحتوي على hSATMVEC. بعد ذلك ، أضف 2-NBD-glucose إلى الوسائط في كل بئر لتحقيق تركيز نهائي يبلغ 20 ميكرومتر. يحفظ بعيدا عن الضوء ويحتضن لمدة 30 دقيقة عند 37 درجة مئوية مع 5٪ CO2.
- اغسل الخلايا مرتين في برنامج تلفزيوني وقم بإصلاح الخلايا الشحمية باستخدام 500 ميكرولتر من 4٪ بارافورمالدهيد (PFA) لمدة 15 دقيقة في RT. اغسل الخلايا ثلاث مرات في برنامج تلفزيوني قبل المغادرة في 100 ميكرولتر من برنامج تلفزيوني.
ملاحظة: في هذه المرحلة ، تكون الخلايا الشحمية جاهزة للتصوير. في الأشكال المدرجة ، تم الحصول على تصوير الطور والضوء الأخضر (إثارة 440-480 نانومتر / انبعاث 504-544 نانومتر) على نظام تحليل الخلايا الحية عند تكبير 10x في أربعة مجالات عالية الطاقة (انظر الشكل 4C). - حدد مستوى امتصاص الجلوكوز عن طريق تحديد النسبة المئوية الخضراء للمساحة الإجمالية باستخدام العتبة في ImageJ (أو أي حزمة برامج أخرى مماثلة).
النتائج
نقاء hSATMVEC والنمط الظاهري
كان hSATMVEC المعزول من مرضى التحكم (أي الأشخاص الذين ليس لديهم تاريخ من أمراض القلب والأوعية الدموية) 99.5٪ CD31 + CD144 + CD45- على قياس التدفق الخلوي (الشكل 2). كان ل hSATMVEC المعزول مورفولوجيا تشبه الحصى نموذجية ل ECs (الشكل 3 أ). كان متوسط وقت مضاعفة عدد السكان hSATMVECs 56.6 ساعة ± 8.1 ساعة (متوسط ± SEM ، n = 10) (الشكل 3B) ، وتم تأكيد تكرار الحمض النووي النشط في hSATMVECs باستخدام مجموعة تصوير تكاثر الخلايا (الشكل 3C).
تصرفت hSATMVEC مثل MVECs العاملة وشكلت أنابيب في Matrigel (الشكل 3D). يوضح الشكل 3E التعبير النسبي للبروتينات الرئيسية المشاركة في مسار إشارات الأنسولين Akt-eNOS. أظهر كل من eNOs و Akt زيادات في الفسفرة المستحثة بالأنسولين ، ممثلة في نسبة البروتين المفسفر / البروتين الكلي الطبيعي إلى ß-actin (الشكل 3E).
hSATMVEC-الثقافة المشتركة للخلايا الشحمية
يمكن رؤية نموذج توضيحي للثقافة المشتركة hSATMVEC-greasecyte في الشكل 4A. عندما تصبح الخلايا preadipocytes البيضاء تحت الجلد البشرية أكثر تمايزا ، سيلاحظ المرء تطور فجوات الدهون (الشكل 4B) ، والتي يمكن قياسها كميا عن طريق تلطيخ Oil Red O (الشكل 4B).
يظهر تباين الطور التوضيحي والتصوير الفلوري (الإثارة 440-480 نانومتر / الانبعاث 504-544 نانومتر) للخلايا الشحمية المتمايزة بعد 30 دقيقة من الحضانة مع 20 ميكرومتر 2-NBD الجلوكوز في الشكل 4C. يمكن قياس امتصاص الجلوكوز عن طريق قياس المساحة الخضراء كنسبة مئوية من إجمالي مساحة الخلية.
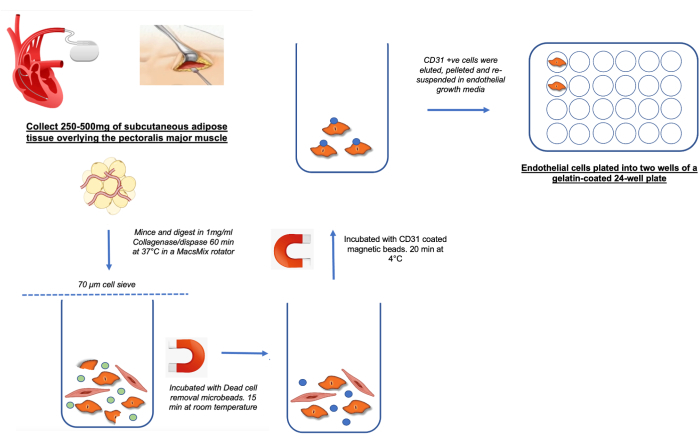
الشكل 1: رسم تخطيطي يوضح حصاد ومعالجة hSATMVECs الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
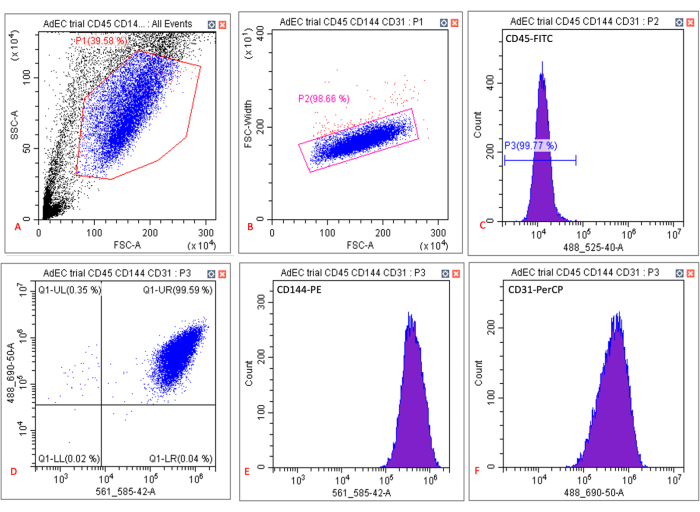
الشكل 2: الناتج النموذجي لتحليل قياس التدفق الخلوي ل hSATMVECs المستزرعة. (أ) مخطط مبعثر لمنطقة التشتت الجانبي (SSC-A) ومنطقة التشتت الأمامية (FSC-A) يوضح البوابة (الصندوق الأحمر) ل hSATMVECs المستزرعة حول كثافة سكانية محددة للخلايا. (B) مخطط مبعثر لعرض التشتت الأمامي (FSC-Width) و FSC-A يظهر بوابة (صندوق أحمر) ل hSATMVECs المستزرعة حول كثافة سكانية معينة للخلايا. (ج) رسم بياني يوضح مضان الخلايا المسورة إلى CD45-FITC. (د) مخطط التشتت لشدة التألق ل CD144-PE (المحور السيني) و CD31-PerCP (المحور ص). ه: مدرج تكراري يوضح مضان الخلايا المسورة إلى CD144-PE. (F) مدرج تكراري يوضح مضان الخلايا المسورة إلى CD31-PerCP. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
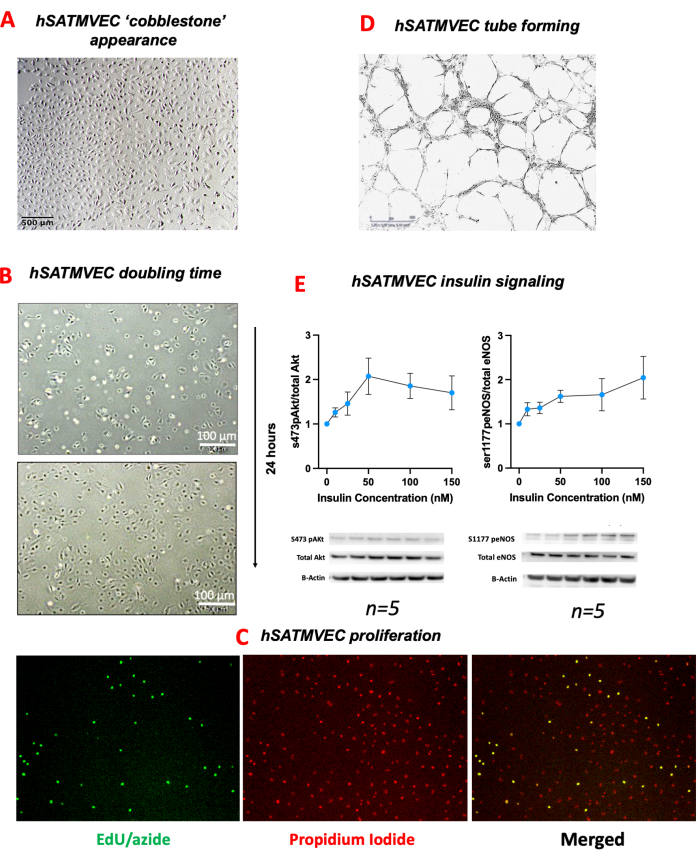
الشكل 3: النمط الظاهري hSATMVEC. (أ) صورة مجهرية ضوئية ل hSATMVEC بالقرب من التقاء تظهر مظهرا يشبه الحصى. (ب) وقت مضاعفة hSATMVEC - الفحص المجهري الضوئي ل HATEC المأخوذ بفاصل 24 ساعة يوضح مدى تكاثر الخلايا. (ج) انتشار الساتل ساتمفيك. الفحص المجهري الفلوري ل hSATMVEC مع يوديد البروبيديوم و EdU / Alexa-fluor 488 من موضوعات التحكم. (D) تشكيل أنبوب hSATMVEC من الموضوعات الضابطة (الصور الملتقطة بتكبير 4x). (ه) تحفيز الأنسولين ل HATECs - إظهار التعبير النسبي ل Akt المفسفر (serine 473) إلى إجمالي Akt (اللوحة اليسرى) eNOS المفسفرة (serine 1177) إلى إجمالي eNOS (اللوحة اليمنى) عند زيادة تركيزات الأنسولين مع بقع غربية توضيحية أسفل موحدة إلى B-actin. يتم عرض البيانات كمتوسط ± SEM. أحجام العينات أسفل كل لوحة. الاختصارات: 5-Ethynyl-2'-deoxyuridine (EdU) ، الخلايا البطانية الوعائية الدقيقة للأنسجة الدهنية البشرية تحت الجلد (hSATMVEC) ، الخطأ المعياري للمتوسط (SEM). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
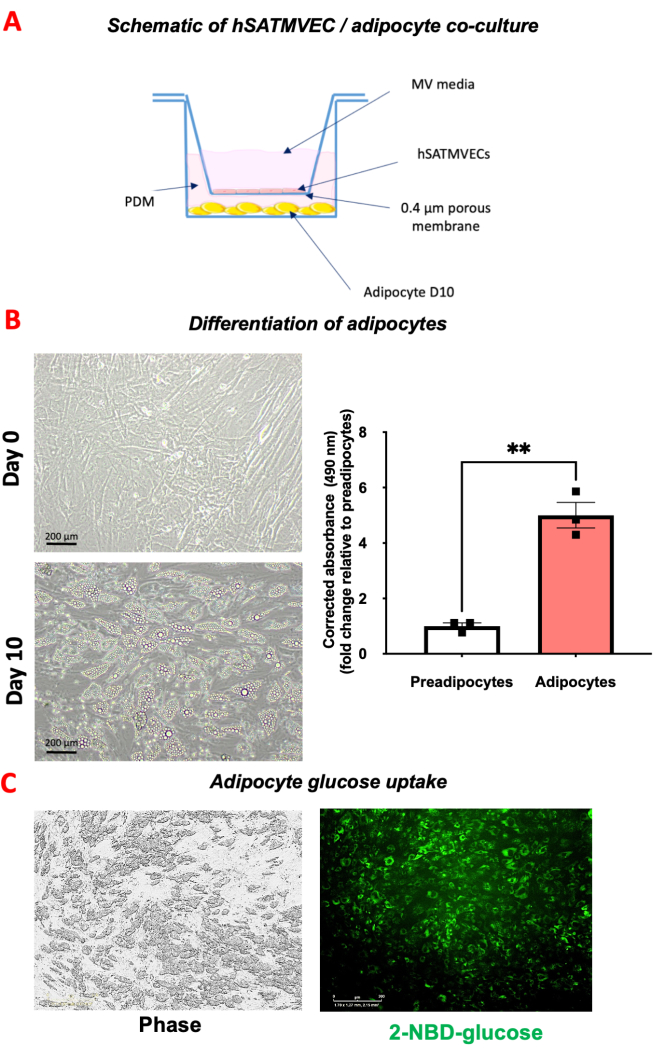
الشكل 4: الاستزراع المشترك للخلايا الشحمية hSATMVEC. (أ) صورة تخطيطية للاستزراع المشترك للخلايا الشحمية hSATMVEC. ب: تمايز الخلايا الشحمية. تظهر اللوحة اليسرى الخلايا السابقة للدهون في اليوم 0 وتظهر اللوحة اليمنى اليوم 10 الخلايا الشحمية المتمايزة بعد إضافة PDM. يوضح الشكل السفلي كمية الدهون المخزنة في الخلايا الشحمية والخلايا preadipocytes الملطخة بمقايسة امتصاص الجلوكوز Oil Red O. (C). تظهر اللوحة اليسرى التصوير الطوري للخلايا الشحمية بعد الزراعة المشتركة والحضانة مع 20 ميكرومتر من الجلوكوز 2-NBD لمدة 30 دقيقة. تظهر اللوحة اليمنى تصويرا أخضر يمكن من خلاله قياس امتصاص الجلوكوز (كنسبة مئوية خضراء من المساحة الإجمالية). يتم عرض البيانات كمتوسط ± SEM. الاختصارات: اليوم 10 (D10) ، الخلايا البطانية الوعائية الدقيقة للأنسجة الدهنية البشرية تحت الجلد (hSATMVEC) ، وسائط تمايز الخلايا قبل الشحمية (PDM) الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي 1: كوكتيل تلطيخ لقياس التدفق الخلوي. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
تصف هذه الدراسة تقنية عزل hSATMVEC المأخوذة من SAT أثناء الزرع الروتيني ل CIEDs. لقد أثبتنا أن hSATMVEC المعزول يتمتع بنقاوة عالية ، ويعبر عن بروتينات الغشاء الخاصة ب EC CD144 و CD31 ، ولا يظهر أي تعبير مهم عن كريات الدم البيضاء CD45. نستمر في إظهار أنه ، بطريقة قابلة للتكرار وموثوقة ، تتكاثر hSATMVEC المعزولة ويمكن استخدامها تجريبيا لدراسة الآلية داخل الخلايا المشاركة في إشارات الأنسولين وتكوين الأوعية. بالإضافة إلى القدرة على استزراعهم بمعزل عن غيرهم، يمكن استخدامها أيضا في الثقافة المشتركة لدراسة الحديث المتقاطع بين الخلايا الدهنية hSATMVEC.
عادة ما يتم الحصول على الخلايا البطانية المستخدمة في الأبحاث الأساسية والانتقالية من الأوعية الكبيرة ، مثل الشريان الأورطي والوريد السري البشري ، أو الأوعية الدموية الدقيقة. هذه المصادر لها حدودهاالخاصة 7,8 ؛ يصعب الوصول إلى الخلايا البطانية من الأوعية الكبيرة (في حالة الأنسجة الأبهرية) أو مشتقة من الأنسجة الوليدية مع احتمال اختلاف الفسيولوجيا والتعرض البيئي9. يسمح استخدام الخلايا البطانية المعزولة من الأنسجة المأخوذة أثناء زرع CIED بالتحقيق والتجريب في علم وظائف الأعضاء الخلوي ضمن مجموعات محددة من المرضى في العالم الحقيقي. يتم زرع CIEDs لمجموعة متنوعة من المؤشرات ، بما في ذلك في المرضى الذين يعانون من بطء نظم القلب وفشل القلب والوقاية الأولية والثانوية من عدم انتظام ضربات القلب البطيني10. غالبا ما يعاني هؤلاء المرضى من أمراض مشتركة متعددة ، بما في ذلك مرض السكري والسمنة وأمراض الشريان التاجي ، والتي تعد محورا عالميا رئيسيا لأبحاث القلب والأوعية الدموية11،12،13. علاوة على ذلك ، في حين أن البيانات التوضيحية في هذه الورقة تتعلق بمراقبة المرضى ، فقد طبقنا هذه التقنيات لعزل ودراسة SATMVEC من مجموعة من المرضى ، بما في ذلك أولئك الذين يعانون من قصور القلب المتقدم و / أو داء السكري من النوع 2.
ليس من النادر أن نواجه مشاكل مع ضعف غلة hSATMVEC بعد محاولة عزل الخلايا. يمكن تقليل هذا الخطر بشكل كبير باستخدام حجم بدء أكبر من SAT لعزل hSATMVEC. بالإضافة إلى ذلك ، نواجه هذا بشكل متكرر في SAT من الأشخاص المصابين بأمراض القلب والأوعية الدموية ، وعلى وجه الخصوص مرض السكري.
أحد قيود هذه التقنية هو أن hSATMVEC المعزول لا يمكن أن يخضع إلا لعدد محدود من الممرات. في تجربتنا بعد المرور 5 ، بغض النظر عن النمط الظاهري للمريض ، يتباطأ انتشار hSATMVEC بشكل كبير. بالإضافة إلى ذلك ، لا تتكاثر hSATMVEC المعزولة باستخدام هذه التقنية بشكل جيد عندما تكون قليلة السكان. لذلك ، نوصي بعدم تمرير hSATMVEC بنسبة أكبر من 1: 6. كما هو مذكور في الصفحة 1. لقد نجحنا في إذابة وإعادة تنشيط hSATMVEC المخزن في النيتروجين السائل لمدة تصل إلى 4 سنوات ، وفي تجربتنا ، تكون فرصة الإنعاش أكبر عند حفظها بالتبريد عند رقم مرور أقل (عادة ما نقوم بحفظ hSATMVEC بالتبريد في الممر 2).
الأنسجة المأخوذة عند إدخال CIED متاحة مجانا ويمكن حصادها دون الإضرار بالمريض. لذلك ، فإن المصدر السهل الوصول إليه وغير الجراحي نسبيا للخلايا البطانية من مجموعات المرضى هذه له فائدة كبيرة في إجراء البحوث المستهدفة. في حين أن الصور التمثيلية في هذه الورقة مستمدة من مرضى "التحكم" (أي المرضى الذين ليس لديهم تشخيص لفشل القلب أو مرض السكري ، وإن كان ذلك مع إشارة إلى زرع CIED) ، فقد نجحنا في عزل وزراعة وزراعة SATMVECs من المرضى الذين يعانون من قصور القلب والسكري ومجموعة من هذه الأمراض. علاوة على ذلك ، يمكن أيضا تطبيق هذه التقنيات على أسرة الأوعية الدموية الدقيقة الأخرى ، بما في ذلك العضلات الهيكلية ، ونحن نعمل حاليا على تحسين نموذج للحديث المتبادل بين العضلات الهيكلية MVEC-myocyte.
يمكن عزل hSATMVECs من الأنسجة البشرية المأخوذة في وقت إدخال CIED وهي ذات نقاء كاف لاستخدامها تجريبيا لدراسة الخلل الوظيفي في الأوعية الدموية الدقيقة والحديث المتبادل بين الخلايا الشحمية البطانية في الأشخاص المصابين بأمراض القلب والأوعية الدموية أو بدونها.
Disclosures
تلقت SS دعما غير مالي ورسوم المتحدثين وأتعاب من AstraZeneca. تلقى RC رسوم المتحدث من Janssen Oncology. تلقى بنك عمان الدولي رسوم المتحدث من نوفارتيس.
Acknowledgements
نحن ممتنون جدا لقسم التصوير الحيوي بكلية العلوم البيولوجية (جامعة ليدز ، المملكة المتحدة) لاستخدام مرفق قياس التدفق الخلوي ، والذي تم دعمه بتمويل منحة من مجلس أبحاث التكنولوجيا الحيوية والعلوم البيولوجية (BBSRC BB / R000352 / 1). تم دعم SS من قبل زمالة التدريب على البحوث السريرية لمؤسسة القلب البريطانية (FS / CRTF / 20/24071). تم دعم CL من قبل منحة الدكتوراه في مؤسسة القلب البريطانية (FS / 19/59/34896). تم دعم LDR من قبل جائزة زمالة Diabetes UK RD Lawrence (16/0005382). تم دعم RMC من قبل زمالة البحوث السريرية المتوسطة لمؤسسة القلب البريطانية (FS / 12/80/29821). MTK هو أستاذ مؤسسة القلب البريطانية لأبحاث القلب والأوعية الدموية والسكري (CH / 13/1/30086) وحاصل على منحة برنامج مؤسسة القلب البريطانية (RG / F / 22 / 110076)
Materials
| Name | Company | Catalog Number | Comments |
| 170L CO2 Incubator | GS Biotech | 170G-014 | |
| 2-NBDG (2-(N-(7-Nitrobenz-2-oxa-1,3-diazol-4-yl)Amino)-2-Deoxyglucose) | Invitrogen | N13195 | |
| 4% PARAFIX buffered histological fixative | VWR Chemicals | PRC/R/38/1 | |
| Akt (tAkt) Rabbit 1:1000 | Cell Signalling Technology | 9272 | |
| BD Venflon Pro Safety 14 g x 45 mm, Orange, 50/pk | Medisave | 393230 | |
| Bovine Serum Albumin solution, 7.5% | Merck | A8412-100ML | |
| CD144 (VE-Cadherin) Antibody, anti-human, PE, REAfinity | Miltenyi Biotec | 130-118-495 | |
| CD31 Antibody, anti-human, PerCP-Vio 700, REAfinity | Miltenyi Biotec | 130-110-811 | |
| CD31 MicroBead Kit, human, 1 kit | Miltenyi Biotec | 130-091-935 | |
| CD45 Antibody, anti-human, FITC, REAfinity | Miltenyi Biotec | 130-110-769 | |
| Cell Extraction Buffer | Invitrogen | FNN0011 | |
| Centrifuge 5804 R | Eppendorf | 5805000060 | |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 488 dye | Invitrogen | C10337 | Cell proliferation imaging kit |
| Collagenase/Dispase, 500 mg | Roche/Merck | 11097113001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | Basement Membrane Matrix |
| Corning 100 mm TC-treated Culture Dish | Corning | 430167 | |
| Costar 24-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3526 | |
| Costar 6-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3516 | |
| CytoFLEX S – 4 laser flow Cytometer | Beckman | ||
| Dead Cell Removal Kit | Miltenyi Biotec | 130-090-101 | |
| Dulbecco′s Phosphate Buffered Saline | Merck | D8537-500ML | |
| EASYstrainer Cell sieve for 50 mL tubes, 70 µm mesh, Blue, sterile, 50/pk | Greiner Bio-One | 542070 | |
| Endothelial Cell Growth Medium MV | PromoCell | C-22020 | |
| Eppendorf Safe-Lock micro test tubes | Merck | EP0030120094 | |
| Ethylenediaminetetraacetic acid solution | Merck | E8008-100ML | |
| Falcon 24 Well TC-Treated Cell Polystyrene Permeable Support Companion Plate, with Lid, Sterile, 1/Pack, 50/Case | Appleton Woods | CF537 | |
| Falcon Permeable Support for 24 Well Plate with 0.4 µm Transparent PET Membrane, Sterile, 1/Pack, 48/Case | Appleton Woods | CF521 | |
| Freezing Medium Cryo-SFM | PromoCell | C-29912 | |
| Gelatin solution, 2% in water | Merck | G1393-100ML | |
| Gibco Antibiotic-Antimycotic (100x), 100mL | Fisher Scientific | 11570486 | |
| Gibco TrypLE Select Enzyme (1x), no phenol red | Fisher Scientific | 12563029 | |
| Hanks′ Balanced Salt solution | Merck | H6648-500ML | |
| Human Subcutaneous Preadipocyte Cells | Lonza | PT-5020 | |
| Incucyte ZOOM | Essen BioScience | Live-cell analysis system | |
| Insulin solution human | Merck | I9278-5ML | |
| LS Columns, 25/pk | Miltenyi Biotec | 130-042-401 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MACS Tissue Storage Solution | Miltenyi Biotec | 130-100-008 | |
| MACSmix Tube Rotator | Miltenyi Biotec | 130-090-753 | Tube Rotator |
| MS Columns, 25/pk | Miltenyi Biotec | 130-042-201 | |
| NuPAGE 4–12% Bis-Tris Gel | Invitrogen | NP0322BOX | |
| OctoMACS Separator | Miltenyi Biotec | 130-042-109 | |
| PGM-2 Preadipocyte Growth Medium-2 BulletKit | Lonza | PT-8002 | |
| Phospho (Ser1177) eNOS Rabbit 1:1000 | Cell Signalling Technology | 9570 | |
| Phospho-Akt (Ser473) Rabbit 1:1000 | Cell Signalling Technology | 4060 | |
| Pre-Separation Filters 30 µm, 50/pk | Miltenyi Biotec | 130-041-407 | |
| Propidium Iodide (PI)/RNase Staining Solution | Cell Signalling Technology | 4087 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| Scalpel Disposable Sterile Style 10 | VWRI | 501 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstetd | 62.554.502 | |
| Screw cap tube, 50 ml, (LxØ): 114 x 28 mm, PP, with print | Sarstedt | 62.547.254 | |
| Screw cap tube, 50 ml, (LxØ): 114 x 28 mm, PP, with print | Sarstetd | 62.547.254 | |
| Total eNOS Mouse 1:1000 | BD Biosciences | 610297 | |
| Triton X-100, BioUltra, for molecular biology | Merck | 93443-500ML | |
| β-Actin (C4) Mouse 1:5000 | Santa Cruz Biotechnology | Sc-47778 |
References
- Bierhansl, L., et al. Central role of metabolism in endothelial cell function and vascular disease. Physiology. 32 (2), 126-140 (2017).
- Aird, W. C. Endothelial cell heterogeneity. Cold Spring Harb Perspect Med. 2 (1), a006429 (2012).
- Rajendran, P., et al. The vascular endothelium and human diseases. Int J Biol Sci. 9 (10), 1057-1069 (2013).
- Brown, O. I., Bridge, K., Kearney, M. T. Nicotinamide adenine dinucleotide phosphate oxidases in glucose homeostasis and diabetes-related endothelial cell dysfunction. Cells. 10 (9), 2315 (2021).
- Luk, C., Haywood, N. J., Bridge, K. I., Kearney, M. T. Paracrine role of the endothelium in metabolic homeostasis in health and nutrient excess. Front Cardiovasc Med. 26 (9), 882923 (2022).
- . Click-iT EdU Imaging Kits Available from: https://www.thermofisher.com/document-connect/document-connect.html?url=https://assets.thermofisher.com/TFS-Assets%2FLSG%2Fmanuals%2Fmp10338.pdf (2024)
- Bouïs, D., et al. Endothelium in vitro: A review of human vascular endothelial cell lines for blood vessel-related research. Angiogenesis. 4 (2), 91-102 (2001).
- Ades, E. W., et al. HMEC-1: establishment of an immortalized human microvascular endothelial cell line. J Invest Dermatol. 99 (6), 683-690 (1992).
- Chi, J. T., et al. Endothelial cell diversity revealed by global expression profiling. Proc Natl Acad Sci U S A. 100 (19), 10623-10628 (2003).
- Brignole, M., et al. 213 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J. 34 (29), 2281-2329 (2013).
- Greenspon, A. J., et al. Trends in permanent pacemaker implantation in the United States from 1993 to 2009: Increasing complexity of patients and procedures. J Am Coll Cardiol. 60 (16), 1540-1545 (2012).
- Mendis, S. A., Alwan, A. . Prioritized Research Agenda for Prevention and Control of Noncommunicable Diseases. , (2011).
- Brown, O. I., et al. Relationship among diabetes, obesity, and cardiovascular disease phenotypes: A UK biobank cohort study. Diabetes Care. 46 (8), 1531-1540 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved