A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التخليق الإشعاعي ومراقبة الجودة والتصوير المقطعي بالإصدار البوزيتروني للحيوانات الصغيرة ل 68جزيئا نانو مسمى Ga
In This Article
Summary
تصف هذه الورقة التخليق الإشعاعي والصياغة ومراقبة الجودة لمسبار جديد ذو علامات إشعاعية (أي 68جسم نانوي مسمى Ga NM-02) ، واستخدامه لتصوير الصغيرة PET / CT في نموذج xenograft.
Abstract
يعد التصوير المقطعي بالإصدار البوزيتروني للحيوانات الصغيرة (PET) والتصوير المقطعي المحوسب بإصدار الفوتون الفردي (SPECT) أمرا بالغ الأهمية في أبحاث السرطان قبل السريرية ، مما يستلزم اهتماما دقيقا بتخليق المقتفي الإشعاعي وضمان الجودة وبروتوكولات الحقن في الجسم الحي . تقدم هذه الدراسة سير عمل شاملا مصمما لتعزيز متانة وقابلية تكرار تجارب الصغيرة PET. تم تفصيل عملية التوليف في مختبر الكيمياء الإشعاعية باستخدام 68Ga ، مما يسلط الضوء على بروتوكولات مراقبة الجودة الصارمة وتأكيدها لكل إنتاج من أجهزة التتبع الإشعاعي. تتم مراقبة المعلمات مثل التركيز والنشاط المولي ودرجة الحموضة والنقاء بدقة ، بما يتماشى مع المعايير المطبقة على الدراسات البشرية. تقدم هذه المنهجية تحضير المحاقن المبسط وقنية 30G المصممة خصيصا للحقن الدقيق في الوريد في الفئران. تضمن مراقبة صحة أثناء المسح ، بما في ذلك درجة الحرارة ومعدل ضربات القلب ، رفاهيتها طوال العملية. يتم تحديد جرعات فحوصات التصوير المقطعي بالإصدار البوزيتروني والتصوير المقطعي بالإصدار المرئي من التصوير المسبق لتحقيق التوازن بين الحصول على البيانات وتقليل التعرض للإشعاع للحيوانات والباحثين. وبالمثل ، تستخدم الأشعة المقطعية إعدادات مبرمجة مسبقا للحد من التعرض للإشعاع ، خاصة ذات الصلة بالدراسات طويلة المدى التي تقيم آثار العلاج. من خلال تحسين هذه الخطوات ، يهدف سير العمل إلى توحيد الإجراءات وتقليل التباين وتحسين جودة تصوير الصغيرة PET / SPECT / CT. يوفر هذا المورد رؤى قيمة للباحثين الذين يسعون إلى تحسين دقة وموثوقية التحقيقات قبل السريرية في التصوير الجزيئي ، مما يؤدي في النهاية إلى تطوير المجال.
Introduction
أحد الموضوعات ذات الأهمية القصوى هو البحث في مجال سرطان الثدي. لا يزال سرطان الثدي سرطانا يحدث بشكل متكرر ، حيث يمثل ما يقرب من ثلث جميع أنواع السرطان لدى النساء. تم تصميم العلاج وفقا للخصائص البيولوجية والنسيجية للورم ومرحلة المرض. تكون فرصة البقاء على قيد الحياة جيدة بشكل عام ما لم يكن الورم قد انتشر بالفعل ، وفي هذه الحالة يكون البقاء على قيد الحياة لمدة 5 سنوات حوالي 30٪ فقط1. تعاني سرطانات أمراض النساء الأخرى من مصير مماثل ، على سبيل المثال ، يظهر سرطان المبيض > 95٪ من البقاء على قيد الحياة لمدة 5 سنوات لأورام المرحلة 1 ولكن 15٪ فقط للأورام المنتشرة في المرحلة 42،3.
يعمل التصوير غير الجراحي ، وخاصة التصوير المقطعي بالإصدار البوزيتروني (PET) ، على تحويل أبحاث السرطان لأنه يقدم رؤى لا مثيل لها في الجوانب الجزيئية للورم ، مثل التمثيل الغذائي والتعبير عن المستقبلات والاستجابة العلاجية4،5،6. يسمح بكل من التصور والقياس الكمي لمناطق التمثيل الغذائي المحددة - مما يسمح ليس فقط بالتشخيص الدقيق ، ولكن أيضا بمراقبة تأثير العلاجات (الجديدة) في نقاط زمنية قصيرة جدا. في الواقع ، يسمح التصوير المقطعي بالإصدار البوزيتروني بتقييم الاستجابة مقابل عدم الاستجابة بعد 1-3 دورات علاج ويقوم بذلك بشكل أفضل وأسرع مقارنة بالتغيرات المورفولوجية كما يتضح من التصوير المقطعي المحوسب الكلاسيكي (CT)7. تتيح الطبيعة غير الغازية للتصوير البوهني أيضا إجراء دراسات طولية.
يتطلب أي نموذج حيواني أقصى قدر من التوحيد القياسي من أجل إجراء تقييم شامل للقدرة العلاجية للمستحضرات الصيدلانية الجديدة (المشعة) ، لذلك يجب التركيز على ذلك - سواء في توليد نموذج الورم أو في تصوير الصغيرة / تحليل البيانات. يمكن للمرء أن يناقش أفضل نموذج للورم في (التلقيح تحت الجلد أو زرع تقويم العظام ، أو الفئران ، أو الأورام البشرية ، أو الأورام المتزامنة ، مصحوبة أو غير مصحوبة برعاية سريرية روتينية) ، ولكن هذا سيكون خارج هدف هذا المنشور. نستخدم العديد من النماذج من قبلنا لدراسات السرطان ، والطريقة الموصوفة هنا هي نموذج بسيط نسبيا تحت الجلد.
تعتبر مراقبة الجودة في الكيمياء الإشعاعية أمرا بالغ الأهمية لسلامة وفعالية العلاج. هذا لا يؤثر فقط على المستحضرات الصيدلانية المشعة نفسها ولكن أيضا على تركيبة المنتج. هناك تشريعات واسعة النطاق بشأن إنتاج المستحضرات الصيدلانية المشعة للتطبيقات السريرية8،9 (انظر 10 للحصول على نظرة عامة شاملة على التشريعات والمبادئ التوجيهية الحالية) ، والعديد من المبادئ التوجيهية حول خصائص المستحضرات الصيدلانية المشعة للبحوث قبل السريرية (انظر 11 للحصول على نظرة عامة شاملة). نحن ننتج المستحضرات الصيدلانية المشعة للتطبيقات السريرية وما قبل السريرية ، مما يبسط الترجمة من مراقبة الجودة المتطورة كما هو موجود في التوليفات للتطبيقات السريرية إلى تلك الخاصة بالتطبيقات قبل السريرية.
ينصب تركيزنا البحثي على العلاجات العلاجية الموجهة ، خاصة على السرطانات الإيجابية لمستقبلات عامل نمو البشرة البشرية 2 (HER2). ومن ثم ، نقوم بتطوير مستحضرات صيدلانية مشعة جديدة لتشخيص السرطان ومراقبته أثناء العلاج. يتم أيضا تقييم المستحضرات الصيدلانية المشعة التشخيصية الناجحة كمركبات علاجية باستخدام نظائر مشعة مختلفة. يتم إجراء تقييم هذه المستحضرات الصيدلانية المشعة في البداية في النماذج الحيوانية ، وتسعى جاهدة للترجمة السريرية بعد نتائج ما قبل السريرية الواعدة. في هذه المقالة ، سوف نقدم البروتوكولات المستخدمة ، على سبيل المثال في أحد الأدوية المشعة ، لضمان مراقبة الجودة وضمانها ، بالإضافة إلى الممارسة القياسية للحقن الوريدي للفأر وفحص التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب ، من أجل تحسين دقة وموثوقية التحقيقات قبل السريرية في التصوير الجزيئي. ينقسم البروتوكول إلى ثلاثة أقسام مختلفة: الكيمياء الإشعاعية (تخليق التتبع ومراقبة الجودة) ، وتوليد النموذج الحيواني (نموذج الورم تحت الجلد) ، والتصوير.
Access restricted. Please log in or start a trial to view this content.
Protocol
يلتزم بروتوكول البحث بأعلى معايير رعاية ويتوافق بدقة مع إرشادات رعاية في مستشفى الجامعة RWTH Aachen. نحن ملتزمون بضمان المعاملة الأخلاقية والإنسانية لجميع المشاركة في الدراسات ، ويتم مراجعة الإجراءات والموافقة عليها من قبل لجنة أخلاقيات المحلية. تمت الموافقة على جميع التجارب على من قبل سلطة ألمانية مختصة (Landesamt für Natur، Umwelt und Verbraucherschutz Nordrhein-Westfalen، LANUV) للامتثال لقانون حماية ، جنبا إلى جنب مع اللائحة الخاصة بحماية المستخدمة في الأغراض التجريبية وغيرها من الأغراض العلمية.
ملاحظة: يتم توفير قائمة كاملة بالمعدات والمواد والكواشف المستخدمة في جميع أنحاء هذه الدراسة في جدول المواد. من المهم ملاحظة أن التعامل مع 68Ga يجب أن يتم بواسطة الماصة كلما أمكن ذلك وبالتأكيد تجنب أي معدن ، حيث يمكن للحديد أن يقلل بشكل كبير من إنتاجية الملصقات. هذا يعني أنه يجب تجنب الإبر حتى تكتمل إجراءات الكيمياء الإشعاعية.
1. الكيمياء الإشعاعية
- وضع العلامات الراديوية ل NM-02-DOTA-GA مع 68Ga
تنبيه: يتضمن البروتوكول التعامل مع المواد المشعة والتلاعب بها. يجب على الباحثين اتباع التشريعات المحلية بشأن التعامل مع المواد المشعة ، وممارسات ALARA (بأقل قدر ممكن من التحقيق) ، والعمل مع حماية الرصاص ، وتقليل وقت الاتصال المباشر ، والحفاظ على أقصى مسافة في كل خطوة من خطوات التعرض للإشعاع. يجب مراقبة الإجراءات التجريبية باستخدام أجهزة الكشف عن النشاط الإشعاعي.- قم بإزالة 68Ge / 68Ga-Generator يدويا أو تلقائيا في 10 مل من 0.6 M HCL (1.2 جيجابايت / 10 مل). قم بفخ 68Ga على خرطوشة PS-H+ (الحجم M - 0.8 مل) عن طريق تمرير الشطف عبر الخرطوشة. قم بإزالة خرطوشة PS-H + SPE بإجمالي 1 مل من 4 M كلوريد الصوديوم تدريجيا وببطء في أنبوب الطرد المركزي الدقيق.
- تخلص من أول 0.3 مل من الشطف واجمع الباقي 0.7 مل في أنبوب طرد مركزي دقيق آخر.
- خذ أنبوبا جديدا لأجهزة الطرد المركزي الدقيقة واستمر في وضع العلامات الراديوية ل NM-02-DOTA-GA كما هو مذكور في بروتوكول الشركة المصنعة.
ملاحظة: تم إعداد مترافق الجسم النانوي المخلب (NM-02-DOTA-GA) مسبقا وفقا لبروتوكول المورد. يمكن تخزين المترافق في حصص عند -80 درجة مئوية لعدة أشهر. - اضبط درجة الحموضة للمنتج على حوالي 7 باستخدام ما يصل إلى 5 ميكرولتر من 3 M NH4OAc.
- مراقبة الجودة
- قم بقياس نشاط العينة المركزة في أنبوب الطرد المركزي الدقيق باستخدام مقياس النشاط في الإعداد الصحيح (68Ga كنظير ؛ 1 مل حقنة ، 0.1 مل للهندسة). يجب أن يكون العائد الكيميائي الإشعاعي (المصحح بالتسلل) 40٪ على الأقل.
- حدد الأس الهيدروجيني باستخدام شريط اختبار الأس الهيدروجيني (0-14) عن طريق اكتشاف كمية كافية على شريط اختبار الأس الهيدروجيني (10-15 ميكرولتر).
- كروماتوغرافيا الطبقة الرقيقة (TLC)
- ضع 1 ميكرولتر من خليط تفاعل الملصقات الراديوية على شريط TLC مشرب بالسيليكا. اترك اللقب يجف لمدة 1 دقيقة. قم بتشغيل TLC باستخدام حامض الستريك كمرحلة متحركة ، مملوءة مسبقا لحوالي 2-3 مم ، في غرفة TLC مغلقة. قم بإزالة شريط TLC من الغرفة عندما يصل السائل إلى الجزء العلوي من الشريط.
- ضع شريط TLC على ماسح ضوئي راديوي TLC وقم بقياسه وفقا لبروتوكول الشركة المصنعة. يجب أن يظهر المنتج في الأصل (Rf < 0.2) ، بينما ستعمل كاتيونات 68Ga الحرة مع مقدمة المذيب (Rf > 0.9).
- احسب إنتاجية الوسم الإشعاعي للتفاعل باستخدام الكروماتوجرام الراديوي ، واقسم المساحة المتكاملة تحت المنحنى (AUC) من Rf 0.0-0.2 على إجمالي AUC (Rf 0.0-1.0) ، واضرب في 100.
- كروماتوغرافيا سائلة عالية الأداء (HPLC)
- تأكد من تشغيل HPLC لمدة 10 دقائق على الأقل باستخدام المذيب الصحيح من أجل غمر جميع الخطوط وضبط إعداد القياس. استخدم التدفق المتساوي لخليط 50:50 من الأسيتونيتريل (المذيب أ) وخليط من محلول كلوريد الصوديوم 0.9٪ (980 مل) جنبا إلى جنب مع حمض ثلاثي فلور أسيتيك (1 مل) ومحلول السترات (20 مل) كمذيب ب. قم بقياس امتصاص الأشعة فوق البنفسجية عند 280 نانومتر.
- خذ 5 ميكرولتر من المنتج وقم بتخفيفه ب 15 ميكرولتر من 0.9٪ كلوريد الصوديوم. حقن 15 ميكرولتر من الخليط في الراديو-HPLC التحليلي (عمود 5 ميكرومتر SEC-s2000 154 Å؛ معدل التدفق: 2 مل / دقيقة).
- استخدم التدفق المتساوي لخليط 50:50 من الأسيتونيتريل (المذيب أ) وخليط من محلول كلوريد الصوديوم 0.9٪ (980 مل) جنبا إلى جنب مع حمض ثلاثي فلور أسيتيك (1 مل) ومحلول السترات (20 مل) كمذيب ب. قم بقياس امتصاص الأشعة فوق البنفسجية عند 280 نانومتر. هناك تحول طفيف في أوقات الاحتفاظ بين قنوات الأشعة فوق البنفسجية وجاما. ويرجع ذلك إلى تصميم HPLC (يتم تثبيت إشارة جاما في سلسلة بعد كاشف الأشعة فوق البنفسجية).
- تحديد النقاء الكيميائي الإشعاعي عن طريق دمج القمم في قناة جاما. يجب أن يكون المنتج في نطاق التكامل الذي تم تحديده سابقا عن طريق قياس الجسم النانوي غير المصنف بالإشعاع. بالإضافة إلى ذلك ، قم بدمج جميع القمم الأخرى في قناة جاما وتقييمها على أنها شوائب. يجب أن تكون النقاء >95٪.
- السموم الداخلية
- قم بإعداد تخفيف 1:20 للمنتج بحجم إجمالي 150 ميكرولتر باستخدام ماء خال من السموم الداخلية (معتمد) للتخفيف.
- أدخل خرطوشة السموم الداخلية التي تستخدم لمرة واحدة ، والتي يتم تعبئتها تجاريا بجميع الكواشف اللازمة ، في قارئ اختبار السموم الداخلية وقم بتحميل 25 ميكرولتر من المنتج المخفف في كل غرفة خرطوشة.
- اضغط على تشغيل. لدى PTS ضوابط داخلية إيجابية وسلبية وسيتم تضمينها في التقرير النهائي. يستغرق الاختبار حوالي 15 دقيقة. يعتبر المنتج خاليا من السموم الداخلية إذا كان محتوى السموم الداخلية < 8.7 EU/مل عند Vكحد أقصى = 20 مل.
- العقم بأثر رجعي
- بعد الحقن وجمع عينة الجودة ، قم بتخزين المستحضرات الصيدلانية المشعة في قارورة معقمة في الثلاجة عند 4 درجات مئوية.
- تسليم العينة إلى معهد معتمد لتحليل العقم (سواء داخل الشركة أو شركة خارجية) إذا لم يتم تجاوز حد الإعفاء البالغ 10أو 5 بيكريل أو 10 بيكريل / جم من أجل إجراء اختبار العقم وفقاللمواصفة 12.
- تحضير الحقنة (واحدة لكل)
- قم بقياس نشاط المنتج باستخدام مقياس النشاط في الإعداد الصحيح (68Ga كنظير ؛ 1 مل حقنة ، 0.1 مل للهندسة).
- خذ 15 ميجابايت من المنتج (حوالي 25 ميكرولتر) في أنبوب طرد مركزي دقيق واملأ الحجم بنسبة 0.9٪ كلوريد الصوديوم إلى 75 ميكرولتر.
- أضف 50 ميكرولتر إلى المحقنة وقم بقياسها باستخدام مقياس النشاط في الإعداد الصحيح (68Ga كنظير ؛ 1 مل حقنة ، 0.1 مل للهندسة). يجب أن تحتوي المحقنة على 10 ميجابايت من المنتج.
ملاحظة: بمجرد تكوين الجسم النانوي NM-02 الذي يحمل علامة 68Ga، لم تعد أطراف الماصة البلاستيكية ضرورية عند التعامل مع 68Ga. من الآن فصاعدا ، عندما يذكر البروتوكول التعامل مع سائل ، استخدم حقنة مناسبة (1 مل) وإبرة (27-30 جم).
2. توليد نموذج
- إسكان
- استخدم الفئران الأنثوية التي تعاني من نقص المناعة Rj: ATHYM-Foxn1nu / nu في عمر 6-8 أسابيع (من مورد تجاري) لتطوير الأورام تحت الجلد. عند الوصول ، قم بإيواء جميع الفئران مباشرة في غرفة وأعط أسبوعا واحدا على الأقل بعد النقل للتأقلم.
- قم بإسكان تحت دورة ضوء 12 ساعة / 12 ساعة في الظلام ووفر حرية الوصول إلى الطعام والماء. حافظ على درجة حرارة الغرفة والرطوبة النسبية بين 20-25 درجة مئوية و 45٪ -65٪ على التوالي.
- تحضير الخلايا للزرع
- ابدأ زراعة الخلايا ب 1 × 106 خلايا SKOV-3 وأضف 25 مل من وسائط DMEM/F12 المسخنة مسبقا المخصبة بنسبة 10٪ FBS و 1٪ بنسلين / ستربتومايسين في قارورة زراعة الخلايا T175.
- قم بزراعة الخلايا في حاضنة عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 واستبدل الوسط الكامل مرتين على الأقل في الأسبوع.
- في أسبوع واحد أو ، قبل يوم واحد على الأكثر من زرع الخلية ، خذ 20 ميكرولتر من الوسط من قارورة زراعة الخلية لاختبار الميكوبلازما13. استخدم فقط الخلايا السالبة للميكوبلازما لحقن الخلايا.
- في يوم حقن الخلية ، قم بشفط الوسط الكامل والماصة 5 مل من PBS في الزجاجة. حرك الزجاجة ذهابا وإيابا عدة مرات لغسل الوسط المتبقي.
- أضف 3 مل من التربسين إلى القارورة واحتضنها لمدة 4 دقائق في الحاضنة عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لفصل الخلايا. تحقق تحت المجهر بتكبير 40x إذا كانت الخلايا منفصلة عن قارورة زراعة الخلية.
- أضف 7 مل من الوسط لتحييد نشاط التربسين ونقل تعليق الخلية إلى أنبوب طرد مركزي سعة 50 مل.
- الطرد المركزي للخلايا عند 150 × جم لمدة 5 دقائق (في درجة حرارة الغرفة) للحصول على حبيبات الخلية. قم بإزالة المادة الطافية وأضف 1 مل من الوسط لإعادة تعليق الخلايا.
- خذ 12 ميكرولتر من معلق الخلية في أنبوب طرد مركزي دقيق وأضف كمية متساوية من التريبان الأزرق. قم بتحميل غرفة مقياس الدم ب 10 ميكرولتر من تعليق الخلية المختلط بعناية.
- عد الخلايا غير الملوثة والقابلة للحياة داخل المنطقة المحددة واحسب رقم الخلية. اضبط تركيز الخلية على 5 × 107 خلايا / مل وسائط واخلط تعليق الخلية بعناية مع 1 مل من مصفوفة الغشاء القاعدي.
- خذ 5 × 106 خلايا في 0.2 مل من وسائط الخلية مع مصفوفة غشاء القاعدي بنسبة 50٪ في حقنة الأنسولين سعة 1 مل لكل فأر. احتفظ بالمحقنة على الثلج حتى الحقن لمنع تصلب مصفوفة الغشاء القاعدي.
ملاحظة: إذا كان وزن الفأر أقل من 20 جراما ، فقم بحقن 150 ميكرولتر فقط (لكل 15-20 جم) أو 100 ميكرولتر (لكل 10-15 جم) من الخليط. بالنسبة للتطبيقات تحت الجلد ، يتم توخي الحذر لضمان عدم تجاوز الحد الأقصى لحجم الجسم البالغ 10 مل / كجم من وزن الجسم الموصى به من قبل GV-SOLAS14.
- التلقيح والمتابعة
- حقن معلق الخلية تحت الجلد في جناح المستيقظ عن طريق تثبيت الرقبة والذيل بيد واحدة. عادة ، نفضل الحقن في الجناح الأيسر.
- انتظر لمدة 10-15 ثانية حتى تصلب مصفوفة الغشاء القاعدي ، ثم قم بإزالة الإبرة.
- راقب نمو الورم يوميا بعد الزرع باستخدام الفرجار الرقمي لقياس محورين عموديا للورم.
- باستخدام هذه القياسات ، قم بتقييم نمو الورم باستخدام حجم الورم المحسوب بواسطة الصيغة:
VT = L × B2 × π / 6
حيث VT هو حجم الورم بالملم3 ، L هو طول الورم بالملم (أي أكبر محورين عموديين) ، و B هو عرض الورم بالملم (أي أصغر محورين متعامدين15). تميل هذه التقنية إلى المبالغة في تقدير حجم الورم لأنها تشمل الجلد أيضا. - تؤثر كتلة الورم على وزن الفأر عند قياسها على المقياس الإلكتروني. لحساب وزن المصحح لكتلة الورم ، استخدم الصيغة التالية:
مالماوس T = مماوس - 0.82 × VT
حيث mmouse T هو وزن الفأر باستثناء كتلة الورم في g ، mmouse هو وزن الماوس وفقا للمقياس الإلكتروني في g و V T هو حجم الورم المحسوب بالملم3. ينتج الرقم 0.82 جم / مم3 عن متوسط قيمة سلسلة من الأورام المعزولة من التجارب السابقة على ، ووزنها وتحديد حجمها باستخدام الصيغة المعطاة. يمثل متوسط كثافة الورم. - بالإضافة إلى ذلك ، حدد حجم الورم مقارنة بالفأر وراقب عبء الورم باستخدام الصيغة التالية:
عبء الورم [٪] = (0.82 × فولتطن) / مفأر × 100
حيث يتم التعبير عن عبء الورم كنسبة مئوية ، فإن 0.82 × VT يتوافق مع كتلة الورم في g (على سبيل المثال ، VT ، حجم الورم المحسوب بالملم3 ، مضروبا في متوسط كثافة الورم) ، و mmouse هو وزن الفأر وفقا للمقياس بالز. - عندما تصل إلى حجم ورم يزيد عن 200 مم3 ، حدد موعدا لها لإجراء التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب أو التصوير المقطعي المحوسب / التصوير المقطعي المحوسب غير الغازي ، اعتمادا على التجربة.
3. التصوير
- تحضير الحقنة (نظام حسب الطلب)
ملاحظة: ذيل الماوس صغير. لذلك ، يلزم استخدام قنية 27G أو أصغر (الأعداد الأكبر تتوافق مع الإبر الأصغر). في حالة إناث الفئران ، فإن الأوردة الوحيدة التي يمكن الوصول إليها لحقن البلعة هي أوردة الذيل الثلاثة. من الناحية التشريحية ، يكون وريد الذيل الظهري أقرب إلى العمود الفقري مقارنة بالوردين الجانبيين. لا تحقن في هذا الوريد لتجنب خدش العظام علاجي المنشأ. بناء على الخبرة ، يوفر استخدام قنية 30G أفضل النتائج حيث يمكن أيضا الوصول إلى الأوردة الأصغر. نظرا لأن قسطرة 30G غير متوفرة للشراء ، يجب أن يتم صنع هذا النوع بعناية من قبل الباحث.- قم بإعداد المحقنة باستخدام المتتبع المشع اعتمادا على المسار المخطط للإعطاء بالنسبة للحقن في الوريد ، تأكد من إعطاء حجم أقصى يبلغ 5 مل / كجم من وزن الجسم لفأر 25 جم ؛ هذا يعني أن الحد الأقصى للحجم المحقون يبلغ 125 ميكرولتر.
- لتحضير قسطرة 30G ، أولا ، استخدم أي إبرة 30G وقم بإزالة عمود الإبرة المعدني ، إما بمقص معدني أو عن طريق ثنيه بعيدا عن البلاستيك.
- أدخل يدويا أنبوب PE10 بقطر 0.3 مم في جزء العمود الذي تمت إزالته من المحور. يجب توخي الحذر لتجنب ثقب الأنبوب.
ملاحظة: يمكن أيضا استخدام أنواع أخرى من البلاستيك ؛ ومع ذلك ، يوفر PE10 أفضل توازن بين صلابة الجدار والمرونة.
- الحقن في الوريد
ملاحظة: يمكن أيضا إجراء الحقن الوريدي في المستيقظة. ومع ذلك ، إذا لم يكن ذلك مطلوبا ، فيجب حقن تحت تخدير الأيزوفلوران لتقليل العبء على البحث.- املأ قسطرة 30G بمخزن مؤقت كلوريد الصوديوم بنسبة 0.9٪ أو أي مخزن مؤقت آخر مرغوب فيه.
- ضع الفأر في غرفة الحث واملأه باستمرار بمزيج من الأكسجين (أو الهواء المضغوط من الدرجة الطبية) والأيزوفلوران الغازي حتى يفقد منعكس التصحيح. للحث ، استخدم 3.5٪ -5٪ إيزوفلوران مع تدفق الأكسجين أو الهواء 0.8 لتر / دقيقة.
- ضع الفأر المخدر على الفور في وضع بطني أولي على حصيرة تسخين (37-38 درجة مئوية) مع الاستمرار في الحفاظ على تخدير الأيزوفلوران من خلال مخروط الأنف. افحص الفئران بشكل متكرر بحثا عن علامات ارتفاع درجة الحرارة (على سبيل المثال ، التمدد المفرط ، التنفس السريع ، احمرار الجلد). للحفاظ على التخدير ، استخدم 1.8٪ -2.5٪ إيزوفلوران مع تدفق الأكسجين أو الهواء 0.8 لتر / دقيقة.
- ضع مرهما للعيون على عيون لمنع الجفاف أثناء التخدير. افحص كل من أوردة الذيل الجانبية واختر أفضلها للحقن. يجب أن تؤخذ رؤية الوريد وقطره في الاعتبار. للحصول على أفضل النتائج ، قم بتدوير الذيل قليلا بحيث يتلامس الوريد المحدد مع حصيرة التسخين واترك الوريد يتمدد لمدة 1 دقيقة.
- أدر الماوس بالكامل إلى الوضع الجانبي بحيث يأتي الوريد المحدد لأعلى. ثبت طرف وقاعدة الذيل بشريط لاصق.
- خذ قسطرة 30G باليد المهيمنة وضع إصبع السبابة لليد غير المهيمنة برفق على الوريد المحددة لإنشاء نسخة احتياطية من الدم بالداخل. في موقع النسخة الاحتياطية ، سوف يتمدد الوريد ، ويشكل سنام صغير.
- باليد المهيمنة ، ضع قسطرة 30G موازية للذيل المواجه للسنام على الوريد. حرك اليد المهيمنة للأمام. في معظم الأحيان ، تضمن هذه التقنية بزل الوريد المباشر.
- بمجرد دخول الوريد ، يصبح ارتجاع الدم مرئيا في الأنبوب البلاستيكي. قم بتثبيت الأنبوب البلاستيكي للتأكد من أن الإبرة لن تتحرك داخل الوريد أثناء الحقن. في الطرف الحر من الأنبوب ، أدخل حقنة التتبع المتصلة بإبرة 30G.
ملاحظة: عندما يحتاج التوزيع الديناميكي لجهاز التتبع إلى التقييم، يجب تنفيذ النقاط التالية بعد وضع على سرير الماسح الضوئي PET وبدء تشغيل PET. - حقن محتوى حقنة التتبع ببطء لمدة 10 ثوان على الأقل. مع الحفاظ على إبرة 30G لا تزال متصلة بنظام القسطرة 30G ، قم بإزالة حقنة التتبع فقط وقم بتوصيل حقنة بمخزن كلوريد الصوديوم بنسبة 0.9٪ (أو أي مخزن مؤقت آخر مرغوب فيه) لشطف القسطرة. راقب التنفس بشكل مستمر أثناء إجراء الحقن واضبط تركيز الأيزوفلوران للحفاظ على ما يقرب من 1 نفس في الثانية.
- قم بإزالة القسطرة 30G من وريد الذيل واستخدم كمادات قطنية معقمة لوقف النزيف.
- لقياس النشاط المتبقي ، قم بقياس قسطرة 30G ، والحقنة العازلة ، وحقنة التتبع الفارغة ، وضغط القطن ، حيث تحتوي جميعها على كميات صغيرة من المقتفي التي لم تصل إلى.
- اكتساب PET / CT
ملاحظة: بالنسبة إلى 68جسم نانوي مسمى Ga NM-02 ، يتم تصوير جميع بنظام PET / CT للحيوانات الصغيرة.- اقتناء PET
- ضع الفأر المخدر في وضع بطني على فراش وقم بتوصيله بالماسح الضوئي PET. قم بتبديل تدفق الأيزوفلوران إلى مخروط الأنف على PET واحتفظ به عند 1.5٪ -2.5٪ إيزوفلوران في الهواء الطبي عند 0.8 لتر / دقيقة بحيث يتراوح معدل تنفس أثناء الفحص بين 75 و 50 تنفس في الدقيقة.
- ثبت الماوس خلف رقبته على فراش بشريط طبي. إذا لزم الأمر ، ضع مرهما للعيون مرة أخرى على عيون الفأر لمنع الجفاف أثناء التخدير.
- قم بتشغيل وسادة التدفئة في فراش إلى حوالي 80٪ من الطاقة ، أي ما يعادل حوالي 30 درجة مئوية.
- اضبط وقت الاستحواذ على 45 دقيقة وحدد منطقة الاهتمام التي سيتم مسحها ضوئيا. حدد 68Ga كنظير الدراسة وابدأ الفحص. أدخل مقدار النشاط المحقون ووقت الحقن ووقت قياس المحقنة الفارغة. يبلغ وضع سرير PET الواحد 160 مم ، وهو طويل بما يكفي لفحص الماوس لكامل الجسم.
- عندما يحتاج التوزيع الديناميكي للمتتبع إلى التقييم، ابدأ أولا فحص التصوير المقطعي بالإصدار البوزيتروني، وانتظر 30 ثانية للاستحواذ، ثم تابع الخطوات 3.2.9-3.2.10. اترك القسطرة في الفأرة مع توصيل المحقنة العازلة لتجنب المزيد من فقدان الدم. قد يتم فصل القسطرة في نهاية التصوير المقطعي بالإصدار البوزيتروني ، قبل الحصول على التصوير المقطعي المحوسب لتجنب القطع الأثرية.
- اقتناء CT
- افصل فراش عن الماسح الضوئي PET وقم بتوصيله على الفور بالماسح الضوئي المقطعي المحوسب. إذا لزم الأمر ، افصل القنية أيضا عن وريد الذيل. بعد 30 دقيقة على الأقل بعد بزل الوريد ، يكون موقع الحقن متخثرا بالفعل ، لذلك لن يحدث المزيد من النزيف.
- قم بتبديل تدفق الأيزوفلوران إلى مخروط الأنف في ماسح التصوير المقطعي المحوسب.
- حدد نفس منطقة الاهتمام المراد مسحها ضوئيا لتصوير التصوير المقطعي بالإصدار البوزيتروني. حدد بروتوكول الاستحواذ القياسي: 440 ميكرو أمبير ، 50 كيلو فولت في الثانية ، وقت تعريض 32 مللي ثانية ، ودوران 1080 درجة في الوضع الحلزوني مع 960 تعريضا / 360 درجة ؛ مدة الفحص المقطعي المحوسب حوالي 7 دقائق لفحص الماوس لكامل الجسم.
- تحكم في معدل التنفس وقم بتشغيل وسادة التدفئة في فراش. راقب التنفس باستمرار أثناء الفحص واضبط تركيز الأيزوفلوران للحفاظ على معدل التنفس بين 75 و 50 نفسا في الدقيقة.
- اقتناء PET
4. رعاية بعد التصوير
- في نهاية عمليات المسح ، يحتاج إلى 15 دقيقة على الأقل للاستيقاظ. لتجنب عدوان زميله ، ضع بمفرده لمدة 15 دقيقة أو حتى يتمكن من المشي بمفرده حتى يعيده إلى قفص السكن الأصلي. خلال هذا الوقت ، استخدم ضوء الأشعة تحت الحمراء لتجنب انخفاض حرارة الجسم.
- في البداية ، ضع على جانبه الأيسر (الوضع الآمن) لتجنب حدوث صدمة ديناميكية للدم. دع مرهم العين يبقى ، حيث سيتم إزالته من قبل نفسه بمجرد استيقاظه.
5. إعادة بناء التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب
- قم بإجراء إعادة بناء PET باستخدام تعظيم توقعات المجموعة الفرعية المرتبة ثلاثية الأبعاد (على سبيل المثال ، OSEM-3D مع 30 تكرارا) مع نافذة طاقة تبلغ ± 15٪ من ذروة 511 كيلو فولت إلى حجم فوكسل متساوي القياس يبلغ 0.4 مم في مصفوفة 192 × 192 × 384. قم بتطبيق التصحيحات المستندة إلى التصوير المقطعي المحوسب (مثل تصحيح التوهين ، وتصحيح التشتت ، والوقت الميت ، والأحداث العشوائية) على إعادة بناء التصوير المبثوني بالإصدار البوزيتروني.
- في حالة الحاجة إلى تقييم التوزيع الديناميكي للمتتبع ، قم بتطبيق إعادة بناء متعددة الإطارات. على سبيل المثال، يمكن استخدام الإطارات التالية لمسح ضوئي لمدة 45 دقيقة: 4 × 30 ثانية، 3 × 1 دقيقة، 5 × 2 دقيقة، 2 × 5 دقائق، 2 × 10 دقائق.
- إعادة بناء بروتوكولات الاستحواذ القياسية CT باستخدام خوارزمية إعادة البناء التكرارية (أي ISRA) عملية إعادة البناء إلى حجم فوكسل متساوي القياس يبلغ 0.2 مم في مصفوفة 200 × 200 × 425. باستخدام برنامج البائع ، قم بتحويل قيم CT إلى وحدات Hounsfield (HU) باستخدام الصيغة:
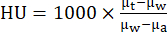
حيث μw هو معامل التوهين الخطي للماء ، μa هو معامل التوهين الخطي للهواء و μt هو معامل التوهين الخطي للأنسجة. - تمت محاذاة صور التصوير المقطعي بالإصدار البوزيتروني والتصوير المقطعي المحوسب تلقائيا بعد إعادة البناء باستخدام المصفوفة التي تم إنشاؤها من المسح الوهمي الشعري. أرشفة جميع البيانات المعاد بناؤها وكذلك نقلها إلى خادم قاعدة البيانات باستخدام برنامج تحليل الصور حسب الحاجة.
6. معالجة الصور وتحليلها
ملاحظة: تستخدم صور التصوير المقطعي بالإصدار البوزيتروني/التصوير المقطعي المحوسب المسجلة بشكل مشترك أيضا للقياس الكمي داخل خادم قاعدة البيانات لبرنامج تحليل الصور، حيث يتم حفظ كل مسح هجين كموضوع.
- حدد الورم بناء على التصوير المقطعي المحوسب وحدد هذا كمنطقة الاهتمام. قم بإخفاء قاعدة الورم يدويا على التصوير المقطعي المحوسب.
- لتحقيق تجزئة مستقلة للمستخدم ، قم بتحديد عتبة قناع الورم المشكل حديثا على PET أو SPECT. بالنسبة للإي بيزترونيتال ، استخدم حدا أدنى يبلغ 1.0 قيمة امتصاص قياسية (SUV). بالنسبة لاختبار الفيض الجانبي ، استخدم حدا أدنى أعلى من متوسط امتصاص تجمع الدم كما تم قياسه في القلب أو الشريان الأورطي البطني النهائي.
- سجل المتوسط والحد الأقصى ومتوسط أكثر 10 فوكسل سخونة (أي المتوسط الساخن 10) والامتصاص الكلي للأحجام التي تم إنشاؤها حديثا ذات الاهتمام.
- استخدم هذه القيم لإنشاء قيم SUV وقيم الهدف إلى الخلفية (TBR) ، والتي سيتم استخدامها بشكل أكبر للتحليل الإحصائي.
Access restricted. Please log in or start a trial to view this content.
النتائج
أحد أهم جوانب مراقبة جودة المستحضرات الصيدلانية المشعة هو عن طريق HPLC ، حيث لا يظهر هذا النقاء الكيميائي والكيميائي الإشعاعي (98.2٪ في هذه الحالة) فحسب ، بل يسمح أيضا بإثبات هوية المستحضرات الصيدلانية المشعة من خلال مقارنة وقت الشطف وشكل الذروة بمركب مرجعي غير مشع. هذا المر...
Access restricted. Please log in or start a trial to view this content.
Discussion
التخليق الإشعاعي
يعد التخليق الإشعاعي الموصوف هنا نموذجيا لمركب جديد يسمى 68Ga - وقت توليف قصير ، مع التركيز على درجة الحموضة المناسبة وتجنب المعادن كلما أمكن ذلك. لهذا ، من المهم اتباع الترتيب الذي تتم به إضافة المكونات بدقة. على أي حال ، يجب أولا تعديل قي?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
FMM هو مستشار طبي لشركة NanoMab Technology Ltd. و Advanced Accelerator Applications (AAA) GmbH. وقد حصل مؤخرا على منح مؤسسية من NanoMab Technology Ltd. و Siemens و GE Precision Healthcare LLC. علاوة على ذلك ، لديه عقد بحث تدخلي مع CURIUM.
Acknowledgements
يعرب المؤلفون عن امتنانهم لسوزان أليكوت على دعمها الفني.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Activity meter ISOMED 2010 | Nuviatech Healthcare | - | |
| Centrifuge MIKRO 185 | Andreas Hettich GmbH & Co. KG | 1203 | |
| Endotoxin testing Endosafe nexgen-PTS | Charles River | - | |
| Heating block NANOCOLOR VARIO C2 | Macherey-Nagel | 919350 | |
| HPLC system, including radio detector | Knauer & Raytest | - | |
| Image analysis software Pmod 4.4 | PMOD Technologies LLC | - | |
| Small animal PET/CT system β-CUBE and X-CUBE | Molecubes NV | - | |
| TLC MiniGITA* | Elysia-Raytest | - | |
| Materials | |||
| 0.3 mm diameter PE10 tube | fisher scientific | 22-204008 | |
| 30G needle | B|Braun | 4656300 | |
| Centrifugal filter; 10 kDa MWCO, 0.5 mL | Millipore | UFC501008 | |
| Chromatography paper strip iTLC-SG | Agilent Technologies | SGI0001 | |
| Endotoxin Cartridge, 0.05 EU/ml sensitivity | Charles River | PTS-2005 | |
| HPLC Column Biosep SEC-s2000 | Phenomenex | - | |
| Microcentrifuge tube (1.5 mL) | Eppendorf | 0030125150 | |
| pH strip 0.0 - 6.0 | Merck KGaA | 109531 | |
| pH strip 0-14 | Merck KGaA | 109535 | |
| PS-H+ SPE cartridge | Macherey Nagel GmbH & Co. KG | 731861 | |
| Sterile vial 10 mL | ALK Life Science Solutions | SEV100 | |
| Reagents | |||
| 68Ge/68Ga-Generator | NRF-iThembaLABS | - | |
| Ammoniumacetate | Merck KGaA | 101116 | |
| Citric acid | Merck KGaA | 100241 | |
| Hydrochloric acid | Merck KGaA | 320331 | |
| NaCl | Merck KGaA | S9888 | |
| Nanobody NM-02 | Radiopharm Theranostics | - | |
| P-SCN-Bz-DOTA-GA | CheMatech | C115 | |
| Trifluoracetic acid | Merck KGaA | T6508 | |
| Ultrapure water | Merck KGaA | 101262 |
References
- American Cancer Society. Cancer facts & figures 2024. , https://www.cancer.org/research/cancer-facts-statistics/all-cancer-facts-figures/2024-cancer-facts-figures.html (2024).
- Cancer Research UK. Ovarian cancer survival. , https://www.cancerresearchuk.org/about-cancer/ovarian-cancer/survival (2021).
- Siegel, R. L., Giaquinto, A. N., Jemal, A. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Altunay, B., et al. Her2-directed antibodies, affibodies and nanobodies as drug-delivery vehicles in breast cancer with a specific focus on radioimmunotherapy and radioimmunoimaging. Eur J Nucl Med Mol Imaging. 48 (5), 1371-1389 (2021).
- Altunay, B., Morgenroth, A., Mottaghy, F. M. Use of radionuclide-based imaging methods in breast cancer. Semin Nucl Med. 52 (5), 561-573 (2022).
- Mcgale, J., et al. Pet/ct and spect/ct imaging of her2-positive breast cancer. J Clin Med. 12 (15), 4882(2023).
- Zhang-Yin, J. State of the art in 2022 pet/ct in breast cancer: A review. J Clin Med. 12 (3), 968(2023).
- USFD Administration. Pet drug products - current good manufacturing practice (cgmp). , https://www.fda.gov/regulatory-information/search-fda-guidance-documents/pet-drug-products-current-good-manufacturing-practice-cgmp (2018).
- Official Journal of the European Union, L238. 60, https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=OJ:L:2017:238:TOC (2017).
- Korde, A., et al. Position paper to facilitate patient access to radiopharmaceuticals: Considerations for a suitable pharmaceutical regulatory framework. EJNMMI Radiopharm Chem. 9 (1), 2(2024).
- Korde, A., et al. Practical considerations for navigating the regulatory landscape of non-clinical studies for clinical translation of radiopharmaceuticals. EJNMMI Radiopharm Chem. 7 (1), 18(2022).
- European Pharmacopeia. , (2023).
- Volokhov, D. V., Graham, L. J., Brorson, K. A., Chizhikov, V. E. Mycoplasma testing of cell substrates and biologics: Review of alternative non-microbiological techniques. Mol Cell Probes. 25 (2-3), 69-77 (2011).
- Dülsner, A., et al. Technical information from the Committee for Animal Welfare Officers (GV-SOLAS) and Working Group 4 in the TVT Recommendation on substance administration to laboratory animals. GV-SOLAS. , (2017).
- derived xenograft (pdx) protocols at the jackson laboratory. , Available from: https://tumor.informatics.jax.org/mtbwi/live/www/html/SOCHelp.html (2020).
- Velikyan, I. 68ga-based radiopharmaceuticals: Production and application relationship. Molecules. 20 (7), 12913-12943 (2015).
- Percie Du Sert, N., et al. Reporting animal research: Explanation and elaboration for the arrive guidelines 2.0. PLoS Biol. 18 (7), e3000411(2020).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. A., Brattelid, T. Prepare: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Landesamt Für Natur UUVN. Tierversuche. , https://www.lanuv.nrw.de/verbraucherschutz/tierversuche (2024).
- Herrmann, D., et al. Statistical controversies in clinical research: Publication bias evaluations are not routinely conducted in clinical oncology systematic reviews. Ann Oncol. 28 (5), 931-937 (2017).
- Johnsen, E., et al. A critical evaluation of amicon ultra centrifugal filters for separating proteins, drugs and nanoparticles in biosamples. J Pharm Biomed Anal. 120, 106-111 (2016).
- TVT-Veröffentlichungen zum Download. , Society for Laboratory Animal Science (GV-SOLAS). Available from: https://www.tierschutz-tvt.de/alle-merkblaetter-und-stellungnahmen/ (2024).
- Bedard, P. L., Hansen, A. R., Ratain, M. J., Siu, L. L. Tumour heterogeneity in the clinic. Nature. 501 (7467), 355-364 (2013).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved