È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Radiosintesi, controllo di qualità e tomografia a emissione di positroni per piccoli animali di 68nanomolecole marcate con GA
In questo articolo
Riepilogo
Questo articolo descrive la radiosintesi, la formulazione, il controllo di qualità di una nuova sonda radiomarcata (ad esempio, 68nanocorpi marcati con GA NM-02) e il suo utilizzo per l'imaging PET/CT di piccoli animali in un modello di xenotrapianto.
Abstract
Le tecniche di imaging della tomografia a emissione di positroni (PET) per piccoli animali e della tomografia computerizzata a emissione di fotoni singoli (SPECT) sono fondamentali nella ricerca preclinica sul cancro, richiedendo un'attenzione meticolosa alla sintesi dei radiotraccianti, alla garanzia della qualità e ai protocolli di iniezione in vivo . Questo studio presenta un flusso di lavoro completo su misura per migliorare la robustezza e la riproducibilità degli esperimenti PET su piccoli animali. Il processo di sintesi nel laboratorio di radiochimica utilizzando 68Ga è dettagliato, evidenziando rigorosi protocolli di controllo e garanzia della qualità per ogni produzione di radiotracciante. Parametri come la concentrazione, l'attività molare, il pH e la purezza sono rigorosamente monitorati, in linea con gli standard applicabili agli studi sull'uomo. Questa metodologia introduce una preparazione semplificata della siringa e una cannula da 30 G progettata su misura per iniezioni endovenose precise nei topi. Il monitoraggio della salute degli animali durante la scansione, compresa la temperatura e la frequenza cardiaca, garantisce il loro benessere durante tutta la procedura. I dosaggi per le scansioni PET e SPECT sono predeterminati per bilanciare l'acquisizione dei dati con la riduzione al minimo dell'esposizione alle radiazioni per animali e ricercatori. Allo stesso modo, le scansioni TC utilizzano impostazioni pre-programmate per limitare l'esposizione alle radiazioni, particolarmente pertinenti negli studi a lungo termine che valutano gli effetti del trattamento. Ottimizzando questi passaggi, il flusso di lavoro mira a standardizzare le procedure, ridurre la variabilità e migliorare la qualità dell'imaging PET/SPECT/CT di piccoli animali. Questa risorsa fornisce preziose informazioni per i ricercatori che cercano di migliorare l'accuratezza e l'affidabilità delle indagini precliniche nell'imaging molecolare, facendo progredire il campo.
Introduzione
Un argomento di estrema rilevanza è la ricerca nel campo del cancro al seno. Il cancro al seno rimane un tumore frequente, che rappresenta circa 1/3 di tutti i tumori nelle donne. Il trattamento è adattato alle caratteristiche biologiche e istologiche del tumore e allo stadio della malattia. Le possibilità di sopravvivenza sono generalmente buone a meno che il tumore non abbia già metastatizzato, nel qual caso la sopravvivenza a 5 anni è solo del 30% circa1. Altri tumori ginecologici soffrono di un destino simile, con, ad esempio, il cancro ovarico che mostra > sopravvivenza a 5 anni del 95% per i tumori in stadio 1 ma solo del 15% per i tumori metastatizzati in stadio 4 2,3.
L'imaging non invasivo, in particolare la tomografia a emissione di positroni (PET), ha trasformato la ricerca sul cancro in quanto offre intuizioni senza precedenti sugli aspetti molecolari del tumore, come il metabolismo, l'espressione dei recettori e la risposta terapeutica 4,5,6. Consente sia la visualizzazione che la quantificazione di specifiche aree metaboliche, consentendo non solo di diagnosticare con precisione, ma anche di monitorare l'effetto di (nuove) terapie in tempi molto brevi. Infatti, la PET consente di valutare la risposta rispetto alla non risposta dopo 1-3 cicli di terapia e lo fa meglio e più velocemente rispetto ai cambiamenti morfologici osservati dalla tomografia computerizzata (TC) classica7. La natura non invasiva della PET consente anche studi longitudinali.
Qualsiasi modello animale richiede la massima standardizzazione al fine di valutare a fondo la capacità terapeutica dei nuovi farmaci (radioattivi), quindi l'accento deve essere posto su questo aspetto, sia nella generazione del modello tumorale che nell'imaging/analisi dei dati PET per piccoli animali. Si potrebbe discutere sul miglior modello di tumore negli animali (inoculazione sottocutanea o impianto ortotopico, topi, tumori umani o singegenici, accompagnati o non accompagnati da cure cliniche di routine), ma ciò andrebbe oltre l'obiettivo di questa pubblicazione. Diversi modelli sono utilizzati da noi per gli studi sul cancro, e quello qui descritto è un modello sottocutaneo relativamente semplice.
Il controllo di qualità in radiochimica è fondamentale per la sicurezza degli animali e l'efficacia del trattamento. Ciò non influisce solo sul radiofarmaco stesso, ma anche sulla formulazione del prodotto. Esiste un'ampia legislazione sulla produzione di radiofarmaci per applicazioni cliniche 8,9 (vedi 10 per un'ampia panoramica della legislazione e delle linee guida attuali) e diverse linee guida sulle proprietà dei radiofarmaci per la ricerca preclinica (vedi 11 per un'ampia panoramica). Produciamo radiofarmaci sia per applicazioni cliniche che precliniche, semplificando la traduzione dal controllo di qualità di alto livello come si trova nelle sintesi per applicazioni cliniche a quelle per applicazioni precliniche.
La nostra ricerca si concentra sulla teranostica diretta, in particolare sui tumori positivi al recettore 2 del fattore di crescita epidermico umano (HER2). Pertanto, sviluppiamo nuovi radiofarmaci per diagnosticare e monitorare il cancro durante il trattamento. I radiofarmaci diagnostici di successo sono anche valutati come composti terapeutici utilizzando diversi radioisotopi. La valutazione di questi radiofarmaci viene eseguita inizialmente in modelli animali, cercando di tradurre clinicamente dopo promettenti risultati preclinici. In questo articolo, presenteremo i protocolli utilizzati, esemplificati con un radiofarmaco, per garantire il controllo e la garanzia della qualità, nonché la pratica standard per l'iniezione endovenosa nel topo e la scansione PET/TC, al fine di migliorare l'accuratezza e l'affidabilità delle indagini precliniche nell'imaging molecolare. Il protocollo è suddiviso in tre diverse sezioni: radiochimica (sintesi di traccianti e controllo di qualità), generazione di modelli animali (modello di tumore sottocutaneo) e imaging.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Il protocollo di ricerca aderisce ai più alti standard di benessere degli animali ed è in stretta conformità con le linee guida per la cura degli animali dell'ospedale universitario RWTH di Aquisgrana. Ci impegniamo a garantire il trattamento etico e umano di tutti gli animali coinvolti negli studi e le procedure sono esaminate e approvate dal comitato etico animale locale. Tutti gli esperimenti sugli animali sono stati approvati da un'autorità competente tedesca (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, LANUV) per la conformità alla legge sulla protezione degli animali, in combinazione con il regolamento per la protezione degli animali utilizzati per scopi sperimentali e altri scopi scientifici.
NOTA: Un elenco completo delle attrezzature, dei materiali e dei reagenti utilizzati durante questo studio è fornito nella Tabella dei materiali. È importante notare che la manipolazione del 68Ga deve essere effettuata con una pipetta quando possibile ed evitare certamente qualsiasi metallo, poiché il ferro può ridurre notevolmente la resa dell'etichettatura. Ciò significa che gli aghi devono essere evitati fino al completamento delle procedure radiochimiche.
1. Radiochimica
- Marcatura radiofonica di NM-02-DOTA-GA con 68Ga
ATTENZIONE: Il protocollo prevede la manipolazione e la manipolazione di materiali radioattivi. I ricercatori devono seguire la legislazione locale sulla gestione dei materiali radioattivi, le pratiche ALARA (il più basso ragionevolmente ottenibile), lavorare con la schermatura del piombo, ridurre al minimo il tempo di contatto diretto e mantenere la massima distanza in ogni fase dell'esposizione alle radiazioni. Le procedure sperimentali devono essere monitorate con dispositivi di rilevamento della radioattività.- Eluire manualmente o automaticamente il generatore di 68Ge/68Ga-Generator in 10 mL di 0,6 M HCL (1,2 GBq/10 mL). Intrappolare il 68Ga su una cartuccia PS-H+ (misura M - 0,8 mL) facendo passare l'eluato attraverso la cartuccia. Eluire la cartuccia PS-H+ SPE con un totale di 1 mL di NaCl 4 M in modo graduale e lento in una provetta da microcentrifuga.
- Scartare i primi 0,3 mL di eluato e raccogliere i restanti 0,7 mL in un'altra provetta da microcentrifuga.
- Prendi una nuova provetta per microcentrifuga e procedi con la marcatura radio di NM-02-DOTA-GA come indicato nel protocollo del produttore.
NOTA: Il coniugato nanobody-chelante (NM-02-DOTA-GA) è stato precedentemente preparato secondo il protocollo del fornitore. Il coniugato può essere conservato in aliquote a -80 °C per diversi mesi. - Regolare il pH del prodotto a circa 7 utilizzando fino a 5 μL di 3 M NH4OAc.
- Controllo qualità
- Misurare l'attività del campione concentrato nella provetta per microcentrifuga utilizzando un misuratore di attività con l'impostazione corretta (68Ga come isotopo; siringa da 1 mL, 0,1 mL per la geometria). La resa radiochimica (corretta per il decadimento) deve essere almeno del 40%.
- Determinare il pH con una striscia reattiva per pH (0-14) individuando una quantità sufficiente sulla striscia reattiva per pH (10-15 μL).
- Cromatografia su strato sottile (TLC)
- Individuare 1 μl della miscela di reazione di radiomarcatura su una striscia TLC impregnata di silice. Lasciare asciugare l'aliquota per circa 1 minuto. Eseguire la TLC utilizzando acido citrico come fase mobile, preriempita per circa 2-3 mm, in una camera TLC chiusa. Rimuovere la striscia TLC dalla camera quando il liquido ha raggiunto la parte superiore della striscia.
- Posizionare la striscia TLC su uno scanner radio-TLC e misurarla secondo il protocollo del produttore. Il prodotto dovrebbe apparire all'origine (Rf < 0,2), mentre i cationi liberi 68Ga eluiranno con il fronte del solvente (Rf > 0,9).
- Calcolare la resa di radiomarcatura della reazione utilizzando il radiocromatogramma, dividendo l'area integrata sotto la curva (AUC) da Rf 0,0-0,2 per l'AUC totale (Rf 0,0-1,0) e moltiplicando per 100.
- Cromatografia liquida ad alta prestazione (HPLC)
- Assicurarsi che l'HPLC sia stato in funzione per almeno 10 minuti utilizzando il solvente corretto in modo che tutte le linee vengano allagate e regolare l'impostazione per la misurazione. Utilizzare il flusso isocratico di una miscela 50:50 di acetonitrile (solvente A) e una miscela di soluzione di NaCl allo 0,9% (980 mL) combinata con acido trifluoracetico (1 mL) e soluzione di citrato (20 mL) come solvente B. Misurare l'assorbanza UV a 280 nm.
- Prelevare 5 μL di prodotto e diluirlo con 15 μL di NaCl allo 0,9%. Iniettare 15 μl della miscela nel radio-HPLC analitico (colonna SEC-s2000 da 5 μm a 154 Å; portata: 2 mL/min).
- Utilizzare il flusso isocratico di una miscela 50:50 di acetonitrile (solvente A) e una miscela di soluzione di NaCl allo 0,9% (980 mL) combinata con acido trifluoracetico (1 mL) e soluzione di citrato (20 mL) come solvente B. Misurare l'assorbanza UV a 280 nm. C'è un piccolo spostamento nei tempi di ritenzione tra i canali UV e gamma; ciò è dovuto al design dell'HPLC (il segnale gamma è installato in serie dopo il rivelatore UV).
- Determinare la purezza radiochimica integrando i picchi nel canale gamma. Il prodotto deve rientrare nell'intervallo di integrazione precedentemente determinato misurando il nanocorpo non radiomarcato. Inoltre, integrare tutti gli altri picchi nel canale gamma e valutarli come impurità. La purezza deve essere del >95%.
- Endotossina
- Preparare una diluizione 1:20 del prodotto con un volume totale di 150 μl utilizzando acqua (certificata) priva di endotossine per diluire.
- Inserire una cartuccia di endotossine monouso, preriempita in commercio con tutti i reagenti necessari, nel lettore di test delle endotossine e caricare 25 μl di prodotto diluito in ciascuna camera della cartuccia.
- Premi Riproduci. Il PTS ha controlli interni positivi e negativi e sarà incluso nel rapporto finale. Il test dura circa 15 minuti. Il prodotto è considerato privo di endotossine se il contenuto di endotossine è < 8,7 EU/mL a Vmax = 20 mL.
- Sterilità retroattiva
- Dopo l'iniezione e la raccolta del campione di qualità, conservare il radiofarmaco in un flaconcino sterile in frigorifero a 4 °C.
- Consegnare il campione a un istituto certificato per l'analisi della sterilità (interno o esterno) se il limite di esenzione di 10,5 Bq o 10 Bq/g non viene superato, al fine di eseguire un test di sterilità secondo12.
- Preparazione della siringa (una per animale)
- Misurare l'attività del prodotto utilizzando un misuratore di attività con l'impostazione corretta (68Ga come isotopo; siringa da 1 mL, 0,1 mL per la geometria).
- Prelevare 15 MBq di prodotto (circa 25 μL) in una provetta da microcentrifuga e riempire il volume con NaCl allo 0,9% a 75 μL.
- Aggiungere 50 μL alla siringa e misurarlo utilizzando un misuratore di attività con l'impostazione corretta (68Ga come isotopo; 1 mL di siringa, 0,1 mL per la geometria). La siringa deve contenere 10 MBq di prodotto.
NOTA: Non appena si forma il nanocorpo NM-02 marcato con 68Ga, i puntali per pipette in plastica non sono più necessari quando si maneggia il 68Ga. Da qui in poi, ogni volta che il protocollo menziona la manipolazione di un liquido, utilizzare una siringa (1 ml) e un ago (27-30 G) appropriati.
2. Generazione di modelli animali
- Stabulazione degli animali
- Utilizzare topi femmina immunodeficienti Rj: ATHYM-Foxn1nu/nu a 6-8 settimane di età (da un fornitore commerciale) per lo sviluppo di tumori sottocutanei. All'arrivo, alloggiare tutti i topi direttamente nella stanza degli animali e dare almeno 1 settimana dopo il trasporto per l'acclimatazione.
- Ospitare gli animali in un ciclo di 12 ore luce/12 ore buio e fornire libero accesso a cibo e acqua. Mantenere la temperatura ambiente e l'umidità relativa rispettivamente tra 20-25 °C e 45%-65%.
- Preparazione delle cellule per l'impianto
- Iniziare la coltura cellulare con 1 x 106 cellule SKOV-3 e aggiungere 25 mL di terreno DMEM/F12 preriscaldato arricchito con il 10% di FBS e l'1% di penicillina/streptomicina in un pallone per colture cellulari T175.
- Coltivare le cellule in un incubatore a 37 °C e 5% di CO2 e sostituire l'intero terreno almeno 2 volte a settimana.
- A 1 settimana o, al più tardi 1 giorno prima dell'impianto cellulare, prelevare 20 μL di terreno dal pallone di coltura cellulare per verificare la presenza di micoplasma13. Utilizzare solo cellule micoplasma-negative per l'iniezione cellulare.
- Il giorno dell'iniezione cellulare, aspirare l'intero terreno e pipettare 5 mL di PBS nel flacone. Agitare la bottiglia avanti e indietro più volte per lavare via il terreno rimanente.
- Aggiungere 3 mL di tripsina al pallone e incubarlo per 4 minuti nell'incubatore a 37 °C e il 5% di CO2 per dissociare le cellule. Controllare al microscopio con un ingrandimento di 40x se le cellule si sono staccate dal pallone di coltura cellulare.
- Aggiungere 7 mL di terreno per neutralizzare l'attività della tripsina e trasferire la sospensione cellulare in una provetta da centrifuga da 50 mL.
- Centrifugare le celle a 150 x g per 5 minuti (a temperatura ambiente) per ottenere un pellet di cellule. Rimuovere il surnatante e aggiungere 1 mL di terreno per risospendere le cellule.
- Prelevare 12 μl della sospensione cellulare in una provetta da microcentrifuga e aggiungere una quantità uguale di blu di tripano. Caricare la camera dell'emocitometro con 10 μl di sospensione cellulare accuratamente miscelata.
- Contare le cellule non colorate e vitali all'interno dell'area definita e calcolare il numero di cellule. Regolare la concentrazione cellulare su 5 x 107 cellule/mL di terreno e miscelare accuratamente la sospensione cellulare con 1 mL di matrice a membrana basale.
- Prelevare 5 x 106 cellule in 0,2 mL di terreno cellulare con il 50% di matrice di membrana basale in una siringa da insulina da 1 mL per ciascun topo. Tenere la siringa sul ghiaccio fino all'iniezione per evitare la solidificazione della matrice della membrana basale.
NOTA: Se un topo pesa meno di 20 g, iniettare solo 150 μl (per 15-20 g) o 100 μl (per 10-15 g) della miscela. Per le applicazioni sottocutanee, si presta attenzione a garantire che il volume massimo di 10 ml/kg di peso corporeo raccomandato dal GV-SOLAS non venga superatoa 14.
- Inoculazione e follow-up
- Iniettare la sospensione cellulare per via sottocutanea nel fianco dell'animale sveglio fissando il collo e la coda con una mano. Di solito, preferiamo le iniezioni sul fianco sinistro.
- Attendere 10-15 s affinché la matrice della membrana basale si indurisca, quindi rimuovere l'ago.
- Monitorare la crescita del tumore ogni giorno dopo l'impianto utilizzando un calibro digitale per misurare due assi tumorali perpendicolari.
- Utilizzando queste misurazioni, valutare la crescita del tumore utilizzando il volume tumorale calcolato dalla formula:
VT = L × B2 × π / 6
dove VT è il volume del tumore in mm3, L è la lunghezza del tumore in mm (cioè il più grande dei due assi perpendicolari) e B è la larghezza del tumore in mm (cioè il più piccolo dei due assi perpendicolari15). Questa tecnica tende a sovrastimare il volume del tumore in quanto include anche la pelle. - La massa tumorale influenza il peso del topo quando viene misurata sulla bilancia elettronica. Per calcolare il peso dell'animale corretto per la massa tumorale, utilizzare la seguente formula:
mmouse-T = mmouse - 0,82 × VT
dove mmouse-T è il peso del topo esclusa la massa tumorale in g, mmouse è il peso del topo secondo la scala elettronica in g e VT è il volume del tumore calcolato in mm3. Il numero 0,82 g/mm3 risulta dal valore medio di una serie di tumori isolati da precedenti esperimenti su animali, pesati e il loro volume determinato utilizzando la formula indicata. Rappresenta una densità tumorale media. - Inoltre, determina quanto è grande il tumore rispetto al topo e monitora il carico tumorale utilizzando la seguente formula:
Carico tumorale [%] = (0,82 × VT) / m× di topo 100
dove il carico tumorale è espresso in percentuale, 0,82 × VT corrisponde alla massa tumorale in g (cioè VT, il volume tumorale calcolato in mm3, moltiplicato per la densità tumorale media) e mmouse è il peso del topo secondo la scala in g. - Quando gli animali raggiungono un volume tumorale superiore a 200 mm3, programmarli per PET/CT o SPECT/CT non invasivi, a seconda dell'esperimento.
3. Imaging
- Preparazione della siringa (sistema su misura)
NOTA: La coda del topo è piccola; pertanto, è richiesto l'uso di una cannula da 27G o più piccola (numeri più grandi corrispondono ad aghi più piccoli). Nel caso di topi femmine, le uniche vene accessibili per le iniezioni in bolo sono le tre vene della coda. Anatomicamente, la vena caudale dorsale è più vicina alla colonna vertebrale rispetto alle due vene laterali; Non iniettare in questa vena per evitare graffi ossei iatrogeni. In base all'esperienza, l'utilizzo di una cannula da 30 G fornisce i migliori risultati in quanto è possibile accedere anche alle vene più piccole. Poiché i cateteri da 30 G non sono disponibili per l'acquisto, questo tipo deve essere realizzato con cura dal ricercatore.- Preparare la siringa con il tracciante radioattivo a seconda della via di somministrazione prevista. Per le iniezioni endovenose, assicurarsi che venga somministrato un volume massimo di 5 ml/kg di peso corporeo per un topo di 25 g; ciò significa un volume massimo iniettato di 125 μL.
- Per preparare un catetere da 30G, in primo luogo, utilizzare un ago da 30G e rimuovere l'asta metallica dell'ago, con forbici metalliche o piegandola lontano dalla plastica.
- Inserire manualmente un tubo in PE10 di 0,3 mm di diametro nella parte dell'albero che è stata rimossa dal mozzo. Prestare attenzione per evitare di perforare il tubo.
NOTA: Possono essere utilizzati anche altri tipi di plastica; tuttavia, il PE10 offre il miglior equilibrio tra rigidità della parete e flessibilità.
- Iniezione endovenosa
NOTA: Le iniezioni endovenose possono essere eseguite anche in animali svegli; Tuttavia, se ciò non è necessario, gli animali devono essere iniettati sotto sedazione con isoflurano per ridurre il carico sull'animale da ricerca.- Riempire il catetere 30G con tampone NaCl allo 0,9% o con qualsiasi altro tampone desiderato.
- Metti il topo in una camera di induzione e riempila continuamente con una miscela di ossigeno (o aria pressurizzata per uso medico) e isoflurano gassoso fino a quando l'animale non perde il riflesso raddrizzante. Per l'induzione, utilizzare isoflurano al 3,5%-5% con un flusso di ossigeno o aria di 0,8 L/min.
- Posizionare immediatamente il topo sedato in posizione ventrale iniziale su un tappetino riscaldante (37-38 °C) mantenendo comunque la sedazione con isoflurano attraverso un cono nasale. Controllare frequentemente i topi per segni di surriscaldamento (ad esempio, stiramento eccessivo, respirazione rapida, arrossamento della pelle). Per il mantenimento dell'anestesia, utilizzare isoflurano all'1,8%-2,5% con un flusso di ossigeno o aria di 0,8 L/min.
- Applicare un unguento oftalmico sugli occhi dell'animale per prevenire l'essiccazione durante la sedazione. Ispezionare entrambe le vene laterali della coda e selezionare quella migliore per l'iniezione. Devono essere presi in considerazione la visibilità e il diametro della vena. Per ottenere i migliori risultati, ruotare leggermente la coda in modo che la vena selezionata entri in contatto con il tappetino riscaldante e lasciare che la vena si dilata per 1 minuto.
- Ruotare l'intero mouse in posizione laterale in modo che la vena selezionata venga verso l'alto. Fissare la punta e la base della coda con del nastro adesivo.
- Prendi il catetere 30G con la mano dominante e posiziona delicatamente il dito indice della mano non dominante sulla vena selezionata per creare un backup di sangue all'interno. Nel sito del backup, la vena si dilata, formando una piccola gobba.
- Con la mano dominante, posizionare il catetere 30G parallelamente alla coda rivolta verso la gobba sulla vena. Sposta in avanti la mano dominante. Il più delle volte, questa tecnica garantisce una venipuntura diretta.
- Una volta all'interno della vena, il reflusso sanguigno diventa visibile nel tubo di plastica. Fissare il tubo di plastica per assicurarsi che l'ago non si muova all'interno della vena durante l'iniezione. All'estremità libera del tubo, inserire la siringa tracciante collegata a un ago da 30G.
NOTA: Quando è necessario valutare una distribuzione dinamica del tracciante, è necessario eseguire i seguenti punti dopo che l'animale è stato posizionato sul letto dello scanner PET e la PET è stata avviata. - Iniettare lentamente il contenuto della siringa tracciante per almeno 10 s. Mantenendo l'ago 30G ancora collegato al sistema di catetere 30G, rimuovere solo la siringa tracciante e collegare una siringa con tampone NaCl allo 0,9% (o qualsiasi altro tampone desiderato) per lavare il catetere. Monitorare continuamente la respirazione durante la procedura di iniezione e regolare la concentrazione di isoflurano per mantenere circa 1 respiro al secondo.
- Rimuovere il catetere da 30 G dalla vena caudale e utilizzare un impacco di cotone sterile per fermare l'emorragia.
- Per misurare l'attività residua, misurare il catetere da 30 G, la siringa tampone, la siringa tracciante vuota e l'impacco di cotone, poiché tutti contengono piccole quantità di tracciante che non hanno raggiunto l'animale.
- Acquisizione PET/CT
NOTA: Per il nanocorpo NM-02 marcato con 68Ga, tutti gli animali vengono ripresi con un sistema PET/CT per piccoli animali.- Acquisizione del PET
- Posiziona il topo sedato in posizione ventrale sul letto dell'animale e attaccalo allo scanner PET. Commutare il flusso di isoflurano al cono del naso sulla PET e mantenerlo all'1,5%-2,5% di isoflurano nell'aria medica a 0,8 L/min in modo che la frequenza respiratoria dell'animale durante la scansione sia compresa tra 75 e 50 respiri al minuto.
- Fissa il topo dietro il collo al letto dell'animale con del nastro adesivo. Se necessario, applicare nuovamente un unguento oftalmico sugli occhi del topo per evitare che si secchi durante la sedazione.
- Accendi il termoforo nella cuccia a circa l'80% di potenza, che equivale a circa 30 °C.
- Impostare il tempo di acquisizione su 45 minuti e selezionare la regione di interesse che verrà scansionata. Selezionare 68Ga come isotopo di studio e avviare la scansione. Inserire la quantità di attività iniettata, il tempo di iniezione e il tempo di misurazione della siringa vuota. Una posizione del letto PET è di 160 mm, che è abbastanza lunga per una scansione del mouse di tutto il corpo.
- Quando è necessario valutare una distribuzione dinamica del tracciante, avviare prima la scansione PET, attendere 30 s per l'acquisizione e solo successivamente procedere con i passaggi 3.2.9-3.2.10. Lasciare il catetere nel topo con la siringa tampone collegata per evitare ulteriori perdite di sangue. Il catetere può essere scollegato alla fine della PET, prima dell'acquisizione della TC per evitare artefatti.
- Acquisizione CT
- Scollegare la cuccia dallo scanner PET e collegarla immediatamente allo scanner CT. Se necessario, staccare anche la cannula dalla vena caudale. Dopo almeno 30 minuti dalla venipuntura, il sito di iniezione è già coagulato, quindi non si verificheranno più sanguinamenti.
- Commutare il flusso di isoflurano al cono del naso nello scanner CT.
- Selezionare la stessa regione di interesse da scansionare per l'imaging PET. Selezionare il protocollo di acquisizione standard: 440 μA, 50 kVp, tempo di esposizione di 32 ms e rotazione di 1080° in modalità spirale con 960 esposizioni/360°; la durata della TAC è di circa 7 minuti per una scansione del mouse di tutto il corpo.
- Controlla la frequenza respiratoria e accendi il termoforo nella cuccia degli animali. Monitorare continuamente la respirazione durante le scansioni e regolare la concentrazione di isoflurano per mantenere una frequenza respiratoria compresa tra 75 e 50 respiri al minuto.
- Acquisizione del PET
4. Cura degli animali dopo l'imaging
- Al termine delle scansioni, l'animale impiega almeno 15 minuti per svegliarsi. Per evitare l'aggressione del compagno di cucciolata, mettere in gabbia l'animale da solo per circa 15 minuti o fino a quando non è in grado di camminare da solo fino a quando non lo rimette nella sua gabbia di alloggiamento originale. Durante questo periodo, utilizzare la luce infrarossa per evitare l'ipotermia.
- Inizialmente, posizionare l'animale sul lato sinistro (posizione sicura) per evitare uno shock emodinamico. Lascia che l'unguento oftalmico rimanga, poiché verrà rimosso dall'animale stesso una volta sveglio.
5. Ricostruzione PET/TC
- Eseguire la ricostruzione PET utilizzando una massimizzazione delle aspettative di sottoinsiemi ordinati tridimensionali (ad esempio, OSEM-3D con 30 iterazioni) con una finestra di energia del ± 15% da un picco di 511 keV a una dimensione isometrica del voxel di 0,4 mm in una matrice di 192 × 192 × 384. Applicare correzioni basate su CT (ad esempio, correzione dell'attenuazione, correzione della dispersione, tempo morto ed eventi casuali) alla ricostruzione PET.
- Nel caso in cui sia necessario valutare una distribuzione dinamica del tracciante, applicare una ricostruzione multi-frame. Ad esempio, per una scansione di 45 minuti è possibile utilizzare i seguenti fotogrammi: 4 x 30 s, 3 x 1 min, 5 x 2 min, 2 x 5 min e 2 x 10 min.
- Ricostruire i protocolli di acquisizione standard CT utilizzando un processo di ricostruzione con algoritmo di ricostruzione iterativo (ad es. ISRA) a una dimensione isometrica del voxel di 0,2 mm in una matrice 200 × 200 × 425. Utilizzando il software del fornitore, converti i valori CT in unità Hounsfield (HU) utilizzando la formula:
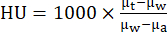
dove μW è il coefficiente di attenuazione lineare dell'acqua, μA è il coefficiente di attenuazione lineare dell'aria e μt è il coefficiente di attenuazione lineare del tessuto. - Le immagini PET e TC sono state allineate automaticamente dopo la ricostruzione utilizzando la matrice generata da una scansione capillare fantoccio. Archivia tutti i dati ricostruiti e trasferiscili su un server di database utilizzando il software di analisi delle immagini, se necessario.
6. Elaborazione e analisi delle immagini
NOTA: Le immagini PET/CT co-registrate vengono ulteriormente utilizzate per la quantificazione all'interno del server di database di un software di analisi delle immagini, in cui ogni scansione ibrida viene salvata come soggetto.
- Identificare il tumore in base alla TC e selezionarlo come regione di interesse. Mascherare manualmente la base tumorale alla TC.
- Per ottenere una segmentazione indipendente dall'utente, soglie la maschera tumorale appena formata su PET o SPECT. Per il PET utilizzare una soglia minima di 1,0 valore di assorbimento standardizzato (SUV). Per la SPECT, utilizzare una soglia minima superiore alla captazione media del pool sanguigno misurata nel cuore o nell'aorta addominale terminale.
- Registra la media, il massimo, la media dei 10 voxel più caldi (cioè la media calda 10) e l'assorbimento totale dei nuovi volumi di interesse generati.
- Utilizzare tali valori per generare valori SUV e TBR (target-to-background), che verranno ulteriormente utilizzati per l'analisi statistica.
Access restricted. Please log in or start a trial to view this content.
Risultati
Uno degli aspetti più importanti del controllo di qualità di un radiofarmaco è l'HPLC, in quanto questo dimostra non solo la purezza chimica e radiochimica (98,2% in questo caso) ma permette anche di dimostrare l'identità del radiofarmaco confrontando il tempo di eluizione e la forma del picco con quelli di un composto di riferimento non radioattivo. Questo composto di riferimento è, in questo caso, un nanocorpo non marcato, che si è dimostrato il composto corretto con tecniche cla...
Access restricted. Please log in or start a trial to view this content.
Discussione
Radiosintesi
La radiosintesi qui descritta è tipica di un nuovo composto marcato con 68Ga: tempo di sintesi breve, con enfasi sul pH adatto ed evitando i metalli quando possibile. Per questo, è importante seguire rigorosamente l'ordine in cui vengono aggiunti i componenti. In ogni caso, il valore del pH della soluzione di 68Ga deve essere prima regolato a pH 4 con 3 M NH4OAc; in caso contrario, il nanocorpo può degradarsi se il pH ?...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
FMM è consulente medico per NanoMab Technology Ltd. e Advanced Accelerator Applications (AAA) GmbH. Ha recentemente ricevuto sovvenzioni istituzionali da NanoMab Technology Ltd., Siemens e GE Precision Healthcare LLC. Inoltre, ha un contratto di ricerca interventistica con CURIUM.
Riconoscimenti
Gli autori sono grati a Susanne Allekotte per il suo supporto tecnico.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Activity meter ISOMED 2010 | Nuviatech Healthcare | - | |
| Centrifuge MIKRO 185 | Andreas Hettich GmbH & Co. KG | 1203 | |
| Endotoxin testing Endosafe nexgen-PTS | Charles River | - | |
| Heating block NANOCOLOR VARIO C2 | Macherey-Nagel | 919350 | |
| HPLC system, including radio detector | Knauer & Raytest | - | |
| Image analysis software Pmod 4.4 | PMOD Technologies LLC | - | |
| Small animal PET/CT system β-CUBE and X-CUBE | Molecubes NV | - | |
| TLC MiniGITA* | Elysia-Raytest | - | |
| Materials | |||
| 0.3 mm diameter PE10 tube | fisher scientific | 22-204008 | |
| 30G needle | B|Braun | 4656300 | |
| Centrifugal filter; 10 kDa MWCO, 0.5 mL | Millipore | UFC501008 | |
| Chromatography paper strip iTLC-SG | Agilent Technologies | SGI0001 | |
| Endotoxin Cartridge, 0.05 EU/ml sensitivity | Charles River | PTS-2005 | |
| HPLC Column Biosep SEC-s2000 | Phenomenex | - | |
| Microcentrifuge tube (1.5 mL) | Eppendorf | 0030125150 | |
| pH strip 0.0 - 6.0 | Merck KGaA | 109531 | |
| pH strip 0-14 | Merck KGaA | 109535 | |
| PS-H+ SPE cartridge | Macherey Nagel GmbH & Co. KG | 731861 | |
| Sterile vial 10 mL | ALK Life Science Solutions | SEV100 | |
| Reagents | |||
| 68Ge/68Ga-Generator | NRF-iThembaLABS | - | |
| Ammoniumacetate | Merck KGaA | 101116 | |
| Citric acid | Merck KGaA | 100241 | |
| Hydrochloric acid | Merck KGaA | 320331 | |
| NaCl | Merck KGaA | S9888 | |
| Nanobody NM-02 | Radiopharm Theranostics | - | |
| P-SCN-Bz-DOTA-GA | CheMatech | C115 | |
| Trifluoracetic acid | Merck KGaA | T6508 | |
| Ultrapure water | Merck KGaA | 101262 |
Riferimenti
- American Cancer Society. Cancer facts & figures 2024. , https://www.cancer.org/research/cancer-facts-statistics/all-cancer-facts-figures/2024-cancer-facts-figures.html (2024).
- Cancer Research UK. Ovarian cancer survival. , https://www.cancerresearchuk.org/about-cancer/ovarian-cancer/survival (2021).
- Siegel, R. L., Giaquinto, A. N., Jemal, A. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Altunay, B., et al. Her2-directed antibodies, affibodies and nanobodies as drug-delivery vehicles in breast cancer with a specific focus on radioimmunotherapy and radioimmunoimaging. Eur J Nucl Med Mol Imaging. 48 (5), 1371-1389 (2021).
- Altunay, B., Morgenroth, A., Mottaghy, F. M. Use of radionuclide-based imaging methods in breast cancer. Semin Nucl Med. 52 (5), 561-573 (2022).
- Mcgale, J., et al. Pet/ct and spect/ct imaging of her2-positive breast cancer. J Clin Med. 12 (15), 4882(2023).
- Zhang-Yin, J. State of the art in 2022 pet/ct in breast cancer: A review. J Clin Med. 12 (3), 968(2023).
- USFD Administration. Pet drug products - current good manufacturing practice (cgmp). , https://www.fda.gov/regulatory-information/search-fda-guidance-documents/pet-drug-products-current-good-manufacturing-practice-cgmp (2018).
- Official Journal of the European Union, L238. 60, https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=OJ:L:2017:238:TOC (2017).
- Korde, A., et al. Position paper to facilitate patient access to radiopharmaceuticals: Considerations for a suitable pharmaceutical regulatory framework. EJNMMI Radiopharm Chem. 9 (1), 2(2024).
- Korde, A., et al. Practical considerations for navigating the regulatory landscape of non-clinical studies for clinical translation of radiopharmaceuticals. EJNMMI Radiopharm Chem. 7 (1), 18(2022).
- European Pharmacopeia. , (2023).
- Volokhov, D. V., Graham, L. J., Brorson, K. A., Chizhikov, V. E. Mycoplasma testing of cell substrates and biologics: Review of alternative non-microbiological techniques. Mol Cell Probes. 25 (2-3), 69-77 (2011).
- Dülsner, A., et al. Technical information from the Committee for Animal Welfare Officers (GV-SOLAS) and Working Group 4 in the TVT Recommendation on substance administration to laboratory animals. GV-SOLAS. , (2017).
- derived xenograft (pdx) protocols at the jackson laboratory. , Available from: https://tumor.informatics.jax.org/mtbwi/live/www/html/SOCHelp.html (2020).
- Velikyan, I. 68ga-based radiopharmaceuticals: Production and application relationship. Molecules. 20 (7), 12913-12943 (2015).
- Percie Du Sert, N., et al. Reporting animal research: Explanation and elaboration for the arrive guidelines 2.0. PLoS Biol. 18 (7), e3000411(2020).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. A., Brattelid, T. Prepare: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Landesamt Für Natur UUVN. Tierversuche. , https://www.lanuv.nrw.de/verbraucherschutz/tierversuche (2024).
- Herrmann, D., et al. Statistical controversies in clinical research: Publication bias evaluations are not routinely conducted in clinical oncology systematic reviews. Ann Oncol. 28 (5), 931-937 (2017).
- Johnsen, E., et al. A critical evaluation of amicon ultra centrifugal filters for separating proteins, drugs and nanoparticles in biosamples. J Pharm Biomed Anal. 120, 106-111 (2016).
- TVT-Veröffentlichungen zum Download. , Society for Laboratory Animal Science (GV-SOLAS). Available from: https://www.tierschutz-tvt.de/alle-merkblaetter-und-stellungnahmen/ (2024).
- Bedard, P. L., Hansen, A. R., Ratain, M. J., Siu, L. L. Tumour heterogeneity in the clinic. Nature. 501 (7467), 355-364 (2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon