A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
רדיוסינתזה, בקרת איכות והדמיית טומוגרפיה של פליטת פוזיטרונים של בעלי חיים קטנים של 68מולקולות ננו עם תווית Ga
In This Article
Summary
מאמר זה מתאר את הרדיוסינתזה, הניסוח, בקרת האיכות של בדיקה חדשה עם תווית רדיו (כלומר, 68ננו-גוף NM-02 עם תווית Ga), והשימוש בו להדמיית PET/CT של בעלי חיים קטנים במודל קסנוגרפ.
Abstract
טכניקות הדמיה של טומוגרפיה של פליטת פוזיטרונים של בעלי חיים קטנים (PET) וטומוגרפיה ממוחשבת של פליטת פוטון בודד (SPECT) הן חיוניות במחקר סרטן פרה-קליני, ומחייבות תשומת לב קפדנית לסינתזה של רדיוטרסר, אבטחת איכות ופרוטוקולי הזרקה in vivo . מחקר זה מציג זרימת עבודה מקיפה המותאמת לשיפור החוסן והשחזור של ניסויי PET בבעלי חיים קטנים. תהליך הסינתזה במעבדת הרדיוכימיה באמצעות 68Ga מפורט, ומדגיש פרוטוקולי בקרת איכות ואבטחת איכות מחמירים עבור כל ייצור רדיו-טריסר. פרמטרים כגון ריכוז, פעילות טוחנת, pH וטוהר מנוטרים בקפדנות, בהתאם לתקנים החלים על מחקרים בבני אדם. מתודולוגיה זו מציגה הכנת מזרק יעילה וצינורית 30G מעוצבת בהתאמה אישית להזרקות תוך ורידיות מדויקות לעכברים. ניטור בריאות בעלי החיים במהלך הסריקה, כולל טמפרטורה ודופק, מבטיח את רווחתם לאורך כל ההליך. מינונים לסריקות PET ו-SPECT נקבעים מראש כדי לאזן בין איסוף נתונים לבין מזעור החשיפה לקרינה לבעלי חיים וחוקרים. באופן דומה, סריקות CT משתמשות בהגדרות מתוכנתות מראש כדי להגביל את החשיפה לקרינה, רלוונטיות במיוחד במחקרים ארוכי טווח המעריכים את השפעות הטיפול. על ידי אופטימיזציה של שלבים אלה, זרימת העבודה שואפת לתקן נהלים, להפחית את השונות ולשפר את איכות הדמיית PET/SPECT/CT של בעלי חיים קטנים. משאב זה מספק תובנות חשובות לחוקרים המבקשים לשפר את הדיוק והאמינות של חקירות פרה-קליניות בהדמיה מולקולרית, ובסופו של דבר לקדם את התחום.
Introduction
נושא אחד בעל רלוונטיות עליונה הוא מחקר בתחום סרטן השד. סרטן השד נותר סרטן המופיע לעתים קרובות, ומהווה בערך 1/3 מכלל מקרי הסרטן אצל נשים. הטיפול מותאם למאפיינים הביולוגיים וההיסטולוגיים של הגידול ולשלב המחלה. סיכויי ההישרדות בדרך כלל טובים אלא אם כן הגידול כבר שלח גרורות, ובמקרה זה ההישרדות ל-5 שנים היא רק כ-30%1. סוגי סרטן גינקולוגיים אחרים סובלים מגורל דומה, כאשר למשל סרטן השחלות מראה >-95% הישרדות של 5 שנים לגידולים בשלב 1 אך רק 15% לגידולים גרורתיים בשלב 4 2,3.
הדמיה לא פולשנית, במיוחד טומוגרפיה של פליטת פוזיטרונים (PET), שינתה את חקר הסרטן מכיוון שהיא מציעה תובנות שאין שני להן לגבי היבטים מולקולריים של גידול, כגון חילוף חומרים, ביטוי קולטנים ותגובה טיפולית 4,5,6. זה מאפשר גם הדמיה וגם כימות של אזורים מטבוליים ספציפיים - ומאפשר לא רק לאבחן במדויק, אלא גם לעקוב אחר ההשפעה של טיפולים (חדשים) בנקודות זמן קצרות מאוד. ואכן, PET מאפשר הערכה של תגובה לעומת אי תגובה לאחר 1-3 מחזורי טיפול ועושה זאת טוב יותר ומהיר יותר בהשוואה לשינויים מורפולוגיים כפי שניתן לראות בהדמיית טומוגרפיה ממוחשבת קלאסית (CT)7. האופי הלא פולשני של PET מאפשר גם מחקרי אורך.
כל מודל של בעלי חיים דורש סטנדרטיזציה מקסימלית על מנת להעריך לעומק את היכולת הטיפולית של תרופות חדשות (רדיואקטיביות), ולכן יש לשים את הדגש על כך - הן ביצירת מודל הגידול והן בהדמיית PET/ניתוח נתונים של בעלי חיים קטנים. אפשר להתווכח על מודל הגידול הטוב ביותר בבעלי חיים (חיסון תת עורי או השתלה אורתוטופית, עכברים, גידולים אנושיים או סינגניים, מלווים או לא מלווים בטיפול קליני שגרתי), אבל זה יהיה מעבר למטרת פרסום זה. מספר מודלים משמשים אותנו לחקר סרטן, וזה המתואר כאן הוא מודל תת עורי פשוט יחסית.
בקרת איכות ברדיוכימיה היא בעלת חשיבות עליונה לבטיחות בעלי חיים ויעילות הטיפול. זה לא משפיע רק על הרדיו-פרמצבטיקה עצמה אלא גם על ניסוח המוצר. קיימת חקיקה נרחבת על ייצור תרופות רדיו-פרמצבטיות ליישומים קליניים 8,9 (ראה 10 לסקירה נרחבת של החקיקה וההנחיות הנוכחיות), ומספר הנחיות לגבי המאפיינים של תרופות רדיו-פרמצבטיות למחקר פרה-קליני (ראה 11 לסקירה נרחבת). אנו מייצרים רדיו-פרמצבטיקה הן ליישומים קליניים והן ליישומים פרה-קליניים, ומפשטים את התרגום מבקרת איכות מתקדמת כפי שנמצא בסינתזה ליישומים קליניים ליישומים פרה-קליניים.
המחקר שלנו מתמקד בתרנוסטיקה מכוונת, במיוחד בסרטן חיובי לקולטן גורם גדילה אפידרמלי אנושי 2 (HER2). לפיכך, אנו מפתחים תרופות רדיו-פרמצבטיות חדשות לאבחון ולניטור סרטן במהלך הטיפול. רדיו-פרמצבטיקה אבחנתית מוצלחת מוערכת גם כתרכובות טיפוליות באמצעות רדיואיזוטופים שונים. ההערכה של תרופות רדיו-פרמצבטיות אלה מתבצעת תחילה במודלים של בעלי חיים, תוך חתירה לתרגום קליני לאחר תוצאות פרה-קליניות מבטיחות. במאמר זה, נציג את הפרוטוקולים בהם נעשה שימוש, המודגמים עם רדיו-פרמצבטיקה אחת, כדי להבטיח בקרת איכות ואבטחה, כמו גם פרקטיקה סטנדרטית להזרקה תוך ורידית של עכבר וסריקת PET/CT, על מנת לשפר את הדיוק והאמינות של חקירות פרה-קליניות בהדמיה מולקולרית. הפרוטוקול מחולק לשלושה חלקים שונים: רדיוכימיה (סינתזת עוקבים ובקרת איכות), יצירת מודלים של בעלי חיים (מודל גידול תת עורי) והדמיה.
Protocol
פרוטוקול המחקר עומד בסטנדרטים הגבוהים ביותר של רווחת בעלי חיים ועומד בקפדנות בהנחיות הטיפול בבעלי חיים של בית החולים האוניברסיטאי RWTH אאכן. אנו מחויבים להבטיח טיפול אתי ואנושי בכל בעלי החיים המעורבים במחקרים, והנהלים נבדקים ומאושרים על ידי ועדת האתיקה המקומית לבעלי חיים. כל הניסויים בבעלי חיים אושרו על ידי רשות מוסמכת גרמנית (Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen, LANUV) לעמידה בחוק הגנת בעלי חיים, בשילוב עם הרגולציה להגנה על בעלי חיים המשמשים למטרות ניסיוניות ומדעיות אחרות.
הערה: רשימה מלאה של הציוד, החומרים והריאגנטים ששימשו במהלך מחקר זה מסופקת בטבלת החומרים. חשוב לציין כי הטיפול ב-68Ga צריך להיעשות על ידי פיפטה במידת האפשר ובוודאי להימנע מכל מתכת, מכיוון שהמגהץ יכול להפחית במידה ניכרת את תפוקת התיוג. המשמעות היא שיש להימנע ממחטים עד להשלמת הליכי הרדיוכימיה.
1. רדיוכימיה
- תיוג רדיו של NM-02-DOTA-GA עם 68Ga
זהירות: הפרוטוקול כולל טיפול ומניפולציה של חומרים רדיואקטיביים. על החוקרים לעקוב אחר החקיקה המקומית לטיפול בחומרים רדיואקטיביים, שיטות ALARA (נמוכות ככל האפשר באופן סביר), לעבוד עם מיגון עופרת, למזער את זמן המגע הישיר ולשמור על מרחק מקסימלי בכל שלב של חשיפה לקרינה. יש לעקוב אחר הליכי הניסוי באמצעות מכשירי גילוי רדיואקטיביות.- יש לשטוף את ה-68Ge/68Ga-Generator באופן ידני או אוטומטי ב-10 מ"ל של 0.6 M HCL (1.2 GBq/10 מ"ל). לכוד את ה-68Ga על מחסנית PS-H+ (גודל M - 0.8 מ"ל) על ידי העברת ה-eluate דרך המחסנית. הוצא את מחסנית ה-PS-H+ SPE עם סך של 1 מ"ל של 4 M NaCl צעד ולאט לתוך צינור מיקרו-צנטריפוגה.
- השליכו את 0.3 מ"ל הראשונים של הפליטה ואספו את השאר 0.7 מ"ל בצינור מיקרו-צנטריפוגה אחר.
- קח צינור מיקרו-צנטריפוגה חדש והמשך עם תיוג הרדיו של NM-02-DOTA-GA כאמור בפרוטוקול היצרן.
הערה: מצומד הננו-גוף-כלאטור (NM-02-DOTA-GA) הוכן בעבר על פי הפרוטוקול של הספק. ניתן לאחסן את המצומד בטמפרטורה של -80 מעלות צלזיוס למשך מספר חודשים. - התאם את ה-pH של המוצר לסביבות 7 באמצעות עד 5 מיקרוליטר של 3 M NH4OAc.
- בקרת איכות
- מדוד את פעילות הדגימה המרוכזת בצינור המיקרו-צנטריפוגה באמצעות מד פעילות בהגדרה הנכונה (68Ga כאיזוטופ; מזרק 1 מ"ל, 0.1 מ"ל לגיאומטריה). התשואה הרדיוכימית (מתוקנת ריקבון) צריכה להיות לפחות 40%.
- קבע את ה-pH עם רצועת בדיקת pH (0-14) על ידי איתור כמות מספקת על רצועת בדיקת ה-pH (10-15 מיקרוליטר).
- כרומטוגרפיה של שכבה דקה (TLC)
- נקודה 1 מיקרוליטר של תערובת תגובת תיוג הרדיו על רצועת TLC ספוגה בסיליקה. הניחו לאליקווט להתייבש כדקה. הפעל את ה-TLC באמצעות חומצת לימון כשלב נייד, מלא מראש כ-2-3 מ"מ, בתא TLC סגור. הסר את רצועת ה-TLC מהתא כאשר הנוזל הגיע לחלק העליון של הרצועה.
- הנח את רצועת ה-TLC על סורק רדיו-TLC ומדוד אותו לפי פרוטוקול היצרן. המוצר צריך להופיע במקור (Rf < 0.2), בעוד ש-68קטיונים Ga חופשיים ייפלטו עם חזית הממס (Rf > 0.9).
- חשב את תפוקת תיוג הרדיו של התגובה באמצעות כרומטוגרמה רדיו, חלוקת השטח המשולב מתחת לעקומה (AUC) מ-Rf 0.0-0.2 בסך ה-AUC (Rf 0.0-1.0), והכפלה ב-100.
- כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (HPLC)
- ודא שה-HPLC פועל לפחות 10 דקות באמצעות הממס הנכון על מנת שכל הקווים יוצפו והתאם את ההגדרה למדידה. השתמש בזרימה איזוקרטית של תערובת של 50:50 של אצטוניטריל (ממס A) ותערובת של תמיסת NaCl של 0.9% (980 מ"ל) בשילוב עם חומצה טריפלואוראצטית (1 מ"ל) ותמיסת ציטראט (20 מ"ל) כממס B. מדוד את ספיגת ה-UV ב-280 ננומטר.
- קח 5 מיקרוליטר מהמוצר ודלל אותו ב -15 מיקרוליטר של 0.9% NaCl. הזרקו 15 מיקרוליטר מהתערובת ברדיו-HPLC האנליטי (5 מיקרומטר SEC-s2000 154 Å עמודה; קצב זרימה: 2 מ"ל/דקה).
- השתמש בזרימה איזוקרטית של תערובת של 50:50 של אצטוניטריל (ממס A) ותערובת של תמיסת NaCl של 0.9% (980 מ"ל) בשילוב עם חומצה טריפלואוראצטית (1 מ"ל) ותמיסת ציטראט (20 מ"ל) כממס B. מדוד את ספיגת ה-UV ב-280 ננומטר. יש שינוי קל בזמני השמירה בין ערוצי ה-UV והגמא; זאת בשל תכנון ה- HPLC (אות הגמא מותקן בסדרה לאחר גלאי ה- UV).
- קבע את הטוהר הרדיוכימי על ידי שילוב הפסגות בערוץ הגמא. המוצר צריך להיות בטווח האינטגרציה שנקבע בעבר על ידי מדידת הננו-גוף שאינו מסומן ברדיו. בנוסף, שלב את כל הפסגות האחרות בערוץ הגמא והעריך אותן כזיהומים. הטוהר צריך להיות >95%.
- אנדוטוקסין
- הכן דילול של 1:20 של המוצר בנפח כולל של 150 מיקרוליטר באמצעות מים נטולי אנדוטוקסינים (מאושרים) לדילול.
- הכנס מחסנית אנדוטוקסין חד פעמית, הממולאת מראש באופן מסחרי בכל הריאגנטים הדרושים, לקורא בדיקת האנדוטוקסין וטען 25 מיקרוליטר מהמוצר המדולל בכל תא מחסנית.
- לחץ על הפעל. ל-PTS יש בקרות חיוביות ושליליות פנימיות והן ייכללו בדוח הסופי. הבדיקה אורכת כרבע שעה. המוצר נחשב נטול אנדוטוקסין אם תכולת האנדוטוקסין היא < 8.7 EU/mL ב-Vmax = 20 מ"ל.
- סטריליות רטרוספקטיבית
- לאחר הזרקה ואיסוף הדגימה האיכותית, יש לאחסן את הרדיו-פרמצבטיקה בבקבוקון סטרילי במקרר בטמפרטורה של 4 מעלות צלזיוס.
- למסור את הדגימה למכון מוסמך לניתוח סטריליות (פנימית או חיצונית) אם לא חורגים ממגבלת הפטור של 10,5 Bq או 10 Bq/g על מנת לבצע בדיקת סטריליות לפי12.
- הכנת מזרק (אחד לכל בעל חיים)
- מדוד את פעילות המוצר באמצעות מד פעילות בהגדרה הנכונה (68Ga כאיזוטופ; מזרק 1 מ"ל, 0.1 מ"ל לגיאומטריה).
- קח 15 MBq של המוצר (בסביבות 25 מיקרוליטר) בצינור מיקרו-צנטריפוגה ומלא את הנפח ב-0.9% NaCl עד 75 מיקרוליטר.
- הוסף 50 מיקרוליטר למזרק ומדוד אותו באמצעות מד פעילות בהגדרה הנכונה (68Ga כאיזוטופ; מזרק 1 מ"ל, 0.1 מ"ל לגיאומטריה). המזרק צריך להכיל 10 MBq של המוצר.
הערה: ברגע שנוצר הננו-גוף NM-02 המסומן ב-68Ga, קצות פיפטה מפלסטיק אינם נחוצים עוד בעת הטיפול ב-68Ga. מכאן ואילך, בכל פעם שהפרוטוקול מזכיר טיפול בנוזל, השתמש במזרק מתאים (1 מ"ל) ובמחט (27-30 גרם).
2. יצירת מודלים של בעלי חיים
- דיור לבעלי חיים
- השתמש בעכברי Rj: ATHYM-Foxn1nu/nu נקבות בגיל 6-8 שבועות (מספק מסחרי) להתפתחות גידולים תת עוריים. עם ההגעה, יש לשכן את כל העכברים ישירות בחדר החיות ולתת לפחות שבוע לאחר ההובלה להתאקלמות.
- יש לשכן את בעלי החיים תחת מחזור אור של 12 שעות ו-12 שעות חושך ולספק גישה חופשית למזון ומים. שמור על טמפרטורת החדר והלחות היחסית בין 20-25 מעלות צלזיוס ו-45%-65%, בהתאמה.
- הכנת תאים להשתלה
- התחל את תרבית התאים עם 1 x 106 תאי SKOV-3 והוסף 25 מ"ל של מדיה DMEM/F12 מחוממת מראש מועשרת ב-10% FBS ו-1% פניצילין/סטרפטומיצין בבקבוק תרבית תאים T175.
- לטפח את התאים בחממה ב-37 מעלות צלזיוס ו-5% CO2 ולהחליף את המדיום השלם לפחות פעמיים בשבוע.
- לאחר שבוע אחד או, לכל המאוחר יום אחד לפני השתלת התא, קח 20 מיקרוליטר של מדיום מבקבוק תרבית התא כדי לבדוק מיקופלזמה13. השתמש רק בתאים שליליים למיקופלזמה להזרקת תאים.
- ביום הזרקת התאים, יש לשאוב את המדיום השלם ולהכניס פיפטה 5 מ"ל PBS לבקבוק. סובב את הבקבוק קדימה ואחורה מספר פעמים כדי לשטוף את המדיום שנותר.
- הוסף 3 מ"ל טריפסין לבקבוק ודגר אותו למשך 4 דקות בחממה בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 כדי לנתק את התאים. בדוק במיקרוסקופ בהגדלה של פי 40 אם התאים התנתקו מבקבוק תרבית התא.
- הוסף 7 מ"ל של מדיום כדי לנטרל את פעילות הטריפסין ולהעביר את תרחיף התא לצינור צנטריפוגה של 50 מ"ל.
- צנטריפוגה של התאים ב-150 x גרם למשך 5 דקות (בטמפרטורת החדר) כדי לקבל כדור תא. הסר את הסופרנטנט והוסף 1 מ"ל של מדיום כדי להשעות מחדש את התאים.
- קח 12 מיקרוליטר מתרחיף התא בצינור מיקרוצנטריפוגה והוסף כמות שווה של טריפן כחול. טען את תא ההמוציטומטר ב -10 מיקרוליטר של מתלה התאים המעורבב בקפידה.
- ספור את התאים הלא מוכתמים והברי קיימא בתוך האזור המוגדר וחשב את מספר התא. התאם את ריכוז התאים ל-5 x 107 תאים/מ"ל מדיה וערבב בזהירות את תרחיף התאים עם 1 מ"ל של מטריצת קרום המרתף.
- קח 5 x 106 תאים ב-0.2 מ"ל של מדיה תאית עם 50% מטריצת קרום בסיס במזרק אינסולין של 1 מ"ל לכל עכבר. שמור את המזרק על קרח עד להזרקה כדי למנוע התמצקות של מטריצת קרום המרתף.
הערה: אם עכבר שוקל פחות מ-20 גרם, הזריק רק 150 מיקרוליטר (עבור 15-20 גרם) או 100 מיקרוליטר (עבור 10-15 גרם) מהתערובת. עבור יישומים תת עוריים, מקפידים להבטיח שהנפח המרבי של 10 מ"ל/ק"ג משקל גוף המומלץ על ידי GV-SOLAS לא יעלה על14.
- חיסון ומעקב
- הזרקת תרחיף התאים תת עורית לאגף החיה הערה על ידי קיבוע הצוואר והזנב ביד אחת. בדרך כלל, אנו מעדיפים זריקות באגף השמאלי.
- המתן 10-15 שניות עד שמטריצת קרום המרתף תתקשה, ולאחר מכן הסר את המחט.
- עקוב אחר צמיחת הגידול מדי יום לאחר ההשתלה באמצעות קליפר דיגיטלי למדידת שני צירי גידול בניצב.
- באמצעות מדידות אלה, העריכו את צמיחת הגידול באמצעות נפח הגידול המחושב על ידי הנוסחה:
VT = L × B2 × π / 6
כאשר VT הוא נפח הגידול במ"מ3, L הוא אורך הגידול במ"מ (כלומר, הגדול מבין שני הצירים המאונכים), ו-B הוא רוחב הגידול במ"מ (כלומר, הקטן מבין שני הצירים הניצבים15). טכניקה זו נוטה להעריך יתר על המידה את נפח הגידול מכיוון שהיא כוללת גם את העור. - מסת הגידול משפיעה על משקל העכבר כאשר היא נמדדת במשקל האלקטרוני. כדי לחשב את משקל החיה המתוקנת למסת הגידול, השתמש בנוסחה הבאה:
mעכבר-T = mעכבר - 0.82 × VT
כאשר mmouse-T הוא משקל העכבר למעט מסת הגידול ב-g, m עכבר הוא משקל העכבר לפי הסולם האלקטרוני ב-g ו-V T הוא נפח הגידול המחושב במ"מ3. המספר 0.82 גרם/מ"מ3 נובע מהערך הממוצע של סדרת גידולים שבודדו מניסויים קודמים בבעלי חיים, נשקלו ונפחם נקבע באמצעות הנוסחה שניתנה. הוא מייצג צפיפות גידול ממוצעת. - בנוסף, קבע כמה גדול הגידול בהשוואה לעכבר ועקוב אחר עומס הגידול באמצעות הנוסחה הבאה:
עומס הגידול [%] = (0.82 × VT) / mעכבר × 100
כאשר נטל הגידול מתבטא באחוזים, 0.82 × VT מתאים למסת הגידול ב-g (כלומר, VT, נפח הגידול המחושב במ"מ3, כפול צפיפות הגידול הממוצעת), ו-m עכבר הוא משקל העכבר לפי הסולם ב-g. - כאשר החיות מגיעות לנפח גידול של יותר מ-200 מ"מ3, קבעו אותן ל-PET/CT או SPECT/CT לא פולשניות, בהתאם לניסוי.
3. הדמיה
- הכנת מזרק (מערכת בהתאמה אישית)
הערה: זנב העכבר קטן; לכן נדרש שימוש בצינורית 27G או קטנה יותר (מספרים גדולים יותר תואמים למחטים קטנות יותר). במקרה של עכברים נקבות, הוורידים הנגישים היחידים להזרקת בולוס הם שלושת ורידי הזנב. מבחינה אנטומית, וריד הזנב הגבי קרוב יותר לעמוד השדרה בהשוואה לשני הוורידים הצדדיים; אין להזריק לווריד זה כדי למנוע גירוד עצם יאטרוגני. בהתבסס על ניסיון, שימוש בצינורית 30G מספק את התוצאות הטובות ביותר מכיוון שניתן לגשת גם לוורידים קטנים יותר. מכיוון שצנתרי 30G אינם זמינים לרכישה, סוג זה צריך להיעשות בזהירות על ידי החוקר.- הכן את המזרק עם העוקב הרדיואקטיבי בהתאם למסלול המתן המתוכנן. עבור זריקות תוך ורידיות, יש לוודא כי נפח מרבי של 5 מ"ל/ק"ג משקל גוף ניתן לעכבר במשקל 25 גרם; המשמעות היא נפח הזרקה מקסימלי של 125 מיקרוליטר.
- כדי להכין קטטר 30G, ראשית, השתמש בכל מחט 30G והסר את פיר המחט המתכתי, בעזרת מספריים מתכתיים או על ידי כיפופו הרחק מהפלסטיק.
- הכנס ידנית צינור PE10 בקוטר 0.3 מ"מ לחלק הפיר שהוסר מהרכזת. יש להקפיד להימנע מניקוב הצינור.
הערה: ניתן להשתמש גם בסוגים אחרים של פלסטיק; עם זאת, PE10 מציע את האיזון הטוב ביותר בין קשיחות הקיר לגמישות.
- הזרקה תוך ורידית
הערה: זריקות תוך ורידיות יכולות להיעשות גם בבעלי חיים ערים; עם זאת, אם זה לא נדרש, יש להזריק את בעלי החיים תחת טשטוש איזופלורן כדי להפחית את העומס על חיית המחקר.- מלאו את צנתר ה-30G במאגר NaCl של 0.9% או כל מאגר רצוי אחר.
- הנח את העכבר בתא אינדוקציה ומלא אותו ברציפות בתערובת של חמצן (או אוויר בלחץ ברמה רפואית) ואיזופלורן גזי עד שהחיה מאבדת את רפלקס הימין. לאינדוקציה, השתמש ב-3.5%-5% איזופלורן עם זרימת חמצן או אוויר של 0.8 ליטר לדקה.
- הנח מיד את העכבר הרדום במיקום גחון ראשוני על שטיח חימום (37-38 מעלות צלזיוס) תוך שמירה על הרגעת האיזופלורן דרך חרוט האף. בדוק את העכברים לעתים קרובות לאיתור סימני התחממות יתר (למשל, מתיחה מוגזמת, נשימה מהירה, אדמומיות של העור). לשמירה על ההרדמה, השתמש ב-1.8%-2.5% איזופלורן עם זרימת חמצן או אוויר של 0.8 ליטר לדקה.
- מרחו משחה עיניים על עיני החיה כדי למנוע ייבוש בזמן הטשטוש. בדוק את שני ורידי הזנב הצדדיים ובחר את הטוב ביותר להזרקה. יש לקחת בחשבון את הנראות והקוטר של הווריד. לקבלת התוצאות הטובות ביותר, סובב מעט את הזנב כך שהווריד שנבחר יבוא במגע עם שטיח החימום ותן לווריד להתרחב למשך דקה.
- סובב את העכבר כולו למצב לרוחב כך שהווריד שנבחר יעלה כלפי מעלה. קבע את קצה ובסיס הזנב בעזרת סרט.
- קח את קטטר ה-30G ביד הדומיננטית והנח בעדינות את האצבע המורה של היד הלא דומיננטית על הווריד הנבחר כדי ליצור גיבוי של דם בפנים. באתר הגיבוי, הווריד יתרחב ויוצר גיבנת קטנה.
- בעזרת היד הדומיננטית, הנח את צנתר ה-30G במקביל לזנב הפונה לגבנת על הווריד. הזיזו את היד הדומיננטית קדימה. לרוב, טכניקה זו מבטיחה ניקור ורידים ישיר.
- ברגע שנכנס לווריד, ריפלוקס דם נראה בצינור הפלסטיק. קבע את צינור הפלסטיק כדי להבטיח שהמחט לא תנוע בתוך הווריד במהלך ההזרקה. בקצה החופשי של הצינור, הכנס את מזרק העוקב המחובר למחט 30G.
הערה: כאשר יש צורך להעריך התפלגות דינמית של העוקב, יש לבצע את הנקודות הבאות לאחר הנחת החיה על מיטת סורק ה-PET והפעלת ה-PET. - הזרקו לאט את תכולת מזרק העוקב למשך 10 שניות לפחות. תוך שמירה על מחט ה-30G עדיין מחוברת למערכת הצנתר 30G, הסר רק את מזרק העוקב וחבר מזרק עם מאגר NaCl של 0.9% (או כל מאגר רצוי אחר) כדי לשטוף את הקטטר. עקוב אחר הנשימה ברציפות במהלך הליך ההזרקה והתאם את ריכוז האיזופלורן כדי לשמור על נשימה אחת בשנייה בערך.
- הסר את קטטר ה-30G מווריד הזנב והשתמש בקומפרס כותנה סטרילי כדי לעצור את הדימום.
- כדי למדוד את שאריות הפעילות, מדדו את צנתר ה-30G, את מזרק החיץ, את מזרק העוקב הריק ואת קומפרס הכותנה, מכיוון שכולם מכילים כמויות קטנות של עוקב שלא הגיעו לבעל החיים.
- רכישת PET/CT
הערה: עבור 68ננו-גוף NM-02 עם תווית Ga, כל בעלי החיים מצולמים עם מערכת PET/CT של בעלי חיים קטנים.- רכישת PET
- הנח את העכבר הרדום במצב גחון על מיטת החי והצמד אותו לסורק ה-PET. העבר את זרימת האיזופלורן לחרוט האף ב-PET ושמור אותו על 1.5%-2.5% איזופלורן באוויר הרפואי ב-0.8 ליטר לדקה, כך שקצב הנשימה של בעל החיים במהלך הסריקה יהיה בין 75 ל-50 נשימות לדקה.
- קבע את העכבר מאחורי צווארו למיטת החי בעזרת סרט רפואי. במידת הצורך יש למרוח שוב משחה עיניים על עיני העכבר כדי למנוע התייבשות בזמן הטשטוש.
- הפעל את כרית החימום במיטת החי לכ-80% הספק, המקביל לכ-30 מעלות צלזיוס.
- הגדר את זמן הרכישה ל- 45 דקות ובחר את אזור העניין שייסרק. בחר 68Ga כאיזוטופ המחקר והתחל את הסריקה. הזן את כמות הפעילות המוזרקת, זמן ההזרקה וזמן המדידה של המזרק הריק. מיקום מיטת PET אחד הוא 160 מ"מ, וזה מספיק זמן לסריקת עכבר גוף מלא.
- כאשר יש צורך להעריך התפלגות דינמית של העוקב, התחל תחילה את סריקת ה-PET, המתן 30 שניות לרכישה, ורק לאחר מכן המשך בשלבים 3.2.9-3.2.10. השאר את הקטטר בעכבר כשמזרק החיץ מחובר כדי למנוע אובדן דם נוסף. ניתן לנתק את הקטטר בסוף ה-PET, לפני רכישת ה-CT כדי למנוע חפצים.
- רכישת CT
- נתק את מיטת החי מסורק ה-PET וחבר אותה מיד לסורק ה-CT. במידת הצורך, נתק גם את הצינורית מווריד הזנב. לאחר לפחות 30 דקות לאחר ניקור הוורידים, מקום ההזרקה כבר נקרש, כך שלא יתרחש דימום נוסף.
- העבר את זרימת האיזופלורן לחרוט האף בסורק ה-CT.
- בחר את אותו אזור עניין לסריקה עבור הדמיית PET. בחר את פרוטוקול הרכישה הסטנדרטי: 440 μA, 50 kVp, זמן חשיפה של 32 אלפיות השנייה וסיבוב של 1080° במצב ספירלי עם 960 חשיפה/360°; משך סריקת ה-CT הוא כ-7 דקות לסריקת עכבר גוף מלא.
- שלוט בקצב הנשימה והפעל את כרית החימום במיטת החי. עקוב אחר הנשימה באופן רציף במהלך הסריקות והתאם את ריכוז האיזופלורן כדי לשמור על קצב נשימה בין 75 ל-50 נשימות לדקה.
- רכישת PET
4. טיפול בבעלי חיים לאחר הדמיה
- בתום הסריקות, החיה דורשת לפחות 15 דקות להתעורר. כדי למנוע תוקפנות של חברי המלטה, כלאו את החיה לבד למשך כ-15 דקות או עד שהיא מסוגלת ללכת בכוחות עצמה עד שתחזיר אותה לכלוב המגורים המקורי שלה. במהלך תקופה זו, השתמש באור אינפרא אדום כדי למנוע היפותרמיה.
- בתחילה, הנח את החיה על צדה השמאלי (מיקום מאובטח) כדי למנוע זעזוע המודינמי. הניחו למשחת העיניים להישאר, שכן היא תוסר על ידי החיה עצמה ברגע שהיא תתעורר.
5. שחזור PET/CT
- בצע שחזור PET באמצעות מקסום תוחלת תת-קבוצה מסודרת תלת-ממדית (כלומר, OSEM-3D עם 30 איטרציות) עם חלון אנרגיה של ± 15% משיא של 511 keV לגודל ווקסל איזומטרי של 0.4 מ"מ במטריצה של 192 × 192 × 384. החל תיקונים מבוססי CT (כלומר, תיקון הנחתה, תיקון פיזור, זמן מת ואירועים אקראיים) על שחזור ה-PET.
- במקרה שיש צורך להעריך התפלגות דינמית של העוקב, החל שחזור מרובה מסגרות. כדוגמה, ניתן להשתמש במסגרות הבאות לסריקה של 45 דקות: 4 x 30 שניות, 3 x 1 דקות, 5 x 2 דקות, 2 x 5 דקות ו-2 x 10 דקות.
- שחזר פרוטוקולי רכישה סטנדרטיים של CT באמצעות תהליך שחזור אלגוריתם שחזור איטרטיבי (כלומר, ISRA) לגודל ווקסל איזומטרי של 0.2 מ"מ במטריצה של 200 × 200 × 425. באמצעות תוכנת הספק, המר ערכי CT ליחידות Hounsfield (HU) באמצעות הנוסחה:
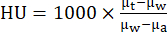
כאשר μw הוא מקדם ההנחתה הליניארי של מים, μa הוא מקדם ההנחתה הליניארי של האוויר ו-μt הוא מקדם ההנחתה הליניארי של הרקמה. - תמונות PET ו-CT יושרו אוטומטית לאחר השחזור באמצעות המטריצה שנוצרה מסריקת פנטום נימית. אחסן בארכיון את כל הנתונים המשוחזרים וכן העבר אותם לשרת מסד נתונים באמצעות תוכנת ניתוח תמונות לפי הצורך.
6. עיבוד וניתוח תמונה
הערה: תמונות ה-PET/CT הרשומות במשותף משמשות לכימות בשרת מסד הנתונים של תוכנת ניתוח תמונות, כאשר כל סריקה היברידית נשמרת כנושא.
- זהה את הגידול על סמך ה-CT ובחר בו כאזור העניין. מסווה ידנית את בסיס הגידול ב-CT.
- כדי להשיג פילוח בלתי תלוי במשתמש, סף את מסכת הגידול החדשה שנוצרה ב-PET או SPECT. עבור PET השתמש בסף מינימלי של 1.0 ערך קליטה סטנדרטי (SUV). עבור SPECT, השתמש בסף מינימלי גבוה יותר מהספיגה הממוצעת של מאגר הדם כפי שנמדד בלב או באבי העורקים הבטני הסופני.
- רשום את הממוצע, המקסימום, הממוצע של 10 הווקסלים החמים ביותר (כלומר, ממוצע חם 10) ואת הספיגה הכוללת של נפחי העניין החדשים שנוצרו.
- השתמש בערכים אלה כדי ליצור ערכי SUV וערכי יעד לרקע (TBR), שישמשו בהמשך לניתוח סטטיסטי.
תוצאות
אחד ההיבטים החשובים ביותר של בקרת איכות של תרופות רדיואקטיביות הוא באמצעות HPLC, שכן זה מראה לא רק את הטוהר הכימי והרדיוכימי (98.2% במקרה זה) אלא גם מאפשר להוכיח את זהות הרדיו-פרמצבטיקה על ידי השוואת זמן הפליטה וצורת השיא לזה של תרכובת ייחוס לא רדיואקטיבית. תרכובת ייחוס זו היא...
Discussion
רדיוסינתזה
הרדיוסינתזה המתוארת כאן אופיינית לתרכובת חדשה המסומנת ב-68Ga - זמן סינתזה קצר, עם דגש על pH מתאים והימנעות ממתכות במידת האפשר. לשם כך, חשוב להקפיד על סדר הוספת הרכיבים. בכל מקרה, תחילה יש להתאים את ערך ה-pH של תמיסת 68Ga ל-pH 4 עם 3 M NH4OAc; אחרת, ?...
Disclosures
FMM הוא יועץ רפואי עבור NanoMab Technology Ltd. ו-Advanced Accelerator Applications (AAA) GmbH. לאחרונה הוא קיבל מענקים מוסדיים מ-NanoMab Technology Ltd., Siemens ו-GE Precision Healthcare LLC. יתר על כן, יש לו חוזה מחקר התערבותי עם CURIUM.
Acknowledgements
המחברים אסירי תודה לסוזן אלקוט על תמיכתה הטכנית.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Activity meter ISOMED 2010 | Nuviatech Healthcare | - | |
| Centrifuge MIKRO 185 | Andreas Hettich GmbH & Co. KG | 1203 | |
| Endotoxin testing Endosafe nexgen-PTS | Charles River | - | |
| Heating block NANOCOLOR VARIO C2 | Macherey-Nagel | 919350 | |
| HPLC system, including radio detector | Knauer & Raytest | - | |
| Image analysis software Pmod 4.4 | PMOD Technologies LLC | - | |
| Small animal PET/CT system β-CUBE and X-CUBE | Molecubes NV | - | |
| TLC MiniGITA* | Elysia-Raytest | - | |
| Materials | |||
| 0.3 mm diameter PE10 tube | fisher scientific | 22-204008 | |
| 30G needle | B|Braun | 4656300 | |
| Centrifugal filter; 10 kDa MWCO, 0.5 mL | Millipore | UFC501008 | |
| Chromatography paper strip iTLC-SG | Agilent Technologies | SGI0001 | |
| Endotoxin Cartridge, 0.05 EU/ml sensitivity | Charles River | PTS-2005 | |
| HPLC Column Biosep SEC-s2000 | Phenomenex | - | |
| Microcentrifuge tube (1.5 mL) | Eppendorf | 0030125150 | |
| pH strip 0.0 - 6.0 | Merck KGaA | 109531 | |
| pH strip 0-14 | Merck KGaA | 109535 | |
| PS-H+ SPE cartridge | Macherey Nagel GmbH & Co. KG | 731861 | |
| Sterile vial 10 mL | ALK Life Science Solutions | SEV100 | |
| Reagents | |||
| 68Ge/68Ga-Generator | NRF-iThembaLABS | - | |
| Ammoniumacetate | Merck KGaA | 101116 | |
| Citric acid | Merck KGaA | 100241 | |
| Hydrochloric acid | Merck KGaA | 320331 | |
| NaCl | Merck KGaA | S9888 | |
| Nanobody NM-02 | Radiopharm Theranostics | - | |
| P-SCN-Bz-DOTA-GA | CheMatech | C115 | |
| Trifluoracetic acid | Merck KGaA | T6508 | |
| Ultrapure water | Merck KGaA | 101262 |
References
- American Cancer Society. . Cancer facts & figures 2024. , (2024).
- Cancer Research UK. . Ovarian cancer survival. , (2021).
- Siegel, R. L., Giaquinto, A. N., Jemal, A. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Altunay, B., et al. Her2-directed antibodies, affibodies and nanobodies as drug-delivery vehicles in breast cancer with a specific focus on radioimmunotherapy and radioimmunoimaging. Eur J Nucl Med Mol Imaging. 48 (5), 1371-1389 (2021).
- Altunay, B., Morgenroth, A., Mottaghy, F. M. Use of radionuclide-based imaging methods in breast cancer. Semin Nucl Med. 52 (5), 561-573 (2022).
- Mcgale, J., et al. Pet/ct and spect/ct imaging of her2-positive breast cancer. J Clin Med. 12 (15), 4882 (2023).
- Zhang-Yin, J. State of the art in 2022 pet/ct in breast cancer: A review. J Clin Med. 12 (3), 968 (2023).
- USFD Administration. . Pet drug products - current good manufacturing practice (cgmp). , (2018).
- . . Official Journal of the European Union, L238. 60, (2017).
- Korde, A., et al. Position paper to facilitate patient access to radiopharmaceuticals: Considerations for a suitable pharmaceutical regulatory framework. EJNMMI Radiopharm Chem. 9 (1), 2 (2024).
- Korde, A., et al. Practical considerations for navigating the regulatory landscape of non-clinical studies for clinical translation of radiopharmaceuticals. EJNMMI Radiopharm Chem. 7 (1), 18 (2022).
- . . European Pharmacopeia. , (2023).
- Volokhov, D. V., Graham, L. J., Brorson, K. A., Chizhikov, V. E. Mycoplasma testing of cell substrates and biologics: Review of alternative non-microbiological techniques. Mol Cell Probes. 25 (2-3), 69-77 (2011).
- Dülsner, A., et al. Technical information from the Committee for Animal Welfare Officers (GV-SOLAS) and Working Group 4 in the TVT Recommendation on substance administration to laboratory animals. GV-SOLAS. , (2017).
- . derived xenograft (pdx) protocols at the jackson laboratory Available from: https://tumor.informatics.jax.org/mtbwi/live/www/html/SOCHelp.html (2020)
- Velikyan, I. 68ga-based radiopharmaceuticals: Production and application relationship. Molecules. 20 (7), 12913-12943 (2015).
- Percie Du Sert, N., et al. Reporting animal research: Explanation and elaboration for the arrive guidelines 2.0. PLoS Biol. 18 (7), e3000411 (2020).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. A., Brattelid, T. Prepare: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Landesamt Für Natur UUVN. . Tierversuche. , (2024).
- Herrmann, D., et al. Statistical controversies in clinical research: Publication bias evaluations are not routinely conducted in clinical oncology systematic reviews. Ann Oncol. 28 (5), 931-937 (2017).
- Johnsen, E., et al. A critical evaluation of amicon ultra centrifugal filters for separating proteins, drugs and nanoparticles in biosamples. J Pharm Biomed Anal. 120, 106-111 (2016).
- . TVT-Veröffentlichungen zum Download Available from: https://www.tierschutz-tvt.de/alle-merkblaetter-und-stellungnahmen/ (2024)
- Bedard, P. L., Hansen, A. R., Ratain, M. J., Siu, L. L. Tumour heterogeneity in the clinic. Nature. 501 (7467), 355-364 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved